A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מכלול ביו-ריאקטור לתרבית מתמשכת של קהילות צואה מורכבות
In This Article
Summary
פרוטוקול זה מפרט את הרכבת מערכי מיני-ביו-ריאקטור שישמשו לתרבית זרימה רציפה של קהילות צואה מורכבות בתנאים אנאירוביים. אנו דנים גם בשיטות ההרכבה, החיסון והדגימה של הכורים להמשך ניתוח.
Abstract
המיקרוביוטה, במיוחד חיידקים, מגיבים לחשיפות סביבתיות שונות כגון מיקרו-מקרו-נוטריינטים, תרכובות פרמקולוגיות ומתווכים דלקתיים, המשנים באופן דינמי את הרכב הקהילה ואת התפוקה המטבולית המיקרוביאלית. הבנת האופן שבו תנאי תרבית פיזיולוגיים משפיעים על קהילות מיקרוביאליות ועל המגוון והיכולת המטבולית שלהם תתרום ידע חשוב על השפעתם על בריאות ומחלות. כאן, אנו מציגים פרוטוקול המותאם מהתבנית שפורסמה על ידי Auchtung et al. ליצירת מערכי מיני-ביו-ריאקטורים שיכולים לטפח קהילות צואה מורכבות, להגדיר קונסורציום חיידקים או זנים בודדים בתנאים מדויקים, כולל זמינות חומרים מזינים, טמפרטורה, קצב זרימה, pH ותכולת חמצן. אנו מתארים את תהליך בניית מערכת המיני-ביו-ריאקטור, כולל התאמות לשיפור המגבלות בפרוטוקול שפורסם. אנו דנים גם בהקמת מערכת המיני-ביו-ריאקטור בתנאים אנאירוביים עם שימוש במדיה MEGA (המבוססת על Han et al.), שהיא מדיה עשירה התומכת בגידול של חיידקים מגוונים. אנו מתארים חיסון של דגימות צואה של עכברים מואנשים במעיים למערכת המיני-ביו-ריאקטור, ולאחר מכן הקמת תרביות קהילתיות מורכבות בתוך מערכת המיני-ביו-ריאקטור, שניתן לגדל בזרימה רציפה עם דגימה אספטית כדי לנטר את הרכב הקהילה. מערכת זו ניתנת להתאמה לשינויים תזונתיים ושינויים תרבותיים אחרים. הטכניקות המתוארות כאן מאפשרות אפיון של קהילות צואה מגוונות וקפדניות בתנאים דינמיים או בתגובה להפרעה במנותק מגורמים שמקורם במארח.
Introduction
מיקרוביוטת המעיים היא רשת עצומה של מיקרואורגניזמים, כולל חיידקים, פטריות, ארכאות ווירוסים, המכילים רפרטואר גנטי ומטבולי עצום שעולה בהרבה על זהשל מארח אנושי. היכולת המטבולית העשירה של המיקרוביום כוללת מטבוליטים המיוצרים מעיבוד חיידקי של חומרים מזינים תזונתיים, מטבוליטים מארחים שעברו שינוי כימי על ידי חיידקים, ומטבוליטים המסונתזים באופן ייחודי על ידי המיקרוביוטה2. המיקרוביוטה מעורבת כמעט בכל התהליכים הביולוגיים של המארח אך גם במצבי מחלה כמו מחלות מעי דלקתיות, סרטן, הפרעות מטבוליות ואפילו הפרעות נוירולוגיות 2,3. ניתוח תרומת המיקרוביוטה מזו של המארח חיוני להבנת תפקידם של מיקרואורגניזמים ספציפיים או קהילות מורכבות בבריאות ובחולי. גישה אחת המאפשרת נתיחה זו היא שימוש בביו-ריאקטורים מיקרוביאליים, המטפחים קהילות מיקרוביאליות מגוונות בתנאים דינמיים. ישנם ביו-ריאקטורים רבים הזמינים מסחרית המאפשרים גידול של קהילות חיידקים צואתיות כמעט לכל מטרה, כולל גידול מוצרים ביולוגיים בקנה מידה גדול או בקרה מדויקת של גורמים תזונתיים ספציפיים לחקר תהליכים מטבוליים. עם זאת, מערכות אלה יקרות מאוד ודורשות הכנה ממושכת, ואינן מאפשרות לבחון תנאי ניסוי מגוונים במקביל. לגישה פשוטה שהיא פחות יקרה, ניתנת להתאמה ומאפשרת תנאים מקבילים רבים, אנו מציגים כאן את הפרוטוקול להקמה ושימוש במערך מיני-ביו-ריאקטור בזרימה רציפה המותאם מ-Auchtung et al.4.
ההגדרה המלאה של מערכת המיני-ביו-ריאקטור מודגמת באיור 1A. מערכת מיני-ביו-ריאקטור זו משתמשת במערכים של 6 בארות כורים, שאינם תלויים לחלוטין זה בזה ומוגדרים בתא אנאירובי תחת זרימה פריסטלטית כדי לאפשר אספקה והסרה רציפה של מדיה (איור 1A). כל מערך כורים יושב על לוחית ערבול מגנטית של 60 מצבים, עם שתי משאבות פריסטלטיות של 48 קלטות המחזיקות צינורות 2 מצבים עבור מדיית המקור וזרימת הפסולת (איור 1A). התא האנאירובי מצויד במוניטור אנאירובי CAM-12 לתכולת חמצן, קופסת זרז להסרת חמצן עם יכולת חימום ועמוד להסרת מימן גופרתי לספיגת עודפי גז מחילוף החומרים של החיידקים. כל באר כור מצוידת בכניסת מדיית מקור, יציאת פסולת ויציאת דגימה, המאפשרת חיסון או דגימה של כל באר כור בודדת (איור 1B).
כפי שתואר, מערכת הביוריאקטור מאפשרת בקרה דינמית על הטמפרטורה, צריכת המדיה וזמינות החומרים המזינים כדי לתמוך בגידול ותחזוקה של קהילות צואה. הטמפרטורה מווסתת על ידי קופסת זרז בעלת יכולת חימום, המאפשרת לבצע שינויים בטמפרטורה בכל החדר האנאירובי במהירות. צריכת המדיה מווסתת על ידי קצבי זרימת משאבה פריסטלטית, הניתנים לשינוי כדי לשנות את תחלופת המדיה בכורים. ניתן להתאים את תחלופת המדיה לסוגי הקהילה המטופחים בכורים, למשל, מותאמים לזני מטרה שגדלים לאט או גדלים מהר מאוד. לבסוף, ניתן לשנות את זמינות החומרים המזינים באופן דינמי על ידי הוספת רכיבים דרך יציאות הדגימה הבודדות עבור כל באר כור. תנאים סטטיים הניתנים לשינוי בתחילת הניסוי, אך אין להם שליטה דינמית במערכת הם סוג המדיה, תכולת החמצן ומספר הכורים בו זמנית. חוקרים יכולים לבחור ליישם כל מדיה שהם רוצים, ובעוד שמדיה אחת מתוארת כאן, אינספור סוגי מדיה אחרים יושמו בהצלחה. ניתן להפעיל את הכורים בתנאים אירוביים או מיקרואירופיליים (בהתאם לזמינות תא מיקרואירופילים). לבסוף, ניתן להקים כמה שיותר או כמה שפחות כורים בהתאם לצרכי הניסוי של החוקר. בעוד שהכורים נמצאים בקבוצות של שישה בתוך מערך, כל כור פועל באופן עצמאי מהאחרים, וניתן לקשר כל אחד מהם למקור אחר אם תרצה.
ניתן להקים את מערכת הביוריאקטור המודולרית הזו בסביבות 25,000 דולר (לא כולל התא האנאירובי או רכיבים ספציפיים לתא), כאשר החלק היחיד שאינו ניתן לשימוש חוזר הוא הצינורות שניתן להחליף בפחות מ-100 דולר להפעלה של המערכת. המערכת היא אוטומטית ברובה, אך דורשת בדיקה יומית של רמות המדיה מכיוון שיהיה צורך להחליף בקבוקי מקור מדיה כאשר הם ריקים. בנוסף, יש להשלים כל דגימה באופן ידני, וכל שינוי מותנה דינמי במערכת יצטרך להתבצע באופן ידני (לדוגמה, שינוי הטמפרטורה). מפרוטוקול המערכת המקורי שפורסם על ידי Auchtung et al., יושמו כמה שינויים כדי לשפר את הביצועים והתועלתהכוללים 4. ראשית, החומר להדפסת תלת מימד של מערך הביוריאקטור שונה להיות פלסטיק שקוף שקוף דמוי ABS כדי לשפר את השלמות המבנית של המערכת באמצעות סבבים חוזרים ונשנים של חיטוי. בנוסף, במקום צינורות OD PTFE בגודל 1/8 אינץ' (3.2 מ"מ), נעשה שימוש בצינורות E-LFL, 2.06 מ"מ ID, 100 רגל בשל החומר היציב יותר, העמיד יותר בפני קריסה, מה שיגרום לחסימות בזרימה במערכת. לבסוף, אביזר נוסף באמצעות תבריג 1/4-28 מ"מ למתאמי זכר דוקרניים משמש להפחתת שינויים בהחלקת צינור מבקבוקי מקור מדיה. מבית Han et al., מתכון המדיה המותאם של MEGA מספק מדיה לא מוגדרת, מורכבת ועשירה ביותר המאפשרת גידול של מיקרואורגניזמים אנאירוביים קפדניים5. המדיה שונה כדי להשתמש בתכשיר חלופי של רכיב היסטידין-המאטין, מכיוון שהמקור אינו זמין עוד מסחרית. נתרן הידרוקסיד משמש גם ל-pH של המדיה ל-7.0 או כל pH רצוי. בסך הכל, מערכת זו היא תקציבית וידידותית למשתמש, מותאמת ונקודת כניסה מצוינת למערכות תרבות זרימה רציפה.
בפרוטוקול זה, אנו מתארים בפירוט את ההגדרה של מערכת מערך מיני ביו-ריאקטור זו, כולל חומרים, עיקור המערכת ושימוש לאחר מכן לגידול דגימות צואה של עכברים אנושיים במעיים. המטרה הכוללת של שיטה זו היא לבנות מערכת ביו-ריאקטור מסתגלת וחסכונית שניתן להשתמש בה לטיפוח קהילות מיקרוביאליות בתנאים מבוקרים. סכימה מפורטת של זרימת העבודה להרכבת מערכת המיני-ביו-ריאקטור מסופקת באיור 2 ומוזכרת בשלבים המתאימים בתוך הפרוטוקול. בדוגמה שלנו, אנו מחסנים שני כורים עם אותה דגימת צואה מעכברי מעיים אנושיים ומתארים מבנה קהילה מיקרוביאלית תחת זרימה רציפה של מדיה MEGA.

איור 1: דיאגרמה סכמטית של מערך מיני-ביו-ריאקטור בתא האנאירובי. (A) תצוגה מלאה של מערך המיני-ביו-ריאקטור שהושלם בתא האנאירובי. מערך הביוריאקטור בן 6 הבארות ממוקם על צלחת הערבוב המגנטית בת 60 המצבים. רשת טי המקור מחוברת למדיית המקור בצד שמאל דרך מכסה הבקבוק בעל שני החורים. שתי משאבות פריסטלטיות מחזיקות את הצינור בעל 2 התחנות מרשתות המקור והפסולת משמאל ומימין, בהתאמה. רשת טי הפסולת מתרוקנת לתוך בקבוק הפסולת בצד ימין. ציוד חיוני להפעלת התא האנאירובי, כולל צג CAM-12, תיבת זרז עם קיבולת חימום ועמוד להסרת מימן גופרתי, מסודרים בתוך התא סביב מערכת המערך. (ב) מבט מלמעלה על המקור, הדגימה ויציאות הפסולת המחוברות לבאר כור אחת עם מדיה בגובה המתאים בכור. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
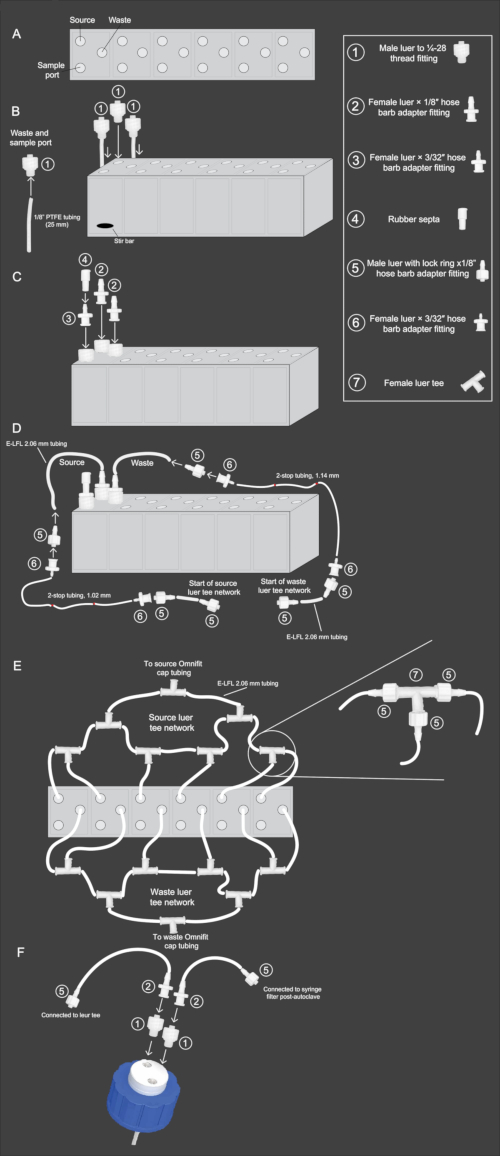
איור 2: דיאגרמה סכמטית של זרימת עבודה של הרכבת מערך מיני-ביו-ריאקטור. (A) מבט מלמעלה למטה של מערך המיני-ביו-ריאקטור, המראה את כיוון המקור, הפסולת ויציאות הדגימה. (B) מבט מהצד של מערך המיני-ביו-ריאקטור עם תצוגה הממחישה את שלבים 2.3-2.4 של הפרוטוקול. צינורות ה-PTFE וההתאמה בגודל 1/8 אינץ' (1) מחוברים ומוכנסים ליציאות הפסולת והדגימה. אביזר (1) ללא PTFE מוכנס ליציאת המקור. (C) מבט מהצד של מערך מיני-ביו-ריאקטור הממחיש את שלבים 2.5-2.6 של הפרוטוקול. אביזר (2) מחובר ליציאות המקור והפסולת. התאמה (3) מחוברת ליציאת הדגימה, ואליה מוכנס אביזר (4) למעלה. (D) מבט מהצד של מערך מיני-ביו-ריאקטור הממחיש את שלבים 2.9-2.11. צינורות E-LFL 2.06 מ"מ מחוברים ליציאות המקור והפסולת, והקצה השני מחובר לאביזרים (5) ולאחר מכן (6). לאחר מכן מחברים צינורות 2 עצירות בקוטר המתאים להתאמה (6). לאחר מכן חוזרים על החיבור ההפוך בסוף הצינור בעל 2 המצירות, כאשר התאמה (6) מתחברת לצינור 2 עצירות והתאמה (5) מתחברת אליו. לבסוף, צינורות E-LFL 2.06 מ"מ יחוברו למתקן (5) לחיבור לרשת ה-luer tee. (ה) מלמעלה למטה view של מערך מיני-ביו-ריאקטור המציג את הגדרת רשת המקור והפסולת המתוארת בשלבים 2.12-2.15. צינורות E-LFL 2.06 מ"מ המסתיימים בהתאמה (5) משמשים לחיבור כל כור למספר אביזרים (7), שפתחם האחרון מחובר למכסה שעל המקור או בקבוק הפסולת. (F) מבט מהצד של מכלול פקק בקבוק דו-חורי המתואר בשלבים 2.16-2.17. פתח אחד במכסה מחובר לצינור PTFE המונח בתוך הבקבוק. לפתח זה מוכנס אביזר (1), ואחריו התאמה (2), וצינורות E-LFL 2.06 מ"מ המחוברים להתאמה (5). אביזר זה מחובר לרשת המקור או לרשת הפסולת. לפתח שאינו מחובר לצינורות PTFE, מוכנס מתקן (1), ואחריו התאמה (2), וצינורות E-LFL 2.06 מ"מ מחוברים לאביזר אחר (5). קצה זה מכוסה בנייר כסף במהלך עיקור חיטוי לחיבור עתידי למסנן מזרק סטרילי של 0.22 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Protocol
דגימות צואה ששימשו במחקר זה התקבלו מניסויים שאושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) באוניברסיטת פלורידה (UF) ובוצעו במתקני טיפול בבעלי חיים של UF (פרוטוקול IACUC #IACUC202300000005). בקצרה, סוג בר מעורב ללא חיידקים (GF WT; עכברי C57BL/6) (שגודלו ומתוחזקים במבודדים על ידי החטיבה ללא חיידקים של UF Animal Care Services) הועברו ממבודדי רבייה והוכנסו למערכת ההדרה הביולוגית של ISOcage P כדי לאפשר מניפולציה מיקרוביאלית. יחידות יוצרות מושבה שוות (CFU) מצואת תורם אנושי נאספו לעכברים. שבועיים לאחר החיסון, דגימות צואה נאספו מעכברים אלה באופן אספטי לאחסון ולשימוש לאחר מכן בפרוטוקול זה.
הערה: איסוף והכנת דגימות צואה המתוארות כאן נועדו רק כדוגמה להליך תקין, שכן בהתאם לסוג הדגימות שנאספו (אדם, עכבר, בעל חיים אחר) ואחסון הדגימות הללו, הליך זה יכול להשתנות מאוד. אנשים צריכים לעיין בספרות המתאימה כדי לעצב פרוטוקול לאיסוף ושימור דגימות צואה בהתבסס על הצרכים של החוקר הבודד.
1. הכנה אופיינית של דגימות צואה לאחסון של -80 מעלות צלזיוס
- בחר אמצעי שימור כדאיות אנאירובית (כאן, השתמשנו בקארי בלייר). יש להוציא 1 מ"ל של אמצעי שימור לצינורות סטריליים, להבריג 2 מ"ל בארון בטיחות ביולוגית, ולאחר מכן להעביר לתא האנאירובי.
- לפני קבלת דגימות צואה, ודא שכל האספקה (מרית חיטוי, מי מלח סטריליים ובקבוקונים קריוגניים עם מכסה הברגה המכילים אמצעי שימור) מופחתת מראש למשך 24 שעות בתא האנאירובי.
- אסוף דגימות צואה באופן אספטי מעכברים באמצעות צינורות סטריליים בארון בטיחות ביולוגית באמצעות כוסות ומלקחיים לאיסוף צואה חיטוי. מיד עם האיסוף, הקפיאו את הצינורות בחנקן נוזלי.
- העבירו מיד דגימות לתא אנאירובי יחד עם משקל נייד לשקילה. שקלו מראש כל צינור. עבור דגימות צואה של עכברים, ניתן למנות כדורי צואה נפרדים לכל צינור. אם משתמשים בדגימות אנושיות, השתמש במרית הסטרילית כדי לערבב כל דגימה ולחלק אותה באופן שווה לבקבוקונים קריוגניים. לאחר שקילה מחדש של כל צינור, הוסף מדיה ביחס משוער של 1:10 צואה (מסה: מסה) לכל צינור לשימור אופטימלי.
הערה: מומלץ שימור אנאירובי מיידי של דגימות צואה לאחר האיסוף. דגימות שלא השתמרו מיד עשויות להפחית את הכדאיות, שינויים בהרכבים וכו', בהשוואה לדגימות שהשתמרו טריות 6,7,8. אמצעי השימור של קארי בלייר שומרים על הכדאיות של קהילות חיידקים תוך עיכוב צמיחה נוספת וניתן לאחסן אותם בטמפרטורה של -80 מעלות צלזיוס. עבור היחס המשוער בין אמצעי השימור לצואה, למרות שהמשקל הרטוב של דגימת הצואה משתנה מאוד, זהו האומדן הטוב ביותר שיש. - יש לתייג, לאטום, להוציא בקבוקונים מהתא האנאירובי, להקפיא הבזק עם חנקן נוזלי ולאחסן בטמפרטורה של -80 מעלות צלזיוס עד שנה או יותר.
2. בניית מערך כורים בן 6 בארות
- השתמש בקובץ ה-CAD (קובץ משלים 1) להדפסת תלת מימד של הכור בעל 6 הבארות. ניתן להגיש קובץ זה לכל חברת הדפסת תלת מימד לייצור. השתמש בפלסטיק שקוף שקוף דמוי ABS כחומר ההדפסה כדי לאפשר הדמיה דרך הכורים תוך עמידות בפני מחזורי חיטוי חוזרים ונשנים.
הערה: הזמנו את מערכי הכורים בעלי 6 הבארות להיות עשויים מפלסטיק שקוף שקוף דמוי ABs על ידי סטריאוליתוגרפיה. אנו ממליצים להטות את המערך (כלומר, להדפיס את החלק בתלת מימד בזווית של 30%-45%) בייצור, מה שמפחית אי דיוקים בממדים. תיקון זה יביא לקווי שכבה גלויים הפועלים באלכסון על פני המערך, אך הדבר אינו משפיע על ביצועי הכורים. - בעזרת כלי הקשה 25-28 מ"מ, הכנס חוטי בורג לכל פתח של מערך הכור.
- חותכים רצועות 12, 25 מ"מ מצינור PTFE בגודל 1/8 אינץ' והכנס קצה אחד של כל קטע צינור לפתח הברגה של לואור זכר להתאמת חוט 25-28. הברג היטב את האביזרים לתוך פתחי הפסולת והדגימה המיועדים של המערך (איור 2B).
הערה: ניתן להשתמש בסכין גילוח כדי לגלח קלות את קצות הצינור לתצורה דמוית חרוט כדי להפוך את הצינור למתאים יותר להחדרה. - הכנס מוט ערבוב מיקרו לכל באר כור של הכור ולאחר מכן הברג חוט זכר 1/4-28 המתאים לחורי המקור של כל באר כור (איור 2B).
- הברג אביזרי מתאם דוקרני צינור נקבה x 1/8 אינץ' לתוך אביזרי ההברגה 1/4-28 לפסולת ולמקור לכל באר כור (איור 2C).
- הברג אביזרי מתאם דוקרני צינור נקבה x 3/32 אינץ' לתוך אביזרי החוט 1/4-28 עבור יציאת המדגם. הנח מחיצת גומי מעל מתאמי דוקרני הצינור בגודל 3/32 אינץ' וקפל את החלק העליון מעל (איור 2C).
- חתוך שני סטים של צינורות E-LFL, 2.06 מ"מ באורכים הבאים עבור קווי הפסולת והמקור: 14 ס"מ, 15.25 ס"מ, 16.5 ס"מ, 17.75 ס"מ, 19 ס"מ ו-20.25 ס"מ.
הערה: ניתן להשתמש בסרט תווית צבעוני עטוף סביב החלק האמצעי כדי לזהות כל אורך צינור. - חבר את צינור E-LFL 2.06 מ"מ לאביזרי מתאם דוקרני צינור 1/8 אינץ' עבור חיבורי המקור והפסולת (איור 2D). השתמש במים חמים כדי להפוך את הצינור לגמיש יותר. זה יאפשר לצינור להתאים בקלות למתאמים.
- חבר לואר זכר עם טבעת נעילה x מתאם דוקרני צינור בגודל 1/8 אינץ' לקצה השני של הצינור. הברג מתאם דוקרני צינור נקבה x 1/16 אינץ' המתאים לזה (איור 2D).
- חבר את הצינורות בגודל המתאים עם 2 עצירות לחיבורי הפסולת והמקור המתאימים. קווי הפסולת משתמשים בצינורות 1.14 מ"מ עם 2 מצבים, בעוד שקווי המקור משתמשים בצינורות 1.02 מ"מ עם 2 מצבים. בקצה השני של הצינור בעל 2 עצירות, חבר מתאם דוקרני צינור נקבה נוסף x 1/16 אינץ' (איור 2D).
- חותכים 20, 5 ס"מ חתיכות E-LFL, צינורות 2.06 מ"מ, ומכניסים לואר זכר עם טבעת נעילה x 1/8 אינץ' אביזרי מתאם דוקרני צינור לשני הקצוות של כל צינור. חבר קצה אחד של הצינור בגודל 5 ס"מ עם ה-luer הזכר עם טבעת נעילה x מתאם דוקרני צינור בגודל 1/8 אינץ' המתאים למתאם דוקרני הצינור הנקבה הלא מאוכלס x 1/16 אינץ' המתאים בקצה כל קטע צינורות 2 עצירות. חזור על תהליך זה עבור 19 חלקי הצינורות הנותרים (איור 2D).
- חבר את צינור ה-E-LFL, 2.06 מ"מ לקווי המקור של בארות כור 1 ו-2 באמצעות קצוות מנוגדים של טי לואר נקבה. חבר את אחד מחלקי הצינור בגודל 5 ס"מ עם לואר זכר עם טבעת נעילה x אביזרי מתאם בגודל 1/8 אינץ' בכל קצה לשקע האמצעי של הטי, מה שמוביל לצומת טי שני (איור 2E).
- חבר את צינור המקור E-LFL, 2.06 מ"מ עבור הכור השלישי, לצד הנגדי של הטי השני. יש לחבר צינור נוסף של 5 ס"מ עם לואר זכר עם טבעת נעילה x מתאם 1/8 אינץ' בקצה אחד, ואילו בקצה השני צריך להיות מחובר לואר נקבה עם טבעת נעילה x מתאם 1/8 אינץ'. עקבו אחר אותו דפוס עבור כורים 4, 5 ו-6 (איור 2E).
- חותכים חתיכה של 25 ס"מ של צינורות E-LFL, 2.06 מ"מ, מחברים לואר זכר עם טבעת נעילה x מתאם דוקרני צינור בגודל 1/8 אינץ' לקצה אחד של הצינור, שיתחבר לצומת טי הנקבה האחרונה שנותרה, ובקצה השני חבר מתאם דוקרני צינור נקבה x 1/8 אינץ'. מכסים את הקצה הזה בנייר אלומיניום (איור 2E).
הערה: במהלך הפעולה, חיוני לשמור על קצוות פתוחים סטריליים, לכן אנו ממליצים לשמור אותם מכוסים בנייר כסף במהלך החיטוי ומאובטחים במקומם באמצעות סרט. - הכן את קווי הפסולת על ידי חזרה על אותו הליך כמו קווי המקור המתוארים בשלבים 2.12-2.14 (איור 2E).
- כדי להרכיב בקבוק איסוף פסולת, אבטח באופן רופף מכסה בקבוק בעל שני חורים על בקבוק 2 ליטר. הכנס אביזרי חוט זכר 1/4-28 לשני החורים של הכובע. חבר לואר נקבה עם מתאמי דוקרני צינור בגודל 1/8 אינץ' למתקן החוט הזכרי שאינו מתחבר לצינור ה-PTFE המחובר מראש במכסה (איור 2F).
- לאחר מכן, חותכים חתיכה של 5 ס"מ של צינור E-LFL 2.06 מ"מ ומחברים אותה למתאם דוקרני הצינור על הבקבוק. חבר לואר זכר עם טבעת נעילה x מתאם דוקרני צינור בגודל 1/8 אינץ' לקצה השני של הצינור בגודל 5 ס"מ וכסה אותו בנייר כסף (צינור זה משמש כפתח אוורור; לאחר החיטוי, יתווסף מסנן מזרק של 0.22 מיקרומטר למניעת זיהום; איור 2F).
- מכסים את כל המכסה בנייר אלומיניום. חיטוי הכורים ובקבוק הפסולת ב-121 מעלות צלזיוס ומינימום של 15 psi למשך 45 דקות באמצעות תוכנית הפליטה האיטית המוגדרת בדרך כלל לנוזלים. לאחר שהכורים התקררו, הדקו את האביזרים ואת אטמי רדיד האלומיניום והניחו אותם בתא האנאירובי למשך 48 שעות לפני השימוש.
3. הכנת מדיה MEGA
- הכן את כל פתרונות המלאי לפי טבלה משלימה 1, טבלה משלימה 2, טבלה משלימה 3, טבלה משלימה 4, טבלה משלימה 5, טבלה משלימה 6, טבלה משלימה 7, טבלה משלימה 8.
- בבקבוק זכוכית של 2 ליטר, הוסיפו את כל המרכיבים היבשים מטבלה משלימה 9, ולאחר מכן 1,640 מ"ל מים טהורים במיוחד ולאחר מכן את שאר המרכיבים הנוזליים של הטבלה המשלימה 10 . מוסיפים מוט ערבוב וממיסים לחלוטין על אש בינונית (90 מעלות צלזיוס) על צלחת ערבוב. המדיה תהיה בצבע כחול בהיר עד סגול ולא תהיה ברורה לחלוטין אך לא יהיו בה גושים ברורים לא מומסים.
הערה: חיטוי גלוקוז וסוכרים אחרים בנוכחות פפטידים יכול להוביל לשינוי ועשוי להפחית את הסוכר הזמין במדיה. אם תרצה, ניתן לסנן באופן סטרילי את כל תמיסות הסוכר ולהוסיף אותן עם מרכיבי טבלה משלימה 10, כמתואר בשלב 3.7. - לאחר ערבוב מלא, התאם את ה-pH של המדיה ל-7.0 על ידי הוספת 10 N נתרן הידרוקסיד (NaOH), תוך מדידה מדויקת של כמות הנפח שמתווספת. לאחר מדידת ה-pH, הוסף 14.4 מ"ל מים פחות נפח הנתרן הידרוקסיד שנוסף כדי להביא את הנפח ל-2 ליטר בדיוק.
- הכן פקק בקבוק בעל שני חורים על ידי הכנסת חוט לואר זכר 1/4-28 מ"מ לשני הפתחים.
- בחור של הכובע שאינו מחובר מראש לצינורות PTFE, חותכים חתיכה של 5 ס"מ של צינור C-flex ומחברים אותה לדוקרני הצינור בגודל 1/8 אינץ' של אביזר הנקבה. בקצה השני של הצינור בגודל 5 ס"מ, הכנס לואר זכר נוסף עם טבעת נעילה ומתאם דוקרני צינור בגודל 1/8 אינץ', וכסה בנייר כסף (זה יחובר גם למסנן מזרק של 0.22 מיקרומטר).
- מכסים את כל המכסה בנייר אלומיניום ומבריגים על גבי בקבוק המדיה 2 ליטר MEGA. חיטוי ב-121 מעלות צלזיוס ומינימום של 15 psi למשך 45 דקות, תוך שימוש בתוכנית הפליטה האיטית לנוזלים.
- מוציאים את החומר מהחיטוי ומניחים לו להתקרר תוך כדי ערבוב עד שהוא פושר. הוסף את הרכיבים בטבלה משלימה 10 לבקבוק המדיה של 2 ליטר בארון בטיחות ביולוגית, אטום את המכסה ולאחר מכן העביר לצלחת ערבוב להומוגניזציה. לאחר שהמדיה התקררה, הדק את האביזרים ואת אטמי נייר האלומיניום והנח אותם בתא האנאירובי למשך 48 שעות לפני השימוש.
הערה: אנו ממליצים להפעיל את משאבת המקור ב-16 מיקרוליטר לדקה (0.94 מ"ל לשעה) למשך זמן שמירה של 16 שעות. עבור קצב זרימה זה, כור בעל 6 בארות משתמש בכ-0.135 ליטר מדיה ביום. אנו ממליצים גם להפעיל את משאבת הפסולת במהירות של 40 מיקרוליטר לדקה כדי למנוע היווצרות חסימה בצינורות הפסולת. עקוב אחר הצינורות והזרימה, ושים לב שניתן להגביר את זרימת הפסולת לפי הצורך אם אכן מתרחשות סתימות. גם קצב זרימת המקור וגם קצב זרימת הפסולת ניתנים לשינוי, אך על החוקרים לעקוב בקפידה אחר הרכב הקהילה ושיעורי הצמיחה שלהם מכיוון שאלה עשויים להשתנות גם עם זרימה מהירה או איטית יותר. כדי להפעיל כור עם 6 בארות במשך שבוע אחד, אנו ממליצים לייצר לפחות 2 ליטר מדיה (הוא יצרוך קצת יותר מ-1 ליטר).
4. הגדרת מערך בתא אנאירובי
הערה: חיוני לנקות את פנים מכסה המנוע ואת כפפות מכסה המנוע עם מי חמצן 3% ואחריו שטיפת מים משולשת ללא יונים כדי להבטיח שאין זיהום פני השטח לפני ההרכבה. אם החיבורים נעשים במהירות לאחר הסרת נייר הכסף, ולא נוצר מגע ישיר עם פנים האבזור וכפפות החדר האנאירובי, יש סיכוי מינימלי לזיהום
- יישר את המערך מעל צלחת ערבוב מגנטית בתא האנאירובי. ודא שהמערך מיושר כהלכה על ידי הגדרת בקר לוחית הערבוב למהירות מרבית (1600 סל"ד) והתבוננות במוטות הערבוב מסתובבים.
- התקן את הצינור בעל 2 התחנות למקור והפסולת ב-clamps על המשאבות הפריסטלטיות המתאימות. אם עושים זאת פחות מ-24 שעות לפני השימוש המיועד, נעלו את המהדקים במקומם. אחרת, השאר אותו רופף עד שהוא מוכן לשימוש כדי להפחית את הבלאי של הצינור.
- הסר את מכסה נייר הכסף על אביזרי מתאם דוקרני הצינור הנקבה x 1/8 אינץ' בקווי המקור והפסולת והברג לתוך ה-luer הזכר ל-1/4 -28 אביזרי איום המוברגים לתוך המכסים (ודא שפתח זה מחובר לצינור ה-PTFE הפנימי).
- הסר את מכסי נייר הכסף והצמד מסנן מזרק של 0.22 מיקרומטר לקו האוורור של 5 ס"מ של בקבוק המקור ולקו האוורור של בקבוק הפסולת.
- התחל את הזרימה בקצב מתון (1 מ"ל/דקה על משאבת המקור ו-2 מ"ל/דקה על משאבת הפסולת) כדי להתחיל למלא את הכורים. ודא שצינור קו הפסולת בכל באר כור נמוך מזה של צינור המקור, מה שימנע מילוי יתר או ריקון של כל באר.
- כאשר הכורים מתחילים להתמלא, ודא שכולם מגיעים לאותו נפח ושהמדיה זורמת לקו הפסולת. עם המדידות המתוארות כאן, נפח העבודה של כל כור הוא 15 מ"ל.
הערה: אם כורים בודדים אינם מתמלאים, הדק את כל האביזרים הרופפים ובדוק את קווי המקור לאיתור בעיות, והחלף אותם בתוספות מוכנות במידת הצורך. אם הבעיה נמשכת, החלף את בקבוק המקור אם זמין. אם המפלס הבינוני עולה מעל קו הפסולת הפנימי בכורים, בדוק שצינור ה-PTFE בחלק הפנימי של יציאת הפסולת של הכור עדיין במקומו. - לאחר מילוי כל כור, התאם את הגדרות המשאבה לקצב הזרימה של 16 מיקרוליטר לדקה, ולאחר מכן כבה את המשאבות.
- הניחו למדיום להישאר בכורים ובבקבוקי הפסולת למשך הלילה לפני החיסון. זה מאפשר התניה אנאירובית נוספת של המדיה (למשך 72~ שעות) ומאפשר למשתמש לאשר את סטריליות המערכת.
- כדי לאשר את הסטריליות של המערכת לפני חיסון דגימת צואה, דגימת כל כור ואמצעי המקור ישירות לאחר המילוי הראשוני (שלב 4.7) ושוב לאחר שלב 4.8. בצע את הנוהל לדגימה אספטית של הכורים המתואר בשלב 6.
- ודא שמדידת הצפיפות האופטית של כל הדגימות זהה לזו של מדיית המקור; אם נצפתה צפיפות אופטית מוגברת, יש חשד לזיהום, ויש לפרק, לנקות ולהרכיב מחדש את כל המדיה והמערכת.
5. חיסון דגימת צואה
- הנח קצות פיפטות סטריליות רחבות, מי מלח סטריליים, צינורות חרוטיים של 50 מ"ל, פיפטות סרולוגיות סטריליות של 25 מ"ל, מזרקים של 5 מ"ל ומחטים בגודל 16 לתוך החדר האנאירובי כדי להתנות בסביבה האנאירובית למשך 24 שעות לפחות.
- חשב את כמות החומר הצואתי הנדרש לחיסון מספר הכורים הרצוי. כל באר כור דורשת 3.8 מ"ל של סופרנטנט בתמיסת צואה של 25% m/v. עבור שש בארות כור, סך של 22.8 מ"ל של 25% m/v תמיסת צואה אמורה לספק מספיק סופרנטנט לחיסון, מה שידרוש 5.7 גרם של חומר צואתי מוצק.
- העבירו את דגימות הצואה השמורות בבקבוקונים קריוגניים לתא האנאירובי ואפשרו להן להפשיר למשך 15 דקות.
- השתמש בקצה פיפטה רחב קדח כדי להעביר חומר צואה מהבקבוקונים הקריוגניים לצינור חרוטי של 50 מ"ל, אטום היטב וצנטריפוגה ב-200 x גרם למשך 5 דקות כדי ליישב חלקיקים.
- העבירו בחזרה לתא אנאירובי והוציאו את הסופרנטנט. בעזרת מרית מעבדה חיטוי, העבירו את מוצקי הצואה לצינור חרוטי חדש של 50 מ"ל, והשיגו מסה כוללת של 5.7 גרם. הוסיפו 17.1 מ"ל של מי מלח סטריליים אנאירוביים לצינור ואטמו היטב.
- הסר את הצינורות החרוטיים מהתא, הומוגניזציה על ידי מערבולת למשך 5 דקות, ואז צנטריפוגה ב-200 x גרם למשך 5 דקות כדי ליישב חלקיקים.
- עקרו את המחיצה על גבי כל כור עם מגבון מעבדה של 10% אקונומיקה למשך 2 דקות לפחות בזמן שהדגימות מונחות בצנטריפוגה.
- החזר דגימות לתא האנאירובי, ובאמצעות פיפטות סרולוגיות סטריליות, העביר את הסופרנטנטים לצינורות חרוטיים חדשים של 50 מ"ל.
- טען 3.8 מ"ל של נוזל צואה לשישה מזרקים נפרדים של 5 מ"ל עם מחטים של 16 גרם 1.5 אינץ'.
- הסר את המגבון, הכנס את המחט דרך המחיצה והזריק לאט את תרחיץ הצואה לתוך הכור.
- אפשר לקהילות הצואה להתבסס בכל כור במשך כ-16-18 שעות לפני תחילת הזרימה לכור. הגדר את לוחית הערבוב המגנטית למהירות מקסימלית מרגע הזרקת תמיסת הצואה (1600 סל"ד).
6. איסוף אספטי של דגימות מבארות כור
- יש לנקב את העטיפה בשישה מזרקים סטריליים של 1 מ"ל ושש מחטים סטריליות בגודל 22 גרם 3 אינץ' ולהניח אותם בתא האנאירובי כדי לנקות את הגז למשך 24 שעות.
- מיד לפני הדגימה, יש לעקר את המחיצה על גבי כל כור עם מגבון מעבדה של 10% אקונומיקה למשך 2 דקות לפחות.
- הסר את מגבון מעבדת האקונומיקה והצמד מיד מחט למזרק והכנס את המחט למרכז המחיצה של באר הכור הראשון.
- משוך 1 מ"ל מהדגימה, הסר את המחט מהמחיצה והעביר את הדגימה מהמזרק לצינור מסומן בנפח 1.7 מ"ל לשימוש במורד הזרם. מחיצות הגומי ייאטמו מחדש עם הסרת המחט. השתמש במחט ובמזרק חדשים לכל באר כור כדי למנוע זיהום צולב.
- אם רוצים את הסופרנטנט, הוציאו את הצינורות מהתא האנאירובי והצנטריפוגה ב-20,000 x גרם למשך דקה אחת כדי לגלול תאי חיידקים.
- מעבירים את הסופרנטנט לצינור בנפח 1.7 מ"ל המסומן בנפרד ושומרים בטמפרטורה של -80 מעלות צלזיוס.
7. פירוק וניקוי מערכת המיני-ביו-ריאקטור
- נתק את בקבוק המקור מטי המקור והגביר את קצב הזרימה (1 מ"ל/דקה במשאבת המקור ו-2 מ"ל/דקה במשאבת הפסולת) כדי להתחיל לרוקן את הצינור. הניחו לצינור להתרוקן לחלוטין. כבה את צלחת הערבוב.
- לאחר שהצינור ריק, נתק את בקבוק הפסולת מטי הפסולת. לאחר מכן, הנח את מכלול הכור לתוך נעילת האוויר של התא האנאירובי והסר אותו מהתא.
- נתק את כל מקטעי צינורות E-LFL 2.06 מ"מ וצינורות PTFE והשליך אותם. נתק את כל האביזרים והנח אותם בתמיסת אקונומיקה של 10%.
- הסר היטב את מוטות הערבוב המיני מכל מערך והנח אותם בתמיסת האקונומיקה. הפוך את מערך הכור כדי לרוקן את המדיה לתמיסת אקונומיקה נפרדת של 10% לחיטוי. לאחר מכן, טבלו את המערך הריק בתמיסת אקונומיקה טרייה.
- אפשר לכל האביזרים ולמערך הכור להשרות בתמיסת האקונומיקה של 10% למשך 30 דקות (השרייה ממושכת תגרום לשינוי צבע).
- שטפו את האביזרים ומערך הכורים במים נטולי יונים, ולאחר מכן טבלו למשך הלילה בתמיסת ניקוי אנזימטית בהתאם להוראות היצרן.
- שטפו שלוש פעמים את האביזרים ומערך הכור במים נטולי יונים, ולאחר מכן הניחו לייבוש מלא באוויר למשך 3 ימים לפחות. לאחר הייבוש, ניתן להשתמש שוב במערך הכור ובאביזרים להרכבה.
תוצאות
דגימות צואה נאספו מעכברים שהתיישבו בתמיסת צואה אנושית שבועיים לאחר החיסון ואוחסנו בטמפרטורה של -80 מעלות צלזיוס. מערכת הביוריאקטור הוקמה עם זרימת מדיה MEGA רציפה עבור שתי בארות כורים משוכפלות (איור 3A). התרחיץ הצואתי הוכן מכדורי הצואה של ה?...
Discussion
מערכת המיני-ביו-ריאקטור המתוארת בפרוטוקול זה מאפשרת גידול של קהילות צואה עצמאיות לניסויים מקבילים. יכולת זו לחקור קהילות מיקרוביאליות בבידוד של גורמים מארחים היא גישה חיונית להבנת היכולת הפנימית של מיקרואורגניזמים להסתגל לסביבתם. ניתן להתאים פרוטוקול זה בקלות לגידול ...
Disclosures
למחברים אין ניגודי אינטרסים.
Acknowledgements
המחברים אסירי תודה לג'וזי גוטייה על הסיוע בריצוף הגנים 16S rRNA. מחקר זה נתמך, בחלקו, על ידי קרנות מרכז הסרטן של UF (CJ) וקרן Gatorade של המחלקה לרפואה של UF (C.J). R.Z.G. נתמך על ידי קרנות מרכז הסרטן של UF Health. R.C.N. נתמך על ידי מענק ההכשרה TL1 של המכונים הלאומיים לבריאות באוניברסיטת פלורידה (TL1TR001428, UL1TR001427), המכון הלאומי לסרטן של המכונים הלאומיים לבריאות פרס תוכנית ההכשרה הבין-תחומית לחקר הסרטן המבוססת על צוות T32CA257923 ומרכז הסרטן של UF Health. המחקר המדווח בפרסום זה נתמך על ידי מרכז הסרטן של UF Health, נתמך בחלקו על ידי הקצאות המדינה הניתנות ב-Fla. Stat. § 381.915 והמכון הלאומי לסרטן של המכונים הלאומיים לבריאות תחת פרס מספר P30CA247796. התוכן הוא באחריות המחברים בלבד ואינו מייצג בהכרח את העמדות הרשמיות של המכונים הלאומיים לבריאות או מדינת פלורידה. למממנים לא היה תפקיד בתכנון המחקר, איסוף הנתונים וניתוחם; החלטה לפרסם; או הכנת כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL BD Slip Tip Syringe sterile, single use | Fisher Scientific | 309659 | |
| 1/4-28 mm thread to barbed male adaptor (3.2 mm), 5/pack | Cole-Parmer | 008NB32-KD5L | To build 1 6-well array, need 2 packs |
| 10M NaOH (Sodium Hydroxide) | Sigma | 72068-100ML | |
| 2.0ml Screw Cap Tube, NonKnurl, Skirted,Natural, E-Beam Sterile tube w/ attached cap | Fisher Scientific | 14-755-228 | |
| 2mag MIXdrive 60 Stirring Drive | 2mag | 40060 | 60-position magnetic stir plate (optional addition of heating capacity- cat# 40260) |
| 6-well reactor arrray, ABS-Like Translucent Clear plastic | Protolabs | Custom | See supplementary files for .stl file for 3D printing |
| Absolute Ethanol (200 Proof) | Fisher Scientific | BP2818 | |
| Acetic acid, glacial | Sigma | A6283 | |
| Adapter, nylon, male luer to 1/4-28 thread, 25/pack | Cole-Parmer | EW-45505-82 | To build 1 6-well array, need 6 (1 pack) |
| Aluminum foil | Fisher Scientific | 01-213-100 | |
| Anaerobic chamber | Coy Lab Products | Type B | |
| Bel-Art SP Scienceware Flea Micro Spinbar Magnetic Stirring Bars (1/pk) | Fisher Scientific | 22-261679 | To build 1 6-well array, need 6 |
| Biosafety cabinet class 2 | Nuaire | ||
| Butyric acid | Sigma | B103500 | |
| CaCl2 · 2H2O (Calcium Chloride Dihydrate) | Sigma | C7902 | |
| Clorox Healthcare Germicidal Wipes With Bleach, Unscented, 6" x 5", Pack Of 150 Wipes | Office Depot | 129202 | |
| D-(-)-Fructose | Sigma | F0127-100G | |
| D-(+)-Cellobiose | Sigma | C7252-100G | |
| D-(+)-Glucose | Sigma | G8270-100G | |
| D-(+)-Maltose monohydrate | Sigma | M5885-100G | |
| Drill America Plug Hand Tap DWTP1/4-28 | Home Depot | 305699489 | |
| Dulbecco's Phosphate Buffered Saline, 1X without Ca and Mg, Sterile | Genesee | 25-508 | |
| Female luer × 1/16″ hose barb adapter, Nylon, 25/pack | Cole-Parmer | EW-45502-00 | To build 1 6-well array, need 24 (1 pack) |
| Female luer × 1/8″ hose barb adapter, Nylon 25/pack | Cole-Parmer | EW-45502-04 | To build 1 6-well array, need 6 (1 pack) |
| Female luer × 3/32″ hose barb adapter, Nylon, 25/ pack | Cole-Parmer | EW-45502-02 | To build 1 6-well array, need 6 (1 pack) |
| Female luer tee, Nylon, 25/pack | Cole-Parmer | EW-45502-56 | To build 1 6-well array, need 10 (1 pack) |
| FeSO4 · 7H2O (Iron [II] Sulfate Heptahydrate) | Sigma | F8633 | |
| Hematin | Sigma | H3281 | |
| Histidine | Sigma | H7750 | |
| Isovaleric acid | Sigma | 129542 | |
| K2HPO4 dibasic (dipotassium hydrogen phosphate) | Sigma | P2222-1KG | |
| KH2PO4 monobasic (potassium dihydrogen phosphate) | Sigma | P0662-500G | |
| Large Orifice Pipet Tips | Fisher Scientific | 02-707-134 | |
| L-Cysteine hydrochloride | Sigma | C1276-10G | |
| Male luer with lock ring × 1/8″ hose barb adapter, Nylon, 25/pack | Cole-Parmer | EW-45505-04 | To build 1 6-well array, need 42 (2 packs) |
| Meat extract | Sigma | 70164-500G | |
| Med Vet International Exel Needle, 20G X 1", Hypodermic, 100/Box, 26417 | Fisher Scientific | 50-209-2532 | |
| Menadione (Vitamin K3) | Sigma | M5625 | |
| MgSO4 · 7H2O (Magnesium Sulfate Heptahydrate) | Sigma | M1880-500G | |
| Milli-Q water | |||
| NaCl (Sodium Chloride) | Sigma | S9888-500G | |
| NaHCO3 (Sodium Bicarbonate) | Sigma | S5761-500G | |
| Omnifi t Q-series two hole bottle cap | Cole-Parmer | 00945Q-2 | To build 1 6-well array, need 1 |
| PMP IPC-N L 24CHNL 8RLR 115V | MasterFlex | ISM939C-115V | 24-channel peristaltic pump, require 1 for source and 1 for waste |
| Precision Seal® rubber septa,white, 7 mm O.D. glass tubing (100/pk) | Millipore Sigma | Z553905-100EA | To build 1 6-well array, need 6 septa |
| Propionic acid | Sigma | P5561 | |
| Pump Tubing, 2-Stop, Tygon S3 E-Lab, 1.02 mm ID; 12/PK | VWR | MFLX96460-28 | To build 1 6-well array, need 6 (1 pack) |
| Pump Tubing, 2-Stop, Tygon S3 E-Lab, 1.14 mm ID; 12/PK | VWR | MFLX96460-30 | To build 1 6-well array, need 6 (1 pack) |
| Puritan Cary-Blair Medium, 5 ml | Fisher Scientific | 22-029-646 | |
| PYREX 2L Round Media Storage Bottles, with GL45 Screw Cap | Fisher Scientific | 06-414-1E | |
| Razor Blades | Genesee | 12-640 | |
| Resazurin, sodium salt | ACROS Organics from ThermoFisher | AC41890-0010 | |
| Soluble starch | Sigma | S9765-100G | |
| Stainless Steel Micro Spatulas, spoon like blade | Fisher Scientific | S50823 | |
| TBNG TYGON ELFL 2.06MMID 100' | VWR | MFLX06449-42 | To build 1 6-well array, need 205.5 cm |
| Trace Mineral Supplement | ATCC | MD-TMS | |
| Trypticase Peptone (BBL) | Fisher Scientific | B11921 | |
| Tubing, PTFE, 1/8″ (3.2 mm) OD × 1.5 mm ID, 10 M | Cole-Parmer | 008 T32-150-10 | To build 1 6-well array, need 300 mm |
| Tween 80 | Sigma | P1754 | |
| Vitamin Supplement | ATCC | MD-VS | |
| Yeast Extract (Bacto) | Fisher Scientific | DF0127-17-9 |
References
- Sender, R., Fuchs, S., Milo, R. Revised estimates for the number of human and bacteria cells in the body. PLoS Biol. 14 (8), e1002533 (2016).
- Postler, T. S., Ghosh, S. Understanding the holobiont: how microbial metabolites affect human health and shape the immune system. Cell Metab. 26 (1), 110-130 (2017).
- Rooks, M. G., Garrett, W. S. Gut microbiota, metabolites and host immunity. Nat Rev Immunol. 16 (6), 341-352 (2016).
- Auchtung, J. M., Robinson, C. D., Farrell, K., Britton, R. A. MiniBioReactor Arrays (MBRAs) as a tool for studying C. difficile physiology in the presence of a complex community. Methods Mol Biol. 1476, 235-258 (2016).
- Han, S., et al. A metabolomics pipeline for the mechanistic interrogation of the gut microbiome. Nature. 595 (7867), 415-420 (2021).
- Bilinski, J., et al. Fresh versus frozen stool for fecal microbiota transplantation-assessment by multimethod approach combining culturing, flow cytometry, and next-generation sequencing. Front Microbiol. 13, 872735 (2022).
- Li, X. M., et al. Effects of stool sample preservation methods on gut microbiota biodiversity: New original data and systematic review with meta-analysis. Microbiol Spectr. 11 (3), e0429722 (2023).
- Fouhy, F., et al. The effects of freezing on faecal microbiota as determined using MiSeq sequencing and culture-based investigations. PLoS One. 10 (3), e0119355 (2015).
- Sun, X., et al. Microbiota-derived metabolic factors reduce Campylobacteriosis in mice. Gastroenterology. 154 (6), 1751-1763.e2 (2018).
- He, Z., et al. Campylobacter jejuni promotes colorectal tumorigenesis through the action of cytolethal distending toxin. Gut. 68 (2), 289-300 (2019).
- Newsome, R. C., et al. Interaction of bacterial genera associated with therapeutic response to immune checkpoint PD-1 blockade in a United States cohort. Genome Med. 14 (1), 35 (2022).
- Ziv, N., Brandt, N. J., Gresham, D. The use of chemostats in microbial systems biology. J Vis Exp. (80), e50168 (2013).
- Wille, J., Coenye, T. Biofilm dispersion: The key to biofilm eradication or opening Pandora's box. Biofilm. 2, 100027 (2020).
- Biagini, F., et al. Designs and methodologies to recreate in vitro human gut microbiota models. Bio-des Manuf. 6 (3), 298-318 (2023).
- Qi, Y., Yu, L., Tian, F., Zhao, J., Zhai, Q. In vitro models to study human gut-microbiota interactions: Applications, advances, and limitations. Microbiol Res. 270, 127336 (2023).
- Gościniak, A., Eder, P., Walkowiak, J., Cielecka-Piontek, J. Artificial gastrointestinal models for nutraceuticals research-achievements and challenges: A practical review. Nutrients. 14 (13), 2560 (2022).
- Marrero, D., et al. Gut-on-a-chip: Mimicking and monitoring the human intestine. Biosens Bioelectron. 181, 113156 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved