È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Assemblaggio di bioreattori per la coltura continua di comunità fecali complesse
In questo articolo
Riepilogo
Questo protocollo descrive in dettaglio l'assemblaggio di array di mini-bioreattori da utilizzare per la coltura a flusso continuo di comunità fecali complesse in condizioni anaerobiche. Discutiamo anche i metodi per l'assemblaggio, l'inoculazione e il campionamento dei reattori per ulteriori analisi.
Abstract
Il microbiota, in particolare i batteri, rispondono a varie esposizioni ambientali come micro e macronutrienti, composti farmacologici e mediatori infiammatori, che alterano dinamicamente la composizione della comunità e l'output metabolico microbico. Comprendere come le condizioni fisiologiche della coltura influenzano le comunità microbiche e la diversità e la loro capacità metabolica contribuirà a un'importante conoscenza del loro impatto sulla salute e sulle malattie. Qui, presentiamo un protocollo adattato dal modello pubblicato da Auchtung et al. per creare array di mini-bioreattori in grado di coltivare comunità fecali complesse, definire consorzi batterici o singoli ceppi in condizioni precise, tra cui disponibilità di nutrienti, temperatura, portata, pH e contenuto di ossigeno. Descriviamo il processo per la costruzione del sistema di mini-bioreattore, compresi gli adattamenti per migliorare le limitazioni nel protocollo pubblicato. Discutiamo anche la configurazione del sistema di mini-bioreattore in condizioni anaerobiche con l'uso di terreni MEGA (adattati da Han et al.), che sono un terreno ricco che supporta la crescita di diversi batteri. Descriviamo l'inoculazione di campioni fecali di topo umanizzati intestinali nel sistema mini-bioreattore, seguita dalla creazione di colture comunitarie complesse all'interno del sistema mini-bioreattore, che possono essere coltivate a flusso continuo con campionamento asettico per monitorare la composizione della comunità. Questo sistema è adattabile ai cambiamenti della dieta e ad altre modifiche culturali. Le tecniche qui descritte consentono la caratterizzazione di diverse e fastidiose comunità fecali in condizioni dinamiche o in risposta a perturbazioni isolate da fattori derivati dall'ospite.
Introduzione
Il microbiota intestinale è una vasta rete di microrganismi, tra cui batteri, funghi, archei e virus, che contengono un enorme repertorio genetico e metabolico che supera di gran lunga quello diun ospite umano. La ricca capacità metabolica del microbioma comprende metaboliti prodotti dall'elaborazione batterica dei nutrienti alimentari, metaboliti dell'ospite modificati chimicamente dai batteri e metaboliti sintetizzati in modo univoco dal microbiota2. Il microbiota è implicato in quasi tutti i bioprocessi dell'ospite, ma anche in stati patologici come la malattia infiammatoria intestinale, il cancro, i disturbi metabolici e persino i disturbi neurologici 2,3. Sezionare il contributo del microbiota da quello dell'ospite è essenziale per comprendere il ruolo di microrganismi specifici o comunità complesse nella salute e nella malattia. Un approccio che consente questa dissezione è l'uso di bioreattori microbici, che coltivano diverse comunità microbiche in condizioni dinamiche. Esistono molti bioreattori disponibili in commercio che consentono la crescita di comunità batteriche fecali per quasi tutti gli scopi, tra cui la coltivazione di bioprodotti su larga scala o il controllo preciso di specifici fattori nutritivi per lo studio dei processi metabolici. Tuttavia, questi sistemi sono enormemente costosi e richiedono un'ampia preparazione e non consentono di esaminare in parallelo diverse condizioni sperimentali. Per un approccio semplificato che sia meno costoso, più adattabile e che consenta molte condizioni parallele, presentiamo qui il protocollo per la configurazione e l'uso di un array di mini-bioreattori a flusso continuo adattato da Auchtung et al.4.
La configurazione completa del sistema del mini-bioreattore è illustrata nella Figura 1A. Questo sistema di mini-bioreattore utilizza array di 6 pozzetti del reattore, che sono completamente indipendenti l'uno dall'altro e sono installati in una camera anaerobica sotto flusso peristaltico per consentire l'erogazione e la rimozione continua dei media (Figura 1A). Ogni array di reattori si trova su una piastra di agitazione magnetica a 60 posizioni, con due pompe peristaltiche a 48 cassette che contengono un tubo a 2 arresti per il fluido sorgente e il flusso di rifiuti (Figura 1A). La camera anaerobica è dotata di un monitor anaerobico CAM-12 per il contenuto di ossigeno, una scatola del catalizzatore per rimuovere l'ossigeno con capacità di riscaldamento e una colonna di rimozione dell'idrogeno solforato per assorbire il gas in eccesso dal metabolismo batterico. Ogni pozzetto del reattore è dotato di un ingresso del mezzo sorgente, di un'uscita di scarico e di una porta di campionamento, che consente l'inoculazione o il campionamento di ogni singolo pozzetto del reattore (Figura 1B).
Come descritto, il sistema di bioreattore consente il controllo dinamico della temperatura, del consumo di terreni e della disponibilità di nutrienti per supportare la coltivazione e il mantenimento delle comunità fecali. La temperatura è modulata da una scatola catalizzatore con capacità di riscaldamento, che consente di implementare rapidamente le variazioni di temperatura in tutta la camera anaerobica. Il consumo dei fluidi è regolato dalle portate delle pompe peristaltiche, che possono essere modificate per modificare il turnover dei fluidi nei reattori. Il turnover dei media può essere personalizzato in base ai tipi di comunità coltivati nei reattori, ad esempio, adattandosi a ceppi bersaglio a crescita lenta o molto rapida. Infine, la disponibilità di nutrienti può essere modificata dinamicamente aggiungendo componenti attraverso le singole porte di campionamento per ciascun pozzetto del reattore. Le condizioni statiche che possono essere modificate all'inizio di un esperimento, ma che non hanno un controllo dinamico nel sistema, sono il tipo di fluido, il contenuto di ossigeno e il numero di reattori simultanei. Gli investigatori possono scegliere di implementare qualsiasi media sorgente che desiderano e, sebbene un media sia descritto qui, sono stati implementati con successo infiniti altri tipi di media sorgente. È possibile far funzionare i reattori in condizioni aerobiche o microaerofile (a seconda della disponibilità di una camera microaerofila). Infine, è possibile installare il numero di reattori necessario a seconda delle esigenze sperimentali del ricercatore. Mentre i reattori sono in gruppi di sei all'interno di un array, ogni reattore funziona indipendentemente dagli altri e ognuno può essere collegato a una fonte diversa, se lo si desidera.
Questo sistema di bioreattore modulare può essere completamente configurato per circa $ 25.000 (esclusa la camera anaerobica o i componenti specifici della camera), con l'unica parte non riutilizzabile che è il tubo che può essere sostituito per meno di $ 100 per corsa del sistema. Il sistema è per lo più automatizzato, ma richiede un controllo quotidiano dei livelli dei terreni, poiché i flaconi di origine dei terreni dovranno essere sostituiti quando sono vuoti. Inoltre, qualsiasi campionamento deve essere completato manualmente e qualsiasi modifica condizionale dinamica al sistema dovrà essere avviata manualmente (ad esempio, la modifica della temperatura). Dal protocollo di sistema originale pubblicato da Auchtung et al., sono state implementate alcune modifiche per migliorare le prestazioni complessive e l'utilità4. In primo luogo, il materiale per la stampa 3D dell'array di bioreattori viene modificato per essere una plastica trasparente traslucida simile all'ABS per migliorare l'integrità strutturale del sistema attraverso ripetuti cicli di sterilizzazione in autoclave. Inoltre, al posto del tubo in PTFE con diametro esterno di 1/8 di pollice (3,2 mm), E-LFL, diametro interno di 2,06 mm, viene invece utilizzato un tubo da 100 piedi a causa del materiale più robusto, che è più resistente al collasso, che causerebbe blocchi nel flusso nel sistema. Infine, un raccordo aggiuntivo che utilizza una filettatura da 1/4 -28 mm per adattatori maschio spinato viene utilizzato per ridurre le variazioni di slittamento del tubo dai flaconi di origine del terreno. Da Han et al., la ricetta adattata del terreno MEGA fornisce un terreno indefinito, complesso e altamente ricco che consente la coltivazione di microrganismi anaerobi esigenti5. Il terreno viene modificato per utilizzare una preparazione alternativa del componente istidina-ematina, poiché l'originale non è più disponibile in commercio. L'idrossido di sodio viene utilizzato anche per pH del terreno a 7,0 o a qualsiasi pH desiderato. Nel complesso, questo sistema è economico e facile da usare, ottimizzato e un eccellente punto di ingresso ai sistemi di coltura a flusso continuo.
In questo protocollo, descriviamo in dettaglio la configurazione di questo sistema array di mini-bioreattori, compresi i materiali, la sterilizzazione del sistema e il successivo utilizzo per la coltivazione di campioni fecali murini umanizzati intestinali. L'obiettivo generale di questo metodo è quello di costruire un sistema di bioreattori adattabile ed economico che possa essere utilizzato per coltivare comunità microbiche in condizioni controllate. Uno schema dettagliato del flusso di lavoro per l'assemblaggio del sistema del mini-bioreattore è fornito nella Figura 2 e vi si fa riferimento nelle fasi appropriate all'interno del protocollo. Nel nostro esempio, inoculiamo due reattori con lo stesso campione fecale da topi intestinali umanizzati e descriviamo la struttura della comunità microbica sotto un flusso continuo di terreni MEGA.

Figura 1: Diagramma schematico della configurazione dell'array di mini-bioreattori nella camera anaerobica. (A) Vista completa della configurazione completa dell'array di mini-bioreattori nella camera anaerobica. L'array di bioreattori a 6 pozzetti è situato sulla piastra di agitazione magnetica a 60 posizioni. La rete luer tee sorgente è collegata al supporto sorgente sul lato sinistro attraverso il tappo di bottiglia a due fori. Due pompe peristaltiche trattengono il tubo a 2 stop dalla rete di origine e di scarico rispettivamente a sinistra e a destra. La rete di scarico a T si svuota nella bottiglia di scarico sul lato destro. Le apparecchiature essenziali per il funzionamento della camera anaerobica, tra cui il monitor CAM-12, la scatola del catalizzatore con capacità di riscaldamento e la colonna di rimozione dell'idrogeno solforato, sono disposte all'interno della camera attorno al sistema array. (B) Vista dall'alto delle porte di origine, campione e di scarto collegate a un pozzetto del reattore con il fluido all'altezza appropriata nel reattore. Clicca qui per visualizzare una versione più grande di questa figura.
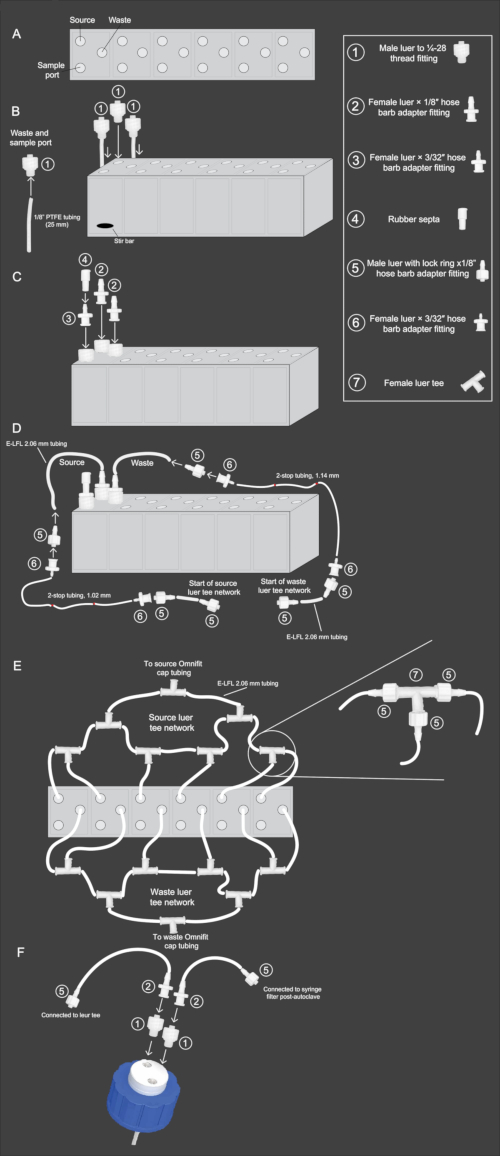
Figura 2: Diagramma schematico del flusso di lavoro dell'assemblaggio dell'array di mini-bioreattori. (A) Vista dall'alto verso il basso dell'array di mini-bioreattori, che mostra l'orientamento delle porte della sorgente, dei rifiuti e del campione. (B) Vista laterale dell'array di mini-bioreattori con vista che illustra i passaggi 2.3-2.4 del protocollo. Il tubo in PTFE da 1/8 di pollice e il raccordo (1) sono fissati e inseriti nelle porte di scarico e di campionamento. Il raccordo (1) senza PTFE viene inserito nella porta di origine. (C) Vista laterale dell'array di mini-bioreattori che illustra i passaggi 2.5-2.6 del protocollo. Il raccordo (2) è fissato alle porte di origine e di scarico. Il raccordo (3) è fissato alla porta del campione e a questo è inserito il raccordo (4) sulla parte superiore. (D) Vista laterale dell'array di mini-bioreattori che illustra i passaggi 2.9-2.11. Il tubo E-LFL da 2,06 mm è collegato alle porte di origine e di scarico e l'altra estremità è collegata ai raccordi (5) e quindi (6). Il tubo a 2 arresti del diametro appropriato viene quindi collegato al raccordo (6). Il collegamento inverso viene quindi ripetuto all'estremità del tubo a 2 arresti, con il raccordo (6) che si collega al tubo a 2 arresti e il raccordo (5) che si collega a quello. Infine, il tubo E-LFL da 2,06 mm sarà collegato al raccordo (5) per il collegamento alla rete luer tee. (E) Vista dall'alto verso il basso dell'array di mini-bioreattori che mostra la configurazione della rete luer tee di origine e di scarto descritta nei passaggi 2.12-2.15. Il tubo E-LFL da 2,06 mm che termina nel raccordo (5) viene utilizzato per collegare ciascun reattore a diversi raccordi (7), l'ultima delle quali è collegata al tappo della sorgente o della bottiglia di scarico. (F) Vista laterale del gruppo tappo di bottiglia a due fori descritto nei passaggi 2.16-2.17. Un'apertura nel tappo è collegata a un tubo in PTFE che viene posizionato all'interno della bottiglia. A tale apertura viene inserito il raccordo (1), seguito dal raccordo (2) e dal tubo E-LFL da 2,06 mm collegato al raccordo (5). Questo raccordo è collegato alla rete di sorgente o di scarico luer. All'apertura non collegata al tubo in PTFE, viene inserito il raccordo (1), seguito dal raccordo (2), e il tubo E-LFL da 2,06 mm viene collegato a un altro raccordo (5). Questa estremità viene tappata con un foglio durante la sterilizzazione in autoclave per il successivo collegamento a un filtro per siringa sterile da 0,22 μM. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
I campioni fecali utilizzati in questo studio sono stati ottenuti da esperimenti approvati dall'Institutional Animal Care and Use Committee (IACUC) presso l'Università della Florida (UF) ed eseguiti presso l'UF Animal Care Facilities (IACUC Protocol #IACUC202300000005). In breve, il genere misto germ-free wild-type (GF WT; I topi C57BL/6) (allevati e mantenuti in isolatori dalla UF Animal Care Services Germ-free Division) sono stati trasferiti dagli isolatori di riproduzione e inseriti nel sistema di bioesclusione ISOcage P per consentire la manipolazione microbica. Unità formanti colonie uguali (CFU) da feci di donatori umani sono state raggruppate per la sonda gastrica nei topi. Due settimane dopo l'inoculazione, i campioni fecali sono stati raccolti da questi topi in modo asettico per la conservazione e il successivo utilizzo in questo protocollo.
NOTA: La raccolta e la preparazione dei campioni fecali qui descritte sono intese solo come esempio di una procedura corretta, poiché a seconda del tipo di campioni raccolti (umano, topo, altro animale) e della conservazione di questi campioni, questa procedura può variare notevolmente. Gli individui dovrebbero fare riferimento alla letteratura appropriata per progettare un protocollo per la raccolta e la conservazione dei campioni fecali in base alle esigenze del singolo ricercatore.
1. Preparazione tipica di campioni fecali per la conservazione a -80 °C
- Selezionare un terreno di conservazione anaerobico (qui, abbiamo usato Cary Blair). Aliquotare 1 mL di terreno di conservazione in provette sterili da 2 mL con tappo a vite in una cappa di biosicurezza, quindi trasferirle nella camera anaerobica.
- Prima di ricevere i campioni fecali, assicurarsi che tutte le forniture (spatole autoclavate, soluzione fisiologica sterile e fiale criogeniche con tappo a vite contenenti mezzi di conservazione) siano pre-ridotte per 24 ore nella camera anaerobica.
- Raccogli campioni fecali in modo asettico dai topi utilizzando provette sterili con tappo a scatto in una cabina di biosicurezza utilizzando coppette e pinze per la raccolta delle feci in autoclave. Immediatamente dopo la raccolta, congelare le provette in azoto liquido.
- Trasferire immediatamente i campioni in una camera anaerobica insieme a una bilancia portatile per la pesatura. Pre-pesare ogni provetta. Per i campioni fecali di topo, è possibile aliquotare pellet fecali separati per provetta. Se si utilizzano campioni umani, utilizzare le spatole sterili per mescolare ogni campione e dividerlo equamente in fiale criogeniche. Dopo aver pesato nuovamente ciascuna provetta, aggiungere il terreno con un rapporto stimato di 1:10 di terreno fetale (massa: massa) a ciascuna provetta per una conservazione ottimale.
NOTA: Si raccomanda l'immediata conservazione anaerobica dei campioni fecali dopo la raccolta. I campioni non immediatamente conservati possono avere una ridotta vitalità, cambiamenti compositivi, ecc., rispetto ai campioni appena conservati 6,7,8. I terreni di conservazione Cary Blair mantengono la vitalità delle comunità batteriche inibendo l'ulteriore crescita e possono essere conservati a -80 °C. Per il rapporto stimato tra mezzi di conservazione e feci, sebbene il peso umido del campione fecale sia molto variabile, questa è la migliore stima disponibile. - Etichettare, sigillare, rimuovere le fiale dalla camera anaerobica, congelare con azoto liquido e conservare a -80 °C per un massimo di un anno o più.
2. Costruzione di un array di reattori a 6 pozzetti
- Utilizzare il file CAD (File supplementare 1) per la stampa 3D del reattore a 6 pozzetti. Questo file può essere inviato a qualsiasi azienda di stampa 3D per la produzione. Utilizzare plastica trasparente traslucida simile all'ABS come materiale di stampa per consentire la visualizzazione attraverso i reattori e allo stesso tempo essere resistente a ripetuti cicli di sterilizzazione in autoclave.
NOTA: Abbiamo commissionato gli array di reattori a 6 pozzetti per essere realizzati con plastica trasparente traslucida simile agli AB mediante stereolitografia. Si consiglia di inclinare l'array (ovvero di stampare la parte in 3D con un angolo del 30%-45%) durante la produzione, riducendo le imprecisioni dimensionali. Questa correzione si tradurrà in linee di strato visibili che corrono diagonalmente attraverso l'array, ma ciò non influisce sulle prestazioni dei reattori. - Utilizzando uno strumento di maschiatura da 25-28 mm, introdurre le filettature delle viti in ciascuna apertura dell'array del reattore.
- Tagliare strisce da 12 mm dal tubo in PTFE da 1/8 di pollice e inserire un'estremità di ciascun segmento di tubo nell'apertura della filettatura di un raccordo maschio da luer a filettatura 25-28. Avvitare saldamente i raccordi nelle apposite aperture di scarico e di campionamento dell'array (Figura 2B).
NOTA: Una lama di rasoio può essere utilizzata per radere leggermente le estremità del tubo in una configurazione a cono per rendere il tubo più adatto per l'inserimento. - Inserire una micro barra di agitazione in ciascun pozzetto del reattore e quindi avvitare un raccordo filettato maschio da 1/4-28 nei fori sorgente di ciascun pozzetto del reattore (Figura 2B).
- Avvitare i raccordi dell'adattatore per portagomma luer femmina x 1/8 di pollice nei raccordi filettati da 1/4-28 per i rifiuti e la fonte per ciascun pozzo del reattore (Figura 2C).
- Avvitare i raccordi dell'adattatore per portagomma luer femmina x 3/32 pollici nei raccordi filettati da 1/4-28 per la porta del campione. Posizionare un setto di gomma sopra gli adattatori della punta del tubo da 3/32 di pollice e piegare la parte superiore (Figura 2C).
- Tagliare due set di tubi E-LFL da 2,06 mm nelle seguenti lunghezze per le linee di scarico e di origine: 14 cm, 15,25 cm, 16,5 cm, 17,75 cm, 19 cm e 20,25 cm.
NOTA: Il nastro adesivo colorato avvolto attorno alla sezione centrale può essere utilizzato per identificare ogni lunghezza di tubo. - Collegare il tubo E-LFL da 2,06 mm ai raccordi adattatori per portagomma femmina luer da 1/8 di pollice per i collegamenti di origine e scarico (Figura 2D). Utilizzare acqua calda per rendere il tubo più malleabile. Ciò consentirà al tubo di adattarsi facilmente agli adattatori.
- Collegare un luer maschio con un anello di bloccaggio x un raccordo adattatore per portagomma da 1/8 di pollice all'altra estremità del tubo. Avvitare un adattatore femmina luer x 1/16 di pollice per portagomma che si adatta a quello (Figura 2D).
- Collegare il tubo a 2 stop di dimensioni appropriate ai corrispondenti collegamenti di scarico e di alimentazione. Le linee di scarico utilizzano tubi a 2 stop con diametro interno di 1,14 mm, mentre le linee di origine utilizzano tubi a 2 stop con diametro interno di 1,02 mm. All'altra estremità del tubo a 2 arresti, collegare un altro raccordo adattatore per portagomma luer femmina x 1/16 di pollice (Figura 2D).
- Tagliare pezzi da 20,5 cm di E-LFL, tubi da 2,06 mm e inserire il luer maschio con anello di bloccaggio x raccordi adattatori per portagomma da 1/8 di pollice su entrambe le estremità di ciascun tubo. Collegare un'estremità del tubo da 5 cm con il luer maschio con anello di bloccaggio x 1/8 di pollice adattatore portagomma al luer femmina non occupato x 1/16 di pollice portagomma raccordo all'estremità di ciascuna sezione del tubo a 2 stop. Ripetere questo processo per i restanti 19 pezzi di tubo (Figura 2D).
- Collegare il tubo E-LFL da 2,06 mm per le linee sorgente dei pozzi del reattore 1 e 2 utilizzando le estremità opposte di un luer tee femmina. Collegare uno dei pezzi di tubo da 5 cm con luer maschio con anello di bloccaggio x raccordi adattatori da 1/8 di pollice su ciascuna estremità all'uscita centrale del raccordo a T, portando a una seconda giunzione a T (Figura 2E).
- Collegare l'E-LFL, tubo sorgente da 2,06 mm per il terzo reattore, al lato opposto del secondo raccordo a T. Un altro tubo da 5 cm con un luer maschio con un anello di bloccaggio x adattatore da 1/8 di pollice dovrebbe essere attaccato su un'estremità, mentre l'altra estremità dovrebbe avere un luer femmina con un anello di bloccaggio x un adattatore da 1/8 di pollice collegato. Seguire lo stesso schema per i reattori 4, 5 e 6 (Figura 2E).
- Tagliare un pezzo di tubo E-LFL da 2,06 mm da 25 cm, collegando un luer maschio con anello di bloccaggio x 1/8 di pollice adattatore per portagomma a un'estremità del tubo, che si collegherà all'ultima giunzione luer tee femmina rimasta, e all'altra estremità collegare un raccordo adattatore luer femmina x 1/8 di pollice. Chiudere questa estremità con un foglio di alluminio (Figura 2E).
NOTA: Durante l'operazione, è essenziale mantenere sterili le estremità aperte, quindi si consiglia di tenerle tappate con un foglio di alluminio durante la sterilizzazione in autoclave e fissate in posizione con nastro adesivo. - Preparare le linee di scarico ripetendo la stessa procedura delle linee di origine descritte nei passaggi 2.12-2.14 (Figura 2E).
- Per assemblare una bottiglia per la raccolta dei rifiuti, fissare senza stringere un tappo a due fori su una bottiglia da 2 L. Inserire i raccordi filettati maschio 1/4-28 in entrambi i fori del cappuccio. Collegare un luer femmina con adattatori per portagomma da 1/8 di pollice al raccordo filettato maschio che non si collega al tubo in PTFE precollegato nel tappo (Figura 2F).
- Quindi, tagliare un pezzo di tubo E-LFL da 2,06 mm di 5 cm e collegarlo all'adattatore della punta del tubo sulla bottiglia. Collegare un luer maschio con anello di bloccaggio x adattatore per portagomma da 1/8 di pollice all'altra estremità del tubo da 5 cm e coprirlo con un foglio (questo tubo funge da sfiato dell'aria; dopo la sterilizzazione in autoclave, verrà aggiunto un filtro per siringa da 0,22 μm per prevenire la contaminazione; Figura 2F).
- Coprire l'intero tappo con un foglio di alluminio. Autoclavare i reattori e la bottiglia di scarico a 121 °C e a una velocità minima di 15 psi per 45 minuti utilizzando il programma di scarico lento tipicamente impostato per i liquidi. Una volta che i reattori si sono raffreddati, serrare i raccordi e le guarnizioni in foglio di alluminio e posizionarli nella camera anaerobica per 48 ore prima dell'uso.
3. Preparazione dei media MEGA
- Preparare tutte le soluzioni madre come indicato nella Tabella supplementare 1, Tabella supplementare 2, Tabella supplementare 3, Tabella supplementare 4, Tabella supplementare 5, Tabella supplementare 6, Tabella supplementare 7, Tabella supplementare 8.
- In una bottiglia di vetro da 2 L, aggiungere tutti gli ingredienti secchi della Tabella supplementare 9, seguiti da 1640 ml di acqua ultrapura e poi il resto degli ingredienti liquidi della Tabella supplementare 10 . Aggiungere una barra di agitazione e sciogliere completamente a fuoco medio (90 °C) su una piastra di agitazione. Il terreno sarà di colore da blu pallido a viola e non sarà completamente limpido, ma non avrà evidenti grumi non disciolti.
NOTA: La sterilizzazione in autoclave del glucosio e di altri zuccheri in presenza di peptidi può portare a modifiche e ridurre lo zucchero disponibile nei terreni. Se lo si desidera, tutte le soluzioni zuccherine possono essere filtrate sterilemente e aggiunte con i componenti della Tabella supplementare 10, come descritto al punto 3.7. - Una volta completamente miscelato, regolare il pH del terreno a 7,0 aggiungendo 10 N di idrossido di sodio (NaOH), misurando esattamente la quantità di volume aggiunta. Dopo la misurazione del pH, aggiungere 14,4 mL di acqua meno il volume di idrossido di sodio aggiunto per portare il volume esattamente a 2 L.
- Preparare un tappo di bottiglia a due fori inserendo un raccordo filettato luer maschio da 1/4-28 mm in entrambe le aperture.
- Nel foro del tappo non prefissato al tubo in PTFE, tagliare un pezzo di tubo C-flex di 5 cm e collegarlo al portagomma da 1/8 di pollice del raccordo luer femmina. All'altra estremità del tubo da 5 cm, inserire un altro luer maschio con un anello di bloccaggio e un adattatore per portagomma da 1/8 di pollice e coprire con un foglio (anche questo sarà collegato a un filtro per siringa da 0,22 μM).
- Coprire l'intero tappo con un foglio di alluminio e avvitare la parte superiore del flacone del terreno MEGA da 2 L. Autoclavare a 121 °C e una minima di 15 psi per 45 min, utilizzando il programma di scarico lento per liquidi.
- Togliere il supporto dall'autoclave e lasciarlo raffreddare mescolando fino a quando non sarà tiepido. Aggiungere i componenti della Tabella supplementare 10 al flacone del terreno da 2 L in una cappa di biosicurezza, sigillare il coperchio e quindi passare a una piastra di agitazione per omogeneizzare. Una volta che il fluido si è raffreddato, serrare i raccordi e le guarnizioni in foglio di alluminio e posizionarli nella camera anaerobica per 48 ore prima dell'uso.
NOTA: Si consiglia di far funzionare la pompa sorgente a 16 μL/min (0,94 mL/h) per un tempo di ritenzione di 16 ore. Per questa portata, un reattore a 6 pozzetti utilizza circa 0,135 L di terreno al giorno. Si consiglia inoltre di far funzionare la pompa di scarico a 40 μL/min per evitare la formazione di ostruzioni nel tubo di scarico. Monitorare il tubo e il flusso, notando che il flusso di scarico può essere aumentato in modo appropriato se si verificano ostruzioni. Sia la portata della fonte che quella dei rifiuti sono modificabili, ma i ricercatori dovrebbero monitorare attentamente la composizione della loro comunità e i tassi di crescita poiché questi possono anche cambiare con un flusso più veloce o più lento. Per far funzionare un reattore a 6 pozzi per una settimana, si consiglia di produrre almeno 2 litri di terreno (consumerà poco più di 1 litro).
4. Configurazione dell'array in camera anaerobica
NOTA: È essenziale pulire l'interno del cappuccio e i guanti del cappuccio con perossido di idrogeno al 3% seguito da un triplo risciacquo con acqua deionizzata per garantire l'assenza di contaminazione superficiale prima del montaggio. Se i collegamenti vengono effettuati rapidamente dopo la rimozione della lamina e non viene effettuato alcun contatto diretto con l'interno dei raccordi e i guanti della camera anaerobica, la possibilità di contaminazione è minima
- Allineare l'array su una piastra di agitazione magnetica nella camera anaerobica. Assicurarsi che l'array sia allineato correttamente impostando il controller della piastra di agitazione alla massima velocità (1600 giri/min) e osservando la rotazione delle ancorette.
- Montare il tubo a 2 arresti per la fonte e lo scarico nelle fascette delle pompe peristaltiche corrispondenti. Se si esegue questa operazione meno di 24 ore prima dell'uso previsto, bloccare i morsetti in posizione. In caso contrario, lasciarlo allentato fino al momento dell'uso per ridurre l'usura del tubo.
- Rimuovere il tappo di alluminio sul luer femmina x 1/8 di pollice portagomma adattatori raccordi sulla fonte e sulle linee di scarico e avvitare nel luer maschio a 1/4 -28 raccordi di minaccia avvitati nei tappi (assicurarsi che questa apertura sia collegata al tubo interno in PTFE).
- Rimuovere i tappi di alluminio e collegare un filtro per siringa da 0,22 μm alla linea di sfiato di 5 cm del flacone di origine e alla linea di sfiato del flacone di scarico.
- Iniziare il flusso a una velocità moderata (1 mL/min sulla pompa di origine e 2 mL/min sulla pompa di scarico) per iniziare a riempire i reattori. Assicurarsi che il tubo della linea di scarico in ciascun pozzetto del reattore sia inferiore a quello del tubo di origine, in modo da evitare il riempimento eccessivo o lo svuotamento di ciascun pozzetto.
- Quando i reattori iniziano a riempirsi, assicurarsi che tutti raggiungano lo stesso volume e che il fluido fluisca nella linea di scarico. Con le misure qui descritte, il volume di lavoro di ciascun reattore è di 15 mL.
NOTA: Se i singoli reattori non si riempiono, serrare eventuali raccordi allentati e ispezionare le linee di origine per verificare la presenza di problemi, sostituendoli con extra preparati se necessario. Se il problema persiste, sostituire la bottiglia di origine, se disponibile. Se il livello del fluido supera la linea di scarico interna dei reattori, verificare che il tubo in PTFE all'interno della porta di scarico del reattore sia ancora in posizione. - Dopo che ogni reattore si è riempito, regolare le impostazioni della pompa sulla portata di 16 μl/min, quindi spegnere le pompe.
- Lasciare che il fluido rimanga nei reattori e nelle bottiglie di scarto per una notte prima dell'inoculazione. Ciò consente un ulteriore condizionamento anaerobico del terreno (per un totale di ~72 ore) e consente all'utente di confermare la sterilità del sistema.
- Per confermare la sterilità del sistema prima dell'inoculazione del campione fecale, campionare ciascun reattore e il terreno di partenza direttamente dopo il riempimento iniziale (fase 4.7) e di nuovo dopo la fase 4.8. Seguire la procedura per il campionamento asettico dei reattori descritta al punto 6.
- Assicurarsi che la misura della densità ottica di tutti i campioni sia la stessa di quella del mezzo sorgente; Se si osserva un aumento della densità ottica, si sospetta una contaminazione e tutti i supporti e il sistema devono essere decostruiti, puliti e riassemblati.
5. Inoculazione del campione fecale
- Posizionare i puntali sterili per pipette a foro largo, soluzione fisiologica sterile, provette coniche da 50 mL, pipette sierologiche sterili da 25 mL, siringhe da 5 mL e aghi calibro 16 nella camera anaerobica per condizionare nell'ambiente anaerobico per almeno 24 ore.
- Calcolare la quantità di materiale fecale necessaria per inoculare il numero desiderato di reattori. Ogni pozzetto del reattore richiede 3,8 mL di surnatante in un impasto fecale al 25% m/v. Per sei pozzetti del reattore, un totale di 22,8 mL di liquame fecale al 25% m/v dovrebbe fornire abbastanza surnatante per l'inoculazione, che richiederà 5,7 g di materia fecale solida.
- Trasferire i campioni fecali conservati in fiale criogeniche nella camera anaerobica e lasciarli scongelare per 15 minuti.
- Utilizzare una punta per pipetta a foro largo per trasferire il materiale fecale dalle fiale criogeniche a una provetta conica da 50 mL, sigillare ermeticamente e centrifugare a 200 x g per 5 minuti per depositare il particolato.
- Trasferire nuovamente in una camera anaerobica e rimuovere il surnatante. Utilizzando una spatola da laboratorio autoclavata, trasferire i solidi fecali in una nuova provetta conica da 50 mL, ottenendo una massa totale di 5,7 g. Aggiungere 17,1 mL di soluzione salina sterile anaerobica alla provetta e sigillare ermeticamente.
- Togliere le provette coniche dalla camera, omogeneizzarle a vortice per 5 minuti, quindi centrifugare a 200 x g per 5 minuti per depositare il particolato.
- Sterilizzare i setti sulla parte superiore di ciascun reattore con una salvietta da laboratorio con candeggina al 10% per almeno 2 minuti mentre i campioni vengono inseriti nella centrifuga.
- Riportare i campioni nella camera anaerobica e, utilizzando pipette sierologiche sterili, trasferire i surnatanti in nuove provette coniche da 50 mL.
- Caricare 3,8 mL di surnatante di liquame fecale in sei siringhe separate da 5 mL con aghi da 16 G da 1,5 pollici.
- Rimuovere la salvietta, inserire l'ago attraverso il setto e iniettare lentamente il liquame fecale nel reattore.
- Lasciare che le comunità fecali si stabiliscano in ciascun reattore per circa 16-18 ore prima di iniziare il flusso verso il reattore. Impostare la piastra di agitazione magnetica alla massima velocità dal momento in cui viene iniettato il liquame fecale (1600 giri/min).
6. Raccolta asettica di campioni dai pozzi dei reattori
- Forare l'involucro su sei siringhe sterili da 1 ml e sei aghi sterili da 22 G da 3 pollici e posizionarli nella camera anaerobica per degassare per 24 ore.
- Immediatamente prima del campionamento, sterilizzare i setti sulla parte superiore di ciascun reattore con una salvietta da laboratorio con candeggina al 10% per almeno 2 minuti.
- Rimuovere la salvietta da laboratorio con candeggina e collegare immediatamente un ago a una siringa e inserire l'ago al centro dei setti del pozzetto del primo reattore.
- Estrarre 1 mL di campione, rimuovere l'ago dai setti e trasferire il campione dalla siringa a una provetta marcata da 1,7 mL per l'uso a valle. I setti di gomma si richiudono dopo la rimozione dell'ago. Utilizzare un ago e una siringa nuovi per ogni pozzetto del reattore per prevenire la contaminazione incrociata.
- Se si desidera il surnatante, rimuovere le provette dalla camera anaerobica e centrifugare a 20.000 x g per 1 minuto per pellettare le cellule batteriche.
- Trasferire il surnatante in una provetta da 1,7 mL etichettata separatamente e conservare a -80 °C.
7. Decostruzione e pulizia del sistema del mini-bioreattore
- Scollegare la bottiglia di origine dal luer tee di origine e aumentare la portata (1 ml/min sulla pompa di origine e 2 ml/min sulla pompa di scarico) per iniziare a svuotare il tubo. Lasciare che il tubo si svuoti completamente. Spegnere la piastra di agitazione.
- Una volta che il tubo è vuoto, scollegare la bottiglia di scarico dal raccordo a T di scarico. Quindi, posizionare il gruppo reattore nella camera di compensazione anaerobica e rimuoverlo dalla camera.
- Scollegare tutti i segmenti di tubi E-LFL da 2,06 mm e in PTFE e smaltirli. Scollegare tutti i raccordi e metterli in una soluzione di candeggina al 10%.
- Rimuovere le mini-barrette da ogni matrice e metterle nella soluzione di candeggina. Capovolgere l'array del reattore per svuotare il mezzo in una soluzione separata di candeggina al 10% per la disinfezione. Quindi, immergere l'array vuoto in una soluzione di candeggina fresca.
- Lasciare tutti i raccordi e l'array del reattore in ammollo nella soluzione di candeggina al 10% per 30 minuti (un ammollo prolungato causerà scolorimento).
- Sciacquare i raccordi e l'array del reattore con acqua deionizzata, quindi immergerli per una notte in una soluzione detergente enzimatica secondo le istruzioni del produttore.
- Risciacquare tre volte i raccordi e l'array del reattore con acqua deionizzata, quindi lasciare asciugare completamente all'aria per almeno 3 giorni. Una volta asciutti, l'array del reattore e i raccordi possono essere riutilizzati per l'assemblaggio.
Risultati
I campioni fecali sono stati raccolti da topi colonizzati con liquame fecale umano 2 settimane dopo l'inoculazione e conservati a -80 °C. Il sistema del bioreattore è stato configurato con un flusso continuo di media MEGA per due pozzi di reattore replicato (Figura 3A). Il liquame fecale è stato preparato dai pellet fecali di topo secondo il protocollo descritto nella fase 6 ed entrambi i reattori sono stati inoculati med...
Discussione
Il sistema di mini-bioreattore descritto in questo protocollo consente la coltivazione di comunità fecali indipendenti per la sperimentazione parallela. Questa capacità di studiare le comunità microbiche isolando i fattori dell'ospite è un approccio essenziale per comprendere la capacità intrinseca dei microrganismi di adattarsi al loro ambiente. Questo protocollo può essere facilmente adattato per la coltivazione di consorzi batterici definiti o anche di singole colture isolate, s...
Divulgazioni
Gli autori non hanno conflitti di interesse.
Riconoscimenti
Gli autori sono grati a Josee Gauthier per l'assistenza con il sequenziamento del gene 16S rRNA. Questa ricerca è stata sostenuta, in parte, dall'UF Health Cancer Center Funds (CJ) e dal UF Department of Medicine Gatorade Fund (CJ). R.Z.G. è stato sostenuto dai fondi dell'UF Health Cancer Center. RCN è stato supportato dal National Institutes of Health TL1 Training Grant presso l'Università della Florida (TL1TR001428, UL1TR001427), dal National Cancer Institute del National Institutes of Health Team-Based Interdisciplinary Cancer Research Training Program T32CA257923 e dall'UF Health Cancer Center. La ricerca riportata in questa pubblicazione è stata supportata dall'UF Health Cancer Center, supportata in parte dagli stanziamenti statali previsti in Fla. Stat. § 381.915 e dal National Cancer Institute del National Institutes of Health con il numero di premio P30CA247796. Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente le opinioni ufficiali del National Institutes of Health o dello Stato della Florida. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta dei dati e nell'analisi; decisione di pubblicazione; o preparazione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL BD Slip Tip Syringe sterile, single use | Fisher Scientific | 309659 | |
| 1/4-28 mm thread to barbed male adaptor (3.2 mm), 5/pack | Cole-Parmer | 008NB32-KD5L | To build 1 6-well array, need 2 packs |
| 10M NaOH (Sodium Hydroxide) | Sigma | 72068-100ML | |
| 2.0ml Screw Cap Tube, NonKnurl, Skirted,Natural, E-Beam Sterile tube w/ attached cap | Fisher Scientific | 14-755-228 | |
| 2mag MIXdrive 60 Stirring Drive | 2mag | 40060 | 60-position magnetic stir plate (optional addition of heating capacity- cat# 40260) |
| 6-well reactor arrray, ABS-Like Translucent Clear plastic | Protolabs | Custom | See supplementary files for .stl file for 3D printing |
| Absolute Ethanol (200 Proof) | Fisher Scientific | BP2818 | |
| Acetic acid, glacial | Sigma | A6283 | |
| Adapter, nylon, male luer to 1/4-28 thread, 25/pack | Cole-Parmer | EW-45505-82 | To build 1 6-well array, need 6 (1 pack) |
| Aluminum foil | Fisher Scientific | 01-213-100 | |
| Anaerobic chamber | Coy Lab Products | Type B | |
| Bel-Art SP Scienceware Flea Micro Spinbar Magnetic Stirring Bars (1/pk) | Fisher Scientific | 22-261679 | To build 1 6-well array, need 6 |
| Biosafety cabinet class 2 | Nuaire | ||
| Butyric acid | Sigma | B103500 | |
| CaCl2 · 2H2O (Calcium Chloride Dihydrate) | Sigma | C7902 | |
| Clorox Healthcare Germicidal Wipes With Bleach, Unscented, 6" x 5", Pack Of 150 Wipes | Office Depot | 129202 | |
| D-(-)-Fructose | Sigma | F0127-100G | |
| D-(+)-Cellobiose | Sigma | C7252-100G | |
| D-(+)-Glucose | Sigma | G8270-100G | |
| D-(+)-Maltose monohydrate | Sigma | M5885-100G | |
| Drill America Plug Hand Tap DWTP1/4-28 | Home Depot | 305699489 | |
| Dulbecco's Phosphate Buffered Saline, 1X without Ca and Mg, Sterile | Genesee | 25-508 | |
| Female luer × 1/16″ hose barb adapter, Nylon, 25/pack | Cole-Parmer | EW-45502-00 | To build 1 6-well array, need 24 (1 pack) |
| Female luer × 1/8″ hose barb adapter, Nylon 25/pack | Cole-Parmer | EW-45502-04 | To build 1 6-well array, need 6 (1 pack) |
| Female luer × 3/32″ hose barb adapter, Nylon, 25/ pack | Cole-Parmer | EW-45502-02 | To build 1 6-well array, need 6 (1 pack) |
| Female luer tee, Nylon, 25/pack | Cole-Parmer | EW-45502-56 | To build 1 6-well array, need 10 (1 pack) |
| FeSO4 · 7H2O (Iron [II] Sulfate Heptahydrate) | Sigma | F8633 | |
| Hematin | Sigma | H3281 | |
| Histidine | Sigma | H7750 | |
| Isovaleric acid | Sigma | 129542 | |
| K2HPO4 dibasic (dipotassium hydrogen phosphate) | Sigma | P2222-1KG | |
| KH2PO4 monobasic (potassium dihydrogen phosphate) | Sigma | P0662-500G | |
| Large Orifice Pipet Tips | Fisher Scientific | 02-707-134 | |
| L-Cysteine hydrochloride | Sigma | C1276-10G | |
| Male luer with lock ring × 1/8″ hose barb adapter, Nylon, 25/pack | Cole-Parmer | EW-45505-04 | To build 1 6-well array, need 42 (2 packs) |
| Meat extract | Sigma | 70164-500G | |
| Med Vet International Exel Needle, 20G X 1", Hypodermic, 100/Box, 26417 | Fisher Scientific | 50-209-2532 | |
| Menadione (Vitamin K3) | Sigma | M5625 | |
| MgSO4 · 7H2O (Magnesium Sulfate Heptahydrate) | Sigma | M1880-500G | |
| Milli-Q water | |||
| NaCl (Sodium Chloride) | Sigma | S9888-500G | |
| NaHCO3 (Sodium Bicarbonate) | Sigma | S5761-500G | |
| Omnifi t Q-series two hole bottle cap | Cole-Parmer | 00945Q-2 | To build 1 6-well array, need 1 |
| PMP IPC-N L 24CHNL 8RLR 115V | MasterFlex | ISM939C-115V | 24-channel peristaltic pump, require 1 for source and 1 for waste |
| Precision Seal® rubber septa,white, 7 mm O.D. glass tubing (100/pk) | Millipore Sigma | Z553905-100EA | To build 1 6-well array, need 6 septa |
| Propionic acid | Sigma | P5561 | |
| Pump Tubing, 2-Stop, Tygon S3 E-Lab, 1.02 mm ID; 12/PK | VWR | MFLX96460-28 | To build 1 6-well array, need 6 (1 pack) |
| Pump Tubing, 2-Stop, Tygon S3 E-Lab, 1.14 mm ID; 12/PK | VWR | MFLX96460-30 | To build 1 6-well array, need 6 (1 pack) |
| Puritan Cary-Blair Medium, 5 ml | Fisher Scientific | 22-029-646 | |
| PYREX 2L Round Media Storage Bottles, with GL45 Screw Cap | Fisher Scientific | 06-414-1E | |
| Razor Blades | Genesee | 12-640 | |
| Resazurin, sodium salt | ACROS Organics from ThermoFisher | AC41890-0010 | |
| Soluble starch | Sigma | S9765-100G | |
| Stainless Steel Micro Spatulas, spoon like blade | Fisher Scientific | S50823 | |
| TBNG TYGON ELFL 2.06MMID 100' | VWR | MFLX06449-42 | To build 1 6-well array, need 205.5 cm |
| Trace Mineral Supplement | ATCC | MD-TMS | |
| Trypticase Peptone (BBL) | Fisher Scientific | B11921 | |
| Tubing, PTFE, 1/8″ (3.2 mm) OD × 1.5 mm ID, 10 M | Cole-Parmer | 008 T32-150-10 | To build 1 6-well array, need 300 mm |
| Tween 80 | Sigma | P1754 | |
| Vitamin Supplement | ATCC | MD-VS | |
| Yeast Extract (Bacto) | Fisher Scientific | DF0127-17-9 |
Riferimenti
- Sender, R., Fuchs, S., Milo, R. Revised estimates for the number of human and bacteria cells in the body. PLoS Biol. 14 (8), e1002533 (2016).
- Postler, T. S., Ghosh, S. Understanding the holobiont: how microbial metabolites affect human health and shape the immune system. Cell Metab. 26 (1), 110-130 (2017).
- Rooks, M. G., Garrett, W. S. Gut microbiota, metabolites and host immunity. Nat Rev Immunol. 16 (6), 341-352 (2016).
- Auchtung, J. M., Robinson, C. D., Farrell, K., Britton, R. A. MiniBioReactor Arrays (MBRAs) as a tool for studying C. difficile physiology in the presence of a complex community. Methods Mol Biol. 1476, 235-258 (2016).
- Han, S., et al. A metabolomics pipeline for the mechanistic interrogation of the gut microbiome. Nature. 595 (7867), 415-420 (2021).
- Bilinski, J., et al. Fresh versus frozen stool for fecal microbiota transplantation-assessment by multimethod approach combining culturing, flow cytometry, and next-generation sequencing. Front Microbiol. 13, 872735 (2022).
- Li, X. M., et al. Effects of stool sample preservation methods on gut microbiota biodiversity: New original data and systematic review with meta-analysis. Microbiol Spectr. 11 (3), e0429722 (2023).
- Fouhy, F., et al. The effects of freezing on faecal microbiota as determined using MiSeq sequencing and culture-based investigations. PLoS One. 10 (3), e0119355 (2015).
- Sun, X., et al. Microbiota-derived metabolic factors reduce Campylobacteriosis in mice. Gastroenterology. 154 (6), 1751-1763.e2 (2018).
- He, Z., et al. Campylobacter jejuni promotes colorectal tumorigenesis through the action of cytolethal distending toxin. Gut. 68 (2), 289-300 (2019).
- Newsome, R. C., et al. Interaction of bacterial genera associated with therapeutic response to immune checkpoint PD-1 blockade in a United States cohort. Genome Med. 14 (1), 35 (2022).
- Ziv, N., Brandt, N. J., Gresham, D. The use of chemostats in microbial systems biology. J Vis Exp. (80), e50168 (2013).
- Wille, J., Coenye, T. Biofilm dispersion: The key to biofilm eradication or opening Pandora's box. Biofilm. 2, 100027 (2020).
- Biagini, F., et al. Designs and methodologies to recreate in vitro human gut microbiota models. Bio-des Manuf. 6 (3), 298-318 (2023).
- Qi, Y., Yu, L., Tian, F., Zhao, J., Zhai, Q. In vitro models to study human gut-microbiota interactions: Applications, advances, and limitations. Microbiol Res. 270, 127336 (2023).
- Gościniak, A., Eder, P., Walkowiak, J., Cielecka-Piontek, J. Artificial gastrointestinal models for nutraceuticals research-achievements and challenges: A practical review. Nutrients. 14 (13), 2560 (2022).
- Marrero, D., et al. Gut-on-a-chip: Mimicking and monitoring the human intestine. Biosens Bioelectron. 181, 113156 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon