Method Article
由Stemgent人类TF慢病毒重新编程人类成纤维细胞生成诱导多能干细胞
摘要
我们展示了为生成诱导多能干的干细胞,人类体细胞用慢病毒介导的人为因素OCT4,SOX2,NANOG和Lin28交付协议。多能性证实了形态学和胚胎干(ES)细胞特异性标志物的存在。
摘要
2006年,Yamanaka和他的同事首先证明了逆转录病毒介导的传递和表达Oct4的,SOX2,c - Myc和KLF4能够诱导小鼠成纤维细胞的多能状态。1同组还报告了人体细胞成功地重编程到诱导多能干细胞(iPS)细胞的逆转录病毒载体提供相同的转录因素中使用的人类版本。此外, 詹姆斯汤姆森等报道的慢病毒介导的另一因素的共同表达(OCT4,SOX2, NANOG和Lin28 )是人体细胞重编程为iPS细胞的能力。
iPS细胞是类似ES细胞的形态,增殖和分化成人体的所有组织类型的能力。人类iPS细胞对ES细胞的一个明显的优势,他们表现出不破坏胚胎的伦理困境的ES细胞的关键特性。病人特异性的iPS细胞的生成个性化的再生医学疗法规避的一个重要障碍,消除非自体移植的细胞的免疫排斥反应的可能性。
在这里,我们展示的协议进行重新编程人类成纤维细胞,使用Stemgent人类TF慢病毒设置。我们也表明,这个设置重新编程的细胞开始显示IPS形态四天后传导。使用Stemolecule Y27632,我们选择了三个殖民地的顺序轮采摘和传代后的iPS细胞,并观察到正确的形态。我们还证明,细胞重新编程后显示的全能性的标志AP,表面标志物TRA - 1 - 81,TRA - 1 - 60,SSEA - 4和SSEA - 3,和核标记OCT4,SOX2和Nanog。
研究方案
1。重新编程
- 种子北京1 × 10 5 6孔板每孔细胞密度细胞。文化在2毫升培养液(450毫升与50毫升ES合格的胎牛血清,5毫升10毫米非必需氨基酸,5 ml青霉素/链霉素,5毫升200毫米L -谷氨酰胺和0.9毫升55毫米βEMEM补充细胞β-巯基乙醇)一夜之间在37 ° C和5%的CO 2。
- 就在同一天,开始准备加入0.1%明胶加水稀释到6孔板和孵化一夜之间在37 ° C和5%的CO 2 MEF的接驳板。
- 孵化后,取出从BJ细胞的培养基,并添加2毫升6微克/毫升的聚凝胺为辅的生长介质中,500μLhOct4慢病毒,50μLhSox2的慢病毒,50μLhNanog慢病毒和50μLhLin28慢病毒,每孔。轻轻摇动,以确保中期甚至涂层板。孵育过夜,在37 ° C和5%的CO 2。
- 就在同一天,取出1小瓶CF - 1的MEF细胞从液氮和解冻。取出液体从明胶涂井(见步骤1.2),并添加在MEF饲养层细胞密度0.2 × 10 5细胞/孔。每孔总体积应2毫升细胞MEF生长培养基(DMEM培养液450毫升与50毫升FBS和5毫升的非必需氨基酸补充)。
- 次日,0.05%胰蛋白酶/ EDTA和200 XG为5分钟的离心分离与北京的细胞。吸在生长介质的介质和悬浮。删除从MEF馈线板(见第1.4步)中,加2毫升/ BJ细胞悬液。细胞浓度应约5 × 10 4细胞/孔。孵育过夜,在37 ° C和5%的CO 2。
- 更换与人类ES / iPS细胞培养液(100毫升淘汰赛血清替代,5毫升10毫米非必需氨基酸,5毫升200毫米L -谷氨酰胺,0.9毫升补充400毫升的DMEM/F12培养24小时后重新播种β-巯基乙醇55毫米和20 ng / ml的重组人碱性成纤维细胞生长因子)。改变介质为7天,每24小时。
- 七天后,改变中MEF条件培养基(见第2节)。
2。准备MEF的条件培养基
- 种子的CF - 1 MEF饲养层细胞,2 × 10 5细胞/孔在2毫升MEF生长培养基在6孔板。孵育过夜,在37 ° C和5%的CO 2。
- 改变人类ES / iPS细胞培养液中的介质。孵育过夜,在37 ° C和5%的CO 2。
- 收集上清为4天,每24小时。通过0.22微米过滤器的过滤上清。
- 与碱性成纤维细胞生长因子50毫微克/毫升上清补充。
3。 IPS殖民地的选择和传代
- 选择一个ES -殖民地在人类胚胎干/ IPS文化与10μMStemolecule Y27632 CF - 1 MEF饲养层细胞种子细胞培养菜培养基和重新播种。孵育过夜,在37 ° C和5的CO 2。
- 中期的第7天(不含Stemolecule Y27632补充),每24小时变化的文化。七天后,改变中MEF条件培养基(见准备第2条)。我们继续传代细胞,直到他们表现出典型的人类胚胎干形态。
4。多潜能性标志物的免疫细胞化学考试
- 清洗细胞,用PBS轻轻三次。
- 修复细胞在室温下20分钟的固定液500μL。
- 清洗细胞,用PBS轻轻三次。
- 阻止非特异性结合,用500μl堵在室温下一个小时的缓冲。
- 用250μL的特定抗体,4℃过夜孵育细胞° C(我们使用1:100 TRA - 1 - 81,TRA - 1 - 60,SSEA - 4,SSEA - 3,OCT4,SOX2,Nanog和Lin28稀释)。
- 清洗细胞,用PBS轻轻三次。
- 用250μL二次抗体孵育的细胞在室温下1小时,保持避光(我们用羊抗小鼠IgM Cy3标记共轭,羊抗鼠IgG Cy3标记山羊抗大鼠IgM抗体Cy3标记共轭轭,和山羊抗兔Cy3标记物)在1:300稀释。
- 清洗细胞,用PBS轻轻三次。
- 添加的DAPI(终浓度为1微克/毫升)的最后一次洗涤,孵育5分钟,以可视化核。
- 分析下放大的细胞。
第5部分:代表结果
1。形态学结果:
人包皮成纤维细胞(北京)分别与Oct4的合作转,SOX2,NANOG和Lin28。早转导后第4天观察形态学变化,以及细胞集群成为更紧密的第17天(图1)包装。菌落手工采摘25天,CF - 1 MEF饲养层细胞培养。为了方便后重新编程的iPS细胞集落形成,我们使用Stemolecule Y27632岩石抑制剂,在每个通道的初始隔夜播种。三个殖民地的顺序轮采摘和传代后的iPS细胞克隆具有良好的形态观察。
2。多能性标志物的表达:
为了进一步孤立的iPS细胞集落,我们期待在ES细胞中表达的共同的全能性的标志物存在。殖民地表现出较强的碱性磷酸酶(AP)的活性(图2)。此外,免疫细胞化学(ICC)的iPS细胞克隆具有多能性的分子标记的特异性抗体的面板,包括表面标志物TRA - 1 - 81,TRA - 1 - 60,SSEA - 4和SSEA - 3以及核标记Oct4,Sox2和Nanog的。隔离IPS殖民地的所有标记(图3)呈阳性反应。国际刑事法院的结果显示,iPS细胞表现出适当的多能性标志物表达模式,表明这些iPS细胞非常类似于未分化的人类胚胎干细胞。

图1:形态学变化转BJ细胞。一个典型的iPS细胞集落形成(一)(二)4天,17天后转明场图像。
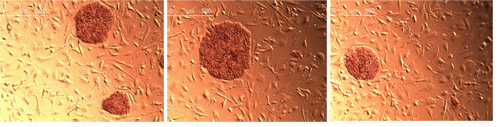
图2:AP的北京重新编程细胞的活动。三种不同的菌落染色Stemgent碱性磷酸酶染色试剂盒。
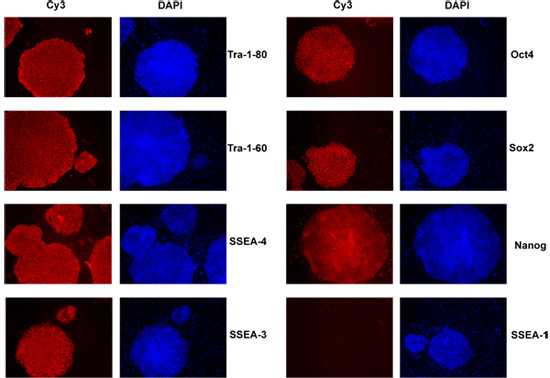
图3:人类iPS细胞表达高水平以下的ES细胞特异性标志物:表面标志物TRA - 1 - 81,TRA - 1 - 60,SSEA - 4和SSEA - 3,10月4日,NANOG和Sox2核标记。
讨论
这些结果表明,Stemgent人类TF慢病毒设置,可以用来有效地产生异位表达诱导的iPS殖民地转染人成纤维细胞中的转录因子。设计重新编程实验时,应考虑几个变量,重新编程,以优化效率。首先,积极的病毒靶比(多重感染的教学语言),可能需要在修改的主要传导步骤,以达到最佳的转染效率。其次,靶细胞的生长条件可能会影响重新编程。健康和增殖细胞更适合重新编程。第三,修改为不同的手机号码的协议时,建议按比例调整到培养皿的表面区域,目标手机号码。最后,如Y27632应用岩石抑制剂应被视为最近的研究已经证明,在提高胚胎干细胞集落生存的效用,以帮助确保成功地重编程。4,5
披露声明
The authors of this article are employed by Stemgent that produces reagents and instruments used in this article.
材料
| Name | Company | Catalog Number | Comments |
| Human TF Lentivirus Set | Stemgent | 00-0005 | |
| Stemolecule Y27632 | Stemgent | 04-0012 | |
| TRA-1-81 antibody | Stemgent | 09-0012 | |
| TRA-1-60 antibody | Stemgent | 09-0009 | |
| SSEA-4 antibody | Stemgent | 09-0003 | |
| SSEA-3 antibody | Stemgent | 09-0014 |
参考文献
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., Vodyanik, M. A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J. L., Tian, S., Nie, J., Jonsdottir, G. A., Ruotti, V., Stewart, R., Slukvin, I. I., Thompson, J. A. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (1917).
- Watanabe, K., Ueno, M., Kamiya, D., Nishiyama, A., Matsumura, M., Wataya, T., Takahashi, J. B., Nishikawa, S., Muguruma, K., Sasai, Y. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat. Biotechnol. 25, 681-686 (2007).
- Koyanagi, M., Takahashi, J., Arakawa, Y., Doi, D., Fukuda, H., Hayashi, H., Narumiya, S., Hashimoto, N. Inhibition of the Rho/ROCK pathway reduces apoptosis during transplantation of embryonic stem cell-derived neural precursors. J. Neurosci. Res. 86, 270-280 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。