Method Article
斑马鱼幼虫的研究急性肾损伤的静脉Microinjections
摘要
我们描述后fetilization(DPF)的斑马鱼幼虫诱发急性肾损伤(AKI)2天氨基糖甙类抗生素,庆大霉素,显微注射技术。我们还描述了一个整装免疫组织化学方法,塑料包埋,切片和斑马鱼幼虫形象化的AKI的介导的损伤。
摘要
在这个视频文章中,我们描述了AKI的斑马鱼模型为nephrotoxicant使用庆大霉素。该技术由静脉注射2 DPF斑马鱼microinjections。这项技术代表了一个高效,快速的方法来提供到斑马鱼幼虫体内的水溶性物质,从而为每小时15-20鱼注射。此外AKI的研究,这种显微注射技术也可以用于其他类型的实验研究,如血管造影。我们提供了一个详细的协议的技术设备所需的肾功能下降的视觉措施。此外,我们也证明了固定,整个装入一个肾曲小管标志,塑料包埋和幼虫斑马鱼切片免疫组化进程。我们表明,注射用庆大霉素表明斑马鱼幼虫形态特征符合亚希:水肿,细胞中的肾小管上皮细胞的极性损失,和肾小管形态破坏。
研究方案
(汉努瑶等人,2005)和(温斯坦等,1995),稍作修改报告公布的方法是基于以下协议的一部分。
第1部分:Microinjections
在预先设定为显微注射
- 鱼注射受精后(DPF)第2天。因此,成年斑马鱼繁殖了3晚,前有计划的实验。收集胚胎,并将其放置在培养皿E3的水(5MM氯化钠,0.17mM KCL,0.33mM 氯化钙 2,0.33mM 硫酸镁 4)为28.5 ° C 。在第一天结束的死胚取出培养皿和独立的胚胎,以便有80-100%培养皿中的胚胎。
- 准备从毛细管的长度,外径0.63 / 0.20 /身份证毫米(mm)的R - 6自定义玻璃管德拉蒙德科学公司,Broomall,扩音9-000-3000(4英寸)电极拉马拉的玻璃针。尖端直径应为10-20微米。 (徕卡S6E)在解剖显微镜下,画出一个永久性标记沿针约101毫米线,与统治者的帮助,并储存在一个大培养皿粘土斜针。
- 准备拿着吸管:消防波兰的一个薄壁硼硅玻璃毛细管(152毫米,外径1 / 0.75 /内径mm TW100 - 6,世界精密仪器公司)的提示,直到内径在本生灯火焰提示是0.4-0.5毫米。这种尺寸允许2 DPF斑马鱼幼虫卵黄囊良好的抓地力。举行一次的一块玻璃毛细管用长镊子,热与毛细管本生灯相反的一角,放置淡蓝色的火焰的内锥,最热的部分,它为1-2秒垂直年底,滚动它来获取一个均匀的熔体。这几次重复,然后在显微镜下研究的毛细血管,在舞台上微米(病区的94 W 9910)。这是关键的一步,它可能是必要的消防波兰少数控股移液器,并选择适当的大小后,当你操纵的幼虫。如果你细心的话,一个拿着吸管持续多个显微注射会议。
- 填写Microsyringe与矿物油的手动泵(MMP,世界精密仪器公司),按照制造商的指示。操纵杆操纵(Narishige,MN - 151),带有磁性的立场(151)Narishige,MN铁板(Narishige,IP)的连接,吸液管插入持有人。
显微注射
- 准备注射液20μL:2.4μl庆大霉素(Sigma - Aldrich公司G8648在盐溶液中,50mg/ml)和17.6μl10 - kDa的路西法黄色右旋糖酐(Invitrogen公司的D1825,(盐水1mg/ml的),在控制鱼庆大霉素盐水代替。荧光葡聚糖(可用于许多不同的颜色),足以证明注射的准确性和选择已注入nephrotoxicant的幼虫。
- 准备用2ml矿物油230毫米培养皿放置下注射混合和控制混合,以防止蒸发的解决方案。
- 准备麻醉:400毫克tricaine粉(乙基- M -氨基磺酸SIGMA A - 5040)97.7毫升2.1毫升1M三(DD水,pH值9)。调整pH至7。存放在冰箱原液,4.2毫升分装。作为麻醉剂稀释4.2毫升tricaine的原液的E3在100毫升水(韦斯特1993年),在室温下离开tricaine。
下面的步骤是在解剖显微镜下进行
- 手动删除任何chorions其余用细镊子和麻醉传输与tricaine培养皿的斑马鱼,在室温下回暖。斑马鱼应暴露在tricaine开始microinjections前至少15分钟。
- 打开使用刀片(VWR科学55411-050)注射针的尖端。保持在一个很小的角度,创建一个斜角切提示,如获得尖端直径约10 -20μm的开放的刀片。
- 打开电源,真空和空气中的微量注射器具(世界精密仪器公司,PV820气动picopump)供应。插入针持针器安装在倾斜的显微和基地(字精密仪器有限公司,型号M3301R,TB - 1)。
- 为了填补针,放置一个液滴的解决方案,在注入充满矿物油(费舍尔化工,0121-1)30毫米的Petri菜(10μL)。打开手动显微淹没针尖端的解决方案中,设置了picopump“保持/发泄”切换到“发泄”(相当于真空的PV820的“发泄”),并填写拉针通过针尖的解决方案。这将需要几分钟的时间,如果进针的解决方案变得太快,这意味着,尖端直径太大,并注射将不准确。针后已被填补,设置picopump“持有”(“持有”,等于注入的PV820)。
- 要校准针,设置的picopump“门控/定时”开关“门”,按下脚踏开关,放电针,并记录为半月板所花费的时间(秒)之一标志着未来(1毫米的总距离)。重复3次,取平均时间(以秒计),除以30(相当于1毫米的直线距离量在纳升(NL))的值,以确定提供的解决方案1 NL所需的毫秒数。范围期间旋钮调整到这个号码,移动的“门控/定时”开关“定时”。现在,picopump是提供一个解决方案1nl脉冲。
- 卸下的矿物油碟和位置的培养皿,在显微镜下的幼虫。集团在培养皿的中心和重点的鱼。
- 广场对面的微量移液器手动microsyringe泵控股(MMP,世界精密仪器),推进其尖端的培养皿中,并进入显微镜的重点平面。一个很浅的角度弯曲,使拿着吸管很尖接触到培养皿的底部,是接近水平。确保不系统中的任何气泡,这将缓慢的响应时间和降低MMP的精度。
- 切换到一个更高的放大倍率的显微镜和使用手柄(特德佩拉113)超细睫毛位置非常接近拿着吸管与蛋黄仔鱼背侧。握住控股吸管吸吮逆时针旋转测微驱动器,控制手动microsyringe泵蛋黄仔鱼。小心不要打开微米太远,蛋黄可以爆拉进拿着吸管太深。重点上形成共同的大是大非的静脉,这是在蛋黄中,下方的周皮和是非常高血流量的站点。随着显微注射器具,引导到发展中国家的共同的大是大非静脉针。它通常是必要的拉针,回位后插入一个的,为共同的大是大非静脉是很肤浅的。按脚踏注入的解决方案1nl,然后释放幼虫从控股吸管,并返回到胚胎水。这是关键的一步,尤其是第一次,因为它需要一定量的实践定位的鱼和钻机的吸力和压力的控制。如果胚胎的蛋黄是正确拿着吸管举行,它不会辊针进入。
- 为了验证显微注射的成功,显示器在路西法黄色右旋糖酐的荧光显微镜下的斑马鱼的心脏。路西法黄色在约20分钟后进入循环系统消散的心脏仍然可见,如果注入的肾毒性的解决方案是正确的注射2小时内,你会看到很少路西法黄色右旋糖酐注射部位的剩余。如果解决方案是在卵黄囊,当场路西法黄色右旋糖酐注射仍将在注射部位。 (图1)。鱼返回到E3介质。
- 注射后两天,幼虫发育为肾功能下降的后果(图2)心包水肿。
第2部分:固定和免疫与Na + / K + ATP酶抗体(α- 6F)
- 4 DPF,10至154毫升玻璃小瓶中的幼虫斑马鱼(Weathon 225012),并解决他们在1毫升登特在室温下4小时(80%甲醇,20%DMSO)。
- 补充水分分级甲醇/ PBT(0.5%Tween20的PBS)系列,75:25 50:50,25:75,100%的PBT的胚胎,吹打的解决方案,并加入新的解决方案,以相同的小瓶(1毫升解决方案,每瓶),20分钟,在每一个解决方案。幼虫不应该暴露在空气中,留下一点点的解决方案,覆盖变化的解决方案时的幼虫。
- 删除PBT和3小时更换1毫升封闭液(PBS,用1%二甲基亚砜,0.5%Tween20,10%正常山羊血清),在4 ° C一个nutator。
- 转让在2毫升离心的幼虫。删除阻断血清取代300μL第一抗体孵育液(PBS与1%DMSO,0.5%Tween20,2%正常山羊血清)在4 ° C过夜,一个nutator。我们使用1:25稀释的单克隆的Na + / K + ATP酶抗体(α- 6F,上清,发育研究杂交瘤细胞银行,爱荷华州)
- 删除的主要抗体,并与在室温下孵育液洗3 × 30分钟。
- 第二抗体(羊抗鼠CY3,杰克逊Immunoresearch Laboratories公司155-165-003)孵育,在孵育液稀释为2小时1:500RT。
- 与PBT 3 × 30分钟洗净。
第3部分:JB - 4塑料包埋
- 脱水通过梯度乙醇系列(50%,75%,95%,100%× 2)的组织,每步10分钟。
- 准备渗透解决方案:JB - 4嵌入解决方案的25毫升(Polysciences 0226A)和催化剂0.24克(Polysciences 02618)。催化剂溶于约20-30分钟,它需要一段时间。该解决方案可以被保存在4 ° C可高达至1个月。
- 倒出了100%的乙醇,并用塑料渗透液更换。将瓶肩4 ° C和允许渗透进行,直到幼虫沉入底部的玻璃小瓶。此过程通常需要大约30分钟。
- 嵌入协议:在解剖显微镜下的塑料成型杯托盘(Polysciences,公司16643A)。幼虫转移,以及渗透解决方案,以支付,到杯子。塑料嵌入媒体准备在一个小塑料管。我们通常嵌入在一次4-5鱼,每杯的鱼类之一。准备5-6毫升塑料嵌入嵌入解决方案,为每杯(120毫升),每毫升的渗透液加入35μl的JB - 4嵌入解决方案的“B”(Polysciences公司0226B)。为每毫升的渗透液中添加35μLJB - 4嵌入解决方案的“B”(Polysciences公司0226B)。拌匀,用塑料巴斯德吸管多次吹打向上和向下。这是很重要的,因为如果不充分混合JB - 4不会聚合正确。嵌入塑料5毫升已经准备后,各地巴斯德吸管样品中删除渗透塑料。填写嵌入塑料杯。必须软泥塑料杯,以确保良好的附着块持有人的标本。为了检测斑马鱼的肾小管,横截面是最好的。为此,嵌入式垂直鱼,低着头。处理或罚款钳睫毛的援助,定期垂直位置的鱼,直到塑料是努力不够,他们不从自己的立场。大约需要20-30分钟。然后,放置在杯EBH - 2座的持有人(Polysciences公司15899)和离开托盘在4 ° C过夜。当在完全聚合,可以弹出像冰块块。
- 替代嵌入多个幼虫协议:中途JB - 4完整填写的模具,并允许它聚合。为15平方毫米的模具,我们在使用700μlJB - 4卷,填补了模具的一半。接下来,添加固化剂JB - 4浸泡幼虫预聚合半满的模具。东方头指向模具的长边和对齐幼虫的幼虫,使眼球排队(你可以在一个单一模具在一条线上10鱼)。块聚合后,您可以减少块的边缘,打开它,让面朝刀和一个塑料的“夹头”,适合在切片强力胶。使用这种方法,你可以定位在相同的块,在塑料为中心,截面准备大量幼虫。护理已采取定向刀块,所以,相当于每条鱼单节。这可以通过眼睛来完成,而切片:即东方块,使每条鱼的眼睛相当于部分。最终的结果是,你就可以分析在一台显微镜玻片上的许多鱼随之而来。
第4部分:切片
- 设置成标本的切片机夹头的持有人(我们用一个Shandon Finesse的热电子公司切片)
- 设置幻灯片回暖至45 ° C。
- DI水倒入一个烧杯中,并把它关闭的切片
- 在切割之前,确保导向块,如鱼以获得完美的横截面。方向头调整杠杆,可以使旋转位置标本头准确地刀。开始切割厚的部分通过鱼嘴。东方块切片,通过眼睛,使眼睛相当于部分是为每条鱼。当胸鳍出现的部分,就是当pronephric管开始。从这一点来说,削减约32 4块UM部分。
- 用镊子收集的部分,并让他们不接触水钳,与水的烧杯中放入。节将扩大尽快到达水面,现在你可以在幻灯片上收集。在45度角插入水中幻灯片和方法帮助睫毛与处理的部分,感人的部分边界。
- 孵育的幻灯片,幻灯片上,直至完全干燥温暖。
- 使用啶或共聚焦显微镜的图像部分。
第5部分:代表ULTS
当正确执行,注入鱼出现类似图1,与小荧光葡聚糖(在这种情况下路西法黄河)在心脏和循环系统可见。如果注射过深,注入的材料可以看出集中在卵黄囊,或心脏被刺破导致失血过多。如果拿着吸管是正确的,鱼不会滚动或移动注射时,这将允许更精确的注射。此外,它的重要,以确保不会有任何气泡,在MMP将缓慢的响应时间和降低系统的精度。一般来说,由于庆大霉素的肾毒性的结果,80%的注射鱼发展心包水肿(图2)。我们使用一种表型为基础的分类系统,中度水肿鱼表现出明显的心包的水肿,但没有其他人观察到的表型,而严重水肿鱼显示有轻微的心包和躯干的水肿,中度轴曲率。使用肾小管抗体对娜一个+ / K + ATP酶(α- 6F),我们可以想像损坏管,横截面具有明显的损失相比,对照组(图3)损坏肾小管细胞极性和肾小管破坏。这种模式是通过多个横截面一致的。为了获得完美肾小管的横截面是很重要的正确位置在嵌入的鱼。比较路段时,胸鳍和近曲小管被用作解剖标记。
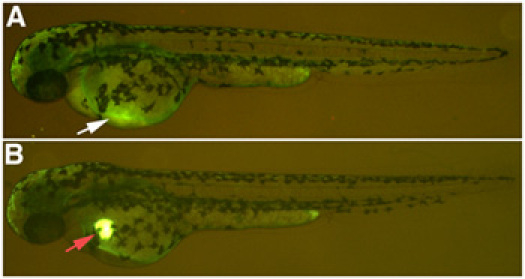
图1。Nephrotoxin显微注射。 (一)成功的一个10kDa右旋糖酐注射结合路西法黄色,淡淡的表达,在共同的大是大非静脉,白色箭头。 (二)不正确的注射,在10kDa右旋糖酐的存款共轭路西法的黄色,不会消散进入循环系统,红色箭头。

图2。庆大霉素介导的水肿。 (一)控制注入了幼虫的斑马鱼。 (二)中度或(C)重度水肿,庆大霉素注射幼虫的斑马鱼。所有的幼虫都在4 DPF前左和背。黑色箭头指向B和C心包水肿
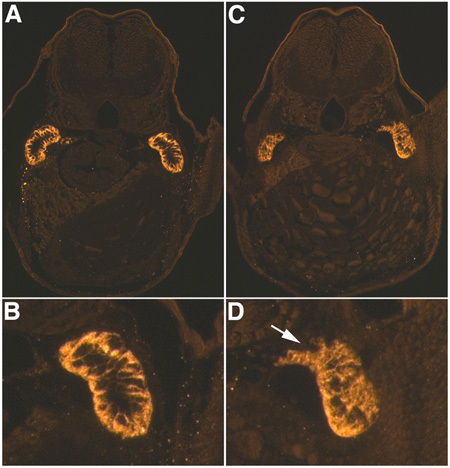
图3。AKI的免疫组化。 α- 6F的Na + / K + ATP酶的48小时后庆大霉素注射液(4 DPF幼虫)控制在(A,B)和庆大霉素注射(C,D)的幼虫的抗体染色。 A,C,20X放大倍率,B和D是正确的肾小管基底极性和肾小管破坏,白色箭头,在D,A和C注意的损失3倍数码放大倍率相比到B。
讨论
在这个视频文章中,我们展示了AKI的模型静脉显微注射技术,通过创建庆大霉素介导斑马鱼幼虫近端肾小管损伤。这种损害结果心包和/或严重水肿的形成,反映了无法调节水的平衡。我们还描述了一个标志着分化肾小管(马宗达等,2000)的一种抗体,免疫组织化学实验,显示损坏肾脏的肾小管上皮细胞极性和中断的损失。静脉microinjections代表到斑马鱼幼虫的血液提供一种可溶性物质的有效方法。这项技术是引进的多种物质的一个极好的工具,并用一种荧光标记统一注射的帮助,可反复多次超过允许一致的结果。
披露声明
致谢
这项工作是由美国国立卫生研究院(NIH)的赠款R01DK069403和P30DK079307研究院的资助。
材料
| Name | Company | Catalog Number | Comments |
| α6F mouse monoclonal | Developmental Studies Hybridoma Bank | ||
| Block Holder EBH-2 | Polysciences, Inc. | 15899 | |
| Borosilicate Glass Capillaries | World Precision Instruments, Inc. | TW100-6 | |
| Capillary tubes R-6 Custom Glass Tubing | Drummond Scientific | 9-000-3000 | |
| Catalyst Powder | Polysciences, Inc. | 02618 | |
| Cy3 | Jackson ImmunoResearch | 155-165-003 | |
| Dextran 10k Lucifer yellow, lysine fixable | Molecular Probes, Life Technologies | D1825 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Eyelash | Ted Pella, Inc. | 113 | |
| Gentamicin sulfate | Sigma-Aldrich | G8648 | |
| Glass vials 4ml | Weathon | 225012 | |
| Iron plate | Narishige International | IP | |
| JB-4 Embedding Solution A | Polysciences, Inc. | 0226A | |
| JB-4 Embedding Solution B | Polysciences, Inc. | 0226B | |
| Joystick micromanipulator | Narishige International | MN 151 | |
| Magnetic stand | Narishige International | MN-151 | |
| Manual microsyringe pump | World Precision Instruments, Inc. | ||
| Microinjection apparatus | World Precision Instruments, Inc. | PV820 | |
| Micromanipulator | World Precision Instruments, Inc. | M3301R | |
| Microtome | Thermo Fisher Scientific, Inc. | Shandon Finesse | |
| Mineral oil, light | Fisher Scientific | 0121-1 | |
| Pipette puller | Kopf Instruments | 720 | |
| Plastic molding cup tray | Polysciences, Inc. | 16643A | |
| Razor blade | VWR international | 55411-050 | |
| Slide warmer | Labline Instruments | ||
| Stage micrometer | WARD’s Natural Science | 94 W 9910 | |
| Tilting base | World Precision Instruments, Inc. | TB 1 | |
| Tricaine powder | Sigma-Aldrich | A-5040 | |
| Tween 20 | Sigma-Aldrich | P7949 | |
| Microscope | Leica Microsystems | S6F | Dissecting microscope |
| Microscope | Leica Microsystems | M205FA | Fluorescent microscope |
参考文献
- Hentschel, D. M., Park, K. M. Acute renal failure in zebrafish: a novel system to study a complex disease. Am J Physiol Renal Physiol. 288 (5), F923-F929 (2005).
- Majumdar, A., Lun, K. Zebrafish no isthmus reveals a role for pax2.1 in tubule differentiation and patterning events in the pronephric primordia. Development. 127 (10), 2089-2098 (2000).
- Weinstein, B. M., Stemple, D. L. Gridlock, a localized heritable vascular patterning defect in the zebrafish. Nat Med. 1 (11), 1143-1147 (1995).
- Westerfield, M. . The Zebrafish Book. , (1993).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。