Method Article
Microiniezioni endovenosa di larve Zebrafish allo Studio danno renale acuto
In questo articolo
Riepilogo
Descriviamo una tecnica di microinjecting l'aminoglicoside, gentamicina, in 2 giorni dopo fetilization (DPF) larve di zebrafish per indurre danno renale acuto (AKI). Abbiamo anche descritto un metodo per intero immunoistochimica montaggio, plastica embedding e sezionamento delle larve di zebrafish per visualizzare il danno mediato AKI.
Abstract
In questo articolo abbiamo video di descrivere un modello di zebrafish di AKI con gentamicina come nephrotoxicant. La tecnica consiste in microiniezioni per via endovenosa, il 2 zebrafish dpf. Questa tecnica rappresenta un metodo efficace e rapido per fornire sostanze solubili nel sangue delle larve di zebrafish, permettendo l'iniezione di pesce 15-20 all'ora. Oltre agli studi di AKI, questa tecnica microiniezione può essere utilizzato anche per altri tipi di studi sperimentali come l'angiografia. Forniamo un protocollo dettagliato della tecnica di attrezzature necessarie per le misure visiva della funzione renale ridotta. In aggiunta, abbiamo anche dimostrare il processo di fissazione, immunoistochimica montare tutto con un pennarello tubulo renale, di inclusione e sezionamento del pesce zebra larvale. Abbiamo dimostrato che le larve di zebrafish iniettati con gentamicina mostrare caratteristiche morfologiche coerenti con AKI: edema, perdita di polarità delle cellule in cellule tubulari prossimali epiteliali, e la rottura morfologica del tubulo.
Protocollo
Parte del protocollo che segue si basa su metodi pubblicati riportato da (Hentschel et al. 2005) e (Weinstein et al. 1995) con lievi modifiche.
Parte 1: Microiniezioni
Impostare in anticipo per la microiniezione
- I pesci vengono iniettati a 2 giorni dopo la fecondazione (DPF). Pertanto, zebrafish adulti sono allevati 3 notti prima di un esperimento programmato. Raccogliere embrioni e porle in una piastra di Petri con acqua E3 (5mm NaCl, KCl 0,17 mm, 0,33 mm di CaCl 2, 0,33 mm MgSO 4) a 28.5 ° C. Al termine della prima giornata rimuovere gli embrioni morti dalla piastra di Petri e gli embrioni separati in modo che non ci sono 80-100 embrioni per piastra di Petri.
- Preparare gli aghi di vetro tirando da tubi capillari (4 cm di lunghezza, 0,63 / 0,20 OD / ID millimetri (mm) R-6 tubi di vetro personalizzati Drummond società scientifiche, Broomall, PA 9-000-3000) con un estrattore elettrodo. Il diametro punta dovrebbe essere di 10-20 micron. Sotto un microscopio da dissezione (Leica S6E), con un pennarello indelebile consumare circa 10 linee 1 millimetro lungo l'ago, con l'aiuto di un righello, e conservare gli aghi in un grande piatto di Petri su rampe d'argilla.
- Preparare la pipetta azienda: Fire-lucidare la punta di un sottile tubo di vetro borosilicato parete capillare (152 mm, 1 / 0,75 OD / mm ID TW100-6, strumenti di precisione del Mondo, Inc.) in una fiamma becco Bunsen fino al diametro interno di la punta è 0,4-0,5 mm. Tale dimensione consente una buona presa del sacco vitellino di una larva 2 dpf zebrafish. Tenere una estremità di un pezzo di vetro capillare con pinze lunghe, e il calore con la punta opposta del capillare con il becco Bunsen, posizionandolo in verticale sopra il cono di luce azzurra interna della fiamma, la parte più calda, per 1-2 secondi, rotolare per ottenere un ancora sciogliersi. Ripetere questa operazione un paio di volte quindi esaminare il capillare al microscopio, su un micrometro (Ward 94 W 9910). Questo è un passo critico, potrebbe essere necessario fuoco lucidare un pipette tenendo pochi e selezionare il formato più tardi, mentre si stanno manipolando le larve. Se si sta attenti, un'azienda pipetta dura microiniezione sessioni multiple.
- Riempire la pompa manuale Microsiringa (MMP, World Precision Instruments, Inc.,) con olio minerale, seguendo le istruzioni fornite dal produttore. Il titolare pipetta è inserito in un manipolatore joystick (Narishige, MN-151), collegato con un supporto magnetico (Narishige, MN 151) a una piastra di ferro (Narishige, IP).
Microiniezione
- Preparare 20μl della miscela di iniezione:. 2.4μl gentamicina (Sigma-Aldrich G8648, 50mg/ml in soluzione salina) e 17.6μl 10-kDa lucifer giallo destrano (Invitrogen D1825, (1mg/ml in soluzione salina) Nel pesce controllare l' gentamicina viene sostituito con una soluzione salina. Il destrano fluorescente (molti colori diversi possono essere usati) è sufficiente a verificare l'esattezza di iniezione e selezionare le larve che sono stati iniettati con la nephrotoxicant.
- Predisporre 2 30 millimetri Petri con 2 ml di olio minerale per l'immissione della miscela di iniezione e la miscela sotto controllo, per prevenire l'evaporazione delle soluzioni.
- Preparare l'anestetico: 400 mg tricaine polvere (etil-m-amminobenzoato metanosolfonato SIGMA A-5040) 97,7 ml di acqua DD, 2,1 ml 1M Tris (pH 9). Regolare a pH 7. Conservare questa soluzione, nel congelatore, in aliquote di 4,2 ml. Per utilizzare tricaine come anestetico diluire 4,2 ml di soluzione madre tricaine in 100 ml di acqua E3 (Westerfield 1993) e lasciare a temperatura ambiente.
I seguenti passaggi sono svolti nell'ambito di un microscopio da dissezione
- Rimuovere manualmente ogni chorions restante con una pinza sottile e anestetizzare il pesce zebra trasferendoli in piastre di Petri con tricaine riscaldato a temperatura ambiente. Zebrafish dovrebbero essere esposti a tricaine almeno 15 minuti prima di iniziare le microiniezioni.
- Aprire la punta di un ago da iniezione con una lama di rasoio (VWR scientifico 55411-050). Tenere la lama con una leggera angolazione per creare una smussatura e taglio la punta tale da ottenere una apertura punta del diametro di circa 10-20μm.
- Accendere, vuoto e aria dell'apparato microiniezione (World di strumenti di precisione Inc., PV820 pneumatici picopump). Inserire l'ago nel porta-aghi montati sulla base micromanipolatore e inclinazione (Strumenti di precisione Parola, Inc., modello M3301R, TB-1).
- Per riempire l'ago, inserire una goccia (10μl) della soluzione da iniettare nel piatto 30 millimetri Petri riempite con olio minerale (Chimica Fisher, 0121-1). Girare il micromanipolatore manuale in modo da far immergere la punta dell'ago nella goccia di soluzione, impostare il picopump "hold / vent" interruttore "vent" ("sfogo" corrisponde a vuoto sul PV820), e riempire l'ago tirando soluzione dalla punta dell'ago. Ci vorrà qualche minuto, se la soluzione entra l'ago troppo veloce,questo significa che il diametro della punta è troppo grande, e le iniezioni non sarà accurato. Dopo che l'ago è riempito, impostare il picopump a "hold" ("hold" corrisponde a iniettare sul PV820).
- Per calibrare l'ago, impostare il picopump "gated / temporizzata" interruttore "gated", premere il pedale per scaricare l'ago, e registrare il tempo necessario (secondi) per il menisco di viaggiare da una marcatura a quello successivo (1 mm Distanza totale). Ripetere 3 volte, prendere il tempo medio (in secondi), e dividere il valore per 30 (volume in nanolitri (nl) corrispondente a 1 mm di distanza lineare) per determinare il numero di millisecondi necessari per fornire 1 nl di soluzione. Regolare la manopola del periodo di gamma a questo numero, e spostare l'interruttore "gated / tempo" a 'tempo'. Ora il picopump è impostato per fornire un impulso 1nl di soluzione.
- Rimuovere il piatto olio minerale e posizionare la piastra di Petri con le larve al microscopio. Gruppo il pesce al centro della scatola di Petri e messa a fuoco.
- Posizionare la pipetta partecipazione nella microsiringa pompa manuale (MMP, strumenti di precisione World) sul lato opposto della microinjector, anticipo la sua punta alla piastra di Petri, e nel piano di messa a fuoco del microscopio. Piega con un angolo poco profondo, in modo che la punta della pipetta holding è toccare il fondo della scatola di Petri ed è vicino a orizzontale. Assicurarsi di non avere bolle d'aria nel sistema, che potrebbe rallentare i tempi di risposta e diminuire la precisione della MMP.
- Cambia per un ingrandimento maggiore sul microscopio e utilizzare un ciglia superfine con maniglia (Ted Pella 113) per posizionare il pesce larvale lato dorsale verso il basso con il tuorlo molto vicino alla pipetta holding. Tenere il pesce larvale succhiando il tuorlo nella pipetta tenendo ruotando in senso antiorario l'unità micrometro controllo della pompa manuale microsiringa. Fare attenzione a non trasformare il micrometro troppo lontano, come il tuorlo può scoppiare se tirato troppo in profondità nella pipetta holding. Focus sulla formazione comune vena cardinale, che si trova sopra il tuorlo, appena sotto il periderm ed è il sito del flusso di sangue molto alto. Con il micromanipolatore dell'apparato iniezione, guidare l'ago nella vena sviluppo comune cardinali. È in genere necessario per tirare l'ago un po 'indietro dopo l'inserimento, in quanto la vena comune cardinale è molto superficiale. Iniettare 1nl della soluzione premendo il pedale, quindi rilasciare le larve dalla pipetta holding e restituirla all'acqua embrione. Questo è un passo critico, soprattutto la prima volta, perché richiede una certa pratica nel posizionamento del pesce e il controllo della pressione di aspirazione e l'impianto di perforazione. Se il tuorlo di un embrione sia correttamente tenuto con la pipetta holding, non rotolerà come l'ago entra.
- Per verificare il successo della microiniezione, monitorare la presenza del giallo Lucifero destrano nel cuore del pesce zebra sotto un microscopio a fluorescenza. Il giallo Lucifero rimane visibile nel cuore per circa 20 minuti prima di dissiparsi nel sistema circolatorio Se la soluzione viene iniettata nefrotossici correttamente, entro 2 ore dall'iniezione si vedrà ben poco lucifer giallo destrano rimanendo nel sito di iniezione. Se la soluzione viene iniettata nel sacco vitellino, un po 'di Lucifero giallo destrano rimarrà al sito di iniezione. (Fig. 1). Ritorna il pesce e medie E3.
- Due giorni dopo l'iniezione, le larve si sviluppano edema pericardico come conseguenza della ridotta funzionalità renale (Fig. 2).
Parte 2: Fissazione e immunofluorescenza con Na + / K + ATPasi anticorpi (α-6F)
- A 4 dpf, mettere tra i 10 ei 15 zebrafish larvale in flaconcini di vetro 4ml (Weathon, 225.012) e fissarli negli anni Dent 1 ml (80% MeOH 20% DMSO) per 4 ore a temperatura ambiente.
- Reidratare gli embrioni in un graduale MeOH / PBT (PBS con 0,5% Tween20) serie, 75:25 50:50, 25:75, 100% PBT, pipettaggio la soluzione fuori e l'aggiunta di nuova soluzione al flacone stesso (1 ml di soluzione per fiala), 20 minuti in ogni soluzione. Le larve non dovrebbe mai essere esposto all'aria, lasciare una piccola soluzione che copre le larve quando si cambia soluzioni.
- Rimuovere e sostituire PBT 1 ml con la soluzione bloccante (PBS con l'1% di DMSO, 0,5% Tween20, 10% siero di capra normale) per 3 ore a 4 ° C su un nutator.
- Trasferire le larve in una microcentrifuga 2 ml. Rimuovere il blocco siero e sostituirlo con 300μl anticorpo primario nella soluzione di incubazione (PBS con l'1% di DMSO, 0,5% Tween20, 2% siero di capra normale) notte a 4 ° C su un nutator. Noi utilizziamo un anticorpo monoclonale Na + / K + ATPasi anticorpi (α-6F, surnatante, studi sullo sviluppo Ibridoma Banca, Iowa) alla diluizione 1:25
- Rimuovere l'anticorpo primario e lavare 3 x 30 minuti con una soluzione di incubazione a temperatura ambiente.
- Incubare con anticorpo secondario (capra anti-topo Cy3, Jackson ImmunoResearch Laboratories, Inc. 155-165-003) diluito 1:500 in soluzione di incubazione per 2 ore aRT.
- Lavare 3 x 30 minuti con PBT.
Parte 3: embedding in plastica con JB-4
- Disidratazione dei tessuti attraverso una serie graduata di etanolo (50%, 75%, 95%, 100% x 2), 10 minuti per passo.
- Preparare la soluzione di infiltrazione: 25 ml di JB-4 Soluzione Embedding A (Polysciences 0226A) e 0.24g di catalizzatore (Polysciences 02.618). Ci vuole un po 'per il catalizzatore per sciogliere, circa 20-30 minuti. La soluzione può essere conservato a 4 ° C fino a 1 mese.
- Decantare l'etanolo al 100% e sostituirlo con una soluzione di infiltrazione di plastica. Mettere le provette a 4 ° C su una rotatori e permettere infiltrazioni di procedere fino a quando il lavandino larve sul fondo della fiala di vetro. Questo processo richiede di solito circa 30 minuti.
- Incorporare protocollo: Posizionare il vassoio di plastica tazza stampaggio (Polysciences, Inc. 16643A) sotto un microscopio da dissezione. Trasferire le larve, insieme con una soluzione di infiltrazione di coprire, nelle coppe. I mezzi di inclusione viene preparato in un tubo di plastica di piccole dimensioni. Normalmente incorporare 4-5 pesce alla volta, un pesce per ogni tazza. Preparare 5-6 ml di plastica embedding (1,2 ml di soluzione di embedding per ogni tazza), aggiungendo 35 l di JB-4 Embedding Soluzione "B" (Polysciences Inc. 0226B) per ogni ml di soluzione di infiltrazione. Aggiungere 35 ml di JB-4 Soluzione Embedding "B" (Polysciences Inc. 0226B) per ogni ml di soluzione di infiltrazione. Mescolare bene, pipettando su e giù con una plastica volte pipetta Pasteur diverse. Questo è importante perché se non mescolato bene i JB-4 non si polimerizza in modo corretto. Dopo 5 ml di plastica incasso è stato preparato, rimuovere plastica infiltrazioni provenienti da tutto campioni con una pipetta Pasteur. Riempire la tazza con l'incorporamento di plastica. La plastica deve fuoriuscita della coppa, per garantire una buona attaccamento del titolare blocco al modello. Per rilevare zebrafish tubuli renali, le sezioni trasversali sono i migliori. A tal fine, i pesci sono integrati verticalmente, a testa in giù. Con l'aiuto di un ciglio con maniglia o una pinza sottile, periodicamente la posizione del pesce in verticale, fino a quando la plastica è abbastanza duro che non si muovono dalla loro posizione. Ci vogliono circa 20-30 minuti. Poi, luogo del titolare EBH-2 Block (Polysciences Inc. 15.899) oltre le coppe e lasciare il vassoio a 4 ° C durante la notte. Quando polimerizzazione in completo, si può saltar fuori i blocchi come cubetti di ghiaccio.
- Embedding protocollo alternativo per le larve più: Riempire gli stampi a metà con completa JB-4 e permettono di polimerizzare. Per i 15 stampi mm quadrati usiamo il JB-4 volume a 700μl di riempire lo stampo a metà strada. Quindi, aggiungere le larve JB-4 imbevuto di indurente per la pre-polimerizzato riempito a metà stampi. Orientare le larve con la testa rivolta verso il lato lungo dello stampo e allineare le larve in modo che il line up occhi (si può mettere 10 pesci in un unico stampo in una linea). Dopo il blocco è polimerizzato è possibile tagliare i bordi del blocco, girarlo in modo che il lato sia rivolto il coltello e colla per una plastica "Chuck" che si inserisce nel microtomo. Con questo metodo è possibile posizionare un gran numero di larve nello stesso blocco, centrato nella plastica, e pronto per sezioni. Cura deve essere presa orientare il blocco al coltello in modo che le sezioni equivalente di ogni pesce vengono prese in un'unica sezione. Questo può essere realizzato mentre sezionare attraverso gli occhi: cioè orientare il blocco in modo che le sezioni equivalente degli occhi sono presi per ogni pesce. Il risultato finale è che si può analizzare molti pesci in concomitanza su un vetrino da microscopio singolo.
Parte 4: sezionamento
- Impostare il campione nel porta mandrino del microtomo (usiamo un Finesse Shandon Thermo Electro Corporation microtomo)
- Impostare la diapositiva più calda a 45 ° C.
- Versare acqua deionizzata in un bicchiere e posizionarlo vicino al microtomo
- Prima di sezionamento, assicurarsi che il blocco è orientato in modo da ottenere perfetta sezioni trasversali del pesce. Le leve di regolazione testa di orientamento può essere ruotata consentendo quindi di posizionare la testa del campione con precisione al coltello. Iniziare a tagliare sezioni spesse attraverso la testa del pesce. Mentre sezionamento attraverso gli occhi, orientare il blocco in modo che le sezioni equivalente degli occhi sono presi per ogni pesce. Quando le pinne pettorali elencati nelle sezioni, cioè quando i tubuli pronephric inizio. Da questo punto, tagliate circa 32 4 sezioni um dal blocco.
- Raccogliere le sezioni con una pinza e lasciate cadere nel bicchiere con l'acqua, senza toccare l'acqua con le pinze. La sezione si espanderà non appena colpisce la superficie dell'acqua, ora lo si può raccogliere in una diapositiva. Inserire il vetrino in acqua ad un angolo di 45 ° e l'approccio alla sezione con l'aiuto di un ciglio con manico, toccando solo i confini della sezione.
- Incubare i vetrini su un vetrino più caldo fino a completa asciugatura.
- Sezioni di immagine usando la microscopia confocale o epifluorescente.
Parte 5: Res RappresentanteULT
Quando eseguito correttamente, il pesce iniettato apparire come in figura 1, con poco destrano fluorescente (in questo caso Lucifero giallo) visibile nel cuore e nel sistema circolatorio. Se l'iniezione è troppo profonda, materiale iniettato può essere visto concentrata nel sacco vitellino, o il cuore può essere forata causando un eccessivo sanguinamento. Se la pipetta azienda è fatta correttamente, il pesce non rotolerà o spostare quando iniettato, e questo permetterà una iniezione più accurata. Inoltre, è importante assicurarsi di non avere bolle d'aria nel MMP, che rallenterebbe i tempi di risposta e diminuire la precisione del sistema. In generale, come conseguenza della nefrotossicità gentamicina, l'80% del pesce iniettato sviluppare edema pericardico (Fig. 2). Usiamo un sistema di classificazione basato fenotipo, in cui i pesci con edema moderato mostrano evidente edema pericardico, ma non gli altri fenotipi osservabile, mentre severamente pesce edematosa mostrano edema pericardico e tronco, con lieve a moderata curvatura asse. Utilizzando un anticorpo contro il tubulo renale Na + / K + ATPasi (α-6F) possiamo visualizzare i tubuli danneggiati nelle sezioni trasversali, con una evidente perdita di polarità delle cellule e interruzione tubolare in tubuli danneggiati rispetto ai controlli (Fig. 3). Questo fenomeno è presente attraverso molteplici sezioni trasversali. Al fine di ottenere un perfetto sezioni trasversali dei tubuli renali è importante posizionare correttamente il pesce durante la incorporamento. Quando si confrontano sezioni, pinne pettorali e tubuli contorti prossimali sono utilizzati come marcatori anatomici.
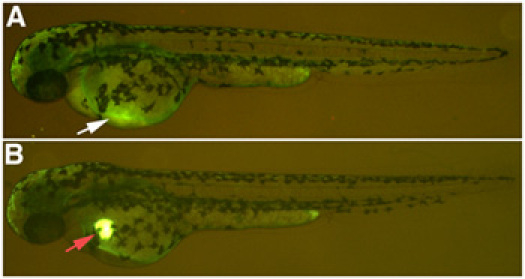
Figura 1. Microiniezione nefrotossina. (A) iniezione di successo di un 10kDa destrano coniugato con lucifer giallo, con espressione debole nella vena comune cardinale, freccia bianca. (B) di iniezione errato, con conseguente deposito di 10kDa destrano coniugato al giallo Lucifero che non dissipa nel sistema circolatorio, freccia rossa.

Figura 2. Gentamicina-mediata edema. (A) Controllo iniettato zebrafish larvale. Gentamicina iniettato zebrafish larvale con (B), moderata o (C), edema grave. Tutte le larve sono in 4 con dpf anteriore a sinistra e dorsale è alto. Frecce nere indicano edema pericardico in B e C.
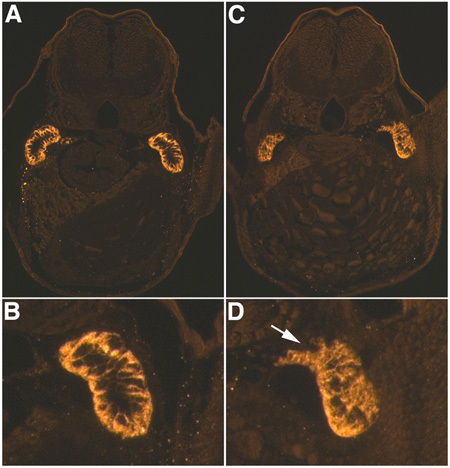
Figura 3. AKI immunoistochimica. α-6F colorazione anticorpi per Na + / K + ATPasi 48 ore post iniezione di gentamicina (4 larve DPF) nel controllo (A, B) e iniettato gentamicina (C, D) larve. A, C sono a 20X di ingrandimento e di B e D sono 3X ingrandimenti digitali dei tubuli destra in perdita Nota A e C. di polarità basolaterale e interruzione tubulo, freccia bianca, in D rispetto a B.
Discussione
In questo articolo abbiamo mostrato un video di tecnica di microiniezione per via endovenosa per un modello di danno renale acuto, con la creazione di gentamicina mediato danno del tubulo prossimale nelle larve zebrafish. Questo danno provoca la formazione di pericardico e / o edema lordo, che riflette l'incapacità di regolare l'equilibrio idrico. Abbiamo anche descritto un esperimento immunoistochimica con un anticorpo che segna tubuli renali differenziata (Majumdar et al. 2000), mostrando la perdita di polarità cellulare e una perturbazione del tubulo prossimale nei reni danneggiati. Microiniezioni per via endovenosa rappresentano un metodo efficiente per la consegna di una sostanza solubile nel sangue delle larve di zebrafish. Questa tecnica è un ottimo strumento per l'introduzione di una varietà di sostanze e con l'aiuto di un iniezioni marcatore fluorescente uniforme può essere ripetuto più volte consentendo risultati coerenti.
Divulgazioni
Riconoscimenti
Questo lavoro è stato finanziato dal National Institutes of Health (NIH) concede R01DK069403 e P30DK079307.
Materiali
| Name | Company | Catalog Number | Comments |
| α6F mouse monoclonal | Developmental Studies Hybridoma Bank | ||
| Block Holder EBH-2 | Polysciences, Inc. | 15899 | |
| Borosilicate Glass Capillaries | World Precision Instruments, Inc. | TW100-6 | |
| Capillary tubes R-6 Custom Glass Tubing | Drummond Scientific | 9-000-3000 | |
| Catalyst Powder | Polysciences, Inc. | 02618 | |
| Cy3 | Jackson ImmunoResearch | 155-165-003 | |
| Dextran 10k Lucifer yellow, lysine fixable | Molecular Probes, Life Technologies | D1825 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Eyelash | Ted Pella, Inc. | 113 | |
| Gentamicin sulfate | Sigma-Aldrich | G8648 | |
| Glass vials 4ml | Weathon | 225012 | |
| Iron plate | Narishige International | IP | |
| JB-4 Embedding Solution A | Polysciences, Inc. | 0226A | |
| JB-4 Embedding Solution B | Polysciences, Inc. | 0226B | |
| Joystick micromanipulator | Narishige International | MN 151 | |
| Magnetic stand | Narishige International | MN-151 | |
| Manual microsyringe pump | World Precision Instruments, Inc. | ||
| Microinjection apparatus | World Precision Instruments, Inc. | PV820 | |
| Micromanipulator | World Precision Instruments, Inc. | M3301R | |
| Microtome | Thermo Fisher Scientific, Inc. | Shandon Finesse | |
| Mineral oil, light | Fisher Scientific | 0121-1 | |
| Pipette puller | Kopf Instruments | 720 | |
| Plastic molding cup tray | Polysciences, Inc. | 16643A | |
| Razor blade | VWR international | 55411-050 | |
| Slide warmer | Labline Instruments | ||
| Stage micrometer | WARD’s Natural Science | 94 W 9910 | |
| Tilting base | World Precision Instruments, Inc. | TB 1 | |
| Tricaine powder | Sigma-Aldrich | A-5040 | |
| Tween 20 | Sigma-Aldrich | P7949 | |
| Microscope | Leica Microsystems | S6F | Dissecting microscope |
| Microscope | Leica Microsystems | M205FA | Fluorescent microscope |
Riferimenti
- Hentschel, D. M., Park, K. M. Acute renal failure in zebrafish: a novel system to study a complex disease. Am J Physiol Renal Physiol. 288 (5), F923-F929 (2005).
- Majumdar, A., Lun, K. Zebrafish no isthmus reveals a role for pax2.1 in tubule differentiation and patterning events in the pronephric primordia. Development. 127 (10), 2089-2098 (2000).
- Weinstein, B. M., Stemple, D. L. Gridlock, a localized heritable vascular patterning defect in the zebrafish. Nat Med. 1 (11), 1143-1147 (1995).
- Westerfield, M. . The Zebrafish Book. , (1993).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon