Method Article
急性腎障害を研究するためにゼブラフィッシュ幼生の静脈内Microinjections
要約
我々は2日後fetilization(DPF)急性腎障害(AKI)を誘導するためにゼブラフィッシュの幼虫にアミノグリコシド、ゲンタマイシンを、マイクロインジェクションのテクニックを説明します。我々はまた、AKIの媒介の損傷を可視化するためにゼブラフィッシュ幼生の埋め込みプラスチックと切片全体のマウント免疫組織化学のための方法を、説明します。
要約
このビデオの記事では、nephrotoxicantとしてゲンタマイシンを使用してAKIのゼブラフィッシュモデルを説明します。テクニックは、2 DPFのゼブラフィッシュでの静脈内microinjectionsで構成されています。この手法は、時間あたり15〜20魚の注入を可能に、ゼブラフィッシュ幼生の血流中に可溶性物質を提供する効率的で迅速な方法を表します。 AKIの研究に加えて、このマイクロインジェクション技術はまた、血管造影などの実験研究の他のタイプに使用することができます。我々は減少し、腎機能の視覚的な措置に必要な機器からの技術の詳細なプロトコルを提供しています。さらに、我々はまた、腎臓の尿細管マーカーで幼生ゼブラフィッシュの埋め込みプラスチックと切片を固定、全体のマウント免疫組織化学のプロセスを示しています。浮腫、近位尿細管上皮細胞における細胞極性の喪失、および尿細管の形態学的混乱:私たちは、ゲンタマイシンを注射したゼブラフィッシュの幼虫は、一貫性のあるAKIとの形態的特徴を示して実証する。
プロトコル
次のプロトコルの一部は、(ヘンチェルら、2005)と(ワインスタインら、1995)若干の修正と報告して公開されたメソッドに基づいています。
パート1:Microinjections
マイクロインジェクションのための事前に設定する
- 魚は2日後に受精(DPF)で注入されています。したがって、成人のゼブラフィッシュは、計画された実験の前に3泊して飼育されています。胚を収集し、28.5でE3水(5mMの塩化ナトリウム、0.17mM KCL、0.33mMのCaCl 2、0.33mMのMgSO 4)でペトリ皿に配置℃にペトリ皿あたり80から100までの胚が存在するようにするために、最初に一日の終わりにはペトリ皿と別々の胚から死んだ胚を削除します。
- 電極プラーとキャピラリーチューブ(長さ4インチ、0.63 / 0.20 OD / IDミリメートル(mm)R - 6カスタムガラス管ドラモンド科学的な会社、Broomall、PA 9-000-3000)から引っ張ってガラスの針を準備します。先端径は10〜20ミクロンである必要があります。解剖顕微鏡(ライカS6E)の下に、油性マジックで定規の助けを借りて、針に沿って約10 1mmの線を描き、粘土のランプに大きなペトリ皿の中で針を格納する。
- の内径まで、ブンゼンバーナーの火炎で薄肉のホウケイ酸ガラス毛細管(152ミリメートル、1 / 0.75 OD / IDミリメートルTW100 - 6、世界の精密機器、(株))のファイアポリッシュヒント:ホールディングピペットを準備先端は0.4〜0.5ミリメートルです。そのような次元は2 DPFのゼブラフィッシュの幼虫の卵黄嚢の良いグリップが可能になります。 、ガラスの部分の長い鉗子を用いてキャピラリー、及びブンゼンバーナーとキャピラリーのと反対側の先端を加熱し、1〜2秒間炎のライトブルーの内部コーン、ホットな部分、垂直にそれを置くことの一端を保持するさらに溶融得るためにそれを圧延。この数回を繰り返してステージのマイクロメータ(ウォードの94 W 9910)で、顕微鏡下でキャピラリーを調べます。あなたが幼虫を操作しているときに、これは重要なステップであり、それは、いくつかの保持ピペットを解雇 - ポーランドと後で適切なサイズを選択する必要があるかもしれません。あなたが慎重な場合は、ワンホールディングピペットは、複数のマイクロインジェクションのセッションのために持続する。
- メーカーの指示に従って、ミネラルオイルで手動マイクロシリンジポンプを(MMP、世界プレシジョンインスツルメンツ社、)入力してください。ピペットホルダーは鉄板(成茂、IP)にマグネチックスタンド(成茂、MN 151)に接続ジョイスティックのマニピュレータ(成茂、MN - 151)、に挿入されます。
マイクロインジェクション
- 注射液の20μlの準備をします。2.4μlゲンタマイシン(Sigma - Aldrich社G8648、生理食塩水で50mg/ml)と17.6μl、10 kDaのルシファーイエローデキストラン(Invitrogen社D1825、(生理食塩水に1mg/ml)コントロール魚ではゲンタマイシンは、生理食塩水に置換されます。蛍光デキストランは、(多くの異なる色を使用することができます)注入の精度を検証し、nephrotoxicantに注入された幼虫を選択するだけで十分です。
- ソリューションの蒸発を防ぐために、下に注入混合と制御の混合物を配置するために2ミリリットルのミネラルオイル2 30ミリメートルのペトリ皿を準備します。
- 400 mgのtricaineパウダー(エチル- M -アミノベンゾエートメタンSIGMA - 5040)97.7ミリリットルDDの水、2.1ミリリットル1Mトリス(pH 9):麻酔薬を準備します。 pHを7に調整してください。 4.2ミリリットルのアリコートで、冷凍庫にこのストック溶液を保管してください。麻酔薬としてtricaineを使用するには100ミリリットルE3水(ウェ1993)の4.2ミリリットルtricaineのストック溶液を希釈し、室温でおきます。
次の手順は、解剖顕微鏡下で実施されています
- 手動で微鉗子で残っているchorionsを削除し、室温で暖めtricaineとペトリ皿の中でそれらを転送するゼブラフィッシュを麻酔。ゼブラフィッシュは、少なくとも15分microinjectionsを開始する前にtricaineに公開される必要があります。
- かみそりの刃(VWR科学55411から050)を使用して、注射針の先端を開きます。ベベルを作成し、約10 -20μmの直径の先端の開口部を得るために次のような先端をカットするためにわずかな角度で刃を保持する。
- 電源、真空およびマイクロインジェクション装置(世界精密計器(株)、PV820空気圧picopump)のエア供給をオンにします。マイクロマニピュレータと傾斜ベース(ワード精密機器、株式会社、モデルM3301R、TB - 1)に搭載されたニードルホルダーに針を挿入します。
- 針を埋めるために、鉱物油(フィッシャー化学、0121〜1)で満たされた30ミリメートルペトリ皿に注入される溶液の液滴(10μlを)置く。 、水没溶液の液滴の針の先端をするように手動マイクロマニピュレーターを回しpicopumpを設定します("口"PV820を真空に相当)"ベント"に切り替える、と引っ張って針を埋める"ベント/ホールド"針先を介しての解決策。解決策が速すぎる針に陥った場合、これは、、数分かかりますそれは先端の直径が大きすぎることを意味し、注射が正確でなくなります。針が埋められた後、("保留"PV820に注入するために相当)を"保持"にpicopumpを設定します。
- 針のキャリブレーションを行うには、"ゲート"、マーキングいずれかから次の(1に移動するメニスカスのにかかる時間(秒)、針を放電するためのフットペダルを押して、録音するpicopump"ゲート/時間指定"スイッチを設定します。 mm総距離)。 3回繰り返し、平均時間(秒単位)を取り、溶液1 NLを配信するために必要なミリ秒数を決定するために30(1ミリメートルの直線距離に相当するナノリットル(nl)での体積)によって値を割る。この数値の範囲の期間のノブを調整し、"時限"に"ゲート/時間指定"スイッチを動かします。今picopumpは、ソリューションの1nlパルスを供給するために設定されています。
- 鉱物油皿と位置顕微鏡下で幼虫とペトリ皿を取り外します。グループペトリ皿と焦点の中心にある魚。
- シャーレにその先端を進める、と顕微鏡の焦点面に、インジェクターの反対側の手動マイクロシリンジポンプでホールディングピペット(MMP、世界の精密機器)を配置します。ホールディングピペットの非常に先端がペトリ皿の底に触れると、水平に近いされるように、かなり浅い角度でそれを曲げてください。応答時間を遅くし、MMPの精度を減少させるシステム内の任意の気泡を、持っていないことを確認してください。
- 顕微鏡で高倍率に変更し、ホールディングピペットに非常に近い卵黄と仔魚の背側を下の位置へのハンドル(テッドペラ113)と極細まつげを使用してください。手動マイクロシリンジポンプを制御するマイクロドライブを反時計回りに回してホールディングピペットに卵黄を吸引することにより仔魚を保持する。ホールディングピペットにあまりにも深く引っ張ら場合卵黄が破裂することができますように、あまりにも遠くマイクロメーターをオンにしないように注意してください。卵黄上に、ちょうど周皮の下にあると非常に高い血流のサイトです。成形総主静脈、に焦点を当てる。射出装置のマイクロマニピュレータで、開発総主静脈に針を導く。総主静脈は非常に表面的なものとしては、通常、挿入後に戻って少し針をプルする必要があります。フットペダルを押すことにより、ソリューションの1nlを注入し、ホールディングピペットから幼虫を解放し、胚の水にそれを返します。それは魚を配置して吸引し、リグの圧力を制御するのに多少の練習量が必要なため、これは、特に重要なステップ、初めてのことです。胚の卵黄が適切にホールディングピペットで保持されている場合は針が入ると、それはロールバックしません。
- マイクロインジェクションの成功を確認するには、蛍光顕微鏡下でゼブラフィッシュの中心部にルシファーイエローデキストランの存在を監視します。ルシファーイエローは、腎毒性のソリューションが正しく注入されている場合は、注射後2時間以内にあなたが非常に少ないルシファーイエローデキストランは、注射部位に残って表示される循環系に放散する前に約20分間、心臓に表示されたままになります。解決策は卵黄嚢に注入されている場合は、ルシファーイエローデキストランのスポットは、注射部位のままになります。 (図1)。 E3培地に魚を戻す。
- 二日後に注射、幼虫は減少し、腎機能(図2)の結果として心膜浮腫を起こす。
パート2:ナトリウムと固定し、免疫蛍光+ / K + ATPアーゼ抗体(α- 6F)
- 4 DPFで、10と4ミリリットルのガラスバイアルで15幼生ゼブラフィッシュ(Weathon、225012)の間に入れて、1ミリリットルデントの(80%メタノール20%DMSO)室温で4時間でそれらを修正。
- ソリューションをピペッティングし、(同じバイアルに新しいソリューションを追加し、等級のMeOH / PBT(0.5%のTween20を含むPBS)のシリーズ、75:25 50:50、25:75、100%PBTで胚を再水和あたりの解決策の1ミリリットルバイアル)、それぞれの溶液中で20分。幼虫が空気にさらされることはありませんが、ソリューションを変更するときに幼虫をカバーする小さな解決策を残す。
- PBTを削除し、° C nutator上で4℃で3時間ブロッキング溶液(PBS 1%DMSOで、0.5%のTween20、10%正常ヤギ血清)と1ミリリットルに置き換えます。
- 2ミリリットルマイクロの幼虫を移す。血清ブロッキング削除し、nutatorに4℃で一晩(PBSで1%DMSO、0.5%のTween20、2%正常ヤギ血清)インキュベーション溶液に300μlの一次抗体と交換してください。我々は1時25分に希釈してモノクローナルのNa + / K + ATPアーゼ抗体(α- 6F、上清、発達研究ハイブリドーマバンク、アイオワ州)を使用
- 一次抗体を除去し、室温でインキュベーション溶液で3 × 30分間洗浄する。
- 2時間のインキュベーション溶液中で1:500に希釈した二次抗体(ヤギ抗マウスCy3を、ジャクソンイムノラボラトリーズ、(株)155-165-003)でインキュベートRT。
- PBT 3 × 30分間洗浄します。
パート3:JB - 4プラスチック製の埋め込み
- 、ステップごとに10分間段階的エタノールシリーズ(; 75%、95%100%× 2 50%)を通じて組織を脱水する。
- JB - 4埋め込み液25ml(Polysciences 0226A)と触媒の0.24グラム(Polysciences 02618):浸透溶液を調製。触媒は20〜30分程度、溶解するためにこれにはしばらく時間がかかります。この溶液を4℃で保存できます1ヶ月間までのC。
- 100%エタノールをオフにデカントし、プラスチック製の浸透液で置き換えてください。ローテーター上バイアル4 ° Cを配置し、幼虫はガラスバイアルの底に沈むまで、浸透が進行することができます。このプロセスは、通常約30分かかります。
- 解剖顕微鏡下でプラスチック成形のカップトレイ(Polysciences、株式会社16643A):プロトコルを埋め込む。カップに、カバーする浸透液と一緒に、幼虫を移す。プラスチック製の埋め込みメディアは、小型のプラスチック製のチューブで調製される。我々は通常、一度に各カップ用の魚を4月5日魚を埋め込みます。浸透液の各MLのためのJB - 4埋め込みソリューション"B"(Polysciences社0226B)35μLを加え、プラスチック(各コップのためのソリューションを埋め込む1.2 ml)を埋め込むの5-6 mlを調製。浸透液の各MLのためにJB - 4埋め込みソリューション"B"(Polysciences社0226B)の35μlを添加する。プラスチック製パスツールピペットで数回ピペッティングし、よく混ぜる。これはよく混合されていない場合はJB - 4が適切に重合されないために重要です。埋め込み樹脂5mlの準備ができたら、パスツールピペットで試料の周りから浸透プラスチックを取り外します。プラスチックを埋め込んでカップを満たします。プラスチックは、試料へのブロックホルダーの良好な付着性を確保するために、コップからしみ出す必要があります。ゼブラフィッシュ腎尿細管を検出するには、横方向のセクションでは、最高です。この目的のために、魚が垂直に埋め込まれている、下に向かう。プラスチックは、彼らが彼らの位置から移動しないことを十分に懸命になるまで、ハンドルや細かいピンセットでまつげの助けを借りて、定期的に、垂直に魚を置きます。それは約20〜30分かかります。その後、カップオーバーEBH - 2ブロックホルダー(Polysciences社15899)を配置し、℃で一晩4℃でトレイを残す。完了するとの重合には、アイスキューブのようにブロックをポップすることができます。
- 複数の幼虫の代替埋め込みプロトコル:JB - 4を完全に半分金を記入し、それが重合することができます。 15ミリメートルの正方形型のために私たちは途中で金型を埋めるために700μlでJB - 4ボリュームを使用してください。次に、プレ重合半分満たされた金型に硬化剤とJB - 4浸した幼虫を追加。東洋金型の長辺方向を向いて頭と幼虫と(あなたがラインで単一の金型で10魚を置くことができる)眼球のラインなど、最大幼虫を合わせます。ブロックが重合した後には、ブロックのエッジを切ることができる側面がナイフに直面しているので、それをオンにし、ミクロトームで収まるプラスチック製の"チャック"にそれを瞬間接着剤。この方法を使えば、同じプラスチック製の中央ブロック、、、クロスセクションのための準備の幼虫を多数配置することができます。ケアは、それぞれの魚の同等のセクションは、単一のセクションに取り込まれるようにナイフにブロックを向ける撮影する必要があります。すなわち東洋ブロック目の同等のセクションがそれぞれの魚のために取られるように:目を通して切片間、これを行うことができます。最終結果は、単一の顕微鏡スライド上に付随して多くの魚を分析できることです。
パート4:セクショ
- ミクロトームのチャックホルダ(我々はシャンドンフィネスサーモ電気株式会社ミクロトームを使用)に標本を設定する
- 45暖かいスライドを℃に設定
- ビーカーに純水を注ぐと、それはミクロトームの近くに配置
- 切片の前に、ブロックはそのような魚の完全な横断切片を得られるように配向されていることを確認。オリエンテーションヘッド調整レバーがナイフに正確に試料ヘッドを位置決めすることを可能に回転させることができる。魚の頭の中厚の切片を切断開始。目を通してのセクショニングしながら、向きをブロックすることは目に相当するセクションは、それぞれの魚のために取られるように。 pronephric細管が起動時に胸びれのセクションに表示されたら、それはです。この点から、ブロックから32 4 UMセクションについてカット。
- 鉗子でセクションを収集し、それらをピンセットで水に触れることなく、水でビーカーに落とす。セクションでは、今では、スライド上にそれを収集することができる、とすぐに水の表面に当たるとして展開します。 45 °の角度で水にスライドを挿入し、セクションの唯一の境界線に触れて、ハンドルとまつげの助けを借りて、セクションに近づく。
- 完全に乾燥するまで暖かく、スライド上のスライドをインキュベートする。
- 落射蛍光または共焦点顕微鏡を使用してイメージセクション。
パート5:代表レスults
正しく実行する場合、注入された魚は少し蛍光デキストラン心臓および循環系の目に見える(ルシファーイエローこの場合)で、図1のように表示されます。注射が深すぎる場合、注入された材料は、卵黄嚢に集中して見ることができる、または心臓は過度の出血を引き起こすパンクチャすることができます。ホールディングピペットが正しく行われている場合、魚はロールバックしませんか注入した場合、移動し、これはより正確な注入が可能になります。また、応答時間を遅らせると、システムの精度を減少させるている、MMPに気泡を持っていないことを確認することが重要です。一般的には、ゲンタマイシンの腎毒性の結果として、注入された魚の80%は、心膜水腫(図2)を開発する。中等度の浮腫ショー明らかに心膜水腫となる魚で私たちは、表現型に基づく分類システムを使用していますが、深刻な浮腫性の魚のに対し、ない他の観察可能な表現型は、軸の曲率を緩和するためにわずかで、心膜およびトランク浮腫を示していない。のNa + / K + ATPアーゼ(α- 6F)に対して、尿細管の抗体を用いて、我々はコントロール(図3)と比較して損傷した尿細管における細胞極性と管状混乱の明らかな損失で、横断面の損傷した細管を可視化することができます。このパターンは、複数の横断切片を通じて一貫しています。腎尿細管の完全な横断切片を得るためには、埋め込みの際に正しく魚を配置することが重要です。セクションを比較するとき、胸びれと近位尿細管は、解剖学的マーカーとして使用されます。
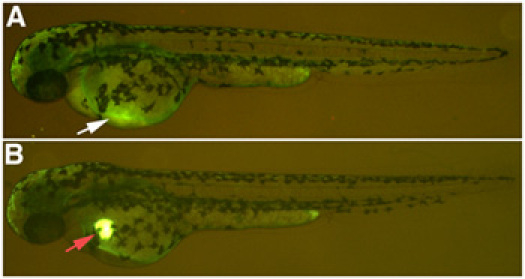
図1。腎毒素のマイクロインジェクション。総主静脈のかすかな表現を持つルシファーイエロー、白い矢印に結合した10kDaデキストランの()成功注入。 (B)、循環器系、赤の矢印に散逸しないルシファーイエローに結合した10kDaデキストランの預金の不正な注入結果。

図2。ゲンタマイシン媒介の浮腫。 (A)コントロールは、幼虫のゼブラフィッシュを注入した。ゲンタマイシンは、(B)中程度または(C)重度の浮腫と幼虫のゼブラフィッシュを注入した。すべての幼虫がアップしている左前方および背側で4 DPFにあります。黒い矢印は、BとCの心膜浮腫を指して
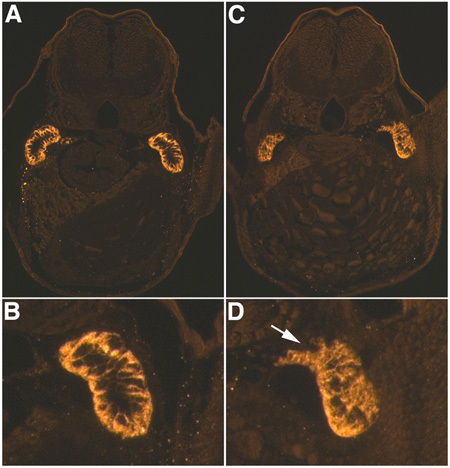
図3。AKI免疫組織化学。制御中のNa + / K + ATPアーゼ48時間ポストゲンタマイシン注射液(4 DPFの幼虫)(A、B)とゲンタマイシン注入(C、D)の幼虫のα- 6F抗体染色。 、Cは側底極性とDの尿細管の中断、白矢印、のとC.ノートの損失で右尿細管の3倍デジタル倍率は、Bに比べて20倍の倍率でAとBとDのされています
ディスカッション
このビデオの記事では、ゼブラフィッシュ幼生におけるゲンタマイシンの媒介近位尿細管の損傷を作成することで、AKIのモデルのための静脈内マイクロインジェクション法を示した。心膜および/または総浮腫の形成にこの損傷は、その結果、水のバランスを調節することができないことを反映。我々はまた、細胞極性の喪失や損傷した腎臓の近位尿細管の混乱を示す、差別化された腎臓の尿細管を(マジュムダールら、2000)マーク抗体による免疫組織化学実験を説明した。静脈内microinjectionsは、ゼブラフィッシュ幼生の血流中に水溶性物質を提供するための効率的な方法を表しています。この手法は、様々な物質を導入するための優れたツールであり、蛍光マーカーのユニフォームの注射の助けを借りて、一貫性のある結果を可能にする、何度も繰り返すことができます。
開示事項
謝辞
この作品は、衛生研究所(NIH)助成金R01DK069403とP30DK079307の米国の国民の協会によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| α6F mouse monoclonal | Developmental Studies Hybridoma Bank | ||
| Block Holder EBH-2 | Polysciences, Inc. | 15899 | |
| Borosilicate Glass Capillaries | World Precision Instruments, Inc. | TW100-6 | |
| Capillary tubes R-6 Custom Glass Tubing | Drummond Scientific | 9-000-3000 | |
| Catalyst Powder | Polysciences, Inc. | 02618 | |
| Cy3 | Jackson ImmunoResearch | 155-165-003 | |
| Dextran 10k Lucifer yellow, lysine fixable | Molecular Probes, Life Technologies | D1825 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Eyelash | Ted Pella, Inc. | 113 | |
| Gentamicin sulfate | Sigma-Aldrich | G8648 | |
| Glass vials 4ml | Weathon | 225012 | |
| Iron plate | Narishige International | IP | |
| JB-4 Embedding Solution A | Polysciences, Inc. | 0226A | |
| JB-4 Embedding Solution B | Polysciences, Inc. | 0226B | |
| Joystick micromanipulator | Narishige International | MN 151 | |
| Magnetic stand | Narishige International | MN-151 | |
| Manual microsyringe pump | World Precision Instruments, Inc. | ||
| Microinjection apparatus | World Precision Instruments, Inc. | PV820 | |
| Micromanipulator | World Precision Instruments, Inc. | M3301R | |
| Microtome | Thermo Fisher Scientific, Inc. | Shandon Finesse | |
| Mineral oil, light | Fisher Scientific | 0121-1 | |
| Pipette puller | Kopf Instruments | 720 | |
| Plastic molding cup tray | Polysciences, Inc. | 16643A | |
| Razor blade | VWR international | 55411-050 | |
| Slide warmer | Labline Instruments | ||
| Stage micrometer | WARD’s Natural Science | 94 W 9910 | |
| Tilting base | World Precision Instruments, Inc. | TB 1 | |
| Tricaine powder | Sigma-Aldrich | A-5040 | |
| Tween 20 | Sigma-Aldrich | P7949 | |
| Microscope | Leica Microsystems | S6F | Dissecting microscope |
| Microscope | Leica Microsystems | M205FA | Fluorescent microscope |
参考文献
- Hentschel, D. M., Park, K. M. Acute renal failure in zebrafish: a novel system to study a complex disease. Am J Physiol Renal Physiol. 288 (5), F923-F929 (2005).
- Majumdar, A., Lun, K. Zebrafish no isthmus reveals a role for pax2.1 in tubule differentiation and patterning events in the pronephric primordia. Development. 127 (10), 2089-2098 (2000).
- Weinstein, B. M., Stemple, D. L. Gridlock, a localized heritable vascular patterning defect in the zebrafish. Nat Med. 1 (11), 1143-1147 (1995).
- Westerfield, M. . The Zebrafish Book. , (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved