Method Article
在单个细胞中的线粒体DNA复制的可视化EDU信号放大
摘要
我们制定了一个敏感的技术标签在单个细胞中新合成的线粒体DNA(mtDNA),为了研究线粒体DNA的生物合成。该技术结合了一个酪胺信号放大(TSA)协议EDU纳入可视化的神经元亚细胞车厢内线粒体DNA的复制。
摘要
线粒体是细胞能量的线粒体生物合成的关键调节是调节在 1-3健康细胞的线粒体数目的重要组成部分。监测线粒体生物合成的方法之一是利率来衡量的线粒体DNA(mtDNA) 复制 4 。我们制定了一个敏感的技术来标记新合成的单个细胞中的线粒体DNA,为了研究线粒体DNA的生物合成。该技术结合了5 -乙炔- 2' -脱氧尿苷(EDU)一个酪胺信号放大(TSA)协议,以可视化神经元亚细胞内的线粒体DNA 复制 5-7纳入。 EDU是优于其他胸苷类似物,如5 -溴-2 -脱氧尿苷(BrdU),因为最初的点击反应标签EDU 5-7不需要苛刻的酸处理或酶消化,揭露BrdU抗原表位。 EDU温和的标签,允许其注册成立的直接比较,与其他细胞标记9-10。线粒体DNA的生物合成的能力,可视化和量化调查,用来调节线粒体的生物合成和与药物毒性反应,延缓衰老,癌症和神经退行性疾病相关的发病机制提供了洞察机制提供了一个必不可少的工具。我们的技术是适用于感觉神经元以及其他类型的细胞。使用这项技术来衡量线粒体DNA的生物合成有重大影响,在促进双方正常的细胞生理学以及受损的疾病状态的理解。
研究方案
1。神经元的制备
- 背根神经节(DRG)神经元生长在无菌(蒸压)12毫米,在24孔培养板盖玻片。
- EDU 10毫米股票(DMSO,点击它EDU微孔板检测试剂盒),通常在培养液稀释1:100作出10X EDU解决方案(100微米),然后稀释成井文化1:10(例如30 μL10X EDU成300μL培养液中的总的解决方案)。 DRG神经元是一个10微米EDU终浓度在37 ° C和5%CO 2 2-24小时之间。时间的长短取决于如何治疗影响线粒体DNA的合成率。
- 在通风橱中,DRG神经元是固定的2%多聚甲醛在室温为10-15分钟,在1X PBS每次冲洗2-5分钟洗2次,新鲜的1X PBS中存储长达1个月,在4 ° C。
- 盖玻片用细尖镊子转移到事先准备好的湿热试验箱(康宁生物测定菜用黑纸糊的对比底部,铝箔包裹保护,光敏感元件和与水饱和Kimwipes加湿),放在一张封口膜中号提供一个疏水表面局限于解决方案,以盖玻片。下面的协议是专为28盖玻片和解决方案是准备32盖玻片(约14%的额外量)。 75-80微升使每个盖玻片上使用昂贵或有限的组件的解决方案。否则,200-300μL用于清洗和模块解决方案,彻底洗出以前的解决方案。
- 重新申请1X PBS覆盖每个盖玻片表面(200-300μL)。准备的点击检测和酪胺信号放大,如下所述,并在制造商的指示包。
点击EDU微孔板检测试剂盒的制备
点击EDU微孔板检测试剂盒的大部分组件都预先制作并保存在4 ° C [2X点击反应缓冲液(10X部分E),硫酸铜(100毫米,F组件),点击它EDU固定液(组件D)和阻塞的缓冲液(2X组件H)]。点击它EDU缓冲添加剂(10X分量G)是储存在-20 ° C,以防止它随着时间的推移转向棕黄色。此组件容忍反复冻融。
俄勒冈州绿488叠氮(B组分)应分成小等份(10-20μL),以尽量减少冻融和储存在-20 ° C
要准备一个反俄勒冈州绿色辣根过氧化物酶标记(组件)的原液,加75μL毫Q DH 2 O的小瓶。轻柔吹打或颠倒混合,避免起泡,并储存于4 ° C。不要旋涡。
TSA试剂盒的制备与HRP的山羊抗兔IgG和的Alexa Fluor 488酪胺试剂盒#12,
要准备的酪胺原液,溶解的固体物质(的Alexa Fluor 488酪胺,A组份),在150μLDMSO(B组)。反转小瓶几次溶解酪胺涂层的小瓶的两侧。存放在小分装原液(10-20μL)在≤-20 ° C,干燥和避光。
2。点击5 - 乙炔- 2 -脱氧尿苷(EDU)标签
注:所有解决方案都与一个灯泡移液管200μL提示贴到年底,轻轻取出细胞,而不会失去的液体中删除。避免使用真空线,通常删除解决方案太大力。一个灯泡使用移液器轻轻洪水盖玻片200-300μL洗解决方案,彻底洗出以前的解决方案。
- 细胞是通透与0.1%1X PBS液TRITON - X - 100在室温为10分钟,在有盖的湿热试验箱。使用1%TRITON - X - 100的股票的解决方案。
- 请加入300微升1%TRITON - X - 100的股票2700μL1X PBS 3000微升0.1%的Triton X - 100的。
- 使用75-80%μL盖玻片。
- 删除的Triton X - 100的解决方案,并与1X PBS冲洗两次。
- 内源性过氧化物酶的活性是由1%1X PBS液中H 2 O 2为30分钟,在室温下淬火。稀释30%的H 2 O 2溶液与1X PBS。这个解决方案应该是新鲜,但可以在10分钟的通透性上述步骤(步骤3.1)。
- 2900μL1 × PBS加入100μL30%H 2 O 2 3000微升1%H 2 O 2。
- 使用75-80%μL盖玻片。
- 移除过氧化物酶的解决方案,并与1X PBS冲洗两次。
- 点击EDU反应
- 32盖玻片(32 × 80μL=2560微升)共2560μL是必要的。 2倍的反应是在1280μL,反应总体积的一半。
- 新鲜准备的点击反应酒会开始前5分钟后修复(以下步骤3.5)。
- 吹打向上和向下混合的鸡尾酒。这种反应时,不要旋涡。
2 ×反应鸡尾酒
组件点击EDU微孔板检测试剂盒半量:1280μL 毫Q DH 2 O 1132.8微升 2X点击反应缓冲液(10X部分E) 100.3微升 点击它EDU缓冲添加剂(10X分量G) 25.6微升 硫酸铜4(100毫米,组件F) 25.6微升 俄勒冈州的绿叠氮(A组分) 6.4微升 共有 1290.7微升
注意:上面所用的体积是成正比的点击EDU微孔板检测试剂盒方向列出的卷。反应鸡尾酒的最终体积略比1280μL。 - 2X点击它的反应是稀释EDU固定液(组件D)使用前点击量相等。混合这些在一起,使得一个统一的反应液中,所有的盖玻片。
- 新增1290.7μL,点击它EDU固定液(组件D)1290.7μL反应鸡尾酒。使用75-80%μL盖玻片。
- 点击EDU固定液(组件D)在室温下5分钟后修复的神经元。
- 删除修正和添加反应鸡尾酒从上面(步骤3.4)。盖,以防止光线和孵育25分钟,在室温。轻轻地取出反应鸡尾酒。洗两次稀释1X封闭液(2X组件高)。
- MilliQ D H 2 O(2600μL)等体积稀释2600μL封闭液(2X组件高)5200 1X封闭液液。使用75-80%μL盖玻片。
- 落射荧光显微镜下,俄勒冈州格林在控制细胞分裂活跃的细胞核染色检查。
3。酪胺信号放大(TSA)EDU信号
- 添加1%TSA块解决方案,每个盖玻片和30分钟,在室温下孵育。
- 重达0.06克与TSA阻断试剂(TSA试剂盒#12,组件D),将它添加到6000μL的1 × PBS 6000微升1%TSA块解决方案。涡旋混合。通常在1%TSA块解决方案的5%山羊血清的加入将有助于减少非特异性结合。
- 简要自旋反俄勒冈州的绿色辣根过氧化物酶标记抗体的股票(组成部分点击EDU微孔板检测我),准备在TSA的提前2-24小时。在1%TSA的封闭液稀释的主要抗体1:300和反转或吸管达轻轻混合。不要旋涡,以避免扰乱了HRP标记的抗体。删除1%TSA块解决方案,每个盖玻片添加75μL,4℃过夜孵育° C。
- 该抗体可用于较为集中,如1:150,但它是在提供数量有限的,所以应谨慎使用。同样,在1%TSA块解决方案的5%山羊血清,往往会有助于减少非特异性反俄勒冈州绿色辣根过氧化物酶标记的抗体结合。
- μL一个1:300抗体溶液中加入8.53μL兔抗俄勒冈绿,辣根过氧化物酶(股票2560点击我T EDU微孔板法)2560μL1%TSA的封锁。混合轻柔吹打或反转。
- 第二天,取出抗体溶液,用1X PBS冲洗三次。在最后洗了一个额外的在室温30-60分钟,以确保去除未结合的抗体孵育的盖玻片。
- 准备为2560μL(32盖玻片× 80μL)的酪胺反应。
- 加入2μL的30%H 2 O 2(TSA试剂盒#12,F组件)398μL扩增缓冲(TSA试剂盒#12,部分E)400μL0.15% 的 H 2 O 2溶液(100X ) 。这应权之前需要。
- 对于最终体积为2560μL结合:
- 25.6μL,酪胺- 488(TSA套件组件A)
- 2508.8μL扩增缓冲(TSA套件部分E)
- 25.6微升0.15%H 2 O 2(从上面最后的0.0015%H 2 O 2)
- 与酪胺反应在室温下15分钟,取出1X PBS孵育。
- 删除酪胺反应,并用1X PBS冲洗三次,最后洗像以前那样在室温为30-60分钟孵化。
- 落射荧光显微镜下检查线粒体DNA标签。
- 山盖玻片显微镜幻灯片抗淬灭安装介质,如延长用DAPI的黄金。另外,埃杜的标签和放大可以遵循标准荧光免疫细胞化学标签其他细胞标记。
4。代表结果:线粒体DNA复制的可视化作为线粒体生源的标志
我们是在感觉神经元(图1)如何调节线粒体的数量感兴趣。该协议将标签用荧光标记的测量新线粒体方法,新合成的线粒体DNA。该法团的Alexa Fluor公司488线粒体DNA与绿色荧光信号(图2)标签的酪胺结果俄勒冈绿叠氮和后续放大点击化学合成的核苷酸EDU。如果做得正确,扩增的绿色信号是足够的背景荧光(如细胞的自体荧光或副作用的HRP - TSA反应)。
这项技术的设计标签新复制的线粒体DNA,以可视化和量化的神经元(图3)的亚细胞内的线粒体DNA的生物合成。 EDU标签,使标签的其他细胞,如神经丝(图3D)标记为随后的荧光免疫细胞化学。
TSA的反应,也可以与其他荧光的Alexa Fluor的Alexa Fluor 594 -酪胺,如tyramides。在从俄勒冈绿叠氮点击在核反应,但没有在线粒体DNA,这是无法察觉到TSA的前绿色信号核绿色荧光信号,这样的结果。的Alexa Fluor 594 -酪胺的放大,加剧了核的标签和红色荧光信号(图4)揭示了线粒体纳入EDU。一个类似放大的过程是用来显示BrdU掺入到新合成的线粒体DNA(图5),但是,这种方法需要一个额外的步骤来恢复一个严酷的酸(盐酸)或酶消化,这是没有必要EDU BrdU抗原表位标签。
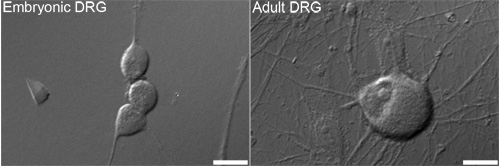
图1。微分干涉对比(DIC)的代表图像的胚胎(左)和成人(右)背根神经节(DRG),通常用于分析。酒吧= 10微米的神经元。
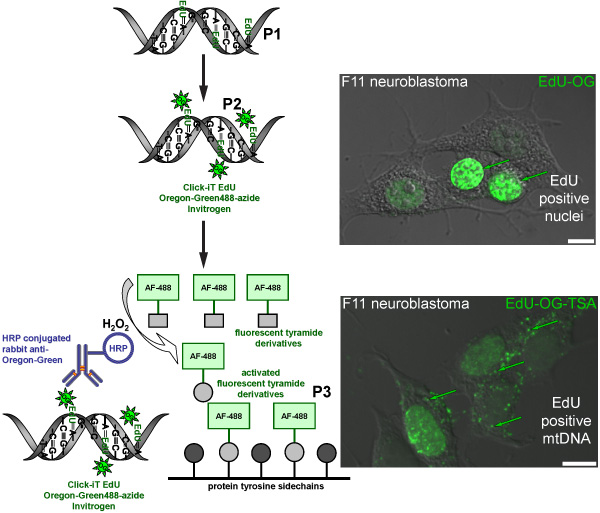
图2。示意图标签EDU mtDNA中的绿色荧光信号的过程 。电路图三步走协议标签EDU mtDNA中的绿色荧光信号。分裂活跃F11神经母细胞瘤细胞作为阳性对照,说明标签EDU的图案,是核和线粒体DNA中。第一步(P1)的孵化细胞中存在的EDU一个胸苷模拟纳入新合成的线粒体DNA。第二步(P2),是基于点击化学标签与俄勒冈州绿叠氮纳入EDU。绿色信号是在其核DNA复制的细胞的细胞核中可见。最后一步(P3),是放大俄勒冈GREEN -叠氮与HRP标记的兔抗体对俄勒冈州的绿孵化的信号其次孵化的Alexa Fluor 488标记的酪胺在过氧化氢 的存在(H 2 O 2)mtDNA中的可视化的绿色信号。
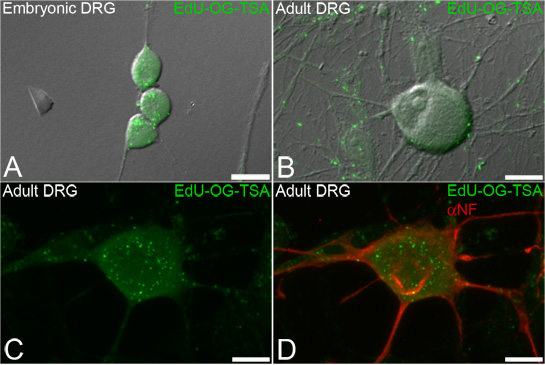
图3。 EDU标签的mtDNA在背根神经节(DRG)神经元 。神经元培养与埃杜随后,信号放大,发现线粒体DNA ,纳入EDU。覆盖上纳入新合成的胚胎(A)和成年人(BD)DRG神经元的线粒体DNA扩增EDU(EDU - OG - TSA,绿色)呈绿色点状信号的传输光的代表荧光图像。 EDU印制标签的程序,可以为后续的神经细胞,如神经丝(D,αNF,红色)标记的免疫荧光染色。比例尺= 10微米。
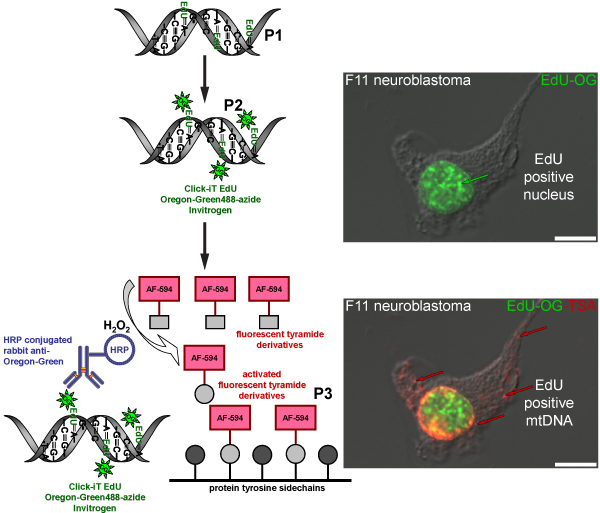
图4。示意图标签EDU mtDNA中有一个红色的荧光信号的过程。电路图三步走协议标签EDU mtDNA中有一个红色的荧光信号。分裂活跃F11神经母细胞瘤细胞作为阳性对照,说明标签EDU的图案,是核和线粒体DNA中。第一步(P1)的孵化细胞中存在的EDU一个胸苷模拟纳入新合成的线粒体DNA。第二步(P2),是基于点击化学标签与俄勒冈州绿叠氮纳入EDU。绿色信号是在其核DNA复制的细胞的细胞核中可见。最后一步(P3),其次是俄勒冈绿叠信号放大与HRP标记的兔抗体对俄勒冈州的绿孵化孵化的Alexa Fluor 594标记的酪胺,过氧化氢 的存在(H 2 O 2)可视化mtDNA中的红色信号。
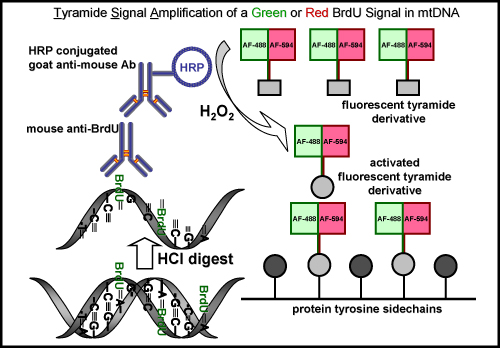
图5。 BrdU标记和mtDNA中的绿色或红色荧光信号的酪胺信号放大示意图 。标签BrdU在新合成的线粒体DNA,用一个绿色或红色荧光信号的过程。最初的步骤是必需的恢复BrdU抗原表位的酸(盐酸)或酶消化,这是没有必要EDU标签。下一步是鼠标的主要抗BrdU抗体进行孵化。其次是与辣根过氧化物酶(HRP)标记的羊抗鼠抗体孵化。最后,信号放大,用一个绿色或红色荧光标记的酪胺在过氧化氢 的存在(H 2 O 2)mtDNA中的可视化的信号。
讨论
我们开发了一种新合成的标签使用EDU酪胺信号放大的单个细胞中的线粒体DNA的敏感检测。在这个协议的优化最大的问题之一是盖玻片之间的不一致的结果。更改了Invitrogen公司试剂盒协议,以避免小卷和个人盖玻片混合,使主的解决方案,使用的所有盖玻片。 75-80μL,每12毫米的圆形玻璃盖玻片使用,是一种理想的体积完全覆盖的表面积,同时提供足够的解决方案给的样本之间的一致的结果。孵育时间和试剂浓度进行了优化,但可能与他们的调整改进。
该协议被设计为运行的每个进程一次。然而,一些步骤已经多次与新的解决方案,恢复后的第一次尝试失败的样本。特别是,EDU点击反应步骤(3.4-3.6)曾多次没有显着增加的背景荧光。俄勒冈州的反绿HRP抗体孵育(4.1-4.3)和酪胺扩增(4.4-4.5)的步骤也被反复,但更多的时候在一个贫穷的信号,因为增加的背景荧光信噪比的结果。
最敏感的试剂点击EDU缓冲添加剂(分量G)和点击EDU微孔板检测试剂盒的兔抗俄勒冈州绿色辣根过氧化物酶抗体(组件)。点击EDU缓冲添加剂逐渐变成黄色随着时间的推移时,保存在4 ° C和6-12个月之间大大变暗。点击埃杜在-20℃的缓冲添加剂的存储C将缓解这个问题。标签和酪胺扩增步骤的工作最好是在4-6个月重组MilliQ DH 2 O内使用兔抗俄勒冈州绿色辣根过氧化物酶抗体
EDU线粒体轻度标签允许额外的9-11细胞标记进行直接的比较和增强这种技术,如5 -溴-2 -脱氧尿苷(BrdU),这就要求苛刻的治疗恢复超过其他胸苷类似物的效用,其抗原表位内的DNA。我们的实验室11-12和13-15已经成功地使用BrdU标签线粒体。 BrdU标记技术EDU使用一个类似的,但有一些重要的差异(图5)。上面列出的通透性步骤(3.1-3.2)后,BrdU抗原表位的是恢复一个变性步骤(2 N的盐酸为30分钟,在37 ° C的三个在1X PBS洗涤)。 BrdU,然后与标记抗体对BrdU(矢量实验室在1%封闭液稀释1:50从TSA试剂盒孵育4℃过夜)。二抗步骤是必需的放大BrdU的信号(标记的羊抗鼠IgG HRP该协议套件#2和#5在1%封闭液稀释1:100,并在室温下45分钟孵育)之前的该协议的步骤(4.3-4.5上面)。有两个胸腺嘧啶核苷类似物,埃杜和BrdU,标签的mtDNA是执行双重标签线粒体可以按顺序在脉冲标签范例11标记实验有利。
我们的实验室是使用EDU和BrdU mtDNA的标签,以检查在糖尿病神经病变,糖尿病常见的并发症中的线粒体生物合成的调控。我们已经成功地用于信号放大来衡量线粒体生物合成的单个神经元的变化11-12。在其他实验旨在探讨线粒体DNA的复制和营业额或确定线粒体DNA合成的药物,抑制的机制中,这种技术将是有益的的。此外,放大埃杜和BrdU信号的基本原则可以应用到其他的研究,措施DNA复制或修复。
披露声明
致谢
这项工作得到了国家卫生赠款研究院NS - 38849和DK - 076160,青少年糖尿病研究基金会糖尿病并发症的研究中心,神经病学研究和发现的A.阿尔弗雷德陶布曼医学研究所在方案美国密歇根大学。这项工作所使用的形态和密歇根州的糖尿病研究和培训中心由国家卫生部批准5P60 DK - 20572研究院从美国国立糖尿病,消化道和肾脏疾病研究所资助,图像分析的核心。作者要感谢他的宝贵意见,从分子探针/ Invitrogen公司的斯科特T.克拉克各种点击EDU标记试剂盒和试剂的慷慨捐赠,以支持EDU扩增技术的初步发展。
材料
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | Fisher Scientific | 12-545-82 | |
| 245 mm x 245 mm BioAssay Dish | Corning | 431111 | |
| Parafilm M | Fisher Scientific | PM-996 | |
| paraformaldehye | Sigma-Aldrich | P6148 | |
| Triton X-100 | Sigma-Aldrich | T-8532 | |
| Phosphate buffered saline 10X solution | Fisher Scientific | BP399 | |
| Transfer Pipet | Fisher Scientific | 13-711-7M | |
| Hydrogen peroxide, 30% in water | Fisher Scientific | BP2633 | |
| Click-iT EdU Microplate Assay Kit | Invitrogen | C10214 | |
| TSA Kit #12, with HRP—goat anti-rabbit IgG and Alexa Fluor 488 tyramide | Invitrogen | T20922 | |
| TSA Kit #15, with HRP–goat anti-rabbit IgG and Alexa Fluor 594 tyramide | Invitrogen | T20925 | |
| ProLong Gold antifade reagent with DAPI | Invitrogen | P-36931 | |
| Polyclonal rabbit Neurofilament antibody | Chemicon International | AB1981 | |
| Mouse monoclonal anti-BrdU antibody | Vector Laboratories | VP-B209 | |
| TSA Kit #2, with HRP—goat anti-mouse IgG and Alexa Fluor 488 tyramide | Invitrogen | T20912 | |
| TSA Kit #5, with HRP—goat anti-mouse IgG and Alexa Fluor 594 tyramide | Invitrogen | T20915 |
参考文献
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu. Rev. Cell Dev. Biol. 22, 79-99 (2006).
- Dimmer, K. S., Scorrano, L. (De)constructing mitochondria: what for. Physiology (Bethesda). 21, 233-241 (2006).
- Suen, D. F., Norris, K. L., Youle, R. J. Mitochondrial dynamics and apoptosis. Genes Dev. 22, 1577-1590 (2008).
- Clay Montier, L. L., Deng, J. J., Bai, Y. Number matters: control of mammalian mitochondrial DNA copy number. J. Genet. Genomics. 36 (3), 125-131 (2009).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc Natl Acad Sci U.S.A. 105, 2415-2420 (2008).
- Buck, S. B., Bradford, J., Gee, K. R., Agnew, B. J., Clarke, S. T., Salic, A. Detection of S-phase cell cycle progression using 5-ethynyl-2'-deoxyuridine incorporation with click chemistry, an alternative to using 5-bromo-2'-deoxyuridine antibodies. Biotechniques. 44, 927-929 (2008).
- Yu, Y., Arora, A., Min, W., Roifman, C. M., Grunebaum, E. EdU incorporation is an alternative non-radioactive assay to [(3)H]thymidine uptake for in vitro measurement of mice T-cell proliferations. J Immunol Methods. 350 (1-2), 29-35 (2009).
- Heusden, J. V. a. n., Jong, P. d. e., Ramaekers, F., Bruwiere, H., Borgers, M., Smets, G. Fluorescein-labeled tyramide strongly enhances the detection of low bromodeoxyuridine incorporation levels. J. Histochem. Cytochem. 45 (2), 315-319 (1997).
- Cappella, P., Gasparri, F., Pulici, M., Moll, J. A novel method based on click chemistry, which overcomes limitations of cell cycle analysis by classical determination of BrdU incorporation, allowing multiplex antibody staining. Cytometry A. 73, 626-636 (2008).
- Kaiser, C. L., Kamien, A. J., Shah, P. A., Chapman, B. J., Cotanche, D. A. 5-Ethynyl-2'-deoxyuridine labeling detects proliferating cells in the regenerating avian cochlea. Laryngoscope. 119, 1770-1775 (2009).
- Lentz, S. I., Edwards, J. L., Backus, C., McLean, L. L., Haines, K. M., Feldman, E. L. Mitochondrial DNA (mtDNA) Biogenesis: Visualization and Duel Incorporation of BrdU and EdU Into Newly Synthesized mtDNA In. Vitro. J Histochem Cytochem. 58 (2), 207-218 (2010).
- Edwards, J. L., Quattrini, A., Lentz, S. I., Figueroa-Romero, C., Cerri, F., Backus, C., Hong, Y., Feldman, E. L. Diabetes regulates mitochondrial biogenesis and fission in mouse neurons. Diabetologia. 53 (1), 160-169 (2010).
- Davis, A. F., Clayton, D. A. In situ localization of mitochondrial DNA replication in intact mammalian cells. J. Cell Biol. 135, 883-893 (1996).
- Magnusson, J., Orth, M., Lestienne, P., Taanman, J. W. Replication of mitochondrial DNA occurs throughout the mitochondria of cultured human cells. Exp. Cell. Res. 289, 133-142 (2003).
- Amiri, M., Hollenbeck, P. J. Mitochondrial biogenesis in the axons of vertebrate peripheral neurons. Dev. Neurobiol. 68, 1348-1361 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。