Method Article
Visualização de replicação do DNA mitocondrial em células individuais por Edu amplificação de sinal
Neste Artigo
Resumo
Nós desenvolvemos uma técnica sensível para identificar recém-sintetizado DNA mitocondrial (mtDNA) em células individuais, a fim de estudar a biogênese mtDNA. A técnica combina a incorporação de Edu, juntamente com um sinal de protocolo de amplificação tiramida (TSA) para visualizar a replicação do mtDNA em compartimentos subcelulares dos neurônios.
Resumo
As mitocôndrias são reguladores chave da energia celular e biogênese mitocondrial é um componente essencial de regular os números mitocôndrias nas células saudáveis 1-3. Uma abordagem para o monitoramento biogênese mitocondrial é medir a taxa de DNA mitocondrial (mtDNA) de replicação 4. Nós desenvolvemos uma técnica sensível para rotular mtDNA recém-sintetizado em células individuais, a fim de estudar a biogênese mtDNA. A técnica combina a incorporação de 5-ethynyl-2'-deoxiuridina (Edu) 5-7 com uma amplificação de sinal tiramida (TSA) 8 protocolo para visualizar a replicação do mtDNA em compartimentos subcelulares dos neurônios. Edu é superior a outros análogos da timidina, como 5-bromo-2-deoxiuridina (BrdU), porque a reação inicial clique para Edu rótulo 07/05 não exige a tratamentos ácida ou enzimática digere que são necessários para expor o epítopo BrdU . O mais suave rotulagem de Edu permite a comparação direta de sua incorporação com outros marcadores celulares 9-10. A capacidade de visualizar e quantificar biogênese mtDNA fornece uma ferramenta essencial para investigar os mecanismos utilizados para regular biogênese mitocondrial e iria dar uma ideia da patogênese associada com a toxicidade dos medicamentos, envelhecimento, câncer e doenças neurodegenerativas. Nossa técnica é aplicável aos neurônios sensoriais, assim como outros tipos celulares. O uso desta técnica para medir a biogênese mtDNA tem implicações significativas para aprofundar a compreensão de ambos os fisiologia normal celular, bem como estados de doença prejudicada.
Protocolo
1. Preparação de Neurônios
- Gânglio da raiz dorsal (DRG) os neurônios são cultivadas em estéril (autoclavada) 12 milímetros lamínulas de vidro em uma placa de cultura de 24 poços.
- O estoque de 10 mM de Edu (em DMSO, Click-iT Edu Microplate Assay Kit) é tipicamente diluído 1:100 em meio de cultura para fazer uma solução Edu 10X (100 mM) e depois diluído 1:10 na cultura poços (por exemplo, 30 mL da solução 10X Edu em um total de 300 mL de meio de cultura). Neurônios DRG são incubados com uma concentração final de 10 mM Edu a 37 ° C e 5% CO 2 entre 24/02 horas. A duração do tempo depende de como os tratamentos afetam a taxa de síntese de mtDNA.
- Em um exaustor, os neurônios DRG são fixadas em paraformaldeído 2% por 10-15 min em temperatura ambiente, lavados duas vezes em 1X PBS 2-5 minutos cada lavagem e armazenadas em 1X PBS fresco por até um mês a 4 ° C.
- Lamínulas são transferidos com pinças de ponta fina para uma câmara úmida preparada (Corning prato Bioensaio com fundo forrado preto para contraste, envolto em papel alumínio para proteger componentes sensíveis a luz e umedecido com água saturada Kimwipes) e colocados em uma folha de Parafilm M que fornece uma superfície hidrofóbica para confinar as soluções para as lamelas. O protocolo a seguir é projetado para 28 lamínulas e soluções são preparadas para 32 lamínulas (cerca de 14% do volume extra). Soluções com componentes caros ou limitados são feitas de modo que 75-80 mL são usados em cada lamela. Caso contrário, 200-300 mL são usadas para soluções de lavagem e bloco para lavar as soluções anteriores.
- Recandidatar-se 1X PBS para cobrir a superfície de cada lamela (200-300 mL). Prepare o ensaio Click-lo e kits de amplificação de sinal tiramida como descrito abaixo e nas instruções do fabricante.
Preparação de Click-iT Edu Microplate Assay Kit
A maioria dos componentes do Click-iT Kit de Ensaio Edu Microplate vêm pré-fabricados e armazenados a 4 ° C [2x Click-iT Tampão de reacção (E Component 10x), CuSO4 (100 mM, Componente F), Click-iT Edu fixador ( componente D) e Tampão de bloqueio (2x componente H)]. Click-iT Aditivo buffer Edu (10x Component G) é armazenada a -20 ° C para evitar que ele gire amarelo-castanho ao longo do tempo. Este componente tolera repetidos ciclos de congelamento e descongelamento.
O Oregon 488 azida Verde (Componente B) deve ser dividida em pequenas alíquotas (10-20 mL) para minimizar os ciclos de congelamento e descongelamento e armazenadas a -20 ° C.
Para preparar uma solução estoque do anti-Oregon Verde HRP (Componente I), adicionar 75 mL de Milli Q dH 2 O para o frasco. Mix pipetando suave ou por inversão para evitar a formação de espuma e armazenar a 4 ° C. Não vortex.
Preparação de TSA Kit # 12, com a cabra HRP Anti-IgG de coelho e Alexa Fluor 488 Kit tiramida
Para preparar a solução estoque tiramida, dissolver o material sólido (Alexa Fluor 488 tiramida Componente, A) em 150 mL de DMSO (Componente B). Inverter o frasco várias vezes para dissolver qualquer revestimento tiramida os lados do frasco. Solução de armazenamento de estoque em pequenas alíquotas (10-20 mL) a ≤ -20 ° C, desidratado e protegido da luz.
2. Click-iT 5 ethynyl-2-deoxiuridina (Edu) Rotulagem
NOTA: Todas as soluções são retirados com uma pipeta de bulbo com uma ponta de 200 mL aposta no fim para remover suavemente as células líquidos sem perder. Evitar o uso de uma linha de vácuo, que geralmente remove soluções muito vigorosamente. Uma pipeta de lâmpada é usado para suavemente inundação lamínulas com 200-300 mL de soluções de lavagem para lavar a solução anterior.
- Células são permeabilizadas com 0,1% Triton-X-100 em 1X solução PBS por 10 minutos em temperatura ambiente em câmara úmida coberta. Use 1% Triton-X-100 soluções estoque.
- Fazer 3000 mL de 0,1% Triton-X-100, adicionando 300% 1 mL de Triton-X-100 ações para 2700μL 1X PBS.
- Use 75-80 mL por lamínula.
- Remover o Triton X-100 da solução e enxaguar duas vezes com PBS 1X.
- Atividade da peroxidase endógena se apaga por um 1% H 2 O 2 em 1X solução PBS por 30 minutos em temperatura ambiente. Diluir 30% H 2 O 2 com solução de 1X PBS. Esta solução deve ser feita fresco, mas pode ser feito durante a etapa de permeabilização 10 minutos acima (passo 3.1).
- Fazer 3000 mL de 1% H 2 O 2 pela adição de 100% 30 mL H 2 O 2-2900 mL 1X PBS.
- Use 75-80 mL por lamínula.
- Remover a solução peroxidase e enxaguar duas vezes com PBS 1X.
- Click-iT Reação Edu
- Para 32 lamelas (32 x 80 mL =2560 mL) um total de 2560 mL é necessário. A reação é feita 2x em 1280 mL, que é a metade do volume total da reação.
- Recém preparar o Cocktail Reação Click-lo antes de iniciar a correção pós 5 minutos (passo 3.5).
- Misture o cocktail pipetando cima e para baixo. Não vortex ao fazer essa reação.
2 Cocktail x Reação
Componentes são de Click-iT Edu Microplate Assay KitMetade Volume: 1280 mL Milli Q dH 2 O 1132,8 mL Tampão de reacção 2x Click-iT (E Component 10x) 100,3 mL Click-iT Aditivo buffer Edu (G Component 10x) 25,6 mL CuSO 4 (100 mM, F Component) 25,6 mL Oregon Verde Azida (um componente) 6,4 mL Total 1290,7 mL
NOTA: Os volumes utilizados acima são proporcionais aos volumes constantes do Click-iT Edu Microplate direções kit de Ensaio. O volume final de Cocktail de reação é um pouco mais de 1.280 mL. - O Click-iT 2X reação é diluído com igual volume de Click-iT Edu fixador (Componente D) o direito antes de usar. Mistura-los juntos faz uma solução de reação uniforme para todas as lamelas.
- Adicionar 1290,7 mL Click-iT Edu fixador (Componente D) para o coquetel de reação 1290,7 mL. Use 75-80 mL por lamínula.
- Pós-fix os neurônios com Click-iT Edu fixador (Componente D) por 5 minutos em temperatura ambiente.
- Remover corrigir e adicionar cocktail reação acima (passo 3.4). Cobertura para proteger da luz e incubar por 25 minutos em temperatura ambiente. Remova cuidadosamente a Cocktail de Reação. Lavar duas vezes com tampão 1X diluído Blocking (2X componente H).
- Fazer 5200 mL de 1X tampão de bloqueio por diluindo 2600 mL tampão de bloqueio (2x componente H) com um volume igual de MilliQ d H 2 O (2600 mL). Use 75-80 mL por lamínula.
- Sob um microscópio epi-fluorescente, verifique se há Oregon coloração verde em núcleos de células controle mitoticamente ativo.
3. Tiramida amplificação de sinal (TSA) de Edu Signal
- Adicionar solução de bloco 1% TSA a cada lamela e incubar por 30 minutos em temperatura ambiente.
- Faça mL de solução 6,000 1% bloco TSA, pesando 0,06 g de TSA reagente de bloqueio (TSA kit # 12, Componente D) e adicioná-lo a 6000 mL 1X PBS. Vortex para misturar. Adição de soro de cabra 5% na solução de um bloco% TSA, muitas vezes, ajudar a reduzir a ligação não específica.
- Brevemente girar o anti-Oregon Verde peroxidase estoque anticorpo conjugado (Componente I do Click-iT Assay Microplate Edu), elaborado 24/02 horas de antecedência da TSA. Diluir o anticorpo primário 1:300 em solução a 1% TSA bloqueio e inverter ou pipeta cima e para baixo cuidadosamente para misturar. Não vortex para evitar interromper o anticorpo HRP-conjugado. Remoção da solução de bloco 1% TSA, adicionar 75 mL de cada lamela e incubar durante a 4 ° C.
- O anticorpo pode ser utilizado mais concentrada, como 1:150, mas é fornecido em quantidades limitadas, para usá-lo com moderação. Mais uma vez, a adição de soro de cabra 5% na solução de um bloco% TSA, muitas vezes, ajudar a reduzir a ligação não específica do anticorpo anti-Oregon peroxidase horseradish Verde conjugados.
- Faça 2,560 mL de uma solução de anticorpo 1:300, adicionando 8,53 mL do Coelho de ações anti-Oregon Green-HRP (Click-iT Edu Microplate Assay) para 2560 mL 1% TSA bloqueio. Mix pipetando suave ou inversão.
- No dia seguinte, retire a solução de anticorpos e lavar três vezes com 1X PBS. Incubar as lamelas na lavagem final por mais 30-60 minutos em temperatura ambiente para garantir que os anticorpos não ligados primário é removido.
- Prepare reação tiramida para 2560 mL (32 mL lamínulas x 80).
- Fazer 400 mL de um 0,15% H 2 O 2 solução (100X), adicionando 2 mL dos 30% H 2 O 2 (TSA kit # 12, Componente F) a 398 mL de buffer de amplificação (TSA kit # 12, E Component) . Isto deve ser feito logo antes necessário.
- Para um volume final de 2560 mL combinar:
- 25,6 tiramida-488 mL (TSA kit componente A)
- 2508,8 mL tampão de amplificação (TSA E Component kit)
- 25,6 mL 0,15% H 2 O 2 (de cima para 0,0015% finais H 2 O 2)
- Remover 1X PBS e incubar com a reação tiramida por 15 minutos em temperatura ambiente.
- Remover reação tiramida e enxaguar três vezes com 1X PBS, incubando na lavagem final por 30-60 minutos em temperatura ambiente como antes.
- Verifique se há mtDNA rotulagem sob um microscópio epi-fluorescente.
- Lamínulas montagem em lâminas de vidro para microscópio com um meio Antifade montagem, tais como Prolongar ouro com DAPI. Alternativamente, a rotulagem Edu e amplificação pode ser seguido por imunocitoquímica fluorescentes padrão para rotular outros marcadores celulares.
4. Resultados Representante: Visualização de replicação do DNA mitocondrial como um marcador para Biogênese Mitocondrial
Estamos interessados em como os neurônios sensoriais (Figura 1) regular o número de mitocôndrias. Este protocolo irá rótulo mtDNA recém-sintetizado com um marcador fluorescente como uma forma de medir as mitocôndrias novo. A incorporação do Edu sintéticos nucleotídeo seguida pela química do clique da amplificação Oregon Green-azida e posterior com a Alexa Fluor-488 resultados tiramida na rotulagem de mtDNA com o sinal verde fluorescente (Figura 2). Se feito corretamente, o sinal amplificado verde é suficientemente maior que a fluorescência de fundo (como autofluorescência celular ou um efeito colateral da reação HRP-TSA).
Esta técnica destina-se a etiqueta de mtDNA recém-replicado, a fim de visualizar e quantificar biogênese mtDNA dentro de compartimentos subcelulares de neurônios (Figura 3). A rotulagem Edu permite imunocitoquímica fluorescentes subseqüente para rotular outros marcadores celulares, tais como neurofilamentos (Figura 3D).
A reação TSA também pode ser feito com outras fluorescentes tyramides Alexa Fluor, como Alexa Fluor 594 tiramida. Isso resulta em um sinal verde fluorescente nuclear a partir da reação clique em Oregon Green-azida no núcleo, mas nenhum sinal verde no mtDNA, que é indetectável antes do TSA. A amplificação com Alexa Fluor 594-tiramida intensifica o rótulo nuclear e revela a Edu incorporadas no mtDNA com um sinal vermelho fluorescente (Figura 4). Um procedimento de amplificação semelhante é usado para visualizar BrdU incorporação mtDNA recém-sintetizado (Figura 5), no entanto, este método requer um passo adicional para recuperar o epítopo BrdU por qualquer um ácido duro (HCl) ou digerir enzimas, que não é necessário para Edu rotulagem.
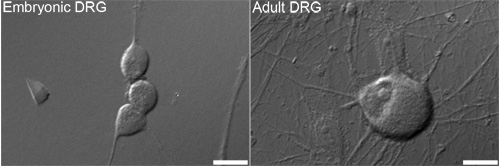
Figura 1. Representante contraste de interferência diferencial (DIC) de imagens embrionário (esquerda) e adulto (direita) gânglio da raiz dorsal (DRG) neurônios que são normalmente utilizados para análise. Bares = 10 mM.
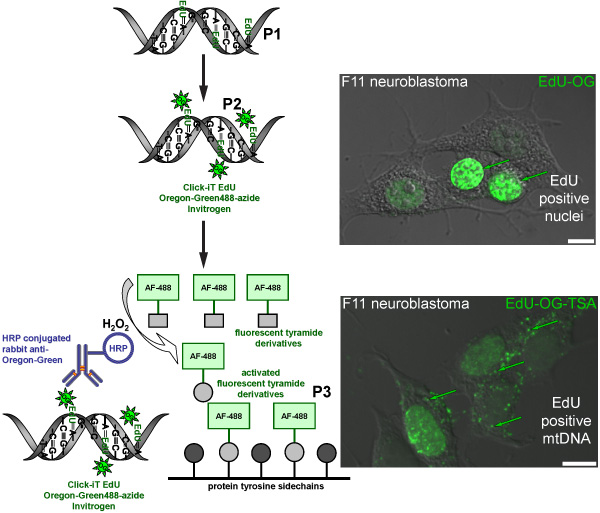
Figura 2. Esquema representando o processo de rotulagem Edu no mtDNA com o sinal verde fluorescente. O esquema representa o protocolo de três passos para a rotulagem Edu no mtDNA com o sinal verde fluorescente. Mitoticamente ativo F11 células de neuroblastoma servir como um controle positivo e ilustrar o padrão de rotulagem de Edu, que foi incorporada no DNA nuclear e mitocondrial. O primeiro passo (P1) é a incorporação de um análogo da timidina em mtDNA recém-sintetizado pela incubação de células na presença de Edu. A segunda etapa (P2) é baseada na química do clique para rotular Edu incorporado com uma Oregon Green-azida. Sinal verde é visível em núcleos de células que replicadas seu DNA nuclear. A etapa final (P3) é ampliar a Gr Oregoneen azida de sinal através da incubação com um anticorpo de coelho conjugada contra o HRP-Oregon Verde seguido de incubação com Alexa Fluor 488 tiramida rotulados na presença de peróxido de hidrogênio (H 2 O 2) para visualizar sinal verde no mtDNA.
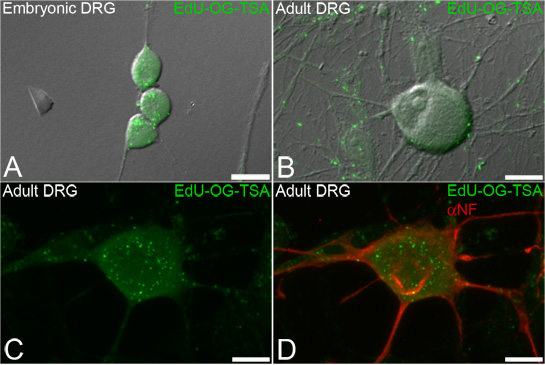
Figura 3. Edu rotulagem de mtDNA no gânglio da raiz dorsal (DRG) neurônios. Neurônios são incubadas com o Edu eo sinal é amplificado posteriormente a revelar mtDNA que incorporou Edu. Representante imagens de fluorescência sobrepostos em luz transmitida mostrando sinais verdes puntiformes de Edu amplificado (Edu-OG-TSA, verde) incorporados mtDNA recém-sintetizada de ambos embrionárias (A) e neurônios de adultos (BD) DRG. O procedimento de rotulagem Edu permite imunofluorescência subseqüente de marcadores neuronais, como neurofilamento (D, αNF, em vermelho). Barra de escala = 10 mM.
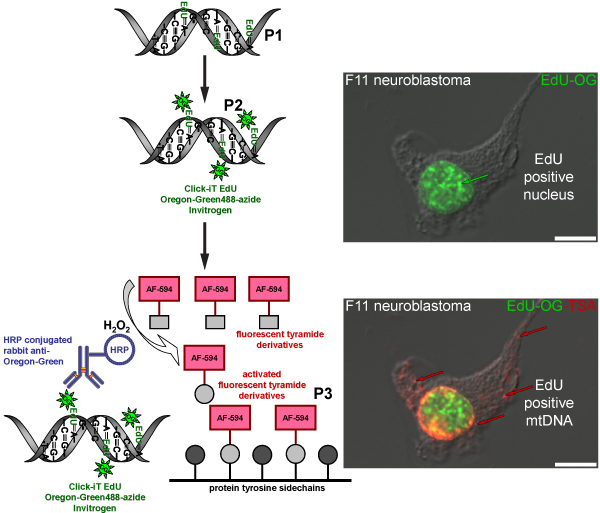
Figura 4. Esquema representando o processo de rotulagem Edu no mtDNA com um sinal vermelho fluorescente. O esquema representa o protocolo de três passos para a rotulagem Edu no mtDNA com um sinal vermelho fluorescente. Mitoticamente ativo F11 células de neuroblastoma servir como um controle positivo e ilustrar o padrão de rotulagem de Edu, que foi incorporada no DNA nuclear e mitocondrial. O primeiro passo (P1) é a incorporação de um análogo da timidina em mtDNA recém-sintetizado pela incubação de células na presença de Edu. A segunda etapa (P2) é baseada na química do clique para rotular Edu incorporado com uma Oregon Green-azida. Sinal verde é visível em núcleos de células que replicadas seu DNA nuclear. A etapa final (P3) é ampliar a Oregon sinal de Green-azida pela incubação com um anticorpo de coelho conjugada contra o HRP-Oregon Verde seguido de incubação com Alexa Fluor 594 tiramida rotulados na presença de peróxido de hidrogênio (H 2 O 2) para visualizar vermelho em sinal de mtDNA.
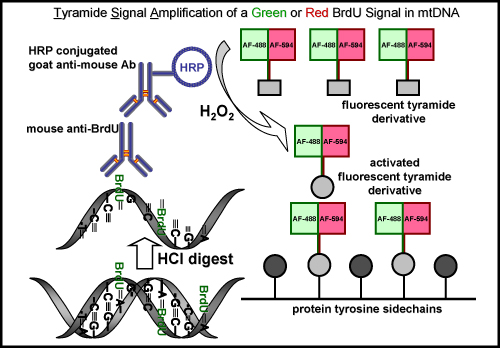
Figura 5. BrdU rotulagem e amplificação do sinal tiramida com um sinal verde ou vermelho fluorescente no mtDNA. O esquema representa o processo de rotulagem BrdU no mtDNA recém-sintetizado com um sinal verde ou vermelho fluorescente. Um passo inicial é necessária para recuperar o epítopo BrdU por um ácido (HCl) ou digerir enzimas, que não é necessário para a rotulagem Edu. O próximo passo é incubada com um rato de anticorpos anti-BrdU primária. Isto é seguido pela incubação com peroxidase (HRP)-cabra conjugado anticorpo anti-rato. Finalmente, o sinal é amplificado com um tiramida verde ou vermelho fluorescente etiquetado na presença de peróxido de hidrogênio (H 2 O 2) para visualizar sinal no mtDNA.
Discussão
Desenvolvemos um ensaio sensível para rotular mtDNA recém-sintetizado em células individuais usando uma amplificação de sinal tiramida de Edu. Um dos maiores problemas durante a otimização deste protocolo foi a resultados inconsistentes entre lamínulas. Alterações foram feitas para os protocolos Invitrogen kit para evitar a mistura de pequenos volumes em lamínulas individuais e tornando as soluções mestre de usar para todas as lamelas. O mL 75-80 utilizada para cada 12 milímetros de vidro circular lamela é um volume ideal para cobrir completamente a área de superfície, proporcionando solução suficiente para dar resultados consistentes entre as amostras. Tempos de incubação e concentração de reagentes foram otimizados mas as melhorias pode ser visto com os ajustes para eles.
O protocolo é projetado para executar cada processo uma vez. No entanto, alguns dos passos foram repetidos com novas soluções para recuperar amostras que falharam após a primeira tentativa. Em particular, o Edu passos clique em reação (3,4-3,6) foram repetidas sem um aumento significativo na fluorescência de fundo. O anti-Oregon incubação do anticorpo Green-HRP (4,1-4,3) ea ampliação tiramida (4,4-4,5), foram igualmente repetida, mas mais frequentemente resulta em um mau sinal-ruído por causa do aumento da fluorescência de fundo.
Os reagentes mais sensíveis são o Click-iT Aditivo buffer Edu (Componente G) eo coelho anti-Oregon anticorpos Green-HRP (Componente I) a partir do Click-iT kit Assay Edu microplaca. O Click-iT Aditivo buffer Edu gradualmente ao longo do tempo fica amarelo quando armazenado a 4 ° C e entre 6-12 meses escurece consideravelmente. Armazenamento do aditivo tampão Click-iT Edu a -20 ° C irá aliviar este problema. A rotulagem e as etapas de amplificação tiramida funcionam melhor quando o coelho anti-Oregon anticorpos Green-HRP é usado dentro de 4-6 meses de reconstituir em MilliQ dH 2 O.
A rotulagem leve de Edu no mtDNA permite comparações diretas com mais marcadores celulares 11/09 e aumenta a utilidade desta técnica sobre os análogos da timidina, tais como 5-bromo-2-deoxiuridina (BrdU), que requer um tratamento duro para se recuperar seu epítopo dentro de DNA. Nosso laboratório 11-12 e 13-15 os outros têm usado com sucesso BrdU para rotular mtDNA. A técnica de rotulagem BrdU é similar ao utilizado para o Edu, mas tem algumas diferenças importantes (Figura 5). Após a etapa de permeabilização listados acima (3,1-3,2), o epítopo BrdU é recuperado com uma etapa de desnaturação (2 N de HCl por 30 min a 37 ° C seguido de três lavagens em PBS 1X). O BrdU é, então, marcado com um anticorpo primário contra BrdU (Vector Laboratories diluída 1:50 em solução de bloqueio de 1% a partir do kit TSA e incubadas overnight a 4 ° C). Um passo anticorpo secundário é necessária para amplificar o sinal BrdU (cabra anti-IgG de rato conjugado com HRP da TSA kits # 2 e # 5, diluído 1:100 em 1% solução de bloqueio e incubado por 45 min à temperatura ambiente) antes de os passos TSA (4,3-4,5 acima). Ter dois análogos da timidina, Edu e BrdU, para mtDNA etiqueta é vantajoso para a realização de experimentos etiqueta dupla onde mtDNA podem ser rotulados sequencialmente no pulso rotulagem paradigmas 11.
Nosso laboratório está usando o Edu e BrdU rotulagem de mtDNA para analisar a regulamentação da biogênese mitocondrial no contexto da neuropatia diabética, uma complicação comum da diabetes. Temos utilizado com sucesso a amplificação de sinal para medir as mudanças no mtDNA biogênese em neurônios individuais 11-12. Esta técnica será útil em outros experimentos projetados para explorar os mecanismos de replicação e mtDNA volume de negócios ou para a identificação de drogas que inibem a síntese de mtDNA. Além disso, os princípios básicos de sinais ampliando Edu e BrdU pode ser aplicada a outros estudos que a replicação do DNA ou medida de reparação.
Divulgações
Agradecimentos
Este trabalho foi financiado pelo National Institutes of Health Grants NS-38849 e DK-076160, o Juvenile Diabetes Research Foundation Centro para o Estudo das Complicações em Diabetes, o Programa de Neurologia Pesquisa e Descoberta e A. Alfred Taubman O Instituto de Pesquisa Médica no Universidade de Michigan. Este trabalho utilizou a Morfologia e Core Image Analysis do Centro de Pesquisa e Treinamento Michigan Diabetes, financiado pelo National Institutes of Health Grant 5P60 DK-20572 do Instituto Nacional de Diabetes e Doenças Digestivas e Renais. Os autores agradecem Scott T. Clarke da Molecular Probes / Invitrogen pelos seus conselhos valiosos sobre as várias Click-iT Edu rotulagem kits ea generosa doação de reagentes para apoiar o desenvolvimento inicial da técnica de amplificação de Edu.
Materiais
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | Fisher Scientific | 12-545-82 | |
| 245 mm x 245 mm BioAssay Dish | Corning | 431111 | |
| Parafilm M | Fisher Scientific | PM-996 | |
| paraformaldehye | Sigma-Aldrich | P6148 | |
| Triton X-100 | Sigma-Aldrich | T-8532 | |
| Phosphate buffered saline 10X solution | Fisher Scientific | BP399 | |
| Transfer Pipet | Fisher Scientific | 13-711-7M | |
| Hydrogen peroxide, 30% in water | Fisher Scientific | BP2633 | |
| Click-iT EdU Microplate Assay Kit | Invitrogen | C10214 | |
| TSA Kit #12, with HRP—goat anti-rabbit IgG and Alexa Fluor 488 tyramide | Invitrogen | T20922 | |
| TSA Kit #15, with HRP–goat anti-rabbit IgG and Alexa Fluor 594 tyramide | Invitrogen | T20925 | |
| ProLong Gold antifade reagent with DAPI | Invitrogen | P-36931 | |
| Polyclonal rabbit Neurofilament antibody | Chemicon International | AB1981 | |
| Mouse monoclonal anti-BrdU antibody | Vector Laboratories | VP-B209 | |
| TSA Kit #2, with HRP—goat anti-mouse IgG and Alexa Fluor 488 tyramide | Invitrogen | T20912 | |
| TSA Kit #5, with HRP—goat anti-mouse IgG and Alexa Fluor 594 tyramide | Invitrogen | T20915 |
Referências
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu. Rev. Cell Dev. Biol. 22, 79-99 (2006).
- Dimmer, K. S., Scorrano, L. (De)constructing mitochondria: what for. Physiology (Bethesda). 21, 233-241 (2006).
- Suen, D. F., Norris, K. L., Youle, R. J. Mitochondrial dynamics and apoptosis. Genes Dev. 22, 1577-1590 (2008).
- Clay Montier, L. L., Deng, J. J., Bai, Y. Number matters: control of mammalian mitochondrial DNA copy number. J. Genet. Genomics. 36 (3), 125-131 (2009).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc Natl Acad Sci U.S.A. 105, 2415-2420 (2008).
- Buck, S. B., Bradford, J., Gee, K. R., Agnew, B. J., Clarke, S. T., Salic, A. Detection of S-phase cell cycle progression using 5-ethynyl-2'-deoxyuridine incorporation with click chemistry, an alternative to using 5-bromo-2'-deoxyuridine antibodies. Biotechniques. 44, 927-929 (2008).
- Yu, Y., Arora, A., Min, W., Roifman, C. M., Grunebaum, E. EdU incorporation is an alternative non-radioactive assay to [(3)H]thymidine uptake for in vitro measurement of mice T-cell proliferations. J Immunol Methods. 350 (1-2), 29-35 (2009).
- Heusden, J. V. a. n., Jong, P. d. e., Ramaekers, F., Bruwiere, H., Borgers, M., Smets, G. Fluorescein-labeled tyramide strongly enhances the detection of low bromodeoxyuridine incorporation levels. J. Histochem. Cytochem. 45 (2), 315-319 (1997).
- Cappella, P., Gasparri, F., Pulici, M., Moll, J. A novel method based on click chemistry, which overcomes limitations of cell cycle analysis by classical determination of BrdU incorporation, allowing multiplex antibody staining. Cytometry A. 73, 626-636 (2008).
- Kaiser, C. L., Kamien, A. J., Shah, P. A., Chapman, B. J., Cotanche, D. A. 5-Ethynyl-2'-deoxyuridine labeling detects proliferating cells in the regenerating avian cochlea. Laryngoscope. 119, 1770-1775 (2009).
- Lentz, S. I., Edwards, J. L., Backus, C., McLean, L. L., Haines, K. M., Feldman, E. L. Mitochondrial DNA (mtDNA) Biogenesis: Visualization and Duel Incorporation of BrdU and EdU Into Newly Synthesized mtDNA In. Vitro. J Histochem Cytochem. 58 (2), 207-218 (2010).
- Edwards, J. L., Quattrini, A., Lentz, S. I., Figueroa-Romero, C., Cerri, F., Backus, C., Hong, Y., Feldman, E. L. Diabetes regulates mitochondrial biogenesis and fission in mouse neurons. Diabetologia. 53 (1), 160-169 (2010).
- Davis, A. F., Clayton, D. A. In situ localization of mitochondrial DNA replication in intact mammalian cells. J. Cell Biol. 135, 883-893 (1996).
- Magnusson, J., Orth, M., Lestienne, P., Taanman, J. W. Replication of mitochondrial DNA occurs throughout the mitochondria of cultured human cells. Exp. Cell. Res. 289, 133-142 (2003).
- Amiri, M., Hollenbeck, P. J. Mitochondrial biogenesis in the axons of vertebrate peripheral neurons. Dev. Neurobiol. 68, 1348-1361 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados