Method Article
EDU信号増幅による個別細胞におけるミトコンドリアDNAの複製の可視化
要約
我々は、ミトコンドリアDNAの生合成を研究するために、個々の細胞内で新しく合成されたミトコンドリアDNA(mtDNA)を標識するために感度の高い手法を開発した。テクニックは、ニューロンの細胞内コンパートメント内にミトコンドリアDNAの複製を視覚化するチラミドシグナル増幅(TSA)プロトコルと一緒にEDUの取り込みを兼ね備えています。
要約
ミトコンドリア細胞のエネルギーとミトコンドリアの生合成の重要な調節因子は1-3健康な細胞のミトコンドリア数を調節するのに不可欠なコンポーネントですがあります。ミトコンドリア発生を監視するための一つのアプローチは、ミトコンドリアDNA(mtDNA)の複製4の速度を測定することです。我々は、ミトコンドリアDNAの生合成を研究するために、個々の細胞で新たに合成されたミトコンドリアDNAを標識するために感度の高い手法を開発した。テクニックは、ニューロンの細胞内コンパートメント内にミトコンドリアDNAの複製を視覚化するチラミドシグナル増幅(TSA)8プロトコル5-7 5 -エチニル-2' -デオキシウリジン(EDU)の混入を兼ね備えています。 EDU 5-7をラベル付けするために最初のクリックの反応がBrdUのエピトープを露出させるために必要とされるその過酷な酸処理または酵素消化を必要としないため、EDUは、例えば5 -ブロモ-2 -デオキシウリジン(BrdU)のような他のチミジン類似体よりも優れている。 EDUの穏やかなラベリングは、他の細胞のマーカー90から10と、その設立の直接比較が可能になります。ミトコンドリアDNAの生合成を可視化し定量化する能力は、ミトコンドリアの生合成を調節するために、薬剤の毒性、老化、がんや神経変性疾患に関連付けられている病因への洞察を提供する使用されるメカニズムを調査するための不可欠なツールを提供しています。私たちの技術は、感覚神経だけでなく、他のタイプの細胞に適用可能です。ミトコンドリアDNAの生合成を測定するためにこのテクニックの使用は、両方とも正常な細胞生理学だけでなく、障害者の疾病状態の理解をすすめるための重要な意味を持っている。
プロトコル
1。神経細胞の調製
- 後根神経節(DRG)神経細胞を24ウェル培養プレートに滅菌(オートクレーブ)12 mmのガラス製カバースリップ上に成長されています。
- EDUの10mMの株式は(DMSO、クリックして- IT EDUマイクロプレートアッセイキットで)(例えば、30一般的に10倍eduの溶液(100μM)を作るために培養液中で1:100に希釈し、培養ウェルに1:10で希釈され培養液の300μLの合計に10X EDU液のμL)。 DRGニューロンは、3710μMのEDUの最終濃度で° Cと2〜24時間の間に5%のCO 2をインキュベートする。時間の長さは、治療はミトコンドリアDNAの合成速度をどのように影響するかに依存します。
- 4℃で最高1ヶ月間はドラフト内で、DRGニューロンは、室温で10〜15分間、2%パラホルムアルデヒドで固定されている各洗浄1X PBSで2-5分間で2回洗浄し、新鮮な1X PBSで℃で保存
- カバースリップを準備多湿チャンバー(コントラスト黒取り替え底とコーニングのバイオアッセイの皿、光に弱い部品を保護するためにアルミホイルに包んで水飽和キムワイプで加湿)に先の細いピンセットで転送して提供するパラフィルムMのシート上に配置されますカバースリップにソリューションを閉じ込めるために疎水性表面。下記のプロトコールは28カバースリップとソリューション用に設計されている32カバースリップ(約14%余分なボリューム)のために準備されています。高価なまたは制限されたコンポーネントとソリューションは、75から80μLを各カバースリップ上で使用されるように作られています。そうでなければ、200〜300μLを徹底的に前のソリューションを洗い流すために洗浄し、ブロックのソリューションに使用されます。
- 1X PBSを各カバーの表面(200〜300μL)をカバーするために再適用されます。クリックして- IT検定し、以下、メーカーの指示書に記載さチラミドシグナル増幅キットを準備します。
クリックして- IT EDUマイクロプレートアッセイキットの準備
クリックして- IT EDUマイクロプレートアッセイキットからほとんどのコンポーネントが来る事前に行い、4℃で保存されています° C [2倍をクリックして- IT反応バッファー(10倍成分E)、硫酸銅(100mMの、コンポーネントF)、クリックして- IT EDU固定液(成分D)とブロッキングバッファー(2 ×成分H)]。クリックして- IT EDUバッファ添加物(10倍成分Gは)時間の経過とともに黄褐色の回転を防ぐために、-20℃で保存されています。このコンポーネントは、凍結融解の繰り返しを許容する。
オレゴングリーン488アジド(B成分)は、凍結融解を最小限に抑えるために少量のアリコート(10〜20μL)に分割し、-20℃で保存してください。
抗オレゴングリーンHRP共役(成分I)のストック溶液を準備するには、バイアルにミリQのdH 2 Oの75μLを加える。発泡回避し、4℃で保存するために穏やかなピペッティングしたり、転倒混和ボルテックスしないでください。
TSAキットの準備HRPヤギ抗ウサギIgG抗体およびAlexa Fluor 488チラミドキット付き#12、
チラミドストック溶液を調製するために、DMSO(成分B)を150μLで(のAlexa Fluor ® 488チラミド、コンポーネント)固体物質を溶解する。どんなチラミドコーティングのバイアルの側面を溶解するためにバイアルを数回転倒。 ≤-20 ° C、乾燥や光から保護における小アリコートで店舗のストック溶液(10〜20μL)。
2。クリックして- IT 5 - エチニル-2 - デオキシウリジン(EDU)のラベリング
注:すべてのソリューションが優しく細胞を失うことなく、液体を除去するために最後に貼られた200μLの先端を使って電球の転送ピペットで除去されています。通常、あまりにも積極的にソリューションを削除する真空ラインを、使用することは避けてください。電球のピペットを穏やかに完全に以前のソリューションを洗い流すために洗浄溶液の200〜300μLとカバースリップをフラッディングするために使用されます。
- 細胞を0.1%覆われた湿った室で、室温で10分間、1 × PBS溶液中でのトリトン- X - 100で透過処理されています。 1%トリトン- X - 100の原液を使用してください。
- 2700μL1X PBSに300μL1%トリトン- X - 100株を追加することにより、0.1%トリトン- X - 100、3000μLを加えます。
- カバースリップ当たり75から80μLを使用してください。
- トリトンX - 100溶液を除去し、1X PBSで2回すすいでください。
- 内因性ペルオキシダーゼ活性を1%、室温で30分間、1 × PBS溶液にH 2 O 2によりクエンチされる。 1X PBSで30%H 2 O 2溶液を希釈する。このソリューションは、新鮮なされるべきであるが、上記の10分の透過処理ステップ(ステップ3.1)中に行うことができます。
- 2900μL1X PBSに100μLの30%H 2 O 2を添加することにより1%H 2 O 2の3000μLを加えます。
- カバースリップ当たり75から80μLを使用してください。
- ペルオキシダーゼ溶液を除去し、1X PBSで2回すすいでください。
- クリックして- IT EDU反応
- 32カバーグラス(32 × 80μL=のための2560μL)2560μLの合計が必要です。 2倍の反応は、反応の総容積の半分である1280μL、で作られています。
- たて5分後の修正(下記ステップ3.5)開始する前にクリックして- IT反応カクテルをご用意。
- ピペッティングでカクテルを混ぜる。この反応を行う際にボルテックスしないでください。
2 ×反応のカクテル
コンポーネントは、Click - IT EDUマイクロプレートアッセイキットからです。半分のボリューム:1280μL ミリQのdH 2 O 1132.8μL 2倍をクリックして- IT反応バッファー(10倍成分E) 100.3μL クリックして- IT EDUバッファ添加物(10倍コンポーネントG) 25.6μL のCuSO 4(100mMの、コンポーネントF) 25.6μL オレゴングリーンアジ(成分A) 6.4μL 合計 1290.7μL
注:上記の使用量は、クリックして- IT EDUマイクロプレートアッセイキットの指示に記載されているボリュームに比例している。反応カクテルの最終容量は1280μLよりも少しです。 - 2Xをクリックして- IT反応は、右使用前にクリックして- IT EDU固定剤(成分D)の等量で希釈する。これらを一緒に混在させると、すべてのカバースリップのための均一な反応溶液になります。
- 1290.7μL反応カクテルに1290.7μLをクリックして- IT EDUの固定剤(成分D)を追加します。カバースリップ当たり75から80μLを使用してください。
- 室温で5分間のClick - IT EDUの固定剤(成分D)とニューロンのポスト修正。
- (ステップ3.4)上記からの反応カクテルを修正し、追加と削除。光から保護し、室温で25分間インキュベートしてカバー。ゆっくりと反応カクテルを削除します。希薄化後1 ×ブロッキングバッファー(2X成分H)で2回洗浄。
- ミリQ D、H 2 O(2600μL)の等量2600μLブロッキングバッファー(2 ×コンポーネントH)を希釈して1 ×ブロッキングバッファーの5200μLを加えます。カバースリップ当たり75から80μLを使用してください。
- 落射蛍光顕微鏡下で、有糸分裂アクティブ制御の細胞の核にオレゴングリーン染色を確認してください。
3。 EDU信号のチラミドシグナル増幅(TSA)
- 各カバースリップを1%TSAブロックのソリューションを追加し、室温で30分間インキュベートする。
- TSAブロッキング試薬0.06gを(TSAキット#12、成分D)の重量および6000μL1X PBSに追加することにより1%TSAブロックのソリューションの6000μLを加えます。ミックスする渦。 1パーセントTSAブロックの溶液中で5%ヤギ血清の添加はしばしば非特異的結合を減らすために役立ちます。
- 簡単に言うと抗オレゴングリーンホースラディッシュペルオキシダーゼ標識抗体の株式(クリックして- IT EDUマイクロプレートアッセイの成分I)は、TSAの前に2〜24時間を準備スピン。 1パーセントTSAブロッキング液で一次抗体1:300希釈し、反転または混合する優しく上下にピペッティング。 HRP標識抗体の中断を避けるためボルテックスしないでください。 、1%TSAブロックのソリューションを削除する各カバースリップを75μLを追加し、4℃で一晩インキュベート℃を
- 抗体はそのような1:150として、より濃縮された使用することができるが、それは限られた量で供給されるため、控えめに使用してください。再び、1%TSAブロックの溶液中で5%ヤギ血清の添加は、しばしば抗オレゴングリーンホースラディッシュペルオキシダーゼ標識抗体の非特異的結合を減らすために役立ちます。
- 株式のウサギ抗オレゴングリーン- HRP(クリックして- iの8.53μLを加えることによって1:300抗体溶液の2560μLを加えますT EDUマイクロプレートアッセイ)2560μL1パーセントTSAブロッキングへ。穏やかなピペッティングまたは転倒混和します。
- 次の日、抗体溶液を除去し、1X PBSで3回リンス。未結合の一次抗体が除去されていることを保証するために室温で更に30〜60分間の最終洗浄にカバースリップをインキュベートする。
- 2560μL(32カバーガラス× 80μL)のためのチラミド反応を準備する。
- 398μL増幅バッファー(TSAキット#12、コンポーネントE)に30%H 2 O 2(TSAキット#12、成分F)2μLを加える0.15%H 2 O 2溶液(100X)400μLを加えます。これは、右の前に必要に応じてなされるべきである。
- 2560μLの最終容量のために組み合わせる。
- 25.6μLチラミド- 488(TSAキットのコンポーネント)
- 2508.8μL増幅バッファー(TSAキットコンポーネントE)
- 25.6μL0.15パーセントH 2 O 2(最後の0.0015パーセントH 2 O 2の上から)
- 室温で15分間チラミド反応を1X PBSとインキュベートを削除します。
- チラミド反応を削除し、以前のように室温で30-60分間、最終的な洗浄でインキュベート、1X PBSで3回リンス。
- 落射蛍光顕微鏡でミトコンドリアDNA標識のために確認してください。
- このようなDAPIでゴールドを延長するなど、メディアをマウントする褪色防止と顕微鏡用スライドガラス上にカバースリップをマウントしてください。また、EDUのラベリングと増幅は他の細胞のマーカーにラベルを付けるために、標準の蛍光免疫細胞化学を続けることができます。
4。代表的な成果:ミトコンドリア生合成のためのマーカーとしてのミトコンドリアDNAの複製の可視化
我々は、感覚ニューロン(図1)はミトコンドリアの数を調節する方法に興味を持っています。このプロトコルは、新しいミトコンドリアを測定する方法として、蛍光マーカーで新たに合成されたミトコンドリアDNAにラベルを付けます。緑色蛍光シグナル(図2)とミトコンドリアDNAの標識のAlexa - ® 488チラミド結果とオレゴングリーン - アジドとその後の増幅のクリックケミストリーに続く合成ヌクレオチドEDUの取り込み。正しく行えば、増幅された緑色の信号は、バックグラウンド蛍光(例えばHRP - TSAの反応の細胞の自己蛍光や副作用など)よりも十分高いです。
この手法は、ニューロンの細胞内コンパートメント(図3)内にミトコンドリアDNAの生合成を可視化し定量化するために、新たに複製されたミトコンドリアDNAを標識するために設計されています。 EDUのラベリングは、ニューロフィラメント(図3D)などの他の細胞のマーカーにラベルを付けるために、後続の蛍光免疫細胞化学が可能になります。
TSAの反応はまた、Alexa Fluor 594の-チラミドのような他の蛍光Alexa Fluor ®のtyramidesで行うことができます。核のオレゴングリーン - アジドのクリック反応が、事前のTSAに検出不可能であるミトコンドリアDNA、のない緑の信号からの緑色蛍光の核信号でこの結果。 Alexa Fluor 594の-チラミドと増幅は核ラベルが激化し、赤の蛍光シグナル(図4)とミトコンドリアDNAに組み込まれているEDUを明らかにする。同様の増幅法が新たに合成されたミトコンドリアDNA(図5)にBrdUの取り込みを可視化するために使用されている、しかし、この方法では、過酷な酸(塩酸)またはEDUのために必要ではない酵素ダイジェスト、いずれかの方法でのBrdUエピトープを回復するために追加のステップが必要です。ラベリング。
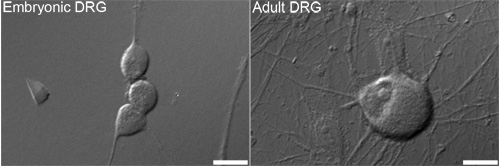
図1。代表的な微分干渉コントラスト(DIC)胚の画像(左)と大人(右)一般的に分析。バー=10μmとするために使用される後根神経節(DRG)ニューロン 。
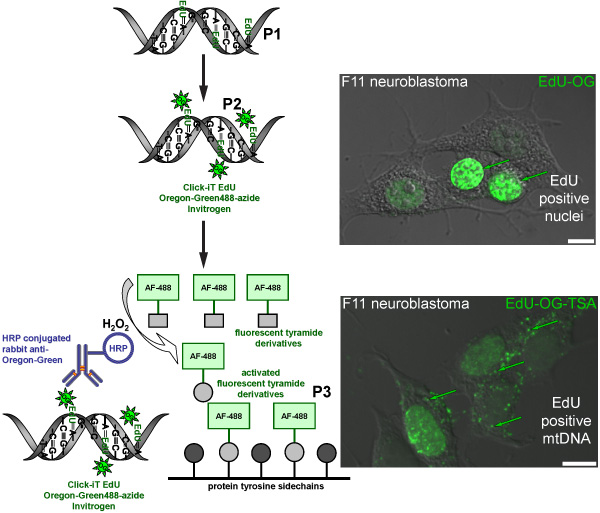
図2。緑色蛍光シグナルとmtDNAのEDUを標識するための手順を表す模式図。回路図は、緑色蛍光シグナルとmtDNAのEDUを標識するための三段階プロトコルを表します。有糸分裂アクティブF11神経芽細胞腫の細胞が陽性対照としての役割を果たし、核とミトコンドリアDNAに組み込まれたEDUの標識パターンを示しています。最初のステップ(P1)は、EDUの存在下で細胞をインキュベートすることにより、新たに合成されたミトコンドリアDNAにチミジンのアナログを組み込むことです。第2ステップ(P2)は、オレゴングリーン - アジドを組み込んだEDUにラベルを付けるためにクリックケミストリーに基づいています。緑の信号は、その核のDNAを複製された細胞の核に表示されます。最後のステップは、(P3)オレゴンGrを増幅することであるオレゴングリーンに対するHRP標識ウサギ抗体でインキュベートすることによりEEN -アジドの信号は、mtDNAの緑の信号を可視化するために過酸化水素(H 2 O 2)の存在下でのAlexa Fluor ® 488標識したチラミドとインキュベートした。
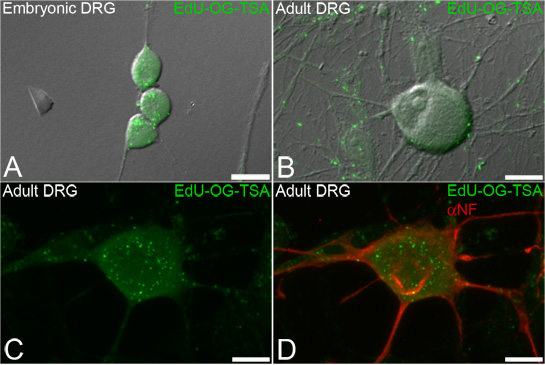
図3。後根神経節(DRG)神経細胞におけるmtDNAのEDUラベリング。ニューロンはEDUとインキュベートされ、信号はその後、法人EDUことのmtDNAを明らかにするために増幅される。胚()と大人(BD)DRGニューロンの両方の、新たに合成されたミトコンドリアDNAに組み込まれて増幅されたEDU(EDU - OG - TSA、緑)の緑の点状の信号を示す透過光の上に重ね代表蛍光画像。 EDUの標識手順は、ニューロフィラメントなど神経マーカーのその後の免疫蛍光染色(D、赤でαNF、)することができます。スケールバー= 10μmの。
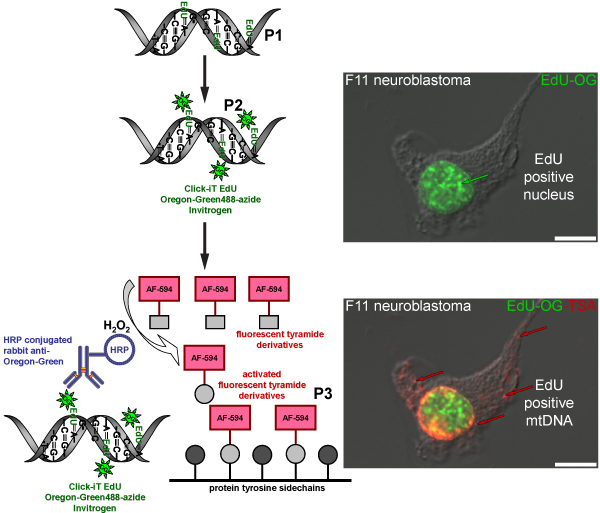
図4。赤色蛍光シグナルとmtDNAのEDUを標識するための手順を表す模式図。回路図は、赤色蛍光シグナルとmtDNAのEDUを標識するための三段階プロトコルを表します。有糸分裂アクティブF11神経芽細胞腫の細胞が陽性対照としての役割を果たし、核とミトコンドリアDNAに組み込まれたEDUの標識パターンを示しています。最初のステップ(P1)は、EDUの存在下で細胞をインキュベートすることにより、新たに合成されたミトコンドリアDNAにチミジンのアナログを組み込むことです。第2ステップ(P2)は、オレゴングリーン - アジドを組み込んだEDUにラベルを付けるためにクリックケミストリーに基づいています。緑の信号は、その核のDNAを複製された細胞の核に表示されます。最後のステップは、(P3)オレゴングリーンに対するHRP標識ウサギ抗体でインキュベートすることにより、オレゴングリーン-アジド信号を増幅することです視覚化するために過酸化水素の存在下でAlexa Fluor 594のラベルが付いたチラミド(H 2 O 2)で培養したmtDNAの赤の信号。
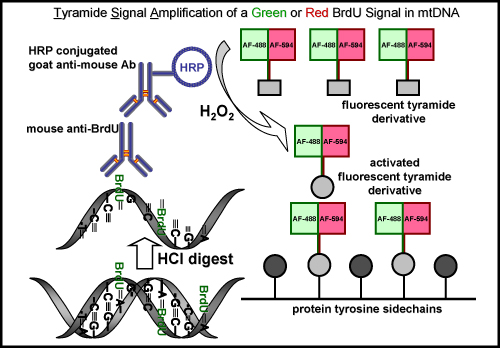
図5。 BrdU標識とmtDNAの緑色または赤色の蛍光シグナルとチラミド信号増幅。模式図は、緑色または赤色の蛍光シグナルを、新たに合成されたミトコンドリアDNAにBrdUを標識するための手順を表します。最初のステップは、酸(塩酸)またはEDUの標識のために必要がない酵素ダイジェスト、いずれかの方法でのBrdUエピトープを回復するために必要です。次のステップは、マウス一次抗BrdU抗体とインキュベートされる。これは、西洋ワサビペルオキシダーゼ(HRP)結合ヤギ抗マウス抗体とインキュベートすることによって続いている。最後に、信号は、mtDNAの信号を視覚化するために過酸化水素の存在下で緑や赤の蛍光標識チラミド(H 2 O 2)で増幅される。
ディスカッション
我々は、EDUのチラミド信号増幅を使用して、個々の細胞内で新しく合成されたミトコンドリアDNAを標識するために感度の高いアッセイを開発した。このプロトコルの最適化中の最大の問題の1つは、カバーグラスの間に一貫性のない結果だった。変更は、個々のカバーガラス上で少量を混合し、すべてのカバーガラスに使用するマスターソリューションを避けるためにインビトロジェンのキットのプロトコールに行われました。各12ミリメートルの円形のガラスカバースリップのために使用される75から80μLのサンプル間で一貫性のある結果を得るために十分なソリューションを提供しながら、完全に表面の面積をカバーする理想的なボリュームです。インキュベーション時間と試薬の濃度が最適化されたが、改善は、それらの調整と見られるかもしれません。
プロトコルは、一度、各プロセスを実行するように設計されています。しかし、ステップのいくつかは最初の試みの後に失敗したサンプルを回収する新しいソリューションで繰り返されてきた。特に、EDUのクリック反応のステップ(3.4から3.6)は、バックグラウンドの蛍光が大幅に増加することなく繰り返されてきた。抗オレゴングリーン- HRP抗体のインキュベーション(4.1から4.3)とチラミド増幅(4.4〜4.5)の手順では、また繰り返されて、しかし、増加するため、バックグラウンド蛍光の雑音比と劣悪な信号でより頻繁に結果している。
最も敏感な試薬は、Click - IT EDUマイクロプレートアッセイキットからクリックして- IT EDUバッファ添加物(成分G)とウサギ抗オレゴングリーン- HRP抗体(成分I)です。 4℃で保存されていると6-12ヶ月の間にかなり暗くするときにクリックして- IT EDUバッファの添加剤は、徐々に黄色に変わります。 -20℃でクリックして- IT EDUバッファの添加剤の保管は、Cは、この問題を軽減します。ラベリングとチラミド増幅ステップは、ウサギ抗オレゴングリーン- HRP抗体をミリQのdH 2 Oにそれを再構成するの4-6ヶ月以内に使用されているときに最高の仕事
mtDNAのEDUの軽度のラベリングは、追加の細胞マーカー9月11日との直接比較が可能で、そのような過酷な治療が回復するために必要な5 -ブロモ-2 -デオキシウリジン(BrdU)、などの他のチミジン類似体以上この手法の有用性を、強化さDNA内のそのエピトープ。当研究室で11月12日 、他は13から15を正常ミトコンドリアDNAを標識するためにBrdUを使用している。 BrdU標識法は、EDUのために使用されるものと似ていますが、いくつか重要な違い(図5)があります。 (3.1から3.2まで)上記の透過化工程の後に、BrdUをエピトープが変性ステップ(37℃で30分間2 N塩酸° Cの1X PBSで3回洗浄が続く)で回収される。 BrdUのはその後のBrdUに対する一次抗体で標識されている(ベクターラボラトリーズは、TSAキットから1%ブロッキング液で1:50に希釈し、4℃で一晩インキュベート)。二次抗体のステップの前に(ヤギ抗マウスIgG 1パーセントブロッキング溶液で1:100に希釈しTSAキット#2と#5、からHRPにコンジュゲートと、室温で45分間インキュベート)のBrdU信号を増幅するために必要ですTSAの手順(上記4.3から4.5)。ラベルのミトコンドリアDNAに2つのチミジン類似体、EDUとBrdUを、持つことのmtDNAを順次パルスラベリングのパラダイム11で標識することができるデュアルラベル実験を行うために有利で ある。
当研究室では、糖尿病性神経障害、糖尿病の一般的な合併症の文脈におけるミトコンドリア生合成の調節を検討するEDUとミトコンドリアDNAのBrdU標識を使用しています。私たちは正常に個々のニューロン11-12のミトコンドリアDNA生合成の変化を測定するために信号増幅を使用している。この手法は、mtDNAの複製と売上高のかミトコンドリアDNAの合成を阻害する薬剤を識別するためのメカニズムを探求するように設計された他の実験で有用であろう。さらに、EDUとBrdU信号を増幅の基本原理は、他の研究でその小節のDNA複製や修復に適用することができる。
開示事項
謝辞
この作品は、健康補助NS - 38849と糖尿病の合併症の研究のためのDK - 076160、少年糖尿病研究財団センター、神経学研究と発見とでA.アルフレッドトーブマン医学研究所のプログラムの国立研究所によってサポートされていましたミシガン大学。この作品は、形態と糖尿病および消化器腎臓病研究所から健康グラント5P60 DK - 20572の国民の協会によって資金を供給ミシガン糖尿病研究研修センター、の画像解析のコアを使用。著者は様々な彼の貴重なアドバイスのための分子プローブ/ InvitrogenからスコットT.クラークに感謝をクリックして、それがEDUの増幅技術の初期の開発を支援するためのキットや試薬の寛大な寄付をラベリングEDU。
資料
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | Fisher Scientific | 12-545-82 | |
| 245 mm x 245 mm BioAssay Dish | Corning | 431111 | |
| Parafilm M | Fisher Scientific | PM-996 | |
| paraformaldehye | Sigma-Aldrich | P6148 | |
| Triton X-100 | Sigma-Aldrich | T-8532 | |
| Phosphate buffered saline 10X solution | Fisher Scientific | BP399 | |
| Transfer Pipet | Fisher Scientific | 13-711-7M | |
| Hydrogen peroxide, 30% in water | Fisher Scientific | BP2633 | |
| Click-iT EdU Microplate Assay Kit | Invitrogen | C10214 | |
| TSA Kit #12, with HRP—goat anti-rabbit IgG and Alexa Fluor 488 tyramide | Invitrogen | T20922 | |
| TSA Kit #15, with HRP–goat anti-rabbit IgG and Alexa Fluor 594 tyramide | Invitrogen | T20925 | |
| ProLong Gold antifade reagent with DAPI | Invitrogen | P-36931 | |
| Polyclonal rabbit Neurofilament antibody | Chemicon International | AB1981 | |
| Mouse monoclonal anti-BrdU antibody | Vector Laboratories | VP-B209 | |
| TSA Kit #2, with HRP—goat anti-mouse IgG and Alexa Fluor 488 tyramide | Invitrogen | T20912 | |
| TSA Kit #5, with HRP—goat anti-mouse IgG and Alexa Fluor 594 tyramide | Invitrogen | T20915 |
参考文献
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu. Rev. Cell Dev. Biol. 22, 79-99 (2006).
- Dimmer, K. S., Scorrano, L. (De)constructing mitochondria: what for. Physiology (Bethesda). 21, 233-241 (2006).
- Suen, D. F., Norris, K. L., Youle, R. J. Mitochondrial dynamics and apoptosis. Genes Dev. 22, 1577-1590 (2008).
- Clay Montier, L. L., Deng, J. J., Bai, Y. Number matters: control of mammalian mitochondrial DNA copy number. J. Genet. Genomics. 36 (3), 125-131 (2009).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc Natl Acad Sci U.S.A. 105, 2415-2420 (2008).
- Buck, S. B., Bradford, J., Gee, K. R., Agnew, B. J., Clarke, S. T., Salic, A. Detection of S-phase cell cycle progression using 5-ethynyl-2'-deoxyuridine incorporation with click chemistry, an alternative to using 5-bromo-2'-deoxyuridine antibodies. Biotechniques. 44, 927-929 (2008).
- Yu, Y., Arora, A., Min, W., Roifman, C. M., Grunebaum, E. EdU incorporation is an alternative non-radioactive assay to [(3)H]thymidine uptake for in vitro measurement of mice T-cell proliferations. J Immunol Methods. 350 (1-2), 29-35 (2009).
- Heusden, J. V. a. n., Jong, P. d. e., Ramaekers, F., Bruwiere, H., Borgers, M., Smets, G. Fluorescein-labeled tyramide strongly enhances the detection of low bromodeoxyuridine incorporation levels. J. Histochem. Cytochem. 45 (2), 315-319 (1997).
- Cappella, P., Gasparri, F., Pulici, M., Moll, J. A novel method based on click chemistry, which overcomes limitations of cell cycle analysis by classical determination of BrdU incorporation, allowing multiplex antibody staining. Cytometry A. 73, 626-636 (2008).
- Kaiser, C. L., Kamien, A. J., Shah, P. A., Chapman, B. J., Cotanche, D. A. 5-Ethynyl-2'-deoxyuridine labeling detects proliferating cells in the regenerating avian cochlea. Laryngoscope. 119, 1770-1775 (2009).
- Lentz, S. I., Edwards, J. L., Backus, C., McLean, L. L., Haines, K. M., Feldman, E. L. Mitochondrial DNA (mtDNA) Biogenesis: Visualization and Duel Incorporation of BrdU and EdU Into Newly Synthesized mtDNA In. Vitro. J Histochem Cytochem. 58 (2), 207-218 (2010).
- Edwards, J. L., Quattrini, A., Lentz, S. I., Figueroa-Romero, C., Cerri, F., Backus, C., Hong, Y., Feldman, E. L. Diabetes regulates mitochondrial biogenesis and fission in mouse neurons. Diabetologia. 53 (1), 160-169 (2010).
- Davis, A. F., Clayton, D. A. In situ localization of mitochondrial DNA replication in intact mammalian cells. J. Cell Biol. 135, 883-893 (1996).
- Magnusson, J., Orth, M., Lestienne, P., Taanman, J. W. Replication of mitochondrial DNA occurs throughout the mitochondria of cultured human cells. Exp. Cell. Res. 289, 133-142 (2003).
- Amiri, M., Hollenbeck, P. J. Mitochondrial biogenesis in the axons of vertebrate peripheral neurons. Dev. Neurobiol. 68, 1348-1361 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved