需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
椎管内针对肌萎缩性脊髓侧索硬化症和外伤性脊髓损伤颈腹角细胞移植
摘要
神经前体移植是一种很有前途的战略,保护和/或更换丢失/功能失调颈椎膈运动神经元在脊髓损伤(SCI)和运动神经元症,肌萎缩边音硬化症(ALS)。我们提供了一个细胞传递到脊髓型颈椎病ALS和SCI的啮齿类动物模型腹角的协议。
摘要
呼吸妥协由于膈运动神经元的损失是一个衰弱的后果了大量人力外伤性脊髓损伤(SCI)的例1的比例,是与运动神经元症,肌萎缩硬化症(ALS)2支管患者死亡的最终原因。
ALS是一种破坏性的神经系统疾病的特点是较快的上下运动神经元的变性。屈服于平均2-5年的疾病的患者最终因呼吸麻痹由于膈运动神经元膜片3 innnervation损失的诊断。绝大多数情况下是零星的,而10%的家族形式。大约二十%的家族性病例是在21号染色体 4铜/锌超氧化物歧化酶1(SOD1)基因点突变。转基因小鼠4,5和6大鼠携带突变人类的SOD1基因(G93A,G37R,G86R,G85R)已经产生,并且,尽管存在着其他的动物模型运动神经元的损失,目前该疾病的最高度使用的模型。
脊髓损伤(SCI)是一个异构的条件,造成身体创伤,脊髓功能的结果,根据不同的类型,位置和严重程度的伤害 7 。然而,大约一半人类脊髓损伤病例的影响颈椎的地区,导致呼吸功能障碍衰弱由于膈运动神经元的损失和伤害的降bulbospinal呼吸轴突1。已开发的脊髓损伤动物模型,最常用的和临床相关挫伤8。
各种类的神经前体细胞(NPC的)移植是治疗外伤性中枢神经系统损伤和神经退行性疾病,包括ALS和SCI的一种很有前途的治疗策略,因为更换丢失或功能失调性中枢神经系统的细胞类型,提供神经保护作用的能力,并提供基因因素9利益。
ALS和SCI的动物模型,可以模拟许多这些疾病的临床相关的各个方面,包括膈运动神经元的损失和由此产生的呼吸妥协10,11。为了评估全国人民代表大会为基础的战略,在ALS和SCI这些动物模型的呼吸功能的疗效,必须专门针对蜂窝干预含有治疗膈运动神经元等有关目标的地区。我们提供一个详细的协议为多节段椎管内的NPC移植到颈椎脊髓腹侧灰质神经退行性型号如SOD1的G93A小鼠和大鼠,以及脊髓损伤大鼠和小鼠11。
研究方案
方法
1。细胞制备
作为一个例子,我们将介绍的程序编制胶质祖细胞移植,因为我们的经验与此类型的细胞12。然而,该协议的细节,包括中型和胰蛋白酶的使用,例如,将依赖于特定的细胞用于移植的类型。
- 所有的解决方案前温37.0 ° C的水洗澡。
- 的HBSS冲洗烧瓶2X。添加5.0 0.05%胰蛋白酶/ EDTA mL/T-75烧瓶。在37.0 ° C培养箱中孵育3分钟烧瓶中。磨碎3X 5或10ml吸管轻轻在烧瓶。
可选:添加5.0 mL/T-75瓶1.0毫克/毫升的大豆中的DMEM/F12胰蛋白酶抑制剂。
- 每5.0毫升的中型冲洗烧瓶2X。池细胞和冲洗。保留所有后续步骤在冰上的细胞。
- 在200-300克旋转锥管5分钟:最好在离心机冷却至4 ° C。倒出(并保存)上清。重悬在1.0毫升的中型细胞,并转移到1.5 mL Eppendorf管。
- 使用台盼蓝,以确定可行性血球计数细胞。
- 自旋再次在1.5毫升管(800转10分钟:最好在离心机冷却至4℃)。倒出(并保存)上清。
- 重悬细胞所需的最终体积中等,以达到适当的细胞密度。
- 分发多个1.5 mL的Eppendorf管中的细胞悬浮液。保持湿冰,直至移植的细胞。
不要使用0.75 mL管,汉密尔顿注射器/针不能深深地融入这个管。多次注射可能会手术过程中会,要避免打扰同一管内细胞多次。尝试准备至少50%以上的细胞悬液的体积比是需要。整个手术会话保持冰的细胞。准备细胞悬液,以保证细胞移植后的可行性最大的4-5小时内移植细胞。
2。手术前的准备
- 在手术前进行相关的基线行为评估。
- 免疫抑制:皮下环孢素A(CSA:10.0毫克/公斤体重)或腹腔(IP)FK-506/Rapamycin(1.0毫克/公斤体重),应至少有3天开始移植之前,应每天,直到牺牲。当局不建议在饮用水(而不是每天注射)。 CSA是我们的鼠源性细胞移植时免疫抑制剂的选择,而FK-506/Rapamycin人源性细胞移植时,是我们的选择。
- 高压灭菌器在手术前的手术工具。准备一个整洁干净的地方做的手术,以及一个整洁的地方放工具。玻璃珠的灭菌也是有益的。保持在手术过程中所有的清洁工具(尤其是咬骨钳),因为这将会使程序更容易。在手术过程中使用的任何物质需求是无菌的。
- 应擦拭,不能消毒,如手术显微镜的仪器,用适当的消毒剂和处理用无菌材料(如纱布)覆盖,使一次穿上无菌手套,外科医生,不会污染他/她的手套。
- 外科医生应该用消毒剂(洗必泰擦洗)开始手术之前,她/他的手。医生会戴上无菌手套,口罩,和一个干净的长衫。
3。外科手术:动物的制备及手术
动物准备:
- 称取动物,和适当剂量的麻醉管理:[acepromazine马来Isofluorane吸入麻醉的鸡尾酒(通过IP交付)(0.7毫克/公斤),氯胺酮(95毫克/公斤),甲苯噻嗪(10毫克/公斤)]。
- 捏脚趾和/或使用的眼睑的反射(摸上眼睑用棉签观察闪烁),以确定是否是正确麻醉的动物。应受术前应用人工泪液软膏的眼角膜。
- 头发剃回用电动剃须刀(无附件)。从耳朵稍喙刮胡子到动物的背部中间。剃须,并去除皮肤切开的头发,防止头发切口越来越。远离将执行手术的手术部位,以避免污染流浪发地区,应进行手术准备。
- Povidine碘消毒液浸泡的纱布,并适用于对光头面积的皮肤。手术部位应擦洗至少两次与Povidine碘溶液,小心擦洗,从中心向外围现场。该网站,然后可以用70%酒精或稀释的杀菌擦洗冲洗。该地区应覆盖无菌窗帘。
- 整个手术,使用一个加热垫我小号强烈建议维持动物的正常体温。此外,应监测体温。将动物卷纱布。对于成年大鼠,冷轧纱布应〜的厚度和1.0英寸〜6.0英寸长。磁带垫手术板,以便它不会移动。将动物垫胸/肩水平。伸出双臂手术板都上垫的武器和磁带。脊髓型颈椎病,所以,很容易工作,因为在整个手术颈髓深层皮肤表面以下发现我们的想法是支撑。
外科手术:
- 在最低的显微镜的放大倍率(我们用8倍的放大倍率),使用手术刀刀片,使正中切口。横向拉伸皮肤,另一方面使皮肤绷紧(这使得皮肤更容易切割),并从颅底切口肩胛骨。 ( 见图 1)
- 使用手术刀刀片,通过3肌肉层切开脊柱。轻轻挤压两侧的肌肉(从外侧向内侧)另一方面。确保按手术刀坚决切断与所有尽可能的削减数量最少的肌肉层使肌肉的切口将不会被锯齿状,这使得在手术结束时更容易缝合。但是,不要按得太紧,以防止在更深的组织损伤(脊柱)。
- 两个棉签涂药,用扭转运动,分离椎旁肌覆肌肉。一个可以大力这里。不要剪开或撕开,因为这会引起出血。扭曲的喷头动作,将很好地捉弄除了组织,而不会造成损坏或出血。如果出血发生在任何阶段的手术,最好是要有耐心。不要试图急于提前大量出血,因为血液会模糊视力的手术领域。烧灼或轻的压力,可以应用到出血的部位,但我们发现,耐心是最好的。随着实践,应该是整个手术的出血很少或根本没有。
- 收回4(见图2)自制拉钩的肌肉。这些拉钩可到牵开器( 参见 图 2,插图)形坚固纸夹。术前高压灭菌这些。应采取生硬的拉钩的末端,以避免组织损伤。领带的字符串拉钩。曝光应方形/矩形。这种形状可以实现拉动4个角,使用4拉钩。磁带字符串板,以确保拉钩( 见图 2)。市售拉钩也可以使用,但我们不喜欢使用这些。它是创造一个良好的手术视野,以清楚地看到整个手术的关键。不要“盲目”继续沿。
- 清除椎旁肌肉,脊柱的背水面。为了处理椎旁肌在脊柱的背水面,有2个潜在的策略。对于第一个战略,用鼠齿钳和中型弹簧剪刀去除背椎骨表面椎旁肌。尝试削减非常接近骨,以更好地暴露骨面。削减椎骨表面平行,但不切入线下来。对于第二种方法,在段脊髓肌肉的正中切口,并收回与更小的拉钩横向。在第二种方法中,然后缝合肌肉,手术后重新走到一起。
- 椎体骨的表面清洁。用咬骨钳(最重要的手术器械)拉离C4,C5和C6水平( 见图 3)肌肉。当然,这取决于有针对性的脊髓水平。虽然用咬骨钳,用一只手,安全,C2的过程,另一方面鼠齿钳抓住肌肉整个脊柱。 C2是在外科领域的大喙过程。 C3是以及稍下的肌肉。 C4,C5和C6易于访问,因为他们很少有肌肉覆。
- 开始的C5椎板切除。再次,通过控股与鼠齿钳C2安全。抓斗全椎板咬骨钳(见图表:中线附近抢)。位置咬骨钳,使该工具是完全垂直轴脊柱。慢慢粉碎椎板。不要压到脊髓,因为这将导致脊髓组织受损。粉碎和骨向上轻轻一拉断片。咬骨钳应粉碎片,使人们可以轻松地拉开了距离,以消除。如果一块骨头还连着其余椎板,不拖船,因为这会导致出血,并可能损伤脊髓。咬骨钳应干净,清晰。的咬骨钳等工具应清洗/擦干用无菌生理盐水,可在无菌碗( 见图 4)提供。
对于椎板切除术的初步开放,定位的咬骨钳垂直于dicular脊柱是可取的。这一步可以再其次是采取小“半字节”,以延长约30-60度角相对线表面轻轻插入下骨咬骨钳椎板切除。 - 椎板切除术扩展到所有C4 - C6椎板。在骨超过三个脊髓水平的不断开放。椎板切除的程度,可以调整的基础上所需的位置(S)椎管内注射。
- 不要扩大椎板切除太远横向因为这会引起出血。为了目标腹角,注射部位是相对内侧的,所以它是不必要的远横向扩大椎板切除。 ( 见图 5)
- 增加放大〜15 X.
- 清洁锋利/直#5镊子顶部硬脑膜结缔组织(和可能干血)。结缔组织和硬脑膜之间的差异,需要经验教训。
- 切开硬脑膜,要么微型弹簧剪刀或microknife,一个非常艰难的脑膜层。使切口平行轴脊柱内侧背根的入口区。这将允许一个目标腹角。 ( 见图 6)
- 使用锋利/直#5钳抓住并稍微解除脊髓硬膜。不要捏/损伤脊髓。这需要一些练习。 microknife或非常小的弹簧剪刀的切口。不要损害脊髓。
- 在延髓,尾椎轴稍延长切口。硬脑膜张力会略微分开硬脑膜脊髓创建一个很好的接触。
- 在适当的地点为每个拟注入所有的切口。杜拉有一个朦胧的半透明外观,而脊髓表面有一个更光明的白色外观。人们需要学会辨别这些除了。最好是不要尝试通过注射针头注入硬脑膜。杜拉是艰难的,使将难以通过它来捅破。此外,通过硬脑膜穿刺针插入的运动轨迹影响,因此将影响细胞的解剖学针对性的交付。
- 在3级(共6个)注入细胞的双边目标颈膨大的广大地区。注射(S)的数量和位置,当然,取决于具体的实验。
- 刺穿硬脑膜后,脑脊液会倒出来。用纱布或棉签线和整个暴露表面干燥。
- 细胞注射,使用10.0μL汉密尔顿气密RN注射器。
- 将33号/ 45度斜角金属RN汉密尔顿针。针应该是尖锐的。只〜20注射(少注射针会更清晰)使用同一个针头。也可以使用针拉玻璃毛细管。使用环氧附加拉玻璃尖26号钝汉密尔顿金属针。修剪外〜75.0-100.0μL(取决于细胞直径:不想破坏细胞在注射过程中)的尖端直径,使用手术显微镜和微米幻灯片。我们更喜欢33号的金属针。
- 细胞会掉下来容易内暂停Eppendorf管上冰。之前,立即装入注射器,轻轻拍打管,直到细胞返回到悬挂。不要一抖太紧张,因为这会损害细胞和/或导致气泡。另外,使用人20.0μL吸管轻轻混匀细胞:吸液管细胞悬液,只有一至两次向上和向下。
- 负载足够的细胞悬液,体积只有一个注射部位。的单元格将下降暂停注射器内,如果计划做多次注射。注射器慢慢进入细胞,以避免气泡和/或细胞损伤。具体来说,我们在我们的实验室工作的神经胶质祖细胞,我们在50,000-75,000细胞超过2-5分钟,每1.0μL稀释注入2.0μL细胞悬液。我们已经发现,2uL/site不会导致组织损伤的脊髓型颈椎病。相反,我们的经验表明,大大提高了本卷中的细胞的数量(尤其是当它们的大小大于我们的神经胶质祖细胞:直径10.0 -20.0),可能会损坏脊髓实质。我们进行了广泛的细胞剂量的实验,以确定最优细胞注入在每个站点(至少在一个完整的脊髓型颈椎病)。参数必须确定特定的细胞类型和病情。
- 行了注射器/针与轴脊柱正确目标所需的解剖区域平行。刚好够针角度(约80度,相对手术表)不磕碰的手术范围头,但接近90度尽可能的。下针尖对脊髓背侧使用显微镜的表面(见图7)。
- 目的针内侧进入ZO背根的NE( 见图 8)。轻轻触摸针尖与脊髓表面。针稍稍压低与脊髓。缩回针,直到脊髓恢复正常。记录本作为位置Z = 0.0使用的显微操纵器上的统治者。
注:我们经常不稳定在脊柱脊髓型颈椎病注射剂。使用我们的麻醉方案,由于沉重的呼吸声和脊髓型颈椎病的运动从来就不是一个问题。但是,如果沉重的呼吸是一个问题,可以稳定脊柱使用一个定制的框架,轻轻夹紧骨和周围的水平,C2和C7使用修改钳段脊髓肌肉,小心不粉碎的椎体骨或伤害潜在的脊髓组织。如果动物的呼吸变得浅在手术过程中,应提供更多的麻醉药物。应中断,直到手术的麻醉平面已前恢复重新取得的手术。 - 略低的进针脊髓。确保在显微镜下看,而这样做。下针深度为1.5毫米的目标在成年大鼠腹角。下针深度为0.75毫米的目标,在成年小鼠腹角。 ( 见图 9)。这些深入的数字代表的成人(至少3个月)女性和男性的Sprague - Dawley大鼠(250-450克)和C57BL / 6小鼠(20-35克)。当然,深度和横向位置取决于特定区域的利益。请勿打扰喷射系统/板或手术手术台上,而针插入到脊髓,以避免损害脊髓组织。
- 降低注射针前所需的深度后,等待两分钟(不再是更好的)。
- 在不断使用泵控制器的速度,超过2-5分钟注入2.0μL。
- 才慢慢消除脊髓针注射后等待两分钟(越长越好)。
- 每次注射后,以防止堵塞dH2O清洁注射器。慢慢地制定和驱逐的3-5倍。不要画到注射器中的空气。
- 最低放大倍数(在手术开始使用相同的:〜8个)。缝合硬脑膜封闭使用9-0缝合,但是这绝对是没有必要的。这也是具有挑战性的。我们缝合硬脑膜,在过去封闭的,但我们发现,在动物的行为,移栽成活或脊髓组织学检查时不封闭缝合硬脑膜没有区别。硬脑膜可以覆盖保护片的无菌凝胶泡沫。凝胶泡沫应直接放置在硬脑膜切口部位的顶部。然而,重要的是要照顾不会突然拉动这块的明胶海绵后灌注清扫过程中的脊髓表面,明胶海绵可以有时紧紧坚持脊髓表面。
- 可选:用4-0缝线缝合椎旁肌封闭。
- 用4-0缝线缝合关闭在同一时间三个覆肌肉层。在延髓尾椎轴在三个地点缝合肌肉( 见图 10)。
- 主食皮肤封闭用9.0毫米的伤口片段( 见图 11)。加强与持针钉书针,以防止动物脱下前全伤口愈合的订书钉。空间主食约0.5厘米分开。不要过度拧紧伤口片段,因为这可能会导致受损的愈合和坏死。
- 应用Povidine碘消毒液浸湿纱布,伤口面积。
- 让动物恢复循环温水垫。给分皮肤无菌乳酸林格液(鼠5.0毫升,0.5毫升的鼠标)注射后立即手术。后续注入也可以提供,如果动物出现脱水和/或无精打采。可以使用预防性的抗生素治疗用头孢唑啉6.0mg/kg;然而,我们的经验表明,这个移植过程不会在手术后的感染结果,其次是无菌技术和所有仪器/手术用品消毒。如果这些预防措施,抗生素是气馁。
- 继续,直到牺牲CSA或FK-506/Rapamycin每天。
- 整个手术应采取少于〜45分钟(6注射部位)。否则,动物开始醒来,呼吸更加严重,这会影响到脊髓注射。
议定书的各个步骤相关联的问题的故障排除提示
/细胞存活率不佳的缺乏,这很可能不是与注射相关的技术问题,但可能是由于被注入和/或immunesuppression方案的细胞类型的属性。这些问题需要在经验上的一个细胞类型和动物模型的具体依据评估。免疫缺陷的小鼠和大鼠模型的可用性也可规避与immunesuppression问题,然而,这些动物也存在困难,如成本,维持殖民地的需要,并在手术过程中和房屋所必需的额外谨慎。
功能缺损观 察手术后:在我们的经验,我们没有观察到的前肢和后肢的握力和膈神经/隔膜化合物的肌肉动作电位等措施进行评估时,按照此过程的任何功能缺损的发生,甚至有6注射网站( 2μL每个)在脊髓型颈椎病。组织的破坏也没有被观察到。这些问题的发生可能的原因包括:不使用建议的针规,注入更大的卷和/或手机号码,无意破坏椎板减压不当造成的,缺少的美味佳肴,同时还削减了硬脑膜(如捏#5线钳)或在汉密尔顿针插入脊髓(更换沉闷针)的过程中。
腹侧灰质细胞中未发现:这可能是由于若干问题。如果注射门柱内侧或外侧的目标,确保排队喷射系统并行与脊髓轴,并插入针背根的内侧。如果注射射门偏出背侧或腹侧,确保零的Z轴读数时,针尖是刚刚接触的脊髓背表面,使用适当的斜角(较长的斜面的建议汉密尔顿针可以影响目标),保证脊髓针插入时不压缩,照顾完全使用的显微测量深度,和使用建议的体重范围内的动物。相应的,如果你一直在一个位置注射细胞(这需要组织学评价和后续技术修改),调整你的技术。如果随机分散在所有注射部位注射,您将需要在实践中提高一致性。如果细胞往往是主要位于脊髓背侧沿针道,等待更长的时间之前和之后细胞注射,并延长在一个较长时期的实际注射。
4。代表性的成果:
鼠源性神经胶质祖细胞被移植到成人的SOD1 的 G93A老鼠的脊髓水平的C4腹角(50,000细胞/网站)。鼠源性移植的细胞,通过检测可以区分鼠标特异性抗体,M2的主机大鼠组织。此图像显示了在移植后1个月M2 +移植源性细胞( 见图 12)的生存。腹侧灰质细胞的本地化,但注射部位内侧错过外侧腹角(最膈运动神经元的位置:虚线表示)。被视为没有形成囊肿50,000细胞注入每个站点,并没有从注射过程中的行为减值。然而,注射高得多的细胞数(实际数量根据不同细胞类型,并应系统地评估)结果在注射部位的损伤和沿针轨道( 参见 图 13:与星形胶质细胞标记的免疫组织化学, GFAP) 。
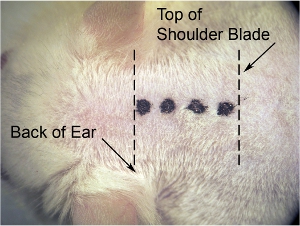
图1。初始的皮肤切口 ,在显微镜的放大倍率最低(我们用8倍的放大倍率),使用手术刀刀片正中切口。横向拉伸皮肤,另一方面使皮肤绷紧(这使得皮肤更容易削减),并从颅底(在耳朵背面的水平)切口(粗虚线表示)肩胛骨(记细虚线)。
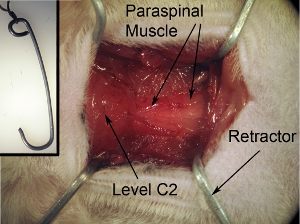
图2。手术暴露术野暴露。应方形/矩形。这种形状可以达到4角落,使用4拉钩拉向周围的肌肉。磁带字符串附加到手术板拉钩,以确保拉钩并妥善保管领域的开放。
图2插图。术野暴露拉钩 ,拉钩拉背部肌肉,为了创造一个外科领域都清晰可见脊髓和足够的空间来进行手术。拉钩可通过塑造成所需的形状和大小的坚固纸夹。高压灭菌前手术拉钩。领带的字符串拉钩。
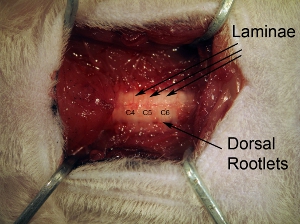
图3。椎骨。以下切除椎旁肌肉,背椎骨表面彻底清洁用咬骨钳。可以看出,个人椎板,以及从侧面脊柱进入背根的。
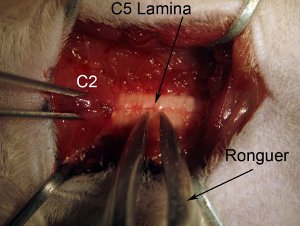
图4。椎板切除术。开始在脊髓水平C5的椎板切除术。安全脊柱肌肉覆盖水平C2与鼠齿钳。抓斗全椎板咬骨钳(见图表:中线附近抢)。位置咬骨钳,使该工具是完全垂直轴脊柱。慢慢粉碎椎板。不要压到脊髓,因为这将导致脊髓组织受损。粉碎和骨向上轻轻一拉断片。咬骨钳应粉碎片,使人们可以轻松地拉开了距离,以消除。如果一块骨头还连着休息的纹层,不拖船,因为这会导致出血,并可能损伤脊髓。咬骨钳应干净,清晰。
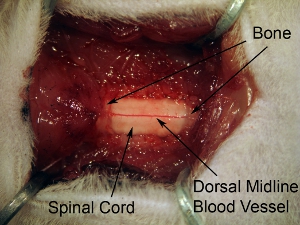
图5。脊髓组织以下椎板切除曝光。扩展椎板切除暴露所有的C4 - C6脊髓。 1在骨超过3脊髓水平的不断开放。不要扩大椎板切除太远横向因为这会引起出血。为了目标腹角,注射部位是相对内侧的,所以它是不必要的扩大椎板切除椎体骨质完整的横向范围。
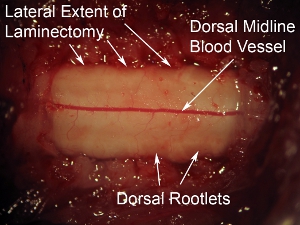
图6。可以看出, 高倍率的脊髓背表面突出的背血管 。脊髓中线运行。在大多数情况下,观察这种血管模式;然而,一些动物显示血管的非中线轨迹。背根的脊髓背表面的横向方面可以看出。相对覆脊髓硬膜,这些神经有一个朦胧的外观。
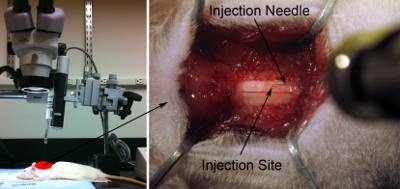
图7。注射设置了注射器/针与轴脊柱正确目标所需的解剖区域平行的线。刚好够针角度(约80度,相对手术表)不磕碰的手术范围头,但尽可能接近尽可能(左图)90度。下注射针尖对脊髓背表面使用显微镜(右图)。轻轻触摸针尖与脊髓表面。稍稍压低与针的线。缩回针,直到脊髓回到正常的平整状态。 Z = 0.0上使用的显微标尺,记录这个位置。
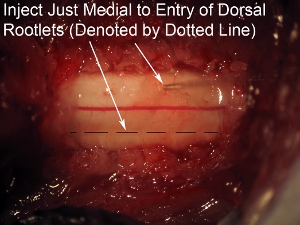
图8。高倍率脊髓针注射目的只是内侧的背根的(虚线表示)进入区。
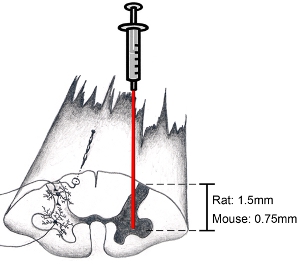
图9。脊髓图:如何定位解剖区域的利益当试图目标腹角,切开硬脑膜平行轴脊柱内侧背根的入口区。这将允许一个目标腹角。下针深度为1.5毫米为目标,在成年大鼠腹角(动物的年龄和性别没有深度上的差异)。下针深度为0.75毫米的目标,在成年小鼠腹角。当然,深度和横向位置取决于特定区域的利益。
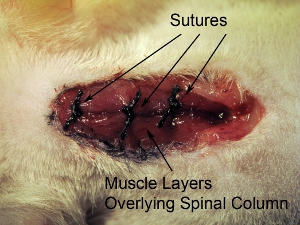
图10。手术部位闭幕。一次用4-0缝线缝合关闭三个覆肌肉层。 3地点在延髓,尾椎轴缝合肌肉。
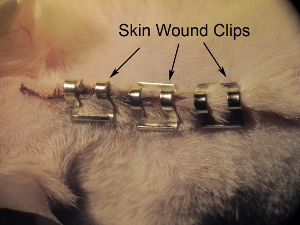
图11。皮肤装订。装订皮肤9.0毫米的伤口剪辑封闭。加强与持针钉书针,以防止动物脱下事先充分伤口愈合的订书钉。空间主食约0.5毫米。
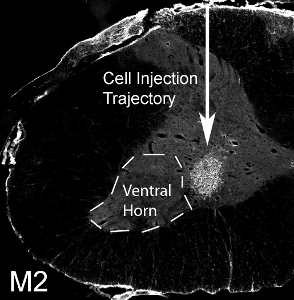
图12。到颈腹角神经胶质祖细胞移植50,000鼠源性神经胶质祖细胞被移植到腹角的SOD1 的 G93A老鼠的脊髓水平的C4。 M2 +鼠源性细胞移植存活1个月后移植。本地化的细胞向腹侧的灰质,但注射部位内侧错过外侧腹角(记虚线)。
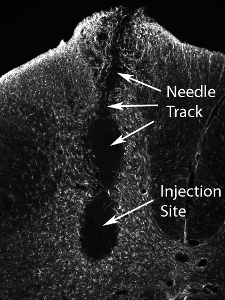
图13。组织损伤移植后高的数字神经前体细胞注射高得多的细胞数(实际数量根据不同细胞类型,并应系统地评估)结果在注射部位的损伤和沿针道。
讨论
研究涉及的SOD1 G93A小鼠和大鼠,年龄和性别匹配的一组内的动物,和分发不同群体的同一窝内的动物。最好是使用ALS和SCI模型相同性别的所有动物,因为疾病的进程可能男性和女性之间有所不同,但是,它也可能是有用的男女双方有足够的动物,以检测出可能特定性别的影响,这一现象已报道G93A SOD1的老鼠13和G93A SOD1的老鼠14,15。考虑细胞移植到动物的年?...
披露声明
没有利益冲突的声明。
致谢
我想感谢:莱波雷的所有成员,Maragakis和罗斯坦有益的讨论实验室;美国和克雷格H.尼尔森基金会拨款瘫痪退伍军人。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 的HBSS | Gibco公司 | 14170 | |
| 0.05%胰蛋白酶 | Gibco公司 | 25300 | |
| 大豆胰蛋白酶抑制剂(可选) | 西格玛 | T - 6522 | |
| Acepromazine马来酸(0.7毫克/公斤) | 发酵动物健康 | ||
| 氯胺酮(95毫克/公斤) | 道奇堡动物健康 | ||
| 甲苯噻嗪(10毫克/公斤) | 拜耳 | ||
| #11羽手术刀片 | 电子显微镜科学 | 72044-11 | |
| 棉签涂药(6英寸) | 费舍尔 | 23-400-101 | |
| 鼠有齿镊 | 精细科学的工具 | 鼠:11023-15; 鼠标:11042-08 | |
| 中型弹簧剪刀 | 精细科学的工具 | 15012-12 | |
| 微型弹簧剪刀 | 精细科学的工具 | 15000-10 | |
| 咬骨钳 | 精细科学的工具 | 鼠:16121-14; 鼠标:16221-14 | |
| Microknife | 精细科学的工具 | 10056-12 | |
| 持针 | 精细科学的工具 | 12502-14 | |
| 缝合:4-0 | 薇乔 | S - 183 | |
| 主食:9毫米 | Autoclip | 427631 | |
| 订书机:9毫米(#203-1000反射) | 世界精密仪器 | 5000344 | |
| 暖水泵(T /泵) | Gaymar | P / ñ 07999-000 | |
| 环孢素A:250.0 mg/5.0毫升安瓿 | 诺华/ Sandimmune | NDC 0078-0109-01 | |
| FK - 506 | 立法会实验室 | F - 4900 | |
| 雷帕霉素 | 立法会实验室 | R - 5000 | |
| 注射器 | 世界精密仪器 | UMP2 | |
| 微型4 Microsyringe泵控制器 | 世界精密仪器 | UMC4 | |
| 微操作机器人 | 世界精密仪器 | 风筝 - R | |
| 10.0微升汉密尔顿注射器 | 汉密尔顿 | 80030 | |
| 汉密尔顿针:33号,45 °斜角,1英寸 | 汉密尔顿 | 7803-05 | |
| 玻璃20.0μLmicrocapillary移液器(可选) | 金布尔 | 71900-20 |
参考文献
- Lane, M. A., Fuller, D. D., White, T. E. Respiratory recovery following high cervical hemisection. Trends in neurosciences. 31, 538-538 (2008).
- Kaplan, L. M., Hollander, D. Respiratory dysfunction in amyotrophic lateral sclerosis. Clin. Chest. Med. 15, 675-675 (1994).
- Miller, R. G., Rosenberg, J. A., Gelinas, D. F. Practice parameter: the care of the patient with amyotrophic lateral sclerosis (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology: ALS Practice Parameters Task Force. Neurology. 52, 1311-1323 (1999).
- Mitsumoto, H., Chad, D. A., Pioro, E. P., Davis, F. A. . Amyotrophic lateral sclerosis. , (1998).
- Tandan, R., Bradley, W. G. Amyotrophic leteral sclerosis: Part 2. Etiopathogenesis. Annals of neurology. 18, 419-419 (1985).
- Bruijn, L. I., Miller, T. M., Cleveland, D. W. Unraveling the mechanisms involved in motor neuron degeneration in ALS. Annu Rev Neurosci. 27, 723-723 (2004).
- Rosen, D. R., Siddique, T., Patterson, D. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 362, 59-59 (1993).
- Bruijn, L. I., Becher, M. W., Lee, M. K. ALS-linked SOD1 mutant G85R mediates damage to astrocytes and promotes rapidly progressive disease with SOD1-containing inclusions. Neuron. 18, 327-327 (1997).
- Gurney, M. E., Pu, H., Chiu, A. Y. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264, 1772-1775 (1994).
- Howland, D. S., Liu, J., She, Y. Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS). Proc Natl Acad Sci. 99, 1604-1604 (2002).
- Nagai, M., Aoki, M., Miyoshi, I. Rats expressing human cytosolic copper-zinc superoxide dismutase transgenes with amyotrophic lateral sclerosis: associated mutations develop motor neuron disease. J. Neurosci. 21, 9246-9246 (2001).
- McDonald, W., Becker, D. Spinal cord injury: promising interventions and realistic goals. Am. J. Phys. Med. Rehabi. I82, S38-S38 (2003).
- Sandrow-Feinberg, H. R., Zhukareva, V., Santi, L. PEGylated interferon-beta modulates the acute inflammatory response and recovery when combined with forced exercise following cervical spinal contusion injury. Experimental neurology. 223, 439-451 (2010).
- Gage, F. H. Mammalian neural stem cells. Science. 287, 1433-1433 (2000).
- Lane, M. A., Lee, K. Z., Fuller, D. D. Spinal circuitry and respiratory recovery following spinal cord injury. Respiratory physiology & neurobiology. 169, 123-123 (2009).
- Lepore, A. C., Rauck, B., Dejea, C. Focal transplantation-based astrocyte replacement is neuroprotective in a model of motor neuron disease. Nature. 11, 1294-1294 (2008).
- Rao, M. S. Multipotent and Restricted Precursors in the Central Nervous System. Anat Rec. 257, 137-137 (1999).
- Rao, M. S., Mayer-Proschel, M. Glial- restricted precursors are derived from multipotent neuroepithelial stem cells. Dev Biol. 188, 48-48 (1997).
- Suzuki, M., Tork, C., Shelley, B. Sexual dimorphism in disease onset and progression of a rat model of ALS. Sexual dimorphism in disease onset and progression of a rat model of ALS. Amyotroph Lateral Scler. 8, 20-20 (2007).
- Lepore, A. C., Haenggeli, C., Gasmi, M. Intraparenchymal spinal cord delivery of adeno-associated virus IGF-1 is protective in the SOD1G93A model of ALS. Brain research. 1185, 256-256 (2007).
- Veldink, J. H., Bar, P. R., Joosten, E. A. Sexual differences in onset of disease and response to exercise in a transgenic model of ALS. Neuromuscul Disord. 13, 737-737 (2003).
- Shumsky, J. S., Lepore, A. C. Transplantation of Neuronal and Glial Restricted Precursors into Contused Spinal Cord Improves Bladder and Motor Functions, Decreases Thermal Hypersensitivity, and Modifies Intraspinal Circuitry. J. Neurosci. 25, 9624-9624 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。