É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Intra Transplante de Células de Segmentação Chifre Cervical Ventral em Esclerose Lateral Amiotrófica e lesão medular traumática
Neste Artigo
Resumo
Transplante precursoras neurais é uma estratégia promissora para a proteção e / ou substituição perdido / cervical disfuncional neurônios motores frênicos em lesão medular (SCI) e do neurônio motor doença, a esclerose amiotrófica laterais (ALS). Nós fornecemos um protocolo para entrega celular para chifre da medula espinhal cervical ventral em modelos de roedores da ALS e SCI.
Resumo
Comprometimento respiratório devido à perda de neurônio motor frênico é uma conseqüência debilitantes de uma grande proporção de lesão da medula espinhal humana traumático (SCI) casos 1 e é a causa final da morte em pacientes com a doença do neurônio motor, esclerose amiotrófica laterais (ALS) 2.
ALS é uma doença devastadora neurológico que se caracteriza pela degeneração relativamente rápida de letras maiúsculas e neurônios motores inferiores. Pacientes finalmente sucumbir à doença, em média, 2-5 anos após o diagnóstico devido à paralisia respiratória devido à perda de innnervation frênico do neurônio motor do diafragma 3. A grande maioria dos casos são esporádicos, enquanto 10% são da forma familiar. Cerca de vinte por cento de casos familiares estão ligados a várias mutações pontuais no gene Cu / Zn superóxido dismutase 1 (SOD1) no cromossomo 21 4. Camundongos transgênicos e ratos 4,5 6 carregando humana mutante SOD1 genes (G93A, G37R, G86R, G85R) foram gerados, e, apesar da existência de outros modelos animais de perda de neurônios motores, são atualmente os modelos mais altamente utilizado da doença .
Lesão da medula espinal (SCI) é um conjunto heterogêneo de condições resultantes de trauma físico para a medula espinhal, com resultado funcional variando de acordo com o tipo, localização e gravidade da lesão 7. No entanto, aproximadamente metade dos casos humanos SCI afetar regiões cervical, resultando em disfunção respiratória debilitante devido à perda frênico neurônio motor e ferimentos descendente axônios respiratórias bulbo-espinal 1. Uma série de modelos animais de SCI têm sido desenvolvidas, com os mais comumente utilizados e clinicamente relevante é a contusão 8.
Transplante de várias classes de células precursoras neurais (NPCs) é uma promissora estratégia terapêutica para o tratamento de lesões traumáticas do SNC e neurodegeneração, incluindo ALS e SCI, por causa da capacidade de substituir neuroproteção perdido ou disfuncional tipos de células do SNC, fornecer, entregar e fatores genéticos de interesse 9.
Modelos animais de ambos os ALS e SCI pode modelar muitos aspectos clinicamente relevantes dessas doenças, incluindo a perda do neurônio motor frênico e conseqüente comprometimento respiratório 10,11. , A fim de avaliar a eficácia da NPC estratégias baseadas na função respiratória nestes modelos animais de ALS e SCI, as intervenções de celulares deve ser especificamente direcionada para regiões que contêm alvos terapêuticos relevantes, tais como os neurônios motores frênico. Nós fornecemos um protocolo detalhado para multi-segmentar transplante, intraspinal de NPCs para o assunto da coluna cervical ventral cabo cinza de modelos neurodegenerativas, como ratos SOD1 G93A e ratos, assim como os ratos com lesão medular e camundongos 11.
Protocolo
Métodos
1. Preparação de células
Como exemplo, vamos descrever o procedimento para a preparação de células progenitoras gliais 12 para transplante por causa da nossa experiência com este tipo de célula. No entanto, as especificidades do protocolo, incluindo médio e uso de tripsina, por exemplo, vai depender do tipo particular de célula a ser utilizado para transplante.
- Pré-aquecer todas as soluções para 37,0 ° C em banho-maria.
- Enxágüe 2X frasco com HBSS. Adicionar 5,0 mL/T-75 frasco de 0,05% Tripsina / EDTA. Incubar frasco por 3 minutos em 37,0 ° C incubadora. Triturar 3X delicadamente em frasco com 5 ou pipeta de 10 mL.
Opcional: Adicionar 5,0 mL/T-75 frasco de 1,0 mg / ml inibidor de tripsina de soja no DMEM/F12.
- Enxaguar cada frasco 2X em 5,0 mL de meio. Células piscina e lavagens. Manter as células no gelo durante todas as etapas subseqüentes.
- Giram em 200-300 g por 5 minutos em tubo cônico: de preferência em centrífuga refrigerados a 4 ° C. Decantar o sobrenadante (e salvar). Re-suspender as células em 1,0 mL de meio, e transferir para tubo Eppendorf 1,5 mL.
- Contagem de células com hemocitômetro utilizando Trypan Blue para determinar a viabilidade.
- Girar novamente em 1,5 mL de tubo (800 RPM por 10 minutos: de preferência em centrífuga refrigerados a 4 ° C). Decantar o sobrenadante (e salvar).
- Re-suspender as células desejadas volume final de meio para alcançar densidade celular adequada.
- Distribuir suspensões de células para vários tubos de 1,5 mL Eppendorf. Manter as células no gelo molhado até o transplante.
Não use tubos de 0,75 mL, como a seringa Hamilton / agulha não pode caber profundamente neste tubo. Múltiplas injeções provavelmente será feito durante as sessões de cirurgia, e se quer evitar a perturbação do mesmo tubo de células muitas vezes. Tente preparar volume de pelo menos 50% a mais de suspensão de células do que o necessário. Manter as células no gelo durante toda a sessão a cirurgia. Transplante de células dentro de 4-5 horas de preparação de suspensões de células, a fim de assegurar maior viabilidade das células pós-transplante.
2. A preparação prévia à cirurgia
- Realizar avaliações comportamento relevante de base antes da cirurgia.
- Supressão imunológica: ciclosporina por via subcutânea A (CSA: 10,0 mg / kg de peso corporal) ou intraperitoneal (IP) FK-506/Rapamycin (1,0 mg / kg de peso corporal) deve ser iniciado pelo menos 3 dias antes do transplante, e deve ser administrada diariamente, até o sacrifício. Administração na água de beber (em vez de injeções diárias) não é aconselhável. CSA é o nosso imunossupressor de escolha ao transplantar células derivadas de roedores, enquanto FK-506/Rapamycin é a nossa escolha quando transplantar células de origem humana.
- Autoclave instrumentos cirúrgicos antes da cirurgia. Prepare um lugar limpo e arrumado para fazer a cirurgia, bem como um local organizado para colocar ferramentas. Um esterilizador de bolas de gude também é útil. Manter todas as ferramentas de limpeza (especialmente rongeur) durante a cirurgia, pois isso irá tornar o processo muito mais fácil. Qualquer material utilizado durante o procedimento cirúrgico deve ser estéril.
- Instrumentos que não podem ser esterilizados, como o microscópio cirúrgico deve ser limpo com um desinfectante apropriado e as alças cobertas com material estéril (gaze, por exemplo) para que o cirurgião, uma vez que vestiu com luvas estéreis, não contamina his / her luvas.
- O cirurgião deve lavar o / as mãos com um desinfetante (matagal clorexidina) antes de iniciar a cirurgia. O cirurgião irá usar luvas estéreis, uma máscara e um vestido limpo.
3. Cirurgia: Preparação e Cirurgia Animal
Animais Prep:
- Pesar animal, e administrar dose adequada de anestesia: anestesia inalatória isofluorano ou cocktail (entregue via IP) de [maleato de acepromazina (0,7 mg / kg), ketamina (95 mg / kg) e xilazina (10 mg / kg)].
- Toe pitada e / ou utilizar o reflexo palpebral (tocar a pálpebra superior com algodão ponta do aplicador para observar a piscar) para determinar se o animal está devidamente anestesiados. As córneas devem ser protegidos através da aplicação de uma pomada lágrima artificial antes da cirurgia.
- Raspar o cabelo para trás com o barbeador elétrico (sem apego necessário). Shave de pouco rostral para os ouvidos para o meio das costas do animal. Shave bem, e remover o cabelo cortado de pele para impedir que o cabelo entrar em incisão. A preparação cirúrgica deve ser realizada longe da área onde a cirurgia será realizada para evitar a contaminação do sítio cirúrgico com o cabelo perdido.
- Embeba uma gaze com Iodo-Povidine solução anti-séptica, e aplicar na pele sobre a área depilada. O local da cirurgia deve ser limpo pelo menos duas vezes com a solução de iodo-Povidine, tomando cuidado de esfregar a partir do centro do local em direção à periferia. O site pode ser lavado com álcool 70% ou esfregar germicida diluído. A área deve ser coberta com campos estéreis.
- Durante toda a cirurgia, o uso de uma almofada de aquecimento is altamente recomendado para manter a temperatura corporal do animal normal. Além disso, a temperatura corporal deve ser monitorada. Coloque o animal em gaze enrolada. Para um rato adulto, a gaze deve ser rolado ~ polegadas 1,0 de espessura e 6,0 ~ centímetros de comprimento. Pad fita esta a bordo de uma cirurgia para que ela não se move. Coloque o animal na almofada ao nível do peito / ombro. Esticar os braços na almofada, e fita as armas a bordo de cirurgia. A idéia é sustentar a medula espinhal cervical de modo que é mais fácil de trabalhar durante toda a cirurgia desde a medula cervical é encontrado profundidade abaixo da superfície da pele.
Cirurgia:
- Sobre a ampliação menor microscópio (usamos 8 x de ampliação), use lâmina de bisturi para fazer incisão mediana. O estiramento da pele lateralmente com outra mão para fazer a pele esticada (o que torna a pele mais fácil inciso), e fazer a incisão da base do crânio, escápula. (Ver Figura 1)
- Use lâmina de bisturi para fazer a incisão através de 3 camadas musculares sobre a coluna vertebral. Ligeiramente espremer o músculo (de lateral para medial) em ambos os lados com a outra mão. Não esqueça de pressionar firmemente o suficiente com bisturi para cortar todas as camadas musculares com o menor número de cortes possível, para que incisões muscular não será irregulares, o que torna a sutura no final da cirurgia mais fácil. No entanto, não pressione muito firmemente para evitar provocar danos em tecidos mais profundos (coluna vertebral).
- Com dois aplicadores com ponta de algodão, use movimento de torção para separar muscular sobrejacente da musculatura paravertebral. Um pode ser vigorosa aqui. Não corte ou rasgue, pois isso irá causar hemorragia. Torcendo movimento com os aplicadores serão muito bem provocar o tecido distante, sem causar danos ou hemorragia. Se a hemorragia ocorre em qualquer fase da cirurgia, o melhor é ser paciente. Não tente apressar em frente com muita hemorragia, porque o sangue vai obscura visão do campo cirúrgico. Cauterização ou uma leve pressão pode ser aplicada para o local da hemorragia, mas nós achamos que a paciência é o melhor. Com a prática, deve haver pouca ou nenhuma hemorragia durante a cirurgia.
- Retrair muscular com 4 afastadores de caseiro (ver figura 2). Estes retratores podem ser feitas de paperclips resistente moldado em um afastador (ver Figura 2-inset). Autoclave estes antes da cirurgia. Cuidados devem ser tomados para amenizar os confins da retratores para evitar danos aos tecidos. Tie string para afastador. Exposição deve ser quadrado / retângulo em forma. Esta forma pode ser alcançado puxando a 4 cantos com os 4 afastadores. Cadeia de fita para embarcar a fim de garantir retratores (ver Figura 2). Comercialmente disponíveis retratores também pode ser usado, mas preferimos não usar esses. É crucial para criar um bom campo cirúrgico, a fim de ver claramente toda a cirurgia. Não "às cegas" continuar junto.
- Musculatura paravertebral clara a partir da superfície dorsal da coluna vertebral. Para lidar com musculatura paravertebral na superfície dorsal da coluna vertebral, há duas estratégias possíveis. Para a primeira estratégia, use rat-toothed pinças e tesouras médias primavera para remover da musculatura paravertebral da superfície dorsal de vértebras. Tente fazer cortes muito perto do osso para melhor expor a superfície óssea. Faça cortes paralelos à superfície de vértebras, mas não cortadas em fio. Para a segunda abordagem, fazer uma incisão mediana no para-espinhal, músculo e retrai lateralmente com afastadores de menores. Na segunda abordagem, o músculo pode então ser suturado de volta junto após a cirurgia.
- Superfície limpa de osso vertebral bem. Use rongeur (o mais importante instrumento cirúrgico) a se afastar do músculo em relação aos níveis C4, C5 e C6 (ver Figura 3). Isso, é claro, depende dos níveis da coluna vertebral que são alvo. Enquanto estiver usando rongeur com uma mão, segura coluna vertebral inteira segurando musculares sobre o processo C2 com ratos de dentes fórceps no outro lado. C2 é o grande processo rostral no campo cirúrgico. C3 é um pouco sob o músculo também. C4, C5 e C6 são de fácil acesso, porque eles têm pouco músculo sobrejacente-los.
- Comece com laminectomia de C5. Mais uma vez, segura, segurando C2 com ratos de dentes fórceps. Agarre lâmina inteira (veja o diagrama: agarrar perto da linha média) com rongeur. Rongeur posição de modo que ferramenta é totalmente perpendicular ao eixo da coluna vertebral. Lentamente esmagar lâmina. Não empurre para dentro da medula espinhal, isto pode causar danos ao tecido espinhal. Esmagar e puxe pedaço quebrado de cima do osso. Rongeur deve esmagar parte de modo que pode-se facilmente se afastar para remover. Se pedaço de osso ainda está ligado ao resto da lâmina, não puxão isto pode causar hemorragia e lesão da medula espinhal possível. Rongeur devem estar limpas e nítidas. Instrumentos como o rongeur deve ser lavado / limpo com soro fisiológico, que pode ser fornecido em um recipiente estéril (ver Figura 4).
Para a abertura inicial da laminectomia, o posicionamento da perpendi rongeurperpendicular à coluna vertebral é preferível. Esta etapa pode ser seguido por tomar pequenas "mordidelas" para estender a laminectomia, inserindo o rongeur suavemente sob o osso com um ângulo de cerca de 30-60 em relação à superfície do cordão umbilical. - Estender a todos laminectomia C4-C6 lâminas. Fazer uma abertura contínua no osso ao longo de três níveis da coluna vertebral. A extensão da laminectomia pode ser ajustada com base na localização desejada (s) de injeção intra.
- Não se estendem laminectomia muito lateralmente, porque isso irá causar hemorragia. A fim de orientar chifre ventral, o local da injeção é relativamente medial, por isso é desnecessário alargar laminectomia muito lateralmente. (Ver Figura 5)
- Aumentar a ampliação para ~ 15 x.
- Limpar o tecido conjuntivo (e sangue seco possível) no topo da dura com uma pinça afiada / hetero # 5. A diferença entre o tecido conjuntivo e dura precisa ser aprendido com a experiência.
- Inciso dura, uma camada muito dura meníngea, com um mini-mola-tesoura ou microknife. Fazer incisão paralela ao eixo da coluna vertebral apenas medial para a zona de entrada do rootlets dorsal. Isso permitirá que um alvo para o chifre ventral. (Ver Figura 6)
- Use afiada / hetero # 5 pinça para agarrar e levantar um pouco dura fora da medula espinhal. Não aperte / ferir medula espinhal. Isso leva um pouco de prática. Fazer incisões com uma tesoura primavera microknife ou muito pequenos. Não ferir medula espinhal.
- Estender incisão ligeiramente em rostral-caudal do eixo. Tensão da dura vai um pouco dura separadas para criar uma boa exposição da medula espinhal.
- Fazer incisões em todos os locais apropriados para cada injeção pretendido. Dura tem uma aparência translúcida nebuloso, enquanto a superfície medular tem um aspecto mais brilhante de cor branca. Teremos de aprender a distinguir esses pedaços. É aconselhável não tentar injectar através da dura-máter com a agulha de injeção. A dura é resistente, de modo que será difícil de perfurar através dele. Além disso, perfuram a dura-máter pode afetar a trajetória de inserção da agulha e, portanto, afetar a entrega anatomicamente alvo de células.
- Injetar células bilateralmente em 3 níveis (6 lugares no total) para atingir grande região do alargamento cervical. O número ea localização (s) de injeções, é claro, depende da experiência específica.
- Depois de perfuração dura, líquido cefalorraquidiano derramará. Superfície seca de cabo e exposição inteira com gaze ou algodão com ponta do aplicador.
- Para injeção de células, use 10.0μL Hamilton estanques RN seringa.
- Anexar calibre 33 / 45 graus de metal recortado RN agulha Hamilton. A agulha deve ser afiada. Use a mesma agulha por apenas ~ 20 injeções (a agulha será mais nítida com injeções menos). Pode-se usar tubos de vidro puxado capilar para agulhas. Use epóxi para fixar a ponta de vidro puxado a 26-gauge agulha de metal blunt Hamilton. Guarnição diâmetro da ponta exterior para ~ mL 75,0-100,0 (dependendo do diâmetro das células: um não quer danificar as células durante o processo de injeção), utilizando um microscópio cirúrgico e micrómetro. Nós preferimos as agulhas de calibre 33 metal.
- Células vão cair de suspensão facilmente no interior do tubo Eppendorf no gelo. Imediatamente antes de carregar a seringa de injeção, bata suavemente tubo até células voltar para suspensão. Não agite muito intensamente quanto isso vai prejudicar as células e / ou bolhas de causa. Alternativamente, use pipeta 20.0μL homem-a delicadamente mix células: pipeta suspensão celular apenas uma ou duas vezes para cima e para baixo.
- Carga de volume suficiente de suspensão celular por apenas um local da injeção. Células vão cair dentro de suspensão seringa se planeja fazer várias injeções. Lentamente, levar até as células para a seringa para evitar bolhas e / ou danos às células. Especificamente para as células progenitoras gliais que nós trabalhamos com no nosso laboratório, injetar 2,0 mL de suspensão de células em uma diluição de 50,000-75,000 células por 1,0 mL em 2-5 minutos. Descobrimos que 2uL/site não resulta em danos aos tecidos da medula espinhal cervical. Em vez disso, nossa experiência sugere que aumentando o número de células, neste volume (principalmente se eles são maiores em tamanho do que nossos progenitores gliais: 10,0 -20,0 m de diâmetro) pode causar danos ao parênquima da medula espinhal. Realizamos um experimento de dosagem extensa celular para determinar o número ideal de células para injetar em cada local (pelo menos na medula cervical intacta espinhal). Os parâmetros devem ser determinados para o tipo específico de célula e condição da doença.
- Line up seringa / agulha paralela ao eixo da coluna vertebral corretamente alvo desejado região anatômica. A agulha é angulado apenas o suficiente (aproximadamente 80 graus em relação à mesa cirúrgica) para não bater a cabeça âmbito cirúrgico, mas o mais próximo possível de 90 graus possível. Inferior da ponta em direção à superfície da medula espinhal dorsal usando microscópio (ver Figura 7).
- Agulha objetivo apenas medial à entrada zone de radículas dorsal (ver Figura 8). Toque suavemente superfície da medula espinhal com ponta de agulha. Deprimem um pouco da medula espinhal com agulha. Retrair agulha até medula espinhal está de volta ao normal. Gravar esta posição como o z = 0.0 usando a régua sobre o micromanipulador.
Nota: Nós não rotineiramente estabilizar a coluna vertebral cervical durante injeções na medula espinhal. Usando o nosso esquema anestésico, o movimento para cima e para baixo da medula espinhal cervical devido à respiração pesada nunca foi um problema. No entanto, se a respiração pesada é um problema, a coluna vertebral pode ser estabilizado através de um quadro personalizado por gentilmente fixação do osso e envolvente para-espinhal muscular em níveis C2 e C7 com a pinça modificada, tomando cuidado para não esmagar o osso vertebral ou ferir a subjacentes do tecido da medula espinhal. Se a respiração do animal se torna superficial durante o procedimento, droga mais anestésico deve ser fornecido. A cirurgia deve ser interrompido até que um plano cirúrgico de anestesia foi re-alcançado antes de retomar. - Agulha ligeiramente inferior em medula espinhal. Certifique-se de olhar no microscópio ao fazer isto. Menor agulha a uma profundidade de 1,5 mm a meta chifre ventral em ratos adultos. Menor agulha a uma profundidade de 0,75 mm a meta chifre ventral em ratos adultos. (Ver Figura 9). Estes números de profundidade são representativas de adultos (pelo menos 3 meses de idade) do sexo feminino e masculino Sprague-Dawley (250-450 g) e camundongos C57BL / 6 (20-35 gramas). É claro, profundidade e posição lateral dependem da região específica de interesse. Não perturbe bordo sistema de injeção / cirurgia ou mesa de cirurgia enquanto agulha é introduzida na medula espinhal para evitar danos ao tecido espinhal.
- Aguarde dois minutos (mais é melhor ainda) depois de abaixar a agulha a uma profundidade desejada antes da injeção.
- Injetar 2,0 mL mais 2-5 minutos a uma taxa constante usando o controlador da bomba.
- Aguarde dois minutos (mais é melhor) após a injeção antes de lentamente retirar a agulha da medula espinhal.
- Seringa limpa com dH2O após cada injecção para evitar entupimento. Lentamente, elaborar e expulsar 3-5 vezes. Não puxar ar para dentro da seringa.
- Retornar à ampliação menor (o mesmo que usou no início da cirurgia: ~ 8 x). Sutura dura fechada com sutura 9-0, mas isso definitivamente não é necessário. É também um desafio. Nós suturada dura fechados no passado, mas não encontramos nenhuma diferença no comportamento animal, a sobrevivência de transplante ou histologia da medula espinhal, quando a dura não é fechada com sutura. A dura-máter pode ser coberto com um pedaço de espuma de proteção gel estéril. A espuma de gel deve ser colocado diretamente em cima do local da incisão dural. No entanto, é importante tomar cuidado em não puxar abruptamente este pedaço de gelfoam fora da superfície da medula espinhal durante o pós-perfusão dissecção, como o gelfoam às vezes pode firmemente aderem à superfície da medula espinhal.
- Opcional: Sutura da musculatura paravertebral fechada com sutura 4-0.
- Sutura fechada três camadas musculares sobrepostas ao mesmo tempo com sutura 4-0. Músculos de sutura em três locais no eixo rostral-caudal (ver Figura 10).
- Pele grampo fechado com 9,0 milímetros clips ferida (ver Figura 11). Aperte os grampos com porta-agulhas para prevenir animal de retirar grampos antes da cicatrização completa. Espaço grampos aproximadamente 0,5 cm de distância. Não aperte demais os clipes de feridas, como isso pode levar a cicatrização e necrose.
- Aplicar Iodo-Povidine solução anti-séptica para ferir área com gaze embebida.
- Permitem animais para recuperar circulando pad água morna. Dê sub-cutânea injeção de solução Ringer Lactato estéril de (5,0 mL de rato, 0,5 mL de mouse) imediatamente após a cirurgia. Follow-up injeções também podem ser fornecidos se o animal aparece desidratadas e / ou apático. Tratamento antibiótico profilático com 6.0mg/kg de cefazolina pode ser usada, no entanto, nossa experiência sugere que este procedimento de transplante não resulta em infecções pós-cirúrgicas, se técnica asséptica é seguido e todos os instrumentos / materiais cirúrgicos são esterilizados. Se estas precauções forem seguidas, a administração de antibióticos é desencorajado.
- Continue CSA ou FK-506/Rapamycin diariamente até o sacrifício.
- Toda a cirurgia deve levar menos de ~ 45 minutos (com 6 locais de injecção). Caso contrário, o animal começa a acordar e respirar mais fortemente, o que afetará negativamente injeção em medula espinhal.
Dicas de solução de problemas associados com as várias etapas do Protocolo
Falta de sobrevivência da célula / pobres: Este não é provável que um problema técnico associado com a injeção, mas é provavelmente devido às propriedades do tipo de célula que está sendo injetado e / ou ao regime de imunossupressão. Essas questões precisam ser avaliadas empiricamente em uma célula de tipo e com base em modelo animal específico. A disponibilidade de um número de modelos de imuno-deficientes ratos e camundongostambém estão disponíveis para contornar problemas com imunossupressão, no entanto, estes animais também apresentam dificuldades, tais como custo, a necessidade de manter uma colônia, e cautela adicional necessário durante a cirurgia e habitação.
Déficits funcionais observados após a cirurgia: Em nossa experiência, não observamos a ocorrência de qualquer déficit funcional após este procedimento quando avaliada por medidas como membro anterior e força de preensão dos membros posteriores e nervo frênico / diafragma compostos potenciais de ação muscular, mesmo com injeções de 6 locais ( de 2μL) cada na medula espinhal cervical. Destruição dos tecidos também não foi observado. Possíveis razões para a ocorrência destes problemas são: não usar o calibre da agulha sugeriu, injetando volumes maiores e / ou números de celular, os danos não intencionais causados por laminectomia inadequada, falta de delicadeza ao cortar a dura-máter (tais como a compressão da medula com o # 5 fórceps) ou durante o processo de inserção da agulha Hamilton para a medula espinhal (substitua uma agulha maçante).
Células não encontrado na substância cinzenta ventral: Isso pode ser devido a uma série de questões. Se a injecção falha o alvo medial ou lateralmente, certifique-se de alinhar corretamente o sistema de injeção paralelo com o eixo da medula espinhal, e inserir a agulha apenas medial à entrada da rootlets dorsal. Se a injecção falha o alvo dorsalmente ou ventralmente, certifique-se a zero sua leitura eixo z quando a ponta da agulha é apenas tocando a superfície dorsal da medula espinhal, use a agulha sugerida Hamilton com o bisel apropriadas (a mais de bisel pode afetar targeting), assegurar que a medula espinhal não comprimir ao inserir a agulha, tome cuidado, exatamente a medida da profundidade usando o micromanipulador, e usar animais dentro da faixa de peso sugeridas. Ajustar a sua técnica de acordo, se você está constantemente injetando as células em um local (o que requer avaliação histológica ea modificação técnica subsequentes). Se as injeções são aleatoriamente espalhados em todos os seus locais de injecção, você precisa praticar para melhorar a consistência. Se as células tendem a ser localizadas principalmente no aspecto dorsal da medula espinhal ao longo da pista de agulha, esperar mais tempo antes e depois da injeção de células, e estender a injeção de reais durante um longo período de tempo.
4. Resultados representativos:
Mouse-derivados de células progenitoras gliais foram transplantadas (50.000 células / site) no corno ventral da medula espinhal C4 nível em um adulto de ratos SOD1 G93A. Mouse-derivado células transplantadas podem ser distinguidos a partir de tecido de ratos host via detecção de anticorpos com o mouse específico, M2. Esta imagem mostra a sobrevivência da M2 + transplante de células derivadas de um mês pós-transplante (ver Figura 12). As células localizadas na substância cinzenta ventral, mas o local da injeção medialmente perdeu o corno lateral ventral (a localização da maioria dos neurônios motores frênicos: denotada pela linha pontilhada). Sem formação de cistos foi observado quando 50.000 células foram injetadas por site, e sem comprometimento do comportamento resultou do procedimento de injeção. No entanto, a injeção de um número muito maior de células (o número real varia de acordo com tipo de célula, e devem ser sistematicamente avaliados) resulta em danos no local da injeção e ao longo da faixa de agulha (ver Figura 13: imuno-histoquímica com o marcador de astrócitos, GFAP) .
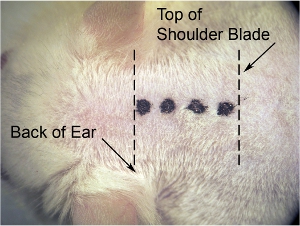
Figura 1. Incisão inicial de pele. Na ampliação menor microscópio (usamos 8 x de ampliação), use lâmina de bisturi para fazer incisão mediana. O estiramento da pele lateralmente com outra mão para fazer a pele esticada (o que torna a pele mais fácil de cortar), e fazer a incisão (denotado por linha pontilhada grossa), da base do crânio (ao nível da parte de trás das orelhas) que a escápula (denotado pela linha pontilhada fina).
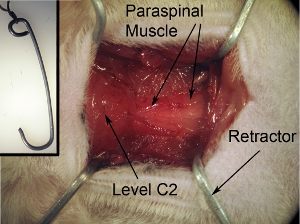
Figura 2. Exposição do campo cirúrgico. A exposição cirúrgica deve ser quadrado / retângulo em forma. Esta forma pode ser alcançado puxando o músculo volta para 4 cantos com os 4 afastadores. Cadeia de fita que está anexado a retratores para embarcar cirúrgica a fim de garantir afastadores e manter adequadamente campo aberto.
Figura 2-inset. Afastadores para exposição do campo cirúrgico. Os afastadores são usados para puxar para trás muscular, a fim de criar um campo cirúrgico com a visibilidade clara da medula espinhal e espaço adequado para realizar a cirurgia. Retratores podem ser feitas por meio da formulação paperclips resistente na forma desejada e tamanho. Autoclave os afastadores antes da cirurgia. Tie string para afastador.
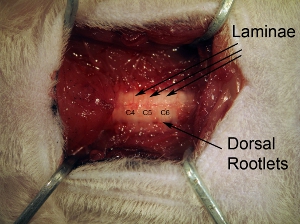
Figura3. Vértebras remoção. Sequência da musculatura paravertebral, limpe superfície dorsal de vértebras com rongeur. Lâmina individuais podem ser vistos, bem como radículas dorsais entrando do aspecto lateral da coluna vertebral.
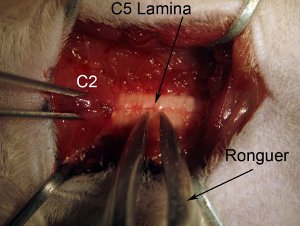
Figura 4. Laminectomia. Iniciar laminectomia na medula espinhal nível C5. Coluna vertebral segura, segurando muscular sobrejacente nível C2 com uma pinça dentada de ratos. Agarre lâmina inteira (veja o diagrama: agarrar perto da linha média) com rongeur. Rongeur posição de modo que ferramenta é totalmente perpendicular ao eixo da coluna vertebral. Lentamente esmagar lâmina. Não empurre para dentro da medula espinhal, isto pode causar danos ao tecido espinhal. Esmagar e puxe pedaço quebrado de cima do osso. Rongeur deve esmagar parte de modo que pode-se facilmente se afastar para remover. Se pedaço de osso ainda está ligado ao resto da lâmina, não puxão isto pode causar hemorragia e possível lesão de medula espinhal. Rongeur devem estar limpas e nítidas.
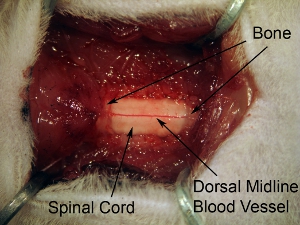
Figura 5. Exposição de laminectomia espinal medula seguintes tecidos. Extend laminectomia para expor toda a C4-C6 medula espinhal. Fazer uma abertura contínua no osso ao longo de 3 níveis da coluna vertebral. Não se estendem laminectomia muito lateralmente, porque isso irá causar hemorragia. A fim de orientar chifre ventral, o local da injeção é relativamente medial, por isso é desnecessário alargar laminectomia na medida completa lateral do osso vertebral.
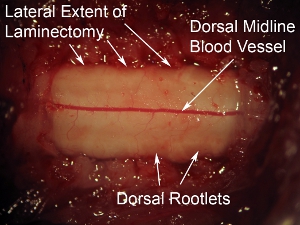
Figura 6. Alta ampliação da superfície dorsal da medula espinhal. O vaso dorsal proeminente pode ser visto correndo pela linha média da medula espinhal. Este padrão dos vasos sangüíneos é observado na maioria dos casos, no entanto, alguns animais mostram uma trajetória não-linha média do vaso sangüíneo. As radículas dorsais podem ser vistos os aspectos lateral da superfície dorsal da medula espinhal. Em relação à dura-máter que recobre a medula espinhal, estes nervos têm uma aparência turva.
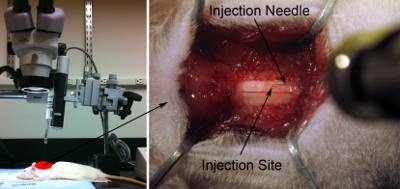
Figura 7. Configuração da injeção. Line up seringa / agulha paralela ao eixo da coluna vertebral corretamente alvo desejado região anatômica. A agulha é angulado apenas o suficiente (aproximadamente 80 graus em relação à mesa cirúrgica) para não bater a cabeça âmbito cirúrgico, mas o mais próximo possível de 90 graus possível (painel esquerdo). Ponta inferior de injeção em direção à superfície da medula espinhal dorsal usando o microscópio (painel direito). Toque suavemente superfície da medula espinhal com ponta de agulha. Ligeiramente deprimir cabo com agulha. Retrair agulha até medula espinhal está de volta ao estado flat normal. Gravar esta posição como z = 0.0 usando a régua sobre o micromanipulador.
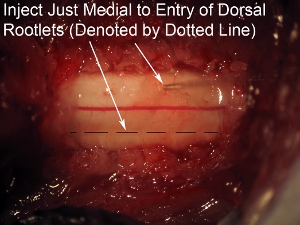
Figura 8. Alta ampliação da espinal medula Aim agulha de injeção apenas medial para a zona de entrada do rootlets dorsal (indicado pela linha pontilhada).
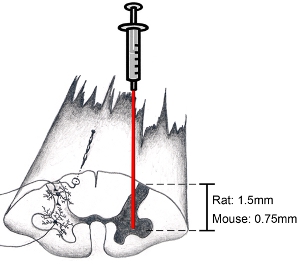
Figura 9. Diagrama da medula espinhal: como alvo região anatômica de interesse Ao tentar atingir o chifre ventral, inciso dura paralelo ao eixo da coluna vertebral apenas medial para a zona de entrada do rootlets dorsal.. Isso permitirá que um alvo para o chifre ventral. Menor agulha a uma profundidade de 1,5 mm a meta chifre ventral em ratos adultos (a idade eo sexo do animal não faz muita diferença na profundidade). Menor agulha a uma profundidade de 0,75 mm a meta chifre ventral em ratos adultos. É claro, profundidade e posição lateral dependem da região específica de interesse.
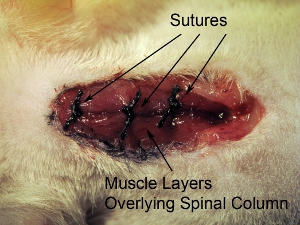
Figura 10. Fechamento da ferida operatória. Suture fechou três camadas musculares sobrepostas ao mesmo tempo com sutura 4-0. Sutura músculos em 3 locais em rostral-caudal do eixo.
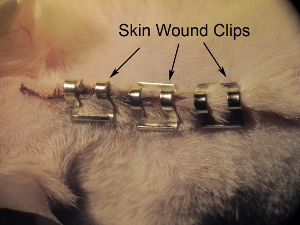
Figura 11. Grampeamento da pele. Staple pele fechada com grampos de sutura 9,0 mm. Aperte os grampos com porta-agulhas para evitar que o animal de retirar grampos antes da cicatrização completa. Grampos espaço de aproximadamente 0,5 mm.
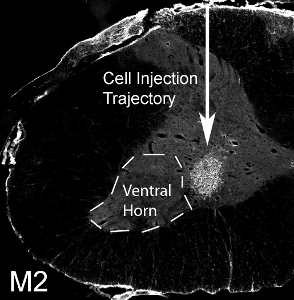
Figura 12. Transplante de progenitores gliais em chifre ventral cervical. Rato derivados 50.000 células progenitoras gliais foram transplantadas para o corno ventral da medula espinhal C4 nível em um rato SOD1 G93A. M2 + mouse derivados células transplantadas sobreviveram a um mês pós-transplante. As células localizadas na substância cinzenta ventral, mas o local da injeção medialmente perdeu o corno lateral ventral (denotadopela linha pontilhada).
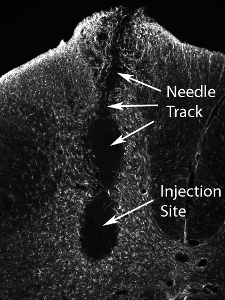
Figura 13. Transplante de tecidos após lesão do alto número de células precursoras neurais. Injeção de um número muito maior de células (o número real varia de acordo com tipo de célula, e devem ser sistematicamente avaliados) resulta em danos no local da injeção e ao longo da trilha da agulha.
Discussão
Para estudos envolvendo ratos SOD1 G93A e ratos, idade e sexo-match os animais dentro de um grupo, e distribuir os animais dentro da mesma ninhada a diferentes grupos. É preferível usar todos os animais do mesmo sexo para ambos ALS e modelos SCI porque os processos de doença pode ser diferente entre machos e fêmeas, no entanto, também pode ser útil ter animais de ambos os sexos suficiente para detectar possíveis efeitos específicos de sexo, como este fenômeno tem sido relatada com SOD1 G93A 13
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Gostaria de agradecer: todos os membros da Lepore, Maragakis e Rothstein laboratórios para discussão útil; Os Veteranos Paralisados da América e do Craig H. Neilsen Fundação para o financiamento.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| HBSS | Gibco | 14170 | |
| Tripsina 0,05% | Gibco | 25300 | |
| Inibidor de tripsina de soja (opcional) | Sigma | T-6522 | |
| Acepromazina maleato (0,7 mg / kg) | Fermentação da Saúde Animal | ||
| Ketamina (95 mg / kg) | Fort Dodge Saúde Animal | ||
| Xilazina (10 mg / kg) | Bayer | ||
| # Feather lâmina cirúrgica 11 | Microscopia Eletrônica de Ciências | 72044-11 | |
| Aplicadores com ponta de algodão (6 polegadas) | Pescador | 23-400-101 | |
| Rat-toothed forceps | Multa Ferramentas Ciência | Rat: 11023-15; Mouse: 11042-08 | |
| Médias empresas tesoura primavera | Multa Ferramentas Ciência | 15012-12 | |
| Mini mola tesoura | Multa Ferramentas Ciência | 15000-10 | |
| Rongeur | Multa Ferramentas Ciência | Rat: 16121-14; Mouse: 16221-14 | |
| Microknife | Multa Ferramentas Ciência | 10056-12 | |
| Porta-agulhas | Multa Ferramentas Ciência | 12502-14 | |
| Sutura: 4-0 | Vicryl | S-183 | |
| Staples: 9 mm | Autoclip | 427631 | |
| Grampeador: 9 mm (Reflex # 203-1000) | Precision Instruments mundo | 5000344 | |
| Bomba de água quente (T Bomba /) | Gaymar | P / N 07999-000 | |
| Ciclosporina A: 250,0 mg/5.0 mL ampolas | Novartis / Sandimmune | NDC 0078-0109-01 | |
| FK-506 | LC Laboratories | F-4900 | |
| Rapamicina | LC Laboratories | R-5000 | |
| Injetor | Precision Instruments mundo | UMP2 | |
| 4 Micro Controlador de Bombas Microsseringa | Precision Instruments mundo | UMC4 | |
| Micromanipulador | Precision Instruments mundo | Kite-R | |
| 10,0 mL seringa Hamilton | Hamilton | 80030 | |
| Agulhas Hamilton: 33 gauge, 45 de bisel °, 1 polegada | Hamilton | 7803-05 | |
| 20,0 mL de vidro pipetas microcapilar (opcional) | Kimble | 71900-20 |
Referências
- Lane, M. A., Fuller, D. D., White, T. E. Respiratory recovery following high cervical hemisection. Trends in neurosciences. 31, 538-538 (2008).
- Kaplan, L. M., Hollander, D. Respiratory dysfunction in amyotrophic lateral sclerosis. Clin. Chest. Med. 15, 675-675 (1994).
- Miller, R. G., Rosenberg, J. A., Gelinas, D. F. Practice parameter: the care of the patient with amyotrophic lateral sclerosis (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology: ALS Practice Parameters Task Force. Neurology. 52, 1311-1323 (1999).
- Mitsumoto, H., Chad, D. A., Pioro, E. P., Davis, F. A. . Amyotrophic lateral sclerosis. , (1998).
- Tandan, R., Bradley, W. G. Amyotrophic leteral sclerosis: Part 2. Etiopathogenesis. Annals of neurology. 18, 419-419 (1985).
- Bruijn, L. I., Miller, T. M., Cleveland, D. W. Unraveling the mechanisms involved in motor neuron degeneration in ALS. Annu Rev Neurosci. 27, 723-723 (2004).
- Rosen, D. R., Siddique, T., Patterson, D. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 362, 59-59 (1993).
- Bruijn, L. I., Becher, M. W., Lee, M. K. ALS-linked SOD1 mutant G85R mediates damage to astrocytes and promotes rapidly progressive disease with SOD1-containing inclusions. Neuron. 18, 327-327 (1997).
- Gurney, M. E., Pu, H., Chiu, A. Y. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264, 1772-1775 (1994).
- Howland, D. S., Liu, J., She, Y. Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS). Proc Natl Acad Sci. 99, 1604-1604 (2002).
- Nagai, M., Aoki, M., Miyoshi, I. Rats expressing human cytosolic copper-zinc superoxide dismutase transgenes with amyotrophic lateral sclerosis: associated mutations develop motor neuron disease. J. Neurosci. 21, 9246-9246 (2001).
- McDonald, W., Becker, D. Spinal cord injury: promising interventions and realistic goals. Am. J. Phys. Med. Rehabi. I82, S38-S38 (2003).
- Sandrow-Feinberg, H. R., Zhukareva, V., Santi, L. PEGylated interferon-beta modulates the acute inflammatory response and recovery when combined with forced exercise following cervical spinal contusion injury. Experimental neurology. 223, 439-451 (2010).
- Gage, F. H. Mammalian neural stem cells. Science. 287, 1433-1433 (2000).
- Lane, M. A., Lee, K. Z., Fuller, D. D. Spinal circuitry and respiratory recovery following spinal cord injury. Respiratory physiology & neurobiology. 169, 123-123 (2009).
- Lepore, A. C., Rauck, B., Dejea, C. Focal transplantation-based astrocyte replacement is neuroprotective in a model of motor neuron disease. Nature. 11, 1294-1294 (2008).
- Rao, M. S. Multipotent and Restricted Precursors in the Central Nervous System. Anat Rec. 257, 137-137 (1999).
- Rao, M. S., Mayer-Proschel, M. Glial- restricted precursors are derived from multipotent neuroepithelial stem cells. Dev Biol. 188, 48-48 (1997).
- Suzuki, M., Tork, C., Shelley, B. Sexual dimorphism in disease onset and progression of a rat model of ALS. Sexual dimorphism in disease onset and progression of a rat model of ALS. Amyotroph Lateral Scler. 8, 20-20 (2007).
- Lepore, A. C., Haenggeli, C., Gasmi, M. Intraparenchymal spinal cord delivery of adeno-associated virus IGF-1 is protective in the SOD1G93A model of ALS. Brain research. 1185, 256-256 (2007).
- Veldink, J. H., Bar, P. R., Joosten, E. A. Sexual differences in onset of disease and response to exercise in a transgenic model of ALS. Neuromuscul Disord. 13, 737-737 (2003).
- Shumsky, J. S., Lepore, A. C. Transplantation of Neuronal and Glial Restricted Precursors into Contused Spinal Cord Improves Bladder and Motor Functions, Decreases Thermal Hypersensitivity, and Modifies Intraspinal Circuitry. J. Neurosci. 25, 9624-9624 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados