Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Intraespinal trasplante de células de Orientación asta ventral del cuello uterino en la esclerosis lateral amiotrófica y la lesión de la médula espinal
En este artículo
Resumen
El trasplante de precursores neuronales es una estrategia prometedora para la protección y / o reemplazar la pérdida / disfuncional neuronas cervical motor frénico en lesiones de médula espinal (LME) y el trastorno de la neurona motora, esclerosis amiotrófica laterales (ALS). Ofrecemos un protocolo para la entrega de celulares a cuerno ventral de la médula espinal cervical en modelos de roedores de la ELA y la médula espinal.
Resumen
Compromiso respiratorio debido a la pérdida de neuronas motoras frénico es una consecuencia debilitantes de una gran proporción de los derechos humanos lesión de la médula espinal (LME) de los casos 1 y es la causa última de muerte en pacientes con la enfermedad de la neurona motora, esclerosis amiotrófica laterales (ALS) 2.
La ELA es una enfermedad devastadora neurológico que se caracteriza por la degeneración relativamente rápido de la parte superior y las neuronas motoras inferiores. Los pacientes finalmente sucumben a la enfermedad en promedio 5.2 años después del diagnóstico debido a la parálisis respiratoria debido a la pérdida de las neuronas motoras innnervation frénico del diafragma 3. La gran mayoría de los casos son esporádicos, mientras que el 10% son de la forma familiar. Aproximadamente el veinte por ciento de los casos familiares están vinculados a las mutaciones puntuales en el gen de varios Cu / Zn superóxido dismutasa 1 (SOD1) en el cromosoma 21 4. Los ratones transgénicos y ratones 4,5 6 llevar humana mutante SOD1 genes (G93A, G37R, G86R, G85R) se han generado, y, a pesar de la existencia de otros modelos animales de la pérdida de neuronas motoras, son actualmente los modelos más usadas de la enfermedad .
Lesión de la médula espinal (SCI) es un conjunto heterogéneo de condiciones que resultan de un trauma físico a la médula espinal, con el resultado funcional que varían según el tipo, localización y gravedad de la lesión 7. Sin embargo, aproximadamente la mitad de los casos humanos de SCI afecta a las regiones cervical, lo que resulta en disfunción respiratoria debilitante debido a la pérdida de motoneuronas frénico y lesiones a descender los axones bulboespinal respiratorias 1. Una serie de modelos animales de LME se han desarrollado, con el más comúnmente usado y clínicamente relevantes, siendo la contusión 8.
El trasplante de las distintas clases de células precursoras neurales (NPC) es una estrategia terapéutica prometedora para el tratamiento de lesiones traumáticas del SNC y la neurodegeneración, incluyendo la ELA y SCI, debido a la posibilidad de sustituir la neuroprotección perdido o proporcionar SNC disfuncionales tipos de células, y entregar los factores genéticos, de interés del 9.
Los modelos animales de ELA y dos SCI pueden modelar muchos aspectos clínicamente relevantes de estas enfermedades, incluyendo la pérdida de las neuronas motoras frénico y el compromiso consecuente respiratorias 10,11. Con el fin de evaluar la eficacia de las estrategias basadas en la APN sobre la función respiratoria en estos modelos animales de ELA y SCI, las intervenciones de celulares deben ser dirigidos específicamente a las regiones que contienen los objetivos terapéuticos relevantes, tales como las neuronas motoras frénico. Ofrecemos un protocolo detallado para multi-segmentaria, el trasplante de intraespinal de NPCs en la cervical de la médula espinal ventral materia gris de los modelos neurodegenerativos como la SOD1 G93A ratones y ratas, así como la médula espinal lesionada ratas y ratones 11.
Protocolo
Métodos
1. Preparación de células
Como ejemplo, vamos a describir el procedimiento para la preparación de las células gliales progenitoras 12 para el trasplante, debido a nuestra experiencia con este tipo de células. Sin embargo, los detalles del protocolo, incluido el medio y el uso de la tripsina, por ejemplo, dependerá del tipo de célula particular que se use para el trasplante.
- Pre-caliente todas las soluciones a los 37,0 ° C en un baño de agua.
- Enjuague 2X matraz con HBSS. Añadir 5,0 mL/T-75 frasco de 0,05% de tripsina / EDTA. Incubar matraz durante 3 minutos en 37,0 ° C incubadora. Triturar 3X suavemente en el frasco con 5 o una pipeta de 10 ml.
Opcional: Añadir 5,0 mL/T-75 frasco de 1,0 mg / ml de inhibidor de tripsina de soja en DMEM/F12.
- Enjuague cada frasco de 2X en 5,0 ml de medio. Las células de la piscina y enjuagues. Mantener las células en hielo durante todas las etapas siguientes.
- Giran a 200-300 g durante 5 minutos en tubo cónico: de preferencia en centrífuga se enfría a 4 ° C. Decantar (y salvar) el sobrenadante. Vuelva a suspender las células en 1,0 ml de medio, y la transferencia de 1,5 ml tubo Eppendorf.
- Recuento de células con hemocitómetro con azul tripán para determinar la viabilidad.
- Girar de nuevo en el tubo de 1.5 ml (800 rpm durante 10 minutos: de preferencia en centrífuga se enfría a 4 ° C). Decantar (y salvar) el sobrenadante.
- Vuelva a suspender las células en el volumen final deseado de medio para lograr una densidad celular apropiada.
- Distribución de células en suspensión de varios tubos Eppendorf de 1,5 ml. Mantener las células en hielo hasta el trasplante.
No utilice tubos de 0,75 ml, ya que la jeringa Hamilton / aguja no cabe profundizar en este tubo. Múltiples inyecciones es probable que se hizo durante las sesiones de la cirugía, y se quiere evitar perturbar el mismo tubo de células muchas veces. Trate de preparar el volumen por lo menos un 50% más de suspensión celular que se necesita. Mantener las células en hielo durante la sesión de la cirugía. Las células del trasplante dentro de 4-5 horas de preparación de suspensiones de células con el fin de asegurar la mayor viabilidad de las células después del trasplante.
2. Preparación Antes de la cirugía
- Llevar a cabo las evaluaciones pertinentes de comportamiento de referencia antes de la cirugía.
- Inmunosupresión: ciclosporina A por vía subcutánea (CSA: 10,0 mg / kg de peso corporal) o intraperitoneal (IP) FK-506/Rapamycin (1,0 mg / kg de peso corporal) se debe iniciar al menos 3 días antes del trasplante, y debe ser da todos los días hasta el sacrificio. Administración en el agua potable (en lugar de inyecciones diarias) no es recomendable. CSA es nuestra inmunosupresor de elección cuando el trasplante de células procedentes de roedores, mientras que FK-506/Rapamycin es nuestra elección al trasplantar células de origen humano.
- Autoclave instrumentos quirúrgicos antes de la cirugía. Prepare un lugar limpio y ordenado para hacer la cirugía, así como un lugar despejado para poner las herramientas. Un esterilizador de bolas de cristal también es útil. Mantenga todas las herramientas de limpieza (especialmente gubia) durante la cirugía, ya que esto hará que el procedimiento mucho más fácil. Cualquier material utilizado durante el procedimiento quirúrgico necesita ser estéril.
- Los instrumentos que no pueden ser esterilizados, tales como el microscopio quirúrgico se deben limpiar con un desinfectante apropiado y las asas cubiertas con material estéril (gasa, por ejemplo) para que el cirujano, una vez que se puso con guantes estériles, no contamina su / sus guantes.
- El cirujano debe lavarse las / sus manos con un desinfectante (clorhexidina matorral) antes de comenzar la cirugía. El cirujano usará guantes esterilizados, máscara y un vestido limpio.
3. Cirugía: Animal preparación y Cirugía
Animal de preparación:
- Pesar de los animales, y administrar la dosis adecuada de anestesia: isofluorano inhalación o un cóctel anestésico (se entrega a través de IP) de [maleato de acepromacina (0,7 mg / kg), la ketamina (95 mg / kg) y xilazina (10 mg / kg)].
- Dedo del pie sujetador y / o utilizar el reflejo palpebral (tocar el párpado superior con punta de algodón del aplicador para observar intermitente) para determinar si el animal está bien anestesiado. Las córneas deben ser protegidos mediante la aplicación de un ungüento de lágrimas artificiales antes de la cirugía.
- Afeitarse el pelo con maquinilla de afeitar eléctrica (no accesorio necesario). Afeitado de poco rostral a los oídos de la mitad de la espalda del animal. Afeitarse bien, y quitar el pelo cortado de piel para evitar que el pelo de entrar en la incisión. La preparación quirúrgica debe ser realizada fuera de la zona donde se realizará la cirugía para evitar la contaminación de la herida quirúrgica con el pelo suelto.
- Remoje una gasa con una solución antiséptica povidona yodada, y se aplican a la piel sobre la zona afeitada. El lugar de la cirugía deben ser lavados por lo menos dos veces con la solución de povidona yodada, teniendo cuidado de matorrales del centro de la página hacia la periferia. El sitio puede ser lavado con alcohol al 70% o matorrales germicida diluida. El área debe ser cubierta con paños estériles.
- A lo largo de la cirugía, el uso de una almohadilla de calefacción is muy recomendable para mantener la temperatura corporal del animal normal. Además, la temperatura corporal debe ser monitoreada. Lugar de los animales en una gasa enrollada. De una rata adulta, la gasa enrollado debe ser ~ 1,0 pulgadas de grosor y 6,0 cm ~ de longitud. Tape el teclado a bordo de la cirugía para que no se mueve. Lugar de los animales en el teclado a nivel del pecho / hombro. Extiende ambos brazos sobre la almohadilla, y la cinta de las armas a bordo de la cirugía. La idea es apoyar a la médula espinal cervical de manera que es más fácil el trabajo a lo largo de la cirugía, ya que la médula cervical se encuentra muy por debajo de la superficie de la piel.
Cirugía:
- En el aumento más bajo microscopio (usamos 8 aumentos x), uso de hoja de bisturí para realizar incisión de línea media. Estiramiento de la piel lateralmente con la otra mano para hacer que la piel tirante (que hace que la piel más fácil de cortar), y hacer la incisión de la base del cráneo hasta la escápula. (Ver Figura 1)
- Use hoja de bisturí para hacer la incisión a través de tres capas musculares sobre la columna vertebral. Poco aprieta el músculo (de lateral a medial) en ambos lados con la otra mano. Asegúrese de presionar con la suficiente firmeza con el bisturí para cortar todas las capas del músculo con el menor número de cortes posible, de manera que las incisiones musculares no será irregular, lo que hace la sutura al final de la cirugía sea más fácil. Sin embargo, no presione con demasiada fuerza para evitar ocasionar daños en los tejidos más profundos (columna vertebral).
- Con dos bastoncillos de algodón, utiliza el movimiento giratorio para separar el músculo que recubre los músculos paravertebrales de. Uno puede ser fuerte aquí. No corte o desgarro, ya que esto causará una hemorragia. Movimiento giratorio de los aplicadores bien se burlan de los tejidos además sin causar daños o hemorragia. Si la hemorragia se produce en cualquier etapa de la cirugía, lo mejor es ser paciente. No trate de adelantarse con una gran cantidad de la hemorragia porque la sangre va a impedir la visión del campo quirúrgico. Cauterización o la presión de la luz puede ser aplicada en el sitio de la hemorragia, pero nos encontramos con que la paciencia es la mejor. Con la práctica, debe haber una hemorragia poco o nada a lo largo de esta cirugía.
- Retraer el músculo con 4 separadores caseros (ver Figura 2). Estos separadores se pueden hacer de forma robusta clips en un retractor (véase la figura 2-inserción). Autoclave de estos antes de la cirugía. Se debe tener cuidado para suavizar los extremos de los separadores para evitar daños en los tejidos. Corbata de retractor. La exposición debe ser cuadrado / rectángulo en forma. Esta forma se puede conseguir tirando a 4 esquinas con los 4 separadores. La cinta de cadena a bordo a fin de asegurar retractores (ver Figura 2). Disponibles en el mercado retractores también se puede utilizar, pero preferimos no utilizar estos. Es crucial para crear un buen campo quirúrgico con el fin de ver claramente a través de la cirugía. No "a ciegas" continuará a lo largo.
- Los músculos paravertebrales claras de la superficie dorsal de la columna vertebral. Para hacer frente a los músculos paravertebrales en la superficie dorsal de la columna vertebral, existen dos posibles estrategias. Para la primera estrategia, el uso de ratas de dientes con fórceps y tijeras de tamaño mediano de primavera para eliminar los músculos paravertebrales de la superficie dorsal de las vértebras. Trate de hacer cortes muy cerca del hueso para exponer mejor la superficie del hueso. Hacer cortes paralelos a la superficie de las vértebras, pero no se reducirá a la médula. En el segundo enfoque, hacer una incisión en el para-espinal muscular, y se retraen lateralmente con pequeños separadores. En el segundo enfoque, el músculo puede ser suturado de nuevo juntos después de la cirugía.
- Limpie la superficie del hueso vertebral bien. Use gubia (el instrumento quirúrgico más importante) para alejarse del músculo de los niveles de C4, C5 y C6 (ver Figura 3). Esto, por supuesto, depende de los niveles de la columna vertebral que se dirigen. Durante el uso de gubia con una mano, seguro toda la columna vertebral agarrando muscular en proceso de C2 con la rata de dientes de las pinzas en la otra mano. C2 es el gran proceso rostral en el campo quirúrgico. C3 es un poco por debajo del músculo también. C4, C5 y C6 son de fácil acceso debido a que tienen poco músculo que recubre ellos.
- Comience con laminectomía de C5. Una vez más, segura mediante la celebración de C2 con la rata de dientes con fórceps. Coge toda la lámina (ver el diagrama: tomar cerca de la línea media) con la gubia. Gubia posición para que la herramienta es completamente perpendicular al eje de la columna vertebral. Poco a poco aplastar a la lámina. No presione hacia abajo en la médula espinal, ya que esto causará daño al tejido espinal. Triturar y tirar suavemente hacia arriba de la pieza rota del hueso. Gubia debe aplastar pieza de modo que uno puede alejarse de quitar. Si un pedazo de hueso todavía está unido al resto de la lámina, no tira, ya que esto causa una hemorragia y una posible lesión de la médula espinal. Gubia deben estar limpias y nítidas. Instrumentos como la gubia se deben lavar / limpiar con una solución salina estéril, que puede ser proporcionada en un recipiente estéril (ver Figura 4).
Para la apertura inicial de la laminectomía, el posicionamiento de la perpendicular gubiaperpendicular a la columna vertebral es preferible. Este paso puede ser seguido mediante la adopción de pequeños "bocados" para ampliar la laminectomía mediante la inserción de la gubia ligeramente por debajo del hueso con un ángulo de aproximadamente 30 a 60 respecto a la superficie del cordón umbilical. - Se extienden a todos los laminectomía de C4-C6 láminas. Hacer una abertura continua en el hueso en tres niveles de la columna vertebral. La extensión de la laminectomía puede ser ajustado en base a la ubicación deseada (s) de la inyección intraespinal.
- No se extienden demasiado lateralmente laminectomía, ya que esto causa una hemorragia. A fin de combatir asta ventral, el sitio de la inyección es relativamente medial, por lo que es necesario ampliar la laminectomía a los lados. (Ver Figura 5)
- Incrementar el aumento de ~ 15 x.
- Limpie el tejido conectivo (y la sangre seca es posible) en la parte superior de la duramadre con fórceps # 5 agudo / recto. La diferencia entre el tejido conectivo y la duración debe ser aprendido con la experiencia.
- Incisión en la duramadre, una capa meníngea muy duro, ya sea con la primavera mini-tijeras o microknife. Realice una incisión paralela al eje de la columna vertebral justo por dentro de la zona de entrada de las raicillas dorsal. Esto permitirá a un objetivo del asta ventral. (Ver Figura 6)
- El uso agudo / recto # 5 pinzas para agarrar y levantar un poco dura fuera de la médula espinal. No pellizque / lesionar la médula espinal. Esto requiere algo de práctica. Hacer incisiones con las tijeras de primavera microknife o muy pequeños. No dañar la médula espinal.
- Extender la incisión ligeramente rostral-caudal del eje. Tensión de duración ligeramente separadas dura para crear una exposición agradable de la médula espinal.
- Hacer incisiones en todos los sitios apropiados para cada inyección prevista. Dura tiene un aspecto translúcido nebulosa, mientras que la superficie de la médula espinal tiene un brillante color blanco apariencia. Uno tendrá que aprender a distinguir las distingue. Es aconsejable no tratar de inyectar a través de la duramadre con la aguja de inyección. La duramadre es difícil, así que será difícil de penetrar a través de él. Además, la perforación a través de la duramadre puede afectar la trayectoria de inserción de la aguja y por lo tanto afectará la entrega anatómica específica de las células.
- Inyectar células bilateral en 3 niveles (6 sitios en total) para apuntar gran región de la ampliación de cuello uterino. El número y la ubicación (s) de las inyecciones, por supuesto, depende de la experiencia específica.
- Después de perforar la duramadre, el líquido cefalorraquídeo se derrama. Superficie seca de la médula y la exposición completa con una gasa o aplicador de algodón.
- Para la inyección de células, el uso 10.0μL Hamilton herméticas RN jeringa.
- Coloque 33 de calibre / 45 grados de metal biselado RN aguja Hamilton. La aguja debe ser fuerte. Use la misma aguja para inyecciones sólo ~ 20 (la aguja será más nítida, con menos inyecciones). También se puede utilizar sacó tubos capilares para las agujas. El uso de epoxy para unir la punta de vidrio tirado a la de calibre 26 aguja de metal contundente Hamilton. Trim diámetro de la punta exterior de l ~ 75.0-100.0 (dependiendo del diámetro de las células: uno no quiere dañar a las células durante el proceso de inyección), utilizando un microscopio quirúrgico y diapositivas micrómetro. Nosotros preferimos las agujas de metal de calibre 33.
- Las células se caen fácilmente de la suspensión en el interior del tubo de Eppendorf en hielo. Inmediatamente antes de la carga de la jeringa, golpee suavemente el tubo hasta que las células se remontan a la suspensión. No película con demasiada intensidad, ya que esto dañar las células y / o burbujas de causa. Por otra parte, el uso 20.0μL pipeta-hombre para mezclar suavemente las células: la suspensión pipeta celda sólo una o dos veces arriba y abajo.
- Volumen de carga suficiente para la suspensión de células sólo un lugar de inyección. Las células se caerá de la suspensión dentro de la jeringa de inyección si se planea hacer varias inyecciones. Poco a poco ocupan las células en la jeringa para evitar burbujas y / o daño a las células. Específicamente para las células progenitoras gliales con los que trabajamos en nuestro laboratorio, se inyectan 2,0 l de la suspensión celular a una dilución de 50.000-75.000 células por 1,0 l más de 2-5 minutos. Hemos encontrado que 2uL/site no resulta en daño a los tejidos de la médula espinal cervical. En cambio, nuestra experiencia sugiere que en gran medida el aumento del número de células en este volumen (sobre todo si son más grandes que nuestros progenitores gliales: 10.0 -20.0 m de diámetro) puede causar daño al parénquima de la médula espinal. Se realizó un experimento de células de dosificación amplio para determinar el número óptimo de las células para inyectar en cada lugar (al menos en el intacta la médula espinal cervical). Los parámetros deben ser determinados por el tipo específico de célula y condición de la enfermedad.
- Alinearse paralelamente jeringa / aguja con el eje de la columna vertebral para apuntar correctamente región deseada anatomía. La aguja se inclina lo suficiente (aproximadamente 80 grados con respecto a la mesa de operaciones) para no golpear la cabeza de alcance quirúrgico, pero lo más cercano a 90 grados como sea posible. Baje la punta hacia la superficie dorsal de la médula espinal usando un microscopio (ver Figura 7).
- Objetivo justo medial a la entrada zo agujane de las raicillas dorsal (ver Figura 8). Tocar suavemente la superficie de la médula espinal con la punta de la aguja. Ligeramente deprimen la médula espinal con una aguja. Retraer la aguja hasta la médula espinal es volver a la normalidad. Registrar esta posición como z = 0,0 con la regla en el micromanipulador.
Nota: De manera rutinaria no estabilizar la columna vertebral cervical durante las inyecciones de la médula espinal. Usando nuestro régimen anestésico, el movimiento hacia arriba y hacia abajo de la médula espinal cervical debido a la respiración pesada no ha sido nunca un problema. Sin embargo, si la respiración pesada es un problema, la columna vertebral se puede estabilizar con un marco personalizado suavemente apriete el hueso circundante y para-espinal muscular en los niveles C2 y C7 con fórceps modificado, teniendo cuidado de no aplastar los huesos vertebrales o lesionar a la subyacente tejido de la médula espinal. Si la respiración del animal se vuelve superficial durante el procedimiento, la droga más anestesia debe proporcionar. La cirugía debe ser interrumpido hasta que un plano de anestesia quirúrgica se ha vuelto a alcanzar antes de continuar. - Aguja ligeramente inferiores en la médula espinal. Asegúrese de buscar en el microscopio mientras hace esto. Baje la aguja hasta una profundidad de 1,5 mm a blanco asta ventral de ratas adultas. Baje la aguja hasta una profundidad de 0,75 mm a blanco asta ventral de ratones adultos. (Ver Figura 9). Estas cifras son representativas de la profundidad de los adultos (al menos 3 meses de edad) femenino y masculino ratas Sprague-Dawley (250-450 gramos) y C57BL / 6 ratones (20-35 gramos). Por supuesto, la profundidad y la posición de lateral depende de la región de interés. No molestar el sistema de inyección / cirugía junta o mesa de cirugía, mientras que la aguja se inserta en la médula espinal para evitar daños en el tejido espinal.
- Espere dos minutos (ya que es aún mejor) después de bajar la aguja a la profundidad deseada antes de la inyección.
- Inyectar 2,0 l más de 2-5 minutos a velocidad constante con el controlador de la bomba.
- Espere dos minutos (más tiempo es mejor) después de la inyección antes de extraer lentamente la aguja de la médula espinal.
- Jeringa limpia con dH2O después de cada inyección con el fin de evitar la obstrucción. Poco a poco la elaboración y expulsar a 3-5 veces. No introducir aire en la jeringa.
- Regresar a la ampliación más baja (la misma que utiliza en el inicio de la cirugía: ~ 8 x). Sutura dura cerrada con sutura 9-0, pero esto definitivamente no es necesario. También es un reto. Se sutura la duramadre se cerró en el pasado, pero no encontramos ninguna diferencia en el comportamiento animal, la supervivencia del trasplante o la histología de la médula espinal cuando la duración no es cerrada con sutura. La duración puede ser cubierto con un trozo de espuma protectora de gel estéril. La espuma de gel debe ser colocado directamente en la parte superior del sitio de la incisión dural. Sin embargo, es importante tener cuidado en no tirar bruscamente este pedazo de espuma de gel fuera de la superficie de la médula espinal durante la disección posterior a la perfusión, como la espuma de gel a veces se adhieren firmemente a la superficie de la médula espinal.
- Opcional: los músculos paravertebrales de sutura cerrada con sutura 4-0.
- Sutura cerrada tres capas de músculo que cubre a la vez con una sutura de 4-0. Los músculos de sutura en tres lugares en el eje rostral-caudal (ver figura 10).
- La piel de primera necesidad se cerró con 9,0 mm clips de heridas (ver Figura 11). Apretar las grapas con porta-agujas para prevenir animal quitando grapas antes de la cicatrización de heridas completa. Espacio de aproximadamente 0,5 cm básicos de diferencia. No apriete demasiado los clips de la herida, ya que esto puede conducir a problemas de cicatrización y necrosis.
- Aplicar povidona yodada solución antiséptica a la zona herida con una gasa empapada.
- Permita que los animales que se recuperan por circulación de agua caliente pad. Dar inyección subcutánea de solución de Ringer lactato estéril de (5,0 ml para las ratas, 0,5 mL para el ratón) inmediatamente después de la cirugía. Seguimiento de inyecciones también se puede proporcionar si el animal parece estar deshidratado y / o apáticos. Tratamiento antibiótico profiláctico con 6.0mg/kg de cefazolina se puede utilizar, sin embargo, nuestra experiencia sugiere que este procedimiento de transplante no da lugar a infecciones post-quirúrgicas, si se sigue una técnica aséptica y todos los instrumentos / suministros quirúrgicos esterilizados. Si estas precauciones son seguidas, la administración de antibióticos no se recomienda.
- Continuar CSA o diario FK-506/Rapamycin hasta el sacrificio.
- La cirugía completa debe tener menos de ~ 45 minutos (con 6 puntos de inyección). De lo contrario, el animal comienza a despertar y respirar más intensamente, lo que afectará negativamente a la inyección en la médula espinal.
Sugerencias de solución de problemas asociados con varios pasos de Protocolo
La falta de supervivencia de las células / los pobres: esto no es probable que un problema técnico asociado con la inyección, pero es probablemente debido a las propiedades del tipo de células que se inyecta y / o con el régimen de inmunosupresión. Estas cuestiones deben ser evaluadas empíricamente en un tipo de célula y la base del modelo animal específico. La disponibilidad de un número de inmunodeficientes modelos de rata y el ratóntambién están disponibles para evitar los problemas con inmunosupresión, sin embargo, estos animales también presentan dificultades tales como el costo, la necesidad de mantener una colonia, y la precaución adicional necesaria durante la cirugía y la vivienda.
Déficits funcionales observados después de la cirugía: En nuestra experiencia, no hemos observado la aparición de alteraciones funcionales de seguir este procedimiento cuando se evaluó a través de medidas tales como la pata delantera y la fuerza de agarre y la extremidad posterior del nervio frénico / diafragma compuestos potenciales de acción muscular, incluso con 6 sitios de inyecciones ( 2μL de cada uno) en la médula espinal cervical. Destrucción de los tejidos no ha sido observado. Las posibles razones para la aparición de estos problemas son: no usar el calibre de la aguja sugerido, la inyección de grandes volúmenes y / o el número de células, el daño intencional causado por laminectomía inadecuada, la falta de delicadeza, mientras que el corte de la duramadre (como presionar la cuerda con el n º 5 fórceps) o durante el proceso de inserción de la aguja de Hamilton en la médula espinal (sustituir una aguja aburrido).
Las células no se encuentran en la sustancia gris ventral: Esto podría ser debido a una serie de cuestiones. Si la inyección no ve puerta medial o lateral, asegúrese de alinear adecuadamente el sistema de inyección en paralelo con el eje de la médula espinal, e insertar la aguja justo por dentro de la entrada de las raicillas dorsal. Si la inyección no ve puerta dorsal o ventral, asegúrese de cero el eje z de lectura cuando la punta de la aguja es apenas tocar la superficie dorsal de la médula espinal, sugirió utilizar la aguja de Hamilton con el bisel correspondiente (un bisel más largo pueden afectar la fijación de objetivos), aseguran que la médula espinal no se comprime cuando se inserta la aguja, tener cuidado en la exactitud de medición de profundidad utilizando el micromanipulador, y el uso de animales dentro del rango de peso recomendado. Ajuste su técnica en consecuencia, si usted está constantemente inyectar las células en un lugar (el cual requiere la evaluación histológica y la modificación técnica posterior). Si las inyecciones son distribuidos al azar en todos los sitios de la inyección, se debe hacer para mejorar la consistencia. Si las células tienden a estar ubicadas principalmente en la cara dorsal de la médula espinal a lo largo del trayecto de la aguja, esperar más tiempo antes y después de la inyección de células, y extender la inyección de efectivos durante un periodo largo de tiempo.
4. Los resultados representativos:
Derivadas de ratón las células progenitoras gliales fueron trasplantados (50.000 células / sitio) en el asta ventral de la columna vertebral C4 nivel de la médula de una rata adulta SOD1 G93A. Derivados del ratón las células trasplantadas se pueden distinguir de tejido del huésped a través de la detección de la rata con el anticuerpo de ratón específico, M2. Esta imagen muestra la supervivencia de M2 + trasplante de células derivadas de un mes post-trasplante (ver figura 12). Las células localizado en la sustancia gris ventral, pero el sitio de la inyección medial se perdió el cuerno lateral ventral (la ubicación de la mayoría de las neuronas motoras frénico: denotado por la línea de puntos). No hay formación de quistes se observó cuando las células se inyectaron 50.000 por sitio, y sin deterioro del comportamiento resultante del procedimiento de la inyección. Sin embargo, la inyección de un número mucho mayor de las células (el número real varía según el tipo de célula, y debe ser evaluado de forma sistemática) resulta en daños en el lugar de la inyección ya lo largo del trayecto de la aguja (ver Figura 13: inmunohistoquímica con el marcador de astrocitos GFAP) .
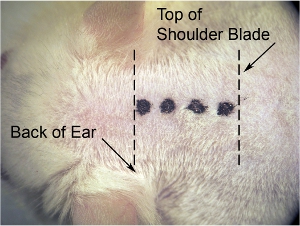
Figura 1. Incisión inicial de la piel. En el aumento más bajo microscopio (usamos 8 aumentos x), uso de hoja de bisturí para realizar incisión de línea media. Estiramiento de la piel lateralmente con la otra mano para hacer que la piel tirante (que hace que la piel más fácil de cortar), y hacer la incisión (indicado por la línea punteada gruesa) a partir de la base del cráneo (en el nivel de la parte de atrás de las orejas) para omóplato (denotado por línea de puntos finos).
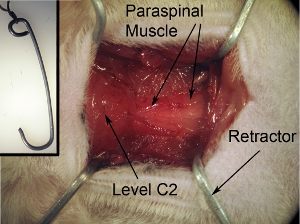
Figura 2. La exposición del campo quirúrgico. La exposición quirúrgica debe ser cuadrado / rectángulo en forma de. Esta forma se puede conseguir tirando del músculo que rodea a 4 esquinas con los 4 separadores. Cadena de cinta que se adjunta a los retractores quirúrgicos a bordo a fin de asegurar retractores y mantener adecuadamente el campo abierto.
Figura 2-inserción. Los retractores para la exposición del campo quirúrgico. Los retractores se utilizan para tirar los músculos con el fin de crear un campo quirúrgico con una visión clara tanto de la médula espinal y el espacio adecuado para realizar la cirugía. Retractores se puede hacer por la configuración de clips resistente a la forma y tamaño deseados. Autoclave de los retractores antes de la cirugía. Corbata de retractor.
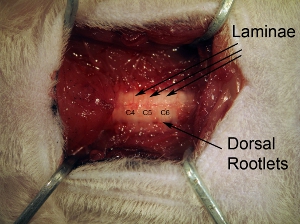
Figura3. Vértebras. Tras la eliminación de los músculos paravertebrales, la superficie dorsal de las vértebras limpiar a fondo con la gubia. Lámina individuales pueden ser vistos, así como raicillas dorsal entrada de cara lateral de la columna vertebral.
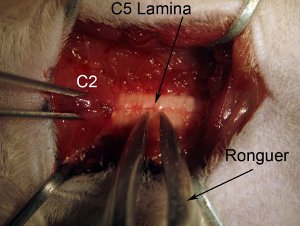
Figura 4. Laminectomía. Inicio laminectomía en la médula espinal a nivel C5. Columna vertebral segura mediante la celebración de los músculos que recubre el nivel C2 con ratas pinzas dentadas. Coge toda la lámina (ver el diagrama: tomar cerca de la línea media) con la gubia. Gubia posición para que la herramienta es completamente perpendicular al eje de la columna vertebral. Poco a poco aplastar a la lámina. No presione hacia abajo en la médula espinal, ya que esto causará daño al tejido espinal. Triturar y tirar suavemente hacia arriba de la pieza rota del hueso. Gubia debe aplastar pieza de modo que uno puede alejarse de quitar. Si un pedazo de hueso todavía se une al resto de las láminas, no tira, ya que esto causa una hemorragia y una posible lesión de la médula espinal. Gubia deben estar limpias y nítidas.
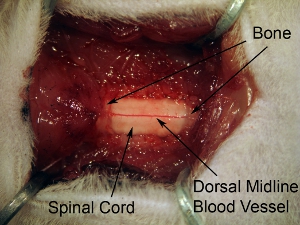
Figura 5. La exposición de la médula espinal después de una laminectomía tejido. Extienda laminectomía para exponer todos los C4-C6 de la médula espinal. Hacer una apertura progresiva de los huesos de más de 3 niveles de la columna vertebral. No se extienden demasiado lateralmente laminectomía, ya que esto causa una hemorragia. A fin de combatir asta ventral, el sitio de la inyección es relativamente medial, por lo que es necesario ampliar la laminectomía en la medida completa lateral del hueso vertebral.
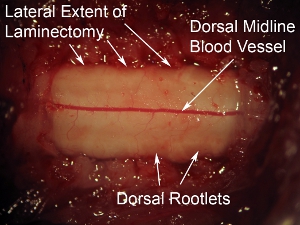
Figura 6. Gran aumento de la superficie dorsal de la médula espinal. El buque sanguíneos prominentes dorsal se puede ver corriendo por la línea media de la médula espinal. Este patrón de los vasos sanguíneos que se observa en la mayoría de los casos, sin embargo, algunos animales muestran una trayectoria sin línea media de los vasos sanguíneos. Las raíces dorsales se pueden ver en las caras laterales de la superficie dorsal de la médula espinal. En relación con la duramadre que recubre la médula espinal, los nervios tienen un aspecto nebuloso.
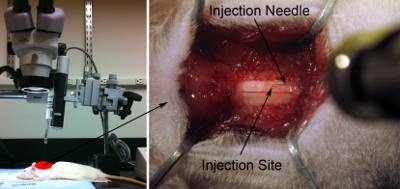
Figura 7. Configuración de la inyección. Alinearse paralelamente jeringa / aguja con el eje de la columna vertebral para apuntar correctamente región deseada anatomía. La aguja se inclina lo suficiente (aproximadamente 80 grados con respecto a la mesa de operaciones) para no golpear la cabeza de alcance quirúrgico, pero lo más cercano a 90 grados como sea posible (izquierda). Extremo inferior de la inyección hacia la superficie dorsal de la médula espinal con el microscopio (panel derecho). Tocar suavemente la superficie de la médula espinal con la punta de la aguja. Ligeramente deprimen la médula con la aguja. Retraer la aguja hasta la médula espinal está de nuevo a estado plano normal. Registro de esta posición z = 0,0 con la regla en el micromanipulador.
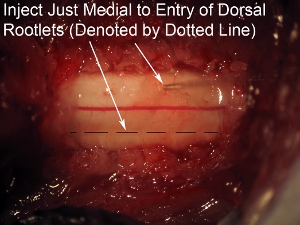
Figura 8. Gran aumento de la aguja de la médula espinal Objetivo inyección justo por dentro de la zona de entrada de las raicillas dorsal (indicado por la línea de puntos).
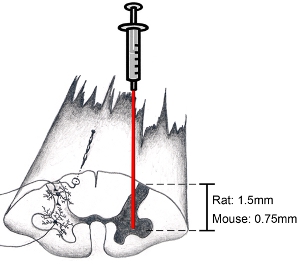
Figura 9. Esquema de la médula espinal: la forma de encauzar región anatómica de interés Cuando se trata de blanco el cuerno ventral, haga una incisión paralela al eje de la duramadre de la columna vertebral justo por dentro de la zona de entrada de las raicillas dorsal.. Esto permitirá a un objetivo del asta ventral. Baje la aguja hasta una profundidad de 1,5 mm a blanco asta ventral de ratas adultas (de la edad y el sexo del animal no hace mucho de la diferencia en la profundidad). Baje la aguja hasta una profundidad de 0,75 mm a blanco asta ventral de ratones adultos. Por supuesto, la profundidad y la posición de lateral depende de la región de interés.
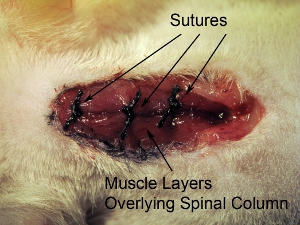
Figura 10. Cierre de herida quirúrgica. Sutura cerró tres capas de músculo que cubre a la vez con una sutura de 4-0. Suturas los músculos en 3 lugares en el rostral-caudal del eje.
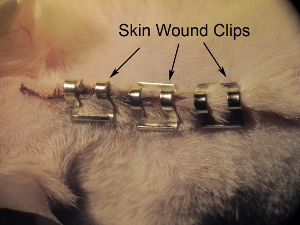
Figura 11. Grapado de la piel. Grapas de piel se cerró con 9,0 mm clips herida. Apretar las grapas con porta-agujas para evitar que el animal tirando de grapas antes de la cicatrización de heridas completa. Espacio de grapas de aproximadamente 0,5 mm.
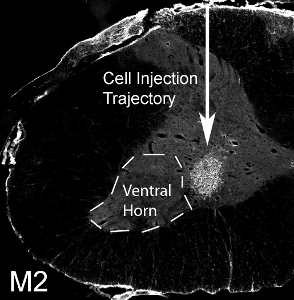
Figura 12. Trasplante de células progenitoras gliales en el cuerno ventral del cuello uterino. 50.000 ratón derivado de las células progenitoras gliales fueron trasplantados en el asta ventral de la columna vertebral C4 nivel de la médula de una rata SOD1 G93A. M2 + ratón derivado de las células trasplantadas sobrevivieron a un mes post-trasplante. Las células localizado en la sustancia gris ventral, pero el sitio de la inyección medial se perdió el cuerno lateral ventral (denotadopor línea de puntos).
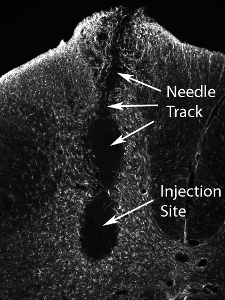
Figura 13. Tejidos, después de la lesión de un gran número de células precursoras neurales. Inyección de un número mucho mayor de las células (el número real varía según el tipo de célula, y debe ser evaluado de forma sistemática) resulta en daños en el lugar de la inyección ya lo largo del trayecto de la aguja.
Discusión
Para estudios con ratones SOD1 G93A y ratas, la edad y el sexo coinciden con los animales dentro de un grupo, y distribuir los animales dentro de la misma camada de los diferentes grupos. Es preferible utilizar todos los animales del mismo sexo, tanto para la ELA y modelos SCI porque los procesos de la enfermedad pueden diferir entre hombres y mujeres, sin embargo, también puede ser útil disponer de suficientes animales de ambos sexos, para detectar posibles efectos específicos del sexo, como este fenómen...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Me gustaría dar las gracias a: todos los miembros de la Lepore, Sergios y los laboratorios de Rothstein útil para el debate; El Veteranos Paralizados de América y la Fundación Craig H. Neilsen para su financiación.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| HBSS | Gibco | 14170 | |
| 0,05% de tripsina | Gibco | 25300 | |
| Inhibidor de tripsina de soja (opcional) | Sigma | T-6522 | |
| Acepromacina maleato (0,7 mg / kg) | Fermentación de Sanidad Animal | ||
| La ketamina (95 mg / kg) | Fort Dodge Animal Health | ||
| Xilazina (10 mg / kg) | Bayer | ||
| # 11 pluma quirúrgica hoja | Microscopía electrónica de Ciencias | 72044-11 | |
| Bastoncillos de algodón (6 pulgadas) | Pescador | 23-400-101 | |
| Rata de dientes con fórceps | Herramientas de Bellas Ciencia | Rata: 11023-15; Mouse: 11042-08 | |
| De tamaño mediano tijeras primavera | Herramientas de Bellas Ciencia | 15012-12 | |
| Mini primavera tijera | Herramientas de Bellas Ciencia | 15000-10 | |
| Gubia | Herramientas de Bellas Ciencia | Rata: 16121-14; Mouse: 16221-14 | |
| Microknife | Herramientas de Bellas Ciencia | 10056-12 | |
| Los porta-agujas | Herramientas de Bellas Ciencia | 12502-14 | |
| Sutura: 4-0 | Vicryl | S-183 | |
| Staples: 9 mm | Autoclip | 427631 | |
| Grapadora: 9 mm (Reflex # 203-1000) | Mundial de Instrumentos de Precisión | 5000344 | |
| Bomba de agua tibia (T / bomba) | Gaymar | P / N 07999-000 | |
| Ciclosporina A: 250.0 mg/5.0 ml ampollas | Novartis / Sandimmune | NDC 0078-0109-01 | |
| FK-506 | LC Laboratorios | F-4900 | |
| La rapamicina | LC Laboratorios | R-5000 | |
| Inyector | Mundial de Instrumentos de Precisión | UMP2 | |
| Micro 4 Controlador de la bomba Microjeringa | Mundial de Instrumentos de Precisión | UMC4 | |
| Micromanipulador | Mundial de Instrumentos de Precisión | Kite-R | |
| 10,0 l jeringa Hamilton | Hamilton | 80030 | |
| Hamilton agujas: 33-calibre 45 de bisel °, 1 pulgada | Hamilton | 7803-05 | |
| Vidrio 20,0 l pipetas microcapilares (opcional) | Kimble | 71900-20 |
Referencias
- Lane, M. A., Fuller, D. D., White, T. E. Respiratory recovery following high cervical hemisection. Trends in neurosciences. 31, 538-538 (2008).
- Kaplan, L. M., Hollander, D. Respiratory dysfunction in amyotrophic lateral sclerosis. Clin. Chest. Med. 15, 675-675 (1994).
- Miller, R. G., Rosenberg, J. A., Gelinas, D. F. Practice parameter: the care of the patient with amyotrophic lateral sclerosis (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology: ALS Practice Parameters Task Force. Neurology. 52, 1311-1323 (1999).
- Mitsumoto, H., Chad, D. A., Pioro, E. P., Davis, F. A. . Amyotrophic lateral sclerosis. , (1998).
- Tandan, R., Bradley, W. G. Amyotrophic leteral sclerosis: Part 2. Etiopathogenesis. Annals of neurology. 18, 419-419 (1985).
- Bruijn, L. I., Miller, T. M., Cleveland, D. W. Unraveling the mechanisms involved in motor neuron degeneration in ALS. Annu Rev Neurosci. 27, 723-723 (2004).
- Rosen, D. R., Siddique, T., Patterson, D. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 362, 59-59 (1993).
- Bruijn, L. I., Becher, M. W., Lee, M. K. ALS-linked SOD1 mutant G85R mediates damage to astrocytes and promotes rapidly progressive disease with SOD1-containing inclusions. Neuron. 18, 327-327 (1997).
- Gurney, M. E., Pu, H., Chiu, A. Y. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264, 1772-1775 (1994).
- Howland, D. S., Liu, J., She, Y. Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS). Proc Natl Acad Sci. 99, 1604-1604 (2002).
- Nagai, M., Aoki, M., Miyoshi, I. Rats expressing human cytosolic copper-zinc superoxide dismutase transgenes with amyotrophic lateral sclerosis: associated mutations develop motor neuron disease. J. Neurosci. 21, 9246-9246 (2001).
- McDonald, W., Becker, D. Spinal cord injury: promising interventions and realistic goals. Am. J. Phys. Med. Rehabi. I82, S38-S38 (2003).
- Sandrow-Feinberg, H. R., Zhukareva, V., Santi, L. PEGylated interferon-beta modulates the acute inflammatory response and recovery when combined with forced exercise following cervical spinal contusion injury. Experimental neurology. 223, 439-451 (2010).
- Gage, F. H. Mammalian neural stem cells. Science. 287, 1433-1433 (2000).
- Lane, M. A., Lee, K. Z., Fuller, D. D. Spinal circuitry and respiratory recovery following spinal cord injury. Respiratory physiology & neurobiology. 169, 123-123 (2009).
- Lepore, A. C., Rauck, B., Dejea, C. Focal transplantation-based astrocyte replacement is neuroprotective in a model of motor neuron disease. Nature. 11, 1294-1294 (2008).
- Rao, M. S. Multipotent and Restricted Precursors in the Central Nervous System. Anat Rec. 257, 137-137 (1999).
- Rao, M. S., Mayer-Proschel, M. Glial- restricted precursors are derived from multipotent neuroepithelial stem cells. Dev Biol. 188, 48-48 (1997).
- Suzuki, M., Tork, C., Shelley, B. Sexual dimorphism in disease onset and progression of a rat model of ALS. Sexual dimorphism in disease onset and progression of a rat model of ALS. Amyotroph Lateral Scler. 8, 20-20 (2007).
- Lepore, A. C., Haenggeli, C., Gasmi, M. Intraparenchymal spinal cord delivery of adeno-associated virus IGF-1 is protective in the SOD1G93A model of ALS. Brain research. 1185, 256-256 (2007).
- Veldink, J. H., Bar, P. R., Joosten, E. A. Sexual differences in onset of disease and response to exercise in a transgenic model of ALS. Neuromuscul Disord. 13, 737-737 (2003).
- Shumsky, J. S., Lepore, A. C. Transplantation of Neuronal and Glial Restricted Precursors into Contused Spinal Cord Improves Bladder and Motor Functions, Decreases Thermal Hypersensitivity, and Modifies Intraspinal Circuitry. J. Neurosci. 25, 9624-9624 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados