Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Интраспинальной клеточной трансплантации для постановки целей шейки Брюшной Рог в боковой амиотрофический склероз и травматического Травма спинного мозга
В этой статье
Резюме
Нейронные трансплантации предшественником является перспективным для общества стратегия охраны и / или замены потерянных / дисфункциональные шейки диафрагмальных мотонейронов в повреждении спинного мозга (ТСМ) и двигательных нейронов расстройства, амиотрофический склероз отводов (ALS). Мы предоставляем протокол для сотовых доставки шейного отдела спинного мозга вентральной рога у грызунов модели ALS и ТСМ.
Аннотация
Respiratory compromise due to phrenic motor neuron loss is a debilitating consequence of a large proportion of human traumatic spinal cord injury (SCI) cases 1 and is the ultimate cause of death in patients with the motor neuron disorder, amyotrophic laterals sclerosis (ALS) 2.
ALS is a devastating neurological disorder that is characterized by relatively rapid degeneration of upper and lower motor neurons. Patients ultimately succumb to the disease on average 2-5 years following diagnosis because of respiratory paralysis due to loss of phrenic motor neuron innnervation of the diaphragm 3. The vast majority of cases are sporadic, while 10% are of the familial form. Approximately twenty percent of familial cases are linked to various point mutations in the Cu/Zn superoxide dismutase 1 (SOD1) gene on chromosome 21 4. Transgenic mice 4,5 and rats 6 carrying mutant human SOD1 genes (G93A, G37R, G86R, G85R) have been generated, and, despite the existence of other animal models of motor neuron loss, are currently the most highly used models of the disease.
Spinal cord injury (SCI) is a heterogeneous set of conditions resulting from physical trauma to the spinal cord, with functional outcome varying according to the type, location and severity of the injury 7. Nevertheless, approximately half of human SCI cases affect cervical regions, resulting in debilitating respiratory dysfunction due to phrenic motor neuron loss and injury to descending bulbospinal respiratory axons 1. A number of animal models of SCI have been developed, with the most commonly used and clinically-relevant being the contusion 8.
Transplantation of various classes of neural precursor cells (NPCs) is a promising therapeutic strategy for treatment of traumatic CNS injuries and neurodegeneration, including ALS and SCI, because of the ability to replace lost or dysfunctional CNS cell types, provide neuroprotection, and deliver gene factors of interest 9.
Animal models of both ALS and SCI can model many clinically-relevant aspects of these diseases, including phrenic motor neuron loss and consequent respiratory compromise 10,11. In order to evaluate the efficacy of NPC-based strategies on respiratory function in these animal models of ALS and SCI, cellular interventions must be specifically directed to regions containing therapeutically relevant targets such as phrenic motor neurons. We provide a detailed protocol for multi-segmental, intraspinal transplantation of NPCs into the cervical spinal cord ventral gray matter of neurodegenerative models such as SOD1G93A mice and rats, as well as spinal cord injured rats and mice 11.
протокол
Методы
1. Сотовые подготовка
В качестве примера мы опишем процедуру подготовки глиальных клеток-предшественников 12 для трансплантации из-за нашего опыта работы с этим типом клеток. Тем не менее, специфика протокола, в том числе средних и использование трипсина например, будет зависеть от конкретного типа клеток, используемых для трансплантации.
- Предварительно теплый все решения до 37,0 ° С на водяной бане.
- Промойте колбу 2X с HBSS. Добавить 5,0 mL/T-75 колбу 0,05% трипсин / ЭДТА. Инкубируйте колбы в течение 3 минут в 37,0 ° C инкубатора. Измельченного в порошок 3X мягко в колбе с 5 или 10 мл пипетки.
Дополнительно: Добавить 5,0 mL/T-75 колбу 1,0 мг / мл соевого ингибитора трипсина в DMEM/F12.
- Промыть каждую колбу 2X в 5,0 мл среды. Бассейн клеток и полосканий. Держите клетки на льду в течение всех последующих шагов.
- Спиновые на 200-300 г в течение 5 минут в конической трубе: желательно в центрифуге охлаждают до 4 ° C. Декантировать (и сохранять) супернатант. Повторное приостановить клеток в 1,0 мл среды, и передачи до 1,5 мл трубки Эппендорф.
- Граф клеток с использованием гемоцитометра Голубой Трипан, чтобы определить жизнеспособность.
- Спиновые снова в 1,5 мл трубки (800 оборотов в течение 10 минут: желательно в центрифуге охлаждают до 4 ° С). Декантировать (и сохранять) супернатант.
- Повторное приостановить клеток в желаемой конечной объем среды для достижения соответствующей плотности клеток.
- Распространение клеточные суспензии к нескольким 1,5 мл Eppendorf труб. Держите клеток на льду до трансплантации.
Не используйте трубы 0,75 мл, а шприц Hamilton / игла не помещается глубоко в эту трубку. Множественные инъекции, вероятно, будет сделано во время операции сессий, а кто-то хочет, чтобы не мешать же пробирке клеток во много раз. Попробуйте приготовить по крайней мере на 50% больше объема суспензии клеток, чем это необходимо. Держите клетки на льду всей операции сессии. Пересадка клеток в течение 4-5 часов приготовления клеточных суспензий, чтобы обеспечить наибольшую жизнеспособность клеток после трансплантации.
2. Подготовка до операции
- Поведения соответствующих оценок поведения базового до операции.
- Подавление иммунитета: подкожные циклоспорина (CSA: 10,0 мг / кг массы тела) или внутрибрюшинно (IP) FK-506/Rapamycin (1,0 мг / кг массы тела) следует начинать минимум за 3 дня до трансплантации, и должно быть дано в день, пока жертва. Администрации в питьевой воде (вместо ежедневных инъекций) не рекомендуется. CSA наш иммунодепрессанты выбора при пересадке грызунов клеток, полученных, в то время FK-506/Rapamycin наш выбор при пересадке человеческих клеток, полученных.
- Автоклав хирургических инструментов до операции. Подготовка аккуратные и чистые место, чтобы сделать операцию, а также лаконичную место для размещения инструментов. Стеклянные бусины-стерилизатор и полезно. Храните все инструменты в чистоте (особенно костные кусачки) во время операции, поскольку это сделает процедуру гораздо проще. Любой материал, используемый во время хирургической процедуры должны быть стерильными.
- Инструменты, которые не могут быть стерилизованы, такие как операционный микроскоп следует протереть вниз с дезинфицирующим раствором и ручки покрыты стерильного материала (например, марлей), так что хирург, один раз надел стерильными перчатками, не загрязняет его / ее перчатки.
- Хирург должен вымыть ее / его руки с дезинфицирующим раствором (хлоргексидином скраб) перед началом операции. Хирург носить стерильные перчатки, маски и чистые халат.
3. Хирургия: подготовка животных и хирургии
Животное Подготовка:
- Взвешивание животных и администрирования соответствующую дозу анестезии: Isofluorane вдыхании или анестезии коктейль (доставляется через IP) из [малеат acepromazine (0,7 мг / кг), кетамина (95 мг / кг), а ксилазина (10 мг / кг)].
- Pinch ног и / или использование глазных рефлексов (касание верхнего века с хлопковым наконечником аппликатором наблюдать мигание), чтобы определить, если животное правильно наркозом. Роговица должна быть защищена с применением искусственной слезы мазь до операции.
- Бритье назад волосами с электрической бритвой (без вложений необходимо). Бритье от слегка ростральнее уши середины спины животного. Бритье хорошо, и удалить подстриженные волосы с кожи, чтобы предотвратить попадание волос разрез. Подготовка к операции должны выполняться от района, где хирургия будет выполнена, чтобы избежать загрязнения места операции с бродячими волос.
- Замочите марлю с Povidine-антисептическим раствором йода, а также применять к коже над бритой области. Хирургических сайт должен быть удалено по крайней мере дважды Povidine-раствор йода, следя, чтобы вычистить от центра сайта к периферии. Сайт может быть затем промыть 70% спиртом или разбавленный бактерицидные скраба. Площадь должна быть покрыта стерильной шторы.
- На протяжении операции, использование грелки яы Настоятельно рекомендуется для поддержания нормальной температуры тела животного. Кроме того, температура тела должны быть проверены. Место животное на прокат площадки марли. Для взрослой крысы, прокат площадки марли должно быть ~ 1.0 дюйма в толщину и ~ 6,0 дюймов в длину. Лента эта площадка для хирургии доску так, чтобы она не двигается. Место животное на площадку на уровне груди / плеча. Протяни обе руки на площадку, и лента оружие операцией борту. Идея заключается в опору шейного отдела спинного мозга так, что легче работать на протяжении операцию, так как шейный шнур находится глубоко под поверхностью кожи.
Хирургия:
- На низком увеличении микроскопа (мы используем 8-кратном увеличении), используйте лезвие скальпеля, чтобы сделать срединный разрез. Натяжные кожи по бокам с другой стороны, чтобы сделать кожу тугие (что делает кожу легче надрезать), и сделать разрез от основания черепа до лопатки. (См. рисунок 1)
- Используйте лезвие скальпеля сделать разрез через 3 слоя мышц в течение позвоночника. Слегка сожмите мышцы (от бокового к медиальному) с обеих сторон с другой стороны. Убедитесь, что нажали достаточно крепко с скальпель, чтобы вырезать всех мышечных слоев с наименьшим количеством разрезов, как можно так, что мышечная разрезы не будут неровными, что делает наложение швов на конце операции легче. Тем не менее, не нажимайте слишком сильно, чтобы предотвратить создание ущерб в более глубокие ткани (позвоночник).
- С двумя хлопка наконечником аппликаторы, использовать вращательным движением отделить вышележащие мышцы от параспинальная мышцы. Можно быть энергичным здесь. Ничего не вырезано и не рвите, так как это вызовет кровотечение. Скручивание движения с аппликаторы будет приятно дразнить ткани друг от друга, не вызывая повреждения или кровоизлияние. Если кровоизлияние происходит на любой стадии операции, то лучше запастись терпением. Не пытайтесь забегать вперед с большим количеством кровоизлияний, потому что кровь будет неясным видение операционного поля. Прижигание или светового давления могут быть применены к месту кровотечения, но мы обнаружили, что терпение является лучшим. С практикой, не должно быть мало или нет кровоизлияния в этой операции.
- Уберите мышц с 4 домашними преднатяжителями (см. Рисунок 2). Эти преднатяжителями могут быть сделаны из прочной скрепки в форме втягивающим устройством (см. Рисунок 2-вставка). Автоклав этих до операции. Следует проявлять осторожность, чтобы тупые концы преднатяжителями, чтобы избежать повреждения тканей. Tie строку втягивающего устройства. Выдержка должна быть квадратной / прямоугольную форму. Эта форма может быть достигнуто, потянув на 4-х углов с помощью 4 преднатяжителями. Лента строку на борт, чтобы обеспечить преднатяжителями (см. Рисунок 2). Коммерчески доступные преднатяжителями также может быть использована, но мы предпочитаем не использовать эти. Очень важно создать хорошие операционного поля для того, чтобы ясно видеть всей операции. Не "вслепую" продолжать идти.
- Очистить параспинальная мышцы от дорсальной поверхности позвоночника. Чтобы справиться с параспинальная мышцы на дорсальной поверхности позвоночника, Есть 2 возможные стратегии. Для первой стратегии использования крысы-зубчатые щипцы и средних ножницы весной, чтобы удалить параспинальная мышцы от дорсальной поверхности позвонков. Попробуйте сделать разрезы очень близко к кости, чтобы лучше подвергать поверхности кости. Сделать разрезы параллельно поверхности позвонков, но не рубить в мозг. Для второго подхода, делают разрез в средней линии пара-спинной мышцы и убрать по бокам с меньшим преднатяжителями. Во втором подходе, мышца может быть пришита обратно вместе после операции.
- Очистить поверхность позвоночных костей хорошо. Используйте костные кусачки (наиболее важные хирургический инструмент), чтобы вырваться мышцы от уровней С4, С5 и С6 (см. Рисунок 3). Это, конечно, зависит от спинного уровней, которые ориентированы. При использовании костные кусачки с одной стороны, безопасность всего позвоночного столба, держа мышцы над процессом C2 с крысами зубчатых щипцов в другой. С2 большой ростральной процесса в операционное поле. C3 немного под мышцу, а также. C4, C5 и C6, легко доступны, потому что они имеют мало мышцы вышележащих них.
- Начните с ламинэктомия С5. Опять же, безопасным путем проведения C2 с крысами зубчатых щипцов. Захват всей пластинки (см. рисунок: захватить около средней линии) с костные кусачки. Позиция костные кусачки, так что инструмент полностью перпендикулярно оси позвоночника. Медленно раздавить пластинки. Не давите вниз в спинной мозг, так как это может привести к повреждению спинного ткани. Давка и осторожно потяните обломок кости вверх. Костные кусачки должны сокрушить кусок, чтобы можно было легко тронуться с места, чтобы удалить. Если кусок кости еще прикреплена к остальной части пластинки, не буксира так как это вызовет кровотечение и возможное повреждение спинного мозга. Костные кусачки должны быть чистыми и острыми. Такие инструменты, как костные кусачки должны быть вымыты / протирают стерильным физиологическим раствором, который может быть предоставлен в стерильных чаша (см. рисунок 4).
Для начального открытия ламинэктомии, позиционирование костные кусачки перпендикулярноперпендикулярную позвоночника предпочтительнее. Этот шаг может быть затем следуют с небольшим "грызет" вытянуть ламинэктомии, вставив костные кусачки мягко под кости с примерно 30-60 градусов по отношению к поверхности шнура. - Расширение ламинэктомии всем С4-С6 пластинок. Сделайте одно непрерывное открытие в кости в течение трех спинного уровнях. Степень ламинэктомии может быть скорректирована на основе нужное место (ы) спинной инъекции.
- Не выдвигайте ламинэктомии слишком далеко сбоку, потому что это вызовет кровотечение. В целях выявления вентрального рога, инъекции относительно медиальной, так что это не продлевать ламинэктомии далеко в сторону. (См. Рисунок 5)
- Увеличение увеличение до ~ 15 x.
- Очистите соединительной ткани (и, возможно засохшей крови) в верхней части оболочки с острыми / прямой # 5 щипцами. Разница между соединительной ткани и оболочки должен быть извлечен с опытом.
- Надрезать оболочки, очень жесткие менингеальные слоя, либо с мини-весенний ножницами или microknife. Сделайте разрез параллельно оси позвоночника просто медиальнее вступления зону спинного корешков. Это позволит одной до целевой вентрального рога. (См. Рисунок 6)
- Используйте резкие / прямой # 5, чтобы захватить пинцетом и слегка приподнимите оболочки от спинного мозга. Не зажимайте / повредить спинной мозг. Это требует некоторой практики. Сделайте разрезы с microknife или очень маленькие ножницы весной. Не повредить спинной мозг.
- Расширение Разрез слегка ростральной-каудальной оси. Напряжение оболочки будет несколько отдельных оболочки, чтобы создать красивый воздействия спинного мозга.
- Сделать разрезы на всех соответствующих сайтов в каждом конкретном случае инъекции. Дура имеет туманные полупрозрачные внешний вид, в то время как спинной поверхности шнур ярче белого цвета внешний вид. Один будет нужно научиться различать эти части. Желательно не пытаться вводить через оболочку с инъекционной иглой. Длительность жесткая, так что это будет трудно проникнуть сквозь него. Кроме того, пробиваясь сквозь оболочки могут повлиять на траекторию введения иглы и, следовательно, влияют на анатомически направленной доставки клеток.
- Inject клетки двустороннем на 3 уровня (6 участков общего числа), чтобы целевая большой области шейного утолщения. Количество и расположение (ы) инъекций, конечно, зависит от конкретного эксперимента.
- После пирсинга оболочки, спинномозговая жидкость выльется. Сухая поверхность мозга и всей экспозиции с помощью марли или хлопчатобумажной наконечником аппликатором.
- Для инъекции клеток, использование 10.0μL Гамильтон газонепроницаемыми RN шприц.
- Прикрепить 33 калибра / 45 градусов скошенными металла RN Гамильтон иглы. Игла должна быть резкой. Используйте ту же иглу для всего ~ 20 инъекций (иглы будет острее с меньшим инъекций). Можно также использовать вытащил стеклянные капилляры для игл. Использование эпоксидной приложить вытащил стеклянным наконечником до 26 калибра тупой иглой металла Гамильтон. Trim внешний диаметр кончика до ~ 75.0-100.0 мкл (в зависимости от диаметра ячеек: один не хочет, чтобы повреждать клетки в процессе инъекции) с использованием операционного микроскопа и микрометра слайда. Мы предпочитаем 33-иглы металла.
- Клетки будут выпадать из подвески легко внутри трубки Эппендорф на льду. Непосредственно перед загрузкой инъекции шприцом, мягко кран трубки, пока клетки возвращаются в подвеске. Не фильм слишком интенсивно, поскольку это повредит клеток и / или вызвать пузыри. Вместо этого можно использовать 20.0μL пипетки человек, чтобы аккуратно перемешать клеток: пипетки клеточной суспензии только один или два раза вверх и вниз.
- Нагрузка достаточного объема суспензии клеток только для одной инъекции. Клетки выпадет приостановления внутри инъекции шприцом, если один планирует сделать несколько инъекций. Медленно занимают клеток в шприце, чтобы избежать пузырей и / или повреждению клеток. Специально для глиальных клеток-предшественников, что мы работаем в нашей лаборатории, мы вводим 2,0 мкл клеточной суспензии в разведении 50,000-75,000 клеток на 1,0 мкл в течение 2-5 минут. Мы обнаружили, что 2uL/site не приводит к повреждению тканей в шейном отделе спинного мозга. Вместо этого, наш опыт показывает, что значительно увеличивает количество клеток в этом объеме (в частности, если они больше по размеру, чем наши предшественники глиальных: 10,0 -20,0 мкм в диаметре), может привести к повреждению спинного паренхимы мозга. Мы провели обширный эксперимент дозирования ячейки для определения оптимального количества клеток для введения на каждом участке (по крайней мере нетронутыми шейного отдела спинного мозга). Параметры должны быть определены для определенного типа клеток и болезненного состояния.
- Выстроить шприц / иглу параллельно оси позвоночника правильно целевой желаемого анатомической области. Иглу под углом ровно настолько (около 80 градусов по отношению к операционном столе), чтобы не ударить головой хирургические возможности, но как можно ближе к 90-градусов, насколько возможно. Нижний наконечник к спинной поверхности грудной отдел спинного мозга использованием микроскопа (см. рисунок 7).
- Цель игла просто медиальнее вступления годной из корешков спинного (см. рисунок 8). Аккуратно сенсорным поверхности спинного мозга с кончика иглы. Слегка нажмите спинного мозга с иглой. Уберите иглы до спинного мозга возвращается к нормальной жизни. Запись этой позиции, поскольку г = 0,0 с использованием линейки на микроманипулятора.
Примечание: Мы обычно не стабилизируют позвоночник во время инъекции шейного отдела спинного мозга. Используя наши анестезии режим, вверх-вниз, движения шейного отдела спинного мозга из-за тяжелого дыхания никогда не было проблемой. Однако, если тяжелое дыхание является проблемой, позвоночника могут быть стабилизированы с помощью настраиваемой кадре, осторожно зажима кости и окружающих пара-спинной мышцы на уровне C2 и C7 с использованием модифицированной пинцетом, стараясь не раздавить позвоночной кости или повредить основной ткани спинного мозга. Если дыхание животного становится мелкой во время процедуры, более анестезии препарата должна быть предоставлена. Операция должна быть прервана до хирургического плоскости анестезии был вновь достигнут, прежде чем возобновить. - Чуть ниже иглу в спинной мозг. Убедитесь, что смотреть в микроскоп, делая это. Нижняя иглы на глубину от 1,5 мм до целевой вентральных рогов у взрослых крыс. Нижняя иглы на глубину 0,75 мм до целевой вентральных рогов у взрослых мышей. (См. рисунок 9). Эти глубины номера представитель взрослого (не менее 3 месяцев), женских и мужских Sprague-Dawley крыс (250-450 граммов) и C57BL / 6 мышей (20-35 г). Конечно, глубины и бокового положения зависит от конкретного региона, представляющих интерес. Не беспокоить системы впрыска / хирургии борту или хирургии столом, а игла вводится в спинной мозг, чтобы избежать повреждения спинного ткани.
- Подождите две минуты (дольше даже лучше) после опускания иглы требуемую глубину до инъекции.
- Inject 2,0 мкл в течение 2-5 минут при постоянной скорости использовании насоса контроллером.
- Подождите две минуты (дольше, тем лучше) после инъекции медленно до удаления иглы из спинного мозга.
- Чистый шприц с dH2O после каждой инъекции для того, чтобы предотвратить засорение. Медленно составить и выслать 3-5 раз. Не привлекайте воздуха в шприце.
- Вернуться на низком увеличении (то же, используется в начале операции: ~ 8 х). Шовный оболочки закрыт с помощью 9-0 шва, но это определенно не стоит. Она также представляет значительную проблему. Мы пришиты оболочки закрыта в прошлом, но мы не видим разницы в поведении животных, трансплантации выживаемость или спинного гистологии шнур, когда длительность не закрыт с швом. Длительность может быть покрыта защитной стерильной пены гель. Гель пены должен быть размещен непосредственно на сайте дурального разрез. Тем не менее, важно позаботиться не резко тянет этот кусок gelfoam от поверхности спинного мозга во время пост-перфузии рассечение, как gelfoam иногда жестко придерживаться поверхности спинного мозга.
- Дополнительно: Шовный параспинальная мышц закрыта с 4-0 шва.
- Шовный закрыты три слоя вышележащих мышц в одно время с 4-0 шва. Шовный мышцы в трех местах в ростральной-каудальной оси (см. рисунок 10).
- Сшивания кожи закрыты с 9,0 мм раны клипов (см. рисунок 11). Затяните скобы с иглодержатели, чтобы предотвратить животное от снимая скобы до полного заживления ран. Космическая скобы примерно 0,5 см друг от друга. Не затягивайте раны клипы, так как это может привести к нарушению заживления и некроза.
- Применить Povidine-антисептическим раствором йода в области раны с пропитанной марли.
- Разрешить животных для восстановления на циркулирующие теплой водой площадку. Дайте подкожной инъекции стерильного раствора лактата Рингера (5,0 мл на крысу, 0,5 мл для мыши) сразу же после операции. Последующие инъекции могут также предоставляться, если животное появляется обезвоженной и / или вялым. Профилактическое лечение антибиотиками использованием 6.0mg/kg из Цефазолин может быть использован, однако, наш опыт показывает, что эта процедура трансплантации не приводит к послеоперационной инфекции, если асептики и используются все инструменты / хирургические принадлежности стерилизуют. Если эти меры предосторожности соблюдаются, антибиотиков не рекомендуется.
- Продолжить CSA или FK-506/Rapamycin ежедневно, пока жертва.
- Все операции должны взять меньше, чем ~ 45 минут (с 6 сайтов инъекции). В противном случае животное начнет просыпаться и дышать тяжело, что негативно скажется на инъекции в спинной мозг.
Советы по устранению неполадок проблем, связанных с различными шагов протокола
Отсутствие / бедные выживаемость клеток: Это, вероятно, не технический вопрос, связанный с впрыском, но, вероятно, из-за свойств типа клеток внедряемому и / или immunesuppression режима. Эти вопросы должны быть эмпирически оценивается по камерного типа и животной модели индивидуальной основе. Наличие количество иммунных-дефицитных крыс и мышейТакже доступны для обхода проблем с immunesuppression, однако эти животные также нынешние трудности, такие как стоимость, необходимость поддержания колонии, а также дополнительные осторожностью необходимости во время операции и жилье.
Функциональный дефицит наблюдается после операции: По нашему опыту, мы не наблюдали появления каких-либо функциональных дефицитов после этой процедуры, когда оцениваются меры, такие как передняя и задние конечности прочность сцепления и диафрагмального нерва / диафрагмы соединения потенциалов мышц действия, даже с 6 сайтов инъекций ( из 2μL каждая) в шейном отделе спинного мозга. Разрушение ткани также не наблюдалось. Возможные причины возникновения этих проблем относятся: не использовать предложил иглой, потребители инъекционных больших объемах и / или числа клеток, непреднамеренного повреждения, вызванные неправильным ламинэктомии, отсутствие деликатности при сокращении длительности (например, щипать шнур с # 5 щипцов) или во время процесса вставки иглы Гамильтон в спинной мозг (заменить скучный иглы).
Клетки не найден в вентральной серого вещества: Это может быть связано с рядом вопросов. Если инъекция не попадает в створ медиально или латерально, убедитесь, что правильно выстраиваются параллельно с системой впрыска оси спинного мозга, и вставить иглу просто медиальнее вступления спинной корешков. Если инъекция не попадает в створ сверху или снизу, убедитесь, что ваш нулевой оси читать, когда кончик иглы, едва касаясь дорсальной поверхности спинного мозга, использовать предложил Гамильтон иглы с соответствующей конической (больше конических могут повлиять на адресность), уверяют, что спинной мозг не сжимает при вставке иглы, заботиться точно измерения глубины с помощью микроманипулятора и использование животных в пределах предложил диапазона массы. Настройте вашу технику соответствующим образом, если вы постоянно инъекционных клетки в месте (что требует гистологического исследования и последующей модификации техники). Если инъекции беспорядочно разбросанных по всем сайтам в инъекции, вы должны на практике для улучшения консистенции. Если клетки, как правило, расположены в основном на спинной части спинного мозга вдоль иглы трек, ждать дольше, до и после инъекции клеток, а также продлить фактический инъекции в течение более длительного периода времени.
4. Представитель Результаты:
Мышь полученных глиальных клеток-предшественников были пересажены (50 000 клеток / сайта) в вентральных рогов спинного C4 уровне мозга в взрослой крысы SOD1 G93A. Мышь полученных пересаженные клетки можно выделить из тканей хозяина крыс через обнаружение с помощью мыши-специфических антител, M2. Это изображение показывает выживание M2 + пересадки клеток, полученных через 1 месяц после трансплантации (см. рисунок 12). Клетки локализованы в вентральной серого вещества, но инъекции медиально пропустил боковой вентральный рог (расположение наиболее диафрагмальных мотонейронов: обозначается пунктирной линией). Нет образованию кист было видно, когда 50000 клетки вводили в сайт, а не поведенческими нарушениями в результате инъекции процедуры. Тем не менее, инъекции гораздо большего числа клеток (фактическое количество варьируется в зависимости от типа клеток, и должна быть систематически оценивать) приводит к повреждению в месте инъекции и иглы вдоль дорожки (см. Рисунок 13: иммуногистохимии с астроцитов маркер, GFAP) .
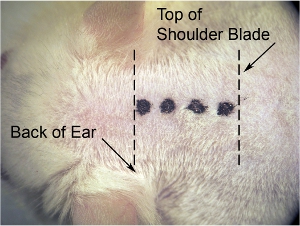
Рисунок 1. Первоначальный разрез кожи. На низком увеличении микроскопа (мы используем 8-кратном увеличении), используйте лезвие скальпеля, чтобы сделать срединный разрез. Натяжные кожи по бокам с другой стороны, чтобы сделать кожу тугие (что делает кожу легче сократиться), и сделать разрез (обозначается толстая пунктирная линия) от основания черепа (на уровне задней уши), чтобы лопатки (обозначается тонкой пунктирной линией).
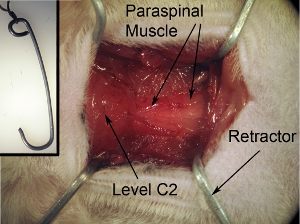
Рисунок 2. Воздействие операционного поля. Хирургическом воздействии должна быть квадратной / прямоугольную форму. Эта форма может быть достигнуто путем вытягивания окружающих мышц по отношению к 4-х углов с помощью 4 преднатяжителями. Лента строку, которая прилагается к преднатяжителями к хирургическому борту в целях обеспечения преднатяжителями и правильно держать поле открытым.
Рисунок 2-вставке. Ретракторы для экспозиции операционного поля. Преднатяжителями используются отступить мышц с целью создания операционного поля с обоими четкую видимость спинного мозга и достаточно места для выполнения операции. Ретракторы может быть сделано путем формирования крепкий скрепки в требуемую форму и размер. Автоклав преднатяжителями до хирургического вмешательства. Tie строку втягивающего устройства.
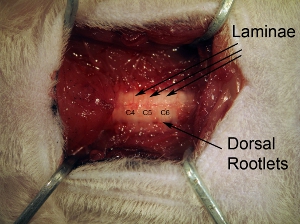
Фигура3. Позвонков. После удаления параспинальная мышцы, тщательно очистить дорсальной поверхности позвонков с костные кусачки. Индивидуальные пластинки можно увидеть, а также спинной корешки, поступающих из наружной стороны позвоночного столба.
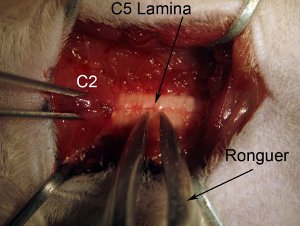
Рисунок 4. Ламинэктомия. Начать ламинэктомии на уровне спинного мозга C5. Безопасные позвоночник, удерживая мышцы вышележащих уровня C2 с крысой зубчатых щипцов. Захват всей пластинки (см. рисунок: захватить около средней линии) с костные кусачки. Позиция костные кусачки, так что инструмент полностью перпендикулярно оси позвоночника. Медленно раздавить пластинки. Не давите вниз в спинной мозг, так как это может привести к повреждению спинного ткани. Давка и осторожно потяните обломок кости вверх. Костные кусачки должны сокрушить кусок, чтобы можно было легко тронуться с места, чтобы удалить. Если кусок кости все еще присоединен к остальной пластинки, не буксира так как это вызовет кровотечение и возможное повреждение спинного мозга. Костные кусачки должны быть чистыми и острыми.
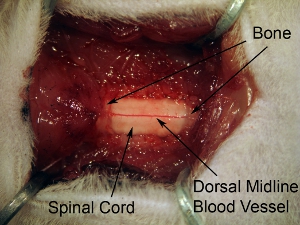
Рисунок 5. Воздействие на ткани спинного ламинэктомии следующие мозга. Расширение ламинэктомии раскрыть все С4-С6 спинного мозга. Сделать 1 непрерывных открытия в кости более 3 спинного уровнях. Не выдвигайте ламинэктомии слишком далеко сбоку, потому что это вызовет кровотечение. В целях выявления вентрального рога, инъекции относительно медиальной, так что это не продлевать ламинэктомии на полный боковой степени позвоночной кости.
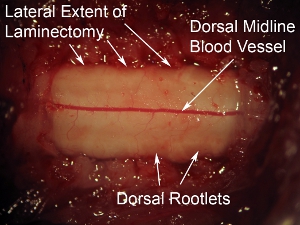
Рисунок 6. Высокая увеличение дорсальной поверхности спинного мозга. Видные спинной кровеносный сосуд можно увидеть бежала по средней линии спинной мозг. Эта схема кровеносных сосудов наблюдается в большинстве случаев, однако, некоторые животные дисплей без средней линии траектории кровеносных сосудов. Спинные корешки можно увидеть на боковой аспекты спинной поверхности спинного мозга. По отношению к твердой мозговой оболочки покрывающей спинной мозг, нервы эти туманные внешний вид.
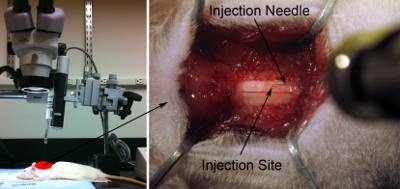
Рисунок 7. Инъекция установки. Выстроить шприц / иглу параллельно оси позвоночника правильно целевой желаемого анатомической области. Иглу под углом ровно настолько (около 80 градусов по отношению к операционном столе), чтобы не ударить головой хирургические возможности, но как можно ближе к 90-градусов, насколько возможно (слева). Нижней инъекции кончиком, направленным к спинной мозг спинной поверхности с помощью микроскопа (справа). Аккуратно сенсорным поверхности спинного мозга с кончика иглы. Слегка нажмите шнур с иглой. Уберите иглы до спинного мозга возвращается к нормальной плоской государства. Запись этой позиции, поскольку г = 0,0 с использованием линейки на микроманипулятора.
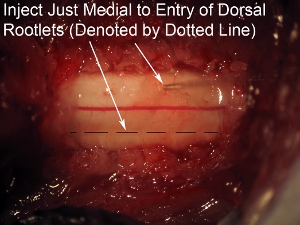
Рисунок 8. Высокое увеличение спинного мозга инъекции Цель игла просто медиальнее вступления зону спинного корешков (обозначается пунктирной линией).
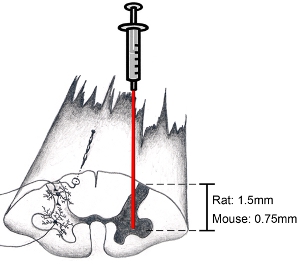
Рисунок 9. Схема спинного мозга: как целевой анатомической области интереса При попытке целевой вентральный рог, надрезать оболочки параллельно оси позвоночника просто медиальнее вступления зону спинного корешков.. Это позволит одной до целевой вентрального рога. Нижняя иглы на глубину от 1,5 мм до целевой вентральных рогов у взрослых крыс (возраст и пол животного, не делает большую часть разницы по глубине). Нижняя иглы на глубину 0,75 мм до целевой вентральных рогов у взрослых мышей. Конечно, глубины и бокового положения зависит от конкретного региона, представляющих интерес.
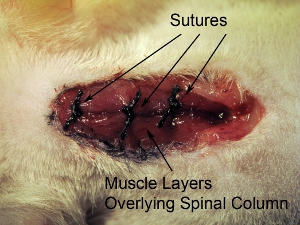
Рисунок 10. Закрытие места операции. Шовный закрыты три слоя вышележащих мышц в одно время с 4-0 шва. Шовный мышцы на 3 места в ростральной-каудальной оси.
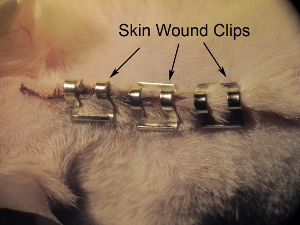
Рисунок 11. Сшивание кожи. Сшивания кожи закрыты с 9,0 мм клипы раны. Затяните скобы с иглодержатели, чтобы предотвратить животное от снимая скобы до полного заживления ран. Космическая скобы примерно 0,5 мм друг от друга.
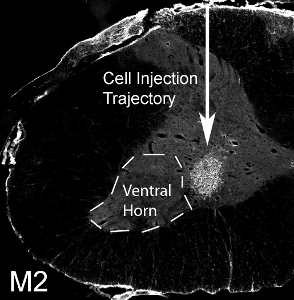
Рисунок 12. Трансплантация глиальных предшественников в цервикальный вентрального рога. 50000 мыши полученных глиальные клетки-предшественники были трансплантированы в вентральных рогов спинного C4 уровне мозга в крысу SOD1 G93A. M2 + мышь полученных пересаженные клетки выжили через 1 месяц после трансплантации. Клетки локализованы в вентральной серого вещества, но инъекции медиально пропустил боковой вентральный рог (обозначаетсяпунктирной линией).
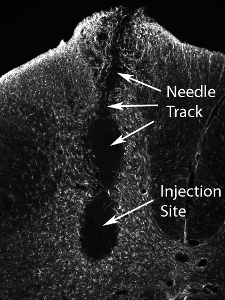
Рисунок 13. Повреждения тканей после трансплантации из большого числа нервных клеток предшественников. Инъекция гораздо большего числа клеток (фактическое количество варьируется в зависимости от типа клеток, и их следует систематически оценивать) приводит к повреждению в месте инъекции и иглы вдоль дорожки.
Обсуждение
Для исследований с участием SOD1 G93A мышей и крыс, возраста и пола животных матча в группе, и распространять животных в пределах одного помета к разным группам. Желательно, чтобы использовать все животные одного пола как для БАС и SCI моделей, поскольку болезненные процессы могут отли?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Я хотел бы поблагодарить: все члены Lepore, Maragakis и Ротштейн лабораторий за полезные обсуждения; Парализованные ветераны Америки и Крейг Х. Нильсен фонд для финансирования.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| HBSS | Гибко | 14170 | |
| 0,05% трипсина | Гибко | 25300 | |
| Соевый ингибитор трипсина (опционально) | Сигма | T-6522 | |
| Acepromazine малеата (0,7 мг / кг) | Fermenta здоровья животных | ||
| Кетамин (95 мг / кг) | Fort Dodge Animal Health | ||
| Ксилазин (10 мг / кг) | Bayer | ||
| # 11 Перо хирургические лезвия | Электронная микроскопия наук | 72044-11 | |
| Хлопок наконечником аппликаторы (6 дюймов) | Рыболов | 23-400-101 | |
| Крыса-зубчатые щипцы | Инструменты изобразительных наук | Крыса: 11023-15; Мышь: 11042-08 | |
| Средние ножницы весны | Инструменты изобразительных наук | 15012-12 | |
| Мини весной ножницы | Инструменты изобразительных наук | 15000-10 | |
| Костные кусачки | Инструменты изобразительных наук | Крыса: 16121-14; Мышь: 16221-14 | |
| Microknife | Инструменты изобразительных наук | 10056-12 | |
| Иглодержатели | Инструменты изобразительных наук | 12502-14 | |
| Шовный: 4-0 | Викрил | S-183 | |
| Staples: 9 мм | Autoclip | 427631 | |
| Степлер: 9 мм (Reflex # 203-1000) | Инструменты Всемирного Precision | 5000344 | |
| Теплый водяной насос (Т / насос) | Гаймар | P / N 07999-000 | |
| Циклоспорин: 250.0 mg/5.0 мл ампулы | Novartis / Sandimmune | НДЦ 0078-0109-01 | |
| FK-506 | LC лаборатории | F-4900 | |
| Рапамицин | LC лаборатории | R-5000 | |
| Инжектор | Инструменты Всемирного Precision | UMP2 | |
| Микро 4 микрошприца контроллер насоса | Инструменты Всемирного Precision | UMC4 | |
| Микроманипулятор | Инструменты Всемирного Precision | Кайт-R | |
| 10,0 мкл шприце Hamilton | Гамильтон | 80030 | |
| Гамильтон игл: 33 калибра, 45 ° скос, 1 дюйм | Гамильтон | 7803-05 | |
| Стекло 20,0 мкл микрокапиллярных пипетки (опционально) | Кимбл | 71900-20 |
Ссылки
- Lane, M. A., Fuller, D. D., White, T. E. Respiratory recovery following high cervical hemisection. Trends in neurosciences. 31, 538-538 (2008).
- Kaplan, L. M., Hollander, D. Respiratory dysfunction in amyotrophic lateral sclerosis. Clin. Chest. Med. 15, 675-675 (1994).
- Miller, R. G., Rosenberg, J. A., Gelinas, D. F. Practice parameter: the care of the patient with amyotrophic lateral sclerosis (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology: ALS Practice Parameters Task Force. Neurology. 52, 1311-1323 (1999).
- Mitsumoto, H., Chad, D. A., Pioro, E. P., Davis, F. A. . Amyotrophic lateral sclerosis. , (1998).
- Tandan, R., Bradley, W. G. Amyotrophic leteral sclerosis: Part 2. Etiopathogenesis. Annals of neurology. 18, 419-419 (1985).
- Bruijn, L. I., Miller, T. M., Cleveland, D. W. Unraveling the mechanisms involved in motor neuron degeneration in ALS. Annu Rev Neurosci. 27, 723-723 (2004).
- Rosen, D. R., Siddique, T., Patterson, D. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 362, 59-59 (1993).
- Bruijn, L. I., Becher, M. W., Lee, M. K. ALS-linked SOD1 mutant G85R mediates damage to astrocytes and promotes rapidly progressive disease with SOD1-containing inclusions. Neuron. 18, 327-327 (1997).
- Gurney, M. E., Pu, H., Chiu, A. Y. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264, 1772-1775 (1994).
- Howland, D. S., Liu, J., She, Y. Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS). Proc Natl Acad Sci. 99, 1604-1604 (2002).
- Nagai, M., Aoki, M., Miyoshi, I. Rats expressing human cytosolic copper-zinc superoxide dismutase transgenes with amyotrophic lateral sclerosis: associated mutations develop motor neuron disease. J. Neurosci. 21, 9246-9246 (2001).
- McDonald, W., Becker, D. Spinal cord injury: promising interventions and realistic goals. Am. J. Phys. Med. Rehabi. I82, S38-S38 (2003).
- Sandrow-Feinberg, H. R., Zhukareva, V., Santi, L. PEGylated interferon-beta modulates the acute inflammatory response and recovery when combined with forced exercise following cervical spinal contusion injury. Experimental neurology. 223, 439-451 (2010).
- Gage, F. H. Mammalian neural stem cells. Science. 287, 1433-1433 (2000).
- Lane, M. A., Lee, K. Z., Fuller, D. D. Spinal circuitry and respiratory recovery following spinal cord injury. Respiratory physiology & neurobiology. 169, 123-123 (2009).
- Lepore, A. C., Rauck, B., Dejea, C. Focal transplantation-based astrocyte replacement is neuroprotective in a model of motor neuron disease. Nature. 11, 1294-1294 (2008).
- Rao, M. S. Multipotent and Restricted Precursors in the Central Nervous System. Anat Rec. 257, 137-137 (1999).
- Rao, M. S., Mayer-Proschel, M. Glial- restricted precursors are derived from multipotent neuroepithelial stem cells. Dev Biol. 188, 48-48 (1997).
- Suzuki, M., Tork, C., Shelley, B. Sexual dimorphism in disease onset and progression of a rat model of ALS. Sexual dimorphism in disease onset and progression of a rat model of ALS. Amyotroph Lateral Scler. 8, 20-20 (2007).
- Lepore, A. C., Haenggeli, C., Gasmi, M. Intraparenchymal spinal cord delivery of adeno-associated virus IGF-1 is protective in the SOD1G93A model of ALS. Brain research. 1185, 256-256 (2007).
- Veldink, J. H., Bar, P. R., Joosten, E. A. Sexual differences in onset of disease and response to exercise in a transgenic model of ALS. Neuromuscul Disord. 13, 737-737 (2003).
- Shumsky, J. S., Lepore, A. C. Transplantation of Neuronal and Glial Restricted Precursors into Contused Spinal Cord Improves Bladder and Motor Functions, Decreases Thermal Hypersensitivity, and Modifies Intraspinal Circuitry. J. Neurosci. 25, 9624-9624 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены