Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Cell Transplantation intraspinale pour le ciblage du col corne ventrale de la sclérose latérale amyotrophique et les lésions de la moelle épinière
Dans cet article
Résumé
La transplantation précurseurs neuraux est une stratégie prometteuse pour protéger et / ou le remplacement perdu / dysfonctionnel cervicale neurones moteurs phrénique des blessures de la moelle épinière (SCI) et les neurones moteurs désordre, la sclérose amyotrophique latérales (SLA). Nous fournissons un protocole pour la livraison de cellule à la corne moelle épinière cervicale ventrale dans des modèles rongeurs de la SLA et la SCI.
Résumé
Compromis respiratoire due à la perte des neurones moteurs phrénique est une conséquence débilitante d'une grande proportion de lésions de la moelle humaine traumatisante épinière (SCI) des cas 1 et est la cause ultime de la mort chez les patients atteints du trouble du neurone moteur, la sclérose amyotrophique latérales (ALS) 2.
La SLA est une maladie neurologique dévastatrice qui se caractérise par une dégénérescence relativement rapide du supérieur et les neurones moteurs inférieurs. Les patients en fin de compte succomber à la maladie, en moyenne 2-5 ans après le diagnostic en raison de la paralysie respiratoire due à une perte de neurones moteurs innnervation phrénique du diaphragme 3. La grande majorité des cas sont sporadiques, tandis que 10% sont de la forme familiale. Environ vingt pour cent de cas familiaux sont liés à des mutations ponctuelles dans le gène de diverses Cu / Zn superoxyde dismutase 1 (SOD1) sur le chromosome 21 4. Les souris transgéniques 4,5 et 6 portant des rats mutants SOD1 humaine gènes (G93A, G37R, G86R, G85R) ont été générés, et, malgré l'existence de modèles animaux autres la perte des neurones moteurs, sont actuellement les modèles les plus utilisés de la maladie .
Lésion de la moelle épinière (SCI) est un ensemble hétérogène de conditions résultant d'un traumatisme physique à la moelle épinière, avec des résultats fonctionnels variant selon le type, la localisation et la sévérité de la blessure 7. Néanmoins, environ la moitié des cas de SCI humaines affectent les régions cervicale, entraînant un dysfonctionnement respiratoire débilitante due à la perte de neurones moteurs phrénique et de blessures aux axones descendant respiratoires bulbospinal 1. Un certain nombre de modèles animaux de la SCI ont été développés, avec le plus couramment utilisé et cliniquement pertinente étant la contusion 8.
Transplantation des différentes classes de cellules précurseurs neurales (PNJ) est une stratégie thérapeutique prometteuse pour le traitement des lésions du SNC traumatique et la neurodégénérescence, notamment la SLA et la SCI, en raison de la capacité de remplacer la neuroprotection perdu ou dysfonctionnel types de cellules du SNC, de fournir et livrer des facteurs génétiques d'intérêts 9.
Les modèles animaux de la SLA et la SCI peut modéliser de nombreux aspects cliniquement pertinentes de ces maladies, y compris la perte de neurones moteurs phrénique et conséquente de troubles respiratoires, 10,11. Afin d'évaluer l'efficacité des PNJ des stratégies basées sur la fonction respiratoire dans ces modèles animaux de la SLA et la SCI, les interventions cellulaires doivent être spécifiquement destinées à des régions contenant des cibles thérapeutiques pertinentes telles que les neurones moteurs phrénique. Nous fournissons un protocole détaillé pour le multi-segmentaire, la transplantation intraspinale de PNJ dans la moelle épinière ventrale du col de la matière grise des modèles de maladies neurodégénératives telles que les souris SOD1 G93A et les rats, ainsi que des rats blessés médullaires et des souris 11.
Protocole
Méthodes
1. Préparation des cellules
Comme exemple, nous allons décrire la procédure de préparation de cellules progénitrices gliales 12 pour la transplantation en raison de notre expérience avec ce type de cellule. Cependant, les spécificités du protocole, y compris le milieu et l'utilisation de la trypsine par exemple, va dépendre du type cellulaire particulier qui est utilisé pour la transplantation.
- Préchauffer toutes les solutions à 37,0 ° C au bain-marie.
- Rincer avec HBSS 2X flacon. Ajouter 5,0 mL/T-75 flacon de 0,05% de trypsine / EDTA. Incuber ballon pendant 3 minutes dans 37,0 ° C incubateur. Triturer 3X doucement dans le ballon avec 5 ou 10 ml pipette.
Facultatif: Ajoutez 5,0 mL/T-75 flacon de 1,0 mg / ml d'inhibiteur de trypsine de soja dans DMEM/F12.
- Rincer chaque 2X ballon dans 5,0 ml de milieu. Piscine cellules et se rince. Gardez les cellules sur la glace pour toutes les étapes ultérieures.
- Spin à 200-300 g pendant 5 minutes dans le tube conique: de préférence en centrifugeuse refroidie à 4 ° C. Décanter (et sauvegarder) surnageant. Re-suspendre les cellules dans 1,0 ml de milieu, et le transfert d'Eppendorf de 1,5 ml tube.
- Compter les cellules avec des hémocytomètre bleu trypan pour déterminer la viabilité.
- Spin nouveau tube de 1,5 ml au (800 rpm pendant 10 minutes: de préférence dans la centrifugeuse refroidie à 4 ° C). Décanter (et sauvegarder) surnageant.
- Re-suspendre les cellules dans le volume final désiré du milieu pour obtenir une densité cellulaire appropriée.
- Distribuer des suspensions cellulaires à de multiples tubes Eppendorf de 1,5 ml. Gardez les cellules sur la glace mouillée jusqu'à la transplantation.
Ne pas utiliser 0,75 mL tubes, comme la seringue Hamilton / aiguille ne rentre pas en profondeur dans ce tube. Les injections multiples sera probablement prise lors des sessions chirurgie, et l'on veut éviter de perturber le même tube de cellules à plusieurs reprises. Essayez de préparer le volume d'au moins 50% de plus de suspension de cellules que nécessaire. Gardez les cellules sur la glace pendant toute la session chirurgie. Cellules de greffe au sein de 4-5 heures de préparation de suspensions cellulaires en vue d'assurer plus de viabilité des cellules après la transplantation.
2. Préparation avant la chirurgie
- Effectuer des évaluations pertinentes comportement de base avant la chirurgie.
- Un déficit immunitaire: la cyclosporine sous-cutanée A (CSA: 10,0 mg / kg de poids corporel) ou intrapéritonéale (IP) FK-506/Rapamycin (1,0 mg / kg de poids corporel) doit être lancé au moins 3 jours avant la greffe, et doit être administré quotidiennement jusqu'au sacrifice. L'Administration dans l'eau potable (au lieu d'injections quotidiennes) n'est pas conseillé. CSA est notre immunosuppresseur de choix lors de la transplantation des cellules dérivées de rongeurs, tandis que FK-506/Rapamycin est notre choix lors de la transplantation humaine des cellules dérivées.
- Autoclave outils chirurgicaux avant la chirurgie. Préparez un endroit propre et en faire de la chirurgie, ainsi que l'endroit dégagé pour mettre les outils. Un stérilisateur perles de verre est également utile. Gardez tous les outils de nettoyage (surtout rongeur) pendant la chirurgie, car cela rendra la procédure plus facile. Tout matériel utilisé pendant l'intervention chirurgicale doit être stérile.
- Les instruments qui ne peuvent pas être stérilisés comme le microscope chirurgical doit être essuyé avec un désinfectant approprié et les poignées couvertes de matériel stérile (gaze, par exemple) afin que le chirurgien, une fois enfilé des gants stériles, ne pas contaminer son / ses gants.
- Le chirurgien doit laver son / ses mains avec un désinfectant (chlorhexidine gommage) avant le début de la chirurgie. Le chirurgien va porter des gants stériles, un masque et une blouse propre.
3. Chirurgie: préparation et la chirurgie des animaux
Animaux de préparation:
- Peser les animaux, et d'administrer la dose appropriée de l'anesthésie: l'inhalation isofluorane ou un cocktail anesthésique (livré via IP) de [maléate d'acépromazine (0,7 mg / kg), la kétamine (95 mg / kg), et de xylazine (10 mg / kg)].
- Pincez orteils et / ou utiliser le réflexe palpébral (toucher la paupière supérieure avec un coton-tige d'applicateur d'observer clignotant) pour déterminer si l'animal est correctement anesthésié. Les cornées doivent être protégés en appliquant une pommade larme artificielle avant la chirurgie.
- Rasez les cheveux avec un rasoir électrique (pas d'attachement au besoin). Rasage de légèrement rostrales aux oreilles au milieu du dos de l'animal. Rasage bien, et enlever les poils coupés de la peau pour empêcher les cheveux d'entrer dans l'incision. La préparation chirurgicale doit être effectuée hors de la zone où la chirurgie sera réalisée afin d'éviter la contamination du site opératoire avec des cheveux errants.
- Faire tremper la gaze avec une solution antiseptique Povidine-iode, et appliquer sur la peau sur la zone rasée. Le site chirurgical doit être nettoyée au moins deux fois avec la solution Povidine-iode, en prenant soin de gommage du centre du site vers la périphérie. Le site peut alors être rincée avec de l'alcool 70% ou dilué gommage germicide. La zone devrait être couvert avec des draps stériles.
- Tout au long de la chirurgie, l'utilisation d'un coussin chauffant iest fortement recommandé pour maintenir la température de l'animal normal du corps. De plus, la température du corps doit être surveillée. Placer sur des animaux tampon de gaze roulée. Pour un rat adulte, la compresse de gaze roulée devrait être ~ 1,0 pouce d'épaisseur et ~ 6,0 pouces de longueur. Ruban ce pad à bord une chirurgie afin qu'elle ne bouge pas. Placer sur des animaux pavé au niveau de la poitrine / épaule. Étends les deux bras sur le coussin, et bande les armes à bord chirurgie. L'idée est de soutenir la moelle épinière cervicale de sorte que c'est plus facile de travailler tout au long de la chirurgie depuis la moelle cervicale se trouve profondément sous la surface de la peau.
Chirurgie:
- Sur le grossissement le plus faible de microscope (nous utilisons grossissement x 8), l'utilisation lame de bistouri pour faire incision médiane. Étirer la peau latéralement avec l'autre main pour faire peau tendue (ce qui rend la peau plus facile pour inciser), et faire une incision de la base du crâne à l'omoplate. (Voir Figure 1)
- Utilisez lame de bistouri pour faire une incision à travers 3 couches musculaires au cours de la colonne vertébrale. Légèrement serrer les muscles (de dehors en dedans), des deux côtés avec l'autre main. Veillez à appuyer assez fermement avec un scalpel pour couper toutes les couches musculaires avec le moins de coupures que possible afin que les incisions musculaires ne sera pas déchiquetés, ce qui rend suture à la fin de la chirurgie plus facile. Cependant, ne pas appuyer trop fermement pour éviter de créer des dommages dans les tissus plus profonds (colonne vertébrale).
- Avec deux coton-tige, utilisez mouvement de torsion de se séparer du muscle sus-jacente à partir de muscle paravertébraux. On peut être vigoureuse ici. Ne pas couper ou déchirer, comme cela va causer une hémorragie. Mouvement de torsion avec les applicateurs seront bien taquiner les tissus sans provoquer de dégâts en dehors ou d'hémorragie. Si l'hémorragie se produit à n'importe quel stade de la chirurgie, il est préférable d'être patient. Ne pas essayer de précipiter les choses avec beaucoup d'hémorragie parce que le sang va obscurcir la vision du champ opératoire. Cautérisation ou une légère pression peut être appliquée sur le site de l'hémorragie, mais nous constatons que la patience est la meilleure. Avec la pratique, il devrait y avoir peu ou pas d'une hémorragie au long de cette chirurgie.
- Rétracter musculaire avec quatre écarteurs maison (voir Figure 2). Ces enrouleurs peuvent être fabriqués à partir de trombones robustes en forme dans un écarteur (voir Figure 2-en médaillon). Autoclave ces derniers avant la chirurgie. Des précautions doivent être prises pour émousser les extrémités des écarteurs pour éviter d'endommager les tissus. Tie chaîne à enrouleur. L'exposition doit être carrée / rectangle en forme. Cette forme peut être atteint en tirant à 4 coins en utilisant les 4 écarteurs. Chaîne de bande de monter à bord afin de sécuriser écarteurs (voir Figure 2). Disponibles dans le commerce écarteurs peuvent également être utilisés, mais nous préférons ne pas utiliser ces. Il est crucial de créer un bon champ opératoire afin de voir clairement à travers la chirurgie. Ne pas "aveuglément" continuer le long.
- Effacer les muscles paravertébraux de la surface dorsale de la colonne vertébrale. Pour faire face à des muscles paravertébraux sur la surface dorsale de la colonne vertébrale, il ya deux stratégies possibles. Pour la première stratégie, l'utilisation à dents de rat pinces et de ciseaux à ressort de taille moyenne à retirer musculaire paravertébrale de la surface dorsale des vertèbres. Essayez de faire des coupes très près de l'os pour mieux exposer la surface des os. Faire des coupes parallèles à la surface des vertèbres, mais ne coupez pas vers le bas dans la moelle. Pour la deuxième approche, faire une incision médiane au para-spinale musculaire, et se rétractent latéralement avec de petits écarteurs. Dans la seconde approche, le muscle peut alors être suturés ensemble après la chirurgie.
- Nettoyer la surface de l'os vertébral bien. Utilisez rongeur (le plus important instrument de chirurgie) à se détacher du muscle à partir des niveaux C4, C5 et C6 (voir figure 3). Ceci, bien sûr, dépend des niveaux spinaux qui sont ciblés. Tout en utilisant rongeur avec une seule main, sécuriser l'ensemble de la colonne vertébrale en saisissant des muscles sur les processus de C2 avec une pince à dents de rat dans l'autre main. C2 est le processus de grande rostrale dans le domaine chirurgical. C3 est légèrement sous le muscle aussi bien. C4, C5 et C6 sont faciles d'accès car ils ont leur petit muscle sus-jacente.
- Commencez par laminectomie de C5. Encore une fois, sécurisé par la tenue C2 avec une pince à dents de rat. Grab limbe entier (voir le diagramme: appui près médiane) avec rongeur. Rongeur position de sorte que l'outil est complètement perpendiculaires à l'axe de la colonne vertébrale. Lentement écraser limbe. Ne poussez pas vers le bas dans la moelle épinière, comme cela va causer des dommages aux tissus épinière. Crush et tirez doucement le haut du morceau cassé l'os. Rongeur devrait écraser morceau de sorte que l'on peut facilement se détacher à enlever. Si morceau d'os est toujours attachée au reste de la lame, ne tirez pas que cela va causer une hémorragie et d'éventuelles blessures à la moelle épinière. Rongeur doit être propre et nette. Des instruments tels que le rongeur doit être lavé / essuyés avec une solution saline stérile, qui peut être fourni dans un bol stérile (voir Figure 4).
Pour l'ouverture initiale de la laminectomie, le positionnement de la perpen rongeurperpendiculaire à la colonne vertébrale est préférable. Cette étape peut être suivie en prenant de petites «bouchées» pour étendre la laminectomie en insérant le rongeur doucement sous l'os avec un angle d'environ 30 à 60 degrés par rapport à la surface du cordon. - Etendre à l'ensemble de laminectomie C4-C6 lames. Faire une ouverture continue dans l'os sur trois niveaux épinière. L'étendue de la laminectomie peut être ajustée en fonction de l'endroit désiré (s) de l'injection intrarachidienne.
- Ne pas prolonger trop loin latéralement laminectomie parce que cela va causer une hémorragie. Afin de cibler corne ventrale, le site d'injection est relativement médiane, il est donc inutile d'étendre laminectomie loin latéralement. (Voir figure 5)
- Augmenter l'agrandissement d'environ 15 x.
- Nettoyez le tissu conjonctif (et éventuellement du sang séché) sur le dessus de Dura avec une pince # 5 pointus / droite. La différence entre le tissu conjonctif et la durée doit être appris avec l'expérience.
- Incisez-mère, une couche très dure méningée, soit avec un mini-ressort des ciseaux ou microknife. Faire une incision parallèle à l'axe de la colonne vertébrale juste en dedans de la zone d'entrée des radicelles dorsales. Cela permettra de cibler une la corne ventrale. (Voir Figure 6)
- Utilisez pointus / droites n ° 5 pinces pour saisir et soulever légèrement durée hors de la moelle épinière. Ne pas pincer / blesser la moelle épinière. Cela prend un peu de pratique. Faire des incisions avec des ciseaux à ressort microknife ou très petits. Ne pas blesser la moelle épinière.
- Prolonger l'incision légèrement en rostrale-caudale axe. La tension de Dura se séparer légèrement durée pour créer une exposition agréable de la moelle épinière.
- Faire des incisions sur tous les sites appropriés pour chaque injection prévue. Dura a une apparence brumeuse translucide, tandis que la surface de la moelle épinière a une brillante de couleur blanche apparence. Il faudra apprendre à distinguer ces dehors. Il est conseillé de ne pas essayer d'injecter à travers la durée avec l'aiguille d'injection. La mère est dure, de sorte qu'il sera difficile de percer à travers elle. En outre, les percer à travers la dure mère peut affecter la trajectoire d'insertion de l'aiguille et donc affecter la livraison anatomique ciblée des cellules.
- Injecter des cellules bilatérale à 3 niveaux (6 sites au total) pour cibler grande région de l'élargissement du col. Le nombre et l'emplacement (s) d'injections, bien sûr, dépend de l'expérience spécifique.
- Après avoir percé mère, liquide céphalo-rachidien répandrai. Surface sèche du cordon et l'exposition entière avec de la gaze ou un coton-tige de l'applicateur.
- Pour l'injection de cellules, utilisez 10.0μL Hamilton étanche RN seringue.
- Attachez 33 de calibre / 45 degrés en métal biseauté RN Hamilton aiguille. L'aiguille doit être forte. Utiliser la même aiguille pour seulement ~ 20 injections (l'aiguille sera plus nettes avec moins d'injections). On peut également utiliser des tubes de verre tiré capillaire pour les aiguilles. Utilisez époxy pour fixer la pointe de verre tiré à 26 aiguille de calibre émoussée en métal Hamilton. Garniture diamètre de l'extrémité extérieure à ~ 75.0 à 100.0 uL (selon le diamètre des cellules: on ne veut pas endommager les cellules lors du processus d'injection) à l'aide d'un microscope chirurgical et micromètre. Nous préférons les aiguilles en métal de 33 jauge.
- Les cellules vont tomber de suspension facilement à l'intérieur du tube Eppendorf sur la glace. Immédiatement avant le chargement de la seringue, tapotez doucement le tube jusqu'à ce cellules revenir en suspension. Ne pas feuilleter trop intensément que ce sera blesser les cellules et / ou des bulles cause. Sinon, utilisez la pipette 20.0μL-homme à mélanger délicatement les cellules: cellules en suspension pipette seulement une ou deux fois haut et bas.
- Chargez suffisamment de volume de suspension cellulaire pour un seul site d'injection. Les cellules vont tomber de suspension à l'intérieur de la seringue d'injection si l'on prévoit de faire de multiples injections. Lentement prendre jusqu'à cellules dans la seringue pour éviter les bulles et / ou des dommages aux cellules. Spécifiquement pour les cellules progénitrices gliales avec qui nous travaillons dans notre laboratoire, nous injectons 2,0 uL de suspension cellulaire à une dilution de 50,000-75,000 cellules par 1,0 uL plus de 2-5 minutes. Nous avons constaté que 2uL/site n'entraîne pas de dommages aux tissus de la moelle épinière cervicale. Au lieu de cela, notre expérience suggère que augmente considérablement le nombre de cellules dans ce volume (en particulier si elles sont plus grandes en taille que nos ancêtres gliales: 10,0 -20,0 m de diamètre) peut causer des dommages à la moelle épinière du parenchyme. Nous avons mené une expérience étendue de cellules de dosage pour déterminer le nombre optimal de cellules à injecter dans chaque site (au moins dans la moelle épinière cervicale intactes). Les paramètres doivent être déterminés pour le type de cellule spécifique et l'état de la maladie.
- Line up seringue / aiguille parallèle à l'axe de la colonne vertébrale afin de bien cibler la région anatomique désirée. L'aiguille est juste assez inclinée (environ 80 degrés par rapport à la table d'opération) à ne pas cogner la tête champ opératoire, mais aussi près de 90 degrés que possible. Basse pointe vers la surface dorsale de la moelle épinière en utilisant un microscope (voir figure 7).
- But aiguille juste en dedans de l'entrée zone des radicelles dorsales (voir figure 8). Toucher doucement la surface de la moelle épinière avec la pointe d'aiguille. Appuyer légèrement sur la moelle épinière avec une aiguille. Rétracter aiguille jusqu'à la moelle épinière est de retour à la normale. Notez cette position en tant que z = 0,0 en utilisant la règle sur le micromanipulateur.
Remarque: Nous faisons régulièrement ne se stabilisent pas la colonne vertébrale cervicale au cours des injections de la moelle épinière. Grâce à notre régime d'anesthésie, mouvement de haut en bas de la moelle cervicale vertébrale due à la respiration lourde n'a jamais été un problème. Toutefois, si la respiration lourde est un problème, la colonne vertébrale peut être stabilisée à l'aide d'un cadre personnalisé par un léger serrage de l'os et autour de para-spinale musculaire au niveau C2 et C7 en utilisant une pince modifiée, en faisant attention de ne pas écraser les os vertébral ou blesser le sous-jacente du tissu de la moelle épinière. Si la respiration de l'animal devient superficielle lors de la procédure, drogue plus d'anesthésie devrait être fournie. La chirurgie doit être interrompu jusqu'à ce qu'un plan chirurgical d'anesthésie a été re-réalisé avant la reprise. - Aiguille légèrement inférieurs dans la moelle épinière. Assurez-vous de regarder au microscope tout en faisant cela. Basse aiguille à une profondeur de 1,5 mm pour cibler corne ventrale chez des rats adultes. Basse aiguille à une profondeur de 0,75 mm pour cibler corne ventrale chez la souris adulte. (Voir Figure 9). Ces chiffres sont représentatifs de la profondeur pour adultes (au moins 3 mois) féminins et masculins rats Sprague-Dawley (250-450 grammes) et C57BL / 6 (20-35 grammes). Bien sûr, la profondeur et la position latérale dépendent de la région d'intérêt spécifiques. Ne pas déranger le système d'injection / la chirurgie pension ou table d'opération tandis aiguille est insérée dans la moelle épinière afin d'éviter des dommages aux tissus épinière.
- Attendez deux minutes (c'est même plus mieux) après avoir abaissé l'aiguille à la profondeur désirée avant l'injection.
- Injecter 2,0 uL plus de 2-5 minutes à vitesse constante en utilisant le contrôleur de pompe.
- Attendez deux minutes (c'est plus mieux) après l'injection avant de lentement retirer l'aiguille de la moelle épinière.
- Nettoyer avec une seringue dH2O après chaque injection afin d'éviter le colmatage. Lentement élaborer et d'expulser 3-5 fois. Ne pas aspirer de l'air dans la seringue.
- Retour à l'agrandissement plus bas (même que celle utilisée au début de la chirurgie: ~ 8 x). Suture durée fermée en utilisant 9-0 suture, mais ce n'est certainement pas nécessaire. Il est également difficile. Nous suturée durée fermée dans le passé, mais nous ne trouvons aucune différence dans le comportement animal, la survie de greffe ou l'histologie de la moelle épinière lorsque la durée n'est pas fermé par suture. La durée peut être recouverte d'un morceau de mousse protectrice gel stérile. La mousse de gel doivent être placés directement sur le dessus du site d'incision durale. Cependant, il est important de prendre soin de ne pas brutalement en tirant ce morceau de Gelfoam hors de la surface de la moelle épinière au cours de post-perfusion dissection, comme le Gelfoam peut parfois étroitement adhérer à la surface de la moelle épinière.
- En option: Suture musculaire paravertébrale fermée avec une suture 4-0.
- Suture fermé trois couches musculaires recouvrant à la fois avec une suture 4-0. Suture des muscles à trois endroits dans l'axe rostrale-caudale (voir figure 10).
- Agrafer la peau fermée avec 9,0 clips plaies mm (voir figure 11). Serrer les agrafes avec les détenteurs de l'aiguille pour empêcher les animaux d'arrachant les agrafes avant la cicatrisation complète. Espace agrafes d'environ 0.5cm d'intervalle. Ne pas trop serrer les clips plaie, comme cela peut conduire à une mauvaise cicatrisation et une nécrose.
- Appliquer Povidine-iode solution antiseptique pour plaies zone avec de la gaze imbibée.
- Laisser les animaux pour récupérer le pavé de l'eau chaude circule. Donnez injection sous-cutanée de solution stérile de Ringer lactate (5,0 ml pour les rats; 0,5 mL pour la souris) immédiatement après la chirurgie. Suivi injections peuvent également être fournie si l'animal semble déshydratés et / ou apathique. Traitement antibiotique prophylactique à l'aide 6.0mg/kg de céfazoline peut être utilisé, cependant, notre expérience suggère que cette procédure de transplantation ne résulte pas en infections post-chirurgicales, si d'asepsie sont respectées et tous les instruments / fournitures chirurgicales sont stérilisés. Si ces précautions sont respectées, l'administration d'antibiotiques est déconseillée.
- Continuer CSA ou FK-506/Rapamycin quotidienne jusqu'au sacrifice.
- La chirurgie ensemble devrait prendre moins de ~ 45 minutes (avec 6 points d'injection). Sinon, l'animal va commencer à se réveiller et de respirer plus fortement, ce qui nuira à l'injection dans la moelle épinière.
Conseils de dépannage pour problèmes liés à diverses étapes du protocole
Manque de survie cellulaire / pauvres: Ce n'est probablement pas un problème technique associé à l'injection, mais elle est probablement due aux propriétés du type de cellule injectée et / ou pour le régime immunosuppresseur. Ces questions doivent être empiriquement évaluées sur une cellule-type et par modèle animal spécifique. La disponibilité d'un certain nombre de modèles de rats et de souris immunodéficientessont également disponibles pour contourner des problèmes avec immunosuppresseur; cependant, ces animaux ont aussi des difficultés comme le coût, la nécessité de maintenir une colonie, et la prudence supplémentaire nécessaire pendant la chirurgie et le logement.
Déficits fonctionnels observés après la chirurgie: Dans notre expérience, nous n'avons pas observé la survenance de tout déficit fonctionnel suivant cette procédure lorsqu'elle est évaluée par des mesures telles que la force de préhension des membres antérieurs et postérieurs et phréniques nerveuses / diaphragme potentiels composés action musculaire, même avec des sites d'injections 6 ( des 2μL chacun) dans la moelle épinière cervicale. La destruction des tissus a également pas été observée. Les raisons possibles de l'apparition de ces problèmes sont: ne pas utiliser l'aiguille du manomètre a suggéré, l'injection de volumes plus importants et / ou des numéros de cellulaire, les dommages non intentionnels causés par laminectomie inadéquate, le manque de délicatesse tout en réduisant la durée (tels que le pincement de la corde avec le n ° 5 forceps) ou pendant le processus d'insertion de l'aiguille de Hamilton dans la moelle épinière (remplacer une aiguille terne).
Les cellules ne se trouve pas dans la matière grise ventrale: Cela pourrait être dû à un certain nombre de questions. Si l'injection manque la cible médiane ou latérale, assurez-vous de bien aligner le parallèle du système d'injection à l'axe de la moelle épinière, et insérer l'aiguille juste en dedans de l'entrée des radicelles dorsales. Si l'injection manque la cible dorsalement ou ventralement, assurez-vous de zéro de votre axe z la lecture lorsque la pointe de l'aiguille est à peine de toucher la surface dorsale de la moelle épinière, l'utilisation de l'aiguille a suggéré de Hamilton avec le biseau approprié (un long biseau peut affecter le ciblage), assure que la moelle épinière ne compresse pas lors de l'insertion de l'aiguille, prendre soin de mesurer exactement la profondeur à l'aide du micromanipulateur, et l'utilisation des animaux dans la fourchette de poids suggéré. Ajustez votre technique en conséquence si vous êtes constamment l'injection des cellules dans un endroit (ce qui nécessite une évaluation histologique et modification technique ultérieure). Si les injections sont éparpillées au hasard dans l'ensemble de vos sites d'injection, vous aurez besoin de pratique pour améliorer la cohérence. Si les cellules ont tendance à être situées principalement à la face dorsale de la moelle épinière le long du trajet de l'aiguille, attendre plus longtemps avant et après injection de cellules, et d'étendre l'injection réelle sur une plus longue période de temps.
4. Les résultats représentatifs:
Souris dérivées des cellules progénitrices gliales ont été transplantés (50 000 cellules / site) dans la corne antérieure de la moelle C4 niveau spinal dans un rat adulte SOD1 G93A. Souris dérivées des cellules transplantées peuvent être distingués des tissus de rat hôte via la détection par l'anticorps de souris spécifiques, M2. Cette image montre la survie de M2 + greffe des cellules dérivées à 1 mois post-transplantation (voir figure 12). Les cellules localisées à la matière grise ventrale, mais le site d'injection médiale raté la corne latérale ventrale (l'emplacement de la plupart des neurones moteurs phrénique: dénoté par la ligne pointillée). Aucune formation de kystes a été observée lorsque 50 000 cellules ont été injectées par site, et aucune dépréciation de comportement résultant de la procédure d'injection. Cependant, l'injection d'un nombre beaucoup plus élevé de cellules (le nombre réel varie selon le type cellulaire, et devraient être systématiquement évalués) entraîne des dommages au site d'injection et le long du trajet de l'aiguille (voir Figure 13: immunohistochimie avec le marqueur des astrocytes, GFAP) .
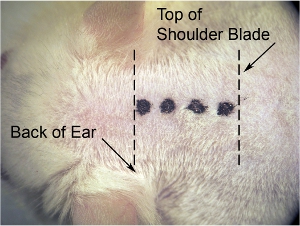
Figure 1. Incision initiale de la peau. Sur le grossissement le plus faible de microscope (nous utilisons grossissement x 8), l'utilisation lame de bistouri pour faire incision médiane. Étirer la peau latéralement avec l'autre main pour faire peau tendue (ce qui rend la peau plus facile à couper), et de faire l'incision (notée par la ligne pointillée d'épaisseur) à partir de la base du crâne (au niveau de l'arrière de l'oreille) afin de l'omoplate (notée par la ligne pointillée fine).
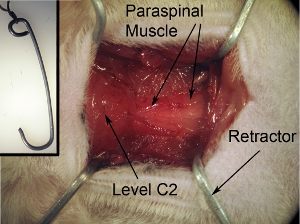
Figure 2. L'exposition du champ opératoire. L'exposition chirurgicale doit être carrée / rectangle en forme. Cette forme peut être obtenue en tirant les muscles entourant vers 4 coins en utilisant les 4 écarteurs. Chaîne de bande qui est attaché à enrouleurs à bord chirurgicale afin de sécuriser et d'écarteurs de tenir correctement en plein champ.
Figure 2-encart. Rétracteurs pour l'exposition du champ opératoire. Les enrouleurs sont utilisés pour retirer les muscles afin de créer un champ opératoire à la fois avec une visibilité claire de la moelle épinière et un espace suffisant pour effectuer la chirurgie. Rétracteurs peut être faite en façonnant trombones robustes dans la forme désirée et la taille. Autoclaver les écarteurs, avant la chirurgie. Tie chaîne à enrouleur.
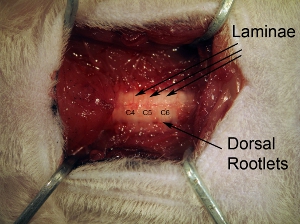
Figure3. Vertèbres. Après le retrait des muscles paravertébraux, nettoyer soigneusement la surface dorsale des vertèbres avec rongeur. Lamina individuels peuvent être vus, ainsi que des radicelles dorsales entrant par la face latérale de la colonne vertébrale.
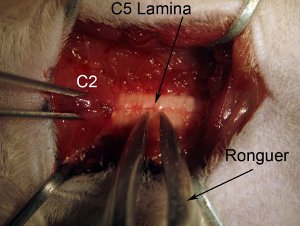
Figure 4. Laminectomie. Démarrer laminectomie au niveau de la moelle épinière C5. Fixez la colonne vertébrale par la tenue du muscle sus-jacentes au niveau C2 avec le rat pince à griffes. Grab limbe entier (voir le diagramme: appui près médiane) avec rongeur. Rongeur position de sorte que l'outil est complètement perpendiculaires à l'axe de la colonne vertébrale. Lentement écraser limbe. Ne poussez pas vers le bas dans la moelle épinière, comme cela va causer des dommages aux tissus épinière. Crush et tirez doucement le haut du morceau cassé l'os. Rongeur devrait écraser morceau de sorte que l'on peut facilement se détacher à enlever. Si morceau d'os est encore attaché au reste de lames, ne tirez pas que cela va causer une hémorragie et d'éventuelles blessures à la moelle épinière. Rongeur doit être propre et nette.
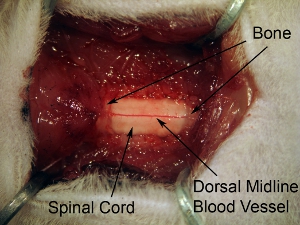
Figure 5. L'exposition de laminectomie moelle épinière suivants tissus. Étendre laminectomie pour exposer l'ensemble de C4-C6 de la moelle épinière. Faire une ouverture constante de l'os sur 3 niveaux épinière. Ne pas prolonger trop loin latéralement laminectomie parce que cela va causer une hémorragie. Afin de cibler corne ventrale, le site d'injection est relativement médiane, il est donc inutile d'étendre la mesure laminectomie complète latérale de l'os vertébral.
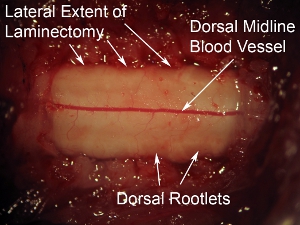
Figure 6. Fort grossissement de la surface dorsale de la moelle épinière. Le vaisseau sanguin en vue dorsale peut être vu couler la ligne médiane de la moelle épinière. Ce modèle de vaisseau sanguin est observée dans la plupart des cas, cependant, certains animaux d'afficher une trajectoire non-médiane du vaisseau sanguin. Les radicelles dorsales peuvent être vus à l'aspect latéral de la surface dorsale de la moelle épinière. Par rapport à la durée recouvrant la moelle épinière, ces nerfs ont une apparence brumeuse.
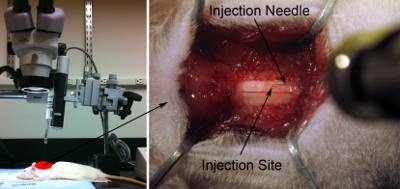
Figure 7. Configuration d'injection. Aligner seringue / aiguille parallèle à l'axe de la colonne vertébrale afin de bien cibler la région anatomique désirée. L'aiguille est juste assez inclinée (environ 80 degrés par rapport à la table d'opération) à ne pas cogner la tête champ opératoire, mais aussi près de 90 degrés que possible (à gauche). Astuce Basse injection vers la surface dorsale de la moelle épinière en utilisant les microscope (à droite). Toucher doucement la surface de la moelle épinière avec la pointe d'aiguille. Appuyer légèrement sur le cordon avec une aiguille. Rétracter aiguille jusqu'à la moelle épinière est de retour à l'état plat normal. Notez cette position z = 0,0 en utilisant la règle sur le micromanipulateur.
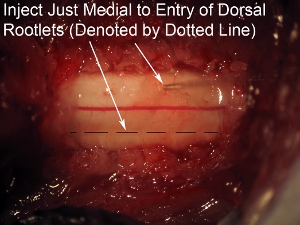
Figure 8. Fort grossissement de l'aiguille d'injection moelle épinière But juste en dedans de la zone d'entrée des radicelles dorsales (notée par la ligne pointillée).
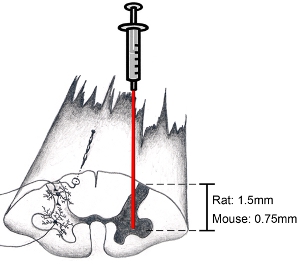
Figure 9. Schéma de la moelle épinière: comment cibler la région anatomique d'intérêt Lorsque vous essayez de cibler la corne ventrale, incisez dura parallèle à l'axe de la colonne vertébrale juste en dedans de la zone d'entrée des radicelles dorsales.. Cela permettra de cibler une la corne ventrale. Basse aiguille à une profondeur de 1,5 mm pour cibler corne ventrale chez des rats adultes (l'âge et le sexe de l'animal ne fait pas beaucoup de différence sur la profondeur). Basse aiguille à une profondeur de 0,75 mm pour cibler corne ventrale chez la souris adulte. Bien sûr, la profondeur et la position latérale dépendent de la région d'intérêt spécifiques.
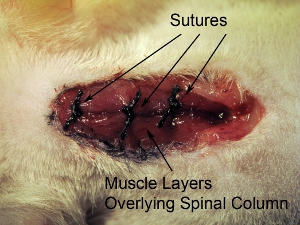
Figure 10. Clôture du site opératoire. Suture fermé trois couches musculaires recouvrant à la fois avec une suture 4-0. Suture des muscles à 3 endroits en rostrale-caudale axe.
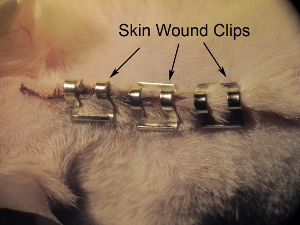
Figure 11. Agrafage de la peau. Agrafage fermé avec la peau 9.0 clips plaies mm. Serrer les agrafes avec les détenteurs de l'aiguille pour empêcher l'animal de arrachant les agrafes avant la cicatrisation complète. Espace agrafes environ 0,5 mm.
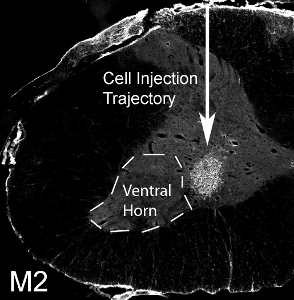
Figure 12. La transplantation de progéniteurs gliales en corne ventrale du col. 50000 souris dérivées des cellules progénitrices gliales ont été transplantées dans la corne antérieure de la moelle au niveau C4 épinière dans un rat SOD1 G93A. M2 + souris dérivées des cellules transplantées ont survécu à 1 mois post-transplantation. Les cellules localisées à la matière grise ventrale, mais le site d'injection médiale raté la corne latérale ventrale (notéepar la ligne pointillée).
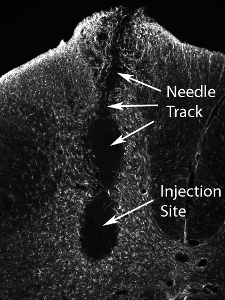
Figure 13. La transplantation des lésions tissulaires suivants du nombre élevé de cellules précurseurs neurales. Injection d'un nombre beaucoup plus élevé de cellules (le nombre réel varie selon le type cellulaire, et devraient être systématiquement évalués) entraîne des dommages au site d'injection et le long du trajet de l'aiguille.
Discussion
Pour les études impliquant souris SOD1 G93A et les rats, l'âge et le sexe correspondre les animaux dans un groupe, et de distribuer les animaux au sein de la même portée à des groupes différents. Il est préférable d'utiliser tous les animaux du même sexe à la fois pour la SLA et les modèles de SCI, car les processus pathologiques peuvent différer entre les mâles et les femelles, mais il peut également être utile d'avoir suffisamment d'animaux des deux sexes pour détecter d'...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Je tiens à remercier: tous les membres du Lepore, Maragakis et les laboratoires Rothstein à la discussion utile; La Paralyzed Veterans of America et la Fondation Craig H. Nielsen pour le financement.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif | Société | Le numéro de catalogue | |
| HBSS | Gibco | 14170 | |
| Trypsine 0,05% | Gibco | 25300 | |
| Inhibiteur de trypsine de soja (facultatif) | Sigma | T-6522 | |
| Maléate d'acépromazine (0,7 mg / kg) | Fermenta Santé Animale | ||
| La kétamine (95 mg / kg) | Fort Dodge Animal Health | ||
| Xylazine (10 mg / kg) | Bayer | ||
| # 11 lames Feather chirurgicale | Sciences Electron Microscopy | 72044-11 | |
| Coton-tige (6 pouces) | Fisher | 23-400-101 | |
| Dents de rat pince | Outils Fine Science | Rat: 11023-15; Souris: 11042-08 | |
| Des ciseaux à ressort de taille moyenne | Outils Fine Science | 15012-12 | |
| Mini ciseaux à ressort | Outils Fine Science | 15000-10 | |
| Rongeur | Outils Fine Science | Rat: 16121-14; Souris: 16221-14 | |
| Microknife | Outils Fine Science | 10056-12 | |
| Porte-aiguilles | Outils Fine Science | 12502-14 | |
| Suture: 4-0 | Vicryl | S-183 | |
| Staples: 9 mm | Autoclip | 427631 | |
| Agrafeuse: 9 mm (Reflex # 203-1000) | Instruments de précision du monde | 5000344 | |
| Pompe à eau chaude (T / pompe) | Gaymar | P / N 07999-000 | |
| Cyclosporine A: 250,0 ml ampoules mg/5.0 | Novartis / Sandimmune | NDC 0078-0109-01 | |
| FK-506 | Laboratoires LC | F-4900 | |
| La rapamycine | Laboratoires LC | R-5000 | |
| Injecteur | Instruments de précision du monde | UMP2 | |
| Micro 4 Contrôleur de pompe Microseringue | Instruments de précision du monde | UMC4 | |
| Micromanipulateur | Instruments de précision du monde | Kite-R | |
| 10,0 seringue Hamilton uL | Hamilton | 80030 | |
| Aiguilles Hamilton: 33-jauge, biseau à 45 °, 1 pouce | Hamilton | 7803-05 | |
| Verre 20,0 uL pipettes microcapillaires (facultatif) | Kimble | 71900-20 |
Références
- Lane, M. A., Fuller, D. D., White, T. E. Respiratory recovery following high cervical hemisection. Trends in neurosciences. 31, 538-538 (2008).
- Kaplan, L. M., Hollander, D. Respiratory dysfunction in amyotrophic lateral sclerosis. Clin. Chest. Med. 15, 675-675 (1994).
- Miller, R. G., Rosenberg, J. A., Gelinas, D. F. Practice parameter: the care of the patient with amyotrophic lateral sclerosis (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology: ALS Practice Parameters Task Force. Neurology. 52, 1311-1323 (1999).
- Mitsumoto, H., Chad, D. A., Pioro, E. P., Davis, F. A. . Amyotrophic lateral sclerosis. , (1998).
- Tandan, R., Bradley, W. G. Amyotrophic leteral sclerosis: Part 2. Etiopathogenesis. Annals of neurology. 18, 419-419 (1985).
- Bruijn, L. I., Miller, T. M., Cleveland, D. W. Unraveling the mechanisms involved in motor neuron degeneration in ALS. Annu Rev Neurosci. 27, 723-723 (2004).
- Rosen, D. R., Siddique, T., Patterson, D. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 362, 59-59 (1993).
- Bruijn, L. I., Becher, M. W., Lee, M. K. ALS-linked SOD1 mutant G85R mediates damage to astrocytes and promotes rapidly progressive disease with SOD1-containing inclusions. Neuron. 18, 327-327 (1997).
- Gurney, M. E., Pu, H., Chiu, A. Y. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264, 1772-1775 (1994).
- Howland, D. S., Liu, J., She, Y. Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS). Proc Natl Acad Sci. 99, 1604-1604 (2002).
- Nagai, M., Aoki, M., Miyoshi, I. Rats expressing human cytosolic copper-zinc superoxide dismutase transgenes with amyotrophic lateral sclerosis: associated mutations develop motor neuron disease. J. Neurosci. 21, 9246-9246 (2001).
- McDonald, W., Becker, D. Spinal cord injury: promising interventions and realistic goals. Am. J. Phys. Med. Rehabi. I82, S38-S38 (2003).
- Sandrow-Feinberg, H. R., Zhukareva, V., Santi, L. PEGylated interferon-beta modulates the acute inflammatory response and recovery when combined with forced exercise following cervical spinal contusion injury. Experimental neurology. 223, 439-451 (2010).
- Gage, F. H. Mammalian neural stem cells. Science. 287, 1433-1433 (2000).
- Lane, M. A., Lee, K. Z., Fuller, D. D. Spinal circuitry and respiratory recovery following spinal cord injury. Respiratory physiology & neurobiology. 169, 123-123 (2009).
- Lepore, A. C., Rauck, B., Dejea, C. Focal transplantation-based astrocyte replacement is neuroprotective in a model of motor neuron disease. Nature. 11, 1294-1294 (2008).
- Rao, M. S. Multipotent and Restricted Precursors in the Central Nervous System. Anat Rec. 257, 137-137 (1999).
- Rao, M. S., Mayer-Proschel, M. Glial- restricted precursors are derived from multipotent neuroepithelial stem cells. Dev Biol. 188, 48-48 (1997).
- Suzuki, M., Tork, C., Shelley, B. Sexual dimorphism in disease onset and progression of a rat model of ALS. Sexual dimorphism in disease onset and progression of a rat model of ALS. Amyotroph Lateral Scler. 8, 20-20 (2007).
- Lepore, A. C., Haenggeli, C., Gasmi, M. Intraparenchymal spinal cord delivery of adeno-associated virus IGF-1 is protective in the SOD1G93A model of ALS. Brain research. 1185, 256-256 (2007).
- Veldink, J. H., Bar, P. R., Joosten, E. A. Sexual differences in onset of disease and response to exercise in a transgenic model of ALS. Neuromuscul Disord. 13, 737-737 (2003).
- Shumsky, J. S., Lepore, A. C. Transplantation of Neuronal and Glial Restricted Precursors into Contused Spinal Cord Improves Bladder and Motor Functions, Decreases Thermal Hypersensitivity, and Modifies Intraspinal Circuitry. J. Neurosci. 25, 9624-9624 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon