Method Article
监视依赖黄素单加氧酶和氧化还原半反应,用停流分光光度法
摘要
我们描述了一停流仪器的使用调查还原和氧化半反应曲霉一个铁载体(SIDA),黄素依赖型单加氧酶。然后,我们显示相应的在思达反应的物种的光谱,并计算其形成的速率常数。
摘要
曲霉一个铁载体(SIDA)是一个基金会含有单加氧酶催化合成氧肟酸铁载体,是重要的毒力(如ferricrocin或N',N“,N”' - triacetylfusarinine丙类)1氨酸羟化。由思达催化反应可以分为还原和氧化半反应(图1),在还原半反应,氧化基金会绑定到一个F思达,减少NADPH的2,3。在氧化半反应,减少辅反应与氧分子,形成一个C4A-hydroperoxyflavin中间,其中一个氧原子转移到鸟。在这里,我们描述了一个程序来衡量利率和检测思达不同光谱形式安装在仪器使用停流厌氧手套箱。在停流仪器,小体积的反应物迅速混合,后日停止流通的ë停止注射器( 图1),在观察细胞中的解决方案的光谱变化随着时间的推移记录。在实验的第一部分,我们将展示我们如何可以使用单一的模式,直接测量黄素NADPH的一个F思达厌氧减少停流仪器。然后,我们使用双混合设置一个F思达第一厌氧NADPH的减少,老龄化循环期间在指定的时间,然后在观察细胞( 图1)氧分子的反应。为了执行这个实验中,厌氧缓冲区是必要的,因为只有还原半反应监测时,任何解决方案中的氧气反应会减少的黄素辅,并形成一个C4A-hydroperoxyflavin中间,最终会衰变成氧化黄素。这不会使用户能够准确地测量削减率自会有完成营业额的ENZyme。当氧化半反应正在研究的酶必须在缺氧的情况下减少之间的氧化还原的步骤,以便观察。在这个实验中所使用的缓冲区之一是饱和的氧气,使我们可以研究在高浓度的氧气氧化半反应。这些通常的程序进行了研究含黄素的单加氧酶或氧化还原半反应时。停止流进行预稳态实验的时间尺度是秒毫秒,这让内在的速率常数的测定和反应中间体的检测和鉴定。这里所描述的程序,可以应用于其他黄素依赖型单加氧酶5,6。
研究方案
1。厌氧缓冲区的制备
- 准备1升100 mM磷酸钾缓冲液,pH值7.5。倒入500毫升毕希纳用搅拌棒瓶250毫升的缓冲。
- 用橡皮塞密封瓶和放在轰动板。瓶到舒伦克线的连接短管。
- 德加的缓冲区在室温下搅拌5小时,在真空状态下。在这段时间内,进行真空脱气,氩气冲洗每隔一小时的连续两轮。
- 10秒刷新瓶氩和真空歧管断开。将烧瓶内的手套箱。
- 离开烧瓶打开手套箱剧烈振荡过夜。
2。氧气从停流系统中删除
- 准备1 L 0.1 M醋酸钠,pH值5.0。倒入250毫升布氏瓶125毫升此缓冲区和执行步骤1.2-1.4。
- 掂量出5从黑曲霉(Aspergillus niger)(181300 U / G)和0.9克葡萄糖,用1.5 mL的Eppendorf管和猎鹰锥形管50毫升,分别毫克的葡萄糖氧化酶。放入手套箱两个容器。
- 葡萄糖氧化酶和葡萄糖溶于50毫升厌氧0.1 M醋酸钠,pH值5.0(终浓度为18.13 U / ml的100毫米,分别)。填补这一解决方案( 图1)水库注射器。
- 确保该驱动器阀“负荷”的位置和填写的驱动器,注射器( 图1)。关闭的F阀的“驱动器”的位置。清空停止注射器点击空 临数据控制软件。推流电路通过提高相应的驱动器RAM手动从驱动器注射器F缓冲区。重复此步骤,共10倍。执行相同的程序与其他三个驱动器注射器。等待一小时。
- 更换与同一缓冲区contai的水库注射器的解决方案宁葡萄糖氧化酶和葡萄糖。重复步骤2.4。
- 重复步骤2.5,让溶液在一夜之间站在流系统。
- 过夜培养后,重复步骤2.5。
3。制备的氧饱和缓冲
- 准备100 mM磷酸钾缓冲液(pH值7.5),倒入50毫升50毫升的小瓶,用搅拌棒。例与惠顿塞和惠顿铝密封的小瓶。
- 放在冰小瓶。沉浸长针连接到到溶液中含有100%的氧气罐。作为一个发泄的小瓶瓶塞通过插入另一个短针。
- 100%,搅拌1小时的氧气气泡的解决方案。
- 首先从小瓶短针,并等待10秒后,取出长针。放置在手套箱的封闭小瓶。
4。 NADPH的溶液的制备
- 在1.5 mL的Eppendorf管中掂量出1毫克和NADPH的地方,我T成手套箱。
- 溶解在300μL厌氧100毫米钾磷酸盐缓冲液,pH值7.5的NADPH。从手套箱中取出30μL此解决方案,以确定与NADPH的浓度分光光度计(ε340纳米 = 6,270 M-1厘米-1)。
5。除氧酶液
- 在手套箱的冷冻和解冻400μL酶原液。酵素原液(360μM)事先准备好的100毫米磷酸钾缓冲液含有100 mM氯化钠(pH值7.5),并在液氮冷冻。
- 酶液转移到一个小的轰动酒吧25毫升的小瓶,瓶盖与惠顿塞和惠顿铝密封的小瓶,从手套箱。
- 放在冰瓶和小瓶的塞子通过插入一根针,它连接到一个舒伦克线。
- 德加的表演,连续5轮的酶液真空脱气,氩气冲洗,每20分钟1小时。
- 10秒刷新瓶氩和断开真空多方面。小瓶放在手套箱内的冰。
6。还原半反应:减少监测黄素
- 准备停流仪器和单一的混合模式,按照制造商的协议支持数据的控制软件。
- 打开循环水浴(15℃)。冒泡通过20分钟的氮去除水中的氧气。这可以防止通过流电路中的氧污染。
- 保持连接停止流动的水洗澡住房循环浴驱动器注射器的温度和观察细胞15°C间。
- 在控制面板窗口临数据控制软件选择光电二极管阵列,外部触发(激活停流操作),LogaritHMIC规模。
- 启动临数据浏览器软件,并确定将存储的数据文件的目录。
- 更换水库注射器C和F与厌氧100 mM磷酸钾缓冲液(pH值7.5)的解决方案。打开C和F阀的“驱动器”的位置。空的空临数据控制软件点击停止注射器。推流电路通过两个驱动器注射器手动提高相应的驱动器在总RAM五倍(点击之前,每个运动的RAM 空 )缓冲区。
- 为了确保流电路完全,葡萄糖氧化酶已被删除,执行步骤总额6.6四次。
- 点击基线临数据控制软件。
- 混合1100μL无氧100 mM磷酸钾缓冲液(终浓度混合后,在15微米停止流动)的,100μL酶原液。
- 取代水库锡尔河的解决方案英格F与的酶液。关闭的F阀的“驱动器”的位置。空的空临数据控制软件点击停止注射器。推流电路通过提高相应的驱动器RAM手动从驱动器注射器F酶液。共执行了三次。在临数据的控制软件,设置采集时间为60秒。
- 确保这两个驱动器注射器填补其相应的解决方案和驱动器公羊接触的驱动器注射器活塞。两个阀门打开的“驱动器”的位置,请在收购临数据控制软件来执行驱动器。重复此步骤2倍多,获得的数据,一式三份。这种氧化酶的形式产生的光谱。
- 使用一个452纳米的从驱动器获得的价值,确定混合(ε452纳米 = 13700 M-1 cm-1处)之前,酶浓度,并准备了4毫升的核苷酸solutioñ1.5倍,更集中。
- 更换水库注射器C的解决方案与NADPH的解决方案,空和填充停止注射器在6.10倍。
- 重复步骤6.11。这期间减少酶的产量光谱。
7。氧化半反应:监测黄素氧化
- 准备停流仪器和混合双模式,按照制造商的协议支持数据的控制软件。
- 重复步骤6.2-6.5。
- 更换厌氧100 mM磷酸钾缓冲液(pH值7.5)中的四个水库注射器的解决方案。关闭的F阀的“驱动器”的位置,通过点击在临数据控制软件的空空站注射器。推动通过流电路的驱动器注射器手动提高相应的驱动器RAM F缓冲区。执行此步骤,在每个驱动器注射器总额的5倍。
- 执行步骤730的四倍,在TOT人完全删除的内容,从流电路。
- 点击在临数据控制软件的基线 。
- 混合1000μL无氧100 mM磷酸钾缓冲液(终浓度混合后,在15微米停止流动)的,200μL酶原液。
- 更换解决水库与酶液的注射器。关闭一个阀门的“驱动器”的位置。空的空临数据控制软件点击停止注射器。酶液,通过提高相应的驱动器RAM手动推入一个驱动器注射器通过流电路。执行此步骤总额的3倍。在临数据的控制软件,设置延迟时间和0.5秒至60秒的采集时间。
- 确保所有驱动器注射器填补其相应的解决方案和驱动器公羊接触的驱动器注射器活塞。关闭所有阀门的“驱动器”的位置,然后单击“在Pro-DAT 收购执行驱动器控制软件。重复此步骤两次获得的数据,一式三份。这种氧化酶的形式产生的光谱。
- 与NADPH的解决方案的1.5倍以上集中在注射器A.酶液的B阀打开的“驱动器”的位置,空和储值停止注射器如7.7中所述的三次更换注射器乙水库的解决方案。
- 替换解决水库注射器C与含氧缓冲区的。的C阀打开“驱动器”的位置和空停止注射器和笔芯7.7倍。在临数据的控制软件,设置在15和900秒的时间延迟和收购,分别。
- 重复步骤7.8。这期间再氧化的酶充分减少产量光谱。
8。数据分析
- 启动临数据转换软件。点击“ 选项 ”图标,并选择保存在ProDataCSV。
- 打开其中存储的数据文件的目录。 APL的专业数据转换器窗口拖动文件。数据将被自动保存为CSV格式的文件在同一目录中。
- 打开CSV格式的文件,使用Microsoft Excel(微软雷德蒙,华盛顿,美国)。正常化减去相应的吸收在700 nm处的基线停流的痕迹。
- 使用KaleidaGraph(Synergy软件,读,PA)与时间,以适当的指数函数拟合在相应的最大吸收的情节分析修正的痕迹。所示,在452 nm处的吸光度,以确定混合后停止流量仪表的NADPH酶和黄素减少率作为时间的函数绘制图2B。在这种情况下,获得最适合的数据,采用双指数方程和0.65和0.23 S -1率分别为第一和第二阶段的减少,水库计算的职衔。要确定的C4A-hydroperoxyflavin中间的和减少与氧酶反应后,再氧化形成率,我们分析了在380和452 nm处,分别为( 图3B)停流的痕迹。使用一个单一的指数方程,我们计算的第一步和第二步的氧化半反应速率为 1.4和0.006,分别。
9。代表结果
从前面的章节中所描述的实验结果显示, 一个F思达还原半反应如何,可以通过测量在452 nm处的吸光度的变化,对应黄素的氧化还原状态的变化监测。这一步的速度,可以由数据拟合到相应的方程( 图2步骤8.4)。减幅获得(0.65秒-1)是类似猫的K值稳态实验,表明减少是速率决定步骤的反应。趁着双混合停流模式,氧化半反应中间体率可确定( 图3;步骤8.4)。在一个F思达催化反应,C4A-hydroperoxyflavin的明确检测(380 nm的最大 λ),并形成和衰变率,可以计算。所获得的再氧化(0.006秒-1)的速度缓慢表示,C4A-hydroperoxyflavin是在没有非常稳定的鸟。

计划1。 一个F思达机制。的基金会辅isoallozaxine的环。氧化黄素(一)结合的NADPH(二)发生反应,形成减少黄素和NADP +(c)。经过与氧分子和有约束力的反应C4A-hydroperoxyflavin的鸟氨酸,形成(四)。这是羟基化的物种。鸟氨酸羟化后,的hydroxyflavin(五)必须脱水形成氧化酶。 NADP +仍然是整个催化循环的约束,是最后被释放(F)的产品。
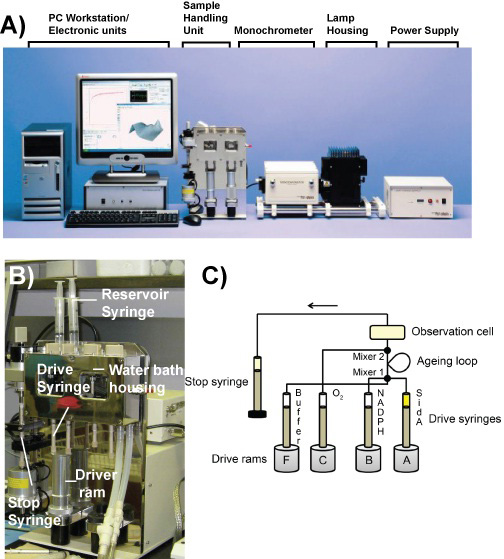
图1。停流仪器。一)图片应用光物理SX20元件停流分光光度计。二)图片的样品处理单元。双混合模式的流电路)计划。
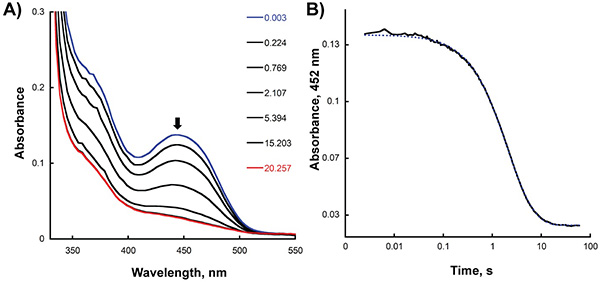
图2。厌氧与NADPH减少思达在停流仪器。思达30微米和45微米的NADPH等量混合后录制的)的光谱变化。第一谱(氧化SIDA)和最后频谱(充分减少希德A)是蓝色和红色,分别突出。 B)在吸收452 nm的记录作为时间的函数跟踪。
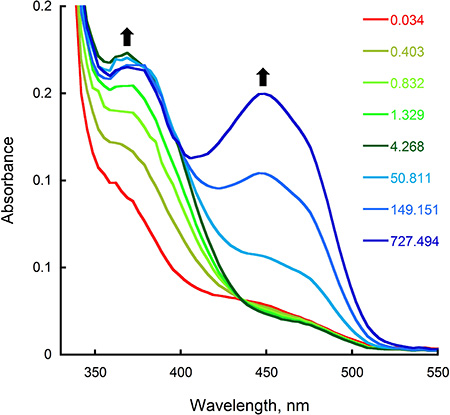
图3。氧化思达在停流仪器。一个记录后,充分减少思达和含氧缓冲区的混合等量)的光谱变化。终浓度为15μM的拔毒,22.5μM的核苷酸,0.95毫米的氧气。频谱记录在0.034,4.268和727.494小号对应充分的酶减少,C4A-hydroperoxyflavin中间的(λ 最大的380纳米),氧化酶(λ 最大的450纳米),分别。 b)在382和452 nm处的吸光度跟踪记录作为时间的函数。
讨论
酶催化氧化还原反应通常含有如血红素和黄素显着的吸光度的变化发生在催化循环的辅助因子。黄素氧化的形式呈现在〜360和450 nm的吸收最大值,它的减少通常在7 450纳米以下的吸收减少监测。在一般情况下,一些短暂的中间体存在,但形式和衰变太快,要定期分光光度计测量。使用应用光物理SX20的停流分光光度计(或类似的工具),它是可以在毫秒时间尺度来衡量的吸光度变化(死区时间,2毫秒)。在这里,我们研究的黄素依赖型单加氧酶的F思达和氧化还原半反应,作为一个模型。氢转移速率决定通过测量与NADPH酶在厌氧条件下混合后在452 nm处的吸光度变化。随后,采取advantagE,酶的双模式混合停流仪器与NADPH反应,直到实现全面减少,减少的酶,辅酶+复杂与氧气混合。在此过程中,它是可以检测瞬态含氧的黄素中间体的形成和衰变率来衡量。这些中间体的鉴定提供了在催化反应物种的性质有关的实验数据。在一个F思达,C4A-hydroperoxyflavin(通常在370-380 nm的监测),这是羟基化物种的形成。此外,每一步的速率常数测量可以获取有关速率决定步骤的反应信息,并有助于阐明酶的动力学和化学机制。
在一般情况下,类似的方法可用于的其他flavoenzymes,或变化发生其中吸收的蛋白质,如蛋白质,是续AIN血红素,哆磷酸盐,非血红素铁8-10。对这种方法的局限性,需要大量纯化的酶,但是这可以通过使用高产量表达系统来克服。一个决定最佳录音谱蛋白浓度,用足够的蛋白质,所以可以观察到一个足够强的信号,但不是太多,使酶不被浪费。通常情况下,停流实验中使用的含黄素酶的酶浓度最低的是6-10微米(混合后),并确定使用相应的酶的摩尔消光系数。在一个F思达的情况下,酶的约束基金会的比例是50-65%2。 APO-蛋白被视为在这些实验中无效,因为绑定的FAD辅基催化是必要的。这种方法的另一个可能的限制是如果在酶的过程发生的速度比2毫秒(停止流动的死区时间),他们不会被观察到,但日ERE报告利率可以下降到解决这一问题的策略。这种情况的一个例子,包括使用高NaCl浓度在1铁氧还蛋白-NADP +还原酶11反应。停止流流电路的氧气擦洗往往是一个棘手的一步,在这个实验中,需要特别注意。这里描述的葡萄糖氧化酶,葡萄糖系统在大多数实验室中成功地使用,因为它是一个有效和廉价的方法。然而,也有一些缺点,其中包括对H 2 O 2的生产,并作为protocatechuate-protocatechuate双加氧酶系统的其他替代品,对于某些应用,应考虑12。利用厌氧手套箱,使得它更容易确保厌氧条件下,但并非是必不可少的。我们希望酶在缺氧的情况下减少或与氧气发生反应,在浓度,氧气必须从停止流流电路那就是我们指定。虽然停流是在手套箱,有流电路中的氧气,如果我们在以前的实验中使用的有氧缓冲区。吸光度测量此外,荧光和圆二色检测可以在应用光物理SX20的停流分光光度计进行相应的配件。
披露声明
我们什么都没有透露。
致谢
研究支持NSF奖断路器-1021384。
材料
| Name | Company | Catalog Number | Comments |
| 通用实验室设备 | 公司 | 目录编号 | |
| 真空泵 | 韦尔奇 | - | |
| 布氏烧瓶 | 费舍尔 | 70340-500 | |
| 搅拌棒 | 费舍尔 | 14-512-129 | |
| 搅拌板 | 费舍尔 | 11-100-49S | |
| 舒伦克线 | kontes玻璃 | - | |
| 氩罐 | 公司Airgas | 受体UPC300 | |
| 液氮罐 | 公司Airgas | NI200 | |
| 氮气罐,超高纯度等级 | 公司Airgas | 倪UHP200 | |
| 氧气罐 | 公司Airgas | 牛年40 | |
| 5%氢平衡氮气罐 | 公司Airgas | X02NI95B200H998 | |
| SX20圣opped,流分光光度计 | AppliedPhotophysics | - | |
| 手套箱 | 怕羞 | - | |
| 水浴 | 布林克曼劳达 | - | |
| 耗材 | |||
| 50毫升BD猎鹰管 | 费舍尔 | 14-432-23 | |
| 15毫升BD猎鹰锥形管 | 费舍尔 | 05-527-90 | |
| 1.5毫升的Eppendorf离心管 | 费舍尔 | 05-402-18 | |
| 50和25毫升玻璃瓶 | 费舍尔 | 06-402 | |
| 橡胶瓶塞 | 费舍尔 | 06-447H | |
| 铝封条 | 费舍尔 | 06-406-15 | |
| reagenTS | |||
| 磷酸钾,二氢 | 费舍尔 | AC2714080025 | |
| 磷酸钾,二元 | 费舍尔 | P288-500 | |
| 醋酸钠 | 西格玛 | 的S-2889 | |
| 答:从葡萄糖氧化酶尼日尔 | 西格玛 | G7141-250KU | |
| D-葡萄糖 | 费舍尔 | D16-500 | |
| β-核苷酸 | 费舍尔 | ICN10116783 | |
| L(+)-鸟氨酸盐酸盐 | 费舍尔 | ICN10116783 |
参考文献
- Hissen, A. H. The Aspergillus fumigatus siderophore biosynthetic gene sidA, encoding L-ornithine N5-oxygenase, is required for virulence. Infect. Immun. 73 (9), 5493-5503 (2005).
- Chocklett, S. W., Sobrado, P. Aspergillus fumigatus SidA is a highly specific ornithine hydroxylase with bound flavin cofactor. Biochemistry. 49 (31), 6777-6783 (2010).
- Mayfield, J. A. Comprehensive spectroscopic, steady state, and transient kinetic studies of a representative siderophore-associated flavin monooxygenase. J. Biol. Chem. 285 (40), 30375-30388 (2010).
- Fierke, C. A., Hammes, G. G. Transient kinetic approaches to enzyme mechanisms. Contemporary enzyme kinetics and mechanism. , (2009).
- Palfey, B. A., McDonald, C. A. Control of catalysis in flavin-dependent monooxygenases. Arch. Biochem. Biophys. 493 (1), 26-26 (2010).
- van Berkel, W. J. H., Kamerbeek, N. M., Fraaije, M. W. Flavoprotein monooxygenases, a diverse class of oxidative biocatalysts. J. Biotechnol. 124 (4), 670-689 (2006).
- Chapman, S. K., Reid, G. A. . Flavoprotein Protocols. , (1999).
- Sobrado, P., Fitzpatrick, P. F. Solvent and primary deuterium isotope effects show that lactate CH and OH bond cleavage are concerted in Y254F flavocytochrome b2, consistent with a hydride transfer mechanism. Biochemistry. 42, 15208-15214 (2003).
- Kumar, S., Gawandi, V. B., Capito, N., Phillips, R. S. Substituent effects on the reaction of β-benzoylalanines with Pseudomonas fluorescens kynureninase. Biochemistry. 49 (36), 7909-7913 (2010).
- Yun, D., García-Serres, R., Chicalese, B. M., An, Y. H., Huynh, B. H., Bollinger, J. M. J. (μ-1,2-Peroxo)diiron(III/III) complex as a precursor to the diiron(III/IV) intermediate X in the assembly of the iron-radical cofactor of ribonucleotide reductase from mouse. Biochemistry. 46 (7), 1925-1932 (2007).
- Pennati, A., Zanetti, G., Aliverti, A., Gadda, G. Effect of salt and pH on the reductive half-reaction of Mycobacterium tuberculosis FprA with NADPH Biochemistry. Biochemistry. 47 (11), 3418-3425 (2008).
- Patil, P. V., Allou, D. P. The use of protocatechuate dioxygenase for maintaining anaerobic conditions in biochemical experiments. Analytical Biochemistry. 286 (2), 187-192 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。