Method Article
Monitoraggio dei riduttivo e ossidativa semireazioni di Flavin-Dependent monoossigenasi con Stopped-Flow Spettrofotometria
In questo articolo
Riepilogo
Si descrivono l'uso di un stopped-flow strumento per studiare sia riduttive e ossidativo semireazioni di Aspergillus fumigatus Sideroforo A (Sida), un flavina-dipendente monoossigenasi. Abbiamo poi mostrano gli spettri corrispondenti alle specie di cui la reazione di Sida e calcolare le costanti di velocità per la loro formazione.
Abstract
Aspergillus fumigatus sideroforo A (Sida) è una monoossigenasi contenente FAD che catalizza l'idrossilazione della ornitina nella biosintesi di siderofori idrossamato che sono essenziali per la virulenza (ad es ferricrocin o N ', N ", N'''-triacetylfusarinine C) 1. La reazione catalizzata da Sida può essere divisa in riduttive e ossidativo semireazioni (Schema 1). Nella riduttiva semi-reazione, la FAD legato ossidato Sida A f, è ridotta NADPH 2,3. Nella ossidativo semireazione , il cofattore ridotta reagisce con l'ossigeno molecolare per formare un C4a-hydroperoxyflavin intermedio, che trasferisce un atomo di ossigeno per ornitina. Qui, si descrive un procedimento per misurare le tariffe e rilevare le forme spettrali differenti di Sida utilizzando un stopped-flow strumento installato uno glove box anaerobico. Nel stopped-flow strumento, piccoli volumi di reagenti sono rapidamente mista, e dopo che il flusso viene interrotto da thsiringa e arresto (figura 1), le variazioni spettrali della soluzione posta nella cella di osservazione sono registrate nel tempo. Nella prima parte dell'esperimento, si mostra come possiamo usare il stopped-flow strumento in modalità singola, in cui la riduzione anaerobica della flavina in A Sida f da NADPH viene misurata direttamente. Abbiamo quindi utilizzare doppie impostazioni di miscelazione dove A Sida f è prima anaerobicamente ridotto di NADPH per un determinato periodo di tempo in un ciclo di invecchiamento, e poi fatto reagire con ossigeno molecolare in cella di osservazione (Figura 1). Per eseguire questo esperimento, buffer anaerobiche sono necessari perché quando solo la metà riduttiva reazione viene controllata, l'ossigeno nelle soluzioni reagirà con il cofattore ridotta flavina e formano un C4a-hydroperoxyflavin intermedio che infine decadono indietro nel ossidato flavina . Ciò non consente all'utente di misurare accuratamente tassi di riduzione poiché non vi sarebbe turnover completa del EnzYME. Quando il ossidativo semireazione viene studiato l'enzima deve essere ridotto in assenza di ossigeno in modo che solo le passi tra riduzione e ossidazione sono osservati. Uno dei buffer utilizzati in questo esperimento è saturo di ossigeno in modo da poter studiare la ossidativo semi-reazione a concentrazioni più elevate di ossigeno. Questi sono spesso le procedure eseguite quando si studia sia le ossidativi o riduttivi semireazioni con flavina contenenti monossigenasi. La scala di tempo dei pre-steady state sperimentazioni condotte con la stopped-flow è millisecondi a secondi, che consentono la determinazione di costanti di velocità intrinseche e il rilevamento e l'identificazione di intermedi nella reazione 4. Le procedure qui descritte possono essere applicate ad altri flavina-dipendenti monossigenasi. 5,6
Protocollo
1. Preparazione del Buffer anaerobico
- Preparare 1 L di tampone fosfato di potassio 100 mM, pH 7,5. Versare 250 mL di tampone in un pallone da 500 ml Büchner con una barra agitatrice.
- Sigillare il pallone con un tappo di gomma e metterlo su un piatto scalpore. Collegare il tubo corto del pallone ad una linea Schlenk.
- Degasare il tampone sotto vuoto per 5 ore a temperatura ambiente con agitazione. Durante questo periodo di tempo, effettuare 5 turni consecutivi di degasaggio sotto vuoto e lavaggio con argon ogni ora.
- Lavare il pallone con argon per 10 secondi e scollegarlo dal collettore di aspirazione. Porre il pallone all'interno del vano portaoggetti.
- Lasciare il pallone aperto nel vano portaoggetti durante la notte con agitazione vigorosa.
2. Rimozione di ossigeno da Stopped-flow del sistema
- Preparare 1 L di acetato di sodio 0,1 M, pH 5,0. Versare 125 ml di questo tampone in un pallone da 250 ml Büchner ed eseguire operazioni 1,2-1,4.
- Pesare 5mg glucosio ossidasi da Aspergillus niger (181.300 U / g) e 0,9 g di glucosio usando un tubo Eppendorf 1,5 mL e 50 mL Falcon tubo conico, rispettivamente. Posizionare entrambi i contenitori nel vano portaoggetti.
- Sciogliere glucosio ossidasi e glucosio in 50 mL di acetato di sodio anaerobica 0,1 M, pH 5,0 (concentrazioni finali di 18,13 U / ml e 100 mm, rispettivamente). Riempire le siringhe serbatoio con questa soluzione (Figura 1).
- Assicurarsi che le valvole di azionamento sono in posizione "carico" e riempire le siringhe di azionamento (Figura 1). Girare la valvola F in posizione "drive". Svuotare la siringa fermata cliccando sul vuoto nel Pro-Data software di controllo. Spingere il buffer da unità F siringa attraverso il circuito del flusso manualmente sollevando la ram corrispondente unità. Ripetere questa operazione dieci volte in totale. Eseguire la stessa procedura con le altre tre siringhe di unità. Attendere un'ora.
- Sostituire la soluzione delle siringhe serbatoio con lo stesso tampone conteniNing glucosio ossidasi e glucosio. Ripetere il punto 2.4.
- Ripetere il passaggio 2.5 e permettono la soluzione di stare nel sistema di flusso durante la notte.
- Dopo una notte di incubazione, ripetere il passo 2.5.
3. Preparazione del tampone di ossigeno saturo
- Preparare potassio 100 mM tampone fosfato (pH 7,5) e 50 mL versare in un flacone da 50 ml con una barra agitatrice. Chiudere la fiala con un tappo Wheaton e un sigillo in alluminio Wheaton.
- Posizionare il flaconcino su ghiaccio. Immergere un lungo ago collegato ad un serbatoio contenente ossigeno al 100% nella soluzione. Inserire un altro ago corto attraverso il tappo del flaconcino come uno sfogo.
- Bubble la soluzione con ossigeno al 100% per 1 ora con agitazione.
- Prima di tutto rimuovere l'ago corto dal flaconcino e attendere 10 secondi prima di rimuovere l'ago lungo. Posizionare il flacone chiuso nel vano portaoggetti.
4. Preparazione della soluzione NADPH
- Pesare 1 mg di NADPH in una provetta da 1,5 ml Eppendorf e posizionare it nel vano portaoggetti.
- Sciogliere il NADPH in 300 pl di anaerobica tampone fosfato di potassio 100 mM, pH 7,5. Rimuovere 30 pl di questa soluzione dal vano portaoggetti per determinare la concentrazione di NADPH con uno spettrofotometro (ε 340 nm = 6.270 M -1 cm -1).
5. Rimozione di ossigeno dalla soluzione enzimatica
- Prendete 400 ml di soluzione enzimatica magazzino dal freezer e scongelare nel vano portaoggetti. La soluzione madre enzima (360 uM) è stato precedentemente preparata in 100 mM tampone fosfato di potassio (pH 7,5) contenente 100 mM NaCl, e congelati in azoto liquido.
- Trasferire la soluzione enzimatica in un flacone da 25 ml con ancoretta, chiudere la fiala con un tappo Wheaton e un sigillo in alluminio Wheaton e togliere dal cassetto portaoggetti.
- Posizionare il flaconcino su ghiaccio e collegarlo ad una linea di Schlenk inserendo un ago attraverso il tappo del flacone.
- Degassare la soluzione enzimatica eseguendo 5 turni consecutivi didegasaggio sotto vuoto e lavaggio con argon ogni 20 minuti per 1 ora.
- Sciacquare la fiala con argon per 10 secondi e scollegarlo dal collettore di aspirazione. Posizionare il flaconcino su ghiaccio all'interno del vano portaoggetti.
6. Riduttiva Half-reazione: Flavin Riduzione Monitoring
- Preparare la stopped-flow strumento e la Pro-dati software di controllo per singola modalità di mescolamento seguendo il protocollo del produttore.
- Attivare un bagno di acqua circolante (15 ° C). Rimuovere ossigeno dall'acqua mediante gorgogliamento di azoto attraverso di essa per 20 minuti. Ciò impedisce la contaminazione da ossigeno attraverso il circuito di flusso.
- Mantenere la temperatura delle siringhe di azionamento e la cella di osservazione a 15 ° C collegando l'alloggiamento bagno d'acqua del stopped-flow al bagno circolante.
- Nella finestra Pannello di controllo del Pro-Data Array software Photodiode controllo di selezione, trigger esterno (per attivare stopped-flow operativo), e LogaritHMIC scala.
- Avviare il Pro-Data software di visualizzazione e definire la directory dove i file di dati verranno memorizzati.
- Sostituire la soluzione del serbatoio siringhe C e F anaerobica con tampone fosfato di potassio 100 mM (pH 7,5). Girare la C e le valvole F alla posizione "drive". Svuotare la siringa fermata facendo clic su Svuota nella Pro-Data software di controllo. Spingere il buffer da entrambe le siringhe guida attraverso il circuito del flusso manualmente sollevando l'unità corrispondente ariete cinque volte in totale (fare clic su Svuota prima di ogni movimento del pistone).
- Al fine di garantire che glucosio ossidasi è stato rimosso completamente dal circuito di flusso, eseguire il passaggio 6,6 quattro volte in totale.
- Fare clic sul Baseline nella Pro-Data software di controllo.
- Mescolare 100 ml di soluzione enzimatica magazzino di 1100 anaerobica 100 microlitri di tampone fosfato di potassio mM (concentrazione finale dopo la miscelazione nel flusso interrotto di 15 pM).
- Sostituire la soluzione del serbatoio syrF Inge con la soluzione di enzima. Girare la valvola F in posizione "drive". Svuotare la siringa fermata facendo clic su Svuota nella Pro-Data software di controllo. Spingere la soluzione enzimatica da unità F siringa attraverso il circuito del flusso manualmente aumentando la ram corrispondente unità. Eseguire questo tre volte in totale. Nella Pro-Data software di controllo, impostare il tempo di acquisizione a 60 s.
- Assicurarsi che entrambe le siringhe sono piene di auto con le loro soluzioni corrispondenti e gli arieti unità sono in contatto con siringhe pistoni di azionamento. Girare entrambe le valvole in posizione "drive" e fare clic su Acquisisci nella Pro-Data software di controllo per eseguire l'unità. Ripetere questa operazione due volte di più per ottenere i dati in triplice copia. Questo spettri rendimenti della forma ossidata dell'enzima.
- Utilizzando il valore di A 452 nm ottenuto dalle unità, determinare la concentrazione dell'enzima prima della miscelazione (ε = 452 nm 13.700 M -1 cm -1) e preparare 4 mL di una solutio NADPHn 1,5 volte più concentrato.
- Sostituire la soluzione del serbatoio C siringa con la soluzione di NADPH e di vuoti e riempire la siringa fermata tre volte, come descritto in 6.10.
- Ripetere il passaggio 6.11. Questo spettri rese durante la riduzione dell'enzima.
7. Ossidativo Half-reazione: Flavin Ossidazione Monitoring
- Preparare la stopped-flow strumento e la Pro-dati software di controllo per doppia modalità di mescolamento seguendo il protocollo del produttore.
- Ripetere i passaggi 6.2-6.5.
- Sostituire la soluzione nelle quattro siringhe serbatoio anaerobica con tampone fosfato di potassio 100 mM (pH 7,5). Girare la valvola F in posizione "drive". Svuotare la siringa fermata facendo clic su Svuota nella Pro-Data software di controllo. Spingere il buffer dalla unità F siringa attraverso il circuito del flusso manualmente sollevando la ram corrispondente unità. Eseguire questa operazione cinque volte in totale con ogni siringa unità.
- Eseguire il passaggio 7.3 quattro volte in total di rimuovere completamente i contenuti dal circuito di flusso.
- Clicca Baseline nella Pro-Data software di controllo.
- Mescolare 200 ml di soluzione enzimatica magazzino con 1000 anaerobica 100 microlitri di tampone fosfato di potassio mM (concentrazione finale dopo la miscelazione nel flusso interrotto di 15 pM).
- Sostituire la soluzione di siringa serbatoio A con la soluzione di enzima. A Girare la valvola nella posizione "drive". Svuotare la siringa fermata facendo clic su Svuota nella Pro-Data software di controllo. Spingere la soluzione enzimatica dalla siringa drive A attraverso il circuito del flusso manualmente aumentando la ram corrispondente unità. Eseguire questa operazione per tre volte in totale. Nella Pro-Data software di controllo, impostare il tempo di ritardo di 0,5 s e il tempo di acquisizione a 60 s.
- Assicurarsi che tutte le siringhe di azionamento sono riempiti con le relative soluzioni e il montone disco sono in contatto con siringhe pistoni di azionamento. Girate tutte le valvole in posizione "drive" e fare clic su Acquisisci nella Pro-Datun software di controllo per eseguire l'unità. Ripetere questa operazione altre due volte per ottenere i dati in triplice copia. Questo spettri rendimenti della forma ossidata dell'enzima.
- Sostituire la soluzione della siringa B serbatoio con una soluzione NADPH 1,5 volte più concentrato rispetto alla soluzione enzimatica in siringa A. Girare la valvola B in posizione "drive" e svuotare e riempire la siringa fermata tre volte, come descritto in 7.7.
- Sostituire la soluzione del serbatoio siringa C con tampone ossigenato. Girare la valvola C in posizione "drive" e svuotare e riempire la siringa fermata tre volte, come descritto in 7.7. Nella Pro-Data software di controllo, impostare il tempo di ritardo e l'acquisizione a 15 e 900 s, rispettivamente.
- Ripetere il punto 7.8. Questo spettri rese durante la riossidazione del enzima completamente ridotto.
8. Analisi dei dati
- Avviare il Pro-Data software di conversione. Fare clic sull'icona Opzioni e selezionare Salva in ProDataCSV.
- Apertola directory in cui sono stati memorizzati i file di dati. Trascinare i file alla APL Pro-Data finestra convertitore. I dati saranno automaticamente salvati come file in formato CSV nella stessa directory.
- Aprire i file in formato CSV utilizzando Microsoft Excel (Microsoft, Redmond, WA, USA). Normalizzare la linea di base dei stopped-flow tracce sottraendo l'assorbimento corrispondente a 700 nm.
- Analizzare le tracce corrette utilizzando Kaleidagraph (Software Synergy, Reading, PA) inserendo la trama del assorbanza al massimo in funzione del tempo corrispondente alla funzione appropriata esponenziale. Come mostrato in Figura 2B, l'assorbanza a 452 nm è stata tracciata in funzione del tempo per determinare il tasso di riduzione flavina dopo la miscelazione e l'enzima NADPH in stopped-flow strumento. In questo caso, il migliore adattamento dei dati sono stati ottenuti utilizzando una doppia equazione esponenziale e tassi di 0,65 e 0,23 s -1 sono stati calcolati per la prima e seconda fase di riduzione, resture rispettivamente. Per determinare il tasso di formazione del C4a-hydroperoxyflavin intermedio e la riossidazione dopo reazione con l'enzima ridotto ossigeno, abbiamo analizzato le stopped-flow tracce a 380 e 452 nm, rispettivamente (Figura 3B). Utilizzo di una singola equazione esponenziale, abbiamo calcolato tassi di 1,4 e 0,006 s -1 per il primo passo e secondo ossidativo semireazione, rispettivamente.
9. Risultati rappresentativi
I risultati degli esperimenti descritti nelle sezioni precedenti mostrano come il riduttiva semi-reazione di A Sida f può essere monitorata misurando le variazioni di assorbanza a 452 nm, che corrispondono ai cambiamenti nello stato redox della flavina. Il tasso di questo stadio può essere determinato inserendo i dati per l'equazione appropriata (Figura 2; Fase 8,4). Il tasso di riduzione ottenuto (0,65 s -1) è simile al valore k calcolato con gattoallo stato stazionario esperimenti 2, suggerendo che la riduzione è il fattore limitante della reazione. Sfruttando la modalità doppia miscelazione del stopped-flow, il tasso di ossidazione e gli intermedi in questo mezzo reazione può essere determinato (Figura 3; Fase 8,4). Nella reazione catalizzata dalla Sida A f, la C4a-hydroperoxyflavin è chiaramente rilevato (λ max di 380 nm), e il tasso di formazione e decadimento può essere calcolato. La lentezza della riossidazione ottenuto (0,006 s -1) indica che il C4a-hydroperoxyflavin è molto stabile in assenza della ornitina.

Schema 1. Meccanismo di un Sida f. L'anello isoallozaxine del cofattore FAD viene mostrato. Il ossidato flavina (A) si lega a NADPH (B) e reagisce per formare ridotta Flavin e NADP + (C). Dopo la reazione con ossigeno molecolare e di legameornitina, il C4a-hydroperoxyflavin si forma (D). Questa è la specie idrossilante. Dopo idrossilazione della ornitina, il hydroxyflavin (E) deve essere disidratato per formare l'enzima ossidato. NADP + rimane vincolato per tutto il ciclo catalitico ed è il prodotto ultimo ad essere rilasciato (F).
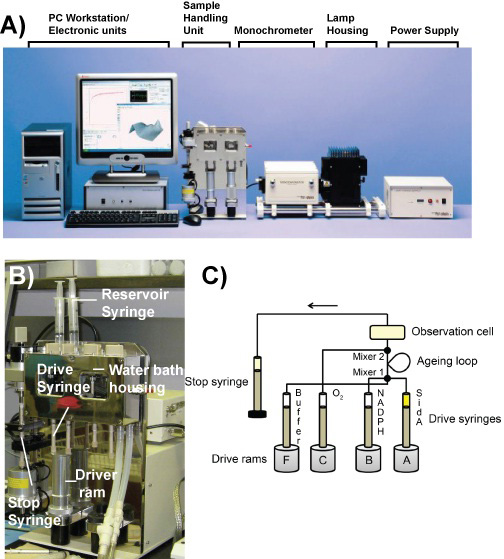
Figura 1. La stopped-flow strumento. A) Immagine dei componenti del Photophysics Applied SX20 stopped-flow spettrofotometro. B) Immagine della centrale di trattamento del campione. C) Schema del circuito di flusso in doppia modalità di mescolamento.
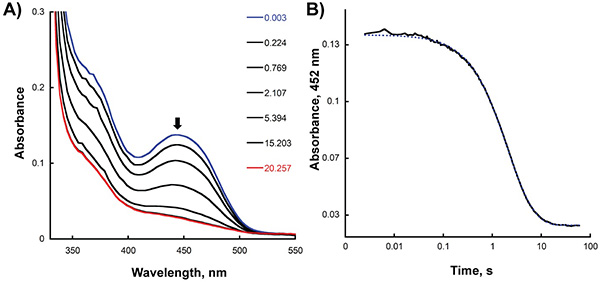
Figura 2. Riduzione anaerobica di Sida con NADPH in stopped-flow strumento. A) modifiche spettrali registrati dopo mescolando volumi uguali di 30 pm Sida NADPH e 45 micron. Il primo spettro (ossidato Sida) e spettro ultimo (completamente ridotto SidA) è evidenziata in blu e rosso, rispettivamente. B) traccia assorbanza a 452 nm registrate in funzione del tempo.
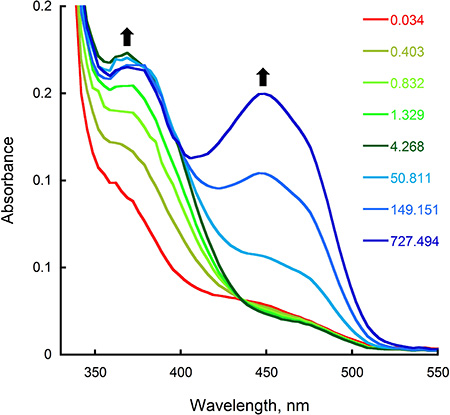
Figura 3. Ossidazione di Sida in stopped-flow strumento. A) i cambiamenti spettrali registrati dopo la miscelazione volumi uguali completamente ridotta Sida e buffer ossigenato. Le concentrazioni finali erano di 15 pM Sida, NADPH 22,5 pM, ossigeno e 0,95 mM. Lo spettro registrato a 0,034, 4,268, e 727,494 s corrisponde all'enzima completamente ridotta, il C4a-hydroperoxyflavin intermedio (λ max di 380 nm), e l'enzima ossidato (λ max di 450 nm), rispettivamente. B) traccia assorbanza a 382 e 452 nm registrata in funzione del tempo.
Discussione
Enzimi che catalizzano reazioni redox solito contengono cofattori quali hemes e flavine che subiscono variazioni di assorbanza significativi durante il ciclo catalitico. La forma ossidata del flavina presenta assorbanza massimi a ~ 360 e 450 nm, e la sua riduzione è tipicamente monitorata seguendo la diminuzione di assorbanza a 450 nm 7. In generale, alcuni transitori intermedi sono presenti, ma la forma e il decadimento troppo veloce per essere misurato in spettrofotometri regolari. Utilizzando il Applied Photophysics SX20 stopped-flow spettrofotometro (o strumenti simili), è possibile misurare le variazioni di assorbanza nella scala temporale millisecondo (tempo morto, 2 ms). Qui abbiamo studiato le riduttive e ossidativo mezze reazioni del flavina-dipendente monooxygenase A Sida f, che funge da modello. Il tasso di trasferimento di idruro è stata determinata misurando la variazione di assorbanza a 452 nm dopo la miscelazione con l'enzima NADPH in condizioni anaerobiche. Successivamente, tenendo advantage della modalità doppia miscelazione del stopped-flow strumento, l'enzima è stato fatto reagire con NADPH, fino a completa riduzione è stata ottenuta, quindi il enzimatica ridotta-NADP + complesso è stato miscelato con ossigeno. Seguendo questa procedura, è possibile rilevare transitori intermedi flavina ossigenati e per misurare i tassi di formazione e di decadimento. L'identificazione di questi intermedi fornisce dati sperimentali sulla natura delle specie reattive di catalisi. Nel caso di Sida A f, la formazione del C4a-hydroperoxyflavin (tipicamente monitorato a 370-380 nm), che è la specie idrossilante. Inoltre, misurando la velocità costante di ogni passo permette di ottenere informazioni sul fattore limitante della reazione e aiutano a chiarire i meccanismi cinetici e chimico dell'enzima.
In generale, gli approcci simili possono essere usati per altre flavoenzymes, o proteine per le quali assorbanza cambiamenti intercorsi, come proteine che contain eme, piridossal-fosfato, o di ferro non-eme 8-10. Una limitazione di questo metodo è che grandi quantità di enzima purificato sono richiesti, ma questo può essere superato utilizzando un sistema di espressione con alte rese. Si determina la concentrazione proteica ottimale per spettri registrazione utilizzando proteine abbastanza così che un segnale sufficientemente forte può essere osservato, ma non troppo enzima che non viene sprecato. Tipicamente, la concentrazione più bassa enzima per flavina contenenti enzimi utilizzati in stopped-flow esperimenti è 6-10 uM (dopo la miscelazione) e viene determinata utilizzando il coefficiente di estinzione molare corrispondente dell'enzima. Nel caso di Sida A f, la percentuale di FAD enzima legato è 50-65% 2. Apo-proteina è considerata inattiva in questi esperimenti perché un cofattore FAD legato è necessaria per la catalisi. Un'altra possibile limitazione di questo metodo è se i processi in un enzima avvenire più velocemente di 2 ms (tempo morto di stopped-flow) che non verrà osservato, ma there sono riportate le strategie in cui i tassi può essere diminuita per superare questo problema. Un esempio di questo include l'utilizzo di una elevata concentrazione di NaCl nella reazione di ferredossina-NADP + riduttasi 11. Il lavaggio di ossigeno dal circuito flusso del stopped-flow è spesso un passo difficile in questo esperimento e richiede una particolare attenzione. La glucosio ossidasi-glucosio sistema qui descritto viene utilizzato con successo nella maggior parte dei laboratori in quanto è un metodo efficace ed economico. Tuttavia, ci sono alcuni svantaggi che includono la produzione di H 2 O 2 e per alcune applicazioni alternative come protocatechuate-diossigenasi protocatechuate sistema deve essere considerato 12. L'utilizzo di un glove box anaerobico rende più facile assicurare condizioni anaerobiche, ma non è essenziale. Ossigeno deve essere rimosso dal circuito di flusso del stopped-flow, come si vuole l'enzima di ridurre in assenza di ossigeno o di reagire con ossigeno a concentraziones che abbiamo specificato. Sebbene il stopped-flow è nel vano portaoggetti, vi è ossigeno nel circuito di flusso se usato buffer aerobiche in esperimenti precedenti. Oltre alle misurazioni di assorbanza, saggi di dicroismo circolare e fluorescenza può essere eseguita in Applied Photophysics SX20 stopped-flow spettrofotometro con relativi accessori.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
La ricerca finanziata dalla NSF award MCB-1021384.
Materiali
| Name | Company | Catalog Number | Comments |
| Attrezzatura generale di laboratorio | Azienda | Numero di catalogo | |
| Pompa del vuoto | Welch | - | |
| Büchner fiaschi | Pescatore | 70340-500 | |
| Mescolare bar | Pescatore | 14-512-129 | |
| Mescolare piastre | Pescatore | 11-100-49S | |
| Schlenk linee | Kontes Glass | - | |
| Serbatoio di Argon | Airgas | AR UPC300 | |
| Serbatoio di azoto | Airgas | NI200 | |
| Azoto serbatoio, ultra elevato grado di purezza | Airgas | NI UHP200 | |
| Serbatoio di ossigeno | Airgas | OX 40 | |
| 5% di idrogeno equilibrio serbatoio di azoto | Airgas | X02NI95B200H998 | |
| SX20 Stop-flow spettrofotometro | AppliedPhotophysics | - | |
| Glove box | Schivo | - | |
| Bagnomaria | Brinkmann Lauda | - | |
| Forniture | |||
| 50 mL tubi BD Falcon | Pescatore | 14-432-23 | |
| 15 mL tubi conici BD Falcon | Pescatore | 05-527-90 | |
| 1.5 mL microcentrifuga Eppendorf tubi | Pescatore | 05-402-18 | |
| 50 e 25 flaconi di vetro ml | Pescatore | 06-402 | |
| Tappi di gomma | Pescatore | 06-447H | |
| Alluminio guarnizioni | Pescatore | 06-406-15 | |
| Reagents | |||
| Fosfato di potassio, monobasico | Pescatore | AC2714080025 | |
| Fosfato di potassio, dibasico | Pescatore | P288-500 | |
| Sodio Acetato | Sigma | S-2889 | |
| Glucosio ossidasi da A. Niger | Sigma | G7141-250KU | |
| D-Glucosio | Pescatore | D16-500 | |
| β-NADPH | Pescatore | ICN10116783 | |
| L (+)-ornitina cloridrato | Pescatore | ICN10116783 |
Riferimenti
- Hissen, A. H. The Aspergillus fumigatus siderophore biosynthetic gene sidA, encoding L-ornithine N5-oxygenase, is required for virulence. Infect. Immun. 73 (9), 5493-5503 (2005).
- Chocklett, S. W., Sobrado, P. Aspergillus fumigatus SidA is a highly specific ornithine hydroxylase with bound flavin cofactor. Biochemistry. 49 (31), 6777-6783 (2010).
- Mayfield, J. A. Comprehensive spectroscopic, steady state, and transient kinetic studies of a representative siderophore-associated flavin monooxygenase. J. Biol. Chem. 285 (40), 30375-30388 (2010).
- Fierke, C. A., Hammes, G. G. Transient kinetic approaches to enzyme mechanisms. Contemporary enzyme kinetics and mechanism. , (2009).
- Palfey, B. A., McDonald, C. A. Control of catalysis in flavin-dependent monooxygenases. Arch. Biochem. Biophys. 493 (1), 26-26 (2010).
- van Berkel, W. J. H., Kamerbeek, N. M., Fraaije, M. W. Flavoprotein monooxygenases, a diverse class of oxidative biocatalysts. J. Biotechnol. 124 (4), 670-689 (2006).
- Chapman, S. K., Reid, G. A. . Flavoprotein Protocols. , (1999).
- Sobrado, P., Fitzpatrick, P. F. Solvent and primary deuterium isotope effects show that lactate CH and OH bond cleavage are concerted in Y254F flavocytochrome b2, consistent with a hydride transfer mechanism. Biochemistry. 42, 15208-15214 (2003).
- Kumar, S., Gawandi, V. B., Capito, N., Phillips, R. S. Substituent effects on the reaction of β-benzoylalanines with Pseudomonas fluorescens kynureninase. Biochemistry. 49 (36), 7909-7913 (2010).
- Yun, D., García-Serres, R., Chicalese, B. M., An, Y. H., Huynh, B. H., Bollinger, J. M. J. (μ-1,2-Peroxo)diiron(III/III) complex as a precursor to the diiron(III/IV) intermediate X in the assembly of the iron-radical cofactor of ribonucleotide reductase from mouse. Biochemistry. 46 (7), 1925-1932 (2007).
- Pennati, A., Zanetti, G., Aliverti, A., Gadda, G. Effect of salt and pH on the reductive half-reaction of Mycobacterium tuberculosis FprA with NADPH Biochemistry. Biochemistry. 47 (11), 3418-3425 (2008).
- Patil, P. V., Allou, D. P. The use of protocatechuate dioxygenase for maintaining anaerobic conditions in biochemical experiments. Analytical Biochemistry. 286 (2), 187-192 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon