Method Article
رصد انتقاصية ومؤكسد نصف ردود فعل من Monooxygenase فلافين التي تعتمد على استخدام توقف تدفق الطيفي
In This Article
Summary
وصفنا استخدام أداة توقف تدفق للتحقيق في كل من الاختزالية والاكسدة نصف ردود فعل الرشاشية الدخناء حاملة الحديد A (سيدا)، والتي تعتمد على monooxygenase فلافين. نعرض ثم الأطياف المقابلة لالأنواع في رد فعل من سيدا، ونحن حساب ثوابت معدل لتشكيلها.
Abstract
الرشاشية الدخناء حاملة الحديد A (سيدا) هو monooxygenase FAD المحتوية على أن يحفز الهيدروكسيل من الأورنيثين في التركيب الحيوي من siderophores hydroxamate التي تعتبر ضرورية لالفوعة (على سبيل المثال ferricrocin أو N '، N "، N'''-triacetylfusarinine C) 1. ويمكن تقسيم رد فعل يحفزه سيدا إلى الاختزالية والأكسدة ردود الفعل نصف (مخطط 1). وفي التخفيض نصف رد فعل، يتم تقليل FAD تتأكسد منضما إلى سيدا و، بواسطة NADPH 2،3. وفي رد فعل الأكسدة نصف والعامل المساعد انخفاض يتفاعل مع الأوكسجين الجزيئي لتشكيل المتوسطة C4a-hydroperoxyflavin، والذي ينقل الأكسجين إلى ذرة الأورنيثين. هنا، ونحن تصف إجراء لقياس معدلات وكشف أشكال مختلفة من الأطياف سيدا باستخدام أداة توقف تدفق مثبتة في 1 علبة القفازات اللاهوائية. في صك توقف التدفق، كميات صغيرة من المواد الداخلة في التفاعل وبسرعة متفاوتة، وبعد أن تم إيقاف تدفق من قبل اله حقنة توقف (الشكل 1)، وتسجل التغيرات الطيفية من الحل وضعت في زنزانة الملاحظة مع مرور الوقت. في الجزء الأول من التجربة، وتبين لنا كيف يمكننا استخدام أداة توقف التدفق في وضع واحد، حيث يتم قياسها بشكل مباشر على تخفيض اللاهوائية من فلافين في وسيدا و بواسطة NADPH. نحن نستخدم ثم إعدادات خلط مزدوج حيث لا هوائيا اول خفض لسيدا و NADPH بواسطة لفترة محددة من الوقت في حلقة الشيخوخة، ومن ثم كان رد فعل مع الأكسجين الجزيئي في الخلية مراقبة (الشكل 1). من أجل تنفيذ هذه التجربة، ومخازن اللاهوائية ضرورية لأنه عندما يتم رصد سوى التخفيض نصف رد فعل، أي الأوكسجين في الحلول وتتفاعل مع العامل المساعد فلافين انخفاض وتشكيل وسيطة C4a-hydroperoxyflavin التي من شأنها أن تتحلل في نهاية المطاف العودة الى فلافين المؤكسد . فإن هذا لن تسمح للمستخدم لقياس بدقة معدلات انخفاض منذ لن يكون هناك دوران كامل للenzyme. عندما يجب أن تجرى حاليا دراسة الأكسدة نصف رد فعل يتم تخفيض الانزيم في غياب الأوكسجين بحيث يتم فقط لاحظت الخطوات بين الحد والأكسدة. واحد من المخازن المؤقتة المستخدمة في هذه التجربة هو الاوكسجين مشبعة حتى نتمكن من دراسة الأكسدة نصف رد فعل على تركيزات أعلى من الأوكسجين. هذه غالبا ما تكون الإجراءات المنفذة وعند دراسة إما الاختزالية أو مؤكسد نصف ردود فعل مع فلافين التي تحتوي على monooxygenases. مقياس الوقت من التجارب السابقة للحالة استقرار أداء مع التدفق توقف هو ميلي ثانية إلى ثانية، والتي تسمح بتحديد سعر الثوابت الجوهرية وكشف وتحديد وسيطة في رد فعل 4. ويمكن تطبيق الإجراءات المذكورة هنا لmonooxygenases فلافين التي تعتمد على الآخرين. 5،6
Protocol
1. إعداد الواق اللاهوائية
- تحضير 1 لتر 100 ملم البوتاسيوم العازلة الفوسفات ودرجة الحموضة 7.5. صب 250 مل من المنطقة العازلة في دورق بوخنر 500 مل مع قضيب تحريك.
- اغلاق القارورة مع سدادة مطاطية ووضعه على طبق من ضجة. ربط أنبوب قصير من القارورة إلى خط شلنك.
- ديغا المنطقة العازلة تحت فراغ لمدة 5 ساعات في درجة حرارة الغرفة مع الإثارة. خلال هذه الفترة الزمنية، وتنفيذ 5 جولات متتالية من فراغ التفريغ والتنظيف مع الأرجون في كل ساعة.
- مسح القارورة مع الأرجون لمدة 10 ثانية، وفصلها من فراغ متعددة. ضع قارورة داخل علبة القفازات.
- ترك القارورة مفتوحة في علبة القفازات بين عشية وضحاها مع الانفعالات القوية.
2. إزالة الأوكسجين من نظام توقف تدفق
- تحضير 1 لتر من 0.1 خلات الصوديوم م، ودرجة الحموضة 5.0. صب 125 مل من هذا المخزن الى دورق بوخنر 250 مل، وتنفيذ الخطوات 1،2-1،4.
- وزن من أصل 5مغ أوكسيديز الجلوكوز من النيجر الرشاشيات (181300 U / ز) و 0.9 غرام جلوكوز باستخدام أنبوب 1،5 إيبندورف مل و 50 مل أنبوب مخروطي الصقر، على التوالي. وضع كل من الحاويات في علبة القفازات.
- حل أوكسيديز الجلوكوز والجلوكوز في 50 مل من اللاهوائية 0.1 خلات الصوديوم م، ودرجة الحموضة 5.0 (تركيز النهائي من 18،13 U / مل و 100 ملم على التوالي). ملء خزان المحاقن مع هذا الحل (الشكل 1).
- تأكد من أن محرك الصمامات هي في موقف "تحميل" وملء محرك الحقن (الشكل 1). تحويل صمام F لموقف "محرك الأقراص". تفريغ حقنة توقف من خلال النقر على فارغ في برنامج حاسوبي لمراقبة الموالية للبيانات. دفع المخزن المؤقت من محرك F حقنة عبر الدائرة عن طريق زيادة تدفق يدويا رام الصلب المطابق. كرر هذه الخطوة 10 مرات في المجموع. تنفيذ الإجراء نفسه مع غيرها من محرك الحقن الثلاث. انتظر ساعة واحدة.
- استبدال حل للمحاقن خزان مع contai العازلة نفسهنينغ أوكسيديز الجلوكوز والجلوكوز. كرر الخطوة 2.4.
- كرر الخطوة 2.5 والسماح للحل للوقوف في نظام تدفق بين عشية وضحاها.
- بعد حضانة بين عشية وضحاها، كرر الخطوة 2.5.
3. إعداد مخزن الأوكسجين المشبعة
- إعداد 100 فوسفات البوتاسيوم العازلة ملم (7.5 درجة الحموضة)، وسكب 50 مل إلى قارورة 50 مل مع قضيب تحريك. تتويج القارورة مع سدادة ويتون، وختم الألومنيوم ويتون.
- وضع قنينة على الجليد. تزج إبرة طويلة متصلة خزان يحتوي على أكسجين بنسبة 100٪ الى حل. أدخل إبرة أخرى قصيرة من خلال سدادة من قنينة وتنفيس.
- فقاعة الحل مع الأكسجين بنسبة 100٪ لمدة 1 ساعة مع الإثارة.
- أولا إزالة الإبرة قصيرة من قارورة والانتظار 10 ثانية قبل إزالة إبرة طويلة. وضع قنينة مغلقة في علبة القفازات.
4. إعداد الحل NADPH
- وزن من 1 ملغ من NADPH في أنبوب 1،5 مل إيبندورف والمكان وأناتي في علبة القفازات.
- حل NADPH في 300 ميليلتر من اللاهوائية العازلة 100 ملم الفوسفات والبوتاسيوم، ودرجة الحموضة 7.5. إزالة 30 ميكرولتر من هذا الحل من علبة القفازات لتحديد تركيز NADPH مع طيفي (ε 340 نانومتر = 6270 م -1 سم -1).
5. إزالة الأوكسجين من الحل الإنزيم
- تناول 400 ميكرولتر من محلول المخزون انزيم من الفريزر وذوبان الجليد في علبة القفازات. محلول المخزون انزيم (360 ميكرومتر) وأعدت سابقا في 100 ملي البوتاسيوم العازلة الفوسفات (7.5 درجة الحموضة) التي تحتوي على 100 ملي مول كلوريد الصوديوم، وتجميدها في النيتروجين السائل.
- نقل حل انزيم إلى قارورة 25 مل مع قضيب تحريك، وكأب القارورة مع سدادة ويتون، وختم الألومنيوم ويتون وإزالته من علبة القفازات.
- وضع قنينة على الجليد وذلك لربط خط شلنك بواسطة ادخال ابرة من خلال السدادة من القارورة.
- ديغا الحل الانزيم عن طريق إجراء 5 جولات متتالية منفراغ التفريغ والتنظيف مع الأرجون كل 20 دقيقة لمدة 1 ساعة.
- مسح القارورة مع الأرجون لمدة 10 ثانية، وفصلها من فراغ متعددة. وضع قنينة على الجليد داخل علبة القفازات.
6. التخفيض نصف رد فعل: رصد لحد من فلافين
- إعداد صك توقف تدفق ومراقبة البرامج الموالية للبيانات عن وضع خلط واحدة بعد بروتوكول الشركة المصنعة.
- بدوره على حمام مائي المتداولة (15 درجة مئوية). إزالة الأكسجين من المياه عن طريق فقاعات النيتروجين من خلال ذلك لمدة 20 دقيقة. هذا يمنع تلوث الأكسجين عبر الدائرة تدفق.
- المحافظة على درجة حرارة محرك الحقن وخلية المراقبة عند 15 درجة مئوية من خلال ربط المساكن حمام ماء للتوقف عن التدفق إلى الحمام المنتشرة.
- في إطار لوحة التحكم من برنامج مراقبة الموالية للبيانات photodiode مجموعة مختارة، الزناد الخارجية (لتنشيط توقف تدفق العملية)، وLogarithmic النطاق.
- إطلاق برنامج المشاهد المؤيدة للبيانات وتحديد الدليل حيث سيتم تخزين ملفات البيانات.
- استبدال حل من خزان الحقن C و F مع اللاهوائية العازلة 100 ملم فوسفات البوتاسيوم (7.5 درجة الحموضة). تحويل C وصمامات F لموقف "محرك الأقراص". تفريغ حقنة توقف بالضغط فارغ في برنامج حاسوبي لمراقبة الموالية للبيانات. دفع المخزن المؤقت على حد سواء من محرك الحقن عبر الدائرة عن طريق زيادة تدفق يدويا محرك المقابلة كبش خمس مرات في المجموع (انقر فوق إفراغ قبل كل حركة من ذاكرة الوصول العشوائي).
- من أجل ضمان أن تمت إزالة أوكسيديز الجلوكوز تماما من الدائرة التدفق، وتنفيذ الخطوة 6،6 أربع مرات في المجموع.
- انقر على خط الأساس في برنامج حاسوبي لمراقبة الموالية للبيانات.
- مزيج 100 ميكرولتر من محلول المخزون انزيم مع 1100 ميكرولتر من اللاهوائية العازلة 100 ملم فوسفات البوتاسيوم (تركيز النهائي بعد خلط في تدفق توقف من 15 ميكرومتر).
- استبدال حل من خزان SYRF إنجي مع الحل الانزيم. تحويل صمام F لموقف "محرك الأقراص". تفريغ حقنة توقف بالضغط فارغ في برنامج حاسوبي لمراقبة الموالية للبيانات. دفع حل الانزيم من F حقنة حملة عبر الدائرة عن طريق زيادة تدفق يدويا رام الصلب المطابق. تنفيذ هذا ثلاث مرات في المجموع. في برنامج للتحكم المؤيدة للبيانات، ضبط الوقت اكتساب الى 60 ق.
- تأكد من أن يتم ملء كل محرك الحقن مع حلول يناظرها والكباش حملة على اتصال مع بيستونز حقنة محرك. تحول كل من الصمامات لموقف "محرك" وفوق تحصل عليها في برنامج حاسوبي لمراقبة الموالية للبيانات لتنفيذ الحملة. كرر هذه الخطوة مرتين أكثر للحصول على البيانات في ثلاث نسخ. هذه الأطياف غلة شكل المؤكسد من الانزيم.
- باستخدام قيمة 452 نانومتر تم الحصول عليها من محركات الأقراص، تحديد تركيز انزيم قبل الاختلاط (ε 452 نانومتر = 13700 م -1 سم -1)، وإعداد 4 مل من محلول NADPHن 1.5 أضعاف أكثر تركيزا.
- استبدال حل من خزان حقنة C مع الحل NADPH والفارغة وإعادة ملء محقنة توقف ثلاث مرات كما هو موضح في 6.10.
- كرر الخطوة 6.11. هذه الأطياف الغلة خلال الحد من الانزيم.
7. التأكسدي نصف رد فعل: مراقبة الأكسدة فلافين
- إعداد صك توقف تدفق ومراقبة البرامج الموالية للبيانات عن وضع خلط مزدوج بعد بروتوكول الشركة المصنعة.
- كرر الخطوات من 6،2-6،5.
- استبدال الحل في حقن الخزان الأربع مع اللاهوائية العازلة 100 ملم فوسفات البوتاسيوم (7.5 درجة الحموضة). تحويل صمام F لموقف "محرك الأقراص". إفراغ حقنة توقف بالضغط فارغ في برنامج حاسوبي لمراقبة الموالية للبيانات. دفع المخزن المؤقت من محرك F حقنة عبر الدائرة عن طريق زيادة تدفق يدويا رام الصلب المطابق. تنفيذ هذه الخطوة خمس مرات في المجموع مع كل حقنة بالسيارة.
- تنفيذ الخطوة 7،3 أربع مرات في تدريب المدربينالقاعدة لإزالة المحتويات من دائرة تدفق.
- فوق خط الأساس في برنامج حاسوبي لمراقبة الموالية للبيانات.
- مزيج 200 ميكرولتر من محلول المخزون انزيم مع 1000 ميكرولتر من اللاهوائية العازلة 100 ملم فوسفات البوتاسيوم (تركيز النهائي بعد خلط في تدفق توقف من 15 ميكرومتر).
- استبدال حل محقنة خزان ومع الحل الانزيم. تحويل صمام ألف لموقف "محرك الأقراص". تفريغ حقنة توقف بالضغط فارغ في برنامج حاسوبي لمراقبة الموالية للبيانات. دفع حل الانزيم من حقنة محرك الأقراص A من خلال الدائرة تدفق من خلال رفع يدويا رام الصلب المطابق. تنفيذ هذه الخطوة ثلاث مرات في المجموع. في برنامج للتحكم المؤيدة للبيانات، ضبط الوقت تأخير إلى 0.5 S واكتساب الوقت إلى 60 ق.
- ضمان أن يتم شغل كل محرك الحقن مع حلول يناظرها والكباش حملة على اتصال مع بيستونز حقنة محرك. تحويل جميع الصمامات الى الموقف "محرك" وانقر تحصل عليها في دات بروبرمجيات التحكم لأداء المحرك. كرر هذه الخطوة مرتين أخريين للحصول على البيانات في ثلاث نسخ. هذه الأطياف غلة شكل المؤكسد من الانزيم.
- استبدال حل من خزان حقنة B مع حل NADPH 1.5 أضعاف أكثر تركيزا من حل الانزيم في ألف حقنة أدر صمام باء لموقف "محرك" والفارغة وإعادة ملء محقنة توقف ثلاث مرات كما هو موضح في 7.7.
- استبدال حل من خزان حقنة C مع عازلة الاوكسيجين. تحويل صمام جيم للموقف "محرك" والفارغة وإعادة ملء محقنة توقف ثلاث مرات كما هو موضح في 7.7. في برنامج للتحكم المؤيدة للبيانات، ضبط الوقت تأخير، والاستحواذ على 15 و 900 ثانية، على التوالي.
- كرر الخطوة 7.8. هذه الأطياف الغلة خلال عودة التأكسد للانزيم خفضت بشكل كامل.
8. تحليل البيانات
- اطلاق برنامج تحويل الموالية للبيانات. انقر على أيقونة خيارات وحدد حفظ في ProDataCSV.
- فتحالدليل حيث تم تخزين ملفات البيانات. اسحب الملفات إلى إطار APL محول الموالية للبيانات. سيتم حفظ البيانات تلقائيا في شكل ملفات CSV في نفس الدليل.
- فتح ملفات تنسيق CSV باستخدام Microsoft Excel (مايكروسوفت، ريدموند، واشنطن، الولايات المتحدة الأمريكية). تطبيع الأساس من آثار توقف التدفق من خلال طرح الاستيعاب المناظر في 700 نانومتر.
- تحليل آثار تصحيح باستخدام KaleidaGraph (برامج التآزر، القراءة، والسلطة الفلسطينية) من خلال تركيب مؤامرة من الامتصاصية في أقصى المناظرة مقابل الزمن إلى وظيفة مناسبة الأسي. كما هو مبين في الشكل 2B، والامتصاصية في 452 نانومتر وتآمر بوصفها وظيفة من الوقت من أجل تحديد معدل الحد من فلافين بعد خلط الانزيم وNADPH في الصك توقف التدفق. في هذه الحالة، تم الحصول على أفضل مناسبة للبيانات باستخدام معادلة مزدوجة الأسي ومعدلات 0،65 و 0،23 ث -1 حسبت للمرحلة الأولى والثانية للتخفيض، الدقةpectively. لتحديد نسبة من تشكيل المتوسطة C4a-hydroperoxyflavin وعودة التأكسد بعد رد فعل الإنزيم المخفض مع الأكسجين، وقمنا بتحليل آثار توقف التدفق في 380 و 452 نانومتر، على التوالي (الشكل 3B). باستخدام معادلة واحدة الأسي، قمنا بحساب معدلات S 1.4 و 0.006 -1 للخطوة الأولى والثانية للأكسدة نصف رد فعل، على التوالي.
9. ممثل النتائج
النتائج من التجارب المذكورة في المقاطع السابقة تبين كيف يمكن رصدها على التخفيض نصف رد فعل من وسيدا و من خلال قياس التغيرات التي طرأت على الامتصاصية في 452 نانومتر، والتي تتوافق مع التغيرات التي طرأت على الدولة الأكسدة من فلافين. ويمكن تحديد معدل هذه الخطوة من قبل تركيب البيانات إلى معادلة مناسبة (الشكل 2؛ الخطوة 8.4). معدل الحد من الحصول على (0.65 ق -1) مشابهة للقيمة القط ك حساب معالحالة المستقرة التجارب 2، مما يدل على أن هذا الانخفاض في معدلات تحديد الخطوة من رد الفعل. الاستفادة من وضع اختلاط المزدوج للتوقف عن التدفق، يمكن تحديد نسبة الأكسدة وسيطة في هذا رد فعل في الشوط (الشكل 3، خطوة 8.4). في رد فعل يحفزه وسيدا و، يتم الكشف عن C4a-hydroperoxyflavin بوضوح (λ كحد أقصى من 380 نانومتر)، ويمكن حساب معدل تكوين والاضمحلال. بطء وتيرة عودة التأكسد والتي تم الحصول عليها (0.006 ق -1) يشير إلى أن C4a-hydroperoxyflavin مستقرة جدا في غياب الأورنيثين.

مخطط 1. آلية من A و سيدا. يتم عرض حلقة isoallozaxine من العامل المساعد FAD. وفلافين أكسدة (A) بربط NADPH (B) وتتفاعل لتشكيل فلافين خفضت وNADP + (C). بعد رد فعل مع الأكسجين الجزيئي وتجليدالأورنيثين، يتم تشكيل C4a-hydroperoxyflavin (D). هذا هو النوع hydroxylating. بعد الهيدروكسيل من الأورنيثين، يجب أن hydroxyflavin (E) يكون المجففة لتشكيل أنزيم المؤكسد. NADP + ما زالت ملزمة في جميع مراحل دورة الحفاز وهي نتاج الماضي أن يطلق سراحه (F).
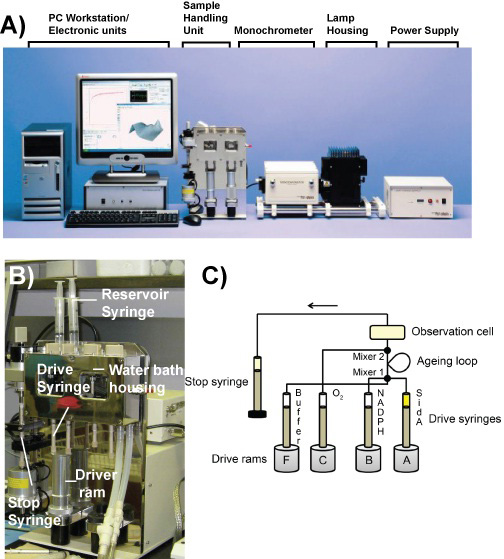
الشكل 1. صك توقف التدفق. أ) توقف تدفق صورة من مكونات SX20 Photophysics التطبيقية طيفي. ب) صورة لعينة وحدة معالجة. C) من نظام الدارة تدفق في وضع خلط مزدوج.
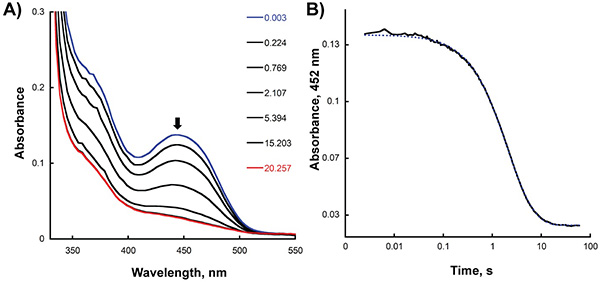
الشكل 2. تخفيض اللاهوائي للسيدا مع NADPH في الصك توقف التدفق. والتغييرات) الطيفية تسجل بعد خلط كميات متساوية من سيدا ميكرومتر 30 و 45 ميكرومتر NADPH. الطيف الأول (تتأكسد SIDA) وطيف الماضي (خفضت بشكل كامل سيدA) هو تسليط الضوء على التوالي في والازرق والاحمر. ب) تتبع الامتصاصية في 452 نانومتر سجلت بوصفها وظيفة من الزمن.
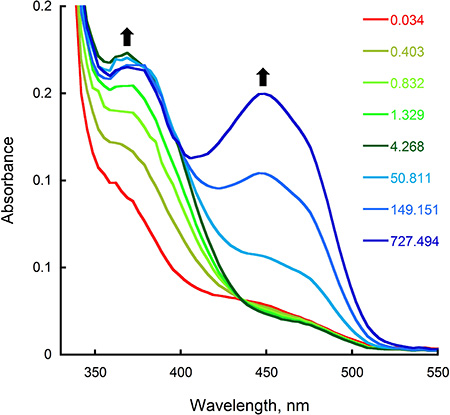
الشكل 3. الأكسدة من سيدا في الصك توقف التدفق. أ) التغيرات الطيفية تسجل بعد أحجام متساوية خلط للسيدا خفضت بشكل كامل والعازلة الاوكسيجين. كانت التركيزات النهائية 15 ميكرومتر سيدا، NADPH 22.5 ميكرون، و 0.95 ملي الأوكسجين. الطيف سجلت في 4.268، 0.034، و 727،494 ق يتوافق مع انزيم خفضت بشكل كامل، وسيطة C4a-hydroperoxyflavin (λ كحد أقصى من 380 نانومتر)، والانزيم المؤكسد (λ كحد أقصى من 450 نانومتر)، على التوالي. ب) تتبع الامتصاصية في 382 و 452 نانومتر سجلت بوصفها وظيفة من الزمن.
Discussion
الإنزيمات التي تحفز تفاعلات الأكسدة والاختزال عادة ما تحتوي على العوامل المساعدة مثل وhemes flavins أن تخضع لتغييرات كبيرة خلال الامتصاصية دورة الحفاز. شكل المؤكسد للفلافين يقدم ماكسيما الامتصاصية في ~ 360 و 450 نانومتر، وعادة ما يتم رصد الحد من قبل بعد انخفاض الامتصاصية في 450 نانومتر 7. بشكل عام، وبعض السلع الوسيطة عابر موجودة ولكن شكل والاضمحلال بسرعة جدا بحيث لا يمكن قياسها في مطياف العادية. باستخدام Photophysics التطبيقية SX20 توقف تدفق طيفي (أو أدوات مماثلة)، فمن الممكن لقياس التغيرات الامتصاصية في مقياس الوقت ميلي ثانية واحدة (ميت مرة، 2 مللي ثانية). درس هنا نحن في الاختزالية والاكسدة نصف ردود فعل monooxygenase فلافين التي تعتمد على وسيدا و، نموذجا يحتذى. وتم تحديد سعر نقل هيدريد عن طريق قياس التغير في الامتصاصية في 452 نانومتر بعد خلط انزيم مع NADPH في الظروف اللاهوائية. في وقت لاحق، مع الميزهوكان (ه) من وضع خلط مزدوج وثيقة وقف التدفق، كان رد فعل لأول مرة انزيم مع NADPH، حتى تم تحقيق تخفيض كامل، ثم كانت مختلطة في خفض انزيم NADP + مجمع مع الأكسجين. بعد هذا الإجراء، فإنه من الممكن الكشف عن عابر وسيطة فلافين الاوكسيجين وقياس معدلات تكوين والاضمحلال. وتحديد هذه السلع الوسيطة توفر البيانات التجريبية حول طبيعة هذا النوع رد فعل في الحفز. في حالة وجود سيدا و، تشكيل C4a-hydroperoxyflavin (رصدها عادة في 370-380 نانومتر)، والذي هو نوع hydroxylating. وبالإضافة إلى ذلك، وقياس معدل ثابت من كل خطوة واحد يسمح للحصول على معلومات عن خطوة تحديد سعر للتفاعل ويساعد على إلقاء الضوء على آليات الحركية والكيميائية للانزيم.
بشكل عام، يمكن استخدام نهج مماثل لflavoenzymes أخرى، أو البروتينات التي الامتصاصية التغييرات التي حدثت، مثل البروتينات التي تابععين الهيم، بيريدكسال فوسفات، أو غير هيم الحديد 8-10. وجود قيود على هذا الأسلوب هو أن هناك حاجة إلى كميات كبيرة من انزيم المنقى، ولكن يمكن التغلب على ذلك عن طريق استخدام نظام التعبير ذات العوائد المرتفعة. واحد يحدد تركيز بروتين الأمثل لأطياف تسجيل عن طريق استخدام ما يكفي من البروتين بحيث يمكن ملاحظة إشارة قوية بما فيه الكفاية، ولكن ليس كثيرا حتى لا يضيع هذا الانزيم. عادة، فإن أقل تركيز انزيم لفلافين التي تحتوي على الانزيمات المستخدمة في توقف تدفق التجارب هو 6-10 ميكرومتر (بعد خلط) ويتم تحديده باستخدام المقابلة معامل الانقراض ضرس من الانزيم. في حالة وجود سيدا و، النسبة المئوية للFAD انزيم ملزمة هو 50-65٪ 2. ويعتبر الاشتقاق بروتين كما نشط في هذه التجارب لأن العامل المساعد FAD المنضم هو ضروري لالحفز. ومن أوجه القصور الممكنة لهذا الأسلوب هو في حالة العمليات في انزيم يحدث بشكل أسرع من 2 مللي ثانية (الوقت الميت من التدفق توقف) لن يكون لاحظوا، ولكن الوتفيد التقارير يحرث الاستراتيجيات التي يمكن أن انخفضت معدلات للتغلب على هذه المشكلة. مثال واحد لهذا يتضمن استخدام تركيزات عالية كلوريد الصوديوم في رد فعل على اختزال + NADP فيريدوكسين-11. لتنقية الأكسجين من الدائرة تدفق تدفق توقفت في كثير من الأحيان خطوة صعبة في هذه التجربة وتتطلب اهتماما خاصا. يستخدم الجلوكوز أوكسيديز الجلوكوز، نظام الموصوفة هنا بنجاح في معظم المختبرات كما هو وسيلة فعالة وغير مكلفة. ومع ذلك، هناك بعض السلبيات التي تشمل إنتاج H 2 O 2 وبالنسبة لبعض التطبيقات وينبغي النظر في بدائل أخرى مثل نظام دي أكسيجيناز-protocatechuate protocatechuate 12. الاستفادة من علبة القفازات اللاهوائية يجعل من الاسهل لضمان الظروف اللاهوائية، ولكن ليس ضروريا. ويجب إزالة الأكسجين من دائرة تدفق تدفق توقف لاننا نريد ان يتم تخفيض الانزيم في غياب الأكسجين أو تتفاعل مع الأكسجين في تركيزق الذي نحدده نحن. وعلى الرغم من توقف التدفق هو في علبة القفازات، وهناك أكسجين في دائرة تدفق إذا كنا مخازن الهوائية في التجارب السابقة. بالإضافة إلى قياسات الامتصاصية، يمكن تنفيذ المقايسات ازدواج اللون مضان والتعميم في معمل توقف تدفق للPhotophysics التطبيقية SX20 مع الملحقات ذات الصلة.
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
البحثية التي تدعمها جائزة جبهة الخلاص الوطني MCB-1021384.
Materials
| Name | Company | Catalog Number | Comments |
| عام معدات المختبرات | شركة | فهرس العدد | |
| فراغ مضخة | وولش | - | |
| بوخنر قوارير | الصياد | 70340-500 | |
| إثارة القضبان | الصياد | 14-512-129 | |
| إثارة لوحات | الصياد | 11-100-49S | |
| شلنك خطوط | Kontes زجاج | - | |
| الأرجون دبابة | Airgas | AR UPC300 | |
| النيتروجين دبابة | Airgas | NI200 | |
| خزان النيتروجين، ودرجة نقاء عالية جدا | Airgas | NI UHP200 | |
| خزان الأكسجين | Airgas | OX 40 | |
| 5 توازن النيتروجين خزان الهيدروجين٪ | Airgas | X02NI95B200H998 | |
| SX20 القديسأوب تدفق طيفي | AppliedPhotophysics | - | |
| علبة القفازات | خجول | - | |
| ماء الحمام | BRINKMANN لاودا | - | |
| لوازم | |||
| 50 مل BD الصقر أنابيب | الصياد | 14-432-23 | |
| 15 مليلتر دينار بحريني الصقر مخروطي أنابيب | الصياد | 05-527-90 | |
| 1.5 microcentrifuge إيبندورف أنابيب مل | الصياد | 05-402-18 | |
| 50 و 25 قارورة زجاج مل | الصياد | 06-402 | |
| سدادات المطاط | الصياد | 06-447H | |
| الألومنيوم الاختام | الصياد | 06-406-15 | |
| ReagenTS | |||
| فوسفات البوتاسيوم، أحادى | الصياد | AC2714080025 | |
| فوسفات البوتاسيوم، ثنائي القاعدة | الصياد | P288-500 | |
| خلات الصوديوم | سيغما | S-2889 | |
| أوكسيديز الجلوكوز من أ. النيجر | سيغما | G7141-250KU | |
| D-جلوكوز | الصياد | D16-500 | |
| β-NADPH | الصياد | ICN10116783 | |
| L (+)-الأورنيثين هيدروكلوريد | الصياد | ICN10116783 |
References
- Hissen, A. H. The Aspergillus fumigatus siderophore biosynthetic gene sidA, encoding L-ornithine N5-oxygenase, is required for virulence. Infect. Immun. 73 (9), 5493-5503 (2005).
- Chocklett, S. W., Sobrado, P. Aspergillus fumigatus SidA is a highly specific ornithine hydroxylase with bound flavin cofactor. Biochemistry. 49 (31), 6777-6783 (2010).
- Mayfield, J. A. Comprehensive spectroscopic, steady state, and transient kinetic studies of a representative siderophore-associated flavin monooxygenase. J. Biol. Chem. 285 (40), 30375-30388 (2010).
- Fierke, C. A., Hammes, G. G. Transient kinetic approaches to enzyme mechanisms. Contemporary enzyme kinetics and mechanism. , (2009).
- Palfey, B. A., McDonald, C. A. Control of catalysis in flavin-dependent monooxygenases. Arch. Biochem. Biophys. 493 (1), 26-26 (2010).
- van Berkel, W. J. H., Kamerbeek, N. M., Fraaije, M. W. Flavoprotein monooxygenases, a diverse class of oxidative biocatalysts. J. Biotechnol. 124 (4), 670-689 (2006).
- Chapman, S. K., Reid, G. A. . Flavoprotein Protocols. , (1999).
- Sobrado, P., Fitzpatrick, P. F. Solvent and primary deuterium isotope effects show that lactate CH and OH bond cleavage are concerted in Y254F flavocytochrome b2, consistent with a hydride transfer mechanism. Biochemistry. 42, 15208-15214 (2003).
- Kumar, S., Gawandi, V. B., Capito, N., Phillips, R. S. Substituent effects on the reaction of β-benzoylalanines with Pseudomonas fluorescens kynureninase. Biochemistry. 49 (36), 7909-7913 (2010).
- Yun, D., García-Serres, R., Chicalese, B. M., An, Y. H., Huynh, B. H., Bollinger, J. M. J. (μ-1,2-Peroxo)diiron(III/III) complex as a precursor to the diiron(III/IV) intermediate X in the assembly of the iron-radical cofactor of ribonucleotide reductase from mouse. Biochemistry. 46 (7), 1925-1932 (2007).
- Pennati, A., Zanetti, G., Aliverti, A., Gadda, G. Effect of salt and pH on the reductive half-reaction of Mycobacterium tuberculosis FprA with NADPH Biochemistry. Biochemistry. 47 (11), 3418-3425 (2008).
- Patil, P. V., Allou, D. P. The use of protocatechuate dioxygenase for maintaining anaerobic conditions in biochemical experiments. Analytical Biochemistry. 286 (2), 187-192 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved