Method Article
逆行荧光染料标记允许有针对性的外单细胞记录技术鉴定神经元
摘要
逆行运输的荧光染料标记的基于解剖突起的神经元的一个子种群。可以在视觉对象标记的轴突在体内,允许确定的轴突外记录。这种技术有利于记录神经元不能被标记通过遗传操作或难以分离使用'盲人'在体内办法。
摘要
这种方法的总体目标是记录单单元反应的神经元从一个确定的人口。 在体内从单个神经元的电生理记录了解神经回路是如何发挥作用的自然条件下的关键。传统上,这些记录已经被进行“盲”的,这意味着上面的记录开始记录,小区的身份是未知的。蜂窝身份可以通过细胞juxtacellular 2或松散的膜片3染料离子导入其后决定,但这些录音不能预先定位功能异质细胞类型的特定神经元的区域。荧光蛋白可以在一个细胞类型特异性的方式允许视觉引导单细胞电生理4-6表示。不过,也有许多模型系统,而这些基因工具所不具备的。即使在基因上可访问的模型系统中,所需的亲启动子可能是未知的或可能有不同的遗传同质的神经元突起图形。同样地,病毒载体已被用于标记特定的投射神经元的亚组7,但使用这种方法是有限的毒性和缺乏跨突触的特异性。因此,需要额外的技术,提供具体的预可视化记录识别单个神经元在体内 。可视化前的目标神经元的具有挑战性的记录条件下,经典的单细胞记录往往是望而却步很难8-11是特别有用的。本文中所描述的新技术使用的荧光染料逆行运输采用钨针迅速,在一个特定的大脑区域,其独特性轴索预测的基础上,选择性地标记细胞的特定子集,从而提供了一个可视化的提示,以获得有针对性的电生理记录范围内,在一个完整的电路确定的神经元呐脊椎动物的中枢神经系统。
我们的方法的最显着的新的进步是荧光标记的使用,针对特定类型的细胞,在非转基因的可访问的模型系统。弱电鱼是一个很好的模型系统研究神经回路清醒,动物行为12。我们利用这种技术来研究感觉处理的“小细胞”(ELA)前exterolateral核弱电mormyrid鱼。 “小细胞”的假设是时间比较重要的神经元,用于检测亚毫秒级的突触前的尖峰13的到达时间的差异。然而,如髓鞘致密,吞噬突触小胞体的解剖特征已记录使用传统的方法11,14从这些细胞是非常困难的。在这里,我们证明了我们的新方法选择性地标记这些细胞在28%的准备,让可靠的,强大的录音和其特征化反应对electrosensory刺激。
研究方案
1。准备染料涂层针
- 电解削直径160微米的钨丝15。最终针尖直径范围从5-50微米。所需的针的数目依赖于被标记的区域的大小。 3-5注入后exterolateral核(ELP),我们准备了5针。
- 实验的前一天晚上,将2毫米葡聚糖共轭的Alexa Fluor 10,000兆瓦染料到每一针远端100微米的下降(<0.25微升)。
- 允许针头,在室温下风干,留下浓缩的尖端处的染料。针存放于4℃在黑暗的容器,以保护他们免受光。
2。准备手术的动物
- 诱导全身麻醉300 mg / L的MS-222罐水将鱼放置在一个解决方案。
- 称取鱼和措施叉长度(吻尖,尾鳍叉)和身体深度(最大背ventra升在横向平面的距离)。这些测量应属于表1中所示,使鱼足够小,以放置下浸水显微镜物镜( 图1)内的录音室,适合的范围之内。
- 固定及电沉默的鱼背的身体肌肉注入100微升3毫克/毫升flaxedil。
- 用水箱水填充录音室( 图1A)。腹侧边鱼放置在平台上的腔室( 图1)的中心。提供充气溶液100 mg / L的MS-222,在鱼的嘴下(1-2毫升/分钟)用移液管尖。稳定鱼棒固定在蜡放在身体两侧( 图1C)。监视鱼的健康检查连续在眼血管的血流量和体色正常。
- 沿其长轴旋转的平台,并降低平台下的后端鱼的头部一侧的背侧表面露出在水面之上,而鱼的身体的其余部分保持淹没,这样ORM。 Kimwipe一小片应放在任何非淹没的部分,以防止皮肤干燥。
3。手术( 图2)
这里描述的基本的外科手术已经非常成熟,可靠地用于盲目在体内的录音在mormyrids 16。对于其他应用,暴露所需的区域标记和记录。该地区含有细胞的轴突末梢必须是可达的染料涂层针。该区域含有更近侧段的那些相同的轴突以上的组织必须有足够的空间以容纳水浸没透镜在我们的情况下)(2毫米的工作距离。
- 应用0.4%利多卡因溶液用棉条头的暴露的表面。
- 使用手术刀刀片,切开皮肤一块长方形的周长。使用一对镊子取出的矩形。的矩形的大小与鱼的大小进行调整,但应该是约3毫米×5毫米为6.2厘米的鱼( 图2A)。的矩形的侧边应与眼睛的中心对齐,前边缘的宽度应该是后方的眼睛,和矩形的内侧缘应该只是鱼的横向中线。
- 展开的暴露颅骨区域前内侧露出一个额外的2.5平方毫米的非重叠的区域( 图2B)。
- 彻底清除和干燥颅骨使用手术刀刀片刮走任何多余的组织的Kimwipes和强制空气干燥的表面( 图2C)的暴露表面。
- 胶水的金属柱前内侧裸露的头骨区域使用超级胶水。等待,直到胶水完全干燥( 图2D)。
- 颅骨取出一个长方形,约2毫米×4毫米的为6.2厘米的鱼。使用〜0.5毫米直径的球磨机硬质合金钻头的牙钻薄矩形的周长。然后,用手术刀和镊子,切矩形的周长相差剥离以暴露底层的大脑。其他钻孔或切割用小剪刀可能是必要的,充分暴露EL( 图2E)。如果发生肌肉出血,电灼单位也可使用。
- 切开硬脑膜(色素)和软脑膜(清除)使用弹簧剪刀或针和一对镊子取出切成部分。的exterolateral核致发光(EL)的前部和后部的部分现在可以看到,ELA和ELP,( 图3A)。
4。利息轴突逆行标记
- 用染料涂层的针(在步骤1)中的机械手的位置,上述包含轴突INTERES的所述对象区域T,情况ELP我们。
- 迅速地将针插入约25微米到组织中。等待15-30秒,直到所有的染料脱落,然后缩回针头。
- 重复需要额外的新鲜的针,每一个放置在不同的位置,使染料分布在整个目标区域。我们每准备用3-5针。
- 希克曼林格液腔冲洗多余的染料。
- 染料的吸收和运输,等待至少2个小时。
5。轴突的可视化
- 将录音室,以及鱼,下面的目标,一个直立的,固定载物台的落射荧光显微镜。由于鱼的体阻塞光的穿透力,白色和荧光光源必须从以上。上述颅骨腔光纤光源的精心安排让令人满意的明场图像。萤光观看,荧光过滤器规格应匹配的染料的吸收/发射光谱。
- 切换呼吸到新鲜罐水,并保持相同的流速。暴露的脑腔中,将一根地线连接到地面记录探头(见6.3)。
- 将旁边的尾根部的一对记录电极,并连接到一个差分放大器和记录装置( 例如,音频监视器,示波器,或计算机)来监视电器官放电的命令(EODC)。鱼从麻醉中恢复后,EODC可用于作为鱼的情况的一个指标。
- 准备过的大脑区域在低倍率缩放草图。包括作为地标(可能会有所不同,从鱼到鱼)确定主要血管的确切位置,只有在高倍率下( 图3D)可见标记的轴突。
- 确认染料安置。首先查看整个组织方向(与明照明的图3A)。然后查看荧光照明( 图3B)。 ELP将有弥漫性标记( 图3B和3C)。最小化荧光激发的染料,以限制光动力和光毒性作用。
- 使用地标船只定位在高倍率下的ELA。荧光灯点亮,同时寻找附近的表面标记的轴突。 ( 图4)。
6。记录外活动
- 拉吸的记录电极使用1毫米外径,0.58 mm内径硼硅玻璃毛细管用灯丝。理想针尖大小将取决于目标轴突的直径,这在我们的例子中是0.1-0.2微米17。对于我们的应用程序中,电极尖端直径为1.5±0.4微米(范围1.0-2.4微米),一个长5毫米,窄柄以接近标记轴突不动,周围密密麻麻的组织。
- 填写电trodes过滤希克曼的振铃器解决方案。最后的的端阻力是45.2±38.0MΩ(范围:16至155MΩ)。
- 将电极放入一个电极固定器与压力端口和连接到放大器探头安装在机械臂上。运行的压力线压力端口,用于监视和控制压力,一个压力计和一个注射器中的一个丁字路口的结局。
- 的探头连接到一个放大器和一个模拟 - 数字采集装置。
- 30毫巴向外的压力在电极线,放置一个电极旁边标记的轴突。吸管放置用于可视化水平低光相机与成像软件接口。组织表面附近,并开始向轴突推进电极。当你接近轴突,向外的压力应引起轻微但明显的运动轴突。
- 当电极是旁边的轴突( 图4A,顶部)记录烈性IAL在电极上,而呈现测试刺激(在我们的例子中,我们使用单相100毫秒正面和负面的横向脉冲强度为20 mV /厘米; 图1A)。动作电位不应该得到遵守,,虽然电气神器确认适当的记录/刺激( 图4A,底部)。
- 在电极释放的外在压力和重复刺激/记录。仍然无法观察到动作电位( 图4B)。
- 轻微(125±25毫巴)吸电极和重复刺激/记录。现在可以观察到动作电位响应的刺激( 图4C)。自发活动也可能发生。如果没有观察到的动作电位,释放吸力,清除电极轻微的压力,稍微移动电极,然后再尝试吸。一旦动作电位是可见的,关闭的压力线。
- 刺激和记录需要的话。
7。终止及出售
- 一旦所有想要的录音完成后,切换到100 mg / L的MS-222呼吸已停止,直到EODC。没有EODC应检测至少10分钟。
- 根据机构指引和认可的动物保健协议处理的鱼。
8。代表结果
对于我们的特定的应用程序,大家有兴趣的学习中枢感觉神经元的刺激编码。成功的录音从标记的轴突允许单单元响应分析感官刺激18, 图5A示出了有代表性的动作电位诱发的横向electrosensory刺激用双极电极位于录音室的左侧和右侧壁的内侧。秒杀时间可以穗栅格图( 图5B)。 25毫秒的预刺激录音风嗷嗷显示低水平的自发活动。这种特殊的ELA“小细胞”,通长调整到6毫伏/厘米的刺激强度,刺激时间增加穗数重复刺激的持续时间增加( 图5C)。第一穗平均潜伏期为4.28±0.16毫秒,符合预期的延迟小细胞ELA 11。
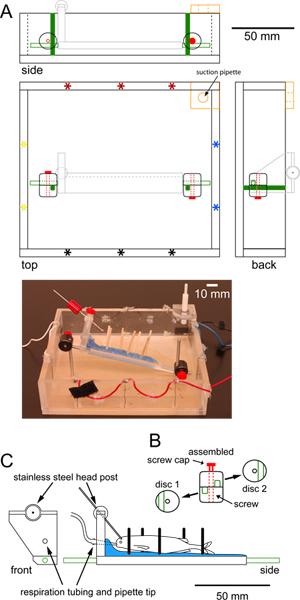
图1。记录规格的腔室可以容纳的一个固定阶段epiflourescent的显微镜的目标下面(A)要大规模方录音室由有机玻璃示出俯视图,侧视图和后视图。配对套在外围刺激电极(星号)允许横向任一(红黑色)或纵向(蓝色黄色)刺激。一个额外的一块有机玻璃在角落里,用橡胶内衬孔中心(橙色),持有吸吸管,保持恒定的水位。两个立式不锈钢职位室(绿灯)的底部拧入连接到平台支持鱼(浅灰色,在C详述)通过可调光盘夹具不锈钢职位(绿色的轮廓)。照片室到比例图如下所示(B)个人意见和组装的圆形塑料盘夹子用于固定的平台,垂直职位。每个光盘钳拧紧螺丝后的中心孔有一个凹槽(绿色)。光碟夹具旋转,使槽是相互垂直的。拧紧螺丝(红色)夹上岗到位,以防止进一步的垂直和旋转运动的平台(C)正面和侧面规模的有机玻璃平台,用来装鱼到位意见。该平台是涂有一层石蜡(蓝色)保持木有人仍然LS(黑网吧),支持鱼。油管呼吸鱼穿过一个洞,平台两端放置在鱼的嘴在枪头“床头”。的不锈钢头后(灰色条)连接到该平台通过球关节,可以360度旋转。不锈钢卧式职位(绿色)平台的任一端拧入。 点击这里查看大图 。
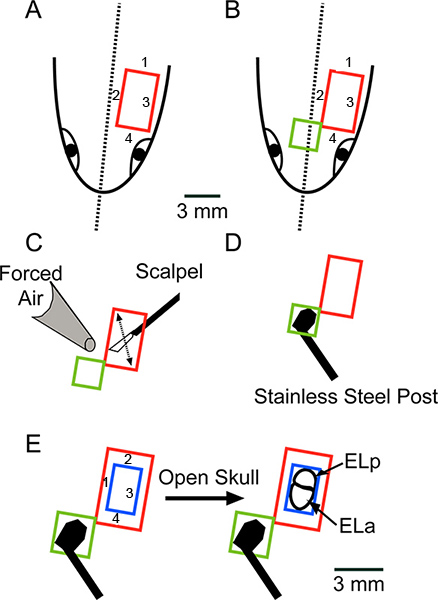
图2。手术原理概述低头看着背头部表面。(A)4个削减,指示的顺序,取出一块长方形的皮肤(红色)(B)延长开放,前内侧删除一个额外的一块长方形皮肤(绿色)(C)刮去任何剩余的脂肪或韧带移动手术刀按箭头所示的叶片表面完全干燥与KIMWIPES和强制空气(D)胶不锈钢的头骨后,使用超级胶水。在A比例尺适用于AD(E)使用牙钻四个削减,指示的顺序,取出一块长方形的骨(蓝色),露出前方和后方exterolateral的原子核(ELA和ELP,分别)。 点击这里查看大图 。
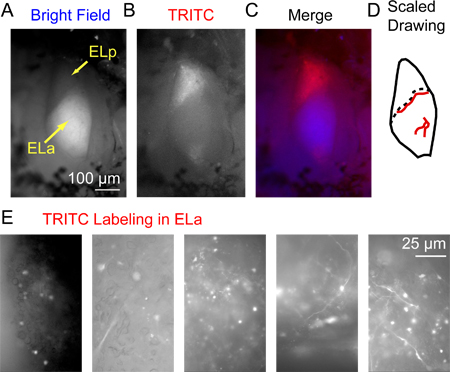
图3。 3小时后注射葡聚糖共轭的Alexa Fluor 568(A)的前部和后部exterolateral核(ELA和ELP),分别从上述可视化与明视场照明后exterolateral核的荧光标记 。注意ELA广泛的髓鞘内给它一个相对明亮的外观区别于ELP(B)相同的区域可视化使用萤光通过TRITC过滤器查看(C)合并后的图像使用蓝色(明场)和红色为B (TRITC)(D)例ELA和ELP的比例绘图,包括大血管(红色线),可作为地标标识的确切位置,只有在高倍率下可见标记的轴突(血管的确切位置从鱼到鱼)。虚线表示之间的边界ELA和ELP(E)样品采集的图像使用TRITC滤波器的5种不同的制剂,小细胞轴突和胞体的ELA出了一系列成功的标签图案。
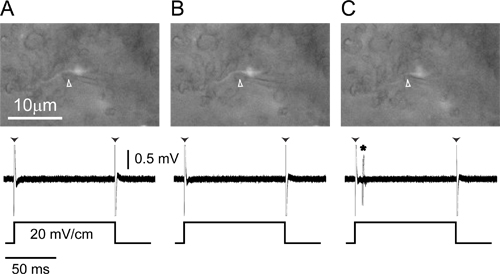
图4。单单元外记录从标记的轴突(A)记录电极(箭头)正压下放在相邻的标记小细胞轴突的ELA(顶)在100毫秒20毫伏/厘米的单相,只记录边缘神器的(箭头主管)对侧阳性的,横向的方波脉冲(底部)。(B)的释放,从电极向外的压力(箭头)会导致轴突移动至略微向电极(顶部),但仍存在的刺激没有反应(底部)( C)轻微负压拉轴突电极(顶部,箭头头)和动作电位响应刺激发病到现在可见的(底部,星号)。所有三种面板的底部覆盖20次重复刺激的反应。
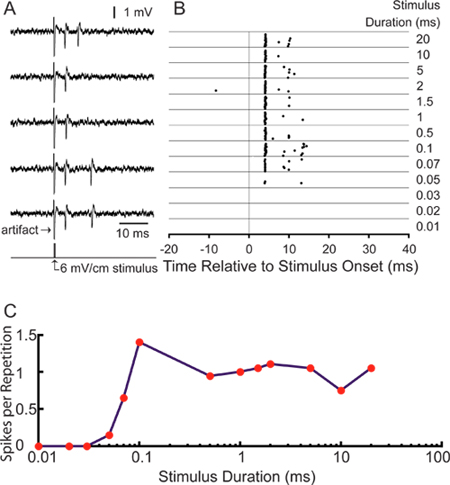
图5。代表性的成果使用这种技术。(A)5个样本的痕迹对侧阳性,横向方波脉冲的刺激。示出由0.1毫秒6毫伏/厘米单相诱发的动作电位,(B)示出穗75毫秒的记录窗口的20次重复相同的单位时间内的栅格图在时间0时的刺激6毫伏/厘米刺激持续时间列在右边的范围(C)量化的响应时间调谐曲线显示在光栅刺激重复穗数。
| 质量(g) | 货叉长度(cm) | 身体深度(厘米) | |
| 意味着 | 2.42 | 6.20 | 1.14 |
| 标准偏差 | 0.64 | 0.52 | 0.18 |
| 范围 | 1.2-4.0 | 5.5-8.4 | 0.9-1.6 |
表1中。最佳鱼的重量,长度和身体深度范围优化重量,货叉长度(吻尖,尾鳍叉)和身体深度(最大背腹在横向平面的距离)范围,让鱼适应在录音室所示图1。鱼太小,可能是不太可能生存了手术,将有一个小的ELP,使染料安置具有挑战性。鱼太大,将有一个大的,过深远的小脑,这将减少ELA和ELP的访问,并可能防止降低高功率,水浸泡的目的ELA和ELP专注于足够接近。
| 现场报名 | 染料类型 | 鱼试图 | ELA标签 | 在ELP标签 | 试图单位 | 录音 |
| EL一 | 的Alexa Fluor注射液 | 32 | 26(81.2%) | 19(59.4%) | 50 | 4(8.0%) |
| ELA | Alexa荧光浸泡滤纸 | 1 | 0 | 0 | 0 | 0 |
| ELA | 狄-I在DMSO中 | 8 | 6(75.0%) | 0 | 0 | 0 |
| ELA | 二-O晶体 | 5 | 3(60.0%) | 2(40.0%) | 9 | 0 |
| ELP | 固体的Alexa Fluor晶体 | 2 | 0 | 2(100%) | 0 | 0 |
| ELP | 的Alexa Fluor涂层钨丝 | 43 | 的29(67.4%) | 41(95.3%) | 119 | 26(21.8%) |
表2中。每个染料注射方法的成功率。每个染料注射方法的成功率。方法被划分的基础上,注射部位和染料型。对于每种方法,鱼的总数试图ELA和ELP的成功标记导致这些实验的百分比显示。需要注意的是有针对性的记录区域是申请地点对面的(粗体箱)。对于注射部位,染料吸收被认为是成功的胞体和轴突标签。与此相反,在录制现场,只准备与标记的轴突被算作成功的标记实验。也示企图单位,这些单位的百分比的总数,导致成功的录音。
| #注射SITES | 平均每次注射量(微升) | 每次注射量范围(微升) | 平均总注射量(微升) | 总注入量范围(微升) | |
| 汉密尔顿微量 | 3或4个 | 0.144 | 0.091 - 0.91 | 0.516 | 0.378 - 0.669 |
| 与玻璃吸管Nanoinjector | 2 - 4 | 0.069(固定) | 定货量注射1-6倍 | 0.621 | 0.414 - 0.966 |
| 微量玻璃吸管 | 2 - 6 | 0.093 | 0.058 - 0.202 | 0.360 | 0.252 - 0.540 |
表3中。用于注入铝的三种方法应用的染料的数量时的例子Fluor Alexa荧光用来注入到从表2中的第一种方法(ELA)的三种方法适用于染料成ELA量。染料注入ELA既是nanoinjector和微量使用33号汉密尔顿注射器针头或拉玻璃毛细吸管。不同的注射部位,每次注射的体积和染料注射的总体积数。
讨论
一旦掌握了这种技术将允许一个目标确定神经元在体内录音在许多模型系统中,包括个人的轴突,。此外,这种技术允许一个可靠地记录神经元具有独特的解剖特点,使体内的记录方法挑战传统的尖峰输出。我们已经利用这种技术来记录从ELA“小细胞”在mormyrid弱电鱼。上一页“小细胞”研究调整属性的尝试是不成功的,由于具有挑战性的拍摄条件11,14。类似的解剖特点,创建获得许多不同脊椎动物听觉和electrosensory的的神经元的8-10的单机录音的障碍。为了克服这些挑战,在我们的系统中,我们利用了事实,即“小细胞”是唯一细胞的ELA项目ELP。因此,逆行运输染料放置在ELP限制“小标签的ELA荧光标记细胞的胞体和轴突。轴突允许精确的电极放置标记轴突旁边,尽管单机录音确定的细胞可能难以接近的胞体。我们试图躯体录音,但均告失败,可能是由于周围吞没突触11 17。然而,体细胞标记清晰可见,这种技术可用于目标体在其他类型的细胞和其他电路的录音,荧光标记的神经元通过在体内的逆行运输已被用于指导有针对性的录音体外 19-21类似的技术用于针对22在斑马鱼脊髓的运动神经元在体内的录音,我们的工作代表了一种新的扩展,这种方法,这两个标签和录音都是在大脑内的体内 ,我们的方法表明, 在体内标签中枢神经系统领域逆行吨赛车手可扩展到其他完好的电路类似的选择性投射神经元的研究。在哺乳动物的听觉处理,例如,下丘(IC)作为一个重要的中继中心多个rhombencephalic结构体23的输入。染料注射到IC选择地将标签从每个这些晶核的投影单元。上丘(SC)提供了类似的功能,视觉24。脊髓制剂特别适合于这种技术,脊髓是很容易访问,可能会发生染料注射远离记录地点,并且可以结合细胞内记录和填充选择的神经元,以获得更详细的解剖信息25。最后,道追踪是一个完善的技术,整个中枢神经系统的映射复杂电路26。我们的方法可以利用功能信息添加到这些研究中,因为已经做了瓦特第i个钙离子敏感的指标在猫视皮层27。
手术,这是公认的,可靠的,经常使用的盲体内录音16,必须以最小的出血和无损伤的大脑,让动物生存的组织的表面完成。通过实践,手术和染料的应用程序可以在30-45分钟内完成。我们成功地标记为“小细胞”轴突在67%的准备。大多数准备只有1或2可见标记的轴突,但有些多达8。的119个标有单位尝试,我们获得了来自26个单位,分布在12个制剂( 表2)单机录音。因此,数据收集从筹备标记轴突的整体成功率28%41%。
染料应用的关键环节,标签的深度。浅钨丝插入将导致水洗一个W的染料唉。但是,如果渗透太深,标记轴突将不可见的目标。另外,一些机械损伤的细胞必须晚升25,28,以得到适当的染料。然而,过多的伤害会杀死细胞。我们试图与其他染料等的方法( 表2),包括顺行示踪染料注射到ELA与记录标记轴突ELP( 表3)配对标记。我们推测,顺标签并不成功,因为标签仅限于细胞与躯体伤害,使他们反应迟钝。此外,突触前终端可能已经不安。与此相反,逆行标记最大限度地减少了这些问题。染料的应用程序的数量和位置,可以进行修改,根据正在研究中的特定的电路。发生极大的标签以最大的染料浓度,这是我们实现的涂层的钨丝。然而,标签轴突与去EP预测,染料可能会掉下来的,因为它是先进的钨针。在这些情况下,压喷射更合适。染料的吸收和运输快速,可见早在注射后2小时和额外的标记轴突迟注射后6小时出现在我们准备与标记的轴突。因此,标签和记录可以在一天内完成,消除技术上的困难与生存手术。时间将有所不同取决于染料运输所需的距离为每个应用程序。
另一个重要方面是放置电极。重要的是要输入标记的轴突的前端,以防止堵塞的部位的组织接近。如ELA组织致密,长,细柄上的记录电极周围组织最大限度地减少多余的运动。如果没有达到一个成功的记录上的第一次尝试,重复用新鲜的电极,直到获得记录或TISSUE的破坏轴突在该点不再可见。然而,这也是很重要,迅速 放置的电极旁边的轴突荧光照射,可引起光毒性,漂白,以尽量减少,并可能影响细胞的生理特性29-31。
一旦成功地吸入到记录电极段轴突,录音可以通过以下方式获得了好几个小时。如果单位一直迷失在不到1个小时,考虑较小的电极提示,以防止轴突滑出。另一方面,过小的尖端可能会导致堵塞,低信号噪声或轴突的损害。一个稳定的下降,在尖峰幅度和'回报'的单位提供额外的吸力是一个迹象表明,小费是太大。吸太多,可能会造成不可挽回的损失的轴突。一种解决方案是允许轻微的泄漏,空气中的行,所以压力慢慢地返回到零。快速均衡日E压力会导致一个短暂的相对向外“推”可能驱逐轴突的。
虽然这种技术代表获得定位的录音从确定的投射神经元的一个重要的优势,将是有用的用于区分本地中间,作为染料,将采取由所有类型的细胞在注射部位。从理论上讲,使用与单独的注射部位的多个荧光团可允许此方法来扩大。例如,单轴与双标记的比较,可以用来区分在电路32中的两个点的双注射之后从投射神经元的interneurons。同样,逆行的示踪剂可以结合其他先进的成像技术,如双光子成像,最近做了斑胸草雀高级发声中枢(HVC)32。另外,记录区被限制使用落射荧光显微镜的表面附近,因为我们只能够解决1&万亩;米在第一个30微米的组织结构。但是,这个深度可以扩展通过使用其他光学技术,如双光子显微镜的33或客观耦合的面状照明显微镜34。总体上,这种技术代表在体内的神经回路的研究中的一个重要的进步,因为它可以用来从单一神经元的许多不同电路中的各种模型系统-包括那些相对无法记录。
披露声明
没有利益冲突的声明。
致谢
资金由美国国家科学基金会(IOS-1050701 BAC),美国国立卫生研究院(NS54174 SM和F30DC0111907的AML-W),上原纪念基金会和日本社会提供科学促进(G2205 TK )。我们感谢他的支持和指导的话题外轴索录音朱利安·米克斯。我们感谢卡尔·霍普金斯大学的提供原型录音室。
材料
| Name | Company | Catalog Number | Comments |
| Tricaine Methanesulfonate | Sigma-Aldrich | E10521 | MS-222 |
| Gallamine Triethiodide | Sigma-Aldrich | G8134 | Flaxedil |
| Lidocaine Hydrochloride | Sigma-Aldrich | L5647 | |
| Hickman’s Ringer Solution | NA | NA | NaCl (6.48 g/l), KCl (0.15 g/l), CaCl2•2H20 (0.29 g/l), MgSO4 (0.12 g/l), NaHCO3 (0.084 g/l), NaH2PO4 (0.06 g/l) |
| Peristaltic Pump | Gilson or Rainin | Minipulse 3 Model 312; RP-1 | 10.0 ± 1.0 rpm, Alternatively, a gravity-fed line with a flow-meter |
| Dissection Microscope | Nikon | SM2645 | |
| Super Glue | Super Glue Corporation | SGH2 | 2g tube |
| Omni Drill 35 | World Precision Instruments | 503-598 | |
| Ball Mill Carbide Drill Bit #1/4 | World Precision Instruments | 501860 | 0.19 DIA (bit diameter = 0.48 mm) |
| Low Temp Cautery Kit | World Precision Instruments | 500391 | |
| Manual Micromanipulator | World Precision Instruments | M3301R | |
| Dextran Conjugated Alexa Fluor 568 | Invitrogen | D-22912 | 2mM concentration; 10,000MW The choice of dye wavelength should be selected to match the microscope filter settings |
| Epifluorescent Microscope | Nikon | E600 FN | A remote focus accessory is helpful for fine focus TRITC filter - or appropriate filter to match focal planes for different dye wavelengths |
| Low Power Objective | Nikon | 93182 | CFI Plan Achromat Series, 4X N.A. 0.1, W.D. 30mm |
| High Power Objective | Nikon | 93148 | CFI Fluor Series, 40X WI N.A. 0.8, W.D. 2.0 mm |
| White Light Source | Dolan-Jenner | Model 190 | Fiber Optic Illuminator |
| Fluorescent Light Source | Lumen Dynamics | X-Cite 120Q | |
| Low-light Level Camera | Photometrics | CoolSnap ES | |
| Digital Manometer | Omega Engineering | HHP-201 | |
| Motorized Micromanipulator | Sutter Instruments | MP-285 | |
| Headstage | Molecular Devices | CV-7B | Axon Instruments |
| Amplifier | Molecular Devices | MultiClamp 700B | Axon Instruments |
| Data Acquisition System | Molecular Devices | Digidata 1322A | Axon Instruments |
| Isolated Pulse Stimulator | A-M Systems | 2100 | |
| Flaming/Brown Micropipette Puller | Sutter Instruments | P-97 | Program settings for our application: Heat: ramp + 1, Pull: ’0’, Velocity: 60, Time: 90 Box filament |
| Pipette Glass | World Precision Instruments | 1B100F-4 | Borosilicate capillary glass with filament (1 mm OD, 0.58 mm ID) |
参考文献
- Meeks, J. P., Jiang, X., Mennerick, S. Action potential fidelity during normal and epileptiform activity in paired soma-axon recordings from rat hippocampus. J. Physiol. 566, 425-441 (2005).
- Pinault, D. A novel single-cell staining procedure performed in vivo under electrophysiological control: morpho-functional features of juxtacellularly labeled thalamic cells and other central neurons with biocytin or Neurobiotin. J. Neurosci. Methods. 65, 113-136 (1996).
- Joshi, S., Hawken, M. J. Loose-patch-juxtacellular recording in vivo--a method for functional characterization and labeling of neurons in macaque V1. J. Neurosci. Methods. 156, 37-49 (2006).
- Margrie, T. W. Targeted whole-cell recordings in the mammalian brain in vivo. Neuron. 39, 911-918 (2003).
- Lima, S. Q., Hromádka, T., Znamenskiy, P., Zador, A. M. PINP: A new method of tagging neuronal populations for identification during in vivo electrophysiological recording. PLoS One. 4, e6099 (2009).
- Foust, A., Popovic, M., Zecevic, D., McCormick, D. A. Action potentials initiate in the axon initial segment and propagate through axon collaterals reliably in cerebellar Purkinje neurons. J. Neurosci. 30, 6891-6902 (2010).
- Lehman, M. N. Herpes simplex virus as a transneuronal tracer. Neurosci. Biobehav. Rev. 22, 695-708 (1998).
- Joris, P. X. A dogged pursuit of coincidence. J. Neurophysiol. 96, 969-972 (2006).
- Heiligenberg, W., Rose, G. Phase and amplitude computations in the midbrain of an electric fish: Intracellular studies of neurons participating in the jamming avoidance response of Eigenmannia. J. Neurosci. 5, 515-531 (1985).
- Morales, E. Releasing the peri-neuronal net to patch-clamp neurons in adult CNS. Pflügers Archiv European J. Physiol. 448, 248-258 (2004).
- Friedman, M. A., Hopkins, C. D. Neural substrates for species recognition in the time-coding electrosensory pathway of mormyrid electric fish. J. Neurosci. 18, 1171-1185 (1998).
- Hitschfeld, &. #. 2. 0. 1. ;. M., Stamper, S. A., Vonderschen, K., Fortune, E. S., Chacron, M. J. Effects of restraint and immobilization on electrosensory behaviors of weakly electric fish. ILAR. J. 50, 361-372 (2009).
- Xu-Friedman, M. A., Hopkins, C. D. Central mechanisms of temporal analysis in the knollenorgan pathway of mormyrid electric fish. J. Exp. Biol. 202, 1311-1318 (1999).
- Amagai, S., Friedman, M. A., Hopkins, C. D. Time coding in the midbrain of mormyrid electric fish. I. Physiology and anatomy of cells in the nucleus exterolateralis pars anterior. J. Comp. Physiol. A: Neuroethol Sens Neural. Behav. Physiol. 182, 115-130 (1998).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull World Health Organ. 2, 143-144 (1965).
- Carlson, B. A. Temporal-pattern recognition by single neurons in a sensory pathway devoted to social communication behavior. J. Neurosci. 29, 9417-9428 (2009).
- Mugnaini, E., Maler, L. Cytology and immunocytochemistry of the nucleus extrolateralis anterior of the mormyrid brain: possible role of GABAergic synapses in temporal analysis. Anat Embryol. (Berl). 176, 313-336 (1987).
- Kohashi, T., Lyons-Warren, A. M., Mennerick, S., Carlson, B. A. Detection of submillisecond spike timing differences based on delay-line anticoincidence detection. J. Neurophysiol. 110, 2295-2311 (2013).
- Colin, W., Donoff, R. B., Foote, W. E. Fluorescent latex microspheres as a retrograde tracer in the peripheral nervous system. Brain Res. 486, 334-339 (1989).
- Katz, L. C., Burkhalter, A., Dreyer, W. J. Fluorescent latex microspheres as a retrograde neuronal marker for in vivo and in vitro studies of visual cortex. Nature. 310, 498-500 (1984).
- Brown, S. P., Hestrin, S. Intracortical circuits of pyramidal neurons reflect their long-range axonal targets. Nature. 457, 1133-1136 (2009).
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J. Neurosci. Methods. 88, 1-13 (1999).
- Pollak, G. D., Burger, R. M., Klug, A. Dissecting the circuitry of the auditory system. Trends Neurosci. 26, 33-39 (2003).
- Wurtz, R. H., Albano, J. E. Visual-motor function of the primate superior colliculus. Annu. Rev. Neurosci. 3, 189-226 (1980).
- O'Malley, D. M., Zhou, Q., Gahtan, E. Probing neural circuits in the zebrafish: a suite of optical techniques. Methods. 30, 49-63 (2003).
- Vercelli, A., Repici, M., Garbossa, D., Grimaldi, A. Recent techniques for tracing pathways in the central nervous system of developing and adult mammals. Brain Res. Bull. 51, 11-28 (2000).
- Ohki, K., Chung, S., Ch'ng, Y. H., Kara, P., Reid, R. C. Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex. Nature. 433, 597-603 (2005).
- Gahtan, E., O'Malley, D. M. Rapid lesioning of large numbers of identified vertebrate neurons: applications in zebrafish. J. Neurosci. Methods. 108, 97-110 (2001).
- Higure, Y., Katayama, Y., Takeuchi, K., Ohtubo, Y., Yoshii, K. Lucifer Yellow slows voltage-gated Na+ current inactivation in a light-dependent manner in mice. J. Physiol. 550, 159-167 (2003).
- Mennerick, S. Diverse voltage-sensitive dyes modulate GABAA receptor function. J. Neurosc. 30, 2871-2879 (2010).
- Oxford, G. S., Pooler, J. P., Narahashi, T. Internal and external application of photodynamic sensitizers on squid giant axons. J. Membr. Biol. 36, 159-173 (1977).
- Roberts, T. F., Tschida, K. A., Klein, M. E., Mooney, R. Rapid spine stabilization and synaptic enhancement at the onset of behavioural learning. Nature. 463, 948-952 (2010).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。