Method Article
Marquage fluorescent rétrograde Permet ciblée extracellulaire seule unité d'enregistrement de neurones identifiés
Dans cet article
Résumé
Transport rétrograde de colorant fluorescent marque une sous-population de neurones en fonction de projection anatomique. Axones marqués peuvent être ciblés visuellement In vivo, Permettant l'enregistrement extracellulaire axones identifiés. Cette technique facilite l'enregistrement lorsque les neurones ne peuvent pas être étiquetés par manipulation génétique ou sont difficiles à isoler en utilisant «aveugle» In vivo Approches.
Résumé
L'objectif global de cette méthode consiste à enregistrer les réponses-ensemble d'une population identifiée de neurones. Dans enregistrements électrophysiologiques in vivo des neurones individuels sont essentielles pour comprendre comment les circuits neuronaux fonctionnent dans des conditions naturelles. Traditionnellement, ces enregistrements ont été effectués «en aveugle», ce qui signifie l'identité de la cellule enregistrée est inconnu au début de l'enregistrement. Identité cellulaire peut être déterminé par la suite via intracellulaire 1, 2 ou juxtacellulaire lâche-patch 3 iontophorèse de colorant, mais ces enregistrements ne peut pas être pré-destiné aux neurones spécifiques dans les régions où les types de cellules fonctionnellement hétérogènes. Les protéines fluorescentes peuvent être exprimés de manière spécifique du type cellulaire permettant visuellement guidé par électrophysiologie unicellulaire 4-6. Cependant, il ya beaucoup de systèmes modèles pour lesquels ces outils génétiques ne sont pas disponibles. Même dans des systèmes modèles génétiquement accessibles, le désiré propromoteur peut être inconnu ou neurones génétiquement homogènes peut avoir différents modèles de projection. De même, les vecteurs viraux ont été utilisés pour étiqueter les sous-groupes spécifiques de neurones de projection 7, mais l'utilisation de cette méthode est limitée par la toxicité et le manque de spécificité trans-synaptique. Ainsi, les techniques supplémentaires qui offrent des pré-visualisation spécifique pour enregistrer des neurones individuels identifiés in vivo sont nécessaires. Pré-visualisation du neurone cible est particulièrement utile pour des conditions d'enregistrement difficiles, pour lesquels les enregistrements mono-cellulaires classiques sont souvent excessivement difficile 8-11. La nouvelle technique décrite dans cet article utilise le transport rétrograde d'un colorant fluorescent appliqué en utilisant des aiguilles de tungstène pour étiqueter rapidement et sélectivement un sous-ensemble spécifique de cellules dans une région particulière du cerveau en fonction de leurs projections axonales uniques, offrant ainsi un repère visuel pour obtenir des enregistrements électrophysiologiques ciblées à partir de neurones identifiés dans un circuit intact withina vertébré CNS.
Le roman progrès le plus significatif de notre méthode est l'utilisation d'un marquage fluorescent pour cibler des cellules spécifiques dans un système de modèle accessible non génétiquement. Poissons faiblement électriques sont un excellent modèle pour l'étude des circuits neuronaux en éveil, se comportant 12 animaux. Nous avons utilisé cette technique pour étudier le traitement sensoriel par des «petites cellules» dans le noyau exterolateral antérieure (ELA) de poissons mormyrid faiblement électrique. «Les petites cellules" sont suppose être temps neurones de comparaison importants pour détecter des différences milliseconde dans les temps d'arrivée des pointes présynaptiques 13. Cependant, les caractéristiques anatomiques telles que la myéline dense, engloutissant synapses et les organismes à petites cellules ont rendu extrêmement difficile d'enregistrer à partir de ces cellules en utilisant des méthodes traditionnelles 11, 14. Nous démontrons ici que notre méthode de nouveaux marqueurs de manière sélective ces cellules dans 28% des préparations, permettant des enregistrements, fiables et robustes et caracrisation des réponses à la stimulation électrosensoriel.
Protocole
1. Préparer Aiguilles Dye revêtus
- Électrolytique aiguiser un diamètre de 15 um fil de tungstène 160. Diamètres de pointe de l'aiguille finale doit être comprise de 5 à 50 um. Le nombre d'aiguilles nécessaires dépend de la taille de la région étant marqué. Nous avons préparé 5 aiguilles pour injections 3-5 dans le noyau exterolateral postérieure (PEL).
- La nuit avant l'expérience, déposer une goutte (<0,25 pi) de 2 mM Fluor colorant dextran conjugué Alexa 10.000 MW sur la partie distale 100 um de chaque aiguille.
- Laisser les aiguilles à l'air sec à température ambiante, en laissant colorant concentré à l'extrémité. Stocker les aiguilles à 4 ° C dans un récipient foncé pour les protéger de la lumière.
2. Préparer des animaux pour la chirurgie
- Induire une anesthésie générale en plaçant le poisson dans une solution de 300 mg / L de MS-222 dans de l'eau du réservoir.
- Peser la longueur de la fourche poisson et mesure (pointe du museau à la fourche de la nageoire caudale) et la profondeur de corps (maximal dorso-Ventral la distance dans le plan transversal). Ces mesures doivent se situer dans les fourchettes indiquées dans le tableau 1 de sorte que le poisson s'adapte à l'intérieur d'une chambre d'enregistrement assez petit pour passer sous un objectif de microscope immersion dans l'eau (Figure 1).
- Immobiliser et faire taire électriquement le poisson en injectant 100 pi de 3 mg / ml flaxedil dans la musculature dorsale du corps.
- Remplir la chambre d'enregistrement (figure 1A) avec de l'eau du réservoir. Placer le poisson ventrale vers le bas sur la plate-forme au centre de la chambre (figure 1). Fournir une solution aérée de 100 mg / L de MS-222 en utilisant un embout de pipette placée dans la bouche du poisson (1-2 ml / min). Stabiliser le poisson avec des tiges fixées à la cire placée sur les deux côtés du corps (figure 1C). Surveiller la santé du poisson en contrôlant le flux sanguin continu dans les vaisseaux oculaires et une couleur normale du corps.
- Tournez la plate-forme le long de son axe et abaisser l'extrémité arrière de la platfORM de telle sorte que d'un côté de la face dorsale de la tête du poisson est exposé au-dessus de l'eau tandis que le reste du corps du poisson reste immergé. Un petit morceau de Kimwipe doit être placé sur la partie non immergée de la peau pour éviter le dessèchement.
3. Chirurgie (Figure 2)
La procédure chirurgicale de base décrite ici est bien établie et fiable utilisé pour aveugles enregistrements in vivo dans mormyridés 16. Pour d'autres applications, d'exposer les régions souhaitées pour l'étiquetage et l'enregistrement. La région contenant terminaisons axonales des cellules d'intérêt doit être accessible par une aiguille de colorant revêtu. La région contenant des segments plus proximales de ces mêmes axones doit disposer d'un espace suffisant au-dessus du tissu pour s'adapter à la distance de travail de la lentille à immersion dans l'eau (2 mm dans notre cas).
- Appliquer une solution à 0,4% de lidocaïne à la surface exposée de la tête à l'aide d'un coton-tige.
- Utilisation d'une lame de scalpel, couper le périmètre d'une pièce rectangulaire de la peau. Retirez le rectangle à l'aide d'une paire de pinces. La taille du rectangle échelle avec la taille du poisson, mais devrait être d'environ 3 mm x 5 mm pour un poisson de 6,2 cm (figure 2A). Le bord latéral du rectangle doit être aligné avec le centre de l'oeil, le bord antérieur du rectangle doit être juste en arrière de l'oeil, et le bord médial du rectangle doit être juste latérale de la ligne médiane du poisson.
- Étendre la région de crâne exposé anteromedially d'exposer une somme additionnelle de 2,5 mm de la zone non-cumul carré (figure 2B).
- Tout à fait claire et sécher la surface exposée du crâne à l'aide de la lame d'un scalpel pour gratter les tissus et Kimwipes excès et air pulsé pour sécher la surface (figure 2C).
- Collez un poteau de métal de la région du crâne exposé antéro utilisant Super Glue. Attendez jusqu'à ce que la colle soit complètement sèche (figure 2D).
- Supprimer un rectangle de crâne, d'environ 2 mm x 4 mm pour un poisson de 6,2 cm. Utilisation d'une fraise de dentiste avec un diamètre de la bille du palpeur ~ 0,5 mm moulin carbure pour fluidifier le périmètre du rectangle. Puis, à l'aide d'un scalpel et la pince, couper le périmètre du rectangle et peler pour exposer le cerveau sous-jacent. Des forages supplémentaires ou couper avec de petits ciseaux peuvent être nécessaires pour exposer pleinement EL (figure 2E). Si le saignement musculaire se produit, une électrocoagulation peut être utilisé.
- Coupez la fois la dure-mère (pigmentée) et la pie-mère (clair) à l'aide des ciseaux à ressort ou une aiguille et enlevez les parties découpées avec une paire de pinces. Les parties antérieure et postérieure du noyau exterolateral (EL) sont maintenant visibles, ELA et ELP, respectivement (figure 3A).
4. Marquage rétrograde des axones d'intérêt
- Positionner un manipulateur avec une aiguille revêtue de colorant (faite à l'étape 1) ci-dessus de la région cible contenant des axones des interest, dans notre cas PEL.
- Rapidement insérer l'aiguille d'environ 25 um dans le tissu. Attendez 15-30 secondes, jusqu'à ce que le colorant est venu hors tension, puis retirer l'aiguille.
- Répéter avec des aiguilles frais supplémentaires que nécessaire, placer chacun dans un lieu différent de sorte que le colorant est répartie dans l'ensemble de la région cible. Nous avons utilisé 3-5 aiguilles par préparation.
- Rincer le colorant en excès de la cavité avec la solution de la sonnerie de Hickman.
- Attendez au moins 2 heures pour la montée du colorant et du transport.
5. Visualisation des axones d'intérêt
- Placer la chambre d'enregistrement, avec le poisson, sous l'objectif d'un microscope à épifluorescence en position verticale, fixe par étape. Comme le corps du poisson obture pénétration de la lumière, des sources de lumière à la fois blanches et fluorescentes doivent provenir ci-dessus. Mise en place soignée d'une source lumineuse à fibre optique au-dessus de la cavité du crâne permet des images en fond clair satisfaisants. Pour la visualisation épifluorescence, filtre de fluorescencespécifications doivent correspondre au spectre d'absorption / d'émission du colorant.
- Commutateur respiration à l'eau du réservoir fraîche et maintenir le même débit. Placez un fil de masse dans la cavité du cerveau exposé et se connecter à la masse de la headstage d'enregistrement (voir 6.3).
- Placer une paire d'électrodes d'enregistrement à côté de la base de la queue et se connecter à un amplificateur différentiel et un dispositif d'enregistrement (par exemple moniteur audio, un oscilloscope ou un ordinateur) pour contrôler la commande de décharge de l'organe électrique (EODC). Une fois le poisson récupère de l'anesthésie, la EODC peut être utilisé comme un indicateur de l'état du poisson.
- Préparer un croquis à l'échelle de la région du cerveau vue à faible grossissement. Inclure les principaux vaisseaux sanguins comme points de repère (peut varier d'un poisson à l') pour identifier l'emplacement exact des axones marqués visibles seulement à fort grossissement (figure 3D).
- Confirmez placement colorant. Première Voir le tissu entier avec brightfield éclairage d'orientation ( Figure 3A). Puis voir avec un éclairage fluorescent (figure 3B). PEL aura étiquetage diffuse (figures 3B et 3C). Minimiser l'excitation de fluorescence à limiter les effets phototoxiques photodynamique et du colorant.
- Utilisez les vaisseaux comme points de repère pour localiser ELa sous fort grossissement. Éclairer avec une lumière fluorescente tout en recherchant un axone marqué près de la surface. (Figure 4).
6. Enregistrer l'activité extracellulaire
- Tirez électrodes d'enregistrement d'aspiration à l'aide de 1 mm de diamètre extérieur de 0,58 mm de diamètre capillaire en verre borosilicate avec filament. Taille idéale de pointe dépendra du diamètre des axones cible, qui dans notre cas est 0,1-0,2 um 17. Pour notre application, les diamètres de pointes d'électrodes étaient de 1,5 ± 0,4 um (fourchette: 1,0-2,4 um) avec un 5 mm de long, queue étroite, afin d'approcher les axones marqués sans bouger le tissu environnant dense.
- Remplissez electrodes avec filtre la solution de la sonnerie de Hickman. Résistance à la pointe finale est de 45,2 ± 38,0 MQ (fourchette: 16 à 155 MQ).
- Placer l'électrode dans un porte-électrode avec un orifice de pression et le connecter à un headstage d'amplificateur monté sur un manipulateur. Exécuter une ligne de pression de l'orifice de pression à une fin jonction en T dans un manomètre et d'une seringue pour surveiller et contrôler la pression, respectivement.
- Raccorder le headstage à un amplificateur et un dispositif d'acquisition analogique-numérique.
- Avec 30 mbar pression vers l'extérieur dans la ligne d'électrode, placer une électrode à côté d'un axone étiquetés. Une caméra de faible éclairage interfacé avec le logiciel d'imagerie permet de visualiser placement pipette. Commencez près de la surface du tissu et de faire progresser l'électrode vers l'axone. Comme vous vous approchez de l'axone, la pression vers l'extérieur devrait provoquer un mouvement légère, mais perceptible de l'axone.
- Alors que l'électrode est à côté de l'axone, (figure 4A, en haut) enregistrer le puissantial à l'électrode lors de la présentation des stimuli de test (dans notre cas, nous avons utilisé 100 ms impulsions transverses positifs et négatifs monophasique à une intensité de 20 mV / cm; figure 1A). Les potentiels d'action ne devraient pas être respectées, même si un artefact électrique confirme bon enregistrement / stimulation (figure 4A, en bas).
- Relâchez la pression vers l'extérieur dans l'électrode et répéter stimulation / enregistrement. Les potentiels d'action devraient pas encore être observées (figure 4B).
- Appliquer une légère (125 ± 25 mbars) d'aspiration à l'électrode de stimulation et / répétition d'enregistrement. Les potentiels d'action doivent désormais être observées en réponse à la stimulation (figure 4C). L'activité spontanée peut également se produire. Si les potentiels d'action ne sont pas respectées, libérer l'aspiration, désactivez l'électrode avec une légère pression, déplacer l'électrode légèrement, et l'aspiration de tenter à nouveau. Une fois les potentiels d'action sont visibles, près de la ligne de pression.
- Stimuler et enregistrer en tant quedésirée.
7. Cessation et mise au rebut
- Une fois que tous les enregistrements souhaités sont complets, passez à la respiration avec 100 mg / L MS-222 jusqu'à la EODC s'est arrêté. N EODC doit être détectée pendant au moins 10 minutes.
- Éliminer le poisson selon les directives institutionnelles et des protocoles de soins des animaux approuvés.
8. Les résultats représentatifs
Pour notre application, nous nous intéressons à l'étude de mesures de relance de codage par les neurones sensoriels centrales. Bons enregistrements à partir des axones marqués permettent l'analyse des réponses, une seule unité à la stimulation sensorielle 18. Figure 5A montre les potentiels d'action représentatifs évoqués par stimulation électrosensoriel transversal utilisant des électrodes bipolaires situées à l'intérieur des murs gauche et droit de la chambre d'enregistrement. Transitoire fois peuvent être présentées comme une trame parcelle pointe (figure 5B). A 25 msec pré-stimulus vent d'enregistrementow montre le faible niveau d'activité spontanée. Cette ELa particulier "à petites cellules" est long passer à l'écoute de la durée du stimulus à une intensité de relance de 6 mV / cm, ce qui augmente le nombre d'épis par répétition avec l'augmentation de la durée de stimulation (figure 5C). La moyenne premier pic de latence est 4,28 ± 0,16 ms, compatible avec la latence attendue pour les petites cellules sein d'ELA 11.
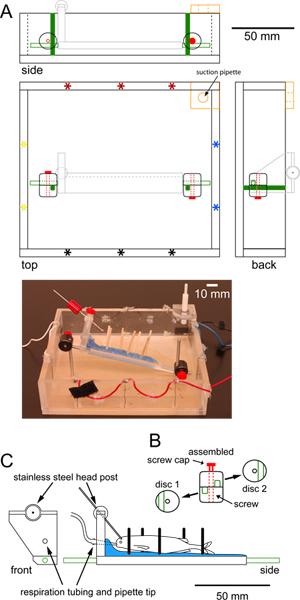
Figure 1. Spécifications pour une chambre d'enregistrement qui peuvent être glissés sous l'objectif d'un microscope epiflourescent fixe stade. (A) chambre d'enregistrement carré Pour échelle faite de plexiglas montrant des vues dessus, de côté et arrière. Ensembles paires d'électrodes de stimulation (astérisques) à la périphérie pour permettre soit transversal (rouge-noir) ou de stimulation longitudinal (bleu-jaune). Une pièce supplémentaire de plexiglas dans le coin, avec un trou garni de caoutchouc dans le centre (orange),détient une pipette d'aspiration qui maintient un niveau d'eau constant. Deux postes verticaux en acier inoxydable vissées dans le fond de la chambre (en vert) se connectent à des poteaux en acier inoxydable (contour vert) attachés à la plate-forme supportant le poisson (gris clair, détaillé dans C) via pinces de disques réglables. Une photographie de la chambre est indiqué ci-dessous le dessin à l'échelle. (B) vue individuel et l'assemblée des pinces de disques circulaires en plastique utilisés pour sécuriser la plate-forme pour les montants verticaux. Chaque pince de disque présente une rainure (vert) à un poste et un trou central pour la vis de serrage. pinces à disques sont mis en rotation de sorte que les rainures sont perpendiculaires l'une à l'autre. Serrage de la vis de serrage (rouge) les poteaux en place pour empêcher de nouveaux vertical et le mouvement de rotation de la plate-forme. (C) frontaux et latéraux vues à l'échelle de la plate-forme en plexiglas servant à maintenir en place le poisson. La plate-forme est recouverte d'une couche de cire de paraffine (bleu) qui maintient dowe boisls (barres noires) en place pour soutenir le poisson. Tuyau pour respirating le poisson passe à travers un trou dans la 'tête' de la plate-forme et se termine dans une pointe de pipette placée dans la bouche du poisson. Un poste de tête en acier inoxydable (barre grise) se connecte à la plate-forme par l'intermédiaire d'un joint à rotule permettant une rotation de 360 degrés. Inoxydable messages horizontales en acier (vert) sont vissées dans chaque extrémité de la plate-forme. Cliquez ici pour agrandir la figure .
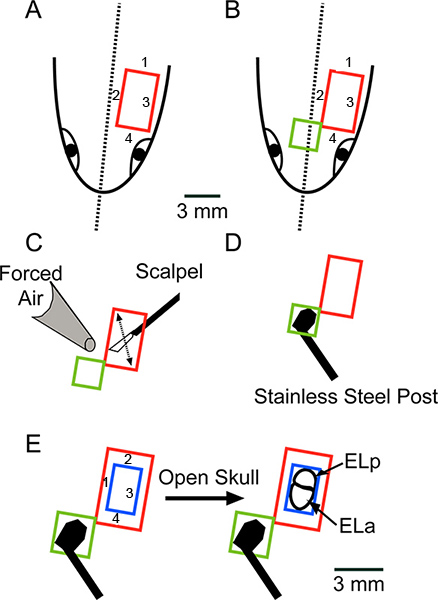
Figure 2. Vue d'ensemble schématique de la chirurgie regardant vers le bas sur la surface dorsale de la tête. (A) Faire quatre coupes, dans l'ordre indiqué, pour enlever une pièce rectangulaire de peau (rouge). (B) prolonger l'ouverture anteromedially pour supprimer une pièce rectangulaire supplémentaire de la peau (vert). (C) gratter toute la graisse ou des ligaments restants pardéplacement de la lame de scalpel, comme indiqué par la flèche et sécher complètement la surface avec Kimwipes et de l'air forcé. (D) Coller un poteau d'acier inoxydable de crâne à l'aide Super Glue. La barre d'échelle en A s'applique aux AD. (E) Utiliser une fraise de dentiste pour faire quatre coupes, dans l'ordre indiqué, pour enlever une pièce rectangulaire de l'os (bleu), exposant les noyaux exterolateral antérieure et postérieure (Ela et ELP, respectivement) . Cliquez ici pour agrandir la figure .
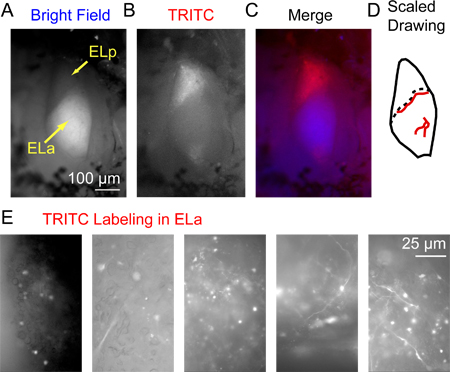
Figure 3. Le marquage fluorescent dans le noyau exterolateral postérieure 3 heures après l'injection de dextran conjugué Alexa Fluor 568. (A) Les noyaux exterolateral antérieure et postérieure (Ela et ELP, respectivement) visualisées avec éclairage de champ lumineux d'en haut. Remarqueque la vaste myélinisation dans les ELa lui donne un aspect relativement brillant qui le distingue des PEL. (B) La même zone visualisée en utilisant épifluorescence vu à travers un filtre TRITC. (C) une image fusionnée au bleu A (fond clair) et rouge pour B (TRITC). (D) Exemple d'un dessin à l'échelle d'ELA et du PEL dont les principaux vaisseaux sanguins (lignes rouges) qui peuvent être utilisés comme points de repère pour identifier l'emplacement exact des axones marqués visibles que sous fort grossissement (l'emplacement exact des vaisseaux sanguins varie d'un poisson à l'). La ligne en pointillés indique la frontière entre Ela et PEL. (E) Exemples d'images acquises à l'aide d'un filtre TRITC de 5 préparations différentes illustrant une gamme de modèles d'étiquetage succès des petits axones des cellules et SOMAS sein d'ELA.
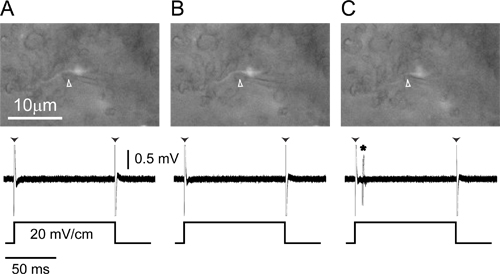
Figure 4. Unitaire enregistrement extracellulaired'un axone étiquetés. (A) électrode d'enregistrement (tête de flèche) sous une pression positive placé à côté d'un petit axone des cellules étiquetées sein d'ELA (en haut) enregistre seul artefact de bord (pointes de flèches) en réponse à un 100 msec 20 mV / cm monophasique, , impulsion carrée transversale controlatéral positif (en bas). (B) relâcher la pression vers l'extérieur à partir de l'électrode (tête de flèche) provoque l'axone se déplacer légèrement vers l'électrode (en haut), mais il n'y a toujours pas les réponses à la relance (en bas). ( C) La pression légèrement négative tire l'axone dans l'électrode (en haut, tête de flèche) et des potentiels d'action en réponse à l'apparition de relance sont maintenant visibles (en bas, astérisque). Toutes les parties inférieures des trois panneaux sont des réponses superposées à 20 répétitions de la relance.
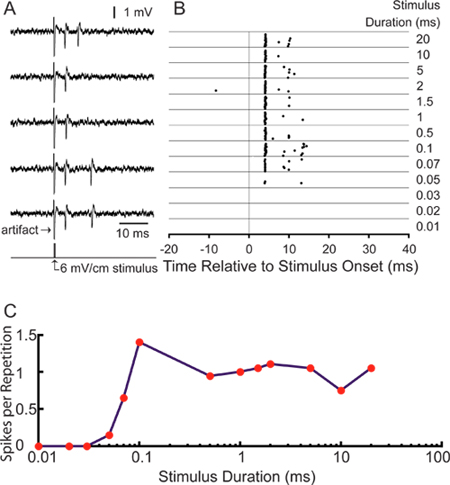
Figure 5. Les résultats représentatifs en utilisant cette technique. (A) 5 traces d'échantillonsmontrant des potentiels d'action évoqués par un 0.1 msec 6 mV / cm monophasique, stimulus d'impulsion carré transversal controlatéral positif. (B) Raster graphique montrant fois pic pendant 20 répétitions d'une fenêtre d'enregistrement de 75 ms pour la même unité stimulée au temps 0 à 6 stimuli mV / cm à la plage des durées figurant sur la droite. (C) courbe d'accord Durée quantifier les réponses affichées dans la trame de crampons par la répétition de relance.
| Masse (g) | longueur à la fourche (cm) | Profondeur du corps (cm) | |
| Signifier | 2,42 | 6.20 | 1.14 |
| L'écart-type | 0,64 | 0,52 | 0,18 |
| Range | 1,2 à 4,0 | 5.5 à 8.4 | 0.9-1.6 |
Tableau 1. Optimalpoids, la longueur et le corps gammes de profondeur pour les poissons. poids optimal, longueur de la fourche (pointe du museau à la fourche de la nageoire caudale) et le corps profondeur (maximum distance de dorso-ventral dans le plan transversal) varie permettant aux poissons de s'adapter dans la chambre d'enregistrement illustré dans Figure 1. Les poissons qui sont trop petits peut-être moins de chances de survivre à l'intervention chirurgicale et aura une petite PEL, ce qui rend difficile le placement colorant. Les poissons qui sont trop volumineux aura un grand cervelet, plus grande envergure qui permettra de réduire l'accès à Ela et PEL et peut empêcher l'abaissement de la puissance, l'objectif élevé immersion dans l'eau assez près pour se concentrer sur Ela et PEL.
| Site d'application | Type de colorant | Poisson tenté | Étiquette sein d'ELA | Étiquette PEL | Unités tenté | Enregistrements |
| ELune | Alexa Fluor injection | 32 | 26 (81,2%) | 19 (59,4%) | 50 | 4 (8,0%) |
| ELa | Alexa Fluor papier filtre imbibé | 1 | 0 | 0 | 0 | 0 |
| ELa | Di-I dans le DMSO | 8 | 6 (75,0%) | 0 | 0 | 0 |
| ELa | Di-O cristaux | 5 | 3 (60,0%) | 2 (40,0%) | 9 | 0 |
| PEL | Solide Alexa Fluor cristaux | 2 | 0 | 2 (100%) | 0 | 0 |
| PEL | Alexa Fluor les fils de tungstène enrobées | 43 | 29 (67,4%) | 41 (95,3%) | 119 | 26 (21,8%) |
Tableau 2. Le taux de réussite pour chaque méthode d'injection de colorant. des taux de réussite pour chaque méthode d'injection de colorant. Les méthodes sont répartis en fonction de site d'injection et le type de colorant. Pour chaque méthode, le nombre total de poissons tentée et le pourcentage de ces expériences qui ont abouti à l'étiquetage réussi à Ela et PEL est affiché. Notez que la zone d'enregistrement visé est l'opposé de la zone d'application (boîtes en caractères gras). Pour le site d'injection, absorption du colorant a été considéré comme un succès avec l'étiquetage des deux somas et des axones. En revanche, sur le site d'enregistrement, seules les préparations axones marqués ont été comptés comme des expériences réussies en matière d'étiquetage. Le nombre total de tentatives d'unités et le pourcentage de ces unités qui ont abouti à de bons enregistrements sont également représentées.
| # De si injectionTES | Volume moyen par injection (ul) | Gamme de volumes par injection (ul) | Le volume moyen d'injection totale (ul) | Gamme de volumes d'injection totale (ul) | |
| Microinjecteur avec Hamilton | 3 ou 4 | 0.144 | 0,091 à 0,91 | 0,516 | 0,378 à 0,669 |
| Nanoinjector avec pipette en verre | 2 - 4 | 0.069 (fixe) | Volume fixe injecté 1-6 fois | 0,621 | De 0,414 à 0,966 |
| Microinjecteur avec pipette en verre | 2-6 | 0.093 | 0,058 à 0,202 | 0.360 | 0,252 à 0,540 |
Tableau 3. Les quantités de colorant appliquées pour chacun des trois méthodes utilisées pour injecter AlEXA Fluor dans ELA quantités de colorant appliquées pour chacun des trois méthodes utilisées pour injecter Alexa Fluor dans ELa (première méthode du tableau 2). Injection de colorant dans ELa a été réalisée à la fois un nanoinjector et un micro-injecteur utilisant une jauge Hamilton aiguille de seringue 33 ou d'une pipette capillaire en verre tiré. Nous avons fait varier le nombre de sites d'injection, le volume par injection et le volume total de l'injection de colorant.
Discussion
Une fois maîtrisée, cette technique permettra de cibler une neurones identifiés, y compris les axones individuels, pour les enregistrements in vivo dans de nombreux systèmes modèles. En outre, cette technique permet d'enregistrer de manière fiable sortie pic de neurones présentant des caractéristiques anatomiques uniques qui font traditionnelle dans les méthodes d'enregistrement in vivo difficile. Nous avons utilisé cette technique pour enregistrer à partir d'ELA »petites cellules» dans mormyrid poissons faiblement électriques. Les tentatives précédentes pour étudier les propriétés de réglage de "petites cellules" ont échoué en raison des conditions d'enregistrement difficiles 11, 14. Caractéristiques anatomiques similaires créent des obstacles à l'obtention des enregistrements mono-unité d'un grand nombre de vertébrés auditif différent et les neurones électrosensoriel 8-10. Pour relever ces défis dans notre système, nous avons profité du fait que les "petites cellules" sont les seules cellules dans ELA projet de PEL. Ainsi, le transport rétrograde de colorant placé dans PEL limite étiquetage sein d'ELA pour "petit"soma et les axones cellulaires. Marquage fluorescent des axones ont permis le placement des électrodes précise à côté axones marqués, des enregistrements seule unité de cellules identifiées possibles malgré somas inaccessibles. Nous avons tenté enregistrements somatiques, mais sans succès, probablement due aux alentours synapses avalement 11 , 17. Cependant, somatique étiquetage était clairement visible ce qui suggère que cette technique pourrait être utilisée pour cibler les enregistrements somatiques dans d'autres types cellulaires et d'autres circuits. Marquage fluorescent des neurones par le transport rétrograde in vivo a été utilisé pour guider les enregistrements cibles in vitro 19-21 . Une technique similaire a été utilisée pour cible enregistrements in vivo des neurones moteurs chez le poisson zèbre moelle épinière 22. Notre travail représente une nouvelle extension de cette approche, dans laquelle les deux étiquetage et d'enregistrement sont réalisées in vivo dans le cerveau. Notre méthode démontre que in vivo l'étiquetage des zones du système nerveux central avec un rétrograde tcoureur peut être étendue à l'étude d'autres circuits intacts avec les neurones de projection similaire sélectifs. Par exemple, dans le traitement auditif des mammifères, le colliculus inférieur (IC) sert de centre de relais important pour les apports de multiples structures rhombencephalic 23. Injection de colorant dans le circuit intégré serait marquer sélectivement les cellules de projection de chacun de ces noyaux. Le colliculus supérieur (CS) a une fonction similaire à la vision 24. Les préparatifs de la moelle épinière sont particulièrement bien adaptés à cette technique, comme la moelle épinière est facilement accessible, injection de colorant peut se produire loin du site d'enregistrement, et il peut être combiné avec l'enregistrement intracellulaire et le remplissage de certains neurones d'acquérir des informations anatomiques détaillées 25. Enfin, des voies de traçage est une technique bien établie utilisée dans le système nerveux central pour cartographier circuits complexes 26. Notre méthode peut être utilisée pour ajouter des informations fonctionnelles à ces études comme cela a été fait avecindicateurs sensibles au calcium Ith cortex visuel du chat 27.
La chirurgie, qui est bien établi, fiable et régulièrement utilisé pour les aveugles in vivo des enregistrements 16, doit être complété par des saignements minimes et aucun dommage à la surface du cerveau pour permettre à l'animal et le tissu pour survivre. Avec la pratique, l'application de la chirurgie et de teinture peut être complété en 30-45 minutes. Nous avons étiqueté avec succès "à petites cellules" axones dans 67% des préparations. La plupart des préparations n'ont que de 1 ou 2 axones marqués visibles, mais certains en avoir autant que 8. Sur les 119 unités marquées tentatives, nous avons obtenu des enregistrements-ensemble de 26 logements répartis sur 12 préparations (tableau 2). Ainsi, les données ont été recueillies auprès de 41% des préparations à axones marqués pour un taux de réussite global de 28%.
L'aspect critique de l'application de teinture est l'étiquetage profondeur. Faible insertion du fil de tungstène se traduira, dans le colorant étant aw lavéay. Toutefois, si la pénétration est trop profonde, les axones marqués ne seront pas visibles pour le ciblage. En outre, certains dommages mécaniques à la cellule doit se produire pour que le colorant soit dûment pris en hausse de 25, 28. Cependant, trop de dégâts va tuer les cellules. Nous avons tenté d'étiquetage avec d'autres colorants et d'autres méthodes (tableau 2), y compris marquage antérograde par injection de colorant dans ELa jumelé avec l'enregistrement à partir des axones marqués dans PEL (tableau 3). Nous émettons l'hypothèse que l'étiquetage antérograde n'a pas réussi parce que l'étiquetage a été limitée aux cellules avec des dommages somatiques, ce qui les rend insensibles. En outre, les bornes de pré-synaptiques peuvent avoir été dérangé. En revanche, l'étiquetage rétrograde minimise ces deux préoccupations. La quantité et le lieu d'application de teinture peuvent être modifiés en fonction du circuit particulier à l'étude. Étiquetage maximale se produit avec la plus grande concentration de colorant, ce qui nous avons obtenu l'aide de fils de tungstène enrobées. Toutefois, pour l'étiquetage des axones avec dedes projections de PE, colorant peuvent se détacher de l'aiguille de tungstène comme il est avancé. Dans ces cas, l'injection sous pression serait plus approprié. Absorption de colorant et le transport sont rapides, avec des axones marqués dans notre préparation étant visible dès 2 heures après l'injection et les axones marqués supplémentaires apparaissant le plus tard 6 heures après l'injection. Ainsi, l'étiquetage et l'enregistrement peut être accompli en une seule journée, en éliminant les difficultés techniques liées à la chirurgie de survie. Timing variera pour chaque application en fonction de la distance nécessaire pour le transport colorant.
Un autre aspect essentiel est le placement des électrodes. Il est important pour entrer dans le tissu à proximité du site de l'axone marquée pour éviter le colmatage de la pointe. Pour les tissus denses tels que dans ELA une longue tige mince sur l'électrode d'enregistrement minimise l'excès mouvement du tissu environnant. Si un enregistrement réussi n'est pas atteint à la première tentative, répétée avec des électrodes frais jusqu'à ce que l'enregistrement soit obtenu ou la tissue est interrompu à l'endroit où l'axone n'est plus visible. Cependant, il est également important de placer rapidement l'électrode à côté de l'axone pour minimiser la quantité d'exposition fluorescent, ce qui peut provoquer la phototoxicité, le blanchiment et peuvent affecter les propriétés physiologiques de la cellule 29-31.
Une fois un segment de l'axone est aspiré avec succès dans l'électrode d'enregistrement, les enregistrements peuvent être obtenues pendant plusieurs heures. Si les unités sont toujours perdus en moins de 1 heure, envisager de faire des petites pointes d'électrodes pour empêcher l'axone de glisser. D'autre part, trop petit d'une pointe peut entraîner l'obstruction, à faible rapport signal-bruit, ou des dommages à l'axone. Une baisse constante pic d'amplitude et le «retour» d'une unité avec aspiration supplémentaire est une indication que la pointe est trop grand. Trop aspiration peut causer des dommages irréparables à l'axone. Une solution consiste à permettre à une fuite dans la conduite d'air de sorte que la pression revient lentement à zéro. Égaliser rapidement èmepression e se traduira par un parent-aller 'push' transitoire qui peut expulser l'axone.
Bien que cette technique représente un atout majeur pour obtenir des enregistrements ciblées de neurones de projection identifiés, il ne sera pas utile pour distinguer les interneurones locaux, comme colorant sera repris par tous les types de cellules au site d'injection. Théoriquement, l'utilisation de plusieurs fluorophores avec des sites d'injection séparés peut permettre que cette méthode soit élargi. Par exemple, la comparaison de simple et d'une double-étiquetage pourrait être utilisée pour distinguer les interneurones de neurones de projection suite à deux injections à deux points dans le circuit 32. De même, les traceurs rétrogrades peuvent être combinés avec d'autres techniques d'imagerie avancées, telles que l'imagerie à deux photons, comme l'a fait récemment en diamant mandarin Haute centre Vocal (HVc) 32. En outre, des régions d'enregistrement sont limités à ceux près de la surface lors de l'utilisation des microscopes à épifluorescence, car nous n'étions en mesure de résoudre 1 &mu, les structures de m dans les 30 premiers um de tissu. Toutefois, cette profondeur pourrait être étendu grâce à l'utilisation d'autres techniques de microscopie, telles que la microscopie à deux photons 33 ou objectif couplé microscopie d'éclairage planaire 34. Dans l'ensemble, cette technique représente un progrès important dans l'étude des circuits neuronaux in vivo, car il peut être utilisé pour enregistrer des neurones simples dans de nombreux circuits dans une variété de systèmes modèles - y compris ceux qui sont relativement inaccessibles.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Le financement fourni par la National Science Foundation (IOS-1050701 à BAC), le National Institutes of Health (NS54174 à la SM et F30DC0111907 à AML-W.), Le Uehara Memorial Foundation et la Société japonaise pour la promotion de la science (G2205 aux savoirs traditionnels ). Nous remercions Meeks Julian pour son soutien et des conseils sur le sujet des enregistrements axonales extracellulaires. Nous remercions Carl Hopkins pour fournir une chambre d'enregistrement de prototype.
matériels
| Name | Company | Catalog Number | Comments |
| Tricaine Methanesulfonate | Sigma-Aldrich | E10521 | MS-222 |
| Gallamine Triethiodide | Sigma-Aldrich | G8134 | Flaxedil |
| Lidocaine Hydrochloride | Sigma-Aldrich | L5647 | |
| Hickman’s Ringer Solution | NA | NA | NaCl (6.48 g/l), KCl (0.15 g/l), CaCl2•2H20 (0.29 g/l), MgSO4 (0.12 g/l), NaHCO3 (0.084 g/l), NaH2PO4 (0.06 g/l) |
| Peristaltic Pump | Gilson or Rainin | Minipulse 3 Model 312; RP-1 | 10.0 ± 1.0 rpm, Alternatively, a gravity-fed line with a flow-meter |
| Dissection Microscope | Nikon | SM2645 | |
| Super Glue | Super Glue Corporation | SGH2 | 2g tube |
| Omni Drill 35 | World Precision Instruments | 503-598 | |
| Ball Mill Carbide Drill Bit #1/4 | World Precision Instruments | 501860 | 0.19 DIA (bit diameter = 0.48 mm) |
| Low Temp Cautery Kit | World Precision Instruments | 500391 | |
| Manual Micromanipulator | World Precision Instruments | M3301R | |
| Dextran Conjugated Alexa Fluor 568 | Invitrogen | D-22912 | 2mM concentration; 10,000MW The choice of dye wavelength should be selected to match the microscope filter settings |
| Epifluorescent Microscope | Nikon | E600 FN | A remote focus accessory is helpful for fine focus TRITC filter - or appropriate filter to match focal planes for different dye wavelengths |
| Low Power Objective | Nikon | 93182 | CFI Plan Achromat Series, 4X N.A. 0.1, W.D. 30mm |
| High Power Objective | Nikon | 93148 | CFI Fluor Series, 40X WI N.A. 0.8, W.D. 2.0 mm |
| White Light Source | Dolan-Jenner | Model 190 | Fiber Optic Illuminator |
| Fluorescent Light Source | Lumen Dynamics | X-Cite 120Q | |
| Low-light Level Camera | Photometrics | CoolSnap ES | |
| Digital Manometer | Omega Engineering | HHP-201 | |
| Motorized Micromanipulator | Sutter Instruments | MP-285 | |
| Headstage | Molecular Devices | CV-7B | Axon Instruments |
| Amplifier | Molecular Devices | MultiClamp 700B | Axon Instruments |
| Data Acquisition System | Molecular Devices | Digidata 1322A | Axon Instruments |
| Isolated Pulse Stimulator | A-M Systems | 2100 | |
| Flaming/Brown Micropipette Puller | Sutter Instruments | P-97 | Program settings for our application: Heat: ramp + 1, Pull: ’0’, Velocity: 60, Time: 90 Box filament |
| Pipette Glass | World Precision Instruments | 1B100F-4 | Borosilicate capillary glass with filament (1 mm OD, 0.58 mm ID) |
Références
- Meeks, J. P., Jiang, X., Mennerick, S. Action potential fidelity during normal and epileptiform activity in paired soma-axon recordings from rat hippocampus. J. Physiol. 566, 425-441 (2005).
- Pinault, D. A novel single-cell staining procedure performed in vivo under electrophysiological control: morpho-functional features of juxtacellularly labeled thalamic cells and other central neurons with biocytin or Neurobiotin. J. Neurosci. Methods. 65, 113-136 (1996).
- Joshi, S., Hawken, M. J. Loose-patch-juxtacellular recording in vivo--a method for functional characterization and labeling of neurons in macaque V1. J. Neurosci. Methods. 156, 37-49 (2006).
- Margrie, T. W. Targeted whole-cell recordings in the mammalian brain in vivo. Neuron. 39, 911-918 (2003).
- Lima, S. Q., Hromádka, T., Znamenskiy, P., Zador, A. M. PINP: A new method of tagging neuronal populations for identification during in vivo electrophysiological recording. PLoS One. 4, e6099 (2009).
- Foust, A., Popovic, M., Zecevic, D., McCormick, D. A. Action potentials initiate in the axon initial segment and propagate through axon collaterals reliably in cerebellar Purkinje neurons. J. Neurosci. 30, 6891-6902 (2010).
- Lehman, M. N. Herpes simplex virus as a transneuronal tracer. Neurosci. Biobehav. Rev. 22, 695-708 (1998).
- Joris, P. X. A dogged pursuit of coincidence. J. Neurophysiol. 96, 969-972 (2006).
- Heiligenberg, W., Rose, G. Phase and amplitude computations in the midbrain of an electric fish: Intracellular studies of neurons participating in the jamming avoidance response of Eigenmannia. J. Neurosci. 5, 515-531 (1985).
- Morales, E. Releasing the peri-neuronal net to patch-clamp neurons in adult CNS. Pflügers Archiv European J. Physiol. 448, 248-258 (2004).
- Friedman, M. A., Hopkins, C. D. Neural substrates for species recognition in the time-coding electrosensory pathway of mormyrid electric fish. J. Neurosci. 18, 1171-1185 (1998).
- Hitschfeld, &. #. 2. 0. 1. ;. M., Stamper, S. A., Vonderschen, K., Fortune, E. S., Chacron, M. J. Effects of restraint and immobilization on electrosensory behaviors of weakly electric fish. ILAR. J. 50, 361-372 (2009).
- Xu-Friedman, M. A., Hopkins, C. D. Central mechanisms of temporal analysis in the knollenorgan pathway of mormyrid electric fish. J. Exp. Biol. 202, 1311-1318 (1999).
- Amagai, S., Friedman, M. A., Hopkins, C. D. Time coding in the midbrain of mormyrid electric fish. I. Physiology and anatomy of cells in the nucleus exterolateralis pars anterior. J. Comp. Physiol. A: Neuroethol Sens Neural. Behav. Physiol. 182, 115-130 (1998).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull World Health Organ. 2, 143-144 (1965).
- Carlson, B. A. Temporal-pattern recognition by single neurons in a sensory pathway devoted to social communication behavior. J. Neurosci. 29, 9417-9428 (2009).
- Mugnaini, E., Maler, L. Cytology and immunocytochemistry of the nucleus extrolateralis anterior of the mormyrid brain: possible role of GABAergic synapses in temporal analysis. Anat Embryol. (Berl). 176, 313-336 (1987).
- Kohashi, T., Lyons-Warren, A. M., Mennerick, S., Carlson, B. A. Detection of submillisecond spike timing differences based on delay-line anticoincidence detection. J. Neurophysiol. 110, 2295-2311 (2013).
- Colin, W., Donoff, R. B., Foote, W. E. Fluorescent latex microspheres as a retrograde tracer in the peripheral nervous system. Brain Res. 486, 334-339 (1989).
- Katz, L. C., Burkhalter, A., Dreyer, W. J. Fluorescent latex microspheres as a retrograde neuronal marker for in vivo and in vitro studies of visual cortex. Nature. 310, 498-500 (1984).
- Brown, S. P., Hestrin, S. Intracortical circuits of pyramidal neurons reflect their long-range axonal targets. Nature. 457, 1133-1136 (2009).
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J. Neurosci. Methods. 88, 1-13 (1999).
- Pollak, G. D., Burger, R. M., Klug, A. Dissecting the circuitry of the auditory system. Trends Neurosci. 26, 33-39 (2003).
- Wurtz, R. H., Albano, J. E. Visual-motor function of the primate superior colliculus. Annu. Rev. Neurosci. 3, 189-226 (1980).
- O'Malley, D. M., Zhou, Q., Gahtan, E. Probing neural circuits in the zebrafish: a suite of optical techniques. Methods. 30, 49-63 (2003).
- Vercelli, A., Repici, M., Garbossa, D., Grimaldi, A. Recent techniques for tracing pathways in the central nervous system of developing and adult mammals. Brain Res. Bull. 51, 11-28 (2000).
- Ohki, K., Chung, S., Ch'ng, Y. H., Kara, P., Reid, R. C. Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex. Nature. 433, 597-603 (2005).
- Gahtan, E., O'Malley, D. M. Rapid lesioning of large numbers of identified vertebrate neurons: applications in zebrafish. J. Neurosci. Methods. 108, 97-110 (2001).
- Higure, Y., Katayama, Y., Takeuchi, K., Ohtubo, Y., Yoshii, K. Lucifer Yellow slows voltage-gated Na+ current inactivation in a light-dependent manner in mice. J. Physiol. 550, 159-167 (2003).
- Mennerick, S. Diverse voltage-sensitive dyes modulate GABAA receptor function. J. Neurosc. 30, 2871-2879 (2010).
- Oxford, G. S., Pooler, J. P., Narahashi, T. Internal and external application of photodynamic sensitizers on squid giant axons. J. Membr. Biol. 36, 159-173 (1977).
- Roberts, T. F., Tschida, K. A., Klein, M. E., Mooney, R. Rapid spine stabilization and synaptic enhancement at the onset of behavioural learning. Nature. 463, 948-952 (2010).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon