Method Article
Retrograd Floresan Etiketleme Belirlenen Nöronlar gelen Hedefli Hücre dışı Tek ünitesi Kayıt izin verir
Bu Makalede
Özet
Floresan boya retrograd taşıma anatomik projeksiyona dayalı nöronların bir alt-nüfus etiketler. Etiketli akson görsel olarak hedeflenebilir In vivo, Belirlenen aksonlardan ekstraselüler bir kayıt izin verir. Bu teknik nöronlar genetik manipülasyon yoluyla etiketli ya da izole etmek zor olamaz zaman 'kör' kullanarak kayıt kolaylaştırır In vivo Yaklaşımlar.
Özet
Bu yöntemin genel amacı nöronların tanımlanmış bir nüfus tek ünite, kaydetmektir. Bireysel nöronlar in vivo elektrofizyolojik olarak nöral devrelerin doğal şartlar altında nasıl çalıştığını anlamak için önemlidir. Geleneksel olarak, bu kayıtları kaydedilen hücrenin kimliğini kaydın başlangıcında bilinmemektedir yani, 'kör' yapılmıştır. Hücresel kimlik ardından hücre içi juxtacellular 1, 2 ya da gevşek yama boya 3 iyontoforez vasıtasıyla tespit edilebilir, ancak bu kayıtlar fonksiyonel farklılıklar hücre tipleri ile bölgelerindeki özel nöron için önceden hedeflenen edilemez. Floresan proteinleri görsel güdümlü tek hücreli elektrofizyoloji 4-6 izin veren bir hücre tipi özel bir şekilde ifade edilebilir. Ancak, bu genetik araçlar mevcut değildir kendisi için birçok model sistemler vardır. Hatta genetik kolay kullanılabilir sistemlerde, istenen promoter bilinmeyen olabilir veya genetik olarak homojen nöronların projeksiyon modelleri farklı olabilir. Benzer şekilde, viral vektörler projeksiyon nöronlarının 7 belirli alt etiketlemek için kullanılmaktadır, ancak bu yöntem kullanımı trans-sinaptik özgüllük toksisite ve yokluğu yüzünden kısıtlıdır. Böylece, in vivo olarak tanımlanan tek nöronlardan kaydetmek için özel ön-görselleştirme sunan ek teknikler ihtiyaç vardır. Hedef nöron Ön görüntüleme klasik tek hücre kayıtları genellikle 8-11 engelleyici zor olan kayıt için zorlayıcı koşulları için özellikle yararlıdır. Bu yazıda anlatılan roman tekniği böylece hedef elektrofizyolojik elde etmek için görsel bir ipucu sağlayan, hızlı ve seçici kendilerine özgü aksonal projeksiyonlar göre belirli bir beyin bölgesi içindeki hücrelerin belirli bir alt etiket tungsten iğne kullanarak bir floresan boya retrograd taşıma uygulandı kullanır sağlam bir devre withi tespit nöronlardanna MSS omurgalı.
Bizim yöntemin en önemli yeni bir gelişme, bir sigara genetik olarak erişilebilir bir model sistemde özel hücre tipleri hedef floresan etiketleme kullanılmasıdır. Zayıf elektrik balık hayvanlar 12 davranıyor, uyanık nöral devreleri eğitim için mükemmel bir model sistem bulunmaktadır. Biz zayıf elektrik mormyrid balık ön exterolateral çekirdeğinde "küçük hücreler" (ELa) tarafından duyusal işleme incelemek için bu teknik kullanılmaktadır. "Küçük hücreler" presinaptik sivri 13 gelişi zamanlarda submillisecond farklılıkları tespit etmek için önemli bir zaman karşılaştırma nöronlar olduğu öne sürülmüştür. Ancak, bu tür yoğun miyelin, içine çeken sinaps ve küçük hücre gövdeleri gibi anatomik özellikleri son derece zor geleneksel yöntemlerle 11, 14 kullanılarak bu hücrelerden kayıt yaptık. Burada güvenilir, sağlam kayıtları ve karakteristiklerini sağlayan, bizim yeni bir yöntem seçerek hazırlıkları 28% bu hücrelerin etiketler göstermektedirelectrosensory uyarıya yanıtların zasyon.
Protokol
1. Boya kaplı İğneler hazırlayın
- Elektrolitik bir 160 mikron çapında tungsten tel 15 keskinleştirmek. Final iğne ucu çapları 5-50 mikron arasında değişir gerekir. Gerekli iğne sayısı bölgenin etiketlenmenin büyüklüğüne bağlıdır. Biz arka exterolateral çekirdeği (ELP) içine 3-5 enjeksiyon için 5 iğne hazırladı.
- Deney önceki gece, her iğne distal 100 mikron üzerine 2 mM dekstran-konjuge Alexa Fluor 10.000 MW boya bir damla (<0.25 ul) yerleştirin.
- Iğne ucunda Konsantre boya bırakarak, oda sıcaklığında kurumaya bırakın. 4 ° C'de ışıktan korumak için karanlık bir kap içinde iğne saklayın.
2. Cerrahi Hayvan hazırlayın
- Tank içinde 300 mg / L, MS-222 bir çözelti içinde balık yerleştirerek genel anestezi neden olur.
- Balık ve ölçü çatal boy (kuyruk yüzgeci çatal ile burun ucu) ve vücut yüksekliği (tartılır ön-Ventra maksimalenine düzlemde l mesafe). Bu ölçümler, balık bir su-immersiyon amacı, (Şekil 1) altında yer alacak kadar küçük bir kayıt odası içine sığacak şekilde Tablo 1'de belirtilen aralıklar dahilinde olmalıdır.
- Hareketsiz ve elektriksel olarak dorsal vücut kas içine, 3 mg / ml 'flaxedil 100 ul enjekte ederek balık sessizlik.
- Tankı su ile kayıt odasına (Şekil 1A) doldurun. Odasının merkezine (Şekil 1), platform üzerinde balık ventral tarafı aşağı gelecek şekilde yerleştirin. Balığın ağzına yerleştirilen bir pipet (1-2 ml / dak) kullanarak 100 mg / L MS-222 bir gazlı çözüm sunmak. Gövde (Şekil 1C) her iki tarafına yerleştirilen balmumu sabit çubuklar ile balık stabilize. Göz damarlarında sürekli kan akımı ve normal gövde rengi kontrol ederek balık sağlığını izlemek.
- Uzun ekseni boyunca platformu döndürün ve platf bir arka uç altbalığın vücudun geri kalan su altında kalır süre balık başının dorsal yüzeyin bir yanında su üstünde açıkta kalacak şekilde orm. Kimwipe küçük bir parça kurumasını önlemek için cilt olmayan herhangi bir su altı kısmı üzerine yerleştirilmelidir.
3. Cerrahi (Şekil 2)
Burada anlatılan temel cerrahi işlem iyi kurulmuş ve güvenilir Mormyridsleri 16 in vivo kayıtlarında kör için kullanılır. Diğer uygulamalar için, etiketleme ve kayıt için istenen bölgelerde ortaya. Ilgi hücrelerinin akson terminalleri içeren bölge bir boya kaplı iğne ile ulaşılabilir olmalıdır. Bu aynı akson daha proksimal segmentleri içeren bölge su daldırma lens (bizim durumumuzda 2 mm) çalışma mesafesi karşılamak için doku üzerinde yeterli alan olmalıdır.
- Q-tip kullanarak başın açıktaki yüzeyine lidokain bir% 0.4 çözelti uygulanır.
- Bir neşter bıçak kullanarak, deri dikdörtgen parçasının çevre kesti. Forseps bir çift kullanarak dikdörtgen çıkarın. Dikdörtgenin boyutu balık büyüklüğü ile dönüşebilecek, ancak yaklaşık 3 mm bir 6,2 cm balık (Şekil 2A) için X 5 mm olmalıdır. Dikdörtgenin yanal kenar gözün merkezi ile aynı hizada olmalıdır, dikdörtgen ön kenarına göze sadece arka olmalı ve dikdörtgenin medial kenarı balığın orta hat sadece yan olmalıdır.
- Ek 2.5 mm kare örtüşmeyen alanı (Şekil 2B) ortaya çıkarmak için anteromediale maruz kafatası bölge genişletin.
- Tamamen yüzey (Şekil 2C) kuru herhangi bir aşırı doku ve Kimwipes ve basınçlı hava kazınması için neşter bıçak kullanarak kafatası açıkta kalan yüzeyi temizleyin ve kurulayın.
- Super Glue kullanarak anteromedial maruz kafatası bölgeye Tutkal bir metal yayınlayın. Tutkal (Şekil 2B) tamamen kuruyana kadar bekleyin.
- , 6.2 cm balıklar için yaklaşık 2 mm x 4 mm kafatası bir dikdörtgen çıkarın. Dikdörtgenin çevre inceltmek için bir ~ 0.5 mm çapında bilyalı değirmen karbür uçlu bir diş matkap kullanın. Daha sonra, bir neşter ve forseps kullanarak, temel beyin ortaya çıkarmak için uzak dikdörtgenin çevre kesme ve soyma. Ek delme veya küçük makas ile kesim tam EL (Şekil 2E) ortaya çıkarmak için gerekli olabilir. Kas kanama oluşursa, bir elektrokoter ünitesi kullanılabilir.
- Dura mater (pigmentli) ve pia mater (net) yaylı makas kullanılarak veya bir iğne hem uzak kesin ve forseps bir çift ile kesim kısımları kaldırmak. Exterolateral çekirdeği (EL) ön ve arka kısımları, şimdi sırasıyla ELa ve ELP, (Şekil 3A) görülebilir.
4. İlgi Aksonlar retrograd Etiketleme
- Ilginç şehirlerinden akson içeren hedef bölgenin üstüne boya kaplı iğne (Adım 1 yapılan) bir manipülatör yerleştirinBizim durumumuzda ELP t,.
- Hızla doku içine iğne yaklaşık 25 mikron yerleştirin. Tüm boya çıkabilir kadar, 15-30 saniye bekleyin ve sonra iğne geri çekin.
- Boya hedef bölgede dağıtılan böylece farklı bir konumda her biri yerleştirerek, gerektiğinde ek taze iğne ile tekrarlayın. Biz hazırlık başına 3-5 iğneler kullanılır.
- Hickman'ın ringer solüsyonu ile boşluğundan fazla boyanın durulayın.
- Boyayı tutma ve taşıma için en az 2 saat bekleyin.
5. İlgi Aksonlar Görselleştirme
- Bir dik duran aşamalı Epifluorescent mikroskop altında amacı, balık ile birlikte, kayıt odasına yerleştirin. Balığın vücudunda ışık girişi tıkar gibi, beyaz ve floresan hem ışık kaynakları yukarıdan gelmelidir. Kafatası boşluğu üzerinde bir fiber optik ışık kaynağının dikkatli yerleştirme tatmin edici aydınlık görüntüler sağlar. Epifloresans görüntüleme, floresan filtre içinözellikler boya emilimi / emisyon spektrumu eşleşmelidir.
- Yeni tank suya solunum geçin ve aynı akış hızı korumak. Maruz kalan beyin boşluğunda bir topraklama kablosu yerleştirin ve kayıt headstage yere (6.3) bağlanır.
- Kuyruk tabanına sonraki kayıt elektrot bir çift koyun ve elektrik organı deşarj komutu (EODC) izlemek için bir diferansiyel amplifikatör ve kayıt cihazı (örneğin ses monitör, osiloskop veya bilgisayar) bağlamak. Balık anestezi kurtarır sonra EODC balık durumunun bir göstergesi olarak da kullanılabilir.
- Düşük büyütmede bakıldığında beyin bölgesi bir ölçekli kroki hazırlayın. Sadece yüksek büyütme (Şekil 3D) altında görülebilir etiketli akson tam yerini belirlemek için yerler (balık balık değişebilir) gibi büyük kan damarları içerir.
- Boya yerleştirme onaylayın. İlk (yönlendirme için aydınlık aydınlatma ile tüm doku görmek Şekil 3A). Sonra floresan aydınlatma (Şekil 3B) ile görüntüleyebilirsiniz. ELP yaygın etiketleme (Şekil 3B ve 3C) olacaktır. Boya fotodinamik ve fototoksik etkilerini sınırlamak için floresan uyarma en aza indirin.
- Yüksek büyütme altında ELa bulmak için nirengi noktaları gibi gemilerin kullanın. Yüzeye yakın bir etiketli akson ararken floresan ışığı ile aydınlatmak. (Şekil 4).
6. Hücre dışı Faaliyet kaydedin
- 1 mm OD, filament ile 0.58 mm ID borosilikat kılcal cam kullanarak emme kayıt elektrotları çekin. İdeal uç boyutu bizim durumumuzda 17 0.1-0.2 mikron hedef akson, çapına bağlıdır. Bizim uygulama için, elektrot ucu çapı 1.5 ± 0.4 mikron (aralığı: 1,0-2,4 mikron), 5 mm uzunluğunda, dar sap ile çevredeki yoğun dolu doku taşımadan etiketli akson yaklaşım için.
- Elektrik doldurunile elektrotlar Hickman en zil çözümü filtre. Son bir ipucu direnci 45.2 ± MQ 38.0 (: 16-155 MQ aralığı) 'dir.
- Bir basınç noktası ile bir elektrot tutucu elektrot yerleştirin ve bir manipülatör monte bir amplifikatör headstage bağlayın. Basınç portuna bir manometre ve sırasıyla, basınç izleme ve kontrol için bir şırınga bir T-kavşak biten bir basınç hattı çalıştırın.
- Bir amplifikatöre headstage ve analog-dijital satın alma cihazı bağlayın.
- Elektrot doğrultusunda 30 mbar dışa basınç ile, bir etiketli akson yanında bir elektrot yerleştirin. Görüntüleme yazılımı ile arabirim bir düşük ışık seviyesi kamera pipet yerleştirme görselleştirmek için kullanılır. Doku yüzeyine yakın başlatın ve akson doğru elektrot ilerlemek. Eğer akson yaklaşırken, dışa basınç akson hafif, ama fark hareket neden olmalıdır.
- Elektrot akson, (Şekil 4A, üst) güçlü kayıt yanında ikenelektrotta ial testi uyaranlara (bizim durumumuzda, biz 20 mV / cm bir yoğunlukta 100 milisaniye monofazik pozitif ve negatif enine bakliyat kullanılan; Şekil 1A) sunarken. Bir elektrik eser uygun kayıt / stimülasyonu (Şekil 4A, alt) teyit rağmen aksiyon potansiyelleri, dikkat edilmesi gerekir.
- Elektrot dış basınç serbest bırakın ve stimülasyon / kayıt tekrarlayın. Aksiyon potansiyelleri hala (Şekil 4B) dikkat edilmesi gerekir.
- Elektrot ve tekrar stimülasyon / kayıt için hafif (125 ± 25 mbar) emme uygulayın. Hareket potansiyeli hemen stimülasyonu (Şekil 4C) tepki olarak dikkat edilmelidir. Spontan aktivite da oluşabilir. Aksiyon potansiyelleri uyulmazsa, emme serbest hafif basınç ile elektrot temizleyin, tekrar hafifçe elektrot hareket ve girişimi emme. Aksiyon potansiyelleri görünür olduğunda, basınç hattını kapatın.
- Olarak teşvik ve kayıtİstenilen.
7. Fesih ve Bertaraf
- İstenen tüm kayıtları tamamlandıktan sonra EODC durana kadar, 100 mg / L MS-222 ile solunum geçin. Resim EODC en az 10 dakika boyunca tespit edilmelidir.
- Kurumsal düzenlemeler ve onaylı hayvan bakımı protokollere göre balık atın.
8. Temsilcisi Sonuçlar
Bizim belirli bir uygulama için, merkezi duyusal nöronlar tarafından kodlama uyarıcı okuyan ilgilendi. Etiketli aksonlar başarılı kayıtları duyusal stimülasyon 18 tek ünite, analizi sağlar. Şekil 5A kayıt odasının sağ ve sol duvarların iç tarafında bulunan bipolar elektrotlar kullanarak enine electrosensory uyarılması ile temsilci aksiyon potansiyelleri gösterir. Başak kez başak raster arsa (Şekil 5B) olarak sunulabilir. Bir 25 msn önceden uyaran kayıt rüzgarow spontan aktivite düşük seviyesini gösterir. Bu özel ELa "küçük hücreli" uzun geçiş uyaran süresi artar (Şekil 5C) olarak tekrarlama başına sivri sayısını artırarak, 6 mV / cm uyaran yoğunlukta uyaran süresi ayarlı olduğunu. Ortalama ilk başak gecikme 4.28 ± 0.16 msn Ela, 11 küçük hücreler için beklenen gecikme ile tutarlıdır.
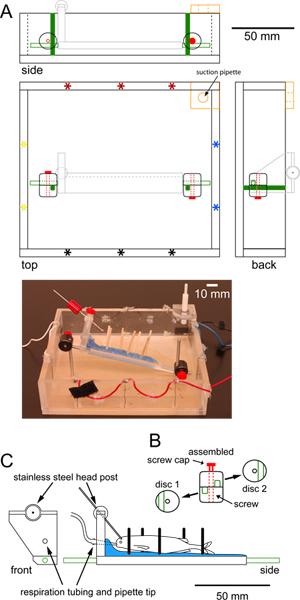
Şekil 1. Sabit aşamalı epiflourescent mikroskop objektif altında uygun bir kayıt odasına Özellikler. (A) için ölçekli kare kayıt odasına üst, yan ve arka kez gösteriliyor pleksiglas yapılmış. Periferinde uyarıcı elektrotlar (yıldız) bir eşleştirilmiş setleri ya enine (kırmızı-siyah) ya da boyuna (mavi-sarı) stimülasyon için izin verir. Merkezi (turuncu) bir lastik kaplı delik köşesinde pleksiglas ek bir parça,,sabit bir su seviyesi sağlayan bir emme pipet tutar. Odası (katı yeşil) alt vidalanmış iki dikey paslanmaz çelik Mesajları ayarlanabilir disk kelepçeler ile balık (C ayrıntılı açık gri,) destekleyen platforma bağlı paslanmaz çelik ileti (yeşil anahat) bağlanmak. Odasının bir fotoğraf için ölçekli çizim aşağıda gösterilmiştir. (B) dairesel plastik disk kelepçe Bireysel ve monte manzarası dikey mesajları için platform güvenliğini sağlamak için kullanılan. Her disk kelepçe sıkma vidası için bir yazı ve bir merkez delik için bir oluk (yeşil) sahiptir. Olukların her biri birbirine dik olacak şekilde disk kelepçeler döndürülür. Vidayı (kırmızı) kelepçeler platformunun daha dikey ve dönme hareketini önlemek için yerinde mesajları sıkma. Yerde balık tutmak için kullanılan pleksiglas platformunun (C) Ön ve yan ölçekli bakıldı. Platform ahşap Dowe tutar parafin tabakası (mavi) ile kaplanmıştırbalık desteklemek için yerinde ls (siyah çubuklar). Balık respirating için Boru balığın ağzına yerleştirilen bir pipet içinde platformu ve biter 'başlık' bir delikten geçer. Paslanmaz çelik kafa yazılan (gri bar) 360 derece dönüş sağlayan bir top ortak ile platform bağlanır. Paslanmaz çelik yatay ileti (yeşil) platformun her iki ucuna vidalanır. büyük rakam görmek için buraya tıklayın .
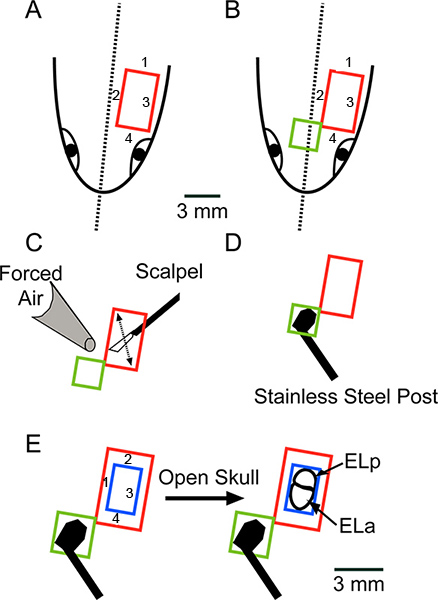
Şekil 2. Cerrahi şematik bakış başın dorsal yüzeyi aşağı bakarak. (A) deri bir dikdörtgen parça (kırmızı) kaldırmak için, sırayla belirtilen, dört kesim olun. (B) anteromediale ek bir dikdörtgen parça kaldırmak için açılış uzatın cilt (yeşil). (C) tarafından kalan yağ veya bağların kazıyın birokla gösterilen ve Kimwipes ve basınçlı hava ile tamamen yüzey kuru olarak neşter bıçak hareket. (D) Tutkal, paslanmaz çelik yazılan Super Glue kullanarak kafatasına. A Ölçek çubuğu AD için de geçerlidir. (E) (sırasıyla ELa ve ELP,) ön ve arka exterolateral çekirdekler açığa, kemik (mavi) bir dikdörtgen parça kaldırmak için, sırayla belirtilen, dört kesim yapmak için bir diş matkap kullanın . büyük rakam görmek için buraya tıklayın .
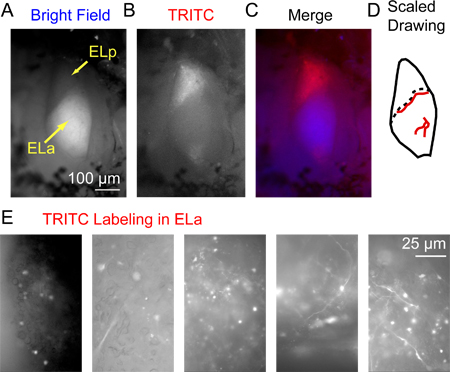
Şekil 3,. 3 saat dekstran-konjuge Alexa Fluor 568. (A) ön ve arka exterolateral çekirdekleri (ELa ve ELP, sırasıyla) yukarıdan parlak bir alan aydınlatma ile görüntülendi enjeksiyonundan sonra arka exterolateral çekirdeğinde Floresan etiketleme. DikkatELa içinde kapsamlı miyelinasyonun bu ELP ayıran nispeten parlak bir görünüm verir. (B) aynı bölgede bir TRITC filtreden izlendi Epifloresans kullanılarak görüntülendi. (C) A birleştirilen görüntü için mavi kullanan bir (aydınlık) ve B için kırmızı (TRITC). (D) sadece yüksek büyütme altında görebilir etiketli akson tam yerini (kan damarlarının tam yerini belirlemek için yerler olarak kullanılabilir büyük kan damarları (kırmızı çizgiler) dahil olmak üzere ELa ve ELP bir ölçekli çizim örneği ) balık balık değişir. Noktalı çizgi ELa ve ELP arasındaki sınırı işaret etmektedir. (E) örnek görüntüler ELa küçük hücre akson ve somas başarılı etiketleme desen bir dizi gösteren 5 farklı hazırlıklar Bir TRITC filtre kullanarak satın aldı.
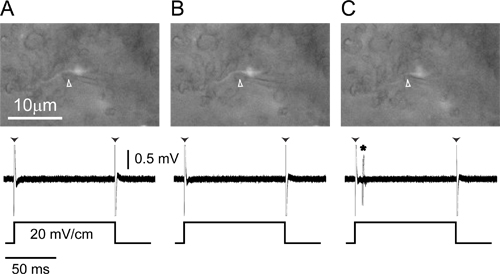
Şekil 4. Tek birim hücre dışı kayıtBir etiketli akson. (A) pozitif basınç altında Kayıt elektrot (ok başı) ELa bir etiketli küçük hücreli akson bitişik yerleştirilen (üst), tek fazlı bir 100 msn 20 mV / cm yanıt olarak kenar eser (ok başları) kaydeder taraf pozitif, enine kare darbe (alt). (B) elektrottan dışa basıncı (ok başı) bırakılması elektrot (üst) doğru hafifçe hareket ettirmek için akson neden olur ama uyarana hiç bir yanıt (alt) hala var. ( C) hafif negatif basınç elektrot (üst, ok başı) ve uyaranın başlangıcından yanıt olarak aksiyon potansiyelleri içine akson çeker şimdi görebilir (alt, yıldız). Her üç panellerin alt kısımları uyaran 20 tekrar ile kaplanmış tepkilerdir.
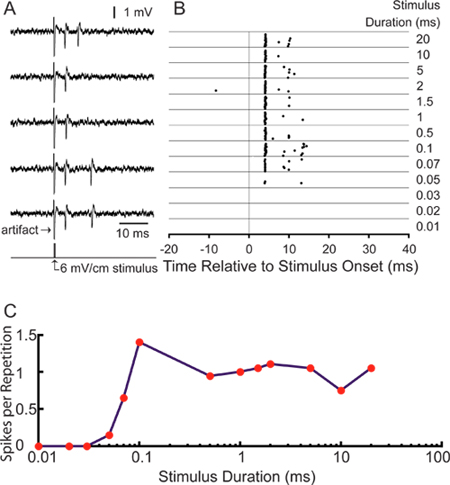
Şekil 5,. Bu tekniği kullanarak Örnek sonuçlanır. (A), 5 örnek izlerimonofazik 0.1 msn 6 mV / cm uyarılmış aksiyon potansiyelleri gösteren, kontralateral pozitif, enine kare darbe uyarıcı. (B) aynı birim için 75 msn kayıt penceresi 20 tekrar sırasında başak kez gösteren Raster arsa 6 ile 0 zamanında uyarılmış Sağdaki listelenen süreleri aralığında mV / cm uyaranlara. (C) Süre ayarlama eğrisi uyarıcı tekrarı başına sivri gibi raster görüntülenen yanıtları miktarının.
| Kütle (g) | Çatal Uzunluk (cm) | Vücut Derinlik (cm) | |
| Ortalama | 2.42 | 6.20 | 1.14 |
| Standart Sapma | 0.64 | 0.52 | 0.18 |
| Dizi | 1,2-4,0 | 5,5-8,4 | 0,9-1,6 |
Tablo 1. En uygunağırlık, uzunluk ve vücut yüksekliği aralıkları balık. Optimal ağırlık, çatal boy (kuyruk yüzgeci çatal ile burun ucu) ve vücut derinliği (enine düzlemde maksimum dorso-ventral mesafe) balık gösterilen kayıt odasına uyum sağlayan aralıkları Şekil 1. Çok küçük balık boya yerleştirme zorlu hale, cerrahi hayatta kalmak için ve küçük bir ELP olacak daha az olabilir. Çok büyük balık ELa ve ELP erişimi azaltacak ve ELa ve ELP odaklanmak için yeterince yakın yüksek güç, su daldırma hedefi düşürücü önleyebilir büyük, aşırı kapsamlı beyincik olacaktır.
| Uygulama Sitesi | Boya Türü | Balık çalıştı | ELa etiket | ELP etiket | Birimler çalıştı | Kayıtlar |
| ELBir | Alexa Fluor enjeksiyon | 32 | 26 (% 81.2) | 19 (% 59.4) | 50 | 4 (% 8.0) |
| ELa | Alexa Fluor filtre kağıdı batırılmış | 1 | 0 | 0 | 0 | 0 |
| ELa | DMSO içinde di-I | 8 | 6 (% 75.0) | 0 | 0 | 0 |
| ELa | Di-O kristaller | 5 | 3 (60.0%) | 2 (% 40.0) | 9 | 0 |
| ELP | Katı Alexa Fluor kristaller | 2 | 0 | 2 (% 100) | 0 | 0 |
| ELP | Alexa Fluor kaplı tungsten teller | 43 | 29 (67.4%) | 41 (% 95.3) | 119 | 26 (% 21.8) |
Tablo 2'de. Her boya enjeksiyon yöntemi için başarı oranları. Her boya enjeksiyon yöntemi için başarı oranları. Yöntem enjeksiyon ve boya türüne göre ayrılır. Her bir yöntem için, balık sayısı çalıştı ve Ela ve Elp başarılı etiketleme ile sonuçlandı, bu deneylerin yüzdesi gösterilmiştir. Hedeflenen kayıt alanı uygulama sitesi (kalın kutu) karşı olduğunu unutmayın. Enjeksiyon için, boya alımı somas ve akson hem de etiketleme ile başarılı kabul edildi. Buna karşılık, kayıt alanı olan, etiketli aksonlar sadece preparatlar başarılı etiketleme deneyleri gibi sayıldı. Teşebbüs birimlerinin sayısı ve başarılı kayıtları neden bu birimlerin yüzdesi de gösterilir.
| # Enjeksiyon sites | Enjeksiyon başına ortalama hacim (ul) | Enjeksiyon başına hacim aralığı (ul) | Ortalama toplam enjeksiyon hacmi (ul) | Toplam enjeksiyon hacimleri aralığı (ul) | |
| Hamilton mikroenjektör | 3 ya da 4 | 0,144 | ,091-0,91 | 0,516 | 0,378-0,669 |
| Cam pipet ile Nanoinjector | 2-4 | 0.069 (sabit) | Sabit hacim 1-6 kez enjekte | 0,621 | 0,414-0,966 |
| Cam pipet ile mikroenjektör | 2-6 | 0.093 | 0,058-0,202 | 0.360 | 0,252-0,540 |
Tablo 3. Boya miktarları Al enjekte etmek için kullanılan üç yöntemlerinin her biri için uygulananELa (Tablo 2'den ilk yöntem) olarak Alexa Fluor enjekte etmek için kullanılan üç yöntem her biri için uygulanan boya ELa miktarları içine EXA Fluor. ELa içine boya enjekte ya bir 33 göstergesi Hamilton şırınga iğnesi ya da çekti cam kapiller pipet kullanarak bir nanoinjector ve bir mikroenjektör hem de yapıldı. Bu enjeksiyon bölgesinde, enjeksiyon başına hacmi ve boya enjeksiyon hacmi sayısını değişiyordu.
Tartışmalar
Bir kere hakim, bu teknik bir çok model sistemler in vivo kayıtlarında için ayrı akson dahil olmak üzere tespit nöronlar, hedef sağlayacaktır. Buna ek olarak, bu teknik bir güvenilir zorlu in vivo kayıt yöntemleri geleneksel sağlayan benzersiz anatomik özelliklere sahip nöronlardan başak çıkış kaydetmenize olanak verir. Biz mormyrid zayıf elektrik balık ELa "küçük hücreler" den kaydetmek için bu tekniği kullanmış olurlar. "Küçük hücreler" ayar özelliklerini incelemek için önceki girişimler zorlu kayıt koşullarına 11, 14 nedeniyle başarısız oldu. Benzer anatomik özellikleri çok farklı omurgalı işitsel ve electrosensory nöronlar 8-10 tek birim kayıtları elde etmek için engeller oluşturmak. Sistemimizde bu zorlukları aşmak için, "küçük hücreler" bu ELa tek hücrelerin olduğu gerçeğini yararlandı ELP proje. Böylece, ELP yerleştirilir boya retrograd taşıma "küçük ELa Etiketleme sınırlarhücre "somas ve akson. akson Floresan etiketleme erişilemez somas rağmen mümkün tespit hücrelerinden tek birim kayıtları yapma, etiketli aksonlar yanında hassas elektrot yerleştirme izin verdi. Biz çevredeki yutma sinaps 11 nedeniyle muhtemelen, somatik kayıtları çalıştı, ancak başarısız oldu , 17. Bununla birlikte, açıkça bu somatik etiketleme tekniği diğer hücre türleri ve diğer devreler somatik kayıtları hedeflemek için kullanılabilir düşündüren görünür hale geldi. in vivo olarak geriye doğru aktarıma yoluyla nöronların fluoresan etiketleme in vitro 19-21 hedeflenen kayıtları ilerletilmesi için kullanılmaktadır . Benzer bir teknik zebrabalıkları omurilik 22 motor nöronların in vivo kayıtları hedeflenen için kullanılmıştır. Çalışmalarımız, etiketleme ve kayıt hem de beyinde in vivo yapılmaktadır ki, bu yaklaşım için yeni bir genişleme gösterir. Bizim yöntemi gösteren in vivo bir retrograd t MSS alanların etiketlemeyarışçı benzer seçici projeksiyon nöronları ile diğer sağlam devrelerin çalışma genişletilebilir. Örneğin, memeli işitsel işleme, alt kollikulus (IC) birden fazla rhombencephalic yapılar 23 girişleri için önemli bir aktarma merkezi olarak hizmet vermektedir. IC içine enjeksiyondan seçici bu çekirdeklerin her birinden projeksiyon hücreleri etiketlemek olacaktır. Üstün colliculus (SC) vizyon 24 için benzer bir işlev görür. Omurilik preparatlar özellikle omurilik kolayca erişilebilir olduğu gibi, boya püskürtme kadar kayıt sitesinden oluşabilir, bu yöntem için uygun olan, ve daha detaylı bilgiler anatomik 25 elde etmek için seçme nöronların hücre içi kayıt ve doldurma ile kombine edilebilir. Son olarak, sistem-izleme karmaşık devre 26 eşleştirmek için merkezi sinir sistemi boyunca kullanılan iyi kurulmuş bir tekniktir. Bizim yöntemi w yapılmıştır bu çalışmalara işlevsel bilgi eklemek için kullanılabilirkedi görsel korteks 27. ith kalsiyum duyarlı göstergeler.
Iyi kurulmuş olan cerrahi, güvenilir ve düzenli in vivo kayıtları 16 kör için kullanılan, minimal kanama ve hayvan ve hayatta kalmak için doku sağlamak için beynin yüzeyine zarar ile tamamlanması gerekir. Uygulama ile, cerrahi ve boya uygulama 30-45 dakika içinde tamamlanabilir. Biz başarıyla hazırlıkları% 67 in "küçük hücreli" akson etiketli. En hazırlıkları sadece 1 veya 2 görünür etiketli aksonlar var, ancak bazı olarak 8 var. Teşebbüs 119 etiketli birimlerinin, biz 12 preparatları (Tablo 2) üzerinden dağıtılan 26 birimlerden tek birim kayıtları elde. Böylece, veri% 28 genel başarı oranı için etiketli akson ile hazırlıkları 41% toplanmıştır.
Boya uygulamasının kritik yönü derinliği etiketleme. Tungsten telinin Sığ ekleme yıkanmış w olan boya ile sonuçlanacaktıray. Penetrasyon çok derin ise, ancak, etiketli akson hedef görebilir olmayacaktır. Bundan başka, hücre için bazı mekanik hasar yeterince 25, 28 ele alınması boya için gerçekleşmelidir. Ancak, çok fazla zarar hücreleri öldürür. Biz ELP etiketlenmesine akson (Tablo 3) kayıt ile eşleştirilmiş ELa içine boya enjeksiyon yoluyla anterograd etiketleme dahil olmak üzere diğer boyalar ve diğer yöntemlerle (Tablo 2), ile etiketleme çalıştı. Biz etiketleme onlara tepkisiz hale somatik hasar hücrelerin sınırlı olduğu için ileriye etiketleme başarılı olmadığını hipotez. Buna ek olarak, pre-sinaptik terminalleri rahatsız olabilir. Buna karşılık, retrograd etiketleme bu endişeleri her iki en aza indirir. Miktarı ve boya uygulama yer çalışılmaktadır belli bir devre uygun olarak modifiye edilebilir. Maksimal etiketleme biz kaplanmış tungsten tellerin kullanılarak elde büyük boya konsantrasyonu oluşur. Ancak de olan aksonlar Etiketlemebu gelişmiş olduğu gibi ep projeksiyonlar, boya bir tungsten iğne yerinden çıkabilir. Bu durumda, basınçlı enjeksiyon daha uygun olacaktır. Boya alımı ve ulaşım 2 saat sonrası enjeksiyon ve 6 saat sonrası enjeksiyon gibi geç görünen ek etiketli akson gibi erken görünür olmak bizim hazırlık etiketli akson ile, hızlıdır. Böylece, etiketleme ve kayıt hayatta kalma cerrahi ile ilgili teknik sorunlar ortadan kaldırarak, tek bir gün içinde yapılabilir. Zamanlama boya nakil için gerekli olan mesafeye bağlı olarak, her uygulama için değişecektir.
Diğer önemli yönü elektrot yerleştirilmesidir. Bu ucu tıkanmasını önlemek için etiketli akson siteye doku yakın girmek için önemlidir. Bu ELa gibi yoğun doku için, kayıt elektrot üzerinde uzun, ince bir sap çevre dokulara aşırı hareketi en aza indirir. Başarılı bir kayıt bir kayıt elde edilene kadar taze elektrotlar ile ilk denemede, tekrar üzerinde elde veya tiss değilseue akson artık görünür hangi noktaya bozulur. Bununla birlikte, hızlı bir şekilde ağartma fototoksisite neden maruz floresan, miktarını en aza indirmek için ve hücre 29-31 fizyolojik özelliklerini etkileyebilir akson yanındaki elektrot yerleştirmek için de önemlidir.
Akson bir bölümünü başarıyla kayıt elektrot içine emilmekte sonra, kayıtlar birkaç saat boyunca elde edilebilir. Birimleri sürekli az 1 saat içinde kaybolur üzerinden kaymasını akson önlemek için küçük elektrot uçları yapmayı düşünün. Öte yandan, bir ucu çok küçük akson için tıkanma, düşük sinyal-gürültü, ya da hasara neden olabilir. Başak genlik ve ek emme ile bir birimin 'dönüş' bir sürekli azalma ucu çok büyük bir göstergesidir. Çok fazla emme akson onarılamaz hasara neden olabilir. Bir çözüm, basınç yavaş yavaş sıfıra döner böylece hava hattı küçük bir sızıntı sağlamaktır. Hızla inci dengelemee basınç akson sınırdışı edebilir geçici bir akraba-dışa 'itme' verilecektir.
Bu teknik belirlenen projeksiyon nöronlardan hedeflenen kayıtları elde etmek için büyük bir avantaj sağlamasına rağmen boya enjeksiyon sitesinde tüm hücre tipleri tarafından alınması gibi, bu, yerel internöronlar ayırt için yararlı olmayacaktır. Teorik olarak, ayrı enjeksiyon siteleri ile birden fazla fluorophores kullanımı bu yöntem genişletilebilir izin verebilir. Örneğin, tek-veya çift-etiketleme karşılaştırma devresi 32, iki nokta, çift enjeksiyonları ardından projeksiyon nöronlarının ikinci internöron ayırt etmek için kullanılabilir. Benzer şekilde, retrograd izleyiciler zebra ispinoz Yüksek Vokal merkezi (HCV) 32 son zamanlarda yapıldı gibi iki foton görüntüleme gibi diğer gelişmiş görüntüleme teknikleri,, ile kombine edilebilir. Epifloresans mikroskop kullanırken Ayrıca, kayıt bölgeleri biz sadece ve 1 çözmek mümkün olduğu gibi, yüzeye yakın olanlar ile sınırlıdırmu, doku ilk 30 mikron içinde m yapılar. Ancak, bu derinliği gibi iki foton mikroskopi 33 veya objektif-birleştiğinde düzlemsel aydınlatma mikroskobu 34 gibi diğer mikroskopi teknikleri kullanımı yoluyla genişletilebilir. Nispeten erişilebilir olduğunu da dahil olmak üzere - bu model sistemler çeşitli birçok farklı devrelerinde tek nöronlardan kaydetmek için kullanılabilir, çünkü genel olarak, bu teknik, in vivo olarak nöral devrelerin çalışma önemli bir gelişmeyi temsil etmektedir.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
TK G2205 (Bilim Teşvik Ulusal Bilim Vakfı (BAC için IOS-1.050.701), Ulusal Sağlık Enstitüleri (SM için NS54174 ve AML-W F30DC0111907.), Uehara Memorial Foundation ve Japon Derneği tarafından sağlanan finansman .) Biz hücre dışı aksonal kayıtların konuda verdiği destek ve rehberlik için Julian Meeks teşekkür ederim. Biz bir prototip kayıt odasına sağlamak için Carl Hopkins teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Tricaine Methanesulfonate | Sigma-Aldrich | E10521 | MS-222 |
| Gallamine Triethiodide | Sigma-Aldrich | G8134 | Flaxedil |
| Lidocaine Hydrochloride | Sigma-Aldrich | L5647 | |
| Hickman’s Ringer Solution | NA | NA | NaCl (6.48 g/l), KCl (0.15 g/l), CaCl2•2H20 (0.29 g/l), MgSO4 (0.12 g/l), NaHCO3 (0.084 g/l), NaH2PO4 (0.06 g/l) |
| Peristaltic Pump | Gilson or Rainin | Minipulse 3 Model 312; RP-1 | 10.0 ± 1.0 rpm, Alternatively, a gravity-fed line with a flow-meter |
| Dissection Microscope | Nikon | SM2645 | |
| Super Glue | Super Glue Corporation | SGH2 | 2g tube |
| Omni Drill 35 | World Precision Instruments | 503-598 | |
| Ball Mill Carbide Drill Bit #1/4 | World Precision Instruments | 501860 | 0.19 DIA (bit diameter = 0.48 mm) |
| Low Temp Cautery Kit | World Precision Instruments | 500391 | |
| Manual Micromanipulator | World Precision Instruments | M3301R | |
| Dextran Conjugated Alexa Fluor 568 | Invitrogen | D-22912 | 2mM concentration; 10,000MW The choice of dye wavelength should be selected to match the microscope filter settings |
| Epifluorescent Microscope | Nikon | E600 FN | A remote focus accessory is helpful for fine focus TRITC filter - or appropriate filter to match focal planes for different dye wavelengths |
| Low Power Objective | Nikon | 93182 | CFI Plan Achromat Series, 4X N.A. 0.1, W.D. 30mm |
| High Power Objective | Nikon | 93148 | CFI Fluor Series, 40X WI N.A. 0.8, W.D. 2.0 mm |
| White Light Source | Dolan-Jenner | Model 190 | Fiber Optic Illuminator |
| Fluorescent Light Source | Lumen Dynamics | X-Cite 120Q | |
| Low-light Level Camera | Photometrics | CoolSnap ES | |
| Digital Manometer | Omega Engineering | HHP-201 | |
| Motorized Micromanipulator | Sutter Instruments | MP-285 | |
| Headstage | Molecular Devices | CV-7B | Axon Instruments |
| Amplifier | Molecular Devices | MultiClamp 700B | Axon Instruments |
| Data Acquisition System | Molecular Devices | Digidata 1322A | Axon Instruments |
| Isolated Pulse Stimulator | A-M Systems | 2100 | |
| Flaming/Brown Micropipette Puller | Sutter Instruments | P-97 | Program settings for our application: Heat: ramp + 1, Pull: ’0’, Velocity: 60, Time: 90 Box filament |
| Pipette Glass | World Precision Instruments | 1B100F-4 | Borosilicate capillary glass with filament (1 mm OD, 0.58 mm ID) |
Referanslar
- Meeks, J. P., Jiang, X., Mennerick, S. Action potential fidelity during normal and epileptiform activity in paired soma-axon recordings from rat hippocampus. J. Physiol. 566, 425-441 (2005).
- Pinault, D. A novel single-cell staining procedure performed in vivo under electrophysiological control: morpho-functional features of juxtacellularly labeled thalamic cells and other central neurons with biocytin or Neurobiotin. J. Neurosci. Methods. 65, 113-136 (1996).
- Joshi, S., Hawken, M. J. Loose-patch-juxtacellular recording in vivo--a method for functional characterization and labeling of neurons in macaque V1. J. Neurosci. Methods. 156, 37-49 (2006).
- Margrie, T. W. Targeted whole-cell recordings in the mammalian brain in vivo. Neuron. 39, 911-918 (2003).
- Lima, S. Q., Hromádka, T., Znamenskiy, P., Zador, A. M. PINP: A new method of tagging neuronal populations for identification during in vivo electrophysiological recording. PLoS One. 4, e6099(2009).
- Foust, A., Popovic, M., Zecevic, D., McCormick, D. A. Action potentials initiate in the axon initial segment and propagate through axon collaterals reliably in cerebellar Purkinje neurons. J. Neurosci. 30, 6891-6902 (2010).
- Lehman, M. N. Herpes simplex virus as a transneuronal tracer. Neurosci. Biobehav. Rev. 22, 695-708 (1998).
- Joris, P. X. A dogged pursuit of coincidence. J. Neurophysiol. 96, 969-972 (2006).
- Heiligenberg, W., Rose, G. Phase and amplitude computations in the midbrain of an electric fish: Intracellular studies of neurons participating in the jamming avoidance response of Eigenmannia. J. Neurosci. 5, 515-531 (1985).
- Morales, E. Releasing the peri-neuronal net to patch-clamp neurons in adult CNS. Pflügers Archiv European J. Physiol. 448, 248-258 (2004).
- Friedman, M. A., Hopkins, C. D. Neural substrates for species recognition in the time-coding electrosensory pathway of mormyrid electric fish. J. Neurosci. 18, 1171-1185 (1998).
- Hitschfeld, ÉM., Stamper, S. A., Vonderschen, K., Fortune, E. S., Chacron, M. J. Effects of restraint and immobilization on electrosensory behaviors of weakly electric fish. ILAR. J. 50, 361-372 (2009).
- Xu-Friedman, M. A., Hopkins, C. D. Central mechanisms of temporal analysis in the knollenorgan pathway of mormyrid electric fish. J. Exp. Biol. 202, 1311-1318 (1999).
- Amagai, S., Friedman, M. A., Hopkins, C. D. Time coding in the midbrain of mormyrid electric fish. I. Physiology and anatomy of cells in the nucleus exterolateralis pars anterior. J. Comp. Physiol. A: Neuroethol Sens Neural. Behav. Physiol. 182, 115-130 (1998).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull World Health Organ. 2, 143-144 (1965).
- Carlson, B. A. Temporal-pattern recognition by single neurons in a sensory pathway devoted to social communication behavior. J. Neurosci. 29, 9417-9428 (2009).
- Mugnaini, E., Maler, L. Cytology and immunocytochemistry of the nucleus extrolateralis anterior of the mormyrid brain: possible role of GABAergic synapses in temporal analysis. Anat Embryol. (Berl). 176, 313-336 (1987).
- Kohashi, T., Lyons-Warren, A. M., Mennerick, S., Carlson, B. A. Detection of submillisecond spike timing differences based on delay-line anticoincidence detection. J. Neurophysiol. 110, 2295-2311 (2013).
- Colin, W., Donoff, R. B., Foote, W. E. Fluorescent latex microspheres as a retrograde tracer in the peripheral nervous system. Brain Res. 486, 334-339 (1989).
- Katz, L. C., Burkhalter, A., Dreyer, W. J. Fluorescent latex microspheres as a retrograde neuronal marker for in vivo and in vitro studies of visual cortex. Nature. 310, 498-500 (1984).
- Brown, S. P., Hestrin, S. Intracortical circuits of pyramidal neurons reflect their long-range axonal targets. Nature. 457, 1133-1136 (2009).
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J. Neurosci. Methods. 88, 1-13 (1999).
- Pollak, G. D., Burger, R. M., Klug, A. Dissecting the circuitry of the auditory system. Trends Neurosci. 26, 33-39 (2003).
- Wurtz, R. H., Albano, J. E. Visual-motor function of the primate superior colliculus. Annu. Rev. Neurosci. 3, 189-226 (1980).
- O'Malley, D. M., Zhou, Q., Gahtan, E. Probing neural circuits in the zebrafish: a suite of optical techniques. Methods. 30, 49-63 (2003).
- Vercelli, A., Repici, M., Garbossa, D., Grimaldi, A. Recent techniques for tracing pathways in the central nervous system of developing and adult mammals. Brain Res. Bull. 51, 11-28 (2000).
- Ohki, K., Chung, S., Ch'ng, Y. H., Kara, P., Reid, R. C. Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex. Nature. 433, 597-603 (2005).
- Gahtan, E., O'Malley, D. M. Rapid lesioning of large numbers of identified vertebrate neurons: applications in zebrafish. J. Neurosci. Methods. 108, 97-110 (2001).
- Higure, Y., Katayama, Y., Takeuchi, K., Ohtubo, Y., Yoshii, K. Lucifer Yellow slows voltage-gated Na+ current inactivation in a light-dependent manner in mice. J. Physiol. 550, 159-167 (2003).
- Mennerick, S. Diverse voltage-sensitive dyes modulate GABAA receptor function. J. Neurosc. 30, 2871-2879 (2010).
- Oxford, G. S., Pooler, J. P., Narahashi, T. Internal and external application of photodynamic sensitizers on squid giant axons. J. Membr. Biol. 36, 159-173 (1977).
- Roberts, T. F., Tschida, K. A., Klein, M. E., Mooney, R. Rapid spine stabilization and synaptic enhancement at the onset of behavioural learning. Nature. 463, 948-952 (2010).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır