Method Article
Marcaje fluorescente retrógrada Permite dirigida extracelular sola unidad de grabación de neuronas identificadas
En este artículo
Resumen
Transporte retrógrado de tinte fluorescente etiqueta a una subpoblación de neuronas en base a la proyección anatómica. Axones etiquetadas pueden orientarse visualmente In vivo, Que permite la grabación extracelular de los axones identificados. Esta técnica facilita la grabación cuando las neuronas no se pueden etiquetar a través de la manipulación genética o son difíciles de aislar el uso de "ciego" In vivo Enfoques.
Resumen
El objetivo general de este método consiste en registrar las respuestas de una sola unidad de una población seleccionada de las neuronas. En los registros electrofisiológicos in vivo de neuronas individuales son fundamentales para la comprensión de cómo funcionan los circuitos neuronales en condiciones naturales. Tradicionalmente, estas grabaciones se han realizado "a ciegas", es decir, la identidad de la célula registrada es desconocido al inicio de la grabación. Identidad celular puede determinarse posteriormente mediante intracelular 1, juxtacellular 2 o sueltas-patch 3 iontoforesis de tinte, pero estas grabaciones no se puede pre-dirigido a neuronas específicas en regiones con tipos de células funcionalmente heterogéneas. Las proteínas fluorescentes se pueden expresar de una manera específica del tipo de célula que permite visualmente guiada por electrofisiología de una sola célula 4-6. Sin embargo, hay muchos sistemas modelo para el que estas herramientas genéticas no están disponibles. Incluso en sistemas de modelos genéticamente accesibles, el programa deseadopromotor puede ser desconocida o neuronas genéticamente homogéneos puede haber diferentes patrones de proyección. Del mismo modo, los vectores virales se han utilizado para etiquetar los subgrupos específicos de las neuronas de proyección 7, pero el uso de este método está limitada por la toxicidad y la falta de especificidad trans-sináptica. Por lo tanto, se necesitan técnicas adicionales que ofrecen pre-visualización específica para grabar desde neuronas individuales identificados in vivo. Pre-visualización de la neurona diana es particularmente útil para condiciones de grabación desafiantes, para los que las grabaciones de una sola célula clásicos a menudo son prohibitivamente difícil 8-11. La novedosa técnica descrita en este documento se utiliza el transporte retrógrado de un colorante fluorescente aplicada, utilizando agujas de tungsteno para etiquetar rápidamente y selectivamente un subconjunto específico de células dentro de una región particular del cerebro sobre la base de sus proyecciones axonales únicas, proporcionando de ese modo una señal visual para obtener registros electrofisiológicos dirigidos de las neuronas identificadas en un circuito intacto withina vertebrado SNC.
La novela avance más significativo de nuestro método es el uso de etiquetado fluorescente para apuntar a tipos de células específicos en un sistema modelo accesible no genéticamente. Débilmente peces eléctricos son un excelente sistema modelo para el estudio de los circuitos neuronales en despierto, comportándose los animales 12. Hemos utilizado esta técnica para estudiar el procesamiento sensorial de "células pequeñas" en el núcleo exterolateral anterior (ELA) de peces mormyrid débilmente eléctrica. "Células pequeñas" son la hipótesis de que el tiempo de comparación neuronas importantes para detectar diferencias submillisecond en los tiempos de llegada de los picos presináptica 13. Sin embargo, las características anatómicas tales como la mielina densa, que envuelve las sinapsis, y cuerpos celulares pequeños han hecho extremadamente difícil para grabar a partir de estas células utilizando métodos tradicionales 11, 14. Aquí nos demuestran que nuestro método novedoso etiqueta selectivamente estas células en el 28% de los preparativos, lo que permite, grabaciones robustos y fiables caracrización de las respuestas a la estimulación electrosensory.
Protocolo
1. Prepare Needles tinte recubiertos
- Electrolíticamente afilar un micras de diámetro de tungsteno 15 160 hilos. Diámetros de punta de aguja finales deben oscilar desde 5 hasta 50 micras. El número de agujas necesarios depende del tamaño de la región que está siendo etiquetado. Preparamos 5 agujas por 3-5 inyecciones en el núcleo exterolateral posterior (ELP).
- La noche antes del experimento, colocar una gota (<0,25 l) de 2 mM de dextrano conjugado con Alexa Fluor 10.000 MW tinta en los distales 100 micras de cada aguja.
- Permita que las agujas se sequen al aire a temperatura ambiente, dejando colorante concentrada en la punta. Guarde las agujas a 4 ° C en un recipiente oscuro para protegerlos de la luz.
2. Prepárese para la Cirugía Animal
- Inducir la anestesia general mediante la colocación de los peces en una solución de 300 mg / L de MS-222 en el tanque de agua.
- Pese a los peces y medir la longitud tenedor (la punta del hocico hasta el tenedor de la aleta caudal) y profundidad corporal (máximo dorso-ventral distancia en el plano transversal). Estas mediciones deben estar dentro de los intervalos indicados en la Tabla 1 para que el pez se ajusta dentro de una cámara de registro lo suficientemente pequeño para colocar debajo de un objetivo de microscopio de inmersión en agua (Figura 1).
- Inmovilizar y silenciar eléctricamente los peces mediante la inyección de 100 l de 3 mg / ml flaxedil en la musculatura dorsal del cuerpo.
- Llenar la cámara de grabación (Figura 1A) con tanque de agua. Coloque el pescado ventral hacia abajo sobre la plataforma en el centro de la cámara (Figura 1). Entregar una solución aireada de 100 mg / L de MS-222 usando una punta de pipeta colocada en la boca del pescado (1-2 ml / min). Estabilizar el pescado con barras fijadas en cera colocado en ambos lados del cuerpo (Figura 1C). Monitorear la salud de los peces mediante la comprobación de flujo continuo de sangre en los vasos oculares y un color normal del cuerpo.
- Girar la plataforma a lo largo de su eje longitudinal y baje el extremo posterior de la platfORM modo que un lado de la superficie dorsal de la cabeza del pescado se expone por encima del agua, mientras que el resto del cuerpo del pescado permanece sumergido. Un pequeño trozo de Kimwipe debe ser colocado en cualquier parte no sumergida de la piel para evitar el secado.
3. Cirugía (Figura 2)
El procedimiento quirúrgico básico descrito aquí está bien establecido y utilizarse de manera fiable para ciegos en grabaciones en vivo mormyrids 16. Para otras aplicaciones, exponer las regiones deseadas para el etiquetado y el registro. La región que contiene terminales de los axones de las células de interés debe ser alcanzable por una aguja de tinte-revestido. La región que contiene los segmentos más proximales de los mismos axones debe tener espacio suficiente por encima del tejido para dar cabida a la distancia de trabajo de la lente de inmersión en agua (2 mm en nuestro caso).
- Aplique una solución de 0,4% de lidocaína a la superficie expuesta de la cabeza con un Q-tip.
- Uso de una hoja de bisturí, cortar el perímetro de una pieza rectangular de la piel. Eliminar el rectángulo usando un par de pinzas. El tamaño del rectángulo se escala con el tamaño del pez, pero debe ser de aproximadamente 3 mm X 5 mm para un pescado 6,2 cm (Figura 2A). El borde lateral del rectángulo debe alinear con el centro del ojo, el borde anterior del rectángulo debe ser justo posterior al ojo, y el borde medial del rectángulo debe ser justo lateral de la línea media del pez.
- Ampliar la región cráneo expuesto anteromedialmente para exponer un adicional de 2,5 mm área de no superposición cuadrada (Figura 2B).
- Completamente limpiar y secar la superficie expuesta del cráneo usando la hoja de bisturí para raspar y retirar cualquier tejido y Kimwipes y el exceso de aire forzado para secar la superficie (Figura 2C).
- Pegue un poste de metal en la región cráneo expuesto anteromedial con Super Glue. Espere hasta que el pegamento se seque completamente (Figura 2D).
- Eliminar un rectángulo del cráneo, aproximadamente 2 mm x 4 mm para un pescado 6,2 cm. Use un taladro dental con un ~ 0,5 mm de diámetro de la bola molino de punta de carburo para diluir el perímetro del rectángulo. Entonces, usando un escalpelo y pinzas, cortar el perímetro del rectángulo y la cáscara de lejos para exponer el cerebro subyacente. Adicional de perforación o el corte con unas tijeras pequeñas pueden ser necesarias para exponer completamente EL (Figura 2E). Si se produce una hemorragia muscular, se puede utilizar una unidad de electrocauterio.
- Cortar tanto la duramadre (pigmentada) y la piamadre (claro) utilizando tijeras resorte o una aguja y eliminar las porciones cortadas con un par de pinzas. Las porciones anterior y posterior del núcleo exterolateral (EL) son ahora visibles, ELA y ELP, respectivamente (Figura 3A).
4. Etiquetado retrógrada de los axones de interés
- Coloque un manipulador con una aguja tinte recubierto (hecho en el paso 1) por encima de la región de destino que contiene los axones de interest, en nuestro caso ELP.
- Rápidamente inserte la aguja aproximadamente 25 micras en el tejido. Espere 15 a 30 segundos, hasta que el tinte se ha desprendido, y luego retirar la aguja.
- Repita el procedimiento con agujas nuevas adicionales, según sea necesario, colocando cada una en un lugar diferente para que el tinte se distribuye en toda la región de destino. Se utilizó 3-5 agujas por preparación.
- Enjuague el exceso de tinte de la cavidad con solución de Ringer Hickman.
- Esperar al menos 2 horas para la absorción de colorante y el transporte.
5. Visualización de los axones de interés
- Coloque la cámara de grabación, junto con los peces, por debajo del objetivo de un microscopio de epifluorescencia en posición vertical, de una etapa fija. A medida que el cuerpo del pez ocluye penetración de la luz, fuentes de luz blancos y fluorescentes deben venir de arriba. La colocación cuidadosa de una fuente de luz de fibra óptica por encima de la cavidad del cráneo permite que las imágenes campo claro satisfactorios. Para una visualización epifluorescencia, filtro de fluorescenciaespecificaciones deben coincidir con el espectro de absorción / emisión del colorante.
- Cambie la respiración de tanque de agua fresca y mantener la misma velocidad de flujo. Coloque un cable de tierra en la cavidad del cerebro expuesto y conecte a la tierra de la headstage grabación (ver 6.3).
- Coloque un par de electrodos de grabación próximos a la base de la cola y conectarse a un amplificador diferencial y dispositivo de grabación (por ejemplo, monitor de audio, osciloscopio, o un ordenador) para supervisar el comando de descarga órgano eléctrico (EODC). Después de que el pez se recupere de la anestesia, la EODC se puede utilizar como un indicador de la condición del pescado.
- Preparar un boceto a escala de la región del cerebro vieron a bajo aumento. Incluir los vasos sanguíneos principales como puntos de referencia (pueden variar de un pez a) para identificar la ubicación exacta de los axones marcados visibles sólo bajo gran aumento (Figura 3D).
- Confirme la colocación tinte. En primer lugar ver el tejido entero con iluminación de campo claro de orientación ( Figura 3A). Entonces ver con la iluminación fluorescente (Figura 3B). ELP tendrá etiquetado difusa (figuras 3B y 3C). Minimizar excitación de fluorescencia para limitar los efectos fotodinámicos y fototóxico del colorante.
- Utilice los vasos como puntos de referencia para localizar ELA con gran aumento. Ilumine con luz fluorescente, mientras que la búsqueda de un axón marcado cerca de la superficie. (Figura 4).
6. Registrar la actividad extracelular
- Tire de electrodos de registro que aspiran de 1 mm de diámetro exterior, 0,58 mm de diámetro interno capilar de vidrio de borosilicato con filamento. Tamaño de la punta Ideal dependerá del diámetro de los axones de destino, que en nuestro caso es de 0,1-0,2 m 17. Para nuestra aplicación, diámetros de punta de electrodo fueron 1,5 ± 0,4 micras (rango: 1,0-2,4 micras) con un 5 mm de largo, vástago estrecho con el fin de acercarse a los axones marcados sin mover el tejido circundante densamente empaquetadas.
- Rellene electrodos con filtran solución de Ringer Hickman. Pérdida de carga final consejo es 45,2 ± 38,0 mW (rango: 16 a 155 mW).
- Coloque el electrodo en un soporte del electrodo con un puerto de presión y conectarlo a un amplificador de headstage montado en un manipulador. Ejecutar una línea de presión desde el puerto de presión a un final unión en T en un manómetro y una jeringa para el seguimiento y control de la presión, respectivamente.
- Conectar el headstage a un amplificador y un dispositivo de adquisición de analógico a digital.
- Con 30 mbar de presión hacia el exterior en la línea de electrodo, coloque un electrodo al lado de un axón etiquetado. Una cámara de bajo nivel de luz en interfaz con software de imágenes se utiliza para visualizar la colocación pipeta. Comience cerca de la superficie del tejido y hacer avanzar el electrodo hacia el axón. Al acercarse al axón, la presión hacia el exterior debe causar una leve, pero perceptible movimiento del axón.
- Mientras que el electrodo está al lado del axón, (Figura 4A, parte superior) grabar el potenteial en el electrodo durante la presentación de los estímulos de prueba (en nuestro caso, hemos utilizado 100 ms monofásicos pulsos transversales positivos y negativos a una intensidad de 20 mV / cm; Figura 1A). Los potenciales de acción no deben tenerse en cuenta, a pesar de un artefacto eléctrico confirma la correcta grabación / estimulación (Figura 4, abajo).
- Libere la presión hacia el exterior en el electrodo y repetir la estimulación / grabación. Los potenciales de acción no deben todavía ser observados (Figura 4B).
- Aplique ligera (125 ± 25 mbar) aspiración al electrodo de estimulación y / repetición de grabación. Los potenciales de acción ahora deben ser observados en respuesta a la estimulación (Figura 4C). También se puede producir la actividad espontánea. Si no se observan los potenciales de acción, liberar la succión, limpie el electrodo con una ligera presión, mueva el electrodo ligeramente y aspiración vuelva a intentar. Una vez que los potenciales de acción son visibles, cerca de la línea de presión.
- Estimular y registrar comodeseada.
7. Terminación y eliminación
- Una vez que todas las grabaciones deseadas son completa, cambiar a la respiración con 100 mg / L de MS-222 hasta que la EODC se ha detenido. No se EODC debe ser detectado durante al menos 10 minutos.
- Deshágase de los peces según las directrices institucionales y protocolos de cuidado de los animales aprobados.
8. Los resultados representativos
Para nuestra aplicación particular, estamos interesados en el estudio de estímulo de codificación de las neuronas sensoriales centrales. El éxito de las grabaciones de los axones marcados permiten el análisis de las respuestas-de una sola unidad a la estimulación sensorial 18. Figura 5A muestra los potenciales de acción evocados por estimulación representativos electrosensorial transversal usando electrodos bipolares situados en el interior de las paredes izquierda y derecha de la cámara de grabación. Pico de veces pueden presentarse como un ráster parcela espiga (Figura 5B). A ms pre-estímulo viento 25 Grabaciónow demuestra el bajo nivel de actividad espontánea. Este particular ELA "células pequeñas" es largo pasar sintonizado a la duración del estímulo a una intensidad del estímulo de 6 mV / cm, lo que aumenta el número de espigas por repetición a medida que aumenta la duración del estímulo (Figura 5C). La media del primer pico de latencia es de 4,28 ± 0,16 ms, en consonancia con la latencia esperada de células pequeñas en ELA 11.
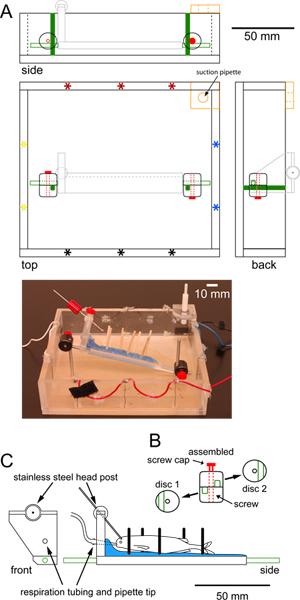
Figura 1. Especificaciones para una cámara de registro que puede caber debajo del objetivo de un microscopio de epifluorescencia etapas fijo. (A) a la cámara de escala de registro cuadrada hecha de plexiglás que muestra vistas superior, lateral y trasera. Conjuntos emparejados de electrodos de estimulación (asteriscos) en la periferia permiten ya sea transversal (rojo-negro) o la estimulación longitudinal (azul-amarillo). Una pieza adicional de plexiglás en la esquina, con un agujero revestido de goma en el centro (naranja),sostiene una pipeta de succión que mantiene un nivel de agua constante. Dos postes de acero inoxidable verticales atornillados en la parte inferior de la cámara (de color verde) se conectan a los postes de acero inoxidable (línea verde) conectados a la plataforma de apoyo a los peces (gris claro, detallado en C) por medio de abrazaderas de discos ajustables. Una fotografía de la cámara se muestra a continuación el dibujo a escala. (B) vistas individuales y montados de las abrazaderas circulares disco de plástico utilizados para fijar la plataforma a los postes verticales. Cada pinza disco tiene una ranura (verde) de un poste y un agujero central para el tornillo de apriete. Abrazaderas de disco son girados por lo que las ranuras son perpendiculares entre sí. Apriete las abrazaderas de tornillo (rojo) de los puestos en el lugar para evitar nuevos verticales y el movimiento de rotación de la plataforma. (C) vistas a escala frontal y lateral de la plataforma de plexiglás se utiliza para mantener el pescado en su lugar. La plataforma está cubierta con una capa de cera de parafina (azul) que contiene Dowe de maderals (barras negras) para apoyar a los peces. Los tubos para respirating el pescado pasa a través de un agujero en la "cabecera" de la plataforma y termina en una punta de pipeta colocada en la boca del pez. Un puesto de cabeza de acero inoxidable (barra gris) se conecta a la plataforma a través de una articulación de rótula que permite la rotación de 360 grados. Montantes horizontales de acero inoxidable (verde) se enroscan en los extremos de la plataforma. Haz clic aquí para ver más grande la figura .
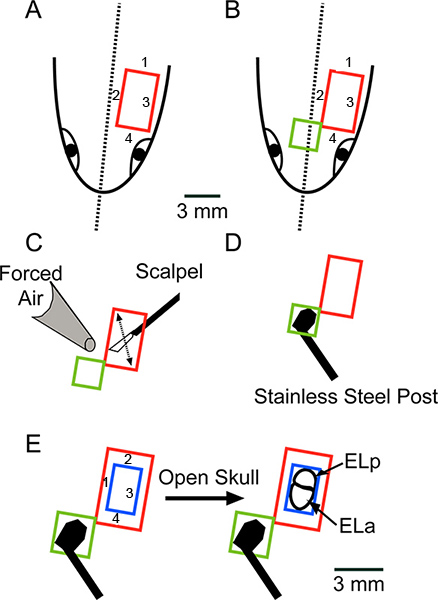
Figura 2. Esquema general de la cirugía mirando hacia abajo en la superficie dorsal de la cabeza. (A) Hacer cuatro cortes, en el orden indicado, para remover una pieza rectangular de la piel (color rojo). (B) Amplíe la apertura anteromedialmente quitar una pieza rectangular adicional de la piel (color verde). (C) Raspe la grasa o ligamentos restantesmover la hoja de bisturí tal como se indica por la flecha y secar la superficie completamente con Kimwipes y aire forzado. (D) Pegamento un poste de acero inoxidable para el cráneo usando Super Glue. Barra de escala en A se aplica a AD. (E) Use un taladro dental para hacer cuatro cortes, en el orden indicado, para remover una pieza rectangular de hueso (azul), la exposición de los núcleos exterolateral anterior y posterior (ELA y ELP, respectivamente) . Haga clic aquí para ver más grande la figura .
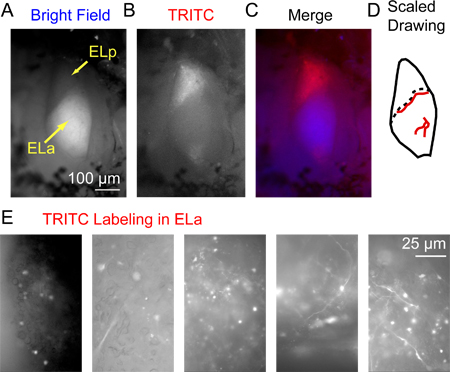
Figura 3. Etiquetado fluorescente en el núcleo exterolateral posterior 3 horas después de la inyección de dextrano conjugado con Alexa Fluor 568. (A) Los núcleos exterolateral anterior y posterior (ELA y ELP, respectivamente) visualizado con iluminación de campo brillante desde arriba. Notaque la amplia mielinización en ELA le da un aspecto relativamente brillante que la distingue de ELP. (B) La misma zona visualizada usando epifluorescencia visto a través de un filtro TRITC. (C) Una imagen combinada con azul de A (campo claro) y rojo para el B (TRITC). (D) Ejemplo de un dibujo a escala de ELA y ELP incluyendo los vasos sanguíneos principales (líneas rojas) que se pueden utilizar como puntos de referencia para identificar la ubicación exacta de los axones marcados visibles sólo bajo una gran ampliación (la ubicación exacta de los vasos sanguíneos varía de un pez a otro). La línea punteada indica la frontera entre el ELA y ELP. (E) muestra imágenes adquiridas utilizando un filtro TRITC de 5 preparaciones diferentes que ilustran una variedad de patrones de etiquetado de éxito de los axones de células pequeñas y somas en ELA.
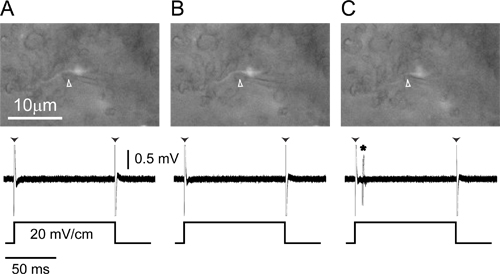
La Figura 4. Individual-unidad de registro extracelulara partir de un axón marcado. (A) electrodo de grabación (cabeza de flecha) bajo presión positiva coloca adyacente a un axón de células pequeñas marcado en ELA (parte superior) registra sólo artefacto borde (cabezas de flecha) en respuesta a un 100 mseg 20 mV / cm monofásicos, , pulso cuadrado transversal contralateral-positivo (parte inferior). (B) Liberación de presión hacia el exterior desde el electrodo (punta de flecha) hace que el axón se mueva ligeramente hacia el electrodo (arriba), pero todavía no hay respuestas a los estímulos (abajo). ( ahora C) una ligera presión negativa tira del axón en el electrodo (superior, cabeza de flecha) y los potenciales de acción en respuesta a la aparición de estímulo son visibles (abajo, asterisco). Partes inferiores de los tres paneles son respuestas superpuestas a 20 repeticiones del estímulo.
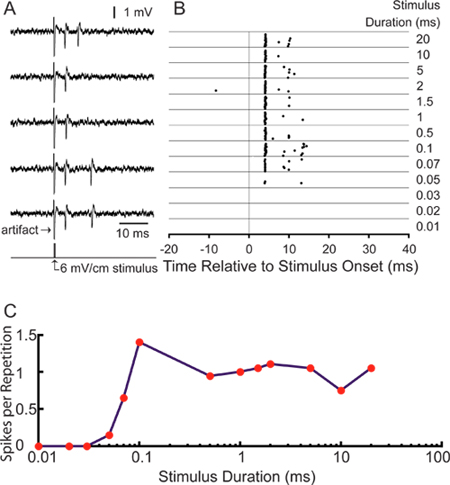
Figura 5. Los resultados representativos que utilizan esta técnica. (A) 5 rastros de muestraque muestra los potenciales de acción evocados por un 0,1 mseg 6 mV / cm monofásicos,, estímulo pulso cuadrado transversal contralateral-positivo. (B) Raster gráfico que muestra tiempos de pico durante 20 repeticiones de una ventana de grabación 75 mseg para la misma unidad estimulada en el tiempo 0 con 6 mV / cm estímulos en el rango de duraciones que figuran a la derecha. (C) Duración curva de afinación cuantificar las respuestas que aparecen en la trama como espigas por estímulo repetición.
| Masa (g) | Tenedor Largo (cm) | Profundidad del cuerpo (cm) | |
| Significar | 2.42 | 6.20 | 1.14 |
| Desviación Estándar | 0.64 | 0.52 | 0.18 |
| Alcance | 1.2-4.0 | 5.5 a 8.4 | 0,9-1,6 |
Tabla 1. Optimalpeso, longitud y profundidad que oscila del cuerpo de los peces. peso óptimo, la longitud tenedor (la punta del hocico hasta el tenedor de la aleta caudal) y el cuerpo de la profundidad (máxima distancia dorso-ventral en el plano transversal) va permitiendo a los peces como para caber en la cámara de grabación se ilustra en la Figura 1. Los peces que son demasiado pequeños puede ser menos propensos a sobrevivir a la cirugía y tendrá una pequeña ELP, por lo que la colocación de tinte desafiante. Los peces que son demasiado grandes tendrá un gran cerebelo, más de gran alcance que reducirá el acceso a ELA y ELP y puede evitar la reducción de la potencia, el objetivo de alta inmersión en agua lo suficientemente cerca como para centrarse en ELA y ELP.
| Lugar de la aplicación | Tinte Tipo | Fish intentó | Etiqueta en ELA | Etiqueta en la ELP | Unidades intentaron | Grabaciones |
| ELun | Alexa Fluor inyección | 32 | 26 (81,2%) | 19 (59,4%) | 50 | 4 (8,0%) |
| ELA | Alexa Fluor papel de filtro empapado | 1 | 0 | 0 | 0 | 0 |
| ELA | Di-I en DMSO | 8 | 6 (75,0%) | 0 | 0 | 0 |
| ELA | Cristales Di-O | 5 | 3 (60,0%) | 2 (40,0%) | 9 | 0 |
| ELP | Alexa Fluor cristales sólidos | 2 | 0 | 2 (100%) | 0 | 0 |
| ELP | Alexa Fluor alambres de tungsteno recubiertos | 43 | 29 (67,4%) | 41 (95,3%) | 119 | 26 (21,8%) |
Tabla 2. Las tasas de éxito para cada método de inyección de medio de contraste. Índices de éxito para cada método de inyección de medio de contraste. Los métodos se dividen con base en el sitio de inyección y el tipo de colorante. Para cada método, el número total de peces intentó y el porcentaje de estos experimentos dio como resultado que en el etiquetado éxito en ELA y ELP se muestra. Tenga en cuenta que el área de grabación dirigida es el opuesto de la zona de aplicación (cajas en negrita). Para el sitio de la inyección, la absorción de colorante fue considerada exitosa con el etiquetado de ambos somas y axones. En contraste, en el lugar de grabación, únicamente de preparados con los axones marcados se contaron como experimentos de marcaje con éxito. También se muestra el número total de intentos de unidades y el porcentaje de estas unidades que se tradujo en éxito en las grabaciones.
| # De inyección SItes | Volumen promedio por inyección (l) | Rango de volúmenes por inyección (l) | Volumen de inyección total promedio (l) | Rango del volumen total de inyección (l) | |
| Microinyector con Hamilton | 3 o 4 | 0.144 | 0,091 a 0,91 | 0.516 | 0,378 a 0,669 |
| Nanoinjector con pipeta de vidrio | 2 - 4 | 0.069 (fijo) | Volumen fijo inyecta 1-6 veces | 0.621 | 0,414-0,966 |
| Microinyector con una pipeta de vidrio | 2 - 6 | 0.093 | 0,058-0,202 | 0.360 | 0,252 a 0,540 |
Tabla 3. Las cantidades de colorante aplican para cada uno de los tres métodos que se utilizan para inyectar AlEXA Fluor en ELA Las cantidades de colorante aplicadas para cada uno de los tres métodos que se utilizan para inyectar Alexa Fluor en ELA (primer método de la Tabla 2). Inyección de un contraste en ELA se llevó a cabo tanto con un nanoinjector y un microinyector utilizando un medidor de Hamilton aguja de la jeringa 33 o un vaso tirado pipeta capilar. Hemos variado el número de puntos de inyección, el volumen por inyección y el volumen total de inyección de tinte.
Discusión
Una vez dominado, esta técnica permitirá una para apuntar a las neuronas identificadas, incluyendo los axones individuales en grabaciones in vivo en muchos sistemas modelo. Además, esta técnica permite grabar fiable de salida de pico de las neuronas con características anatómicas únicas que lo hacen tradicional en métodos de grabación que desafían in vivo. Hemos utilizado esta técnica para grabar desde ELA "pequeñas células" en mormyrid peces débilmente eléctrica. Los intentos anteriores para estudiar las propiedades de ajuste de "celdas pequeñas" no tuvieron éxito debido a las condiciones difíciles de grabación 11, 14. Características anatómicas similares crean barreras para obtener grabaciones de una sola unidad de diversos vertebrados y neuronas auditivas electrosensoriales 8-10. Para superar estos retos de nuestro sistema, tomamos ventaja del hecho de que "células pequeñas" son las únicas células en ELA que proyectan a ELP. Por lo tanto, el transporte retrógrado de colorante colocado en ELP limita etiquetado en ELA para "pequeña"somas celulares y axones. etiquetado fluorescente de los axones permite la colocación precisa del electrodo al lado de los axones marcados, por lo que las grabaciones de una sola unidad de células identificadas posibles a pesar de somas inaccesibles. Se intentó grabaciones somáticas, pero no tuvieron éxito, probablemente debido a las sinapsis envolventes alrededor de 11 , 17. Sin embargo, somática etiquetado era claramente visible lo que sugiere que esta técnica podría ser utilizada para orientar grabaciones somáticas en otros tipos de células y otros circuitos. etiquetado fluorescente de las neuronas a través de transporte retrógrado in vivo se ha usado para guiar grabaciones específicas in vitro 19-21 . Una técnica similar se utiliza para dirigido en grabaciones in vivo de las neuronas motoras en la médula espinal pez cebra 22. Nuestro trabajo representa una nueva expansión de este enfoque, en el que tanto el etiquetado y la grabación se realiza in vivo en el cerebro. Nuestro método demuestra que en vivo etiquetado de las áreas del sistema nervioso central con una retrógrada tcorredor se puede ampliar para el estudio de otros circuitos intactos con las neuronas de proyección similar selectivos. Por ejemplo, en el procesamiento auditivo mamífero, el colículo inferior (CI) sirve como un centro de retransmisión importante para las entradas de múltiples estructuras rhombencephalic 23. Inyección de un contraste en el IC se etiquete selectivamente las células de proyección de cada uno de estos núcleos. El colículo superior (SC) cumple una función similar para la visión 24. Preparaciones de médula espinal son particularmente adecuados para esta técnica, como la médula espinal es de fácil acceso, la inyección de medio de contraste puede ocurrir lejos del sitio de registro, y que se pueden combinar con el registro intracelular y el llenado de las neuronas seleccione para adquirir información más detallada anatómica 25. Finalmente, el trazado de las vías es una técnica bien establecida usada en todo el sistema nervioso central para asignar circuitos complejo 26. Nuestro método se puede utilizar para añadir información funcional a estos estudios como se ha hecho windicadores sensibles al calcio ith de gato corteza visual 27.
La cirugía, que está bien establecida, fiable, y se usa regularmente para ciego in vivo grabaciones 16, debe ser completada con un sangrado mínimo y ningún daño a la superficie del cerebro para permitir que el animal y el tejido para sobrevivir. Con la práctica, la aplicación de la cirugía y el tinte se puede completar en 30-45 minutos. Hemos marcado con éxito "pequeñas células" axones en el 67% de las preparaciones. La mayoría de las preparaciones de tener sólo 1 o 2 axones marcados visibles, pero algunos tienen el mayor número 8. De las 119 unidades etiquetadas intentos, se obtuvo grabaciones de una sola unidad de 26 unidades distribuidas en 12 preparaciones (Tabla 2). Por lo tanto, los datos se obtuvieron de 41% de las preparaciones con axones etiquetados para una tasa de éxito del 28%.
El aspecto crítico de la aplicación de tinte es el etiquetado profundidad. Poca inserción del alambre de tungsteno dará lugar a que el colorante de ser lavada away. Sin embargo, si la penetración es demasiado profunda, los axones marcados no serán visibles para la orientación. Además, algunos daños mecánicos en la celda debe ocurrir para que el medio de contraste para ser tomada adecuadamente hasta 25, 28. Sin embargo, demasiado daño matará a las células. Hemos intentado marcar con otros tintes y otros métodos (Tabla 2), incluido el etiquetado anterógrada a través de inyección de tinta en ELA junto con la grabación de los axones marcados en ELP (Tabla 3). Nuestra hipótesis es que el etiquetado anterógrada no tuvo éxito porque el etiquetado se limita a las células con daños somáticos, por lo que no responde. Además, los terminales presinápticos pueden haber sido perturbado. Por el contrario, el etiquetado retrógrada minimiza tanto de estas preocupaciones. La cantidad y la ubicación de la aplicación del colorante pueden ser modificados de acuerdo con el circuito particular que está siendo estudiado. Etiquetado máxima se produce con la mayor concentración de colorante, lo que hemos logrado con alambres de tungsteno recubiertas. Sin embargo, para la rotulación de los axones conproyecciones ep, colorante podrían salir de una aguja de tungsteno, ya que es avanzado. En estos casos, la inyección de presión sería más apropiado. La absorción de colorante y el transporte son rápidos, con los axones marcados en nuestra preparación son visibles tan temprano como 2 horas después de la inyección y los axones marcados adicionales que aparecen tan tarde como 6 horas después de la inyección. Por lo tanto, el etiquetado y registro pueden llevarse a cabo en un solo día, la eliminación de dificultades técnicas asociadas con la cirugía de la supervivencia. El tiempo variará para cada aplicación en función de la distancia necesaria para el transporte de tinte.
Otro aspecto crítico es la colocación de electrodos. Es importante para entrar en el tejido cerca del sitio del axón marcado para evitar la obstrucción de la punta. Para tejido denso como en ELA, un largo, pierna delgada en el electrodo de registro minimiza el movimiento excesivo de los tejidos circundantes. Si una grabación correcta no se consigue en el primer intento, repita con electrodos frescos hasta que se obtiene una grabación o el TISSue se interrumpe hasta el punto en el que el axón es ya no es visible. Sin embargo, también es importante para colocar rápidamente el electrodo al lado del axón para reducir al mínimo la cantidad de exposición fluorescente, que puede causar fototoxicidad, blanqueo y puede afectar a las propiedades fisiológicas de la célula 29-31.
Una vez que un segmento de axón se filtra con succión con éxito en el electrodo de registro, las grabaciones se puede conseguir por varias horas. Si las unidades se pierden constantemente en menos de 1 hora, considerar la posibilidad de puntas de los electrodos más pequeños para prevenir el axón se deslice fuera. Por otra parte, demasiado pequeño de una punta puede dar lugar a la obstrucción, baja relación señal-ruido, o daños en el axón. Una disminución constante de la amplitud de la espiga y el "retorno" de una unidad con succión adicional es una indicación de que la punta es demasiado grande. El exceso de aspiración puede causar daños irreparables en el axón. Una solución es permitir que una pequeña fuga en la línea de aire para que la presión lentamente vuelve a cero. Rápidamente igualar ªpresión e dará lugar a un "empuje" relativa-transitoria de salida que puede expulsar al axón.
Aunque esta técnica representa una gran ventaja para la obtención de grabaciones específicas de las neuronas de proyección identificados, no será útil para distinguir interneuronas locales, como colorante estaría ocupado por todos los tipos de células en el sitio de la inyección. Teóricamente, el uso de múltiples fluoróforos con distintos lugares de inyección puede permitir que este método se expanda. Por ejemplo, la comparación de un solo frente de doble etiquetado podría ser utilizado para distinguir interneuronas de las neuronas de proyección después de las inyecciones de doble en dos puntos en el circuito 32. Del mismo modo, los trazadores retrógrados se pueden combinar con otras técnicas de imagen avanzadas, tales como la imagen de dos fotones, como se hizo recientemente en el centro de Vocal zebra finch High (HVc) 32. Además, las regiones de grabación se limitan a los que están cerca de la superficie cuando se utiliza microscopios de epifluorescencia, ya que sólo hemos sido capaces de resolver 1 μ estructuras m dentro de los primeros 30 micras de tejido. Sin embargo, esta profundidad se podría extender a través de la utilización de otras técnicas de microscopía, como la microscopía de dos fotones 33 u objetivo-junto microscopía de iluminación plana 34. En general, esta técnica representa un avance importante en el estudio de los circuitos neuronales in vivo, ya que puede ser utilizado para grabar desde las neuronas individuales en muchos circuitos diferentes en una variedad de sistemas de modelos - incluyendo aquellos que son relativamente inaccesibles.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los fondos de la Fundación Nacional para la Ciencia (IOS-1050701 a BAC), los Institutos Nacionales de Salud (NS54174 a SM y F30DC0111907 de AML-W.), La Fundación Uehara Memorial de la Sociedad Japonesa para la Promoción de la Ciencia (G2205 a los conocimientos tradicionales ). Damos las gracias a Julian Meeks por su apoyo y orientación sobre el tema de las grabaciones extracelulares axonal. Damos las gracias a Carl Hopkins para proporcionar una cámara de registro prototipo.
Materiales
| Name | Company | Catalog Number | Comments |
| Tricaine Methanesulfonate | Sigma-Aldrich | E10521 | MS-222 |
| Gallamine Triethiodide | Sigma-Aldrich | G8134 | Flaxedil |
| Lidocaine Hydrochloride | Sigma-Aldrich | L5647 | |
| Hickman’s Ringer Solution | NA | NA | NaCl (6.48 g/l), KCl (0.15 g/l), CaCl2•2H20 (0.29 g/l), MgSO4 (0.12 g/l), NaHCO3 (0.084 g/l), NaH2PO4 (0.06 g/l) |
| Peristaltic Pump | Gilson or Rainin | Minipulse 3 Model 312; RP-1 | 10.0 ± 1.0 rpm, Alternatively, a gravity-fed line with a flow-meter |
| Dissection Microscope | Nikon | SM2645 | |
| Super Glue | Super Glue Corporation | SGH2 | 2g tube |
| Omni Drill 35 | World Precision Instruments | 503-598 | |
| Ball Mill Carbide Drill Bit #1/4 | World Precision Instruments | 501860 | 0.19 DIA (bit diameter = 0.48 mm) |
| Low Temp Cautery Kit | World Precision Instruments | 500391 | |
| Manual Micromanipulator | World Precision Instruments | M3301R | |
| Dextran Conjugated Alexa Fluor 568 | Invitrogen | D-22912 | 2mM concentration; 10,000MW The choice of dye wavelength should be selected to match the microscope filter settings |
| Epifluorescent Microscope | Nikon | E600 FN | A remote focus accessory is helpful for fine focus TRITC filter - or appropriate filter to match focal planes for different dye wavelengths |
| Low Power Objective | Nikon | 93182 | CFI Plan Achromat Series, 4X N.A. 0.1, W.D. 30mm |
| High Power Objective | Nikon | 93148 | CFI Fluor Series, 40X WI N.A. 0.8, W.D. 2.0 mm |
| White Light Source | Dolan-Jenner | Model 190 | Fiber Optic Illuminator |
| Fluorescent Light Source | Lumen Dynamics | X-Cite 120Q | |
| Low-light Level Camera | Photometrics | CoolSnap ES | |
| Digital Manometer | Omega Engineering | HHP-201 | |
| Motorized Micromanipulator | Sutter Instruments | MP-285 | |
| Headstage | Molecular Devices | CV-7B | Axon Instruments |
| Amplifier | Molecular Devices | MultiClamp 700B | Axon Instruments |
| Data Acquisition System | Molecular Devices | Digidata 1322A | Axon Instruments |
| Isolated Pulse Stimulator | A-M Systems | 2100 | |
| Flaming/Brown Micropipette Puller | Sutter Instruments | P-97 | Program settings for our application: Heat: ramp + 1, Pull: ’0’, Velocity: 60, Time: 90 Box filament |
| Pipette Glass | World Precision Instruments | 1B100F-4 | Borosilicate capillary glass with filament (1 mm OD, 0.58 mm ID) |
Referencias
- Meeks, J. P., Jiang, X., Mennerick, S. Action potential fidelity during normal and epileptiform activity in paired soma-axon recordings from rat hippocampus. J. Physiol. 566, 425-441 (2005).
- Pinault, D. A novel single-cell staining procedure performed in vivo under electrophysiological control: morpho-functional features of juxtacellularly labeled thalamic cells and other central neurons with biocytin or Neurobiotin. J. Neurosci. Methods. 65, 113-136 (1996).
- Joshi, S., Hawken, M. J. Loose-patch-juxtacellular recording in vivo--a method for functional characterization and labeling of neurons in macaque V1. J. Neurosci. Methods. 156, 37-49 (2006).
- Margrie, T. W. Targeted whole-cell recordings in the mammalian brain in vivo. Neuron. 39, 911-918 (2003).
- Lima, S. Q., Hromádka, T., Znamenskiy, P., Zador, A. M. PINP: A new method of tagging neuronal populations for identification during in vivo electrophysiological recording. PLoS One. 4, e6099(2009).
- Foust, A., Popovic, M., Zecevic, D., McCormick, D. A. Action potentials initiate in the axon initial segment and propagate through axon collaterals reliably in cerebellar Purkinje neurons. J. Neurosci. 30, 6891-6902 (2010).
- Lehman, M. N. Herpes simplex virus as a transneuronal tracer. Neurosci. Biobehav. Rev. 22, 695-708 (1998).
- Joris, P. X. A dogged pursuit of coincidence. J. Neurophysiol. 96, 969-972 (2006).
- Heiligenberg, W., Rose, G. Phase and amplitude computations in the midbrain of an electric fish: Intracellular studies of neurons participating in the jamming avoidance response of Eigenmannia. J. Neurosci. 5, 515-531 (1985).
- Morales, E. Releasing the peri-neuronal net to patch-clamp neurons in adult CNS. Pflügers Archiv European J. Physiol. 448, 248-258 (2004).
- Friedman, M. A., Hopkins, C. D. Neural substrates for species recognition in the time-coding electrosensory pathway of mormyrid electric fish. J. Neurosci. 18, 1171-1185 (1998).
- Hitschfeld, ÉM., Stamper, S. A., Vonderschen, K., Fortune, E. S., Chacron, M. J. Effects of restraint and immobilization on electrosensory behaviors of weakly electric fish. ILAR. J. 50, 361-372 (2009).
- Xu-Friedman, M. A., Hopkins, C. D. Central mechanisms of temporal analysis in the knollenorgan pathway of mormyrid electric fish. J. Exp. Biol. 202, 1311-1318 (1999).
- Amagai, S., Friedman, M. A., Hopkins, C. D. Time coding in the midbrain of mormyrid electric fish. I. Physiology and anatomy of cells in the nucleus exterolateralis pars anterior. J. Comp. Physiol. A: Neuroethol Sens Neural. Behav. Physiol. 182, 115-130 (1998).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull World Health Organ. 2, 143-144 (1965).
- Carlson, B. A. Temporal-pattern recognition by single neurons in a sensory pathway devoted to social communication behavior. J. Neurosci. 29, 9417-9428 (2009).
- Mugnaini, E., Maler, L. Cytology and immunocytochemistry of the nucleus extrolateralis anterior of the mormyrid brain: possible role of GABAergic synapses in temporal analysis. Anat Embryol. (Berl). 176, 313-336 (1987).
- Kohashi, T., Lyons-Warren, A. M., Mennerick, S., Carlson, B. A. Detection of submillisecond spike timing differences based on delay-line anticoincidence detection. J. Neurophysiol. 110, 2295-2311 (2013).
- Colin, W., Donoff, R. B., Foote, W. E. Fluorescent latex microspheres as a retrograde tracer in the peripheral nervous system. Brain Res. 486, 334-339 (1989).
- Katz, L. C., Burkhalter, A., Dreyer, W. J. Fluorescent latex microspheres as a retrograde neuronal marker for in vivo and in vitro studies of visual cortex. Nature. 310, 498-500 (1984).
- Brown, S. P., Hestrin, S. Intracortical circuits of pyramidal neurons reflect their long-range axonal targets. Nature. 457, 1133-1136 (2009).
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J. Neurosci. Methods. 88, 1-13 (1999).
- Pollak, G. D., Burger, R. M., Klug, A. Dissecting the circuitry of the auditory system. Trends Neurosci. 26, 33-39 (2003).
- Wurtz, R. H., Albano, J. E. Visual-motor function of the primate superior colliculus. Annu. Rev. Neurosci. 3, 189-226 (1980).
- O'Malley, D. M., Zhou, Q., Gahtan, E. Probing neural circuits in the zebrafish: a suite of optical techniques. Methods. 30, 49-63 (2003).
- Vercelli, A., Repici, M., Garbossa, D., Grimaldi, A. Recent techniques for tracing pathways in the central nervous system of developing and adult mammals. Brain Res. Bull. 51, 11-28 (2000).
- Ohki, K., Chung, S., Ch'ng, Y. H., Kara, P., Reid, R. C. Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex. Nature. 433, 597-603 (2005).
- Gahtan, E., O'Malley, D. M. Rapid lesioning of large numbers of identified vertebrate neurons: applications in zebrafish. J. Neurosci. Methods. 108, 97-110 (2001).
- Higure, Y., Katayama, Y., Takeuchi, K., Ohtubo, Y., Yoshii, K. Lucifer Yellow slows voltage-gated Na+ current inactivation in a light-dependent manner in mice. J. Physiol. 550, 159-167 (2003).
- Mennerick, S. Diverse voltage-sensitive dyes modulate GABAA receptor function. J. Neurosc. 30, 2871-2879 (2010).
- Oxford, G. S., Pooler, J. P., Narahashi, T. Internal and external application of photodynamic sensitizers on squid giant axons. J. Membr. Biol. 36, 159-173 (1977).
- Roberts, T. F., Tschida, K. A., Klein, M. E., Mooney, R. Rapid spine stabilization and synaptic enhancement at the onset of behavioural learning. Nature. 463, 948-952 (2010).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados