需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
单卵母细胞的亚硫酸氢钠诱变
摘要
亚硫酸氢钠诱变是分析DNA甲基化的黄金标准。我们修改后的协议允许在单细胞水平和DNA甲基化分析,是专门设计为个别的卵母细胞。它也可以用于卵裂阶段的胚胎。
摘要
表观遗传学包括所有遗传和可逆的修改,染色质改变基因的辅助功能,从而调节基因转录1的主要机制。 DNA甲基化是表观遗传修饰作用主要是为镇压商标。通过共价除了到CpG二核苷酸的胞嘧啶甲基组,它可以聘请额外的镇压蛋白和组蛋白修饰,启动过程冷凝染色质和基因沉默2。 DNA甲基化是必不可少的正常发展,因为它起着关键作用,在发展规划,细胞分化,逆转录病毒分子的镇压,X染色体失活和基因组印记。
DNA甲基化分析的最有力的方法之一是亚硫酸氢钠诱变。亚硫酸氢钠是一种DNA诱变,deaminates胞嘧啶为uracils的。经过PCR扩增和seque ncing,这些转换事件被检测为胸腺嘧啶。甲基化的胞嘧啶脱氨和保护,从而继续为胞嘧啶,使单个核苷酸的3级鉴定的DNA甲基化。先进的亚硫酸氢钠诱变法的发展已经从最初报告对那些更敏感和重复性7 4-6。一个关键的进步是在琼脂糖珠嵌入少量的DNA,从而保护了苛刻的亚硫酸氢钠治疗8 DNA。这使甲基化分析,对卵母细胞和囊胚阶段的胚胎,9池进行。最先进的亚硫酸氢钠诱变协议日期是10个人囊胚阶段的胚胎。然而,由于囊胚平均64个单元(含120-720 PG基因组DNA),这个方法是不是个别的卵母细胞或卵裂期胚胎的甲基化研究有效。 帐篷“从琼脂糖嵌入包括卵母细胞11分钟的DNA金额以线索,在这里,我们提出了卵母细胞,即是直接嵌入在琼脂糖和裂解液珠紧随其后的检索和卵母细胞的透明带去除的方法,这使我们能够绕过单卵母细胞的亚硫酸氢钠诱变的两个主要挑战:保护的DNA微量降解,并在随后的众多协议的步骤的损失,更重要的是,从单一的卵母细胞获得的数据作为PCR泳池内的偏见问题被淘汰此外。 ,不慎卵丘细胞污染是用这种方法检测,可从分析12排除,因为任何一个以上的甲基化模式的样本。该协议提供了一个在单细胞水平上的成功和可重复性的DNA甲基化分析方法的改进非常适合个别的卵母细胞以及卵裂期胚胎。
研究方案
第1天
GIBCO公司的水,如用无菌蒸馏水,准备当天收集的卵母细胞的新鲜以下的解决方案。为了减少DNA污染的机会,经常更换手套,并使用过滤嘴。保持管的角度离开时开放,并在不使用时,回顾一下所有的管子。我们建议的解决方案为N +1。
3%低熔点琼脂糖
30毫克低熔点(LMP)的琼脂糖
1毫升GIBCO公司H 2 O
溶于70°C间
裂解液
8μL裂解液
1μL蛋白酶K
1μl的10%IGEPAL
冰的地方,直到准备使用
2:1琼脂糖: 裂解液 (10μL每个卵母细胞,金额为3卵母细胞)
20微升3%低熔点琼脂糖
10μL裂解液
混合@ 70°C间
SDS LYSIS缓冲区(每个卵母细胞501μL)
| 1X TE的pH值7.5 | 450μL |
| 10%SDS | 50μL |
| 蛋白酶K | 1μL |
| 501μL |
1。卵母细胞的采集
- 将在M2媒体解剖小鼠输卵管,撕壶腹提取的卵丘细胞复杂。
- 分离的卵母细胞的卵丘细胞,用0.3毫克/毫升在30μL的M2媒体下降的透明质酸解复杂。 ,因为它需要取出卵丘细胞,长时间暴露可能会损害他们只要保持在溶液中的卵母细胞。 M2的媒体在30μL下降3倍,定期去除卵丘细胞的卵母细胞的洗净。
- 取下透明带用酸性台氏的解决方案。首先将30μL溶液滴的卵母细胞,然后转移到另外30个降微升,为沿线进行任何媒体将稀释胃酸,并降低其效率。只要删除透明,长时间暴露可能会损害他们保持在溶液中的卵母细胞。注:酸性台氏液,或蛋白酶浓度的增加,可用于人体标本,为人类的透明带酸性台氏的解决方案比鼠标更耐治疗。
- 洗一次在30μL的M2媒体下降的卵母细胞。
2。琼脂糖嵌入和裂解
- 执行琼脂糖嵌入,放置在70℃heatblock裂解液。预热低熔点琼脂糖加入裂解液,生产2:1琼脂糖:裂解液。
- 最小的M2的媒体在洁净的载玻片上放置一个单卵母细胞。到枪头,以10μL琼脂糖:裂解液,并在显微镜下轻轻驱逐少量(1μL或更少)的玻片上,允许它与微量混合人的媒体。轻轻一挑到枪头的卵母细胞,并把所有10μL与300μL矿物油Eppendorf管,珠形成的球体。
注意:此过程中,必须做得相当迅速的琼脂糖会变硬,如果温度降到低至5℃以下,70°C - 在冰上孵育10分钟管。执行裂解,取出300μL矿物油,并加入500μLSDS裂解液。在50℃水浴中孵育过夜。
注:裂解液( 见表1),也可用于这一目的。
第2天
准备天的亚硫酸氢钠诱变的新鲜以下解决方案。为了减少DNA污染的机会,经常更换手套,并使用过滤嘴。保持管的角度离开时开放,并在不使用时,回顾一下所有的管子。我们建议的解决方案为N +1。
| 3 M氢氧化钠 | 2.4克氢氧化钠20毫升蒸压DDH 2 |
| 0.1 M氢氧化钠 | 0.5毫升,14.5毫升蒸压DDH 2 O的 3M |
| 0.3 M氢氧化钠 | 3M在13.5毫升蒸压DDH 2 O的 1.5毫升 |
2.5米硫酸氢钠溶液
- 3.8克亚硫酸氢钠
5.5毫升GIBCO公司蒸馏水H 2 O
1毫升3 M氢氧化钠
解散@室温 - 110毫克对苯二酚
1毫升GIBCO公司蒸馏水H 2 O
解散@ 90℃(只只要需要解散,定期混合)
当完全溶解,混合溶液(a)和(二)
远离光*
3。亚硫酸氢钠诱变
- 完全消除500μLSDS裂解液加入300μl的矿物油(约20小时)。任何剩余裂解液稀释日é琼脂糖当它被加热和珠会更容易溶解在随后的步骤。立即着手与亚硫酸氢钠诱变,或在-20°C存储长达5天。
- 如果适用,从冷冻卵母细胞,并让解冻(仅直到琼脂糖珠是相对半透明)。孵育90℃加热块2.5分钟后,冰上孵育10分钟。
注意:不要混合或搅拌均匀,延长时间超过2.5分钟,或波动的温度。 - 执行变性,去除矿物油,并添加1毫升0.1M氢氧化钠每个管,轻弹和反转的5-6倍。
- 孵育15分钟,在37℃水浴,反相每隔3-4分钟。珠应漂浮在氢氧化钠。
- 执行重亚硫酸盐处理,管轻轻旋转,然后取出NaOH和加入300μl的矿物油和500μL亚硫酸氢钠溶液。管在50℃水浴孵育3.5小时*远离光*
注:潜伏期长,可能需要经验感兴趣的基因决定的。 - 上冰执行desulfonation,孵育3分钟,然后取出矿物油和亚硫酸氢钠溶液,轻轻地旋转,并添加1毫升0.3 M氢氧化钠。弗里克和反转的5-6倍。
- 孵育15分钟,在37℃水浴,反相每隔3-4分钟。珠应漂浮在氢氧化钠。
- 样品洗净,先纺纱轻轻,然后取出氢氧化钠,加1毫升1X TE的pH值7.5。摇5-10分钟,在室温下(振动筛)。再次旋转轻轻地,然后取出1倍TE。重复此洗涤过程中的两倍。
- 1毫升蒸压DDH 2 O摇5-10分钟,在室温下(振动筛)。旋转轻轻地,然后取出H 2 O重复DDH 2Ø洗两次。
- 检查上清液的pH值,它应该是pH值5.0。如果还是太基本,洗一次与H 2 O删除所有上清液,留下只有琼脂糖是广告。
4。 第一和第二轮PCR扩增
- 而洗衣机**准备第一轮PCR混合物**
| 10μM的底漆远期外 | 0.5μL |
| 10μM的引物反外 | 0.5μL |
| 240毫微克/毫升的tRNA | 1μL |
| H 2 O | 13μL |
加入插图准备走热启动PCR珠
小心滑入了坚实的琼脂糖珠(10μL)的PCR管
加热到70°C和混合
中加入25μl的矿物油
总计:50μL
- 放大
注:鼠标SNRPN循环条件的一个例子是变性2分钟,94℃,周期为30秒40在94℃,在50°C 1分钟,1分钟在68°C,在68分钟的最后10延伸°C。 第一轮PCR鼠标的H19和PEG3退火温度为50°C。 - 准备第二轮PCR混合物
| 10μM的底漆转发内蒙古 | 0.5μL |
| 10μM的引物反内蒙古 | 0.5μL |
| H 2 O | 19μL |
加入插图准备走热启动PCR珠
加入5μL作为模板第一轮产品。 第一轮产品加热至70℃,1分钟软化琼脂糖。一定要吸取下面的一层矿物油。
中加入25μl的矿物油
总计:50μL
注:SNRPN,H19的,PEG3嵌套引物序列,可以发现,在市场Velker 等 1012。
- 放大
注:鼠标SNRPN循环条件是变性2分钟,94°,周期为30秒40,在94℃,50℃,1分钟和1分钟,68℃;和最后10分钟的伸长第一步在68°C 10。鼠标的H19和PEG3要求在50°C退火温度为第二轮PCR。 - 作为一个诊断测试,第二轮的样品可以是甲基化或具体应变与限制性内切酶切割。
| 第二轮产品 | 4μL |
| 限制性内切酶 | 1μL |
| 缓冲 | 1μL |
| H 2 O | 4μL |
- Electrophorese 8%丙烯酰胺凝胶上的消化产品。任何异构带代表一个以上的sequeNCE。
5。 TA克隆和菌落PCR
- 克隆第二轮的产品,先加热到70°C下1分钟软化琼脂糖,然后结扎到载体使用Promega公司的pGEM-T载体系统(尔科技猫#A1360)。
| 第二轮PCR | 1μL |
| pGEMT-Easy载体 | 1μL |
| 连接酶 | 1μL |
| H 2 O | 2μL |
| 2X结扎缓冲器 | 5μL |
酝酿过夜@ 4°C的PCR仪。
- 在冰上解冻主管大肠杆菌细胞(Zymo研究公司猫#T3009)15分钟。加入3μL8μL 大肠杆菌孵育15分钟冰结扎结扎反应。
- 热休克40秒,在42℃水浴,孵育2分钟冰。在37°C,1小时(振动筛)加入60μLSOC培养基孵育。
- 所有的反应混合物放置在LB /琼脂/的IPTG / Xgal /放板与板在37℃过夜孵育。
- 准备菌落PCR组合
| 20μM的M13正向引物 | 0.7μL |
| 20μM的M13反向引物 | 0.7μL |
| 的5X绿围棋的Taq缓冲 | 7.0μL |
| 10毫米的dNTP | 0.7μL |
| Taq DNA聚合酶 | 0.28μL |
| H 2 O | 25.62μL |
| 35μl总 |
添加到PCR管35μL菌落PCR预混。从板块与枪头,和漩涡PCR反应挑白色菌落。
- 放大变性10分钟,94°,周期为45秒30紧随其后94°C间,30秒57°C间,1分钟,72°C,和最后的10分钟延伸72°C。 Electrophorese 4微升1.5%琼脂糖凝胶上。发送〜30μl的PCR产物测序。
注:对于卵母细胞,5菌落PCR产物测序。 - 一旦得到测序结果,甲基化模式可以读取。任何原创CG,仍然作为一个CG甲基化,甲基化任何原创CG,也就是现在的Tg。
6。代表结果
在我们的工作中,我们检测的烙印在个别卵母细胞和胚胎(图1)的甲基化。使用硫酸氢钠转化引物的巢式PCR扩增,这是可以确认转换成功,通过可视化琼脂糖凝胶电泳(图2)正确的片段大小。个别的卵母细胞代表一个父母的基因,并在理论上,有一个印记的甲基化模式。因此,第二轮PCR产物可以测试无意污染。可以使用到DNA甲基化(HinfI或DpnII)敏感的限制性内切酶消化的第二轮PCR产物,以评估它是否包含一个甲基化或甲基化等位基因(图3)。内酶识别序列的甲基化的C被切割甲基化的C,它被转换为T时,不再承认酶,是完整无缺。任何含有甲基化和甲基化等位基因的MII卵母细胞样本应该被丢弃,因为它表明卵丘细胞污染(图3)。连接和转化,成功的菌落PCR扩增琼脂糖凝胶可以可视化,以确保正确的产品大小的样品进行测序发送(图4)。最后,五个人CL序列由一个MII卵母细胞的产生5个相同的甲基化模式和的相同nonCpG转换率(图5a)。应放弃任何包含多于一个模式的样本(图5b)。由于排卵的卵母细胞有两个染色体副本或附加极体,有可能获得两个类似的序列模式(图5c)。我们建议从卵母细胞有高度不同的甲基化模式,因为卵丘细胞污染不能排除丢弃数据。

图1。单卵母细胞的亚硫酸氢钠诱变实验的示意图。
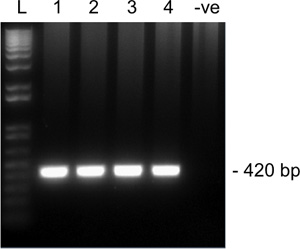
从第二轮SNRPN从一唱放大图2。代表结果乐MII卵母细胞在1.5%琼脂糖凝胶。泳道1-4四个单卵母细胞和5巷是一个阴性对照组(无卵母细胞)。 SNRPN预计扩增大小为420 bp的。 L时,梯子。
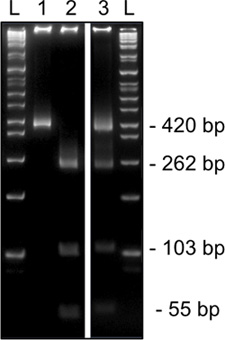
图3。代表从第二轮甲基化特异性SNRPN限制从一个单一的MII卵母细胞在8%丙烯酰胺凝胶消化。HinfI诊断酶切显示甲基化的DNA藏着一个T,废除限制网站(420bp,泳道1) DNA甲基化,其中包含识别网站内权证(切,262,103,和54个基点,泳道2)。消化,显示甲基化和甲基化的酶切位点(切割和未切割带,3车道)的卵丘细胞污染的指标。 L时,梯子。
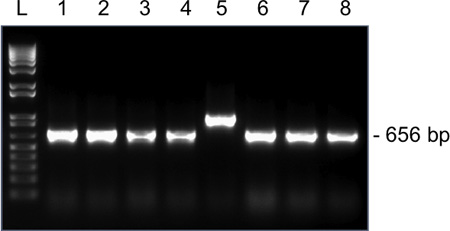
图4。 代表结果菌落PCR扩增SNRPN从一个单一的MII卵母细胞在1.5%琼脂糖凝胶。到载体pGEM-T Easy载体的SNRPN结扎,并使用M13的正向和反向引物预期扩增大小为656 bp的。 1-8车道,从克隆1-8扩增。克隆5有一个不正确的扩增大小,不应该被送往测序。

图5。代表测序结果为单个MII卵母细胞的SNRPN。SNRPN在卵母细胞中的甲基化。黑色圆圈表示甲基化的CPGs。白色圆圈表示甲基化的CPGs。 CpG基的数目和位置是B6的应变雌性小鼠为代表。 a)预期测序结果从一个单一的MII卵母细胞为SNRPN。只有一个DNA单链,应该在所有5个克隆扩增。卵母细胞与一个单一的甲基化模式和相同的CpG非转换行话n应该被纳入分析(%非的CPGs转换权表示,作为非CpG基胞嘧啶转化为胸腺嘧啶作为一个总的非CpG基胞嘧啶的百分比计算)。 B)测序结果SNRPN从单个MII卵母细胞的卵丘细胞污染。注意表明多股放大之间的甲基化状态和转换模式的不同。 C)测序从一个单一的MII卵母细胞染色体的副本或极体列入SNRPN结果。
讨论
这种单卵母细胞的检测数字包含了许多步骤,是至关重要的,需要特殊照顾。首先是卵母细胞洗涤。尤其重要的是洗每个卵母细胞的新鲜培养基中多次下降后,透明质酸酶处理以去除尽可能多的卵丘细胞。此外,卵母细胞的透明带去除酸性台氏解决方案时,要确保周围介质是清晰的卵丘细胞。卵母细胞的卵去除是非常棘手的,任何周围的卵丘细胞可以很容易地成为坚持的卵母细胞。删除一个被套?...
披露声明
作者没有透露。
致谢
这项工作是由西安大略大学妇产科学系;支持和补助金从Ministryof研究和创新,早期的研究者奖“ER06-02-188。 MMD的支持,在的CIHR训练计划繁殖,早期发育和健康(REDIH)研究生奖学金的影响。
材料
表特定的试剂和设备。
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 卵母细胞的采集 | |||
| 透明质酸 | 西格玛 | H4272 | |
| 酸性台氏 | 西格玛 | T1788 | |
| 蛋白酶K | 西格玛 | P5568 | |
| 10%IGEPAL | bioshop | NON999.500 | |
| 裂解液 | |||
| 三pH值7.5 | bioshop | TRS001.5 | |
| 氯化锂 | 西格玛 | L9650 |   |
| EDTA的pH值8.0 | 西格玛 | E5134 | |
| LIDS | bioshop | LDS701.10 | |
| 数码地面电视 | Invitrogen公司 | P2325 | |
| SDS裂解液 | |||
| TE的pH值7.5 | bioshop(三) 西格玛(乙二胺四乙酸) | TRS001.5 E5134 | |
| 10%SDS | bioshop | SDS001.500 | |
| 重亚硫酸盐转化 | |||
| 氢氧化钠 | 西格玛 | S8045 | |
| 的钠Hydrogensulfite(亚硫酸氢钠) | 西格玛 | 243973 | ; |
| 对苯二酚 | 西格玛 | H9003 | |
| 低熔点(LMP)的琼脂糖 | 西格玛 | A9414 | |
| 矿物油 | 西格玛 | M8410 | |
| M2培养基 | 西格玛 | M7167 | |
| GIBCO公司蒸溜水 | Invitrogen公司 | 15230-196 | |
| 蒸压加双蒸水(DD) | |||
| 聚合酶链反应 | |||
| 插图热启动混叠 | GE医疗集团 | 28-9006-54 | |
| 240毫微克/毫升酵母tRNA | Invitrogen公司 | 15401-011 | |
| 5X绿色GoTaq反应缓冲液 | 临巨型 | M7911 | |
| 内部和外部的嵌套引物 | 西格玛 | ||
| 结扎 | |||
| Promega公司PGEM-T Easy载体 | Fisher Scientific则 | A1360 | |
| TA克隆 | |||
| 主管大肠杆菌细胞 | zymo研究公司 | T3009 | |
| 设备 | |||
| 解剖显微镜 | |||
| 70°C和90°C热块 | |||
| 37°C和50°C间Waterbaths(42°C的转换) | |||
| 跷 | |||
| PCR仪 | |||
参考文献
- Jaenisch, R., Bird, A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nat. Genet. 33, 245-254 (2003).
- Rodenhiser, D., Mann, M. Epigenetics and human disease: translating basic biology into clinical applications. CMAJ. 174, 341-348 (2006).
- Frommer, M. A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands. Proc. Natl. Acad. Sci. U.S.A. 89, 1827-1831 (1992).
- Clark, S. J., Harrison, J., Paul, C. L., Frommer, M. High sensitivity mapping of methylated cytosines. Nucleic Acids Res. 22, 2990-2997 (1994).
- Feil, R., Charlton, J., Bird, A. P., Walter, J., Reik, W. Methylation analysis on individual chromosomes: improved protocol for bisulphite genomic sequencing. Nucleic Acids Res. 22, 695-696 (1994).
- Raizis, A. M., Schmitt, F., Jost, J. P. A bisulfite method of 5-methylcytosine mapping that minimizes template degradation. Anal. Biochem. 226, 161-166 (1995).
- Patterson, K., Molloy, L., Qu, W., Clark, S. DNA Methylation: Bisulphite Modification and Analysis. J. Vis. Exp. (56), e3170 (2011).
- Olek, A., Oswald, J., Walter, J. A modified and improved method for bisulphite based cytosine methylation analysis. Nucleic Acids Res. 24, 5064-5066 (1996).
- Mann, M. R. Selective loss of imprinting in the placenta following preimplantation development in culture. Development. 131, 3727-3735 (2004).
- Market-Velker, B. A., Zhang, L., Magri, L. S., Bonvissuto, A. C., Mann, M. R. Dual effects of superovulation: loss of maternal and paternal imprinted methylation in a dose-dependent manner. Hum. Mol. Genet. 19, 36-51 (2010).
- Meng, L. H., Xiao, S. Q., Huang, X. F., Zhou, Y., Xu, B. S. A study on bisulfite sequencing method for methylation status of imprinted genes in single human oocytes. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 25, 289-292 (2008).
- Denomme, M. M., Zhang, L., Mann, M. R. Embryonic imprinting perturbations do not originate from superovulation-induced defects in DNA methylation acquisition. Fertil. Steril. 96, 734-738 (2011).
- Tahiliani, M. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science. 324, 930-935 (2009).
- Hajj, N. E. l. Limiting dilution bisulfite (pyro)sequencing reveals parent-specific methylation patterns in single early mouse embryos and bovine oocytes. Epigenetics. 6, 1176-1188 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。