需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
建模结肠炎相关的癌症与氧化偶氮甲烷(AOM)和葡聚糖硫酸钠(DSS)
摘要
我们展示了一个协议,氧化偶氮甲烷(AOM)的遗传毒性剂,其中给药后由促炎性剂硫酸葡聚糖钠(DSS)的迅速的三个周期的和一贯生成结肠肿瘤在小鼠与在人类结肠炎所见的形态学和分子的相似之处相关的癌症。
摘要
个人与炎症性肠病(IBD),如克罗恩病(CD)和溃疡性结肠炎(UC)是在健康的个人发展结直肠癌(CRC)的风险增加。这种风险是成正比的持续时间和程度的疾病,结肠发育不良鸡传染性法氏囊病和结肠炎相关癌症(CAC)被认为是发展的结果,累计发病率高达30%,个人长期的UC结肠的广泛参与。上皮细胞的损伤和修复的重复循环,而这些细胞沐浴在一种慢性炎症性细胞因子环境2虽然自发和结肠炎相关的癌症的共享的质量是腺癌,被认为是相关的分子事件的序列是不同的。3这区分认为需要特定动物模型的CAC。
目前存在的一些小鼠模型的研究CAC。硫酸葡聚糖SODIUM(DSS),代理人对结肠上皮细胞的直接毒性作用,可管理的饮用水中创建多个周期的小鼠慢性炎症状态。有足够的时间,这些小鼠肿瘤的发展。4肿瘤的发展,赶紧在这个模型中,如果一个亲致癌设置的管理。这些包括与遗传突变小鼠在肿瘤发生途径(APC,p53基因,MSH2),以及预先处理的基因毒性剂(氧化偶氮甲烷[AOM],1,2 -二甲基肼[DMH])。5小鼠
与AOM相结合的DSS结肠炎相关癌症的典范,重现性,效力,低廉的价格,和易用性已经得到普及。虽然他们有一个共享的机制,AOM已被发现是更有效和稳定的溶液中比DMH。虽然肿瘤的发生发展中的其他车型,一般需要几个月,注射AOM,随后用DSS小鼠肿瘤的制定适当的的小为7-10周。6,7的最后,AOM和DSS可以施用任何遗传背景的小鼠(基因敲除,转基因等),而不到一个特定的致瘤菌株杂交育种。在这里,我们展示了一个协议驱动的炎症结肠肿瘤在小鼠体内利用一个单一的注射AOM三个7天为一个周期超过10周的时间DSS。这种模式导致肿瘤的组织学和分子的变化密切类似于发生在人类CAC,在本病的发生和化学预防的研究提供了一个非常有价值的模型8
研究方案
1。溃疡性结肠炎相关性诱发癌症
- 抛开笼子里的性别和年龄相匹配的6-8周龄小鼠用于实验组和对照组。与尾标记或耳夹的小鼠可以单独标记。
- 在第0天,记录基线的权重,并与10毫克/公斤的保持在-20摄氏度AOM的工作溶液(1 mg / ml的等渗盐水中,10毫克/毫升原液蒸馏水稀释,注入每只小鼠腹膜内(IP)) 。经验的基础上,可以调整剂量7-14 mg / kg和/之间,在实验的早期或重复。
注意:AOM是一种易挥发的基因毒性剂,并根据附带的MSDS应谨慎处理。稀释液应准备的化学式吸油烟机,保持在冰上,被丢弃后,针对具体机构的协议。
- 设为2.5%(2.5 0.5g/100ml的)在蒸馏水中,并通过DSS溶液通过0.22μm的醋酸纤维素fILTER的真空。此剂量可根据小鼠品系和环境的1-3.5%之间进行调整。一旦制备完成,DSS溶液可以保存在冰箱中长达1周。
- 在第7天,供应DSS溶液的小鼠作为他们的饮用水。约250毫升/笼,将需要每次新的DSS提供的最大的5只/笼,但这些都只是估计和动物设施中使用的水瓶的类型将取决于。
- DSS七天,以提供持续的供应应更换干净的瓶子三次(每2-3天),在此期间,DSS解决方案。一些研究者测量DSS消耗之前更换新的解决方案作为衡量的曝光量。
- 第14天,转笼标准的饮用水了两个星期。
- 重复步骤(1.4) - (1.6)在28和49天的DSS提供了第二个和第三个周期。 "循环"的DSS一个星期的DSS的饮用水其次2周定期(灭菌)水。
2。临床评估结肠炎与肿瘤进展
- 在小鼠,应权衡利弊/观察,每周2-3次。 %的重量损失相对基准是用来作为替代措施结肠炎的严重程度。定期评估直肠出血,腹泻,或脱出,可以根据实验目标,并根据不同的评分系统。9,10
- DSS(每日观察可能是有用的,在这后立即DSS)的一个完整周期后一周的重量损失高达10%,可以预期,随着2-3天的腹泻,直肠出血。
这是可能的,一些老鼠可能无法收回;小鼠失去自己的体重大于20%,是不太容易生存,可能需要提前安乐死。一个单一的IP在这些小鼠注射0.5 - 1.0毫升生理盐水可以成为一个有用的支持措施,对纠正flui D音量因腹泻而失去。
3。小鼠内窥镜检查(可选)
- 内镜的决策支持系统的第二个或第三个周期之后,可以执行之前确认体内肿瘤的生长在牺牲。由于AOM / DSS的模型是相当可靠的,在产生肿瘤,这一步是没有必要的。只有少数几个小鼠应使用这种方法进行评价的,因为它有可能破坏小鼠肿瘤11
- 吸入或注射镇静麻醉的小鼠。
- 小鼠被麻醉后,平面板用胶带固定在鼠标的尾部和胸部。
- 推进小鼠内窥镜插入直肠的鼠标轻轻用生理盐水膨胀,灌溉,改善管腔内查看和删除粪内容。 (请注意,也可以进行内窥镜检查用空气吹入盐水和这种技术作为一种替代,可以提供改善的可视化的肿瘤。12)
- 第70天,每个AOM / DSS对待的鼠标应该怀有多个结肠肿瘤,并准备评估。这个日期可能会延迟几个星期到几个月,如果需要较大的肿瘤。 (值得注意的是,可能需要重度直肠脱垂的小鼠早期被安乐死动物每体制动物护理委员会,以避免过度的不适。)
- 尸检之前,单独实施安乐死小鼠异氟醚和颈椎脱位(或其他体制认可的方法)。最终重量和其他测量数据,可在这个时候。
- 奠定其腹侧面暴露砧板上的鼠标。量的腹部,用70%乙醇,以防止毛发污染腹腔内容物,在提取过程中的结肠。
- 使用产钳,把握中线的腹部,做一个小切口,显露腹膜。
- 此切口延伸的腹部的每一侧上沿肋软骨MARGIN。
- 用剪刀剪通过骨盆,使结肠可收获的肛门直肠交界处。这是很重要的,因为DSS结肠炎损伤是最大的在的前端直肠和相应的区域,这是最大的肿瘤的发展。
- 其他组织如肠系膜淋巴结也可以在这个时候收获。
5。准备结肠宏观分析的
- 使用18G灌胃针连接到一个5毫升注射器,用冰冷的磷酸盐缓冲盐水(PBS),使得流体生理方向退出冲洗结肠。如果结肠组织将被用于RNA或蛋白质为基础的分析,它可以保持在低温,通过采用预先冷却的工作托盘。
- 打开冲洗结肠纵向沿其肠系膜和油漆的冷托盘上。肿瘤是更容易地可视化结肠时,被放置在一个黑暗的表面。可替换地,将1%阿辛兰染料可以施加到突出吨umors。评估肿瘤的数量和大小,用直尺或游标卡尺。
- 切除肿瘤和邻近正常组织的小部分可以在这一点上,供日后分析的RNA,蛋白质或免疫组织化学法(IHC),离开其它结肠组织学评估的某些部分。
数码摄影的总的结肠标本紧随步骤5.2可以帮助肿瘤负荷进行精确的分析,特别是如果冒号的重要部分切除上述其他形式的分析。可以计算出使用自由软件,如ImageJ的肿瘤面积/总结肠区肿瘤的负担(%)。
6。准备结肠组织评估
- 应用10%福尔马林剩余的结肠通过注射器或手指在冰冷的托盘。允许组织固定为至少30秒,以这种方式,有利于转移到固定盆地。确保残留的甲醛是WIP编关闭之前,在同一托盘上画一个新开的结肠。
- 转移冒号充满10%的福尔马林的一个盆地,牵制的边缘。
- 固定3小时后,转移到70%乙醇中的冒号。冒号可以保留无限期地在70%乙醇。
- 三纵截面冒号(近,中,远端/直肠)可以稳定在2%琼脂和石蜡包埋提交。保证在近端结肠和远端结肠/直肠癌取向在一个均匀的方式为每个鼠标。
- 不典型增生,隐窝破坏和炎症可以由有经验的个人描述和评估根据此前公布的协议,10日,13日至15日小鼠可以牺牲前的第70天,如果实验者感兴趣早期发育不良事件的。
7。代表性的成果
AOM / DSS本文所述的模型使研究人员能够可靠地产生结肠肿瘤在小鼠体内。在这个模型中肿瘤生长的影响直接由相关联的炎症过程。结肠炎严重性应监测临床按照体重减轻和腹泻/便血存在下( 图2)。这些迹象的疾病活动往往DSS除去后的DSS周期的第5天开始,四个或更多天。在极少数情况下,一个显着的直肠肿瘤负担的小鼠可以发展直肠脱垂。后,第二次或第三次DSS周期的腹泻可能成为持续性。通常情况下,肿瘤是本和可辨认的DSS( 图3)的第三个周期之前由小鼠结肠镜检查。更多的时间是第三个疗程的DSS结果在较大的肿瘤,在收割时( 图4)。使用的局部应用的爱茜蓝染色可被用来强调肿瘤( 图5)。结肠肿瘤的照片将协助产生肿瘤测量可用于定量地比较肿瘤生产和大小实验组之间( 图6)。然后,可以固定,石蜡包埋的结肠标本评价组织学或与使用免疫组织化学染色( 图7和8)。
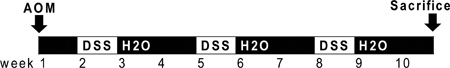
图1。图 AOM和DSS管理的。 AOM(10毫克/千克)在第0天被注入。在开始的第二个星期(7天),2.5%DSS溶液给药的小鼠在他们的饮用水。七天的DSS随后两个星期的无菌水。前两个周期的DSS牺牲。

图2。的鼠标重量相对于基线AOM和DSS管理期间,。请注意,在本周每个DSS周期之后,小鼠洛斯 Ê5-10%的体重。在本实验中减肥结肠炎严重程度的替代指标。
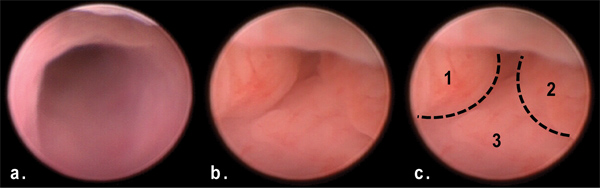
图3。肿瘤的远端结肠通过小鼠内镜在50天AOM / DSS处理。注意的多个息肉群众阻碍远端结肠的管腔(乙,丙)在比较正常结肠(一)。
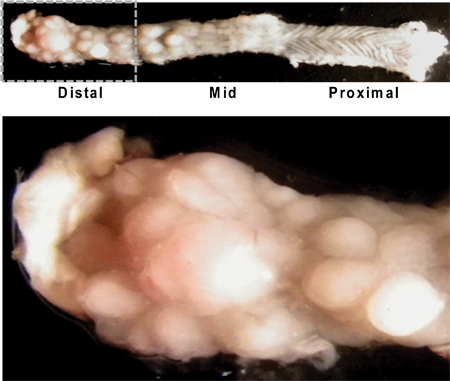
图4。纵向打开的小鼠结肠说明肿瘤的大体外观。注意较高的肿瘤负荷在远端结肠/直肠癌(左上图像),和与肿瘤的生长小的近端结肠(右上形象)的特征瓦楞纸纹理。远端结肠,密切了众多肿瘤大小不等(见下文)。
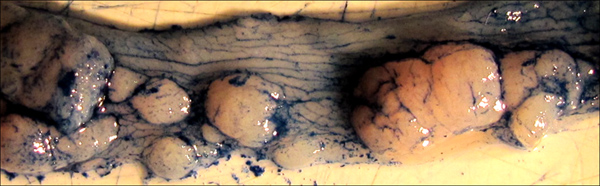
图5。肿瘤所强调的应用阿尔辛蓝染色。注意染料如何强调的结肠的正常纹理以及每个单独的肿瘤的边界。这种染色可以帮助在肿瘤领域由统治者或数字测量的精确测量。
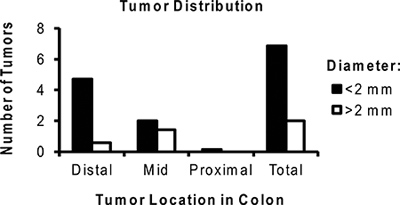
图6。代表分布AOM / DSS每只小鼠的肿瘤治疗的平均次数。注意大多数肿瘤位于远端结肠和<2毫米大小。
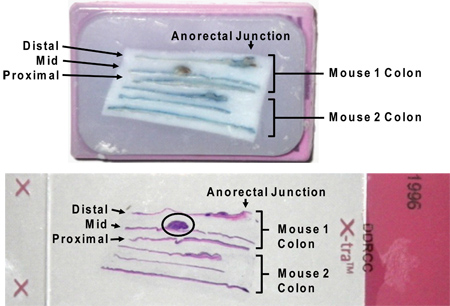
图7。石蜡包埋的结肠磁带盒的纵向部分(上述)d的幻灯片后,H&E染色(如下图)。需要注意的是剩余的阿尔辛蓝染色不干扰H&E染色。一个大的肿瘤盘旋而上的幻灯片图像(圆圈内)。所用名称"远侧","中间"和"近侧"的结果,从切片整个结肠盲肠和肛门之间的三分之二。

图8。代表一个从AOM / DSS管理远端结肠肿瘤的组织学。 H&E,尿嘧啶和β-catenin的染色切片50X(上图)和400X(底部面板),分别表现出类似人类的结肠腺癌发育不良的变化。
讨论
AOM和DSS的小鼠迅速和有效的模型人结肠炎相关的癌症的治疗。假设关于遗传因素结肠炎相关癌症可以容易地研究与遗传工程小鼠结肠炎相关癌症的效果的药理学目标13,16或者,可以通过采用野生型小鼠研究。
虽然这种模式是高度重视的那些有兴趣在结肠肿瘤的发生发展中的设置炎症的研究存在局限性。在这个模型中小鼠中观察到疾病的程度可以有很大的不同,这取?...
披露声明
没有利益冲突的声明。
致谢
这项工作是由部分DK089016和L30 RR030244(MAC),CA153036(AS),P30-DK52574(华盛顿大学消化疾病研究核心)。 AIT是霍华德·休斯医学研究所的医学研究培训研究员。
材料
",曲线点期间防止损坏结肠开幕。
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录编号 | 评论 |
| C57BL/6J小鼠 | 杰克逊实验室 | 000664 | |
| 氧化偶氮甲烷(AOM) | Sigma Aldrich公司 | A5486-100MG | 储备溶液:稀释至10被保持在-20℃下在蒸馏水中为0.5毫克/毫升- 1毫升的等分试样。 解决方案:1 mg / ml的等渗(0.9%)盐水稀释股票 |
| 葡聚糖硫酸酯钠(DSS) | TDB咨询 | DB001 | MW 40 kDa的(36-50 kDa的准备从其他来源是可接受的;应该使用相同的特定的一个单一的实验)6 |
| Coloviewminiendoscopic系统 | 卡尔斯托斯 | 多种 | Becker 等人 11的设备和设置的详细的解释。 |
| TPP快速FILTERMAX 500毫升瓶,过滤器,0.22微米PES | 中西部地区科学 | TP99500 | 任何标准组织文化过滤器是可以接受的 |
| 乙醇200证明ASC / USP | 药物AAPER(或其它) | 11ACS200 | 在蒸馏水中,稀释至70%的 |
| 异氟醚,USP | 巴特勒动物保健供应 | 4029405 | 将鼠标玻璃瓶中,用纱布或小布浸泡在麻醉 |
| 18G直灌胃针 | 布伦特里科学 | N-008 | |
| 磷酸盐缓冲液(PBS) | 西格玛Aldrich公司 | P5493 | 在蒸馏水中稀释至1X(0.01M) |
| 冷托盘(II冷板组织康) | Fisher Scientific则 | NC9491941 | 存放在-20°C |
| ImageJ软件 | 美国国立卫生研究院(免费下载) | http://rsbweb.nih.gov/ij/ | |
| 甲醛(37%) | Fisher Scientific则 | F79-500 | 在PBS中稀释至10%的 |
| BD Bacto琼脂 | Fisher Scientific则 | DF0140-01-0 | 使用烤盘创建2%的溶液,在蒸馏水中 |
| MILTEX眼睛敷料钳 | MedPlus公司 | 18-780 | |
| MILTEX眼睛剪刀 | MedPlus公司 | 18-1430 | |
| 经Alcian Blue 8GX(粉末) | Sigma Aldrich公司 | A5268 | 1克粉末添加到100毫升3%醋酸(3毫升冰醋酸+ 97毫升蒸馏水中) |
| 1毫升结核菌素皮锥针注射器附有26克×3/8 | BD | 305946 | 对于注射AOM |
参考文献
- Ekbom, A. Ulcerative colitis and colorectal cancer. A population-based study. N. Engl. J. Med. 323, 1228-1233 (1990).
- Terzic, J. Inflammation and colon cancer. Gastroenterology. 138, 2101-2114 (2010).
- Ullman, T. A., Itzkowitz, S. H. Intestinal inflammation and cancer. Gastroenterology. 140, 1807-1816 (2011).
- Okayasu, I. Dysplasia and carcinoma development in a repeated dextran sulfate sodium-induced colitis model. J. Gastroenterol. Hepatol. 17, 1078-1083 (2002).
- Kanneganti, M., Mino-Kenudson, M., Mizoguchi, E. Animal models of colitis-associated carcinogenesis. J. Biomed. Biotechnol. 342637, (2011).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nat. Protoc. 2, 1998-2004 (2007).
- Tanaka, T. A novel inflammation-related mouse colon carcinogenesis model induced by azoxymethane and dextran sodium sulfate. Cancer Sci. 94, 965-973 (2003).
- De Robertis, M. The AOM/DSS murine model for the study of colon carcinogenesis: From pathways to diagnosis and therapy studies. J. Carcinog. 10, 9 (2011).
- Wirtz, S. Chemically induced mouse models of intestinal inflammation. Nat. Protoc. 2, 541-546 (2007).
- Cooper, H. S. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 69, 238-249 (1993).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nat. Protoc. 1, 2900-2904 (2006).
- Becker, C., Fantini, M. C., Wirtz, S., Nikolaev, A., Kiesslich, R., Lehr, H. A., Galle, P. R., Neurath, M. F. In vivo imaging of colitis and colon cancer development in mice using high resolution chromoendoscopy. Gut. 54, 950-954 (2005).
- Shaker, A. Epimorphin deletion protects mice from inflammation-induced colon carcinogenesis and alters stem cell niche myofibroblast secretion. J. Clin. Invest. 120, 2081-2093 (2010).
- Boivin, G. P. Pathology of mouse models of intestinal cancer: consensus report and recommendations. Gastroenterology. 124, 762-777 (2003).
- Cooper, H. S. Dysplasia and cancer in the dextran sulfate sodium mouse colitis model. Relevance to colitis-associated neoplasia in the human: a study of histopathology, B-catenin and p53 expression and the role of inflammation. Carcinogenesis. 21, 757-768 (2000).
- Yoshida, Y. The forkhead box M1 transcription factor contributes to the development and growth of mouse colorectal cancer. Gastroenterology. 132, 1420-1431 (2007).
- Suzuki, R. Strain differences in the susceptibility to azoxymethane and dextran sodium sulfate-induced colon carcinogenesis in mice. Carcinogenesis. 27, 162-169 (2006).
- Mahler, M. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. Am. J. Physiol. 274, 544-551 (1998).
- Nambiar, P. R. Preliminary analysis of azoxymethane induced colon tumors in inbred mice commonly used as transgenic/knockout progenitors. Int. J. Oncol. 22, 145-150 (2003).
- Tanaka, T. Colorectal carcinogenesis: Review of human and experimental animal studies. J Carcinog. 8, (2009).
- Ciorba, M. A. Induction of IDO-1 by immunostimulatory DNA limits severity of experimental colitis. J. Immunol. 184, 3907-3916 (2010).
- Kerr, T. A. Dextran sodium sulfate inhibition of real-time polymerase chain reaction amplification: A poly-A purification solution. Inflamm. Bowel Dis. 18, 344-348 (2012).
- Tang, Y. is required for resection-induced changes in apoptosis, proliferation, and members of the extrinsic cell death pathways. Gastroenterology. 126, 220-230 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。