Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Моделирование колит, связанного с раком Azoxymethane (ОСО) и декстран сульфат натрия (DSS)
В этой статье
Резюме
Мы демонстрируем протокол, в котором администрация генотоксического azoxymethane агента (ОСО), а затем трех циклов провоспалительных агентов декстран сульфат натрия (DSS) быстро и последовательно создает опухолей толстой кишки у мышей с морфологической и молекулярно сходство тем, которые наблюдаются в человеческом колит -связанных рака.
Аннотация
Лица с воспалительными заболеваниями кишечника (IBD), такие как болезнь Крона (БК) или неспецифический язвенный колит (UC), подвергаются повышенному риску развития колоректального рака (КРР) над здоровых людей. Этот риск пропорционально длительности и степени заболевания, с кумулятивная частота достигает 30% у лиц с давних UC с широко распространенным толстой участие 1. Кишечное дисплазии в IBD и колит, связанный рака (CAC), как полагают, развиваются в результате повторяющихся циклов повреждения эпителия и восстановление клеток в то время как эти клетки купались в хронический воспалительный цитокин среды. 2 Во время спонтанной и колит связанных рака поделиться качество бытия аденокарциномы, последовательности, лежащие в основе молекулярных событий, как полагают быть разными. 3 Это Различие утверждает, потребность в конкретных моделях животных CAC.
Несколько моделей мышей существуют в настоящее время для изучения CAC. Декстрансульфат Содимкм (DSS), агент с прямым токсическим действием на эпителий толстой, можно вводить в питьевой воде мышей в несколько циклов, чтобы создать хронические воспалительные состояния. При достаточной продолжительности, некоторые из этих мышей будет развиваться опухоль. 4 Опухоль развития поспешили в этой модели, если вводить в про-канцерогенные настройки. Они включают в себя мышей с генетическими мутациями в онкогенезе путей (APC, p53, Msh2), а также мышей, предварительно обработанных генотоксического агентов (azoxymethane [AOM], 1,2-диметилгидразин [DMH]) 5.
Сочетание DSS с острым средним отитом в качестве модели для рака колит, связанный завоевала популярность своей воспроизводимости, потенции, низкой ценой и простотой использования. Хотя они имеют общий механизм, ОСО было установлено, что более мощные и стабильные в растворе, чем DMH. В то время как развитие опухоли в других моделях обычно требуется несколько месяцев, мышей, которым вводили с острым средним отитом и затем обрабатывали DSS разработки адекватных опухолей6 сек всего 7-10 недель., 7 Наконец, ОСО и DSS могут быть введены мышам любого генетического фона (выбить, трансгенные и т.д.) без скрещивания на конкретный штамм онкогенного. Здесь мы покажем, протокол воспаление управляемых толстой опухолей у мышей с использованием одной инъекции острого среднего отита следуют три семидневного цикла DSS в течение 10 недель. Эта модель вызывает опухоли с гистологическим и молекулярные изменения, напоминающий те, которые происходят в человеческом CAC и обеспечивает очень ценной моделью для изучения онкогенеза и химиопрофилактики при этом заболевании 8.
протокол
1. Колит, связанный индукции рака
- Отложите в сторону клетки от пола и возраста из 6-8 недельных мышах, которые будут использоваться для экспериментальной и контрольной групп. Мыши могут быть снабжены индивидуальными этикетками с маркировкой хвост или ухо клипов.
- В день 0, вес записи базовой и придать каждой мыши внутрибрюшинно (IP) с 10 мг / кг ОСО рабочего раствора (1 мг / мл в изотонический солевой раствор, разбавляют от 10 мг / мл маточного раствора в dH2O храниться при температуре -20 ° С) . Опираясь на опыт, эта доза может регулироваться в пределах 7-14 мг / кг и / или повторяющиеся в начале эксперимента.
Внимание: ОСО является летучим генотоксического агента и следует обращаться осторожно в соответствии с прилагаемой MSDS. Растворы должны быть подготовлены в химическом капот, поддерживается на льду, и отбрасываются после учреждения специальных протоколов.
- Сделайте 2,5% (2,5 г/100 мл) DSS раствор в дистиллированной воде и пропускают через 0,22 мкм F ацетата целлюлозыILTER вакуумом. Эта доза может регулироваться в пределах 1-3,5% в зависимости от штамма мыши и окружающей среды. После приготовления DSS решение может быть в холодильнике до 1 недели.
- На 7-й день, поставка DSS решение мышей в качестве питьевой воды. Около 250 мл / клетка будет необходимо каждый раз новые DSS обеспечивает не более 5 мышей / клетку, однако, это лишь оценки и будет варьироваться в зависимости от типа бутылки с водой используется в вашем животного центр.
- Для обеспечения непрерывной подачи DSS в течение семи дней, DSS решение должно быть заменено в чистой бутылки в три раза (каждые 2-3 дня) в течение этого периода. Некоторые исследователи измеряют количество потребляемого DSS перед заменой с новым решением в качестве меры воздействия.
- На 14 день, переключиться обратно в клетки стандарт качества питьевой воды в течение двух недель.
- Повторите шаги (1,4) - (1,6) в дни 28 и 49 для обеспечения второго и третьего цикла DSS. DSS "цикл" состоит из одной неделе DSS в питьевой воде, затем 2 недели регулярных (автоклавного) воды.
2. Клиническая оценка колит и опухолевой прогрессии
- Мыши должны быть взвешены / наблюдается 2-3 раза в неделю. Процент потери веса по сравнению с исходным используется в качестве косвенного показателя колита тяжести. Регулярная оценка кровотечения из прямой кишки, поносы, или пролапс может быть сделан в зависимости от экспериментальных целей и сообщил по различным системам скоринга. 9, 10
- Потеря веса до 10%, наряду с 2-3 дня понос и кровотечение из прямой кишки можно ожидать в течение недели после полного цикла DSS (ежедневное наблюдение может быть полезно при этом сразу после DSS период).
Вполне возможно, что некоторые мыши может восстановиться; мышей потери более чем на 20% своего веса имеют меньше шансов выжить, и может потребовать досрочного эвтаназии. Одна инъекция IP 0,5 - 1,0 мл физиологического раствора в таких мышей может быть полезно поддерживать меры к исправлению flui г объем потерянных в результате диареи.
3. Мышиные эндоскопии (необязательно)
- Эндоскопия после второго или третьего цикла DSS могут быть выполнены, чтобы подтвердить рост опухолей в естественных условиях до жертвовать. Как ОСО / DSS модель вполне надежны в производстве опухолей, этот шаг, как правило, не требуется. Лишь несколько мышей должна оцениваться с помощью этого метода, так как он имеет потенциал, чтобы нарушить мыши опухолей 11.
- Anesthetize мыши с ингаляционным или инъекционные седативный эффект.
- После мышь находится под наркозом, обеспечить мыши на плоской доске с лентой на хвосте и груди.
- Переход мышиный эндоскопа в мышь прямую кишку осторожно использованием физиологического раствора, чтобы раздуть и орошения для улучшения внутрипросветного просмотра и удаления фекальных содержание. (Заметим, что эндоскопия также может быть выполнена с использованием воздуха вдувания в качестве альтернативы солевой раствор и этот метод может предложить улучшенную визуализацию опухоли. 12)
- В день 70, каждая ОСО / DSS рассматриваться мышь должна питать множественных опухолей толстой кишки и быть готовым к оценке. Эта дата может быть отложена недель до нескольких месяцев, если большие опухоли лучшего. (Следует отметить, что мышей с тяжелым ректальной выпадение возможно, должны быть подвергнуты эвтаназии рано, чтобы избежать чрезмерных неудобств для животных в соответствии с институциональными комитетов ухода за животными).
- До вскрытия, индивидуально усыпить мышей с изофлурана и смещения шейных позвонков (или другие институционально одобренных метода). Окончательный вес и другие измерения могут быть сделаны в это время.
- Положите мышь с брюшной стороны выставлен на разделочной доске. Накройте живота с 70% этанола, чтобы предотвратить волосы от загрязнения содержимого брюшной полости при добыче толстой кишки.
- Используйте пинцет, чтобы понять средней линии живота и сделать небольшой надрез, чтобы разоблачить брюшины.
- Расширение этот разрез на каждой стороне живота вдоль реберного Margiн.
- Используйте ножницы, чтобы вырезать через таз так, чтобы толстая кишка может быть собрано до аноректальной перехода. Это важно, потому DSS колит травмы наибольший в дистальной кишки и, соответственно, это является областью наибольшего развития опухоли.
- Дополнительная тканей, таких как мезентериальных лимфатических узлов также может быть собран в это время.
5. Подготовка толстой кишки для макроскопического анализа
- Использование 18G иглу через желудочный зонд присоединен к 5 мл шприц, промойте толстой ледяной фосфатный солевой буфер (PBS), что жидкость выходит в физиологическую сторону. Если толстой ткани будет использоваться для РНК или белка на основе анализа, он может быть холодным, используя предварительно охлажденные лотки работы.
- Откройте раскрасневшееся толстой кишки в продольном направлении вдоль ее брыжейки и краски на холодном лоток. Опухоли более легко визуализировать, когда толстая кишка находится на темной поверхности. Кроме того, 1% Alcian синего красителя может быть применен для выделения тumors. Оценка опухоли количество и размер с помощью линейки или цифровой суппорта.
- Малые участки опухоли и прилегающих нормальных тканей может быть вырезана на данный момент для будущего анализа РНК, белков, или иммуногистохимического (IHC) методы, оставляя некоторую часть оставшейся толстой кишки для гистологического оценки.
Цифровая фотография валового образцов толстой кишки сразу же после шага 5.2 может быть полезным для точного анализа опухоли, особенно если значительная часть двоеточия вырезали для других форм анализа, как описано выше. Опухоли (%) может быть рассчитана как опухолевые площадь / общая площадь толстой кишки с помощью бесплатного программного обеспечения, таких как ImageJ.
6. Подготовка толстой кишки для гистологического оценки
- Применяют 10% формалина на оставшиеся толстой кишки на холодную лоток с помощью шприца или пальцем. Разрешение ткани, чтобы исправить по крайней мере, 30 секунд таким образом облегчает передачу фиксации бассейна. Убедитесь, остаточная формалина WIPред с перед покраской новых открыт толстой кишки на том же лотке.
- Передача двоеточия в бассейне, заполненной 10% формалина и придавить по краям.
- Через 3 часа фиксации, передачи двоеточия до 70% этанола. Колоны могут быть сохранены в 70% этанола на неопределенный срок.
- Три продольные срезы толстой кишки (проксимальная, средняя, дистальная / прямой кишки) может быть стабилизировано в 2% агара и представлен на парафин вложения. Убедитесь, что проксимальных толстой кишки и дистального отдела толстой кишки / прямой кишки ориентированы единым образом для каждой мыши.
- Дисплазия, склеп повреждения и воспаления могут быть описаны и оценены опытными отдельных согласно ранее опубликованным протоколам. 10, 13-15 Мыши могут быть принесены в жертву до дня 70, если экспериментатор заинтересован в выявлении ранних диспластических событий.
7. Представитель Результаты
ОСО / DSS модели, описанные здесь позволяет исследователю надежно генерировать опухолей толстой кишки у мышей.Рост опухоли в этой модели напрямую зависит от соответствующей воспалительного процесса. Колит тяжести должны быть проверены клинически после потери веса и диареи наличии / кровянистый стул (рис. 2). Эти признаки активности болезни, как правило, начинается на 5-й день цикла DSS и в течение четырех или более дней после DSS удаляется. Редко, мышей со значительным бременем ректальные опухоли могут развиваться выпадения прямой кишки. После второго или третьего поноса DSS цикла могут стать постоянными. Обычно опухоли присутствуют и идентифицированы мышиный колоноскопии до третьего цикла DSS (рис. 3). Дополнительное время и третьего курса DSS результаты в больших опухолях в момент сбора урожая (рис. 4). Использование местного применения Alcian синевы может быть использован для выделения опухоли (рис. 5). Фотографии опухолей толстой окажет содействие в создании опухоли измерений, которые могут быть использованы для количественного сравнения опухоли производства и размерамежду экспериментальными группами (рис. 6). Фиксированные и парафином образцов толстой кишки может быть оценена для гистологии или с использованием иммуногистохимического окрашивания (рис. 7 и 8).
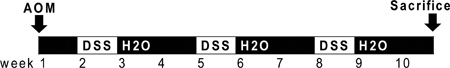
Рисунок 1. Схематическое ОСО и DSS администрации. ОСО (10 мг / кг) вводят в день 0. В начале второй недели (день 7), 2,5% DSS раствор вводят мышам в их питьевой водой. Семь дней DSS следуют две недели из автоклавного воды. Дополнительных двух циклов DSS вводят до жертвовать.

Рисунок 2. Вес мыши относительно исходных условий в течение острого среднего отита и DSS администрации. Обратите внимание, что в течение недели после каждого цикла DSS, мышей-лос- электронной 5-10% от их веса тела. Потеря веса в этом эксперименте является суррогатным маркером тяжести колита.
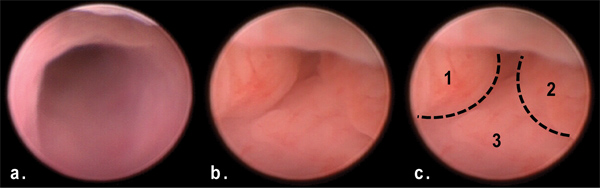
Рисунок 3. Вид опухоли в дистальной толстой кишки с помощью эндоскопии мышиной в день 50 ОСО / DSS лечения. Обратите внимание на несколько полиповидными препятствует просвета дистального отдела толстой кишки (B, C) по сравнению с нормальным толстой кишки (а).
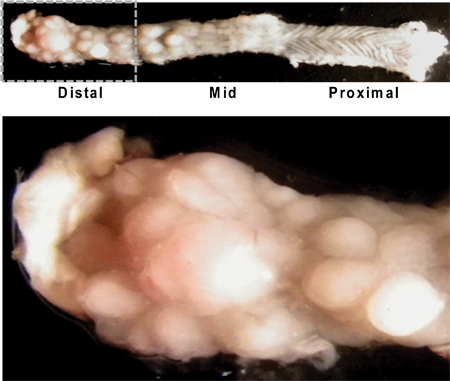
Рисунок 4. Продольно открыл мыши толстой кишки иллюстрирующие валового появление опухолей. Обратите внимание, что выше опухоли в дистальной толстой кишке / прямой кишки (левый верхний рисунок), а характерные rugated текстуры проксимальной толстой кишки (правый верхний рисунок) с небольшой рост опухоли. Закрыть вверх вид дистального отдела толстой кишки показывает многочисленные опухоли различных размеров (см. ниже).
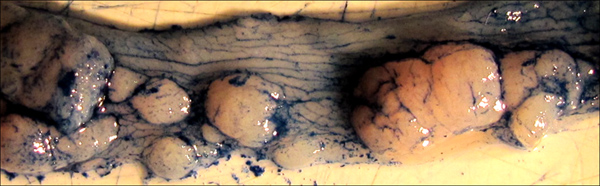
Рисунок 5. Опухоли подчеркивается применение Alcian синие пятна. Обратите внимание, как краситель подчеркивает текстуру нормального толстой кишки, а также границах каждой отдельной опухоли. Такое окрашивание может быть полезным в точных измерений опухоли районах правителя или цифровых измерений.
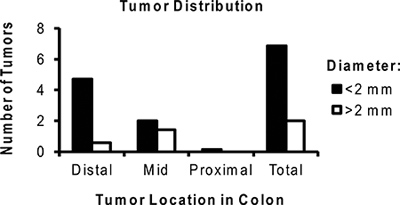
Рисунок 6. Представитель распределения среднее число опухолей на мышь обрабатывают ОСО / DSS. Обратите внимание, что большинство опухолей, расположенных в дистальной толстой кишке и <2 мм.
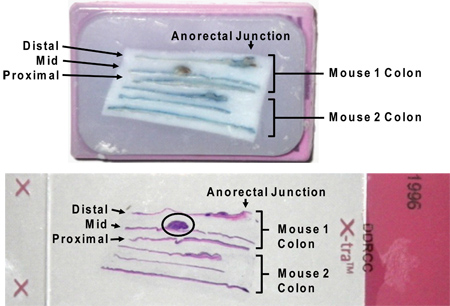
Рисунок 7. Парафиновые продольных срезах толстой кишки в кассете (см. выше)D на слайде после H & E пятно (см. ниже). Обратите внимание, что остаточная Alcian синевы не мешает H & E окрашивание. Большая опухоль, кружили на слайде изображения (в кружке). Обозначения "дистальный", "средний" и "проксимальный" в результате секционирования всей толстой кишки в третей между слепой кишки и ануса.

Рисунок 8. Представитель гистологии опухоли в результате ОСО / DSS администрации в дистальных отделах толстой кишки. H & E, BrdU, и β-катенина окрашенные слайды на 50X (верхняя панель) и 400X (нижняя панель), соответственно, демонстрируют диспластических изменений похожи на человеческие аденокарциномы толстой кишки.
Обсуждение
Лечение мышей с острым средним отитом и DSS быстро и эффективно моделей человеческого колит связанных рака. Гипотезы о наследственных факторов, способствующих колит связанных рака может быть легко изучена с генетически модифицированным мышам. 13, 16 Кроме того, влияние фармакологи?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была частично финансируется за счет DK089016 и L30 RR030244 (MAC), CA153036 (AS) и P30-DK52574 (в пищеварительной Вашингтонского университета Основные исследования болезней). AIT был Медицинского института Говарда Хьюза медицинской подготовки научных кадров Fellow.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| C57BL/6J мышей | Jackson Laboratory | 000664 | |
| Azoxymethane (ОСО) | Sigma Aldrich | A5486-100мг | Маточный раствор: разбавленный до 10 мг / мл в дистиллированной воде, чтобы хранить при -20 ° С, 0,5 - 1 мл аликвоты. Рабочий раствор: разбавленный акции до 1 мг / мл в изотоническом (0,9%) солевой |
| Декстран Сульфат натрия (DSS) | БТ консультирование | DB001 | MW 40 кДа (36-50 кДа препараты из других источников, являются приемлемыми; Та же участь должна быть использована для одного эксперимента) 6 |
| Coloviewminiendoscopic системы | Karl Storz | Множественный | См. Becker и соавт. Для подробного объяснения оборудование и установку 11. |
| ТЭС быстрого FilterMax 500 мл Бутылка-фильтр, 0,22 мкм PES | Midwest Научные | TP99500 | Любой стандартный фильтр культуре тканей приемлемой |
| Этиловый спирт 200 Доказательство ASC / USP | Фармако-AAPER (или другой) | 11ACS200 | Разбавить до 70% в дистиллированной воде |
| Isoflurane, USP | Батлер Animal Health питания | 4029405 | Место мышь в стеклянную банку марлей или небольшой тканью, смоченной в анестетика |
| 18G прямой зонд иглы | Braintree Научные | N-008 | |
| Фосфатным буферным раствором (PBS) | СигмаAldrich | P5493 | Развести до 1X (0,01 М) в дистиллированной воде |
| Холодная лоток (Tissue Tek II холодной плиты) | Fisher Scientific | NC9491941 | Хранить при -20 ° C |
| ImageJ программного обеспечения | NIH (бесплатная загрузка) | http://rsbweb.nih.gov/ij/ | |
| Формальдегид (37%) | Fisher Scientific | F79-500 | Разбавить до 10% в PBS |
| BD Bacto Агар | Fisher Scientific | DF0140-01-0 | Используйте плиту для создания 2% раствор в дистиллированной воде |
| Miltex пинцет глаз Туалетный | MedPlus Инк | 18-780 | |
| Ножницы Miltex глаз | MedPlus Инк | 18-1430 | изогнутые предотвращения повреждения толстой кишки во время открытия. |
| Alcian синий 8GX (порошок) | Sigma Aldrich | A5268 | Добавить 1 г порошка на 100 мл 3%-ной уксусной кислоты (3 мл ледяной уксусной кислоты + 97 мл дистиллированной воды) |
| 1 мл туберкулина шприц с прикрепленными 26 G х 3/8 в внутрикожные иглы конические | BD | 305946 | Для инъекций AOM |
Ссылки
- Ekbom, A. Ulcerative colitis and colorectal cancer. A population-based study. N. Engl. J. Med. 323, 1228-1233 (1990).
- Terzic, J. Inflammation and colon cancer. Gastroenterology. 138, 2101-2114 (2010).
- Ullman, T. A., Itzkowitz, S. H. Intestinal inflammation and cancer. Gastroenterology. 140, 1807-1816 (2011).
- Okayasu, I. Dysplasia and carcinoma development in a repeated dextran sulfate sodium-induced colitis model. J. Gastroenterol. Hepatol. 17, 1078-1083 (2002).
- Kanneganti, M., Mino-Kenudson, M., Mizoguchi, E. Animal models of colitis-associated carcinogenesis. J. Biomed. Biotechnol. 342637, (2011).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nat. Protoc. 2, 1998-2004 (2007).
- Tanaka, T. A novel inflammation-related mouse colon carcinogenesis model induced by azoxymethane and dextran sodium sulfate. Cancer Sci. 94, 965-973 (2003).
- De Robertis, M. The AOM/DSS murine model for the study of colon carcinogenesis: From pathways to diagnosis and therapy studies. J. Carcinog. 10, 9 (2011).
- Wirtz, S. Chemically induced mouse models of intestinal inflammation. Nat. Protoc. 2, 541-546 (2007).
- Cooper, H. S. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 69, 238-249 (1993).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nat. Protoc. 1, 2900-2904 (2006).
- Becker, C., Fantini, M. C., Wirtz, S., Nikolaev, A., Kiesslich, R., Lehr, H. A., Galle, P. R., Neurath, M. F. In vivo imaging of colitis and colon cancer development in mice using high resolution chromoendoscopy. Gut. 54, 950-954 (2005).
- Shaker, A. Epimorphin deletion protects mice from inflammation-induced colon carcinogenesis and alters stem cell niche myofibroblast secretion. J. Clin. Invest. 120, 2081-2093 (2010).
- Boivin, G. P. Pathology of mouse models of intestinal cancer: consensus report and recommendations. Gastroenterology. 124, 762-777 (2003).
- Cooper, H. S. Dysplasia and cancer in the dextran sulfate sodium mouse colitis model. Relevance to colitis-associated neoplasia in the human: a study of histopathology, B-catenin and p53 expression and the role of inflammation. Carcinogenesis. 21, 757-768 (2000).
- Yoshida, Y. The forkhead box M1 transcription factor contributes to the development and growth of mouse colorectal cancer. Gastroenterology. 132, 1420-1431 (2007).
- Suzuki, R. Strain differences in the susceptibility to azoxymethane and dextran sodium sulfate-induced colon carcinogenesis in mice. Carcinogenesis. 27, 162-169 (2006).
- Mahler, M. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. Am. J. Physiol. 274, 544-551 (1998).
- Nambiar, P. R. Preliminary analysis of azoxymethane induced colon tumors in inbred mice commonly used as transgenic/knockout progenitors. Int. J. Oncol. 22, 145-150 (2003).
- Tanaka, T. Colorectal carcinogenesis: Review of human and experimental animal studies. J Carcinog. 8, (2009).
- Ciorba, M. A. Induction of IDO-1 by immunostimulatory DNA limits severity of experimental colitis. J. Immunol. 184, 3907-3916 (2010).
- Kerr, T. A. Dextran sodium sulfate inhibition of real-time polymerase chain reaction amplification: A poly-A purification solution. Inflamm. Bowel Dis. 18, 344-348 (2012).
- Tang, Y. is required for resection-induced changes in apoptosis, proliferation, and members of the extrinsic cell death pathways. Gastroenterology. 126, 220-230 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены