È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modellazione Colite-Associated Cancro con azoxymethane (OMA) e sodio solfato destrano (DSS)
In questo articolo
Riepilogo
Dimostriamo un protocollo in cui somministrazione del azoxymethane agente genotossico (AOM) seguito da tre cicli di pro-infiammatoria agente destrano solfato di sodio (DSS) rapidamente e genera costantemente tumori del colon in topi con somiglianze morfologiche e molecolari a quelli osservati negli colite umana cancro-associata.
Abstract
I soggetti con malattia infiammatoria intestinale (IBD), come il morbo di Crohn (CD) o la colite ulcerosa (UC) sono ad aumentato rischio di sviluppare il cancro del colon-retto (CRC) su individui sani. Questo rischio è proporzionale alla durata e l'estensione della malattia, con una incidenza cumulativa fino al 30% in individui con UC di lunga data con ampio coinvolgimento del colon. 1 displasia del colon in IBD e la colite associata cancro (CAC) si ritiene che si sviluppano come conseguenza di ripetuti cicli di lesione cellulare epiteliale e la riparazione mentre queste cellule sono immersi in un ambiente citochina infiammatoria cronica. 2 Mentre cancri spontanei e colite associata parti la qualità di adenocarcinomi essendo, la sequenza di eventi molecolari sottostanti si crede di essere diverso. 3 Questo distinzione sostiene la necessità di modelli animali specifici di CAC.
Modelli murini diversi esistono attualmente per lo studio di CAC. Destrano solfato Sodium (DSS), un agente con effetti tossici diretti sul epitelio del colon, può essere somministrata in acqua potabile a topi in più cicli per creare uno stato infiammatorio cronico. Con durata sufficiente, alcuni di questi topi svilupperanno tumori. 4 sviluppo tumorale è accelerato in questo modello se somministrato in un pro-cancerogene impostazione. Questi includono i topi con mutazioni genetiche nei percorsi tumorigenesi (APC, p53, MSH2), così come topi pre-trattati con agenti genotossici (azoxymethane [AOM], 1,2-dimetilidrazina [DMH]) 5.
La combinazione di DSS con OMA come modello per il cancro colite associata ha guadagnato popolarità per la sua riproducibilità, potenza, prezzo basso, e facilità d'uso. Se hanno un meccanismo condiviso, AOM è stato trovato per essere più potente e stabile in soluzione di DMH. Mentre lo sviluppo del tumore in altri modelli generalmente richiede diversi mesi, topi iniettati con AOM e successivamente trattato con DSS sviluppano tumori adeguate in uns soli 7-10 settimane. 6, 7 Infine, AOM e DSS può essere somministrato a topi di qualsiasi background genetico (knock out, transgenica, ecc) senza incroci per un ceppo specifico oncogeno. Qui, dimostriamo un protocollo per l'infiammazione-driven tumorigenesi del colon nei topi utilizzando una singola iniezione di OMA seguito da tre cicli di sette giorni di DSS per un periodo di 10 settimane. Questo modello induce tumori con alterazioni istologiche e molecolari molto simili a quelle che si verificano in CAC umana e fornisce un modello di grande valore per lo studio della oncogenesi e chemioprevenzione in questa malattia. 8
Protocollo
1. Colite associata a cancro induzione
- Mettere da parte le gabbie di sesso e di pari età 6-8 topi settimana fa da utilizzare per i gruppi sperimentali e di controllo. I topi possono essere etichettati singolarmente con le marcature coda o clip orecchio.
- Al giorno 0, i pesi di base registrare e iniettare ciascun topo per via intraperitoneale (IP) con 10 mg / kg di soluzione AOM lavoro (1 mg / ml in soluzione salina isotonica, diluito da 10 mg / ml di soluzione concentrata in dH2O mantenuta a -20 gradi C) . In base all'esperienza, questa dose può essere regolata tra 7-14 mg / kg e / o ripetuto all'inizio dell'esperimento.
Attenzione: AOM è un agente genotossico volatili e devono essere maneggiati con cura in base alla scheda di sicurezza di accompagnamento. Le diluizioni devono essere preparate in una cappa chimica, mantenuto su ghiaccio, ed eliminato secondo protocolli specifici dell'ente.
- Fare un 2,5% (2,5 g/100 ml) soluzione DSS in acqua distillata e passa attraverso un acetato di cellulosa f 0,22 micronilter sotto vuoto. Questa dose può essere regolata tra 1-3,5% a seconda del ceppo di topi e l'ambiente. Una volta preparata, la soluzione DSS può essere conservato in frigorifero per un massimo di 1 settimana.
- Il giorno 7, DSS soluzione di approvvigionamento di topi come l'acqua potabile. Circa 250 ml / gabbia sarà necessario ogni volta che viene fornito DSS nuovo per un massimo di 5 topi / gabbia, ma questi sono solo stime e possono variare a seconda del tipo di bottiglie di acqua utilizzati nel stabulario.
- Per fornire un approvvigionamento continuo di DSS per sette giorni, la soluzione DSS devono essere sostituiti in bottiglie pulite tre volte (ogni 2-3 giorni) durante questo periodo. Alcuni ricercatori misurare la quantità di DSS consumati prima di sostituire con nuova soluzione come misura di esposizione.
- Il giorno 14, passare gabbie torna all'acqua potabile standard per due settimane.
- Ripetere i punti (1,4) - (1,6) nei giorni 28 e 49 per fornire un secondo e terzo ciclo di DSS. Un DSS "ciclo" consiste di una settimana di DSS in acqua potabileseguito da 2 settimane di regolare (autoclave) di acqua.
2. Colite valutazione clinica e la progressione del tumore
- I topi dovrebbero essere pesati / osservate 2-3 volte a settimana. Perdita di peso percentuale rispetto al basale è utilizzato come parametro di misurazione della gravità colite. Valutazioni periodiche di sanguinamento rettale, diarrea, o prolasso può essere fatta a seconda degli obiettivi sperimentali e conformemente ai sistemi di valutazione diversi. 9, 10
- Una perdita di peso fino al 10% con 2-3 giorni di diarrea e sanguinamento rettale si può aspettare la settimana successiva un ciclo completo di DSS (osservazione quotidiana può essere utile in questo immediato post-DSS periodo).
È possibile che alcuni topi non può recuperare; topi perdere superiore al 20% del loro peso sono meno probabilità di sopravvivere e possono richiedere eutanasia precoce. Una iniezione singolo IP di 0,5-1,0 ml di soluzione salina nei topi queste può essere una misura utile di sostegno di colmarlo frazio del volume d persi a causa di diarrea.
3. Murine Endoscopia (opzionale)
- Endoscopia seguendo il ciclo secondo o terzo DSS può essere effettuata per confermare la crescita tumorale in vivo prima del sacrificio. Come il AOM / modello DSS è abbastanza affidabile nella produzione di tumori, questo passaggio non è generalmente necessario. Solo pochi topi dovrebbe valutati con questo metodo, in quanto ha il potenziale di distruggere i tumori del mouse 11.
- Anestetizzare il mouse con sedazione per via inalatoria o iniettabili.
- Dopo mouse è anestetizzato, fissare il mouse per una tavola piatta con nastro alla coda e al torace.
- Far avanzare l'endoscopio murino nel retto del mouse delicatamente con soluzione fisiologica per gonfiare e irrigare per migliorare vista intraluminale e rimuovere i contenuti fecali. (Si noti che l'endoscopia può essere effettuata anche mediante insufflazione di aria come alternativa alla soluzione salina e questa tecnica può offrire una migliore visualizzazione del tumore. 12)
- Il giorno 70, ogni AOM / DSS topo trattato dovrebbe ospitare tumori del colon più ed essere pronti per la valutazione. Questa data può essere ritardato di settimane o mesi, se i tumori più grandi si desiderano. (Da notare che i topi con prolasso rettale grave può essere necessario eutanasia presto per evitare disagi eccessivi per gli animali come per i comitati istituzionali la cura degli animali.)
- Prima di necroscopia, individualmente eutanasia topi con isoflurano e dislocazione cervicale (o altro metodo istituzionalmente approvato). Peso finale e altre misurazioni possono essere effettuate in questo momento.
- Posare il mouse con il suo lato ventrale esposto su un tagliere. Coprire l'addome con etanolo 70% per evitare peli contamini il contenuto addominale durante l'estrazione del colon.
- Usare pinze per afferrare la linea mediana dell'addome e fare una piccola incisione per esporre il peritoneo.
- Estendere questa incisione su ciascun lato del ventre lungo la Margi costalen.
- Utilizzare le forbici per tagliare attraverso il bacino in modo che il colon può essere raccolto alla giunzione ano-rettale. Questo è importante perché infortunio colite DSS è più grande al retto distale e corrispondentemente, questa è la regione di maggiore sviluppo tumorale.
- Altri tessuti come i linfonodi mesenterici possono essere raccolti in questo momento.
5. Preparazione del colon per l'analisi macroscopica
- Usando un ago 18G gavage attaccato ad una siringa da 5 ml, lavare il colon con gelida tampone fosfato salino (PBS) tale che esce fluido nella direzione fisiologica. Se il tessuto del colon verrà utilizzato per RNA o proteina-based analisi, può essere mantenuto freddo impiegando pre-raffreddate vassoi lavoro.
- Aprire i due punti arrossato longitudinalmente lungo il suo mesentere e vernice sul vassoio freddo. I tumori sono più facilmente visualizzato quando il colon è posto su una superficie scura. In alternativa, 1% Alcian blue colorante può essere applicata per evidenziare tumors. Valutare il numero e le dimensioni del tumore, con un righello o un calibro digitale.
- Piccole sezioni di tumore e tessuto normale adiacente possono essere asportati a questo punto per analisi future da RNA, proteine, o immunoistochimiche (IHC) metodi, lasciando una parte del colon rimanente per la valutazione istologica.
Fotografia digitale dei campioni del colon lordi immediatamente successivi punto 5.2 può essere utile per l'analisi precisa del carico tumorale, soprattutto se porzioni significative dei due punti vengono asportate per altre forme di analisi come descritto in precedenza. Massa tumorale (%) può essere calcolato come area tumorale / area totale del colon utilizzando software libero come ImageJ.
6. Preparazione del colon per la valutazione istologica
- Applicare formalina al 10% per i due punti rimanenti sul vassoio freddo tramite siringa o un dito. Consentendo di fissare il tessuto per almeno 30 secondi in questo modo facilita il trasferimento al bacino fissaggio. Assicurarsi che residua formalina è wiped off prima di dipingere i due punti nuova aperta sul vassoio stesso.
- Trasferire i due punti di un bacino pieno di formalina al 10% e di definire con precisione sui bordi.
- Dopo 3 ore di fissazione, di trasferire i due punti al 70% di etanolo. Due punti possono essere conservati in etanolo 70% indefinitamente.
- Tre sezioni longitudinali colon (prossimale, intermedio, distale / retto) può essere stabilizzata in 2% agar e sottoposti paraffina. Assicurare che il colon prossimale e distale colon / retto sono orientati in modo uniforme per ciascun topo.
- Displasia, danno cripta, e l'infiammazione possono essere descritti e valutati da un individuo esperto secondo protocolli pubblicati in precedenza. 10, 13-15 I topi possono essere sacrificati prima del giorno 70 se lo sperimentatore è interessato a rilevare i primi eventi displasici.
7. Risultati rappresentativi
L'AOM / DSS modello descritto nel presente documento consente al ricercatore di generino tumori del colon nei topi.La crescita del tumore in questo modello è direttamente influenzato dal processo infiammatorio associato. Gravità colite deve essere monitorato clinicamente seguendo perdita di peso e la presenza di diarrea / hematochezia (Figura 2). Questi segni di attività della malattia tendono a iniziare 5 giorni del ciclo DSS e per quattro o più giorni dopo DSS viene rimosso. Raramente, i topi con un notevole carico di tumore rettale in grado di sviluppare prolasso rettale. Dopo il secondo o terzo ciclo di diarrea DSS può diventare persistente. Tipicamente tumori sono presenti e identificabili mediante colonscopia murino prima del terzo ciclo di DSS (Figura 3). Altro tempo e un terzo ciclo di risultati DSS in tumori di dimensioni maggiori al momento della raccolta (figura 4). Uso di applicazione topica Alcian colorazione blu può essere utilizzato per evidenziare tumori (Figura 5). Fotografie dei tumori del colon aiuterà a generare misurazioni tumorali che possono essere utilizzati per confrontare quantitativamente la produzione e la dimensione del tumoretra gruppi sperimentali (Figura 6). Fissi e paraffina campioni colon incorporati possono poi essere valutati per istologia o con l'uso di colorazione immunoistochimica (Figure 7 e 8).
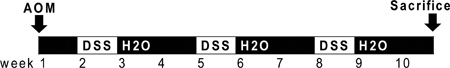
Figura 1. Schema di OMA e amministrazione DSS. AOM (10 mg / kg) viene iniettato il giorno 0. All'inizio della seconda settimana (giorno 7), soluzione DSS 2,5% viene somministrato a topi nell'acqua potabile. Sette giorni di DSS è seguita da due settimane di acqua autoclavato. Un ulteriore due cicli di DSS vengono somministrati prima del sacrificio.

Figura 2. Peso del mouse rispetto al basale durante OMA e amministrazione DSS. Si noti che nella settimana successiva ogni ciclo DSS, topi los e 5-10% del loro peso corporeo. La perdita di peso in questo esperimento è un marker surrogato per gravità colite.
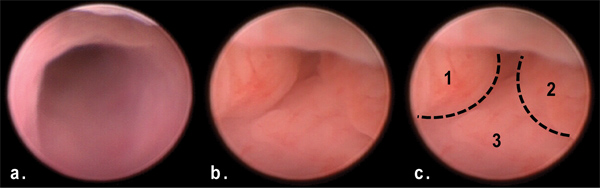
Figura 3. Veduta di tumori nel colon distale via murino endoscopia al giorno 50 di OMA / DSS trattamento. Nota masse multiple polipoidi ostruiscono il lume del colon distale (b, c) rispetto al colon normale (a).
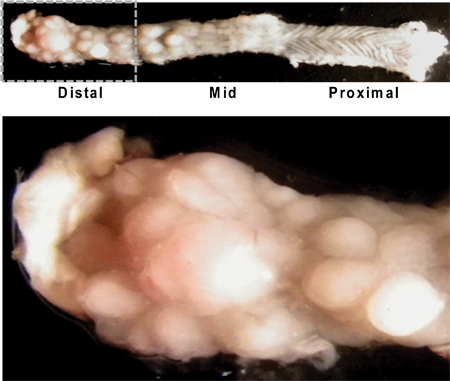
Figura 4. Longitudinalmente aperto due punti del mouse illustra aspetto macroscopico di tumori. Nota l'onere maggiore del tumore nel colon distale / retto (immagine in alto a sinistra), e la caratteristica consistenza ondulato del colon prossimale (immagine in alto a destra) con poca crescita tumorale. Un vicino di vista del colon distale mostra numerosi tumori di varie dimensioni (sotto).
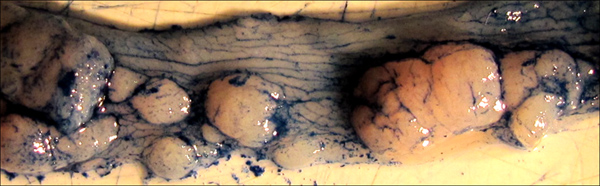
Tumori Figura 5. Evidenziati mediante l'applicazione di Alcian blu macchia. Si noti come il colorante evidenzia la consistenza normale del colon, nonché i confini di ogni singolo tumore. Tale colorazione può essere utile per la misurazione precisa delle aree tumorali di righello o di misura digitale.
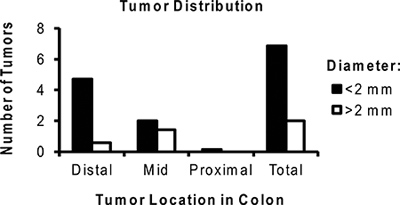
Figura 6. Distribuzione rappresentativa del numero medio dei tumori per topo trattati con AOM / DSS. Notare la maggior parte dei tumori sono localizzati nel colon distale e sono <2 mm.
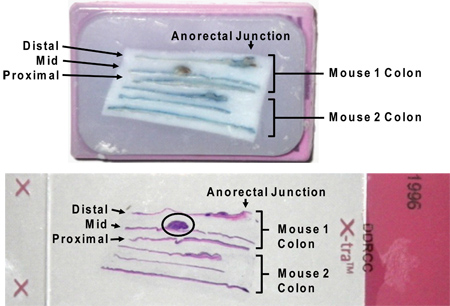
Figura 7. Incluse in paraffina sezioni longitudinali del colon in cassetta (sopra) und su vetrino dopo colorazione H & E (sotto). Notare che Alcian blue residua macchia non interferisce con H & E colorazione. Un tumore di grandi dimensioni è cerchiato sul l'immagine della diapositiva (cerchiato). Le denominazioni "distale", "medio" e "" risultato prossimale da sezionare tutto il colon in terzi tra il cieco e l'ano.

Figura 8. Istologia rappresentante di un tumore derivante da OMA / DSS amministrazione nel colon distale. H & E, BrdU, e vetrini colorati β-catenina a 50X (pannello in alto) e 400X (pannello in basso) rispettivamente dimostrare cambiamenti displastiche simili a adenocarcinomi umani del colon.
Discussione
Il trattamento dei topi con OMA e DSS rapidamente ed efficacemente i modelli umani colite associata a cancro. Ipotesi riguardanti i fattori ereditari contribuiscono alla colite tumori associati possono essere facilmente studiato con topi geneticamente. 13, 16 In alternativa, l'effetto di bersagli farmacologici in colite associata a cancro può essere studiata utilizzando topi wild-type.
Anche se questo modello è molto apprezzato da coloro che sono interessati allo studio dell...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato in parte finanziato dal DK089016 e L30 RR030244 (MAC), CA153036 (AS), e P30-DK52574 (al Core Digestive Diseases Washington University Research). AIT è stato un Howard Hughes Medical Institute Research Fellow Medical Training.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
| C57BL/6J Mice | Jackson Laboratory | 000664 | |
| Azoxymethane (AOM) | Sigma Aldrich | A5486-100MG | Soluzione stock: diluire a 10 mg / ml in acqua distillata per essere conservato a -20 ° C dello 0,5 - aliquote da 1 ml. Soluzione di lavoro: diluire magazzino a 1 mg / ml in isotonica (0,9%) soluzione salina |
| Destrano sodio solfato (DSS) | TdB Consulenza | DB001 | MW 40 kDa (36-50 kDa preparati provenienti da altre fonti sono accettabili; Lo stesso lotto deve essere utilizzato per un singolo esperimento) 6 |
| Coloviewsistema miniendoscopic | Karl Storz | Multiplo | Vedi Becker et al. Per una spiegazione dettagliata delle attrezzature e la configurazione 11. |
| TPP Rapid FilterMax flacone da 500 ml-Filter, 0,22 micron PES | Midwest scientifico | TP99500 | Ogni filtro standard coltura dei tessuti è accettabile |
| Alcool etilico 200 Proof ASC / USP | Farmaco-AAPER (o altro) | 11ACS200 | Diluire al 70% in acqua distillata |
| Isoflurano, USP | Butler Animal Health di alimentazione | 4029405 | Topo Mettere in vaso di vetro con una garza o un piccolo panno imbevuto di anestetico |
| 18G ago dritto Gavage | Braintree scientifico | N-008 | |
| Soluzione tampone fosfato (PBS) | SigmaAldrich | P5493 | Diluire a 1X (0,01 M) in acqua distillata |
| Vassoio freddo (tavola Tissue Tek II a freddo) | Fisher Scientific | NC9491941 | Conservare a -20 ° C |
| ImageJ Software | NIH (download gratuito) | http://rsbweb.nih.gov/ij/ | |
| Formaldeide (37%) | Fisher Scientific | F79-500 | Diluire al 10% in PBS |
| BD Bacto Agar | Fisher Scientific | DF0140-01-0 | Utilizzare piastra per creare soluzione al 2% in acqua distillata |
| Miltex Eye Dressing Pinze | MedPlus Inc. | 18-780 | |
| Miltex Eye Forbici | MedPlus Inc. | 18-1430 | punti curvi evitare danni al colon in fase di apertura. |
| Alcian Blu 8GX (polvere) | Sigma Aldrich | A5268 | Aggiungere 1 g di polvere per 100 ml di acido acetico al 3% (3 ml di acido acetico glaciale + 97 ml di acqua distillata) |
| 1 ml siringa da tubercolina con annesso 26 G x 3/8 ago smusso intradermica | BD | 305946 | Per l'iniezione di OMA |
Riferimenti
- Ekbom, A. Ulcerative colitis and colorectal cancer. A population-based study. N. Engl. J. Med. 323, 1228-1233 (1990).
- Terzic, J. Inflammation and colon cancer. Gastroenterology. 138, 2101-2114 (2010).
- Ullman, T. A., Itzkowitz, S. H. Intestinal inflammation and cancer. Gastroenterology. 140, 1807-1816 (2011).
- Okayasu, I. Dysplasia and carcinoma development in a repeated dextran sulfate sodium-induced colitis model. J. Gastroenterol. Hepatol. 17, 1078-1083 (2002).
- Kanneganti, M., Mino-Kenudson, M., Mizoguchi, E. Animal models of colitis-associated carcinogenesis. J. Biomed. Biotechnol. 342637, (2011).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nat. Protoc. 2, 1998-2004 (2007).
- Tanaka, T. A novel inflammation-related mouse colon carcinogenesis model induced by azoxymethane and dextran sodium sulfate. Cancer Sci. 94, 965-973 (2003).
- De Robertis, M. The AOM/DSS murine model for the study of colon carcinogenesis: From pathways to diagnosis and therapy studies. J. Carcinog. 10, 9 (2011).
- Wirtz, S. Chemically induced mouse models of intestinal inflammation. Nat. Protoc. 2, 541-546 (2007).
- Cooper, H. S. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 69, 238-249 (1993).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nat. Protoc. 1, 2900-2904 (2006).
- Becker, C., Fantini, M. C., Wirtz, S., Nikolaev, A., Kiesslich, R., Lehr, H. A., Galle, P. R., Neurath, M. F. In vivo imaging of colitis and colon cancer development in mice using high resolution chromoendoscopy. Gut. 54, 950-954 (2005).
- Shaker, A. Epimorphin deletion protects mice from inflammation-induced colon carcinogenesis and alters stem cell niche myofibroblast secretion. J. Clin. Invest. 120, 2081-2093 (2010).
- Boivin, G. P. Pathology of mouse models of intestinal cancer: consensus report and recommendations. Gastroenterology. 124, 762-777 (2003).
- Cooper, H. S. Dysplasia and cancer in the dextran sulfate sodium mouse colitis model. Relevance to colitis-associated neoplasia in the human: a study of histopathology, B-catenin and p53 expression and the role of inflammation. Carcinogenesis. 21, 757-768 (2000).
- Yoshida, Y. The forkhead box M1 transcription factor contributes to the development and growth of mouse colorectal cancer. Gastroenterology. 132, 1420-1431 (2007).
- Suzuki, R. Strain differences in the susceptibility to azoxymethane and dextran sodium sulfate-induced colon carcinogenesis in mice. Carcinogenesis. 27, 162-169 (2006).
- Mahler, M. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. Am. J. Physiol. 274, 544-551 (1998).
- Nambiar, P. R. Preliminary analysis of azoxymethane induced colon tumors in inbred mice commonly used as transgenic/knockout progenitors. Int. J. Oncol. 22, 145-150 (2003).
- Tanaka, T. Colorectal carcinogenesis: Review of human and experimental animal studies. J Carcinog. 8, (2009).
- Ciorba, M. A. Induction of IDO-1 by immunostimulatory DNA limits severity of experimental colitis. J. Immunol. 184, 3907-3916 (2010).
- Kerr, T. A. Dextran sodium sulfate inhibition of real-time polymerase chain reaction amplification: A poly-A purification solution. Inflamm. Bowel Dis. 18, 344-348 (2012).
- Tang, Y. is required for resection-induced changes in apoptosis, proliferation, and members of the extrinsic cell death pathways. Gastroenterology. 126, 220-230 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon