需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
淀粉样前体蛋白胞内结构域的分离纯化和聚集
摘要
APP胞内结构域(AICD)用于大规模纯化的方法,进行说明。我们也将介绍的方法来诱导
摘要
淀粉样前体蛋白(APP)是与阿尔茨海默氏病(AD)的发病机制相关联的I型跨膜蛋白。 APP是其特征在于由一个大的胞外结构域和一个短的胞质域称为APP胞内结构域(AICD)。在成熟过程中通过分泌途径,APP可以由蛋白酶被称为α,β,和γ-分泌1裂解。顺序的蛋白水解切割APP的β和γ-分泌导致一个小的蛋白水解肽,称为Aβ是淀粉样蛋白形成和老年斑的核心成分的生产。 AICD是从膜中解放出来后分泌处理,并通过FE65和TIP60的相互作用,可转位到细胞核内参与多个靶基因的转录调节2,3。蛋白质 - 蛋白质相互作用的AICD可能会影响贩运,加工,细胞功能的全息APP和C-termin人的片段。最近,我们已经表明,AICD可以聚集在体外 ,而这个过程被抑制的AD-牵连分子伴侣ubiquilin的,1 4。与这些结果一致,AICD暴露出疏水区,并有内在的紊乱体外 5,6,但它获得稳定的二级结构时,势必FE65 7。我们已经提出,ubiquilin-1防止AICD不适当间和分子内相互作用,防止聚集在体外和在完整细胞4。虽然大多数研究专注于APP在AD的发病机制中的作用,AICD在这个过程中的作用目前尚不清楚的。已被证明的表达AICD诱导细胞凋亡8,调制信号通路9,调节钙信号10。 AICD和FE65过度表达的转基因小鼠模型中诱导阿尔茨海默氏症样病变11日 ,并于最近AICD中发现了胸罩在裂解液免疫印迹当使用合适的抗原修复技术12。为了方便的AICD的结构,生化和生物物理研究,我们开发了一个程序,以重组产生大量的高纯度AICD蛋白。我们进一步对诱导在体外热聚集,的AICD并分析利用原子力显微镜的描述方法。描述的方法是有用的生物化学,生物物理与结构表征,AICD的影响AICD聚集的分子伴侣。
研究方案
1。表达的重组APP胞内结构域(AICD)
- 变换E. coli菌株BL21与人类AICD(残基649-695的APP,神经元亚型编号)克隆到载体pGEX-4T-1(GE Healthcare公司)。该载体将快递AICD作为谷胱甘肽-S-转移酶(GST)的融合蛋白的C-末端基团。该载体也编码凝血酶裂解序列的GST部分以有利于去除。 AICD的克隆到pGEX-4T-1的详细信息可以在我们以前出版4。
- 从单菌落,接种用氨苄青霉素(100微克/毫升)的10毫升的LB肉汤培养基中,并在37℃下剧烈振荡培养过夜。
- 第二天早晨,接种400毫升LB /氨苄青霉素在一个1升的烧瓶中,用5ml的过夜培养。
- 孵育在37℃下剧烈振荡培养,直至在600 nm处的光密度达到0.4到0.6。这通常需要2到2.5小时。
- 加入0.4毫米的异丙基-β-D-半乳糖苷(IPTG)诱导表达的GST-AICD。剧烈摇动5小时,在37℃下孵育。
- 离心细胞在4℃下以6,000 xg离心15分钟将细胞沉淀在-80℃下,可以存储数个月,在这一点上的程序。
2。纯化GST-AICD的
- 准备50 ml裂解缓冲液中,如下所示:1mM的乙二胺四乙酸(EDTA),1mM的二硫苏糖醇,0.1%的Triton-X100,1mM苯甲基磺酰氟(PMSF),完全蛋白酶抑制剂鸡尾酒(罗氏应用科学),和磷酸盐缓冲盐水。冰浴。
- 解冻后细菌沉淀(如果先前冻结)冰。
在这一点上,这是至关重要的所有步骤都在4℃下进行,以限制的蛋白水解。所有的试管,缓冲剂,和其他试剂应该是预冷。如果使用法国媒体或乳化剂的溶解,这些都应该是预冷。
- 彻底细菌沉淀悬浮在20毫升的裂解缓冲液中。用10ml移液管在冰上的涡流和研磨的组合将确保沉淀完全重悬。
- 通过通过乳化剂的再悬浮的细菌细胞( 例如 ,Avestin EmulsiFlex-C 3)或法国的压力盒,预先冷却至4℃下以30,000磅。通过溶胞产物通过乳化剂的第二时间。成预先冷却的50毫升的试管中收集的溶胞产物。
这两个工具的主要优点是,它们最大限度地减少样品的加热。常用的技术的超声产生显着的声处理探针的尖端处的热量,并可以导致重组蛋白质的聚集。
- 离心裂解液以15,000 xg离心30分钟。分离并保持成预先冷却的50毫升的试管上清液。
- 加入500μl的谷胱甘肽 - 琼脂糖(Sigma-Aldrich公司)的50%的淤浆。旋转30分钟,在4℃下当样品旋转,使新鲜的洗脱缓冲液:50mM的Tris 7.8,0.1%的Triton-X100,0.5 mM的二硫苏糖醇,10mM还原型谷胱甘肽。
的唯一步骤的协议,它是在室温下进行的洗脱步骤。因此,洗脱缓冲液在室温下保持。洗脱缓冲液应新鲜配制。
- 的溶胞产物和淤浆倒入到5"一次性聚苯乙烯色谱柱与粗(90-130微米)过滤器(常绿科学)。洗净塔5次,用3毫升的磷酸盐缓冲盐水。
- 盖上的列的底部和室温洗脱缓冲液中加入500μl。盖上的顶部列和5分钟,在室温下旋转。冰鲜1.5 ml离心管,收集洗脱液。重复洗脱2次以上(总共需要1.5毫升的洗脱液)。
- 透析的洗脱液在10,000分子量截止透析膜( 例如 ,Thermo Scientific的幻灯片-A仪透析盒),在4升的磷酸盐缓冲盐水中,在4℃下过夜透析对额外的4升的磷酸盐缓冲盐水中,在4℃下1小时,翌日。
- 除去蛋白质从透析盒进行蛋白定量测定,以确定产量的GST-AICD。从400毫升培养一个典型的纯化将导致产率> 20毫克的纯化蛋白的浓度为10-20毫克/毫升。等分试样的蛋白质成200μl的等份并冷冻在-80℃下
3。凝血酶切割GST-AICD和纯化AICD
- 解冻200μl的纯化GST-AICD,加入20μl1 U /μl的血栓形成英寸,37℃孵育过夜。
制造商之间的凝血酶的质量和纯度有很大的差别,并且可以是一个重大的污染来源。我们使用凝血酶GE医疗(见表的试剂)。过夜培养后,> 95%应裂解的融合蛋白( 图1B)。
- 与凝血酶裂解过夜后,它很可能是一小部分被解放的AICD聚集和解决方案可能出现混浊。删除的聚合材料通过离心分离30分钟,在4℃下以20,000 xg离心到预冷冻的微量离心管中,除去上清液。
- 加入50μl的50%谷胱甘肽 - 琼脂糖浆料和50μl50%对 - 氨基苯甲脒 - 琼脂糖浆料以除去GST和凝血酶,分别。孵育5分钟,在室温下的旋转。
- 短暂离心沉淀琼脂糖珠,去除上清到一个新的管。提取吨他GST与谷胱甘肽 - 琼脂糖四次。与p-氨基苯甲脒-琼脂糖是一个单一的提取足以除去20 U的凝血酶。
- 5微升的纯化AICD执行蛋白定量测定。从400毫升培养物的典型产率在0.2至0.5毫克/毫升的浓度为50〜100微克。较高的收益率是可能的裂解更大量的GST-AICD。
纯净的AICD应新鲜配制,生物化学/生物物理特性。未使用的材料应被丢弃。它也可以通过冷冻干燥的样品,并重新悬浮在一个更小的体积的缓冲液6集中AICD。如果检测到的AICD需要杂交后(如过滤器陷阱或斑点杂交实验),应进行描述由Pimplikar和Suryanarayana 12细胞膜上的抗原检索。
4。 AICD聚合原子力显微镜(AFM)
- 稀释新鲜烹制的AICD在phosphate缓冲盐水中的浓度为0.1毫克/毫升的最终体积为15微升。在这一点上,各种化合物和/或蛋白可加入,以确定它们是否抑制AICD聚集。例如,我们已经表明,在该测定4等摩尔浓度的ubiquilin-1防止聚集AICD。
另外,也可以聚合反应体积较大的生化实验,如过滤器捕集阱检测和光散射4。我们已经成功地执行过滤器捕集阱检测反应混合物的酸稀释到浓度低至1μM为400μL。
- 诱导热聚集在Eppendorf恒温在800 rpm的转速下振荡48小时,在43℃下温育样品。在该温度下根据的伴侣化验,检查热聚集的模型伴侣基板柠檬酸合成酶4,13选择。
热聚合是一种常用的方法诱导的蛋白质的结构转变,从本地到非天然结构(通常是丰富的β折叠),导致分子聚集体的形成。热聚合也可以用来检查功能,可以屏蔽形成不适当的分子间相互作用(从而延缓或防止热聚合)的疏水性链段的分子伴侣。
- 在去离子水和点2μL20倍稀释样品新鲜剥离的云母片上。在干燥器中干燥样品过夜。这将是必要的经验确定的最佳稀释度进行成像,从而几个稀释度范围从10 - 100倍。将审慎。
- 可视化的聚合的AICD使用AFM轻敲模式工作在14。悬臂使用的是镀金微锋利的氮化物的杆(MSNL,布鲁克的名义尖端半径为2 nm)。典型的攻振幅过程中在悬臂的共振频率(30-50千赫)ING成像是10-20纳米。
我们发现,不同的蛋白质聚集体的图像质量和对比度依赖于所施加的力和实验的持续时间。为了尽量减少样品由尖端的扰动,我们保持所施加的力相对低的保持的一组点的比例在95%以上,和限制每个样品的扫描5-10分钟。与WSxM软件(Nanotec的)进行图像处理。标准的图像处理包括平面减法和扁平化。我们的实验室使用"自制的"原子力显微镜连接到商业扫描探针显微镜控制系统(NANOTEC)15。
5。代表性的成果
示出在图1A中的表达及相对富集的GST-AICD。裂解后,大部分的融合蛋白是存在于可溶组分,并因此从inclusi萃取对机构不是必需的。从谷胱甘肽琼脂糖柱洗脱的材料,纯度> 95%。在制备图1中所示,从柱中洗脱的蛋白质浓度为14.5毫克/毫升,且产率为22毫克(400毫升)从起始的培养。 200μl的此制备用20 U的凝血酶过夜的裂解导致裂解的融合蛋白( 图1B)几乎为100%。所用的凝血酶的量是足够低,以不被察觉,考马斯亮蓝染色(参见"劈开"车道, 图1B)。凝血酶和GST的去除导致丧失一些的材料,然而它是> 90%纯的浓度为0.35毫克/毫升的收率在此准备70微克AICD在图1C中示出的流程图,用于聚集AICD和随后的分析。 AICD的聚集体通过AFM成像通常球体/无定形的,尺寸范围从50至100纳米( 图1D,F)。汇总材料是不可检测的,当等摩尔量的分子伴侣ubiquilin-1被添加到的聚集反应( 图1E)4。
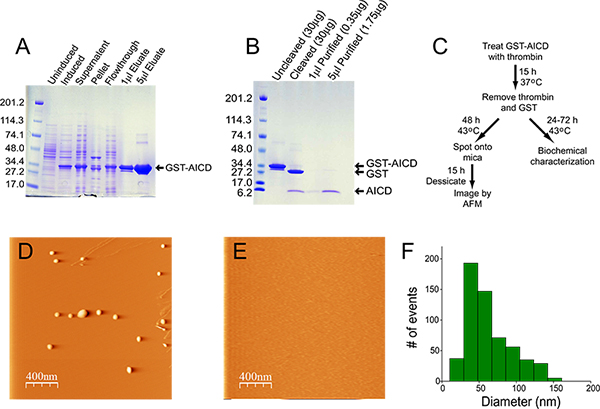
图1。纯化和聚集AICD A)考马斯亮蓝染色的纯化过程中的每个步骤,在采集的样本。对于未诱导的和诱导的样品中,20微升的总细菌凝胶上运行。上清液部分,5μl的溶胞产物(从总体积为20ml),在凝胶上运行。对于沉淀级分中,将沉淀物重新悬浮于20 ml裂解缓冲液,5微升这种材料,超声处理30分钟,在水浴中超声波发生器,在4℃下前装载到凝胶。对于流出液,5微升,在凝胶上运行。加载到凝胶洗脱液的量表示。 B)考马斯亮蓝染色的凝胶的未裂解的和被裂解的GST-AICD(2微升),1和5&米U;升纯化AICD。 C)的AICD的纯化,聚合和分析的流程。 D,E)代表的AFM图像的热AICD中的情况下(D)和存在的分子伴侣ubiquilin-1(E)的聚合。 F)AICD的聚集体的粒度分布的直方图。
讨论
在这个协议中,我们提出的结构,生物物理和生物化学分析,获得高纯度的AICD的程序。此过程不需要复杂的色谱仪,因此大多数实验室访问。其他团体纯化的AICD 5-7,16,包括GST-AICD 17日至19日 ,生化/结构的分析。到先前的协议的缺点包括AICD 16的溶解性差,小于理想纯度17,和尺寸排阻16的要求,或反相色谱法6,20。因此,这里所描述的协议,极大地?...
披露声明
没有利益冲突的声明。
致谢
作者要感谢郑晖博士(美国贝勒医学院)的APP基因。这个工作是由美国国立卫生研究院资助R21AG031948(DB,JMB),F30AG030878(ESS),R01DK073394(AFO),约翰·西利纪念基金会生物医学研究基金(AFO),并在Jean C.和威廉·D·威利斯神经研究基金(ESS)。 ,JMB是一个学者的翻译研究学者项目和大学的德克萨斯州医学科克劳德·E.辣椒年长美国人独立中心的成员(由美国国立卫生研究院资助UL1RR029876和P30-AG-024832,分别支持)。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录编号 | 评论 |
| PGEX-4T-1 | GE医疗集团 | 28-9545-49 | |
| 凝血酶 | GE医疗集团 | 27-0846-01 | |
| 氨苄青霉素 | Fisher Scientific则 | BP1760 | |
| Bradford蛋白测定试剂 | Bio-Rad公司 | 500-0002 | |
| 考马斯亮蓝 | Bio-Rad公司 | 161-0786 | |
| IPTG(异丙基-β-D硫代半乳糖苷) | Sigma-Aldrich公司 | I6758 | |
| 谷胱甘肽 - 琼脂糖 | Sigma-Aldrich公司 | G4510 | |
| 对氨基苯甲脒琼脂糖 | Sigma-Aldrich公司 | A7155 | |
| 完整的蛋白酶抑制剂混合物 | 罗氏公司 | 11836170001 | |
| 幻灯片-A仪透析磁带的 | Thermo Scientific的 | 66380 | |
| 层析柱 | 长荣科学 | 208-3367-050 | |
| 乳化剂 | Avestin公司 | EmulsiFlex-C3 | 强烈推荐 |
| 的Eppendorf恒温 | Eppendorf公司 | 022670107 | |
| 云母磁盘 | 特德·佩拉 | 50-12 | |
| 原子力显微镜的悬臂 | 布鲁克 | MSNL-10 | |
| WSxM软件 | NANOTEC | N / A | 神父EE下载 |
参考文献
- De Strooper, B., Vassar, R., Golde, T. The secretases: enzymes with therapeutic potential in Alzheimer disease. Nature reviews. Neurology. 6, 99-107 (2010).
- Chang, K. A., Suh, Y. H. Possible roles of amyloid intracellular domain of amyloid precursor protein. BMB reports. 43, 656-663 (2010).
- McLoughlin, D. M., Miller, C. C. The FE65 proteins and Alzheimer's disease. J. Neurosci. Res. 86, 744-754 (2008).
- Stieren, E. S. Ubiquilin-1 is a molecular chaperone for the amyloid precursor protein. J. Biol. Chem. 286, 35689-35698 (2011).
- Ramelot, T. A., Nicholson, L. K. Phosphorylation-induced structural changes in the amyloid precursor protein cytoplasmic tail detected by NMR. J. Mol. Biol. 307, 871-884 (2001).
- Ramelot, T. A., Gentile, L. N. Transient structure of the amyloid precursor protein cytoplasmic tail indicates preordering of structure for binding to cytosolic factors. Biochem. 39, 2714-2725 (2000).
- Radzimanowski, J. Structure of the intracellular domain of the amyloid precursor protein in complex with Fe65-PTB2. EMBO Rep. 9, 1134-1140 (2008).
- Ohkawara, T., Nagase, H., Koh, C. S., Nakayama, K. The amyloid precursor protein intracellular domain alters gene expression and induces neuron-specific apoptosis. Gene. 475, 1-9 (2011).
- von Rotz, R. C. The APP intracellular domain forms nuclear multiprotein complexes and regulates the transcription of its own precursor. J. Cell Sci. 117, 4435-4448 (2004).
- Hamid, R. Amyloid precursor protein intracellular domain modulates cellular calcium homeostasis and ATP content. J. Neurochem. 102, 1264-1275 (2007).
- Ghosal, K., Stathopoulos, A., Pimplikar, S. W. APP intracellular domain impairs adult neurogenesis in transgenic mice by inducing neuroinflammation. PLoS ONE. 5, e11866 (2010).
- Pimplikar, S. W., Suryanarayana, A. Detection of APP intracellular domain in brain tissue. Met. Molecul. Biol. 670, 85-91 (2011).
- Buchner, J., Grallert, H., Jakob, U. Analysis of chaperone function using citrate synthase as nonnative substrate protein. Met. Enzymol. 290, 323-338 (1998).
- Hansma, H. G. Recent advances in atomic force microscopy of DNA. Scanning. 15, 296-299 (1993).
- Valbuena, A. Quasi-simultaneous imaging/pulling analysis of single polyprotein molecules by atomic force microscopy. Rev. Sci. Instrum. 78, 113707 (2007).
- Radzimanowski, J., Beyreuther, K., Sinning, I., Wild, K. Overproduction, purification, crystallization and preliminary X-ray analysis of human Fe65-PTB2 in complex with the amyloid precursor protein intracellular domain. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 64, 409-412 (2008).
- Chen, T. Y., Liu, P. H., Ruan, C. T., Chiu, L., Kung, F. L. The intracellular domain of amyloid precursor protein interacts with flotillin-1, a lipid raft protein. Biochem. Biophys. Res. Commun. 342, 266-272 (2006).
- Kim, M. Y. Regulation of Notch1 signaling by the APP intracellular domain facilitates degradation of the Notch1 intracellular domain and RBP-Jk. J. Cell Sci. 124, 1831-1843 (2011).
- Lazarov, O. Axonal transport, amyloid precursor protein, kinesin-1, and the processing apparatus: revisited. J. Neurosci. 25, 2386-2395 (2005).
- Kakuda, N. Equimolar production of amyloid beta-protein and amyloid precursor protein intracellular domain from beta-carboxyl-terminal fragment by gamma-secretase. J Biol. Chem. 281, 14776-14786 (2006).
- Gosal, W. S., Myers, S. L., Radford, S. E., Thomson, N. H. Amyloid under the atomic force microscope. Protein Pept. Lett. 13, 261-270 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。