Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La purificación y la agregación de la proteína precursora amiloide del dominio intracelular
En este artículo
Resumen
Un método para la purificación a gran escala del dominio intracelular de APP (AICD) se describe. También describe la metodología para inducir In vitro AICD agregación y visualización por microscopía de fuerza atómica. Los métodos descritos son útiles para la caracterización bioquímica / estructural de la AICD y los efectos de las chaperonas moleculares en su agregación.
Resumen
Proteína precursora de amiloide (APP) es una proteína transmembrana de tipo I asociado con la patogénesis de la enfermedad de Alzheimer (AD). APP se caracteriza por un gran dominio extracelular y un dominio citosólico corto denominado el dominio intracelular de APP (AICD). Durante la maduración a través de la vía secretora, APP puede ser escindida por proteasas denominadas α, β, y γ-secretasas 1. La escisión proteolítica de APP secuencial con β y γ-secretasas conduce a la producción de un péptido pequeño proteolítica, Aß denomina, que es amiloidogénica y el constituyente principal de las placas seniles. La AICD también es liberado de la membrana después de la elaboración secretasa, y a través de las interacciones con Fe65 y Tip60, puede trasladar al núcleo de participar en la regulación de la transcripción de genes diana múltiples 2,3. Interacciones proteína-proteína que implican la AICD pueden afectar el tráfico, el procesamiento y las funciones celulares de holo-APP y su C-terminfragmentos col. Recientemente hemos demostrado que puede AICD agregado in vitro, y este proceso se inhibe por la ubiquitina-1 AD-implicado chaperona molecular 4. Consistente con estos hallazgos, la AICD ha expuesto dominios hidrófobos y está intrínsecamente desordenados in vitro 5,6, sin embargo se obtiene una estructura secundaria estable cuando está unido a Fe65 7. Hemos propuesto que la ubiquitina-1 previene apropiado interacciones inter-e intramolecular de la AICD, prevenir la agregación in vitro y en células intactas 4. Mientras que la mayoría de los estudios se centran en el papel de APP en la patogénesis de la EA, el papel de la AICD en este proceso no está claro. Expresión de AICD se ha demostrado que induce la apoptosis 8, para modular las vías de señalización 9, y para regular la señalización de calcio 10. La sobreexpresión de la AICD y Fe65 en un modelo de ratón transgénico induce patología de Alzheimer como 11, y recientemente AICD se ha detectado en el sujetadoren lisados por Western Blot utilizando las técnicas apropiadas de recuperación de antígeno 12. Para facilitar estudios estructurales, bioquímicos y biofísicos de la AICD, se ha desarrollado un procedimiento para producir cantidades grandes de proteína recombinante AICD altamente puro. Nos describen además un método para inducir la agregación en vitro térmica de AICD y el análisis por microscopía de fuerza atómica. Los métodos descritos son útiles para la caracterización bioquímica, biofísica y estructural de la AICD y los efectos de las chaperonas moleculares sobre la agregación de AICD.
Protocolo
1. Expresión recombinante de dominio intracelular APP (AICD)
- Transformar E. coli cepa BL21 con AICD humana (residuos 649-695 de APP, neuronal numeración isoforma) clonado en el vector pGEX-4T-1 (GE Healthcare). Este vector se expresa por AICD como el resto C-terminal de una proteína de fusión de glutatión-S-transferasa (GST). Este vector también codifica una secuencia de escisión de trombina para facilitar la eliminación de la fracción GST. Los detalles de la clonación AICD en pGEX-4T-1 se encuentra en nuestra publicación anterior 4.
- A partir de una sola colonia, inocular 10 ml de caldo LB con ampicilina (100 mg / ml), y se incuba durante la noche a 37 ° C con agitación vigorosa.
- A la mañana siguiente, inocular 400 ml de LB / ampicilina en un matraz de un litro con 5 ml del cultivo durante toda la noche.
- Incubar a 37 ° C con agitación vigorosa hasta que la densidad óptica a 600 nm alcanzó 0,4 a 0,6. Para ello suele tardar de 2 a 2,5 horas.
- Inducir la expresión de GST-AICD mediante la adición de 0,4 mM de isopropil-beta-D-tiogalactopiranósido (IPTG). Incubar a 37 ° C con agitación vigorosa durante 5 horas.
- Centrifugar las células a 6.000 xg durante 15 min a 4 ° C. El sedimento de células se pueden almacenar a -80 ° C durante varios meses en este punto del procedimiento.
2. Purificación de GST-AICD
- Preparar 50 ml de tampón de lisis como sigue: 1 mM de ditiotreitol, 1 mM de ácido etilendiaminotetraacético (EDTA), 0,1% Triton-X100, 1 mM de fluoruro de fenilmetilsulfonilo (PMSF), cóctel completo de inhibidor de proteasa (Roche Applied Science), y solución salina tamponada con fosfato. Enfríe en hielo.
- Descongele sedimento bacteriano (si previamente congelado) enhielo.
En este punto, es fundamental que todas las etapas se realizaron a 4 º C para limitar la proteólisis. Todos los tubos, tampones, y otros reactivos deben ser enfriados previamente. Si se utiliza una prensa francesa o emulsionante para la lisis, estos deben ser enfriados previamente también.
- Resuspender completamente el sedimento bacteriano en 20 ml de tampón de lisis. Una combinación de agitación y trituración con 10 ml pipeta en hielo asegurará la completa resuspensión del pellet.
- Pasar las células resuspendidas bacterianas a través de un emulsionante (por ejemplo, Avestin Emulsiflex-C3) o célula de presión francesa, pre-refrigerado a 4 ° C a 30.000 psi. Pasar el lisado a través del emulsionador una segunda vez. Recoger el lisado en un tubo ml pre-enfriado 50.
La principal ventaja de estos dos instrumentos es que minimizar el calentamiento de la muestra. La técnica comúnmente utilizada de la sonicación genera mucho calor a la punta de la sonda de sonicación ypueden resultar en una agregación de proteínas recombinantes.
- Se centrifuga el lisado a 15.000 xg durante 30 min. Separar y mantener el sobrenadante a un tubo ml pre-refrigerada 50.
- Añadir 500 l de una suspensión al 50% de la glutatión-agarosa (Sigma-Aldrich). Rotar durante 30 min a 4 ° C. Mientras que la muestra está girando, hacer tampón de elución fresco: 50 mM de Tris 7,8, 0,1% Triton-X100, ditiotreitol 0,5 mM, 10 mM de glutatión reducido.
El único paso del protocolo, que se lleva a cabo a temperatura ambiente es la etapa de elución. Así, el tampón de elución se mantiene a temperatura ambiente. Tampón de elución debe estar recién preparado.
- Verter el lisado y la suspensión a un desechable 5 "columna de cromatografía de poliestireno con gruesas (90-130 micras) filtros (Evergreen Scientific). Lavar la columna 5 veces con 3 ml de solución salina tamponada con fosfato.
- Se tapa el fondo de la columna y añadir 500 l de tampón de elución a temperatura ambiente. Cerrar la parte superior de lacolumna y girar durante 5 min a temperatura ambiente. Recoger el eluido en un tubo de microcentrífuga refrigerada 1,5 ml. Repetir la elución dos veces más (1,5 ml de eluido total).
- Dializar el eluido en una membrana de diálisis de peso molecular 10.000 de corte (por ejemplo, Thermo Scientific Slide-A-Lyzer casetes de diálisis) en 4 litros de solución salina tamponada con fosfato durante la noche a 4 ° C. Dializar contra un adicional de 4 litros de solución salina tamponada con fosfato a 4 ° C durante 1 hora al día siguiente.
- Eliminar la proteína de la casete de diálisis y realizar un ensayo de cuantificación de proteínas para determinar el rendimiento de GST-AICD. Una purificación típica de 400 ml de cultivo se traducirá en rendimientos de> 20 mg de proteína purificada a concentraciones de 10-20 mg / ml. Dividir en partes alícuotas de la proteína en 200 ml de alícuotas y se congelan a -80 ° C.
3. Escisión de trombina de GST-AICD y purificación de la AICD
- Descongele 200 l de GST purificado-AICD y añadir 20 l de 1 U / l thromb¡El Incubar durante una noche a 37 ° C.
La calidad y la pureza de la trombina varía considerablemente entre los fabricantes, y puede ser una fuente importante de contaminación. Utilizamos la trombina de GE Healthcare (ver tabla de reactivos). Después de la incubación durante la noche,> 95% de la proteína de fusión debe ser escindido (Figura 1B).
- Después de la escisión con trombina durante la noche, es probable que una fracción de la AICD liberado se sometieron a la agregación y la solución aparezca turbia. Borrar el material agregado por centrifugación a 20.000 xg durante 30 min a 4 ° C. Eliminar el sobrenadante a un tubo de microcentrífuga de pre-enfriada.
- Añadir 50 l de glutatión-agarosa suspensión al 50% y 50 l 50% de lechada p-aminobenzamidina-agarosa para eliminar el GST y trombina, respectivamente. Incubar con rotación durante 5 min a temperatura ambiente.
- Centrifugar brevemente para sedimentar las perlas de agarosa, y eliminar el sobrenadante a un nuevo tubo. Extracto tél GST cuatro veces más con glutatión-agarosa. Una sola extracción con p-aminobenzamidina-agarosa es suficiente para eliminar la U 20 de la trombina.
- Realizar un ensayo de cuantificación de proteínas en 5 l de la AICD purificado. Los rendimientos típicos de un cultivo de 400 ml son 50-100 mg a una concentración de 0,2 a 0,5 mg / ml. Los rendimientos más altos son posibles mediante la escisión de un mayor volumen de GST-AICD.
Purificada AICD debe estar preparado fresco para la caracterización bioquímica / biofísica. El material no utilizado debe desecharse. También es posible concentrar la AICD de la liofilización de la muestra y resuspensión en un volumen más pequeño de tampón 6. Si la detección de AICD requiere secante (por ejemplo, después de una trampa o filtro de ensayo de dot blot), la recuperación de antígenos en la membrana debe realizarse como se describe por Pimplikar y Suryanarayana 12.
4. Agregación AICD de Microscopía de Fuerza Atómica (AFM)
- Diluir recién preparado AICD en phosphate solución salina tamponada a una concentración de 0,1 mg / ml en un volumen final de 15 l. En este punto, diversos compuestos y / o las proteínas se pueden añadir para determinar si inhiben la agregación AICD. Por ejemplo, se ha demostrado que las concentraciones equimolares de ubiquitina-1 prevenir la agregación de AICD en este ensayo 4.
También es posible agregar volúmenes de reacción más grandes para experimentos bioquímicos tales como ensayos de trampa de filtro y dispersión de la luz 4. Hemos tenido éxito en la realización de ensayos de filtro trampa en mezclas de reacción tan grande como 400 ml con DAI diluye a concentraciones tan bajas como 1 micra.
- Inducir la agregación térmica incubando las muestras a 43 ° C con agitación a 800 rpm en un Thermomixer Eppendorf durante 48 hr. Esta temperatura se eligió basándose en ensayos de chaperonas que examinan la agregación térmica de la sintasa de chaperona modelo de citrato 4,13 sustrato.
térmica es un método comúnmente utilizado para inducir la transición estructural de una proteína a partir de una nativa a una estructura no nativa (que es generalmente rica en lámina beta) que da lugar a la formación de agregados intermoleculares. Agregación térmica también se utiliza para examinar la función de las chaperonas moleculares, que protegen la formación de segmentos hidrófobos no apropiado interacciones intermoleculares (y por lo tanto retrasar o prevenir la agregación térmica).
- Diluir la muestra de 20-veces en agua desionizada y 2 l mancha sobre mica recién cortado. Secar la muestra en un desecador durante una noche. Será necesario determinar empíricamente la dilución óptima para formación de imágenes, y por lo tanto varias diluciones que van de 10 - a 100-veces sería prudente.
- Visualice la AICD agregado mediante la operación AFM en modo de contacto intermitente 14. Los voladizos utilizados son recubiertas de oro palancas micro nitruro afilados (MSNL, Bruker) con un radio de punta nominal de 2 nm. Típico tocando amplitudes duranteING imágenes son 10-20 nm en la frecuencia de resonancia de los voladizos (30-50 kHz).
Se encontró que la calidad de imagen y el contraste de agregados de proteínas diferentes dependía de la fuerza aplicada y la duración del experimento. Para reducir al mínimo la perturbación de la muestra por la punta, se mantiene la fuerza aplicada relativamente baja, manteniendo una relación de punto de ajuste por encima de 95% y la limitación de la exploración de cada muestra a 5-10 min. El procesamiento de imágenes se realizó con WSxM software (Nanotec). Procesamiento de imágenes estándar consistía en avión resta y aplanamiento. Nuestros laboratorios utilizan una "casa-construida" AFM 15 conectado a un sistema de escaneo comercial sonda de control del microscopio (Nanotec).
5. Los resultados representativos
La expresión y enriquecimiento relativo de GST-AICD se muestra en la Figura 1A. Después de la lisis, la mayoría de la proteína de fusión está presente en la fracción soluble, y por lo tanto la extracción de inclusien los órganos no se requiere. El material eluido de la columna de glutatión agarosa es> 95% pura. En la preparación mostrada en la Figura 1, la concentración de la proteína eluida de la columna fue de 14,5 mg / ml, y el rendimiento fue de 22 mg (de un cultivo de partida de 400 ml). La escisión de 200 l de esta preparación durante la noche con 20 U de trombina dado lugar a la escisión casi el 100% de la proteína de fusión (Figura 1B). La cantidad de trombina utilizada es suficientemente baja como para no ser detectable por tinción con azul Coomassie (véase "Cleaved" carril, Figura 1B). La eliminación de la trombina y la GST dio como resultado cierta pérdida de material, sin embargo, era> 90% de pureza con un rendimiento en esta preparación de 70 g de AICD a una concentración de 0,35 mg / ml. Figura 1C muestra el diagrama de flujo para la agregación de AICD y el análisis subsiguiente. Agregados AICD fotografiadas por AFM son típicamente esferoide / amorfo, y varían en tamaño de 50 a 100 nm (Figura 1 D, F). Agregadomaterial no es detectable cuando una cantidad equimolar de la chaperona ubiquitina-1 se añade a la reacción de agregación (Figura 1E) 4.
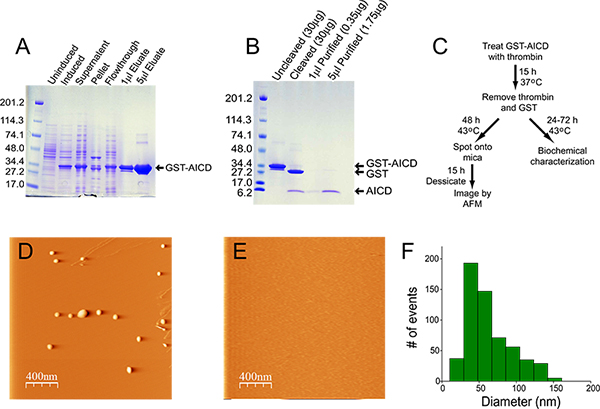
Figura 1. La purificación y la agregación de AICD. A) tinción con azul Coomassie de las muestras recogidas en cada paso del proceso de purificación. Para las muestras no inducidas e inducidas, 20 l de bacterias totales se hicieron correr en el gel. Para la fracción de sobrenadante, 5 l de lisado (de un volumen total de 20 ml) se hicieron correr en el gel. Para la fracción de sedimento, el sedimento se resuspendió en 20 ml de tampón de lisis, y 5 l de este material se sonicaron en un sonicador de baño de agua durante 30 min a 4 ° C antes de la carga en el gel. Para la medición de flujo, 5 l se hicieron correr en el gel. Las cantidades de eluato cargados en el gel se indican. B) azul de Coomassie de gel teñido no escindido y troceados GST-AICD (2 l) y 1 y 5 y mu, l purificado AICD. C) Diagrama de flujo de purificación AICD, agregación y análisis. D, E) Representante de imagen AFM térmicamente agregados AICD en ausencia (D) y presencia (E) de la chaperona molecular ubiquitina-1. F) Histograma de la distribución del tamaño de los agregados AICD.
Discusión
En este protocolo hemos descrito un procedimiento para la obtención de DAI de alta pureza para análisis estructurales, biofísicos y bioquímicos. Este procedimiento no requiere un equipo sofisticado y cromatografía es por tanto accesible a la mayoría de los laboratorios. Otros grupos han purificado AICD 5-7,16, incluyendo GST-AICD 17-19, para los análisis bioquímicos / estructural. Las desventajas de los protocolos anteriores incluyen mala solubilidad de AICD 16, menos de pureza i...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer al Dr. Hui Zheng (Baylor College of Medicine) para la APP cDNA. Este trabajo fue financiado por el NIH subvenciones R21AG031948 (DB, JMB), F30AG030878 (ESS), R01DK073394 (AFO), el Memorial Juan Sealy Fondo de Dotación para la Investigación Biomédica (AFO), y el C. Jean y William D. Willis Fundación de Investigación de Neurociencia (ESS). JMB es un erudito en el Programa de Investigación Traslacional Académico y miembro de la Universidad de Texas Medical Branch Claude E. Pepper Older Independencia estadounidenses Center (apoyado por el NIH subvenciones UL1RR029876 y P30-AG-024.832, respectivamente).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| pGEX-4T-1 | GE Healthcare | 28-9545-49 | |
| La trombina | GE Healthcare | 27-0846-01 | |
| Ampicilina | Fisher Scientific | BP1760 | |
| Proteína Bradford ensayo de reactivos | Bio-Rad | 500-0002 | |
| Azul de Coomassie | Bio-Rad | 161-0786 | |
| IPTG (isopropil-beta-D tiogalactopiranósido) | Sigma-Aldrich | I6758 | |
| Glutatión-agarosa | Sigma-Aldrich | G4510 | |
| p-aminobenzamidina-agarosa | Sigma-Aldrich | A7155 | |
| Proteasa completo cóctel inhibidor | Roche | 11836170001 | |
| Slide-A-Lyzer cassettes de diálisis | Thermo Scientific | 66380 | |
| Columnas para cromatografía | Evergreen Scientific | 208-3367-050 | |
| Emulsionante | Avestin, Inc | Emulsiflex-C3 | Altamente recomendado |
| Eppendorf Thermomixer | Eppendorf | 022670107 | |
| Mica discos | Ted Pella | 50-12 | |
| AFM voladizos | Bruker | MSNL-10 | |
| WSxM software | Nanotec | N / A | P.ee descarga |
Referencias
- De Strooper, B., Vassar, R., Golde, T. The secretases: enzymes with therapeutic potential in Alzheimer disease. Nature reviews. Neurology. 6, 99-107 (2010).
- Chang, K. A., Suh, Y. H. Possible roles of amyloid intracellular domain of amyloid precursor protein. BMB reports. 43, 656-663 (2010).
- McLoughlin, D. M., Miller, C. C. The FE65 proteins and Alzheimer's disease. J. Neurosci. Res. 86, 744-754 (2008).
- Stieren, E. S. Ubiquilin-1 is a molecular chaperone for the amyloid precursor protein. J. Biol. Chem. 286, 35689-35698 (2011).
- Ramelot, T. A., Nicholson, L. K. Phosphorylation-induced structural changes in the amyloid precursor protein cytoplasmic tail detected by NMR. J. Mol. Biol. 307, 871-884 (2001).
- Ramelot, T. A., Gentile, L. N. Transient structure of the amyloid precursor protein cytoplasmic tail indicates preordering of structure for binding to cytosolic factors. Biochem. 39, 2714-2725 (2000).
- Radzimanowski, J. Structure of the intracellular domain of the amyloid precursor protein in complex with Fe65-PTB2. EMBO Rep. 9, 1134-1140 (2008).
- Ohkawara, T., Nagase, H., Koh, C. S., Nakayama, K. The amyloid precursor protein intracellular domain alters gene expression and induces neuron-specific apoptosis. Gene. 475, 1-9 (2011).
- von Rotz, R. C. The APP intracellular domain forms nuclear multiprotein complexes and regulates the transcription of its own precursor. J. Cell Sci. 117, 4435-4448 (2004).
- Hamid, R. Amyloid precursor protein intracellular domain modulates cellular calcium homeostasis and ATP content. J. Neurochem. 102, 1264-1275 (2007).
- Ghosal, K., Stathopoulos, A., Pimplikar, S. W. APP intracellular domain impairs adult neurogenesis in transgenic mice by inducing neuroinflammation. PLoS ONE. 5, e11866 (2010).
- Pimplikar, S. W., Suryanarayana, A. Detection of APP intracellular domain in brain tissue. Met. Molecul. Biol. 670, 85-91 (2011).
- Buchner, J., Grallert, H., Jakob, U. Analysis of chaperone function using citrate synthase as nonnative substrate protein. Met. Enzymol. 290, 323-338 (1998).
- Hansma, H. G. Recent advances in atomic force microscopy of DNA. Scanning. 15, 296-299 (1993).
- Valbuena, A. Quasi-simultaneous imaging/pulling analysis of single polyprotein molecules by atomic force microscopy. Rev. Sci. Instrum. 78, 113707 (2007).
- Radzimanowski, J., Beyreuther, K., Sinning, I., Wild, K. Overproduction, purification, crystallization and preliminary X-ray analysis of human Fe65-PTB2 in complex with the amyloid precursor protein intracellular domain. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 64, 409-412 (2008).
- Chen, T. Y., Liu, P. H., Ruan, C. T., Chiu, L., Kung, F. L. The intracellular domain of amyloid precursor protein interacts with flotillin-1, a lipid raft protein. Biochem. Biophys. Res. Commun. 342, 266-272 (2006).
- Kim, M. Y. Regulation of Notch1 signaling by the APP intracellular domain facilitates degradation of the Notch1 intracellular domain and RBP-Jk. J. Cell Sci. 124, 1831-1843 (2011).
- Lazarov, O. Axonal transport, amyloid precursor protein, kinesin-1, and the processing apparatus: revisited. J. Neurosci. 25, 2386-2395 (2005).
- Kakuda, N. Equimolar production of amyloid beta-protein and amyloid precursor protein intracellular domain from beta-carboxyl-terminal fragment by gamma-secretase. J Biol. Chem. 281, 14776-14786 (2006).
- Gosal, W. S., Myers, S. L., Radford, S. E., Thomson, N. H. Amyloid under the atomic force microscope. Protein Pept. Lett. 13, 261-270 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados