É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Purificação e Agregação do Domínio proteína precursora de amilóide intracelular
Neste Artigo
Resumo
Um método para a purificação em larga escala do domínio intracelular de APP (AICD) é descrita. Nós também descrevem metodologia de indução In vitro Agregação AICD e visualização por microscopia de força atômica. Os métodos descritos são úteis para a caracterização bioquímica / estrutural da AICD e os efeitos das chaperones moleculares sobre a sua agregação.
Resumo
Proteína precursora amilóide (APP) é uma proteína transmembranar de tipo I associado à patogénese da doença de Alzheimer (AD). APP é caracterizada por um grande domínio extracelular e um domínio citosólico curto denominado o domínio intracelular de APP (AICD). Durante a maturação através da via secretora, APP pode ser clivada por proteases denominadas α, β e γ-secretases 1. A clivagem proteolítica da APP sequencial com β e γ-secretases conduz à produção de um péptido pequeno proteolítico, denominado de Ap, que é amiloidogénica e o constituinte principal das placas senis. A AICD também é libertada a partir da membrana, após o processamento secretase, e por meio de interacções com Fe65 e Tip60, pode translocar para o núcleo para participar na regulação da transcrição de genes alvo múltiplas 2,3. Interacções proteína-proteína envolvendo a AICD podem afectar o tráfico, o processamento e as funções celulares de holo-APP e seus C-terminfragmentos al. Mostrámos recentemente que AICD pode agregar in vitro, e este processo é inibido pelo ubiquilin-1-AD implicado chaperone molecular 4. Consistente com estes resultados, a AICD expôs domínios hidrofóbicos e está intrinsecamente desordenados in vitro 5,6, no entanto, obtém estrutura secundária estável quando ligado ao Fe65 7. Propusemos que ubiquilin-1 impede inadequado interacções inter-e intramolecular da AICD, prevenindo a agregação in vitro e em células intactas 4. Enquanto a maioria dos estudos focado o papel de APP na patogénese de AD, o papel da AICD neste processo não são claras. Expressão da AICD foi mostrado para induzir a apoptose 8, para modular as vias de sinalização 9, e para regular a sinalização de cálcio 10. A sobre-expressão da AICD e Fe65 num modelo de ratinho transgénico induz patologia de Alzheimer, como 11, e recentemente AICD foi detectado no braem lisados por western blotting quando usando técnicas de recuperação de antigénios apropriados 12. Para facilitar os estudos estruturais, bioquímicas e biofísicas da AICD, desenvolvemos um procedimento para a produção de quantidades grandes de forma recombinante altamente pura proteína AICD. Iremos descrever um método para a indução in vitro da agregação térmica da AICD e análise por microscopia de força atómica. Os métodos descritos são úteis para a caracterização bioquímica, biofísica e estrutural da AICD e os efeitos das chaperones moleculares na agregação AICD.
Protocolo
1. Expressão de domínio recombinante APP intracelular (AICD)
- E. Transformação coli BL21 com AICD humana (resíduos 649-695 de APP, isoforma neuronal de numeração) clonado no vector pGEX-4T-1 (GE Healthcare). Este vector expressará AICD como a porção C-terminal de uma proteína de fusão de glutationa-S-transferase (GST). Este vector também codifica uma sequência de clivagem pela trombina para facilitar a remoção da porção GST. Detalhes da clonagem AICD em pGEX-4T-1 pode ser encontrada na nossa publicação anterior 4.
- A partir de uma colónia isolada, inocular 10 ml de caldo de LB com ampicilina (100 jig / ml) e incubar durante a noite a 37 ° C com agitação vigorosa.
- Na manhã seguinte, inocular 400 ml de LB / ampicilina, num balão de um litro com 5 ml da cultura durante a noite.
- Incubar a 37 ° C com agitação vigorosa até a densidade óptica a 600 nm ter atingido 0,4 e 0,6. Isto normalmente levar de 2 a 2,5 horas.
- Induzem a expressão de GST-AICD pela adição de 0,4 mM de isopropil-beta-D-tiogalactopiranósido (IPTG). Incubar a 37 ° C com agitação vigorosa durante 5 horas.
- Centrifugar as células a 6.000 xg durante 15 min a 4 ° C. O pelete de células pode ser armazenada a -80 ° C durante vários meses, neste ponto do procedimento.
2. Purificação de GST-AICD
- Preparar 50 ml de tampão de lise como se segue: 1 mM de ditiotreitol, 1 mM de ácido etilenodiaminotetracético (EDTA), 0,1% de Triton-X100, fluoreto de fenilmetilsulfonilo 1 mM (PMSF), cocktail inibidor de protease completo (Roche Applied Science), e solução salina tamponada com fosfato. Relaxar no gelo.
- Descongelar pelete bacteriana (se previamente congelado) emgelo.
Neste ponto, é importante que todos os passos são realizados a 4 ° C para limitar a proteólise. Todos os tubos, tampões, e outros reagentes devem ser pré-arrefecida. Se usar uma imprensa francesa ou emulsificante para lise, estes devem ser pré-refrigerados também.
- Completamente ressuspender o sedimento bacteriano em 20 ml de tampão de lise. Uma combinação de centrifugação e a trituração com 10 ml de pipeta em gelo assegurará completa ressuspensão do sedimento.
- Passar as células ressuspensas bacterianas através de um emulsionante (por exemplo, Avestin EmulsiFlex-C3) ou célula de pressão Francesa, pré-refrigerada a 4 ° C a 30000 psi. Passar o lisado por o emulsionante uma segunda vez. Recolher o lisado para um tubo de ml pré-refrigerada 50.
A principal vantagem destes dois instrumentos é que eles minimizar o aquecimento da amostra. A técnica normalmente usada de sonicação produz calor significativo na ponta da sonda de ultra-sons epode resultar em agregação de proteínas recombinantes.
- Centrifuga-se o lisado a 15.000 xg durante 30 min. Separa-se e manter-se o sobrenadante para um tubo de ml pré-refrigerada 50.
- Adicionar 500 ul de uma suspensão a 50% de esférulas de glutationa-agarose (Sigma-Aldrich). Rodar durante 30 min a 4 ° C. Enquanto a amostra está a rodar, fazer de tampão de eluição fresco: 50 mM de Tris 7,8, 0,1% de Triton X100, 0,5 mM de ditiotreitol, 10 mM de glutationa reduzida.
O único passo do protocolo, que é realizado à temperatura ambiente é o passo de eluição. Assim, o tampão de eluição é mantida à temperatura ambiente. Tampão de eluição deve ser preparada.
- Verter o lisado e lama numa coluna de cromatografia de 5 descartável "poliestireno com grosseiras (90-130 mm) (filtros Evergreen Scientific). Lava-se a coluna 5 vezes com 3 ml de solução salina tamponada com fosfato.
- Tapar a parte inferior da coluna e adicionar 500 ul de tampão de eluição de temperatura ambiente. Tapar o topo dacoluna e girar durante 5 min à temperatura ambiente. Recolher o eluato num refrigerados tubo de microcentrífuga de 1,5 ml. Repita a eluição mais duas vezes (1,5 ml eluato total).
- Dialisar o eluato num molecular da membrana de diálise de corte de peso 10000 (por exemplo, Thermo Scientific Slide-A-Lyzer de diálise cassetes) em 4 litros de solução salina tamponada com fosfato durante a noite a 4 ° C. Dializar contra um adicional de 4 litros de tampão fosfato salino a 4 ° C durante 1 hora no dia seguinte.
- Remover a proteína a partir da cassete de diálise e realizar um ensaio de quantificação de proteína para determinar o rendimento de GST-AICD. Uma purificação típica de 400 ml de cultura irá resultar em rendimentos de> 20 mg de proteína purificada em concentrações de 10-20 mg / ml. Alíquota da proteína em alíquotas de 200 ul e congelar a -80 ° C.
3. A clivagem de trombina de GST-AICD e Purificação de AICD
- Ul descongelamento 200 das purificada GST-AICD e adicionar 20 ul de uma Thromb U / ulpol Incubar durante a noite a 37 ° C.
A qualidade e pureza da trombina varia consideravelmente entre os fabricantes, e pode ser uma importante fonte de contaminação. Usamos trombina da GE Healthcare (ver tabela de reagentes). Após incubação durante a noite,> 95% da proteína de fusão deve ser clivado (Figura 1B).
- Após a clivagem com trombina durante a noite, é provável que uma fracção da AICD libertada foi submetido a agregação e a solução pode parecer turva. Limpar o material agregado por centrifugação a 20.000 xg durante 30 min a 4 ° C. Remover o sobrenadante para um tubo de microcentrífuga de pré-arrefecida.
- Adicionar 50 ul de 50% de esférulas de glutationa-agarose a suspensão aquosa e 50 ul de 50% de p-aminobenzamidina-agarose suspensão para remover GST e da trombina, respectivamente. Incubar com rotação durante 5 minutos à temperatura ambiente.
- Centrifugar brevemente para sedimentar as esferas de agarose, e remover o sobrenadante para um novo tubo. Extrair tele GST mais quatro vezes com glutationa-agarose. A única extracção com p-aminobenzamidina-agarose é suficiente para remover o U 20 da trombina.
- Executar um ensaio de quantificação de proteínas em 5 ul da AICD purificada. Os rendimentos típicos a partir de uma cultura de 400 ml são 50-100 ug, a uma concentração de 0,2 a 0,5 mg / ml. Rendimentos mais altos são possíveis por meio de clivagem de volumes maiores de GST-AICD.
Purificada AICD deve ser preparado para a caracterização bioquímica / biofísica. Material não utilizado deve ser descartado. Também é possível concentrar a AICD por liofilização da amostra e ressuspensão em um pequeno volume de tampão 6. Se detectar AICD requer blotting (tal como após uma armadilha de filtro ou de ensaio dot blot), a recuperação do antigénio da membrana deve ser realizada como descrito por Pimplikar Suryanarayana e 12.
4. Agregação AICD de Microscopia de Força Atômica (AFM)
- Diluir preparado de fresco AICD em phosphate solução salina tamponada a uma concentração de 0,1 mg / ml num volume final de 15 ul. Neste ponto, vários compostos e / ou proteínas podem ser adicionados, para determinar se eles inibem a agregação AICD. Por exemplo, demonstramos que as concentrações equimolares de ubiquilin-1 prevenir a agregação de AICD neste ensaio 4.
Também é possível acrescentar um maior volume de reacção para experiências bioquímicas, tais como ensaios de armadilha de filtragem e de espalhamento de luz 4. Tivemos sucesso realizando ensaios de armadilha de filtro em misturas reaccionais tão grande como 400 ul com AICD diluído para concentrações tão baixas como 1 uM.
- Induzir a agregação térmica por incubação das amostras a 43 ° C com agitação a 800 rpm num Thermomixer de Eppendorf durante 48 horas. Esta temperatura foi escolhida com base em ensaios que examinam a chaperones agregação térmica do modelo da citrato sintase chaperone substrato 4,13.
Agregação térmica é um método vulgarmente utilizado para induzir a transição estrutural da proteína nativa a partir de uma estrutura para um não-nativo (que é geralmente folha beta rico), que resulta na formação de agregados intermoleculares. Agregação térmica também é utilizado para examinar a função de chaperonas moleculares, os quais protegem os segmentos hidrofóbicos de formar inadequado interacções intermoleculares (e, assim, retardar ou evitar a agregação térmica).
- Dilui-se a amostra 20 vezes em água desionizada e ul ponto 2 sobre mica clivada de fresco. Seca-se a amostra num exsicador durante a noite. Será necessário determinar empiricamente a diluição óptima para a imagiologia, e, portanto, várias diluições que variam de 10 - e 100 vezes seria prudente.
- Visualize a AICD agregado utilizando a operação AFM em modo de tocar 14. As vigas são utilizados ouro revestidas com nitreto de micro alavancas afiados (MSNL, Bruker), com um raio da ponta nominal de 2 nm. Típico tocando durante amplitudesção de imagem são 10-20 nm, a frequência de ressonância das consolas (30-50 kHz).
Nós descobrimos que a qualidade da imagem e do contraste de agregados de proteínas diferentes dependia da força aplicada e da duração da experiência. Para minimizar a perturbação da amostra pela ponta, é mantida a força aplicada relativamente baixo, mantendo uma relação de set-point acima de 95% e limitando o varrimento de cada uma das amostras de 5-10 min. Processamento de imagem foi realizada com WSxM software (Nanotec). Processamento de imagem padrão consiste em avião subtração e achatamento. Nossos laboratórios utilizam uma "casa-construída" AFM 15, interligados a um sistema de digitalização sonda comercial controle microscópio (Nanotec).
5. Resultados representativos
A expressão e um enriquecimento relativo de GST-AICD é mostrado na Figura 1A. Após a lise, a maior parte da proteína de fusão está presente na fracção solúvel e, portanto, a extracção a partir de inclusiem órgãos não é necessária. O material eluído da coluna de agarose de glutationa é> 95% puro. Na preparação mostrado na Figura 1, a concentração de proteína eluída da coluna foi de 14,5 mg / ml, e o rendimento foi de 22 mg (a partir de uma cultura inicial de 400 ml). A clivagem de 200 ul da preparação, durante a noite, com 20 U de trombina resultou em quase 100% de clivagem da proteína de fusão (Figura 1B). A quantidade de trombina utilizada é suficientemente baixo para não ser detectáveis por coloração com azul de Coomassie (ver "Clivadas" pista Figura 1B). A remoção da trombina e GST resultou em alguma perda de material, no entanto, foi> 90% puro com um rendimento nesta preparação de 70 ug de AICD, a uma concentração de 0,35 mg / ml. Figura 1C mostra o diagrama de fluxo para a agregação de AICD e subsequente análise. Agregados AICD fotografada por AFM são tipicamente esferoidais / amorfa, e variam em tamanho de 50 a 100 nm (Figura 1D, F). Agregadomaterial não é detectável, quando uma quantidade equimolar da chaperona ubiquilin-1 é adicionado à reacção de agregação (Figura 1E) 4.
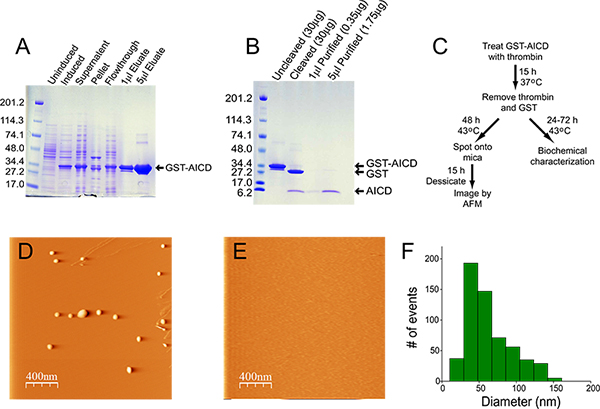
Figura 1. Purificação e agregação de AICD. A) Coloração com azul de Coomassie de amostras recolhidas em cada passo do processo de purificação. Para as amostras não induzidas e induzidas, 20 uL de bactérias totais foram corridas no gel. Para a fracção sobrenadante, 5 ul de lisado (a partir de um volume total de 20 ml), foram executados no gel. Para a fracção de sedimento, o sedimento foi ressuspenso em 20 ml de tampão de lise, e 5 ul deste material foram sonicadas num sonicador de banho de água durante 30 min a 4 ° C antes do carregamento para o gel. Para o fluxo contínuo, 5 pi foram corridos no gel. As quantidades de líquido eluído carregadas no gel são indicadas. B) de Coomassie azul do gel corado não clivada e clivada GST-AICD (2 ul) e 1 e 5 m &u; l purificada AICD. C) Fluxograma de purificação AICD, agregação e análise. D, E) representativas de imagem AFM termicamente agregada AICD na ausência (D) e na presença (E) da chaperona molecular ubiquilin-1. F) Histograma da distribuição de tamanho de agregados AICD.
Discussão
Neste protocolo temos delineado um procedimento para obter AICD altamente puro para análises estruturais, biofísicos e bioquímicos. Este procedimento não requer equipamento sofisticado cromatografia e é, portanto, acessível para a maioria dos laboratórios. Outros grupos têm purificada AICD 5-7,16, incluindo GST-AICD 17-19, para as análises bioquímicas / estrutural. Desvantagens aos protocolos anteriores incluem fraca solubilidade do AICD 16, menos do que ideal pureza 17,
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer ao Dr. Hui Zheng (Baylor College of Medicine) para a APP cDNA. Este trabalho foi financiado pelo NIH R21AG031948 (DB, JMB), F30AG030878 (ESS), R01DK073394 (AFO), o John Sealy Memorial Fund Endowment for Biomedical Research (AFO), e Jean C. e D. William Willis Neuroscience Research Endowment (ESS). JMB é um estudioso do Programa de Pesquisa Translacional Scholar e membro da Universidade do Texas Medical Sucursal Claude E. Pimenta antiga americanos Independência Centro (apoiado pelo NIH UL1RR029876 e P30-AG-024832, respectivamente).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| pGEX-4T-1 | GE Healthcare | 28-9545-49 | |
| Trombina | GE Healthcare | 27-0846-01 | |
| Ampicilina | Fisher Scientific | BP1760 | |
| Bradford reagente de ensaio de proteínas | Bio-Rad | 500-0002 | |
| Coomassie azul | Bio-Rad | 161-0786 | |
| IPTG (isopropil-beta-D tiogalactopiranósido) | Sigma-Aldrich | I6758 | |
| Glutationa-agarose | Sigma-Aldrich | G4510 | |
| p-aminobenzamidina-agarose | Sigma-Aldrich | A7155 | |
| Cocktail inibidor de protease completo | Roche | 11836170001 | |
| Slide-A-Lyzer cassetes de diálise | Thermo Scientific | 66380 | |
| Colunas de cromatografia | Scientific Evergreen | 208-3367-050 | |
| Emulsificante | Avestin, Inc | EmulsiFlex-C3 | Altamente recomendado |
| Eppendorf Thermomixer | Eppendorf | 022670107 | |
| Discos de mica | Ted Pella | 50-12 | |
| Cantilevers de AFM | Bruker | MSNL-10 | |
| WSxM software | Nanotec | N / A | Free Download |
Referências
- De Strooper, B., Vassar, R., Golde, T. The secretases: enzymes with therapeutic potential in Alzheimer disease. Nature reviews. Neurology. 6, 99-107 (2010).
- Chang, K. A., Suh, Y. H. Possible roles of amyloid intracellular domain of amyloid precursor protein. BMB reports. 43, 656-663 (2010).
- McLoughlin, D. M., Miller, C. C. The FE65 proteins and Alzheimer's disease. J. Neurosci. Res. 86, 744-754 (2008).
- Stieren, E. S. Ubiquilin-1 is a molecular chaperone for the amyloid precursor protein. J. Biol. Chem. 286, 35689-35698 (2011).
- Ramelot, T. A., Nicholson, L. K. Phosphorylation-induced structural changes in the amyloid precursor protein cytoplasmic tail detected by NMR. J. Mol. Biol. 307, 871-884 (2001).
- Ramelot, T. A., Gentile, L. N. Transient structure of the amyloid precursor protein cytoplasmic tail indicates preordering of structure for binding to cytosolic factors. Biochem. 39, 2714-2725 (2000).
- Radzimanowski, J. Structure of the intracellular domain of the amyloid precursor protein in complex with Fe65-PTB2. EMBO Rep. 9, 1134-1140 (2008).
- Ohkawara, T., Nagase, H., Koh, C. S., Nakayama, K. The amyloid precursor protein intracellular domain alters gene expression and induces neuron-specific apoptosis. Gene. 475, 1-9 (2011).
- von Rotz, R. C. The APP intracellular domain forms nuclear multiprotein complexes and regulates the transcription of its own precursor. J. Cell Sci. 117, 4435-4448 (2004).
- Hamid, R. Amyloid precursor protein intracellular domain modulates cellular calcium homeostasis and ATP content. J. Neurochem. 102, 1264-1275 (2007).
- Ghosal, K., Stathopoulos, A., Pimplikar, S. W. APP intracellular domain impairs adult neurogenesis in transgenic mice by inducing neuroinflammation. PLoS ONE. 5, e11866 (2010).
- Pimplikar, S. W., Suryanarayana, A. Detection of APP intracellular domain in brain tissue. Met. Molecul. Biol. 670, 85-91 (2011).
- Buchner, J., Grallert, H., Jakob, U. Analysis of chaperone function using citrate synthase as nonnative substrate protein. Met. Enzymol. 290, 323-338 (1998).
- Hansma, H. G. Recent advances in atomic force microscopy of DNA. Scanning. 15, 296-299 (1993).
- Valbuena, A. Quasi-simultaneous imaging/pulling analysis of single polyprotein molecules by atomic force microscopy. Rev. Sci. Instrum. 78, 113707 (2007).
- Radzimanowski, J., Beyreuther, K., Sinning, I., Wild, K. Overproduction, purification, crystallization and preliminary X-ray analysis of human Fe65-PTB2 in complex with the amyloid precursor protein intracellular domain. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 64, 409-412 (2008).
- Chen, T. Y., Liu, P. H., Ruan, C. T., Chiu, L., Kung, F. L. The intracellular domain of amyloid precursor protein interacts with flotillin-1, a lipid raft protein. Biochem. Biophys. Res. Commun. 342, 266-272 (2006).
- Kim, M. Y. Regulation of Notch1 signaling by the APP intracellular domain facilitates degradation of the Notch1 intracellular domain and RBP-Jk. J. Cell Sci. 124, 1831-1843 (2011).
- Lazarov, O. Axonal transport, amyloid precursor protein, kinesin-1, and the processing apparatus: revisited. J. Neurosci. 25, 2386-2395 (2005).
- Kakuda, N. Equimolar production of amyloid beta-protein and amyloid precursor protein intracellular domain from beta-carboxyl-terminal fragment by gamma-secretase. J Biol. Chem. 281, 14776-14786 (2006).
- Gosal, W. S., Myers, S. L., Radford, S. E., Thomson, N. H. Amyloid under the atomic force microscope. Protein Pept. Lett. 13, 261-270 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados