Method Article
在导游的带领下材料的筛选方法定量溶胶 - 凝胶蛋白芯片开发
摘要
在导游的带领下物料的筛分方法来开发溶胶凝胶蛋白掺杂微阵列使用一个新兴的销印刷法制造。这种方法是通过发展的乙酰胆碱酯酶和的多激酶芯片,用于成本效益的小分子筛选证明。
摘要
芯片已发现使用高通量检测新材料和新发现的小分子药物先导的发展。本文中,我们描述了一种引导物料的筛分的方式来确定基于溶胶 - 凝胶的材料,适合用于生产三维蛋白质微阵列。该方法首先识别微阵列,它可以打印的材料,材料的吞吐量是与一个给定的酶测定兼容,然后锤炼的最佳材料的基础上保留最大酶活性收缩的数目。这种方法的应用,开发适用于两种不同的酶检测,用乙酰胆碱酯酶和其他使用四个关键激酶参与癌症的一组微阵列。在每一种情况下,有可能产生,可用于定量小分子的筛选试验和生产的剂量依赖性的抑制响应曲线的微阵列。重要的是,有能力筛选许多队友里亚尔生产上的类型的材料,最适合两个微阵列的生产和酶的活性保留的信息。材料数据提供洞察基本材料的要求,必要的剪裁最佳,高密度的溶胶凝胶微阵列。
引言
微阵列技术在科学界已经获得了普及,提高检测吞吐量作为一种方法。由于芯片技术的发展,以评估1基因的表达,在20世纪90年代中期,芯片已发现使用开发的高通量分析,以确定蛋白质-蛋白质和蛋白质-小分子的相互作用,并寻找新的材料,具有独特的性能。微阵列2-5最近,已开发其特征在于,特定的材料,用于固定功能的蛋白质,产生一个三维微阵列元素内的蛋白质包埋,允许简便测定酶活性和抑制的微阵列本身使用一个合适的荧光测定联接到基板周转。5-10,更重要的是,这样的微阵列可被设计为包括所有必需的组件到屏幕上的样品和对照一起在一个高度并行的方式。5,8
蛋白质微阵列的早期例子通常使用标准的蛋白质固定化的方法,如共价连接到固相载体上,制备11亲和捕获3和物理吸附12的生物固定化虽然这些方法允许样品浓度增加和加速所需的反应动力学检测的小型化,他们每个人都遭受缺点。一般来说,所有导致的固有生物分子的功能,由于表面的化学改性的降低,阻碍了活性位点的访问,或不正确的取向,由于非特异性的固定化。因此,所有的方法在生物分子的沉积,虽然增加的响应,可能需要人为地结合到表面上的生物分子的产生是由于在较低的检测灵敏度的结果。
一个新兴的用于生产功能性的生物分子的微阵列的方法是通过引脚印刷掺蛋白硅溶胶到固相载体上,这是典型要么功能的载玻片或个别井的微孔板。在室温下在含水环境中发生的溶胶-凝胶工艺本身,它是液体前体,进行打印,然后凝胶的坑害生物分子内的3D矩阵,允许高蛋白质:13,以及多个组件的包封内13,14裁缝的溶胶-凝胶衍生的材料可以通过仔细选择不同的氧化硅前体,以及通过改变含水组分通过使用不同的缓冲液(pH,离子强度),列入相同的微阵列元件。各种添加剂(聚合物,小分子),以达到一个最佳的材料,其中的特定性质取决于包埋的生物分子。
一个潜在的局限性与发展中国家通过溶胶凝胶蛋白质芯片引脚印刷相关需要确定溶胶-凝胶基复合材料销无凝胶,它可以打印或显示不良属性(不可再生的光斑尺寸,开裂,附着力差,与检测组件不兼容,蛋白活性较差)一次印刷表面上。同时所有这些参数的最优化排除了可以设计新的方法,其特征在于材料,或以串行方式慢慢地检查。另一方面,随机筛选的几千或几十万材料既不是时间,也不符合成本效益的。
在本文中,我们描述了一种直接筛选方法,使随机筛选大量的材料,而不需要采用合适的材料,用于生产蛋白质微阵列的快速鉴定。采用引导的方法,首先确定适合芯片印刷材料,随后通过了一系列小规模的屏幕,识别最佳的溶胶凝胶材料人的组合,可再现地打印,不开裂,是与一个给定的检测兼容。最后,最佳的材料的基础上确定保留酶的活性和性能在最后的小分子筛选方法。在这种方式中,最佳的材料可以被识别从无数使用只有几百测定步骤的候选人。我们证明这种方法制造的两个高密度的乙酰胆碱酯酶和多激酶微阵列,使用这样的微阵列的小分子筛选。
研究方案
1。制备添加剂解决方案
- 准备25和50毫米三(羟甲基)氨基甲烷(Tris碱,Mŗ121.14克/摩尔)和HEPES(M R238.3克/摩尔)在pH值为7.0,7.2,7.4,7.6,7.8,8.0和8.2在50 ml离心管。用1N HCl和NaOH,将pH调节。在室温下保存,3个月后更换。
- 准备24%(重量/体积)的聚(乙烯醇)(PVA):称取2.4克PVA(M 瓦特 9,000 - 10,000,80%水解的),并加至10毫升的去离子蒸馏水(DDH 2 O的),溶解聚合物颗粒进行振荡。使用24%(重量/体积)的溶液中以制备等体积的16%(重量/体积),12%(重量/体积)和8%(重量/体积)的PVA解决方案。德加使用前超声解决方案。在4℃下储存最多至1个月。
- 准备24%(W / V)聚乙烯亚胺(PEI):加入PEI(M W 1300人,50%(W / W)的H 2 O)4.8毫升5.2毫升DDH 2 O。使用准备等量的24%(W / V)溶液16%(重量/体积),12%(重量/体积)和8%(重量/体积)PEI的解决方案。德加使用前超声解决方案。在4℃下储存最多至1个月。
- 准备60%(W / V)聚乙二醇(PEG):重6克PEG(M W 600),并加入10毫升DDH 2 O的溶解聚合物颗粒的涡旋。使用连续稀释以制备等体积的30%(重量/体积)的聚乙二醇溶液。德加使用前超声解决方案。在4℃下储存最多至1个月。
- 准备24%(V / V)N-(3 - 三乙氧基)葡糖(GLS):加480微升的GLS(50%乙醇 - 股票GLS可能需要使用水浴预热和溶解的解决方案,如果结晶)通过超声处理20分钟520μl的95%(体积/体积)乙醇和混合。使用24%(体积/体积)的溶液,以等体积的16%(体积/体积)GLS溶液。每天使用的新的解决方案。
- 准备24%(V / V)甲基三甲氧基硅烷(MTMS):加240微升MTMS现有酸化DDH 2 O(760微升pH值2.0,1N盐酸)和混合超声波处理20分钟。使用24%(体积/体积)的解决方案,以使MTMS溶液等体积的16%(体积/体积)。每天使用的新的解决方案。
- 准备24%(体积/体积)二[(3 - methyldimethoxylsilyl)丙基]聚环氧丙烷(MDSPPO):添加240微升MDSPPO中现有酸化双蒸2 O(pH为2.0,1N盐酸),混合760微升的20分钟利用超声波。使用24%(体积/体积)的溶液,以等体积的16%(体积/体积)MDSPPO溶液。每天使用的新的解决方案。
- 准备24%(体积/体积)3 - (氨基丙基) -三乙氧基硅烷(APTES):加到现有的酸化双蒸2 O(pH值2.0,1 N盐酸)并混合20分钟,超声处理760微升240微升的APTES。使用24%(体积/体积)的溶液,以等体积的16%(体积/体积)APTES溶液。每天使用的新的解决方案。
- 准备24%(体积/体积)的双(triethoxysily)乙烷(双-TEOS):现有酸化DDH 2 O的(pH值2.0,1N盐酸760微升240微升双-TEOS)混合,通过超声处理20分钟。使用24%(体积/体积)的溶液中,使双-TEOS溶液等体积的16%(体积/体积)。每天使用的新的解决方案。
- 准备24%(V / V)carboxyethylsilanetriol(SI-COOH):SI-COOH在DDH 2 O(25%)加960微升40微升现有酸化DDH 2 O的(pH值2.0,1N盐酸),混合20分钟利用超声波。使用24%(体积/体积)的溶液,以等体积的16%(体积/体积)的Si-COOH溶液。每天使用的新的解决方案。
- 分别准备3 mM的Nε -乙酰基-L-赖氨酸,D-山梨糖醇,α,α-海藻糖(M R188.22克/摩尔,182.17克/摩尔,378.33克/摩尔)和1.5 mM的曲拉通X-100 (平均M 瓦特 625克/摩尔),在DDH 2 O。卷可以取决于需要多少,每天使用作出新的解决方案。
- 准备60%(W / W)甘油:无水甘油2.4克至1.6克涡,混合DDH 2 O的。德加解决方案在使用前通过超声处理。在4℃下储存最多至1个月。
- 准备30%(W / W)甘油:无水甘油1.6克至2.4克涡,混合DDH 2 O的。德加使用前超声解决方案。在4℃下储存最多至1个月。
2。硅溶胶的制备
按照下面的程序,各自的溶胶,保存在冰中时,可以使用1小时后加入水。溶胶下降/材料不一致凝胶时间超过1小时使用。
- 的钠硅酸盐(SS)的基溶胶的制备
- 到500ml的塑料烧杯中,称取120克的离子交换树脂。
- 加入150毫升0.1N的盐酸,搅拌1小时,使用2英寸的磁力搅拌棒。
- 过滤溶液,用布氏漏斗真空连接。
- 慢慢加入DDH 2 O的,洗过滤树脂,直到得到的滤液清澈的。这大约需要100毫升双蒸2 O。
- 收集和储存所制备的树脂,在塑料容器中,在室温下最多1个月。
- 到50ml的塑料烧杯中,称取2.59克硅酸钠(SS,27%(重量/重量)的SiO 2,10%(重量/重量)的NaOH)。
- DDH 2 O的加入10毫升的SS。用手轻轻摇动使溶液混合。
- 到一个单独的50毫升塑料烧杯中,称取5.60克制备的树脂。添加硅酸钠溶液,搅拌2分钟,用一个一英寸的磁性搅拌棒。
- 连接到一个吸气器连接到一个水龙头用布氏漏斗过滤混合物溶液。
- 使用配用0.2微米的膜过滤器过滤溶胶溶液10 ml塑料注射器中。这将产生与5.6%(重量/重量)的溶胶二氧化硅简称为SS进一步文本。冰在不使用时,保持溶胶。
- 半SS:准备SS溶胶加1毫升1毫升DDH 2 O的,旋涡混匀。不用时,在冰上保持溶胶使用。
- (DGS)的diglycerylsilane基溶胶的制备
- 合成其他地方所描述的DGS 15,16店结晶DGS在干燥器中,在室温下最多至6个月。
- 称取结晶DGS大约1克。
- 使用迫击炮和杵磨的DGS细粉。完成此步骤尽可能快,以防止从空气中吸收水分。
- 小心转移细磨DGS到一个空的20毫升闪烁瓶中,记录质量(一克千分之一)。
- 添加DDH 2 O的产量为0.5克/毫升DGS。
- 超声水解DGS冰20分钟,5秒,每隔5分钟由涡流混合。在潮湿的日子里,完全溶解的DGS可能需要加入10μl1N盐酸。这应该被添加到该溶液中超声处理前。
- 用3毫升的塑料注射器配有孔径为0.2μm的膜过滤器过滤溶胶溶液,除去细颗粒。这将产生的溶胶与5.0%(重量/重量)的二氧化硅称为DGS进一步的文本。冰在不使用时,保持溶胶。
- DGS半:准备DGS溶胶加1毫升1毫升DDH 2 O的混合涡。冰在不使用时,保持溶胶。
3。预检识别打印材料
图1中所示的广义的方式示出导因素分析,用于识别可打印的材料的不同阶段的。 最低的总材料体积100μl建议。使用更小的体积,使得可视化材料的凝胶困难。
- 第1阶段:缓冲液和硅烷
- 2毫升玻璃闪烁瓶中加入50μl的缓冲液(25和50毫米的Tris或HEPES pH为7.0,7.2,7.4,7.6,7.8,8.0,8.2)。
- 加入50微升适当溶胶(DGS DGS半半SS,SS)和旋涡混合10秒和小康时尚移动小瓶旋涡混合器和关闭。
- 设置的材料在室温下休息,监测材料的凝胶化时间。凝胶化时间被定义为在该点的材料可自由旋转时的管形瓶中,以45°的角度停止流动。
- 排除凝胶时间少于2.5小时,后续物料的筛分级的材料组合。
- 第2阶段:缓冲液,硅烷和聚合物
- 在2毫升玻璃闪烁瓶中,加3.13微升或16%(W / V)或8%(W / V)的PVA / PEI溶液或6.3微升30%(W / V)或60%(W /五)PEG溶液。
- 添加50mM的HEPES(pH 8.0)中,使总体积至50μl,通过涡旋混合溶液。
- 加入50微升适当溶胶(DGS DGS半半SS,SS),混合步骤3.1.2中所描述的时尚。
- 排除凝胶时间(定义见步骤3.1.3)少于2.5小时,从后续物料的筛分级的材料组合。
- 第3阶段:缓冲区,硅烷基聚合物和有机硅烷
- 在2毫升玻璃闪烁小瓶中,加入3.13微升或16%(重量/体积)或8%(重量/体积)的PVA溶液或30%(重量/体积)或60%(w / v的6.3微升) PEG溶液。
- 添加3.13微升16%(W / V)有机硅烷(GLS,MTMS,MDSPPO,双TEOS,SI-COOH或APTES等)。
- 添加50mM的HEPES(pH 8.0)中,使总体积至50μl,通过涡旋混合溶液。
- 加入50微升适当溶胶(DGS DGS半半SS,SS)和混合步骤3.1.2中所描述的时尚。排除凝胶时间(定义见步骤3.1.3)少于2.5小时,从后续物料的筛分级的材料组合。
- 第4阶段:缓冲液,硅烷,聚合物,有机硅烷和小分子添加剂
- 在2毫升玻璃闪烁小瓶中,加入2.08微升或24%(重量/体积)或12%(重量/体积)的PVA溶液或30%(重量/体积)或60%(w / v的6.3微升) PEG溶液。
- 加2.08微升24%(W / V)有机硅烷(GLS,SI-COOH)。
- 加入2.08微升3毫米的小分子溶液(Nε -乙酰基-L-赖氨酸,D-山梨糖醇,α,α-海藻糖)或1.5毫米(曲拉通X-100)。
- 添加50mM的HEPES(pH 8.0)中,使总体积至50μl,通过涡旋混合溶液。
- 加入50微升适当溶胶(DGS DGS半半SS,SS)和混合步骤3.1.2中所描述的时尚。
- 排除凝胶时间(在步骤3.1.3定义)小于2.5小时,从后续的材料印刷阶段的材料组合。
4。打印掺蛋白材料的制备
在结束这些材料中的步骤3.4.6结转在可印刷性研究,现在被包括在溶胶与合适的酶。下文概述了在所有情况下,水溶液中的硅烷以外的所有元件制备在一个微孔,然后由另外的溶胶,就在打印之前。 384微量滴定板,以适应使用,溶液总体积为50μl加入100μl是用来代替。
- 乙酰胆碱酯酶(AChE)芯片
- 准备2 KU / ml的溶液,AChE的很多特定酶的活性(单位每毫克活动)由制造商提供的信息后,在50毫米HEPES(pH值8.0)。
- 分装2 KU / ml的酶原液用500微升离心管中并储存在-20°C到5微升分数2 KU /毫升的乙酰胆碱酯酶股票解决方案长达4个月保持稳定,储存在-20°C时,
- 准备基体材料相结合,相应的聚合物,有机硅烷和384孔微量滴定板中通过步骤3.4.6确定的小分子添加剂的一半体积。
- 加入5微升2 KU /毫升乙酰胆碱酯酶在50毫米HEPES(pH值8.0)。
- 使用50mM的HEPES(pH 8.0)中,使组合孔体积25μl的混合溶液通过移液向上和向下几次。
- 多激酶芯片
- 准备100纳克/μL的激酶的解决方案(p38α的MAPK2,表皮生长因子受体,GSK-3β)活性(U / ml或U /毫克)和数量由制造商提供的信息后,在DDH 2 O。存储激酶解决方案在2微升的等分试样在-80℃下
- 在5毫克/毫升,50毫克/毫升或300微米的DDH 2 O的准备激酶底物(MBP,P(E 4 Y),GSM),由制造商提供的数量信息。基板在2.5微升的等分试样,然后保存于-80℃。
- 准备基体材料相结合,相应的聚合物,有机硅烷和384孔微量滴定板中通过步骤3.4.6确定的小分子添加剂的一半体积。
- 以及包含基体材料,加入2.5微升激酶和其各自的基片2微升(p38α的MAPK2和MBP,EGF和MBPR和P(E 4 Y),GSK-3β和GSM)的编制步骤4.2.1和4.2.2。
- 使用50毫米HEPES(pH值7.4),带来的合并以及体积至25μl。吹打混合。
5。基因芯片组
本节介绍了在一个单一的滑动面印刷材料的详细过程。要打印多个修改的滑动面(环氧树脂,胺,醛和聚甲基丙烯酸甲酯),此过程重复4次。
- 形成微阵列,通过XYZ载物台配备的接触销的印刷机器人。使用有开槽鞘标签直径为100μM,以沉积掺蛋白溶胶。
- 设置在80%至90%的印刷室的湿度。湿度<80%,可能会导致在样品的蒸发和印刷不一致,由于沉积量小。
- 前15分钟的印刷和干燥氮气流下超声在DDH 2 O引脚。使用管道cleaner以除去残留的水分从销钉保持器内,并小心地将针在打印头中。不以去除残留的水分可能会妨碍脚自由移动,持有人,导致错过点。
- 控制阵列模式,通过芯片作家临(CWP)计划。对于每个样本内的384孔的源板,200个点(使用的SMP3鞘引脚每摄取的点的最大数量)的表面改性的玻璃载片上印刷。
- 开始印刷过程中,通过该软件。设置在XY方向上旅行,以10 mm / s的速度和样品的方法(Z方向),以2毫米/秒与2.5秒采样时间。
- 通过CWP暂停运行。降低针放入样品中,加入25微升各自溶胶(DGS DGS半半SS,SS),以及用吸管。溶液混合,用50倍重复的向上和向下的移液动作。通过移液混合时,最小化的空气的量加入溶液。气泡预防吨内完成装载样品,销。
- 通过CWP,开始打印过程中和打印样本到一个滑动面。之前暂停打印过程中装载样品板以及随后的来源。
- 拆下打印针使用磁铁和管放置在打印头在打印头的清洁,以防止受潮。
- 冲洗DDH 2 O的打印针,超声干净DDH 2 O 30秒。
- 下氮气流中干燥打印针和移除的管清洁器,放置到打印头的引脚。
- 以下步骤是5.6 - 5.10,所有样品的内源板剩余开始打印。最多至12,000点直径100微米,可以存放到一个单一的幻灯片。
- 此方法也可以应用到井的底部上的印刷材料,在96孔微量培养板中。经过的CWP校准文件,重新校准以确保远程控制打印针策旅游以上的微孔板的高度之间的点沉积。这允许引脚始终很好地以线性方式打印而不损坏引脚。
- 年龄在80-90%的湿度下完成整个印刷实验后30分钟至24小时内的印刷室最少的阵列。
6。乙酰胆碱酯酶活性测定
- 阳性对照(PC)样品准备
- 准备1毫米碘化乙酰胆碱(ATCH:M R289.18克/摩尔)在4%甘油,25毫米的Tris(pH值7.0)的1.5毫升离心管中。 ATCH需要在每次使用前新鲜配制和使用较高的pH缓冲液的pH为7.0的缓冲会导致快速的自发水解,产生误报。根据样品(每个样品25微升)的数量,可以是多种多样的最终体积。
- 0.14微升5mM的BODIPY-FL-L-胱氨酸加入25微升为1mM ATCH在阱384微量滴定解放军德。
- 添加24.86微升4%甘油的25mM的Tris(pH7.0)中,用移液管小心,以避免在溶液中的气泡形成的混合。潜在的酶抑制剂,可以掺入到PC溶液前用缓冲液使体积至50μl。
- 准备阴性对照组(NC)样本
- 中加入0.14微升5毫BODIPY-FL-L-胱氨酸49.86微升4%甘油,25毫摩尔Tris(pH6.5)中,在384微量滴定板的孔中。吹打混合。
- 叠印PC和NC解决方案
- 套印中年蕊片以下步骤5.1 - 5.10(忽略步骤5.6)的协议。使用槽护套的管脚直径235微米存入的PC和NC套印的解决方案。这可确保溶液完全覆盖先前沉积的斑点。
- 年龄在80-90%的湿度下的阵列在室温下进行1小时。由于自发水解ATCH,较长的孵育时间可能导致误报或增加连接酶的活性。
7。激酶活性测定
- 准备500μM腺苷-5'-三磷酸(ATP)的解决方案,使用库存ATP(100毫摩尔),保存于-20℃。新鲜的解决方案,每个实验和实验的需要调节音量:每个印刷解决方案需要5微升。
- 准备100毫米氯化镁( 氯化镁 :M R95.21克/摩尔)原液在DDH 2 O
- 阳性对照(PC)
- 加入2.5微升的100mM的MgCl 2和5μl500μM的ATP 384微量滴定板的孔中。
- 带来的总的孔体积至50μl用50mM HEPES(pH 7.4)中,通过移液混合。潜在的酶抑制剂,可以掺入到PC溶液前用缓冲液使体积至50μl。
- 阴性对照组(NC)
- 加入2.5微升的100mM的MgCl 2和5μlDDH 2 O 的 384米的井icrotiter板。
- 用50mM HEPES(pH 7.4)中,通过移液混合,使总的孔体积至50μl。
- 叠印PC和NC检测辅助因子
- 遵循步骤6.3.1的协议。
- 年龄在80-90%的湿度下在室温下搅拌2小时阵列。
- 幻灯片染色
- 地点印刷芯片幻灯片在培养皿中分别有足够的染料(套件),以覆盖整个幻灯片。摇适度使用板摇床45分钟(约200转)。
- 删除的幻灯片,使用镊子,并放入一个干净的培养皿中,用洗涤缓冲液(套件)。摇适度使用板摇床45分钟(约200转)。
- 取出使用产钳的滑动,并配备了幻灯片持有人使用传统的桌面芯片离心甩干。
8。微阵列成像与分析
- 成像
请注意,影像处理方法将是Specific数组类型的读者提供。在这些研究中,配备一个Alpha Innotech公司的白色光源和CCD检测系统NovaRay成像器478±17 nm的激发波长和538±21 nm的发射光滤光片AChE的微阵列,和530±40 nm的激发波长和614±62 nm的发射筛选激酶芯片。共聚焦激光扫描系统也可以被用于读取的阵列,但这些设置将被特定的仪器。
- 将幻灯片插入到幻灯片持有人与面临的斑点。
- 设置的预览部分的数目(至少2建议的显微镜载片上的任一端),分辨率(建议最少为4μm)内的图像处理软件曝光(自动建议)。
- 采集幻灯片图像,并保存为“TIFF”文件。
- 分析
- 开启收购的幻灯片图像ImageJ64。
- 点击椭圆选择工具和测量每个点的信号强度测量分析“选项卡下选择使用。当选择的面积来衡量,选择一个区域略大于观测点和ImageJ的主观性之间的点,以减少大小一致。
- 中等强度类似PC从25点,除以25个类似的NC点的平均强度比个人材料组合物获得PC / NC。
结果
材质屏幕进行引导因素分析,我们能够尽量减少材料测试的数量从20,000〜几百适合印刷的胶凝时间。通过应用严格的指导方针,要求材料凝胶化时间2.5小时或以上,从未被印刷材料可能堵塞打印针或产生不可复制的阵列。确定的可打印的材料,有足够的凝胶化时间(> 2.5小时)到4种不同的官能化的载玻片表面上印刷。为了被认为是“可打印”,每摄取量的引脚的点的最大数目,还必须印SMP3(= 200)。斑点现货的形态也进行了评估,以确保使用简单的明视场显微术,如在图2中示出,不开裂或不希望出现的相分离发生。
从这个阶段确定的打印材料,芯片生产的乙酰胆碱酯酶和纳入激酶缓冲的含水组分。材料兼容的检测程序(包括潜在的叠印和洗涤步骤或染色步骤)确定观察微阵列点,保留(不开裂,斑点或不寻常的荧光图案的损失)和阳性对照(PC)的阴性对照(NC )的比值大于1的作为直通图像观察。由于这是大约50%的材料,有较大的比为3 PC / NC使用保留蛋白的活性,以确定最佳的材料。通过这种方法,26溶胶凝胶材料含有乙酰胆碱酯酶和2的材料中含有激酶满足> 3的PC / NC标准图3和图4显示了一个图形击穿5引导材质的屏幕,识别最佳的乙酰胆碱酯酶和激酶的步骤微阵列。
检测也可以通过产生一个Z'得分进行验证。 图5示出通过比较产生的信号从200点,100的PC,叠印后AChE的阵列上的指示剂染料和衬底和100的NC得到的Z'情节。 Z'在各自的得分为0.60和0.67,表明一个很好的实验导致的疼痛和激酶阵列。然而,应该指出的是,阵列的酶,染料,底物和辅因子浓度测定前应验证通过叠印各组分的浓度,选择的范围内的浓度,产生最高的信号,进行优化,如其他地方详细描述5。
来验证的试验,得到定量的抑制数据用已知和未知的乙酰胆碱酯酶抑制剂,重复执行的结果,并用来产生重复的图( 图6A)和抑制曲线( 图6B和6C)。强>景点第一套印已知的具有生物活性的小分子抑制剂的混合物,然后用染料和基板,包括控制混合物包含两种已知的抑制剂或无抑制剂。产生重复的重复,以评估酶的活性,导致酶活性低于25%的任何混合物的抑制被认为是阳性的。个别化合物从这种混合物,然后测试重复来识别特定的小分子()负责抑制。一旦确定,这些小分子被用来生成定量的抑制曲线,以确定IC 50值与抑制常数。
类似的定性结果获得了使用一个共同的激酶抑制剂星形孢菌素的的多激酶阵列与图7A和7B示出的微阵列图像,并注明叠印和染色的多激酶后的信号强度数组中的预期( - ATP)阴性对照组,阳性对照(ATP)和已知抑制剂(+ ATP + INH)。为了演示的能力,获得定量的抑制从微阵列的数据,以浓度依赖的抑制测定为一个单一的激酶。 图8A和8B中所示,信号强度随着抑制剂浓度的增加而减小,并响应如下的的激酶/基板p38α/MBP系统为预期浓度依赖性的抑制曲线。
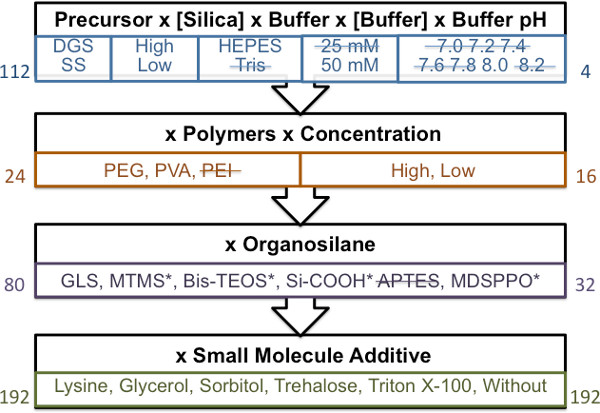
图1。导游物料的筛分方法的一般原理。每块代表的步骤顺序的画面。在左侧的编号表示准备用于分析的材料的总数。使用凝胶时间大于2.5小时(材料的胶凝时间小于2.5小时ARê表示三振),通过每个阶段的材料和材质的屏幕,在结转表示由数量的权利。 *表示用不到最佳的相分离的材料。

图2。光学图像显示屏幕上面的印刷适性步骤的材料的失效模式的不同。一个形象的一个“好”的材料(第二行,第三列中)还示出作比较。转载参考8,版权2013美国化学学会的许可。
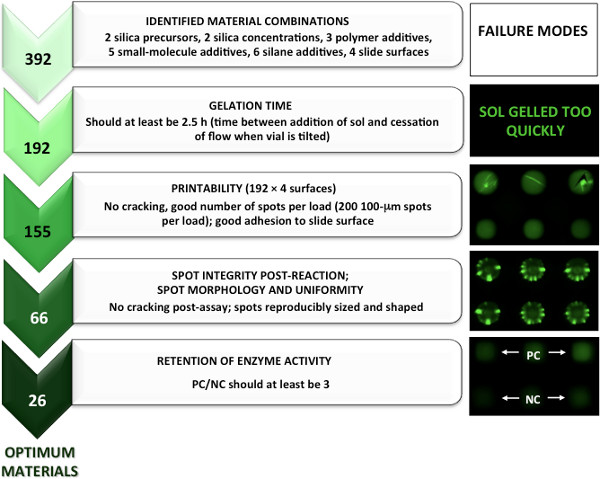
图3。烫发转载定向材料的筛选方法鉴定的最佳材料制造溶胶-凝胶衍生的乙酰胆碱酯酶微阵列。ission参考5,著作权2013美国化学学会。

图4。有向材料筛选方法鉴定的最佳材料制造溶胶-凝胶源性激酶芯片。转载参考8,版权2013美国化学学会的许可。
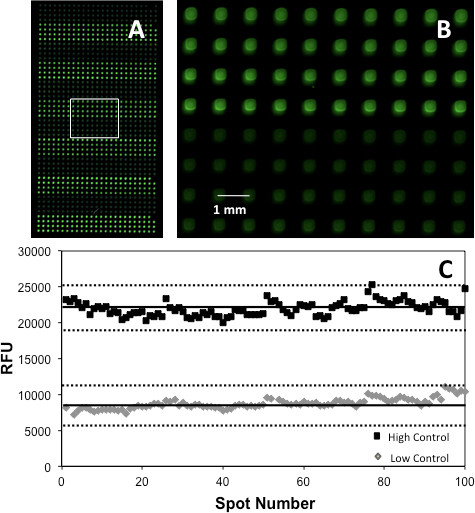
图5。 (A)A的乙酰胆碱酯酶芯片显示HC(亮绿色)和LC(浅绿色)点(一个黑绿色调色板伪清晰的演示),(B)盒装面积的放大视图突出现货形态对应,和(C)的Z'情节。实线表示的平均值重复,而虚线对应3SD。转载参考5,著作权2013美国化学学会的许可。
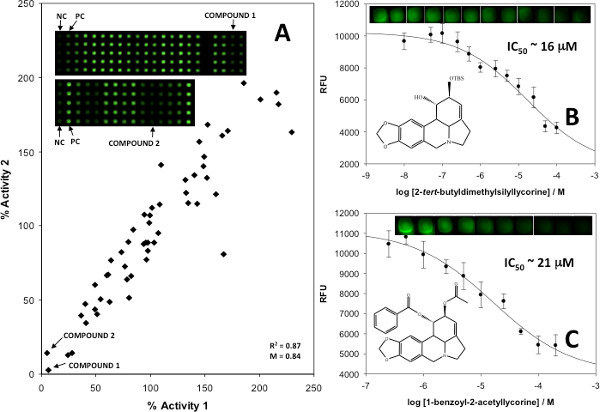
图6。 (A)重复阵列筛选石蒜生物碱的合成类似物的阴谋,(B)IC 50块标记为识别潜在抑制剂化合物1和化合物(C)2,用误差棒代表一个标准差的平均值从25复制。代表点来说明不同抑制剂浓度成比例的信号。转载版权许可参考5,2013年美国化学学会。 点击这里查看大图 。
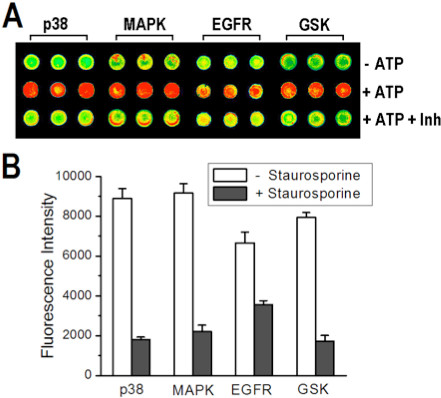
图7。 (A)形象,其中一款芯片斑激酶包埋各自的基板被套印缓冲区阵列检测四个激酶使用1.4SS/1.0PVA截留并打印到一个胺衍生的幻灯片。 (NC,上排),或含有ATP(PC,中间行)或ATP +星形孢菌素(下排)的解决方案。 (B)之间比较信号强度条形图抑制的不羁的反应后,减去背景信号和误差棒代表一个标准差的平均值从25个重复。转载参考8,版权2013美国化学学会的许可。
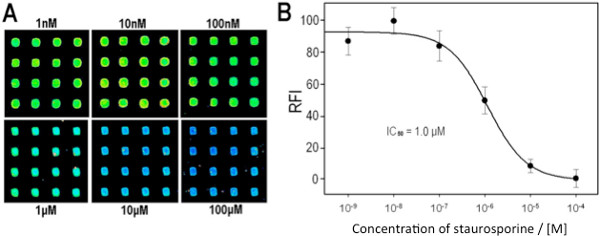
图8。 Inhibiti上p38a/MBP微阵列测定(A)示出有代表性的点,与不同浓度的星形孢菌素overspotted的微阵列的部分,如(同一个幻灯片的单次扫描方式获得的图像,合成图像显示的清晰度)。 (B)的 IC 50曲线生成从所分析的阵列图像。从所有图像中减去获得的强度在100 mM,所有其他的强度归一化的强度设置在10纳米到100%的酶活性值。转载参考8,版权2013美国化学学会的许可。
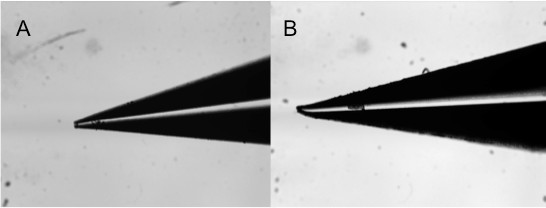
图9所示。用于微观隐形针插针印刷各种缺陷的图像:(A),(B)堵塞弯曲。
讨论
这里描述的方法被选择为最合适的吞吐量接触打印机可打印的溶胶 - 凝胶衍生材料,制造时间和成本有效的程序的快速吞吐量最佳的材料,而无需筛选大量的材料。从共〜20,000的潜在材料,它是可能的,以确定〜200的材料,适合于单独的凝胶时间的基础上,打印。这大大减少了所需材料的数量要准备随后的印刷试验。这些可打印的材料,然后印刷到4个滑动面,总的768材料的滑动组合。平均而言,50点/复制的一种材料,可以打印〜3分钟,包括样品装载,现货沉积和引脚清洗。其中,155的材料,或大约20%,允许打印的点的最大数目每个溶液的吸收,并产生可再现的光斑尺寸。应该指出的是,4 sl的IDE表面测试,材料上印制的顺序为:胺>环氧树脂>醛> PMMA,PMMA幻灯片没有产生有用的阵列的任何材料。这可能是由于表面涂层的极性。比较,在上述的滑动表面,极性较大的胺和环氧,更适合的水溶胶相比,聚甲基丙烯酸甲酯的幻灯片。此外,胺包被的载玻片的测试表面,提供了一个潜在的正电的表面沉积的粘结阴离子溶胶。我们怀疑,二氧化硅纳米颗粒的界面处之间的滑动和沿表面的溶胶交互。环氧和醛的滑动表面缺乏相同的初始基于电荷的相互作用。为了确保最佳的现货沉积,强烈建议从供应商如Arrayit使用预涂幻灯片,。在内部涂层会产生不一致的表面,导致点再现性差13,在某些情况下,可能会导致量化概率的根源。18同样重要的,温度和湿度的影响“的印刷适性”的材料。虽然没有详细的与温度有关的影响进行了研究,始终进行印刷,在室温下(23±3℃)。湿度(大于80%)也被控制在打印室之内,以防止由于小的沉积量(0.7-2.3 nl)的和蒸发的不规则形状沉积。
虽然材质屏幕引向确定最佳的溶胶 - 凝胶衍生材料专为印刷乙酰胆碱酯酶和激酶,一小部分的材料进行鉴定,曾任职于这两种类型的蛋白质。事实上,两个被确定在激酶芯片制造的材料是基于SS + PVA +甘油,并于AChE的微阵列26选择的材料,这两种材料也被确认。这些“最佳”的材料可能会提供一个通用的起点,进一步发展PROTE掺杂溶胶 - 凝胶微阵列,并围绕这些组合物的小屏幕可以识别芯片制造的甚至更好的材料。第二点要注意的是所用的酶的重要性。乙酰胆碱酯酶(相当强大的酶)的情况下,保留原来的66确定检测兼容的材料26(或约40%),残存的乙酰胆碱酯酶的活性。然而,对于的更细腻激酶,只有2 69检测兼容的组合物,或大约3%的材料,能够保留所有的激酶的活性。当足够数量的不同的酶还没有被研究作出决定性的报表,它似乎与相对不稳定的酶的优化阵列制造,可能会导致鉴定的材料,可以截留广泛的蛋白质,能使芯片制造mutliplexed。
独立于所选择的蛋白,吞吐量可打印的材料的截止主要因素是需要相当长的材料的凝胶时间(2.5小时)。在开发基于SS的溶胶 - 凝胶材料时,这是非常重要的,以确保在离子交换和过滤后,该溶胶是在pH约为4。溶胶具有较低的初始pH值可能导致在材料以低于中性的pH值,这可能会影响酶的活性。19 DOWEX(离子交换树脂),对SS的量,可以改变最终的溶胶的pH值的调节。当一个新的批次的树脂制备的树脂对SS的比例需要调整以便产生溶胶协议的第2条中的程序后,在约pH值为4。
同样,结晶DGS的编制往往是错误的来源,相关的材料失效时,利用生物分子截留DGS基溶胶。虽然没有在这里详细报道,伟大的护理过程中要采取的合成结晶DGS,尤其需要避免的合成过程中水的存在,可以产生polyglycerated二氧化硅TES而非单体DGS。此外,由于DGS的吸湿性,结晶样品需要被存储的干燥的,合成后的6个月内使用。 6个月以上的结晶性DGS可能不完全溶解,即使在酸性环境下用超声处理(由于部分冷凝的聚甘油硅酸盐材料)。不完全的DGS解散溶胶未知和不可控的二氧化硅含量,因此,不太可靠的材料。
一个重要的一点要注意接触印刷质量的针脚。损坏或处理不当销( 图9)将不会产生重复性阵列正在打印的材料无关。建议检查使用解剖显微镜,以确保不使用破裂或堵塞销针质量。小心处理,确保使用寿命长的引脚。自由流动的引脚也很重要。在被困在打印头之间的头和脚,脚湿气的情况下,不会座椅正确和适当的接触,因而不会使配合面,导致在缺乏材料的沉积。
总之,我们已经提供了一个详细的,多步骤的筛选方法,发展高密度蛋白掺针印制的微阵列。甄别涉及优化材料性能(凝胶化时间和适印性),以允许识别兼容一个给定的检测,并能保留酶活性的材料,印刷材料,然后由更集中的筛选。本指导材料的筛选方法可以应用到其他微阵列格式,以减少时间和成本与生产效率的高密度微阵列。
披露声明
我们什么都没有透露。
致谢
作者感谢玛丽亚·蒙顿朱莉莱贝特的,源自:jessamyn小,葛昕和劳拉Lautens的协助开发蛋白质芯片。作者还感谢自然科学和工程研究理事会,加拿大(NSERC)为这项工作提供资金。作者还感谢加拿大基金会为支持这项工作的创新和安大略省创新信托。加多宝拥有加拿大研究主席在生物分析化学和生物界面。
材料
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Poly(vinyl alcohol) (PVA) | Sigma-Alderich | 360627 | 80% hydrolozyed, Mw 600 |
| Polyethylene glycol 600 (PEG) | Sigma-Alderich | 87333 | |
| Polyethylenimine (PEI) | Sigma-Alderich | 482595 | 50 wt% solution in water |
| Carboxyethylsilanetriol (Si-COOH) | Gelest, Inc. | SIC2263.0 | 25% in water |
| N-(3-triethoxysilylpropyl) gluconamide(GLS) | Gelest, Inc. | SIT8189.0 | 50% in ethanol |
| bis[(3-methyldimethoxysilyl)propyl]polypropylene oxide (MDSPPO) | Gelest, Inc. | SIB1660.0 | |
| Methyltrimethoxysilane (MTMS) | Gelest, Inc. | SIM6560.1 | |
| Bis(triethoxysiyly)ethane (Bis-TEOS) | Gelest, Inc. | SIB1817.0 | |
| 3-Aminopropyltriethoxysilane (APTES) | Gelest, Inc. | SIA0610.0 | |
| Glycerol | Sigma-Alderich | 49767 | |
| D-Sorbitol | Sigma-Alderich | 240850 | |
| D-(+)-Trehalose dihydrate | Sigma-Alderich | T9531 | |
| Triton X-100 | Sigma-Alderich | X-100 | |
| Nε-Acetyl-L-lysine | Sigma-Alderich | A4021 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Alderich | 154563 | |
| HEPES | Sigma-Alderich | H3375 | |
| Sodium hydroxide, 1.0 N | LabChem Inc. | LC24350-2 | |
| Hydrochloric Acid, 1.0 N/0.1 N | LabChem Inc. | LC15300-2/LC152220-2 | |
| Magnesium chloride | Sigma-Alderich | M8266 | |
| Diglycerolsilane (DGS) | Prepared in laboratory | ||
| Sodium silicate solution | Fisher Scientific | SS338-1 | |
| Dowex 50WX8-100 ion exchance resin | Sigma-Alderich | 217492 | |
| Acetylthiocholine iodide | Sigma-Alderich | 1480 | |
| Acetylcholinesterase from Electrophorus electricus (electric eel) | Sigma-Alderich | C2888 | |
| BODIPY FL L-Cystine | Invitrogen | B-20340 | |
| Pro-Q Diamond Phosphoprotein/Phosphopeptide Microarray Stain Kit | Invitrogen | P33706 | |
| Adenosine 5'triphosphate disodium salt (ATP) solution | Sigma-Alderich | A6559 | |
| MAP Kinase 2 (MAPK2) | EMD Millipore | 454850 | |
| p38α/SAPK2a (T106M), active | EMD Millipore | 14-687M | |
| Epidermal growth factor (EGFR) | EMD Millipore | Donated by Millipore | |
| Glycogen synthase kinase 3β (GSK-3β) | EMD Millipore | 14-306 | |
| Myelin basic protein (MBP) | EMD Millipore | Substrate for MAPK2 and p38α, Donated by Millipore | |
| GSM | EMD Millipore | 12-533 | Substrate for GSK-3β |
| Poly-glu-tyr polypeptide p(E4Y) | EMD Millipore | 12-440 | Substrate for EGFR |
| Stealth pin | ArrayIt | SMP3 | |
| Stealth pin | ArrayIt | SMP7 | |
| Amine coated slides | ArrayIt | SMM2 | |
| Aldehyde coated slides | ArrayIt | SMA2 | |
| Exposy coated slides | ArrayIt | SME2 | |
| Poly(methylmethacrylate) (PMMA) coated slides | Exakt Technologies Inc. | 41500 | |
| 0.2-μm syringe filter | PALL Life Sciences | 4612 | |
| Equipment | |||
| Virtek Contact Printer | BioRad | ||
| Novaray Fluorescence Slide Imager | Alpha Innotech Corporation | ||
| Desktop microarray centrifuge | ArrayIt | MHC110V | |
| MilliQ Synthesis A10 | Millipore | Used to filter all water required for experiments |
参考文献
- Schena, M. M., Shalon, D. D., Davis, R. W. R., Brown, P. O. P. Quantitative monitoring of gene expression patterns with a complementary DNA microarray. Science (New York, N.Y.). 270 (5235), 467-470 (1995).
- MacBeath, G., Schreiber, S. L. Printing proteins as microarrays for high-throughput function determination. Science (New York, N.Y.). 289 (5485), 1760-1763 (2000).
- Zhu, H. H., Bilgin, M. M., et al. Global analysis of protein activities using proteome chips. Science (New York, N.Y.). 293 (5537), 2101-2105 (2001).
- Hook, A. L., Chang, C. -. Y., et al. Combinatorial discovery of polymers resistant to bacterial attachment. Nature Biotechnology. , (2012).
- Monton, M. R. N., Lebert, J. M., Little, J. R. L., Nair, J. J., McNulty, J., Brennan, J. D. A Sol-Gel-Derived Acetylcholinesterase Microarray for Nanovolume Small-Molecule Screening. Analytical Chemistry. 82 (22), 9365-9373 (2010).
- Cho, E. J., Tao, Z., Tehan, E. C., Bright, F. V. Multianalyte pin-printed biosensor arrays based on protein-doped xerogels. Analytical Chemistry. 74 (24), 6177-6184 (2002).
- Cho, E. J., Tao, Z., et al. Tools to Rapidly Produce and Screen Biodegradable Polymer and Sol-Gel-Derived Xerogel Formulations. Applied Spectroscopy. Society for Applied Spectroscopy. 56 (11), 1385-1389 (2002).
- Ge, X., Lebert, J. M., Monton, M. R. N., Lautens, L. L., Brennan, J. D. Materials Screening for Sol-Gel-Derived High-Density Multi-Kinase Microarrays. Chemistry of Materials. 23 (16), 3685-3691 (2011).
- Rupcich, N., Green, J. R. A., Brennan, J. D. Nanovolume Kinase Inhibition Assay Using a Sol-Gel-Derived Multicomponent Microarray. Analytical Chemistry. 77 (24), 8013-8019 (2005).
- Rupcich, N. Coupled enzyme reaction microarrays based on pin-printing of sol-gel derived biomaterials. Analytica Chimica Acta. 500 (1-2), 3-12 (2003).
- MacBeath, G. G., Schreiber, S. L. S. Printing proteins as microarrays for high-throughput function determination. Science (New York, N.Y.). 289 (5485), 1760-1763 (2000).
- Stillman, B. A. B., Tonkinson, J. L. J. FAST slides: a novel surface for microarrays. BioTechniques. 29 (3), 630-635 (2000).
- Rupcich, N., Goldstein, A., Brennan, J. D. Optimization of sol-gel formulations and surface treatments for the development of pin-printed protein microarrays. Chemistry of Materials. 15 (9), 1803-1811 (2003).
- Gill, I., Ballesteros, A. Encapsulation of biologicals within silicate, siloxane, and hybrid sol-gel polymers: An efficient and generic approach. Journal of the American Chemical Society. 120 (34), 8587-8598 (1998).
- Brook, M. A., Chen, Y., et al. Proteins entrapped in silica monoliths prepared from glyceroxysilanes. Journal of Sol-gel Science and Technology. 31 (1), 343-348 (2004).
- Brook, M. A., Chen, Y., Guo, K., Zhang, Z., Brennan, J. D. Sugar-modified silanes: precursors for silica monoliths. Journal of Materials Chemistry. 14 (9), 1469 (2004).
- Zhang, J., Chung, T., Oldenburg, K. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- . Next generation of protein microarray support materials: Evaluation for protein and antibody microarray applications. Journal of Chromatography A. , 1-8 (2013).
- Bhatia, R. B., Brinker, C. J., Gupta, A. K., Singh, A. K. Aqueous Sol-Gel Process for Protein Encapsulation. Chemistry of Materials. 12 (8), 2434-2441 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。