Method Article
גישת הקרנת חומרים מודרכת לפיתוח Microarrays החלבון כמותי סול ג הנגזר
In This Article
Summary
גישה חומרי הקרנה מודרכת לפתח microarrays מסוממת סול ג נגזר חלבון באמצעות שיטת סיכת הדפסה מתפתחת של ייצור מתוארת. מתודולוגיה זו באה לידי ביטוי באמצעות הפיתוח של acetylcholinesterase וmultikinase microarrays, המשמשים להקרנת מולקולה קטנה וחסכונית.
Abstract
Microarrays מצאו שימוש בפיתוח של מבחני תפוקה גבוהה לחומרים חדשים וגילוי של מוביל סמים מולקולות קטנות. מסמך זה אנו מתארים את הגישה חומרית הקרנה מודרכת לזיהוי חומרים מבוססי סול ג המתאימים לייצור חלבון microarrays תלת ממדית. הגישה ראשונה מזהה חומרים שניתן להדפיס כmicroarrays, מצמצמת את מספר החומרים אלו על ידי זיהוי התואמים את assay אנזים מסוים, ולאחר מכן התמקדות ברזולוציה גבוהה על חומרים אופטימליים המבוסס על שמירה של פעילות אנזים מקסימלית. גישה זו מיושמת לפתח microarrays מתאימה לשני מבחני אנזים שונים, אחד באמצעות acetylcholinesterase והשני באמצעות סדרה של ארבע קינאזות המרכזיות מעורבת בסרטן. בכל מקרה, אפשר היה לייצר microarrays שיכול לשמש למבחני מיון מולקולות קטנות כמותיים וייצור של עקומות תגובה מעכבים תלויות מינון. חשוב מכך, את יכולת מסך בן זוג רביםריאל הניב מידע על סוגי חומרים שהמתאימים ביותר הן ייצור microarray ושימור של פעילות אנזים. נתוני החומרים לספק תובנות לגבי דרישות חומר בסיסיות הנדרשות להתאמה אופטימלית microarrays, בצפיפות גבוהה הנגזרת סול ג.
Introduction
Microarrays צבר פופולריות בקרב הקהילה המדעית כאמצעי להגדלת תפוקת assay. מאז הפיתוח של טכנולוגיית microarray להעריך ביטוי גני 1 בשנת 1990 באמצע, microarrays מצאו שימוש בפיתוח של מבחני תפוקה גבוהה כדי לזהות מולקולת אינטראקציות בין חלבונים וחלבונים קטנים, ולמצוא חומרים חדשים בעלי תכונות ייחודיות. 2-5 לאחרונה, microarrays פותחו בו חומרים מסוימים המשמשים כדי לשתק חלבונים פונקציונליים, בהפקת אלמנט microarray תלת ממדי שבתוכו חלבונים בפח, מה שמאפשר למדידה קלילה של פעילות האנזימטית ועיכוב בmicroarray עצמו באמצעות הקרינה מתאימה assay כי הוא יחד למחזור המצע. 5-10 חשוב לציין, יכולה להיות מתוכנן microarrays כאלה שיכלול את כל המרכיבים הדרושים לדגימות מסך ובקרים יחד בצורה מאוד מקבילה. 5,8
דוגמאות הראשונות של microarrays החלבון בדרך כלל הוכנו תוך שימוש בשיטות סטנדרטיות לקיבוע על גבי חלבון תומך מוצק, כגון קובץ מצורף קוולנטיים, 11 זיקה ללכוד 3 וספיחה פיזית. בעוד 12 שיטות של ביו immobilization אלה מאפשרות לריכוז מדגם גדל וקינטיקה תגובה מואצת נדרשים מזעור assay, כל אחד מהם סובלים חסרונות. באופן כללי, כל לגרום לירידה בתפקוד האם של biomolecule בשל שינוי הכימי של פני השטח, הפריעה את גישה לאתרים פעילים, או נטייה פסולה בשל חוסר תנועה שאינה ספציפית. לפיכך, בכל שיטות התוצאה ברגישות assay נמוכה למרות עלייה בתצהיר biomolecule, סביר להניח שתגובה עולה בשל הצורך לקשור מולקולות ביולוגיות באופן מלאכותי למשטח.
גישה המתעוררות לייצור microarrays biomolecule הפונקציונלי היא באמצעות סיכת הדפסה של חלבון מסומםSols סיליקה על גבי תומך מוצק, שהם בדרך כלל שקופיות זכוכית או פונקציונלית או בארות בודדות של צלחות microwell. תהליך סול ג'ל עצמו מתרחש בסביבה מימית בטמפרטורת חדר, וזה מבשר נוזל שמודפס ולאחר מכן ג'ל לביומולקולות לוכד בתוך מטריצת 3D, המאפשר לחלבון גבוה טעינת 13 כמו גם מלכודת של רכיבים מרובים בתוך אותו יסוד microarray. 13,14 חייטות של החומר נגזר סול ג ניתן לעשות זאת באמצעות בחירה זהירה של מבשרי סיליקה שונים, כמו גם על ידי שינוי המרכיב המימית באמצעות שימוש במאגרים שונים (pH, חוזק יוני), והכללתו של תוספים שונים (פולימרים, מולקולות קטנות) כדי להשיג את חומר אופטימלי, האופי המיוחד של אשר תלוי biomolecule כי הוא ממולכד. 10
מגבלה פוטנציאלית הקשורים בפיתוח microarrays חלבון הנגזר סול ג באמצעות סיכת הדפסההצורך לזהות חומרים מרוכבים על בסיס סול ג'ל שניתן להדפיס ללא gelling בסיכה או מראים תכונות לא רצויות (גדלי irreproducible ספוט, פיצוח, הדבקה לקויה, חוסר תאימות עם רכיבי assay, פעילות חלבון עניה) מודפסות פעם אחת על משטח. 5 סימולטני אופטימיזציה של כל הפרמטרים הללו מונעת ניתן עצבו חומרי מסגרתו גישת דה נובו, או בדקה באיטיות באופן סדרתי. מצד השני, הקרנה של אלף רבים או עשרות אלפי של חומרים אקראיים היא לא זמן ולא, יעיל וחסכוני.
במאמר זה, אנו מתארים את גישת הקרנה מכוונת המאפשרת זיהוי מהיר של חומרים המתאימים לייצור של חלבון microarrays ללא צורך במסך באופן אקראי מספר גדול של חומרים. באמצעות גישה מודרכת, חומרים מתאימים להדפסת microarray מזוהים ראשון, ואחריו סדרה של מסכי בקנה מידה קטנה לזיהוי אופטימלי סול ג נגזר materiשילובי al שניתן להדפיס reproducibly, ללא פיצוח ותואמים assay נתון. לבסוף, חומרים אופטימליים מזוהים מבוססים על שמירה של פעילות אנזים ובביצועי assay הקרנת מולקולה קטנה סופי. בדרך זו, ניתן לזהות חומרים אופטימליים מאלף מועמדים רבים באמצעות צעדי assay רק כמה מאה. אנו מדגימים גישה זו עבור ייצור של שניהם acetylcholinesterase בצפיפות גבוהה וmicroarrays multikinase ושימוש microarrays כאלה להקרנה מולקולה קטנה.
Protocol
1. הכנת פתרונות תוסף
- הכן 25 ו -50 מ"מ טריס aminomethane (hydroxymethyl) (טריס בסיס, M r 121.14 g / mol) צנטריפוגות וHEPES (ז R 238.3 g / mol) ב-pH 7.0, 7.2, 7.4, 7.6, 7.8, 8.0 ו 8.2 ב 50 מ"ל צינורות. התאם את ה-pH באמצעות 1 N HCl וNaOH, בהתאמה. לאחסן בטמפרטורת חדר ולהחליף לאחר 3 חודשים.
- הכינו 24% (w / v) פולי (ויניל אלכוהול) (PVA): שוקלים 2.4 גרם של PVA (M W 9,000 - 10,000, 80% עברו הידרוליזה) ולהוסיף עד 10 מ"ל של מים deionized-מזוקקים (DDH 2 O), לפזר את כדורי הפולימר ידי vortexing. השתמש 24% (w / v) פתרון כדי להכין כמויות שווה של 16% (W / V), 12% (w / v) ו -8% (w / v) פתרונות PVA. פתרונות דגה ידי sonication לפני השימוש. חנות ב 4 מעלות צלזיוס עד לחודש 1.
- הכן 24% (w / v) פוליאתילן imine (תש"ן): להוסיף 4.8 מ"ל של PEI (ז 1,300 W, 50% (w / w) בH 2 O) לרמה של 5.2 מ"ל של DDH 2 O. השתמש 24% (w / v) פתרון כדי להכין כמויות שווהשל 16% (w / v), 12% (w / v) ו -8% (w / v) פתרונות PEI. פתרונות דגה ידי sonication לפני השימוש. חנות ב 4 מעלות צלזיוס עד לחודש 1.
- הכן 60% (w / v) פוליאתילן גליקול (PEG): שוקל 6 גרם של PEG (M W 600) ולהוסיף עד 10 מ"ל של DDH 2 O, לפזר את כדורי הפולימר ידי vortexing. השתמש בדילול סדרתי להכין נפח שווה של 30% (w / v) פתרון PEG. פתרונות דגה ידי sonication לפני השימוש. חנות ב 4 מעלות צלזיוס עד לחודש 1.
- הכן 24% (V / V) N-(3-triethoxysilylpropyl) gluconamide (GLS): להוסיף 480 μl של GLS (50% באתנול - GLS המניות עשוי לדרוש שימוש באמבט מים כדי לחמם ולהמס פתרון אם גבישים) ל 520 μl של 95% (V / V) אתנול ולערבב למשך 20 דקות על ידי sonication. השתמש בפתרון 24% (V / V) כדי להפוך את נפח שווה של 16% (V / V) פתרון GLS. הפוך את פתרונות לשימוש טריים ליום.
- הכן 24% (V / V) methyltrimethoxysilane (MTMS): להוסיף 240 μl של MTMS לμl 760 קיימים acidified DDH 2 O (2.0 pH, 1 N HCl) ולערבב למשך 20 דקות על ידי sonification. השתמש בפתרון 24% (V / V) כדי להפוך את נפח שווה של 16% (V / V) פתרון MTMS. הפוך את פתרונות לשימוש טריים ליום.
- הכן 24% bis [(3-methyldimethoxylsilyl) propyl] (V / V) פוליפרופילן תחמוצת (MDSPPO): 240 דקות להוסיף μl של MDSPPO לμl 760 קיימים acidified DDH 2 O (2.0 pH, 1 N HCl) ותערובת ל20 על ידי sonification. השתמש בפתרון 24% (V / V) כדי להפוך את נפח שווה של 16% (V / V) פתרון MDSPPO. הפוך את פתרונות לשימוש טריים ליום.
- הכן 24% (V / V) 3 - (aminopropyl)-triethoxysilane (APTES): להוסיף 240 μl של APTES לμl 760 הקיים acidified DDH 2 O (2.0 pH, 1 N HCl) ולערבב למשך 20 דקות על ידי sonification. השתמש בפתרון 24% (V / V) כדי להפוך את נפח שווה של 16% (V / V) APTES פתרון. הפוך את פתרונות לשימוש טריים ליום.
- הכן 24% (V / V) אתאן BIS (triethoxysily) (BIS-TEOS): להוסיף 240 μl של BIS-TEOS לμl 760 קיימים acidified DDH 2 O (2.0 pH, 1 N HCl) ולערבב למשך 20 דקות על ידי sonification. השתמש בפתרון 24% (V / V) כדי להפוך את נפח שווה של 16% (V / V) פתרון BIS-TEOS. הפוך את פתרונות לשימוש טריים ליום.
- הכן 24% (V / V) carboxyethylsilanetriol (Si-COOH): להוסיף 960 μl של Si-COOH (25% בDDH 2 O) עד 40 μl הקיים acidified DDH 2 O (2.0 pH, 1 N HCl) ותערובת ל 20 דקות על ידי sonification. השתמש בפתרון 24% (V / V) כדי להפוך את נפח שווה של 16% (V / V) פתרון Si-COOH. הפוך את פתרונות לשימוש טריים ליום.
- בנפרד להכין 3 מ"מ ε N - אצטיל-L-ליזין, D-סורביטול, α-α-trehalose (M r g / mol, g / mol, ו378.33 g / mol, בהתאמה 188.22 182.17) ו -1.5 מ"מ טריטון X-100 (הממוצע M W 625 g / mol) בDDH 2 O. נפחים יכולים להשתנות בהתאם לאופן שנדרש הרבה; להפוך פתרונות מפתיעים לשימוש בכל יום.
- הכן 60% (w / w) גליצרול: להוסיף 2.4 גרם של גליצרול נטול מים ל1.6 גרם של DDH 2 O, על ידי תמהיל מערבולת. דגה פתרוןעל ידי sonication לפני השימוש. חנות ב 4 מעלות צלזיוס עד לחודש 1.
- הכן 30% (w / w) גליצרול: להוסיף 1.6 גרם של גליצרול נטול מים ל2.4 גרם של DDH 2 O, על ידי תמהיל מערבולת. פתרון דגה ידי sonication לפני השימוש. חנות ב 4 מעלות צלזיוס עד לחודש 1.
2. הכנת Sols סיליקה
בעקבות ההליכים המפורטים להלן, את Sols בהתאמה, כאשר כל הזמן על קרח, ניתן להשתמש בו עד שעה 1 לאחר תוספת של מים. Sols משמש מעבר לתוצאת שעה 1 בזמני gelation חומריים / לא עקביים ירד.
- הכנת (SS) מבוסס סול נתרן סיליקט
- לשקול את 120 גרם של שרף חילוף יונים לתוך כוס פלסטיק 500 מ"ל.
- הוסף 150 מ"ל של 0.1 N HCl ומערבבים במשך שעה 1 באמצעות סרגל סערה מגנטי 2 אינץ'.
- סנן את הפתרון באמצעות משפך יכנר מחובר לואקום.
- לאט לאט להוסיף DDH 2 O לשטוף את השרף המסונן עד התסנין המתקבל הוא ברור. זה לוקח כ 100מ"ל של DDH 2 O.
- לאסוף ולאחסן את השרף המוכן במכל פלסטיק בטמפרטורת חדר עד לחודש 1.
- לשקול את 2.59 גרם של נתרן סיליקט (אס, 27% (w / w) 2 SiO, 10% (w / w) NaOH) לתוך כוס פלסטיק 50 מ"ל.
- הוסף 10 מ"ל של DDH 2 O ל-SS. מערבולת בעדינות ביד לערבב את הפתרון.
- לשקול את 5.60 גרם של שרף מוכן לתוך כוס נפרדת 50 מיליליטר פלסטיק. הוסף לפתרון ותמהיל נתרן סיליקט למשך 2 דקות באמצעות סרגל סערה מגנטי אינץ' אחד.
- סנן את פתרון התערובת עם משפך יכנר מחובר לaspirator המחובר לברז מים.
- השתמש במזרק פלסטיק 10 מ"ל מצויד בקרום 0.2 מיקרומטר מסנן כדי לסנן פתרון סול. זה מניב סול עם 5.6% (w / w) סיליקה מכונות SS בטקסט נוסף. שמור סול על קרח כאשר אינו בשימוש.
- ½ SS: להוסיף 1 מ"ל של סול לס"ס מוכן 1 מ"ל של DDH 2 O, על ידי תמהיל מערבולת. שמור סול על קרח כאשר אינו בלהשתמש בו.
- הכנת (DGS) מבוסס סול diglycerylsilane
- לסנתז DGS כפי שתואר במקומות אחרים. 15,16 DGS גבישי חנות בייבוש בטמפרטורת חדר למשך עד 6 חודשים.
- לשקול את בערך 1 גרם של DGS גבישיים.
- השתמש במכתש ועלי לטחון את DGS לאבקה דקה. השלים שלב זה במהירות אפשרית כדי למנוע ספיגת לחות מהאוויר.
- להעביר את DGS הטחון בזהירות לבקבוקון נצנץ 20 מ"ל ריק, להקליט המוני (לאלפית גרם).
- הוסף DDH 2 O להניב 0.5 DGS גרם / מ"ל.
- Sonicate את DGS הידרוליזה על קרח במשך 20 דקות, לערבב על ידי מערבולת לשנייה בכל 5 דקות 5. בימים לחים, פירוק DGS מלא עשוי לדרוש הוספת 10 μl של 1 N HCl. זה יש להוסיף לפתרון לפני sonication.
- השתמש במזרק פלסטיק של 3 מ"ל מצויד בקרום 0.2 מיקרומטר מסנן כדי לסנן פתרון סול, הסרה של חלקיקים קטנים. זה מניב סול עם 5.0% (w / w) סיליקה מכונות DGS בטקסט נוסף. שמור סול על קרח כאשר אינו בשימוש.
- ½ DGS: הוסף 1 מ"ל של DGS סול מוכן ל1 מ"ל של DDH 2 O, על ידי תמהיל מערבולת. שמור סול על קרח כאשר אינו בשימוש.
3. הקרנה טרום לזיהוי חומרים להדפסה
תכנית כללית המציגה את השלבים של ניתוח הגורמים המודרך המשמש לזיהוי חומרים להדפסה השונים מוצגת באיור 1. נפח חומר כולל מינימאלי של 100 μl מומלץ. שימוש בכמויות קטנות יותר עושה חזותית gelation החומר קשה.
- שלב 1: חיץ וsilane
- הוסף 50 μl של חיץ (25 ו -50 מ"מ טריס או HEPES ב-pH 7.0, 7.2, 7.4, 7.6, 7.8, 8.0, 8.2) לבקבוקון נצנץ זכוכית מ"ל 2.
- הוסף 50 μl של סול המתאים (DGS, ½ DGS, אס, ½ SS) ותערובת מערבולת באופנה ובפעמית עבור 10 שניות על ידינע בקבוקון ולכבות את מיקסר המערבולת.
- הגדר חומרים לנוח בטמפרטורת חדר, מעקב הזמן של gelation חומר. זמן gelation מוגדר כנקודה שבה החומר מפסיק לזרום בחופשיות על מסתובב הבקבוקון לזווית של ° 45.
- תכלול שילובי חומר עם זמני gelation פחות מ -2.5 שעות משלבי מיון חומר שלאחר מכן.
- שלב 2: חיץ, silane ופולימר
- בבקבוקון נצנץ זכוכית של 2 מ"ל, להוסיף 3.13 μl של או 16% (w / v) או 8% (w / v) פתרון PVA / PEI או 6.3 μl של 30% (w / v) או 60% (W / V) פתרון PEG.
- הוסף 50 HEPES מ"מ (pH 8.0) כדי להביא את הנפח המשולב ל50 μl, לערבב את הפתרון על ידי מערבולת.
- הוסף 50 μl של סול המתאים (DGS, ½ DGS, אס, ½ SS), בתמהיל האופנה המתוארת בשלב 3.1.2.
- תכלול שילובי חומר עם gelation פעמים (כהגדרתו בצעד 3.1.3) פחות מ -2.5 hr משלבי מיון חומר שלאחר מכן.
- שלב 3: חיץ, silane, הפולימר וorganosilane
- בבקבוקון נצנץ זכוכית של 2 מ"ל, להוסיף 3.13 μl של או 16% (w / v) או 8% (w / v) פתרון PVA או 6.3 μl של 30% (w / v) או 60% (w / v) פתרון PEG.
- הוסף 3.13 μl של 16% (w / v) organosilane (GLS, MTMS, MDSPPO, BIS-TEOS, Si-COOH או APTES).
- הוסף 50 HEPES מ"מ (pH 8.0) כדי להביא את הנפח המשולב ל50 μl, לערבב את הפתרון על ידי מערבולת.
- הוסף 50 μl של סול המתאים (DGS, ½ DGS, אס, ½ SS) ומערבבים באופנה המתוארת בשלב 3.1.2. תכלול שילובי חומר עם gelation פעמים (כהגדרתו בצעד 3.1.3) פחות מ -2.5 hr משלבי מיון חומר שלאחר מכן.
- שלב 4: חיץ, כתוסף silane, פולימר, organosilane ומולקולה קטנה
- בבקבוקון נצנץ זכוכית של 2 מ"ל, להוסיף 2.08 μl של או 24% (w / v) או 12% (w / v) פתרון PVA או 6.3 μl של 30% (w / v) או 60% (w / v) פתרון PEG.
- להוסיף2.08 μl של 24% (w / v) organosilane (GLS, Si-COOH).
- הוסף 2.08 μl של פתרון המולקולה קטנה 3 מ"מ (N ε - אצטיל-L-ליזין, D-סורביטול, α-α-trehalose) או 1.5 מ"מ (טריטון X-100).
- הוסף 50 HEPES מ"מ (pH 8.0) כדי להביא את הנפח המשולב ל50 μl, לערבב את הפתרון על ידי מערבולת.
- הוסף 50 μl של סול המתאים (DGS, ½ DGS, אס, ½ SS) ומערבבים באופנה המתוארת בשלב 3.1.2.
- תכלול שילובי חומר עם gelation פעמים (כהגדרתו בצעד 3.1.3) פחות מ -2.5 hr משלבי הדפסת חומר שלאחר מכן.
4. הכנת חומרי חלבון מסומם להדפסה
את החומרים שזוהו בסוף השלב 3.4.6 מתבצעים קדימה במחקרי printability, עם האנזים המתאים עכשיו להיכלל בסול. בכל המקרים המפורטים להלן תמיסה מימית, המכילה את כל המרכיבים, פרט לsilaneמוכן בmicrowell, ואחריו על ידי התוספת של סול רק לפני ההדפסה. כדי להתאים את השימוש בצלחת 384 microtiter, נפח פתרון כולל של 50 μl משמש במקום 100 μl.
- Acetylcholinesterase (AChE) microarray
- הכן פתרון 2 Ku / מ"ל של כאב ב50 HEPES מ"מ (pH 8.0), בעקבות פעילות האנזים הספציפית הרבה (יחידות של פעילות למ"ג) מידע המסופק על ידי היצרן.
- פתרון מניות אנזים KU / מיליליטר Aliquot 2 ל -5 ברי μl באמצעות צינורות microcentrifuge 500-μl ולאחסן ב -20 ° C. 2 פתרונות מניות לכאוב KU / מ"ל יישארו יציבים לתקופה של עד 4 חודשים, כאשר הם מאוחסנים ב -20 ° C.
- הכן את חומרי בסיס על ידי שילוב של המחצית מהכרכים של פולימרים מתאימים, organosilanes ותוספי מולקולות קטנות שזוהו עד שלב 3.4.6 בצלחת microtiter 384 גם.
- הוסף 5 μl של 2 Ku / מיליליטר כאב ב50 HEPES מ"מ (pH 8.0).
- באמצעות 50 HEPES מ"מ (pH 8.0), להביא את משולבנפח היטב לתערובת μl 25 על ידי pipetting למעלה פתרון ומטה מספר פעמים.
- Multikinase microarray
- 100 פתרונות קינאז ng / μl (p38α, MAPK2, EGFR, GSK-3β) להכין בDDH 2 O בעקבות הפעילות (U / מ"ל או U / מ"ג) וכמות מידע המסופקת על ידי היצרן. פתרונות קינאז לאחסן בaliquots של 2 μl ב -80 ° C.
- הכן קינאז מצעים (MBP, עמ 'ה (4 Y), GSM) בשעה 5 מ"ג / מ"ל, מיקרומטר 50 מ"ג / מ"ל או 300 בDDH 2 O, בעקבות מידע הכמות המסופק על ידי היצרן. חנות מצעים בaliquots של 2.5 μl ב -80 ° C.
- הכן את חומרי בסיס על ידי שילוב של המחצית מהכרכים של פולימרים מתאימים, organosilanes ותוספי מולקולות קטנות שזוהו עד שלב 3.4.6 בצלחת microtiter 384 גם.
- גם כל המכילים את חומרי הבסיס, להוסיף 2.5 קינאז μl ו2 μl של המצע שלו בהתאמה (p38α וMBP, MAPK2 וMBP, EGFR ו-P (E 4 Y), GSK-3β ו-GSM) כפי שהוכנו בשלבי 4.2.1 ו4.2.2, בהתאמה.
- באמצעות 50 HEPES מ"מ (pH 7.4), להביא את הנפח גם בשילוב ל25 μl. מערבבים על ידי pipetting.
5. גיבוש microarray
סעיף זה מסביר את הנוהל מפורט להדפסת חומרים על משטח שקופית אחת. להדפסה על משטחים שונות שקופיות מרובות (אמין, אפוקסי, אלדהיד וPMMA), הליך זה חוזר על עצמו 4 פעמים.
- טופס microarrays באמצעות רובוט סיכת הדפסת מגע מצויד בשלב XYZ. השתמש בסיכות נדן מחוררות בקוטר 100 מיקרומטר להפקיד את Sols חלבון המסומם.
- הגדר לחות בתוך חדר ההדפסה כדי 80-90%. לחות <80% עלולים לגרום לאידוי מדגם וחוסר עקביות בהדפסה, זאת בשל ההיקפים הקטנים בתצהיר.
- Sonicate סיכות בDDH 2 O למשך 15 דקות לפני ההדפסה ויבשות תחת זרם של חנקן. השתמש בצינור cleaneR כדי להסיר שאריות לחות מבפנים בעל הסיכה ולמקם את הסיכה בזהירות בראש ההדפסה. אי להסיר שאריות לחות עלולים לעכב את הסיכה מלנוע בחופשיות עם בעל, וכתוצאה מכתמים שלא נענו.
- דפוסי מערך שליטה באמצעות תכנית Pro סופר צ'יפ (קואליציית נשים לשלום). עבור כל דגימה היטב בתוך צלחת מקור 384 היטב, 200 נקודות (מספר המרבי של נקודות לספיגה באמצעות סיכת נדן SMP3) מודפסות על גבי משטח-שונה שקופית זכוכית.
- להתחיל את תהליך ההדפסה באמצעות תוכנה. סט נסיעות בכיוון XY עד 10 מדגם מהירות גישה (כיוון Z) עד 2 מ"מ / s עם 2.5 שניות זמן טעינת מדגם מ"מ / s ו.
- להשהות את הריצה דרך קואליציית נשים לשלום. מנמיכים את הסיכה לתוך המדגם ולהוסיף 25 μl של סול, בהתאמה (DGS, ½ DGS, אס, ½ SS) להיטב על ידי פיפטה. מערבבים את הפתרון באמצעות תנועת pipetting מעלה ומטה חזר 50x. כאשר ערבוב על ידי pipetting, למזער את כמות האוויר שולבה בפתרון. אוויר preven בועותלא להשלים את הטעינה של מדגם בסיכה.
- להתחיל את תהליך ההדפסה דרך קואליציית נשים לשלום, ולהדפיס את המדגם על שקופית משטח אחד. להשהות את תהליך ההדפסה לפני טעינת מדגם מצלחת המקור שלאחר מכן כן.
- הסר את סיכת ההדפסה באמצעות מגנט ולמקם את מנקה מקטרת בראש ההדפסה כדי למנוע הצטברות לחות בראש ההדפסה.
- יש לשטוף את סיכת ההדפסה עם DDH 2 O, וsonicate בנקי DDH 2 O למשך 30 שניות.
- ייבש את סיכת הדפוס תחת זרם של חנקן ולהסיר את המנקה המקטרת, הצבת הסיכה בחזרה לראש ההדפסה.
- הדפסה להתחיל על ידי ביצוע שלבים 5.6-5.10, לכל הדגימות שנותרו בצלחת המקור. עד 12,000 נקודות בקוטר 100 מיקרומטר ניתן להפקיד לשקופית בודדת.
- שיטה זו גם יכולה להיות מיושמת על חומרי הדפסה על גבי תחתית הבארות בתוך 96 microplate היטב. בעקבות קובץ כיול קואליציית נשים לשלום, לכייל מחדש את סיכת ההדפסה כדי להבטיח את distance נסע בין נקודה בתצהיר הוא מעל הגובה של צלחת microwell. זה מאפשר לך להדפיס באופן עקבי הסיכה מבארת לבאר באופן ליניארי מבלי לפגוע בסיכה.
- גיל המערך למינימום של 30 דקות ועד 24 שעות בתוך חדר הדפוס בלחות 80-90% בעקבות השלמת ניסוי ההדפסה כולו.
6. Assay פעילות acetylcholinesterase
- הכנה חיובית בקרה (מחשב) דגימות
- הכן 1 יודיד acetylthiocholine מ"מ (atch: M r 289.18 g / mol) בגליצרול 4%, 25 מ"מ טריס (pH 7.0) בצינור microcentrifuge 1.5 מ"ל. Atch צריך להיות מוכן טרי לפני כל שימוש ושימוש במאגר ב7.0 pH כחוצצי pH גבוהים יותר לגרום לautohydrolysis המהיר, לייצר תוצאות חיוביות שגויות. יכול להיות מגוון הנפח הסופי בהתאם למספר הדגימות (25 μl לדגימה).
- הוסף 0.14 μl של 5 מ"מ bodipy-FL-L-ציסטין ל25 μl של 1 מ"מ atch בבאר של PLA 384 microtiterטה.
- הוסף 24.86 גליצרול 4% μl, 25 מ"מ טריס (pH 7.0), מערבב על ידי pipetting בזהירות כדי למנוע היווצרות בועה בפתרון. מעכבי אנזים פוטנציאליים ניתן לשלב את פתרון המחשב לפני שהביא את עוצמת הקול עד 50 μl עם חיץ.
- הכנה שלילית בקרה (NC) דוגמאות
- הוסף μl 0.14 של 5 מ"מ bodipy-FL-L-ציסטין ל49.86 μl של גליצרול 4%, 25 מ"מ טריס (pH 6.5) בבאר של צלחת 384 microtiter. מערבבים על ידי pipetting.
- Overprinting מחשב ופתרונות NC
- חותמת microarrays את גיל ביצוע השלבים 5.1-5.10 (תוך התעלמות שלב 5.6) של הפרוטוקול. השתמש בסיכות נדן מחוררות בקוטר 235 מיקרומטר להפקיד את המחשב ופתרונות overprinting צפון קרוליינה. זה מבטיח את הפתרון מכסה את המקום שהופקד בעבר לחלוטין.
- מערכים בגיל 80-90% לחות לשעה 1 בטמפרטורת חדר. בשל autohydrolysis של atch, פעמים דגירה ארוכות יותר עלולות לגרום לתוצאות חיוביות שגויות או גדלו enתסס פעילות.
7. Assay פעילות קינאז
- הכן 500 מיקרומטר 5'-טריפוספט פתרון (ATP) באמצעות מניית ATP אדנוזין (100 מ"מ) מאוחסן ב -20 ° C. הפוך פתרון טרי עבור כל ניסוי ולהתאים את עוצמת קול לצורך ניסוי: כל פתרון הדפסה דורש 5 μl.
- הכן מגנזיום כלוריד 100 מ"מ (MgCl 2: M r 95.21 g / mol) פתרון המניות בDDH 2 O.
- ביקורת חיובית (PC)
- הוסף 2.5 μl של 100 מ"מ MgCl 2 ו -5 500 מיקרומטר μl-ATP להיטב של צלחת 384 microtiter.
- תביא את הנפח הכולל גם ל50 μl עם 50 HEPES מ"מ (pH 7.4), מערבב על ידי pipetting. מעכבי אנזים פוטנציאליים ניתן לשלב את פתרון המחשב לפני שהביא את עוצמת הקול עד 50 μl עם חיץ.
- ביקורת שלילית (NC)
- הוסף 2.5 μl של 100 מ"מ MgCl 2 ו -5 DDH 2 O μl לטוב של 384 מ 'icrotiter צלחת.
- תביא את הנפח הכולל גם ל50 μl עם 50 HEPES מ"מ (pH 7.4) ומערבב על ידי pipetting.
- מחשב Overprinting וcofactors assay NC
- בצע את שלב 6.3.1 של הפרוטוקול.
- מערכי גיל בלחות 80-90% עבור שעה 2 בטמפרטורת חדר.
- מכתים שקופית
- microarray המודפסת המקום מחליקה בנפרד בצלחת פטרי עם מספיק צבע (מערכה) כדי לכסות את כל השקופית. Shake בינוני (~ 200 סל"ד) במשך 45 דקות באמצעות ייקרה צלחת.
- הסר את השקופית באמצעות מלקחיים ומקום לתוך צלחת פטרי עם נקי לשטוף חיץ (מערכה). Shake בינוני (~ 200 סל"ד) במשך 45 דקות באמצעות ייקרה צלחת.
- הסר את השקופית באמצעות מלקחיים וספין יבש באמצעות microcentrifuge microarray שולחן עבודה קונבנציונלי מצוידים בבעל שקופית.
8. Microarray הדמיה וניתוח
- הדמיה
שים לב ששיטת ההדמיה תהיה שלpecific לסוג של קורא מערך זמין. למחקרים אלה, Innotech NovaRay imager אלפא עם מערכת זיהוי CCD מקור אור לבן ומצויד ב478 ± 17 ננומטר עירור ו538 ± 21 ננומטר פליטה לסנן עבור microarrays לכאוב, ו530 ± 40 ננומטר עירור ופליטת 614 ± 62 ננומטר לסנן שימש microarrays קינאז. מערכות סריקת לייזר Confocal יכולה לשמש גם לקריאה למערכים, אם כי ההגדרות תהיה ספציפיות למכשיר.
- הנח שקופית לתוך מחזיק השקופיות עם הכתמים פונים כלפי מעלה.
- הגדר את מספר הסעיפים מקדימות (מינימום של 2 מומלץ, אחד בכל צד של שקופיות מיקרוסקופ), רזולוציה (מינימום של 4 מיקרומטר מומלץ) וחשיפה (אוטומטי מומלץ) בתוך תוכנת ההדמיה.
- לרכוש שקופית תמונה ולשמור כקובץ ". TIFF".
- אנליזה
- פתח תמונת שקופית שנרכשה בImageJ64.
- לחץ על כלי הבחירה הסגלגל ולמדודעוצמת אות של כל מקום באמצעות האפשרות למדוד תחת הלשונית לנתח. בעת בחירת האזור למדידה, בחר אזור מעט גדול יותר ממקום שנצפה ושל גודל עקבי בין כתמים לצמצום הסובייקטיביות ImageJ.
- ממוצע עוצמת 25 נקודות ממחשב דומות, מחולקות בעצמה הממוצעת של 25 נקודות דומות NC להשיג יחסי PC / NC לקומפוזיציות החומר הבודדים.
תוצאות
על ידי ביצוע ניתוח גורמים מודרך למסך חומר, היינו יכול לצמצם את מספר החומרים שנבדקו מ~ 20,000 לכמה מאה שהיו פעמים gelation מתאימות להדפסה. על ידי יישום קפדני זמן הנחיה הדורש חומר gelation של 2.5 שעות או יותר, חומרים העשויים להדביק את סיכות הדפסה או לייצר מערכי irreproducible מעולם לא הודפסו. את החומרים להדפסה זיהו שיש (> 2.5 שעות) פעמים gelation מספיק היו מודפסים על גבי משטחי זכוכית שקופית 4 פונקציונליות שונים. כדי להיחשב "להדפסה", מספר המקסימאלי של נקודות בהיקף ספיגה של הסיכה היה צריך להיות מודפס (SMP3 = 200). כתמים נבדקו גם למורפולוגיה נקודה כדי להבטיח שאין הפרדת פאזות פיצוח או לא רצויה שהתרחשה באמצעות מיקרוסקופ brightfield פשוט כפי שמוצג באיור 2.
מהשלב הזה של חומרים להדפסה שזוהו, microarrays יוצרו עם כאב וקינאזות שולבה המרכיב המימית שנאגרו. חומרים שהיו בקנה אחד עם נוהל assay (כולל overprinting פוטנציאל ושטיפה או צביעת מדרגות) זוהו על ידי התבוננות שימור של כתמי microarray (לא נסדק, אובדן של כתמים או דפוסי הקרינה חריגים) ושליטה חיובית (PC) לביקורת שלילית (NC ) יחס גדול מ -1 כפי שנצפה דרך תמונה. כפי שזה היה בערך 50% מהחומרים, יחס מחשב / NC גדול יותר של 3 שימש להגדרת חומרים אופטימליים עם שמירה של פעילות חלבון. באמצעות שיטה זו, 26 חומרי סול ג נגזרות המכילים חומרים המכילים 2 כאב וקינאזות עומדת בקריטריונים> 3 PC / NC. איור 3 ואיור 4 מראים פירוט גרפי של 5 שלבים מהותי המסך המודרכים לזיהוי של כאב וקינאז אופטימליים microarrays, בהתאמה.
יכולים להיות גם תוקף את מבחני באמצעות הדור של הציון 'זי. 17 זה נעשה שימוש בחומר שהופק יחס המחשב / NC הגבוה ביותר. איור 5 מראה העלילה "Z מתקבלת על ידי השוואת האותות שנוצרו מ200 נקודות, 100 ומחשב 100 NC לאחר overprinting צבע המחוון והמצע על המערך לכאוב. את הכאב ואת מערכי קינאז הביאו את ציוני ההתאמה "Z של 0.60 ו 0.67, מעידים על assay מצוין. עם זאת, יש לציין כי לפני אימות assay, ריכוזי אנזים, צבע, מצע וcofactor על מערך היינו צריכים להיות מותאמים על ידי overprinting טווח הריכוזים של כל רכיב ובחירה בריכוז שהפיק את האות הגבוה ביותר, כפי שתוארו בפירוט במקום אחר 5.
כדי לאמת את מבחני, נתונים כמותיים עיכוב התקבלו באמצעות מעכבי כאב ידועים ובלתי ידועים, עם תוצאות שבוצעו בשני עותקים, ומשמשות לייצור מגרשים כפולים (איור 6 א) ועיקולים עיכוב (האיורים 6B ו6C). <כתמים> חזקים היו overprinted הראשון עם תערובות של מעכבי מולקולות קטנות פעילים ביולוגי הידועים לאחר מכן עם צבע ומצע, ותערובות המכילות גם בקרת מעכבים ידועים או לא מעכב נכללו. מגרשים כפולים נוצרו כדי להעריך את פעילות אנזים, וכל תערובות שתסתיימנה בפחות מ -25% בפעילות אנזים נחשבו חיובית לעיכוב. תרכובות בודדות מתערובות כאלה אז נבדקו בשני עותקים לזהות מולקולה הקטנה (ים) הספציפית אחראית לעיכוב. לאחר שזוהה, מולקולות קטנות אלה משמשים ליצירת עקומות עיכוב כמותיים כדי לקבוע IC 50 ערכים וקבועים עיכוב.
תוצאות איכותיות דומות התקבלו באמצעות מערך multikinase עם מעכבי קינאז משותפים, staurosporine. איור 7 א ו -7 להראות את תמונת microarray ומצביעים על כך שעוצמות האות לאחר overprinting ומכתים את multikinaseמערך הוא כצפוי לביקורת שלילית (- ATP), בקרה חיובית (+ ATP) ומעכב ידוע (+ + INH-ATP). כדי להדגים את היכולת לקבל נתונים כמותיים עיכוב מmicroarrays, assay עיכוב תלוי ריכוז נעשה לקינאז אחת. כפי שניתן לראות בתרשימים ו8A 8B, עוצמת אות יורדת עם עלייה בריכוז מעכב, ואת התגובה להלן עקומה תלוית הריכוז הצפוי עיכוב למערכת קינאז / מצע p38α/MBP.
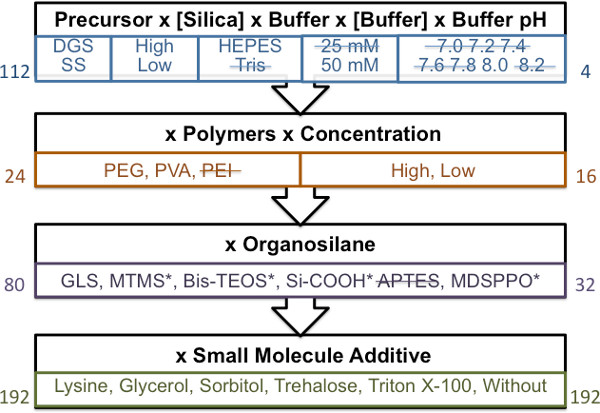
איור 1. סכמטי כללי לגישת הקרנת חומרים מודרכת. כל בלוק, מהווה צעד של המסך בסדר רציף. מספרים בצד השמאל מייצגים את המספר הכולל של חומרים שהוכנו לצורך הניתוח. שימוש בזמן gelation יותר מ -2.5 שעות (חומרים בעלי פעמים gelation פחות מ -2.5 שעות arדואר מצויינים על ידי הקו החוצה), מספר החומרים שעברו כל אחד משלבים ומועברים בזמן מסך חומר מסומן במספר בצד ימין. * מייצג חומרים עם פחות מהפרדת פאזות אופטימלית.

איור 2. תמונות אופטיות המראות מצבי כשל שונים של חומרים בצעד printability של המסך. תמונה של חומר "טוב" (שורה שנייה, עמודה שלישית) היא גם הראתה להשוואה. התפרסם באישור התייחסות 8, האגודה אמריקנית לכימית זכויות יוצרים 2013.
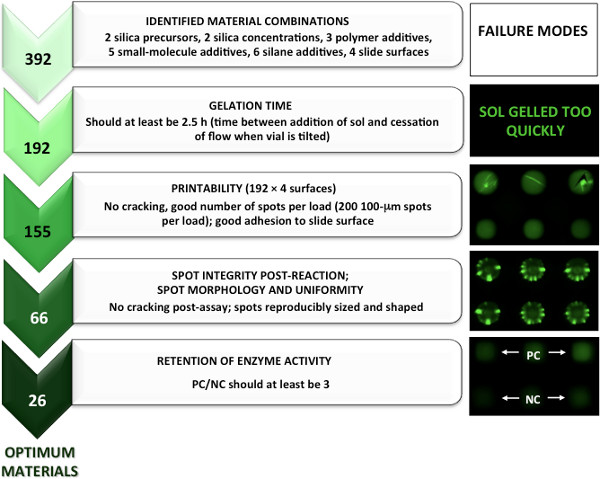
איור 3. גישה מכוונת לזיהוי חומרי הקרנה של חומרים אופטימליים לבודת סול ג הנגזרות microarrays לכאוב. הודפס מחדש בסלסולission מהתייחסות 5, האגודה אמריקנית לכימית זכויות יוצרים 2013.

איור 4. גישה מכוונת חומרי סינון לזיהוי של חומרים אופטימליים לבודת microarrays קינאז סול ג הנגזרות. התפרסם באישור התייחסות 8, האגודה אמריקנית לכימית זכויות יוצרים 2013.
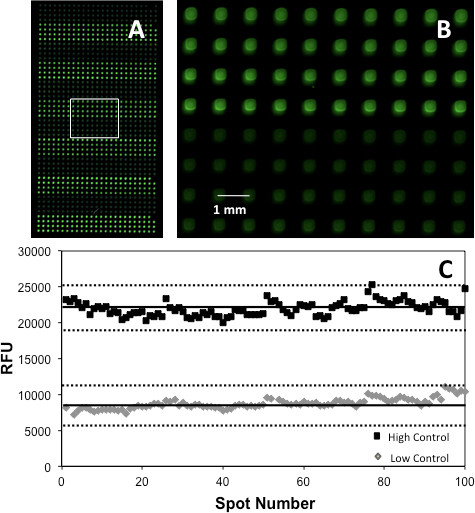
איור 5. (א) קטע של microarray AChE מראה HC (ירוק בהיר) וLC (אור ירוק) נקודות (צבעים שחורים, ירוקים יושמו כpseudocolor לבהירות של מצגת), (ב) תצוגה מוגדלת של האזור התאגרף כדי להדגיש נקודה מורפולוגיה ויישור; ו. (ג) העלילה "Z קווים מלאים מצביעים על הממוצע של משכפל, בעוד קווים מקווקווים מתאים ל3SD. התפרסם באישור התייחסות 5, האגודה אמריקנית לכימית זכויות יוצרים 2013.
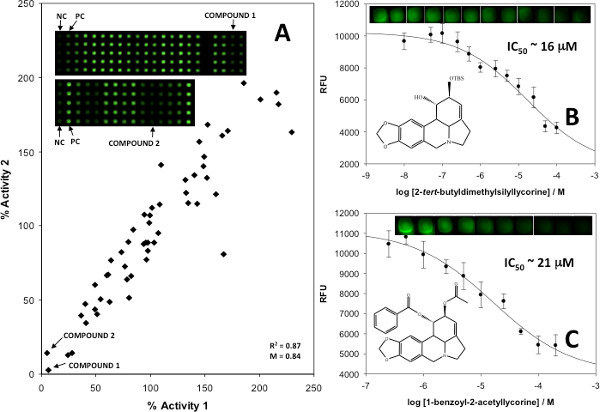
איור 6. () שכפל מגרש להקרנה על מערך של אנלוגים סינטטיים של אלקלואידים Amaryllidaceae, (ב) IC 50 מגרשים של מעכבים פוטנציאליים שזוהו סומנו כתרכובות 1 ו (ג) במתחם 2, עם טווח טעות מייצג סטיית תקן אחת של הממוצע בין 25 משכפל. כתמי נציג מוצגים כדי להמחיש הבדלים באות פרופורציונלית לריכוזים מעכבים. התפרסם באישור התייחסות 5, האגודה כימי זכויות יוצרים 2013 אמריקנית. לחץ כאן לצפייה בדמות גדולה.
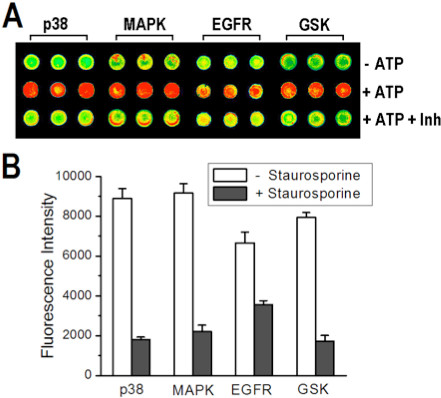
איור 7. assay על מערך של ארבע קינאזות באמצעות 1.4SS/1.0PVA למלכוד ומודפס על גבי שקופית אמין-derivatized. () תמונה של קטע מmicroarray בי כתמים עם קינאז במשותף ממולכד עם מצעים שלהם היו overprinted עם חיץ (צפון קרוליינה, בשורה העליונה), או פתרונות המכילים ATP (מחשב, בשורה האמצעית) או ה-ATP + staurosporine (בשורה תחתונה). (ב) גרפים בר השוואת עוצמות אות בין עכבות ותגובות חסרות מעצורים, לאחר הפחתה של אותות רקע וברים שגיאה מייצגים סטיית תקן אחת מהממוצע מ 25 חזרות. התפרסם באישור התייחסות 8, האגודה אמריקנית לכימית זכויות יוצרים 2013.
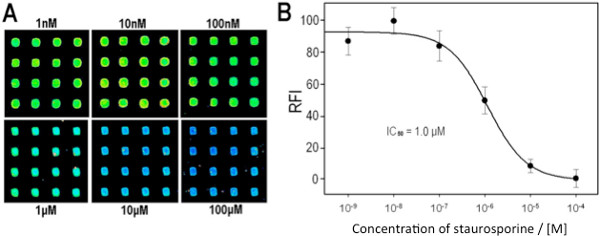
איור 8. Inhibiti. על assay על microarray p38a/MBP (א) סעיפים של microarrays מראה כתמים יציגים overspotted עם ריכוזים שונים של staurosporine, כפי שצוינו (את התמונות התקבלו על ידי סריקה בודדת של אותה השקופית; תמונה מורכבת מוצגת לבהירות). (ב) עקומת IC 50 נוצרה מתמונות המערך נותחו. העצמה השיגה ב 100 מ"מ מפחיתים את כל התמונות, את כל העוצמות האחרות היו מנורמלות על ידי קביעת עוצמת הושגה ב10 ננומטר לערך של 100% פעילות. התפרסם באישור התייחסות 8, האגודה אמריקנית לכימית זכויות יוצרים 2013.
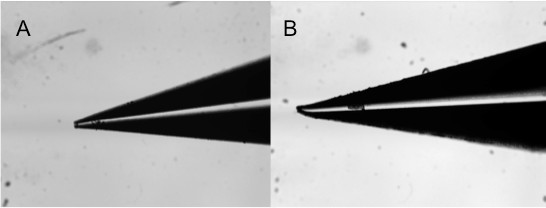
איור 9. תמונות של סיכת התגנבות מיקרוסקופית המשמשת למגע סיכת הדפסה מראה פגמים שונים: (א) סתום, (ב) מקופלות.
Discussion
המתודולוגיה שתוארה כאן נבחרה כמתאים ביותר לזיהוי חומרים הנגזרים סול ג'ל להדפסה עם מדפסת קשר, בהפקה בזמן והליך יעיל וחסכוני לזיהוי חומרים במהירות אופטימלי מבלי לסנן כמויות גדולות של חומרים. מתוך סך של 20,000 ~ חומרים פוטנציאליים, ניתן היה לזהות ~ 200 חומרים שהיו מתאימים להדפסה על בסיס זמן gelation לבד. זו צמצמה באופן משמעותי את מספר החומרים הדרושים כדי להיות מוכנים לניסויי הדפסה שלאחר מכן. אלה חומרים להדפסה ואז היו מודפסים על גבי משטחי 4 שקופיות עבור סכום כולל של 768 חומר שקופיות שילובים. בממוצע, ניתן להדפיס 50 נקודות / משכפל של חומר אחד ב~ 3 דקות, כולל טעינת מדגם, נקודת תצהיר וניקוי סיכה. מבין אלו, 155 חומרים, או בערך 20%, אפשרו להדפסת המספר המקסימאלי של נקודות בספיגת פתרון והופקו גדלי ספוט לשחזור. יצוין, כי מ4 SLמשטחי IDE נבדקו, החומרים מודפסים טובים יותר לפי הסדר: אמין> אפוקסי> אלדהיד> PMMA; שקופיות PMMA לא לייצר מערכים שימושיים עבור כל חומרים. זה סביר לייחס לקוטביות של משטח הציפוי. השוואה בין משטחי השקופיות האמורים, אמין ואפוקסי הקוטבי יותר היו מתאימים יותר לSols מימיים בהשוואה לשקופיות PMMA. יתר על כן, מהמשטחים שנבדקו, את השקופיות המצופים האמינות מספקות משטח טעון חיובי פוטנציאל להופקד anionic סול לאג"ח. אנחנו חושדים, סיליקה חלקיקים בממשק שבין השקופיות וסול אינטראקציה על פני השטח. גם אפוקסי ומשטחי שקופיות אלדהיד חסרים את אותה האינטראקציה מבוססת עלות ראשונית. על מנת להבטיח מקום אופטימלי תצהיר זה מאוד מומלץ להשתמש בשקופיות מראש מצופים מן ספק כגון Arrayit. ציפוי בבית מייצר משטחים לא עקביים שיובילו לשחזור מקום עני ו13, במקרים מסוימים, עלול להוביל לכימות problems 18. חשיבות שווה, טמפרטורה ולחות ישפיעו "printability" של החומרים. אמנם אין מחקרים מפורטים על התופעות הקשורות לטמפרטורה בוצעו, הדפסה תמיד בוצעה בטמפרטורת חדר (23 ± 3 מעלות צלזיוס). לחות (יותר מ 80%) הייתה גם שלט בתוך חדר ההדפסה כדי למנוע סדיר צורת תצהיר בשל כרכי תצהיר קטנים (0.7-2.3 NL) ואידוי.
בעוד מסך החומר לכוון זיהוי חומרים הנגזרים סול ג אופטימליים במיוחד עבור הדפסה של כאב וקינאזות, קבוצה קטנה של חומרים שאותרו עבדה עבור שני הסוגים של חלבונים. ואכן, גם מהחומרים שזוהו לקינאז microarray ייצור היו מבוסס על הס"ס + + PVA גליצרול, ושני החומרים גם זוהו בתוך 26 החומרים שנבחרו לmicroarrays לכאוב. חומרים אלה "אופטימליים" עשויים להציע נקודת התחלה לפיתוח גנרי prote נוסףmicroarrays במסוממת סול ג מבוסס, והמסכים קטנים התרכזו סביב יצירות אלה עשויות לזהות חומרים טובים עוד יותר לייצור microarray. נקודה שנייה שיש לשים לב לחשיבותו של האנזים בשימוש. במקרה של כאב (אנזים ולא חזק), 26 (או בערך 40%) של 66 חומרים המקוריים שזוהו כassay תואם נשמרים הפעילות של כאב לכוד. עם זאת, לקינאזות העדינה יותר, רק 2 מתוך 69 יצירות assay התואמים, או בערך 3% מהחומרים, הצליחו לשמר את הפעילות של כל קינאזות. אמנם בכמות מספקת של אנזימים שונים לא נחקרה להצהיר הצהרות חד משמעיות, נראה כי מערך ייצור אופטימיזציה עם אנזימים יציבים יחסית יכול להוביל לזיהוי של חומרים שיכולים ללכוד מגוון רחב של חלבונים כדי לאפשר mutliplexed microarray הייצור.
עצמאי של החלבון שנבחר, גורם החתך הגדול לזיהוי חומרים להדפסה היה הצורך בזמן רבפעמים gelation מהותיים (> 2.5 שעות). בעת פיתוח חומרים מבוססי SS סול ג'ל, שזה מאוד חשוב על מנת להבטיח כי לאחר חילוף יונים וסינון, סול הוא על ה-pH 4 ב. Sols עם pH ראשוני נמוך עלול לגרום לחומרים עם חומציות נמוכה מניטראלית, אשר יכול להשפיע על פעילות אנזים. 19 התאמת כמות Dowex (שרף חילוף יונים) לאס יכול לשנות את ה-pH הסופי של סול. כאשר קבוצה חדשה של השרף מוכנה היחס של שרף לאס צריך להיות מותאם כדי לייצר Sols בערך pH 4 ביצוע ההליך בסעיף 2 לפרוטוקול.
בדומה לכך, הכנת DGS גבישים היא לעתים קרובות מקור השגיאה הקשור לכשל מהותי בעת השימוש בDGS Sols מבוסס למלכודת biomolecule. למרות שלא דווח כאן בהרחבה, בזהירות רבה צריכה להילקח בסינתזה של DGS גבישיים, בפרט בצורך למנוע את נוכחותם של מים במהלך הסינתזה, אשר יכול לייצר סיליקה polyglyceratedTES ולא DGS monomeric. כמו כן, בשל אופי hygroscopic של DGS, מדגם גבישים צריך להיות מאוחסנת מיובש ומשמש בתוך 6 חודשים לאחר סינתזה. DGS הקריסטל ישן יותר מ -6 חודשים לא יכול להתמוסס באופן מלא (הודות לחומרי סיליקט polyglyceryl חלקית מרוכז) אפילו עם sonication בסביבת חומצית. פירוק DGS שלם מייצר Sols עם תוכן בלתי ידוע ובלתי נשלט סיליקה וכך, חומרים פחות חזקים.
נקודה חשובה לציין מגע עם הדפסה היא באיכות של הסיכות. סיכות ניזוקו או לרעה (איור 9) אף פעם לא תהיה לייצר מערכי שחזור עצמאיים של החומר המודפס. מומלץ לבדוק את איכות סיכה באמצעות מיקרוסקופ לנתיחה על מנת להבטיח פינים שבורים או סתומים לא נמצאים בשימוש. טיפול זהיר מבטיח חיים ארוכים לסיכות. תנועה החופשית של הפינים היא גם חשובה. במקרים בהם לחות היא לכוד בתוך ראש ההדפסה בין הראש והסיכה, הסיכהלא מושב כהלכה ולכן לא יעשה את הקשר נכון עם פני השטח, וכתוצאה מכך חוסר בתצהיר של חומר.
לסיכום, אנו מספקים גישת הקרנה מפורטת, רב שלבי לפיתוח microarrays חלבון עם צפיפות גבוהה מסוממת סיכה מודפסת. ההקרנה כרוכה באופטימיזציה של תכונות חומר (זמן וprintability gelation) כדי לאפשר הדפסה של חומרים, ואחריו הקרנה ממוקדת יותר לזהות חומרים התואמים את assay נתון והצליח לשמור על פעילות אנזים. גישת הקרנת חומר מודרך זה יכול להיות מיושם על פורמטי microarray נוספים כדי להפחית את הזמן והעלות הכרוך בהפקת microarrays צפיפות גבוהה יעילה.
Disclosures
יש לנו מה למסור.
Acknowledgements
המחברים מודים מריה Monton, ג'ולי Lebert, Jessamyn ליטל, שין גה ולורה Lautens לסיוע בפיתוח של microarrays החלבון. המחברים גם להודות למדעי הטבע והנדסת מועצת המחקר של קנדה (NSERC) למימון עבודה זו. המחברים גם להודות לקרן קנדה עבור חדשנות ואמון חדשנות אונטריו לתמיכה של עבודה זו. JDB מחזיק קתדרה למחקר בקנדה ובכימית Bioanalytical BioInterfaces.
Materials
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Poly(vinyl alcohol) (PVA) | Sigma-Alderich | 360627 | 80% hydrolozyed, Mw 600 |
| Polyethylene glycol 600 (PEG) | Sigma-Alderich | 87333 | |
| Polyethylenimine (PEI) | Sigma-Alderich | 482595 | 50 wt% solution in water |
| Carboxyethylsilanetriol (Si-COOH) | Gelest, Inc. | SIC2263.0 | 25% in water |
| N-(3-triethoxysilylpropyl) gluconamide(GLS) | Gelest, Inc. | SIT8189.0 | 50% in ethanol |
| bis[(3-methyldimethoxysilyl)propyl]polypropylene oxide (MDSPPO) | Gelest, Inc. | SIB1660.0 | |
| Methyltrimethoxysilane (MTMS) | Gelest, Inc. | SIM6560.1 | |
| Bis(triethoxysiyly)ethane (Bis-TEOS) | Gelest, Inc. | SIB1817.0 | |
| 3-Aminopropyltriethoxysilane (APTES) | Gelest, Inc. | SIA0610.0 | |
| Glycerol | Sigma-Alderich | 49767 | |
| D-Sorbitol | Sigma-Alderich | 240850 | |
| D-(+)-Trehalose dihydrate | Sigma-Alderich | T9531 | |
| Triton X-100 | Sigma-Alderich | X-100 | |
| Nε-Acetyl-L-lysine | Sigma-Alderich | A4021 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Alderich | 154563 | |
| HEPES | Sigma-Alderich | H3375 | |
| Sodium hydroxide, 1.0 N | LabChem Inc. | LC24350-2 | |
| Hydrochloric Acid, 1.0 N/0.1 N | LabChem Inc. | LC15300-2/LC152220-2 | |
| Magnesium chloride | Sigma-Alderich | M8266 | |
| Diglycerolsilane (DGS) | Prepared in laboratory | ||
| Sodium silicate solution | Fisher Scientific | SS338-1 | |
| Dowex 50WX8-100 ion exchance resin | Sigma-Alderich | 217492 | |
| Acetylthiocholine iodide | Sigma-Alderich | 1480 | |
| Acetylcholinesterase from Electrophorus electricus (electric eel) | Sigma-Alderich | C2888 | |
| BODIPY FL L-Cystine | Invitrogen | B-20340 | |
| Pro-Q Diamond Phosphoprotein/Phosphopeptide Microarray Stain Kit | Invitrogen | P33706 | |
| Adenosine 5'triphosphate disodium salt (ATP) solution | Sigma-Alderich | A6559 | |
| MAP Kinase 2 (MAPK2) | EMD Millipore | 454850 | |
| p38α/SAPK2a (T106M), active | EMD Millipore | 14-687M | |
| Epidermal growth factor (EGFR) | EMD Millipore | Donated by Millipore | |
| Glycogen synthase kinase 3β (GSK-3β) | EMD Millipore | 14-306 | |
| Myelin basic protein (MBP) | EMD Millipore | Substrate for MAPK2 and p38α, Donated by Millipore | |
| GSM | EMD Millipore | 12-533 | Substrate for GSK-3β |
| Poly-glu-tyr polypeptide p(E4Y) | EMD Millipore | 12-440 | Substrate for EGFR |
| Stealth pin | ArrayIt | SMP3 | |
| Stealth pin | ArrayIt | SMP7 | |
| Amine coated slides | ArrayIt | SMM2 | |
| Aldehyde coated slides | ArrayIt | SMA2 | |
| Exposy coated slides | ArrayIt | SME2 | |
| Poly(methylmethacrylate) (PMMA) coated slides | Exakt Technologies Inc. | 41500 | |
| 0.2-μm syringe filter | PALL Life Sciences | 4612 | |
| Equipment | |||
| Virtek Contact Printer | BioRad | ||
| Novaray Fluorescence Slide Imager | Alpha Innotech Corporation | ||
| Desktop microarray centrifuge | ArrayIt | MHC110V | |
| MilliQ Synthesis A10 | Millipore | Used to filter all water required for experiments |
References
- Schena, M. M., Shalon, D. D., Davis, R. W. R., Brown, P. O. P. Quantitative monitoring of gene expression patterns with a complementary DNA microarray. Science (New York, N.Y.). 270 (5235), 467-470 (1995).
- MacBeath, G., Schreiber, S. L. Printing proteins as microarrays for high-throughput function determination. Science (New York, N.Y.). 289 (5485), 1760-1763 (2000).
- Zhu, H. H., Bilgin, M. M., et al. Global analysis of protein activities using proteome chips. Science (New York, N.Y.). 293 (5537), 2101-2105 (2001).
- Hook, A. L., Chang, C. -. Y., et al. Combinatorial discovery of polymers resistant to bacterial attachment. Nature Biotechnology. , (2012).
- Monton, M. R. N., Lebert, J. M., Little, J. R. L., Nair, J. J., McNulty, J., Brennan, J. D. A Sol-Gel-Derived Acetylcholinesterase Microarray for Nanovolume Small-Molecule Screening. Analytical Chemistry. 82 (22), 9365-9373 (2010).
- Cho, E. J., Tao, Z., Tehan, E. C., Bright, F. V. Multianalyte pin-printed biosensor arrays based on protein-doped xerogels. Analytical Chemistry. 74 (24), 6177-6184 (2002).
- Cho, E. J., Tao, Z., et al. Tools to Rapidly Produce and Screen Biodegradable Polymer and Sol-Gel-Derived Xerogel Formulations. Applied Spectroscopy. Society for Applied Spectroscopy. 56 (11), 1385-1389 (2002).
- Ge, X., Lebert, J. M., Monton, M. R. N., Lautens, L. L., Brennan, J. D. Materials Screening for Sol-Gel-Derived High-Density Multi-Kinase Microarrays. Chemistry of Materials. 23 (16), 3685-3691 (2011).
- Rupcich, N., Green, J. R. A., Brennan, J. D. Nanovolume Kinase Inhibition Assay Using a Sol-Gel-Derived Multicomponent Microarray. Analytical Chemistry. 77 (24), 8013-8019 (2005).
- Rupcich, N. Coupled enzyme reaction microarrays based on pin-printing of sol-gel derived biomaterials. Analytica Chimica Acta. 500 (1-2), 3-12 (2003).
- MacBeath, G. G., Schreiber, S. L. S. Printing proteins as microarrays for high-throughput function determination. Science (New York, N.Y.). 289 (5485), 1760-1763 (2000).
- Stillman, B. A. B., Tonkinson, J. L. J. FAST slides: a novel surface for microarrays. BioTechniques. 29 (3), 630-635 (2000).
- Rupcich, N., Goldstein, A., Brennan, J. D. Optimization of sol-gel formulations and surface treatments for the development of pin-printed protein microarrays. Chemistry of Materials. 15 (9), 1803-1811 (2003).
- Gill, I., Ballesteros, A. Encapsulation of biologicals within silicate, siloxane, and hybrid sol-gel polymers: An efficient and generic approach. Journal of the American Chemical Society. 120 (34), 8587-8598 (1998).
- Brook, M. A., Chen, Y., et al. Proteins entrapped in silica monoliths prepared from glyceroxysilanes. Journal of Sol-gel Science and Technology. 31 (1), 343-348 (2004).
- Brook, M. A., Chen, Y., Guo, K., Zhang, Z., Brennan, J. D. Sugar-modified silanes: precursors for silica monoliths. Journal of Materials Chemistry. 14 (9), 1469 (2004).
- Zhang, J., Chung, T., Oldenburg, K. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- . Next generation of protein microarray support materials: Evaluation for protein and antibody microarray applications. Journal of Chromatography A. , 1-8 (2013).
- Bhatia, R. B., Brinker, C. J., Gupta, A. K., Singh, A. K. Aqueous Sol-Gel Process for Protein Encapsulation. Chemistry of Materials. 12 (8), 2434-2441 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved