Method Article
定量ゾルゲル由来のタンパク質マイクロアレイを開発するためのガイド材料スクリーニングアプローチ
要約
製造の新たなピン印刷法を用いてゾル - ゲル由来のタンパク質ドープされたマイクロアレイを開発するための誘導物質のスクリーニング手法が記載されている。この方法は、費用対効果の高い小分子のスクリーニングのために使用されるアセチルコリンエステラーゼ及びマルチキナーゼマイクロアレイの開発により実証されている。
要約
マイクロアレイは、新素材や小分子薬物リードの発見のためのハイスループットアッセイの開発に使用することを見出した。本明細書で我々は3次元タンパク質マイクロアレイを製造するのに適しているゾル - ゲル系材料を識別するための誘導物質のスクリーニング手法を説明する。アプローチは、最初にマイクロアレイとして印刷することができる材料を識別する最大の酵素活性の保持に基づいて、特定の酵素アッセイと互換性のあるもの、および、最適な材料で上まで迫るを識別することによって、材料の数を絞り込む。このアプローチは、2つの異なる酵素アッセイに適したマイクロアレイ、アセチルコリンエステラーゼを使用して1つおよび癌に関与する4つの主要なキナーゼのセットを使用して、他の開発に適用される。それぞれの場合には、定量的な小分子のスクリーニングアッセイおよび用量依存的な阻害剤の応答曲線の製造に使用することができるマイクロアレイを製造することが可能であった。重要なのは、能力は、多くの仲間をスクリーニングするリアルでは、最高の酵素活性のマイクロアレイの生産と保持の両方を最適材料の種類についての情報を生成した。素材データは、最適な、高密度のゾル - ゲル派生マイクロアレイを調整するために必要な基本的な材料の要件への洞察を提供します。
概要
マイクロアレイは増加アッセイのスループットのための方法として、科学界で人気を得ています。マイクロアレイ技術の開発は、1990年代半ばにおける遺伝子発現1を評価するので、マイクロアレイは、タンパク質-タンパク質およびタンパク質-小分子相互作用を識別するために、独特の特性を有する新しい材料を見つけるためのハイスループットアッセイの開発に使用することを見出した。 2-5最近では、マイクロアレイは、適切な蛍光を用いたマイクロアレイ自体の酵素活性及び阻害の容易な測定を可能にする、特定の材料がタンパク質が捕捉される範囲内の三次元マイクロアレイ素子の製造、機能性タンパク質を固定化するために使用されることを特徴とする請求開発されている基質代謝回転に結合されているアッセイ5-10重要なことに、このようなマイクロアレイは非常に並列接続された方法で一緒に画面サンプルとコントロールに必要なすべてのコンポーネントを含むように設計することができる。5,8
タンパク質マイクロアレイの初期の例は、典型的には、共有結合、11アフィニティキャプチャ3と物理吸着などの固体支持体上へのタンパク質固定化のための標準的な方法を用いて調製した。12バイオ固定するこれらの方法は、増加した試料濃度とするために必要な加速反応速度を可能にする一方でアッセイ小型化が、彼らはそれぞれの欠点に苦しむ。一般的に、すべての活性部位へのアクセスを妨げて、表面の化学修飾にネイティブ機能により生体分子の減少を引き起こすか、または非特異的な固定化のために不適切な姿勢。生体分子堆積の増加にもかかわらず、低いアッセイ感度、おそらく人工的に表面に生体分子をバインドする必要があるため、発生する応答でこのように、すべてのメソッドの結果。
機能的な生体分子マイクロアレイの生産のための新たなアプローチは、タンパク質ドープのピンプリンティングを介して行われます通常はどちらか官能ガラススライドまたはマイクロウェルプレートの個々のウェルである固体支持体上にシリカゾル、。ならびに13をロードする高タンパク質を考慮して、3次元マトリクス内に閉じ込める生体分子ゲル、複数の構成要素の挟み込み内ゾル-ゲルプロセス自体は室温で水性環境で行われ、それが印刷された液体前駆体であり、同じマイクロアレイ素子。ゾルゲル由来材料の裁縫13,14は、同様に異なるバッファの使用(pH、イオン強度)を介して水性成分を変更することにより、異なるシリカ前駆体の注意深い選択によって行われ、包含することができるの最適な材料を達成するために種々の添加剤(ポリマー、小分子)の特定の性質が捕捉される生体分子に依存する。10
ピンプリンティングを介してゾル - ゲル由来のタンパク質マイクロアレイの開発に関連する潜在的な制限があるピンでゲル化することなく、印刷または一度表面に印刷望ましくない特性(クラッキング再生不可能なスポットサイズ、接着不良、アッセイ成分との非互換性、貧しいタンパク質活性)を示すことができ、ゾル-ゲルベース複合材料を識別する必要があります。5同時これらのすべてのパラメータの最適化は、材料は、デノボ設計、またはシリアル方式でゆっくりと調べることができ、請求のアプローチを排除。一方、多くの千又は材料の数万のランダムスクリーニングも、時間も費用効果が高い。
本稿では、ランダムな材料の多数をスクリーニングすることなく、タンパク質マイクロアレイの製造に適した材料の迅速な同定を可能に向けスクリーニング手法を説明する。誘導アプローチを用いて、マイクロアレイ印刷に適した材料は、第一の最適なゾル - ゲル誘導さ、材質を識別するための小規模な一連の画面に続いて、同定さ割れや与えられたアッセイと互換性のあるなしで、再現性よく印刷することができるほかの組み合わせ。最後に、最適な材料は、最終的な小分子のスクリーニングアッセイにおける酵素活性および性能の維持に基づいて識別される。このように、最適な材料は、わずか数百アッセイ手順を使用して、何千もの候補の中から識別することができます。我々は、高密度のアセチルコリンエステラーゼ及びマルチキナーゼマイクロアレイの両方を製造するためのこのアプローチは、小分子のスクリーニングのためのそのようなマイクロアレイの使用を示す。
プロトコル
1。添加剤溶液の調製
- 50ml遠心内のpH 7.0、7.2、7.4、7.6、7.8、8.0および8.2で25〜50 mMのトリス(ヒドロキシメチル)アミノメタン(トリス塩基、M R 121.14グラム/モル)を準備し、HEPES(M R 238.3グラム/モル)チューブ。それぞれ1NのHClおよびNaOHを使ってpHを調整する。室温で保管し、3ヵ月後に交換してください。
- ポリ(ビニルアルコール)(PVA)24%(W / V)を準備します。PVA(M W 9,000 - 10,000 80%加水分解)の2.4グラムの重さ、脱イオン蒸留水(のddH 2 O)を10mlに追加、ディゾルブボルテックスでポリマーペレット。 16%の等量(w / v)の、12%(w / v)で、8%(w / v)のPVA溶液を調製し24%(w / v)の溶液を使用する。使用前に超音波処理によってドガソリューション。最大1ヶ月までは4℃で保管してください。
- 24%(w / v)のポリエチレンイミン(PEI)を準備します。のddH 2 O 5.2 mlにPEI(M wは 1,300、H 2 O、50%(w / w)の)の4.8ミリリットルを追加等量を調製し24%(w / v)の溶液を使用する16%(w / v)で、12%(w / v)で、8%(w / v)のPEI溶液の。使用前に超音波処理によってドガソリューション。最大1ヶ月までは4℃で保管してください。
- (w / v)のポリエチレングリコール(PEG)60%を準備:PEG(M W 600)の6グラムの重さとのddH 2 Oを10mlに追加、ボルテックスでポリマーペレットを溶解する。 30%に等しい容積(w / v)のPEG溶液を調製する段階希釈を使用します。使用前に超音波処理によってドガソリューション。最大1ヶ月までは4℃で保管してください。
- 24%(v / v)のN-(3 - トリエトキシシリルプロピル)グルコンアミド(GLS)を準備します(エタノール中50% - 在庫GLSが結晶場合水浴を使用するソリューションを温めて溶解するために必要な場合があります)GLSの480μLを追加する超音波処理を20分間、95%(v / v)のエタノールと混合物の520μlの。 16%の等量(v / v)のGLS溶液を作るために24%(v / v)の溶液を使用する。一日あたりの使用のために新鮮なソリューションを作る。
- (v / v)の24%を準備メチル(MTMS):既存の酸性化のddH 2 O(の760μlにMTMSの240μLを加えるpHは2.0、1NのHCl)と超音波処理によって20分間のミックス。 16%の等量(v / v)のMTMS溶液を作るために24%(v / v)の溶液を使用する。一日あたりの使用のために新鮮なソリューションを作る。
- 24%の準備(v / v)のビス[(3 - methyldimethoxylsilyl)プロピル]ポリプロピレンオキシド(MDSPPO):20分間のddH 2 O(pHは2.0、1NのHCl)とミックスを酸性化し、既存の760μlにMDSPPOの240μLを加える音波処理によって。 16%の等量(v / v)のMDSPPO溶液を作るために24%(v / v)の溶液を使用する。一日あたりの使用のために新鮮なソリューションを作る。
- 24%(v / v)の3を準備- (アミノプロピル)トリエトキシシラン(APTES)は:既存の酸性化のddH 2 O(pHは2.0、1NのHCl)と超音波処理によって20分間ミックス760μlにAPTESの240μLを加える。 16%の等量を作るために24%(v / v)の溶液を使用して、(v / v)の溶液をAPTES。一日あたりの使用のために新鮮なソリューションを作る。
- 24%の準備(v / v)のビス(triethoxysily)エタン(ビス-TEOS):既存の酸性化のddH 2 O(pHは2.0、1 N塩酸760μlにビス-TEOSの240μLを加える)と超音波処理によって20分間混ぜる。 16%の等量(v / v)のビス-TEOS溶液を作るために24%(v / v)の溶液を使用する。一日あたりの使用のために新鮮なソリューションを作る。
- 24%(v / v)のcarboxyethylsilanetriolをシリコン(Si-COOH)の準備のための:既存の酸性化のddH 2 O(pHは2.0、1NのHCl)とミックス40μlにのSi-COOHの960μlの(のddH 2 Oで25%)を追加超音波処理によって20分。 16%の等量(v / v)でのSi-COOH溶液を作るために24%(v / v)の溶液を使用する。一日あたりの使用のために新鮮なソリューションを作る。
- 別途3mMのNεを調製-アセチル-L-リシン、D-ソルビトール、α-α-トレハロース(M rは 188.22グラム/モル、182.17グラム/モル、それぞれ378.33グラム/モル)、および1.5mMのトリトンX-100 (平均M wは 625グラム/モル)のddH 2 Oでボリュームは、必要とされるどの程度に応じて変えることができる。一日あたりの使用のために新鮮なソリューションを作る。
- 60%(w / w)のグリセロールを準備のddH 2 O、ボルテックスによって混合物1.6gに無水グリセロール2.4gのを追加します。ドガソリューション使用前に超音波処理によって。最大1ヶ月までは4℃で保管してください。
- 30%(w / w)のグリセロールを準備のddH 2 O、ボルテックスによって混合物2.4gに無水グリセロール1.6gのを追加します。使用前に超音波処理によってドガソリューション。最大1ヶ月までは4℃で保管してください。
2。シリカゾルの調製
以下の手順に従って、氷上に保持し、それぞれのゾルは、水の添加後1時間まで使用することができる。減少/矛盾した材料のゲル化時間が1時間の結果を超えて使用ゾル。
- ゾルベースのナトリウムケイ酸(SS)の調製
- 500mLのプラスチックビーカーにイオン交換樹脂を120gを秤量する。
- 0.1 N HClを150mlのを加えて2インチの磁気撹拌棒を用いて1時間撹拌した。
- 真空に接続ブフナー漏斗を用いてソリューションをフィルタリング。
- 徐々に得られた濾液が透明になるまでフィルター樹脂を洗浄するためのddH 2 Oを追加します。これは、約100を取りのddH 2 O mlの
- 最大1ヶ月まで室温でプラスチック容器に準備樹脂を収集し、保管してください。
- を50mlのプラスチックビーカーにケイ酸ナトリウム(SS、27%(w / w)でのSiO 2、10%(w / w)の水酸化ナトリウム)の2.59グラムを秤量する。
- SSへのddH 2 Oを10mlを加える。ソリューションを混在させる手で優しく渦巻。
- 独立した50ミリリットルのプラスチックビーカーに準備樹脂5.60グラムを秤量する。 1インチの磁気撹拌棒を用いて2分間、ケイ酸ナトリウム溶液と混合入れる。
- 水栓に取り付ける吸引器に接続されてブフナー漏斗との混合溶液をフィルタリング。
- ゾル溶液をフィルタリングするフィルタ0.2μmの膜を備えた10ミリリットルのプラスチックシリンジを使用してください。これは、5.6%でゾル(w / w)のシリカは、さらにテキストでSSと呼ばれるが得られます。使用しないときは、氷の上にゾルを保管してください。
- ½SS:のddH 2 O、ボルテックスによって混合1mlのために準備SSゾル1 mlを加える。ていないときに氷の上にゾルを保つ使用しています。
- diglycerylsilane(DGS)ベースのゾルの調製
- 別の場所で説明されているようにDGSを合成します。デシケーター中15,16ストア結晶DGSは、室温で6ヶ月までのため。
- 結晶DGSの約1グラムを秤量する。
- 微粉末にDGSを挽くために乳鉢と乳棒を使用してください。空気から吸湿を防ぐために、できるだけ早く、この手順を完了します。
- 注意深く空の20mlのシンチレーションバイアルに微粉砕DGSを転送、質量(グラムの千分のへ)を記録。
- 0.5グラム/ mlのDGSを得るためのddH 2 Oを追加します。
- 5秒ごとに5分間ボルテックスにより混合、20分間氷上で加水DGSを超音波処理。湿気の多い日の間に、DGSの完全な溶解は1NのHClを10μlを加えることが必要な場合があります。これは、超音波処理前の溶液に添加されるべきである。
- 微粒子を除去し、ゾル溶液をフィルタリングするフィルタ0.2μmの膜を備えた3 mlのプラスチックシリンジを使用。これはさらに、テキスト内のDGSと称する5.0%(w / w)のシリカゾルが得られる。使用しないときは、氷の上にゾルを保管してください。
- ½DGS:のddH 2 O、ボルテックスによって混合1mlのために準備DGSゾル1 mlを加える。使用しないときは、氷の上にゾルを保管してください。
3。印刷可能な素材を識別するために、事前審査
印刷可能な物質を同定するために使用される誘導因子分析のさまざまな段階を示す一般的なスキームを図1に示されている。 100μlの最小の総物質量が推奨されます。より少量の使用は、可視化材料ゲル化が困難になります。
- ステージ1:バッファとシラン
- 2 mlのガラス製シンチレーションバイアルに緩衝液50μl液(pH 7.0、7.2、7.4、7.6、7.8、8.0、8.2で25と50 mMのトリスまたはHEPES)を追加します。
- で10秒のオンとオフの方法で適切なゾル(DGS、½DGS、SS、½SS)、ボルテックス混合液50μlを追加バイアルのオンとオフをボルテックスミキサー移動。
- 材料のゲル化時間を監視し、室温で休ませる材料を設定します。ゲル化時間は、材料が45°の角度にバイアルを回転させることにより自由に流れることを停止した時点として定義される。
- その後の材料スクリーニング段階から2.5時間未満のゲル化時間と材料の組み合わせを除外します。
- ステージ2:バッファ、シランおよびポリマー
- 2mlのガラスシンチレーションバイアル中で、w / 16%(w / v)の8%(w / v)のPVA / PEI溶液又は30%(w / v)の、または、60%(6.3μlのいずれかの3.13μlを添加ⅴ)PEG溶液。
- 、50μlに組み合わせたボリュームをもたらす渦によってソリューションを混合する50mMのHEPES液(pH8.0)を追加します。
- 適切なゾル(DGS、½DGS、SS、½SS)、ステップ3.1.2で説明した方法でミックス50μLを加える。
- ゲル化時間(ステップ3.1.3で定義されている)、その後の材料スクリーニング段階から2.5未満の時間と材料の組み合わせを除外します。
- ステージ3:バッファ、シラン、ポリマーと有機シラン
- 2mlのガラスシンチレーションバイアル中に、16%(w / v)の8%(w / v)のPVA溶液または30%(w / v)で、60%(w / v)の6.3μlのいずれかの3.13μlを添加PEG溶液。
- 16%の3.13μL(w / v)のオルガノ(GLS、MTMS、MDSPPO、ビス-TEOSに、Si-COOHまたはAPTES)を追加します。
- 、50μlに組み合わせたボリュームをもたらす渦によってソリューションを混合する50mMのHEPES液(pH8.0)を追加します。
- 適切なゾル(DGS、½DGS、SS、½SS)50μlのを追加し、ステップ3.1.2で説明した方法で混ぜる。ゲル化時間(ステップ3.1.3で定義されている)、その後の材料スクリーニング段階から2.5未満の時間と材料の組み合わせを除外します。
- ステージ4:バッファ、シラン、ポリマー、有機小分子添加剤
- 2mlのガラスシンチレーションバイアル中に、24%(w / v)の12%(w / v)のPVA溶液または30%(w / v)で、60%(w / v)の6.3μlのいずれかの2.08μlを添加PEG溶液。
- 加える24%の2.08液(w / v)のオルガノシラン(GLSに、Si-COOH)。
- または1.5 mMの(トリトンX-100) - 3 mMの小分子溶液(アセチル-L-リジン、D-ソルビトール、α-α-トレハロースNε)の2.08μLを加える。
- 、50μlに組み合わせたボリュームをもたらす渦によってソリューションを混合する50mMのHEPES液(pH8.0)を追加します。
- 適切なゾル(DGS、½DGS、SS、½SS)50μlのを追加し、ステップ3.1.2で説明した方法で混ぜる。
- ゲル化時間(ステップ3.1.3で定義されている)、その後の材料印刷の段階から2.5未満の時間と材料の組み合わせを除外します。
4。印刷可能なタンパク質ドープ材料の調製
ステップ3.4.6の末尾識別材料は今ゾルに含まれている適切な酵素で、印刷適性試験で繰り越されている。シラン以外のすべての成分を含有するすべての場合で以下のとおり、水溶液印字直前にゾルを添加し、マイクロウェルで調製される。 384マイクロタイタープレートの使用に対応するために、50μlの溶液の総体積を100μlのの代わりに使用されている。
- アセチルコリンエステラーゼ(AChE)マイクロアレイ
- 製造業者によって提供される情報は、多くの特定の酵素活性は、次の50mM HEPES(pH8.0)に(1mg当たりの活性の単位)でのAChEの2 KU / mlの溶液を調製します。
- -20℃で500μlのマイクロチューブやストアを使用して5μlのフラクションに分注し2 KU / mlの酵素原液-20℃で保存した場合2 KU / mlのAChEのストック溶液は、最大4ヶ月のために安定した状態を保つ
- 対応するポリマー、有機シランおよび384ウェルマイクロタイタープレートのステップ3.4.6を通じて特定小分子添加剤の半分のボリュームを組み合わせることにより、基材を準備する。
- 50mMのHEPES(pH8.0)中で2 KU / mlのアセチルコリンエステラーゼの5μLを加える。
- 50mMのHEPESを液(pH8.0)を使用して、結合をもたらす上下に数回ソリューションをピペッティングにより25μlのミックスによくボリューム。
- マルチキナーゼマイクロアレイ
- 製造元から提供されている活動(U / ml以下U / mg)及び数量情報は、次のddH 2 Oで100 ng /μLのキナーゼソリューション(のp38α、MAPK2、EGFR、GSK-3β)を準備します。 -80℃で2μLのアリコートでキナーゼソリューション℃で保存
- 製造業者によって提供数量情報に続いて、5 mg / mlの、のddH 2 Oで50 mg / mlのまたは300μMでキナーゼ基質(MBP、P(E 4 Y)、GSM)を準備します。 -80℃で2.5μLのアリコートの基板℃で保存
- 対応するポリマー、有機シランおよび384ウェルマイクロタイタープレートのステップ3.4.6を通じて特定小分子添加剤の半分のボリュームを組み合わせることにより、基材を準備する。
- 各ウェル基材を含むことに、2.5μlのキナーゼおよびそのそれぞれの基板(のp38αとMBP、MAPK2とMBP、EGFの2μLを追加それぞれ、手順4.2.1と4.2.2で調製したRとp(E 4 Y)、GSK-3βおよびGSM)。
- 50mMのHEPESを液(pH7.4)を使用し、25μlに組み合わせただけでなく、ボリュームをもたらす。ピペッティングで混ぜる。
5。マイクロアレイの形成
このセクションでは、単一のスライド表面に材料を印刷するための詳細な手順を説明します。多重修飾された摺動面(アミン、エポキシ、アルデヒド及びPMMA)に印刷するには、この手順を4回繰り返す。
- XYZステージを備えた接触ピン印刷用ロボットを用いてマイクロアレイを形成する。タンパク質ドープゾルを堆積させるために直径100μmのスロットシースピンを使用します。
- 80〜90%への印刷チャンバ内の湿度を設定します。湿度<80%が小型の堆積量が原因で、印刷のサンプル蒸発と不整合が生じる可能性があります。
- 窒素気流下で印刷する前に、乾燥した15分間のddH 2 Oのピンを超音波処理。パイプcleaneを使用rはピンホルダー内から残留水分を除去し、慎重にプリントヘッドにピンを配置する。残留水分を除去しないと、逃したスポットで、その結果、ホルダーと自由に動くからピンを妨げる可能性があります。
- コントロール配列チップライタープロ(CWP)プログラムを通してパターン。よく384ウェルソースプレート内の各サンプルについて、200スポット(SMP3シースピンを使用して取り込みあたりのスポット数の最大値)は表面改質されたスライドガラス上に印刷されています。
- ソフトウェアを介して印刷処理を開始する。 2.5秒サンプルのロード時間を2ミリメートル/秒から10mm / sとサンプルアプローチ速度(Z方向)にXY方向の移動を設定します。
- CWPを介して実行を一時停止。サンプルにピンを下げ、ピペットでウェルにそれぞれのゾル(DGS、½DGS、SS、½SS)25μlのを追加します。 50倍を繰り返し上下ペッティングモーションを使用してソリューションを混ぜる。ピペッティングにより混合する際に、溶液中に取り込まれる空気の量を最小限に抑える。気泡予防tはピン内のサンプルの読み込みを完了します。
- CWPを通じて印刷プロセスを開始し、1スライド表面上にサンプルを印刷します。よく続くソースプレートからサンプルをロードする前に、印刷処理を一時停止。
- 磁石を用いた印刷ピンを外し、プリントヘッド内の水分の蓄積を防ぐために、プリントヘッドのパイプクリーナーを配置。
- のddH 2 Oで印刷ピンをすすぎ、そして30秒のためにきれいなのddH 2 O中に超音波で分解する。
- 窒素気流下で印字ピンを乾燥、プリントヘッドに戻ってピンを配置し、パイプクリーナーを削除します。
- ソース·プレート内の残りのすべてのサンプルについて、5.10 - 5.6の手順に従って、印刷を開始する。最大直径100μmの12,000スポットには、単一のスライド上に堆積させることができる。
- この方法は、96ウェルマイクロプレート内のウェルの底には記録材料に適用することができる。 CWP校正ファイルに続き、distanを確保するために、印刷のピンを再較正スポット堆積の間に旅ceがマイクロウェルプレートの高さを超えています。これは、ピンがピンを損傷することなく直線的にウェルに井戸から一貫して印刷することができます。
- 全体の印刷実験の終了後80〜90%の湿度で30分と印刷チャンバ内の最大24時間の最低年齢配列。
6。アセチルコリンエステラーゼ活性アッセイ
- 準備ポジティブコントロール(PC)のサンプル
- 1.5 mlのマイクロ遠心チューブに25mMトリス(pH7.0)で、4%グリセロール中:1 mMのヨウ化アセチルチオコリン(M R 289.18グラム/モルATCH)を準備します。ニーズは、各使用前に新たに調製するATCHと高いpHバッファは偽陽性を生産、迅速な自動加水分解を起こすようにpH7.0の緩衝液を使用。最終容量は、サンプル(サンプルあたり25μlの数)に応じて変化させることができる。
- 384タイターPLAの井戸でATCH 1mMに25μlにBODIPY-FL-L-シスチン5 mMと0.14μLを追加TE。
- 24.86μlの4%グリセロール、25mMトリス(pH値7.0)を追加し、溶液中の気泡の形成を避けるために慎重にピペッティングにより混合。潜在的な酵素阻害剤は、緩衝液50μlにボリュームをもたらす前に、PC溶液に組み込むことができる。
- 陰性コントロール(NC)のサンプルを準備
- 4%グリセロール、384マイクロタイタープレートのウェル中の25mMトリス(pH6.5)中の49.86μlに5 mMと0.14μlのBODIPY-FL-L-シスチンを追加します。ピペッティングで混ぜる。
- 刷りPCとNCソリューション
- 5.10(ステップ5.6を無視して)プロトコルの - 手順5.1以下の高齢マイクロアレイをオーバープリント。 PCとNCオーバープリントソリューションを堆積させるために235μM直径のスロットシースピンを使用します。これは解決策は完全に以前に堆積スポットをカバーしていますが保証されます。
- 室温で1時間、80〜90%の湿度時の年齢アレイ。 ATCHの自動加水分解のため、より長いインキュベーション時間は、偽陽性になることがありまたはEN増加アクティビティZYME。
7。キナーゼ活性アッセイ
- -20℃で保存された株式ATP(100 mm)を用いたアデノシン5'-三リン酸(ATP)ソリューション500μMを準備各実験のために新しい溶液を作成し、実験的なニーズに音量を調整する:各印刷ソリューションは、5μlのを必要とします。
- のddH 2 Oでストック溶液:100mMの塩化マグネシウム(M rは 95.21グラム/モルのMgCl 2)を準備
- ポジティブコントロール(PC)
- 100のMgCl 2および384マイクロタイタープレートのウェルにATP5μlの500μMの2.5μLを加える。
- 50mMのHEPES(pH7.4)で50μlに合計うまくボリュームを持ってきて、ピペッティングしてミックス。潜在的な酵素阻害剤は、緩衝液50μlにボリュームをもたらす前に、PC溶液に組み込むことができる。
- 陰性コントロール(NC)
- 384-Mのウェルに100のMgCl 2および5μlの蒸留H 2 Oを2.5μlをicrotiterプレート。
- ピペッティングにより50mMのHEPES(pH7.4)に、混合で50μlに合計うまくボリュームを持参してください。
- 刷りPCとNCアッセイ補因子
- プロトコルの6.3.1のステップに従ってください。
- 室温で2時間、80〜90%の湿度時の年齢アレイ。
- スライド染色
- 場所印刷マイクロアレイはスライド全体をカバーするのに十分な染料(キットから)をペトリ皿に個別にスライドします。プレートシェーカーを使用して45分間(〜200 rpm)で適度に振る。
- 洗浄バッファー(キットから)できれいにペトリ皿に鉗子と場所を使用してスライドを削除します。プレートシェーカーを使用して45分間(〜200 rpm)で適度に振る。
- 鉗子を使用してスライドを外し、スライドホルダーを装備し、従来のデスクトップマイクロアレイ遠心を用いたドライスピン。
8。マイクロアレイイメージングと解析
- イメージング
イメージング法がSになることに注意してください利用可能なアレイリーダーのタイプにpecific。これらの研究については、白色光源とCCD検出システムとアルファイノテックNovaRayイメージャは478±17 nmの励起と538±AChEのマイクロアレイ、および530のために21 nmの発光フィルター±40 nmの励起および614±62 nmの放射を装備キナーゼマイクロアレイを使用したためにフィルタリング。共焦点レーザー走査システムも設定値が機器に固有であろうけれども、配列を読み取るために使用することができる。
- 上向きにスポットをスライドホルダーにスライドを置きます。
- イメージングソフトウェア内のプレビューセクションの数(2の最小値が推奨され、顕微鏡スライドのどちらかの端に1つずつ)、解像度(4μmの最小値を推奨します)と露出(オートをお勧めします)を設定します。
- スライド画像を取得し、 "。TIFF"ファイルとして保存します。
- 分析
- ImageJ64で取得スライド画像を開きます。
- 楕円形選択ツールをクリックして、測定解析タブの下に測定オプションを使用して、各スポットのシグナル強度。測定するための領域を選択すると、ImageJの主観を減らすためのスポットの間で観察されたスポットと一貫性のあるサイズよりわずかに大きい地域を選択します。
- 個々の材料組成のためのPC / NC比を得るために、25と同様のNCスポットの平均強度で割った25同様のPCスポットから平均強度。
結果
材料画面用の誘導因子分析を行うことにより、我々は、約20,000から印刷に適したゲル化時間を有し、数百に試験した材料の数を最小限に抑えることができた。の厳格なガイドラインが必要な材料ゲル化時間を適用することにより、2.5時間以上が、印刷ピンを詰まらせたり、再生不可能な配列を生成する可能性が高い材料は印刷されませんでした。十分な(> 2.5時間)ゲル化時間を有すると同定印刷可能な材料は、4つの異なる官能化ガラススライドの表面に印刷した。秩序 "印刷可能"と見なされるべきでは、ピンの取り込み体積あたりのスポット数は最大(SMP3を= 200)を印刷しなければならなかった。スポットは、 図2に示すように、割れまたは望ましくない相分離が単純な明視野顕微鏡を用いて発生していないことを確認するために、スポット形態について評価した。
同定され印刷可能な素材のこの段階から、マイクロアレイはアセチルコリンエステラーゼを製造し、キナーゼは、バッファリングされた水性成分に組み込む。アッセイ手順(潜在的なオーバープリントと洗濯や染色工程を含む)との互換性があった材料はネガティブコントロール(NCにマイクロアレイスポットの保持(無割れ、斑点や珍しい蛍光パターンの損失)及び陽性コントロール(PC)を観察することによって同定された等の画像を通して観察は1より大きい)比。これは材料の約50%であったとして、3以上のPC / NC比は、タンパク質の活性を保持して最適な材料を定義するために使用された。この方法によって、> 3 PC / NC基準を満たしキナーゼを含むAChEの2物質を含む26ゾル-ゲル由来材料。 図3と図4は、最適のAChE及びキナーゼの同定のための5誘導物質画面ステップのグラフィカル内訳を示すそれぞれマイクロアレイ、。
アッセイもZ 'スコアの世代を通じて検証することができます17 これは、最高のPC / NC比が製造された材料を使用して行われました。 図5は Z 'プロットは200箇所、100 PCとAChEのアレイ上指示薬色素と基板をオーバープリントした後100 NCから生成された信号を比較することによって得を示しています。アセチルコリンエステラーゼとキナーゼアレイは優れたアッセイを示す0.60と0.67のそれぞれのZ 'スコアをもたらした。しかしながら、アッセイの検証前に、オン·アレイ酵素、染料、基板と補因子の濃度が他の場所で詳細に説明するように、各成分の濃度の範囲をオーバープリントし、最も高い信号を生成した濃度を選択することによって最適化されなければならなかったことに留意すべきである5
アッセイを検証するために、定量的な阻害データが重複し、重複プロット( 図6A)および阻害曲線( 図6B及び図6C)を生成するために使用で行われる結果と、既知および未知のAChE阻害剤を用いて得られた。<第染料と基板との既知の阻害剤又は阻害剤なしのいずれかを含む制御次いで混合物で知られている生物学的に活性な小分子阻害剤の混合物と重ねてプリントされた強い>スポットが含まれていた。重複したプロットは、酵素活性を評価するために生成され、25%未満の酵素活性をもたらした任意の混合物が阻害について陽性とみなした。このような混合物から個々の化合物は、次いで阻害の原因特定の小分子(単数または複数)を識別するために、二重に試験した。一旦、識別されたこれらの小分子は、IC 50値および阻害定数を決定するために定量的な阻害曲線を生成するために使用された。
同様の定性的な結果が共通のキナーゼ阻害剤、スタウロスポリンによるマルチキナーゼアレイを用いて得られた。 図7Aおよび7Bは、マルチキナーゼを重ね刷りし、染色した後マイクロアレイ画像を表示し、その信号強度を示す( - ATP)、ポジティブコントロール(+ ATP)と既知の阻害剤(+ ATP + INH)の配列は、ネガティブコントロールのために期待されている。マイクロアレイから定量的阻害データを取得する能力を実証するために、濃度依存的な阻害アッセイは、単一のキナーゼを行った。 図8A及び図8Bに示すように、信号強度が阻害剤濃度が増加するにつれて減少し、応答がp38α/MBPキナーゼ/基質システムの予想濃度依存的阻害曲線に従う。
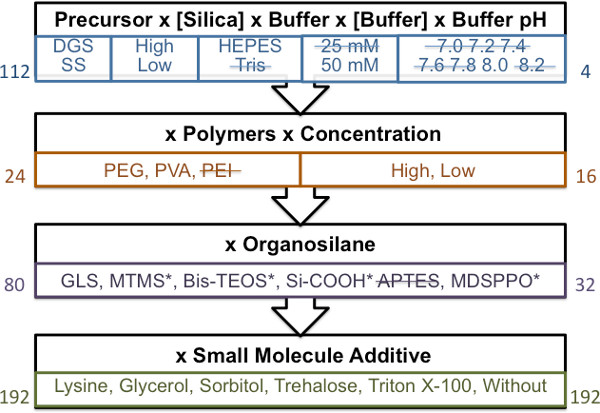
図1。ガイド付きの材料スクリーニングアプローチのための一般的な回路図は 、 各ブロックには、順番に画面のステップを表しています。左側の数字は、分析のために調製材料の総数を表す。 2.5時間(ゲル化時間を有する材料未満で2.5時間arを超えるゲル化時間を用いてe)は取り消し線で示すように、各ステージを通過し、材料画面中に繰り越さ材料の数が右側の数字で示されている。 *最適な相分離未満の材料を表します。

図2。スクリーン印刷適性の工程において材料の様々な故障モードを示す光学像は "良い"材料(第2行3列目)の画像は、比較のために示されている。参照8、著作権2013年米国化学会から許可を得て転載。
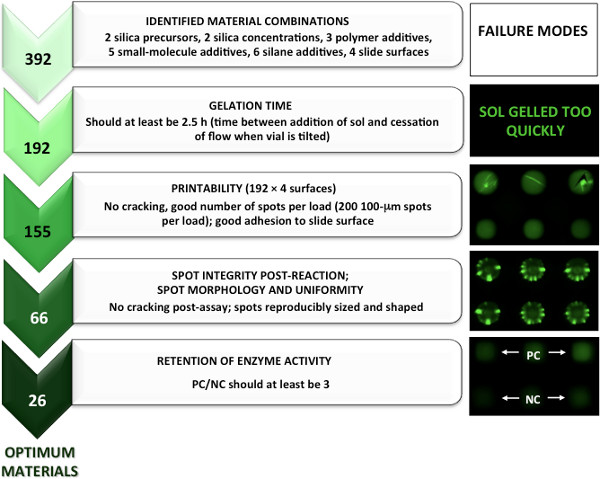
図3。ゾル-ゲル由来のAChEマイクロアレイを製造するための最適な材料を識別するための指向性材料スクリーニングアプローチは、パーマを得て転載文献5、著作権2013年アメリカ化学会からission。

図4。ゾル-ゲル由来キナーゼマイクロアレイを製造するための最適な材料の識別のためのアプローチをスクリーニング監督材料。参照8、著作権2013年のアメリカの化学会から許可を得て転載。
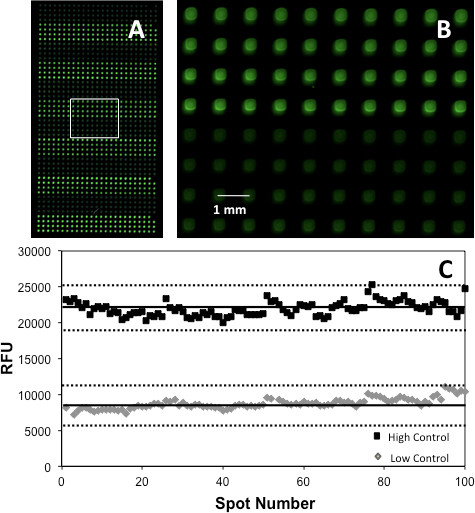
図5。 (A)HC(明るい緑色)とLC(ライトグリーン)スポット(黒緑パレットがプレゼンテーションを明確にするために擬似カラーとして適用された)を示すのAChEマイクロアレイの部と、(B)箱入りエリアの拡大図は、スポットを強調する形態およびアラインメント;及び(C)Z 'プロットの実線は平均値を示す破線は3SDに対応しながら、複製します。文献5、著作権2013年米国化学会から許可を得て転載。
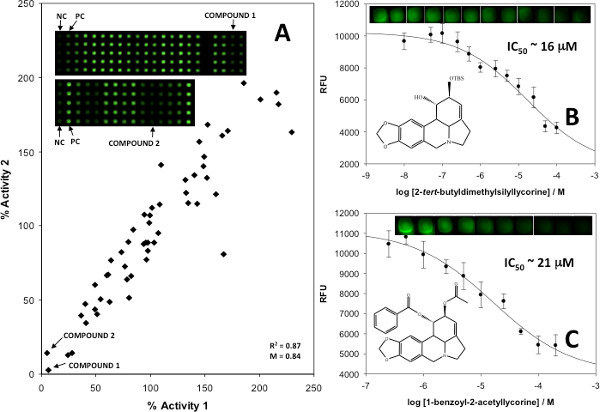
図6。 (A)は、ヒガンバナ科アルカロイドの合成類似のオン配列スクリーニングのためのプロットを重複し、(B)を同定可能性阻害剤のIC 50プロットは、化合物1〜25からの平均の1標準偏差を表すエラーバー付き(C)化合物2、としてマーク複製する。代表的なスポットが阻害剤濃度に比例した信号の差を説明するために示されている。文献5、著作権2013年米国化学会から許可を得て転載。 より大きい数字を表示するには、ここをクリックしてください 。
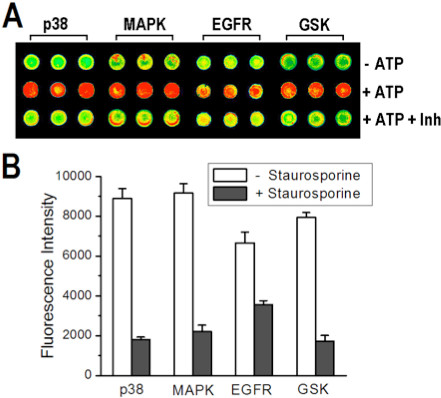
図7。オン·アレイは、捕捉用1.4SS/1.0PVAを使用して、4つのキナーゼアッセイおよびアミン誘導体化されたスライド上に印刷しました。(A)キナーゼ、それぞれの基質と同時捕捉さを有するスポットを緩衝液で重ねてプリントされたマイクロアレイの断面の画像(NC、一番上の行)、またはATP(PC、中段)またはATP +スタウロスポリン(下段)を含む溶液。 (B)との間の信号強度を比較する棒グラフを抑制し、25から平均値の1標準偏差を表すバックグラウンド信号と誤差棒の減算後の制約のない反応は、レプリケート。参照8、著作権2013年米国化学会から許可を得て転載。
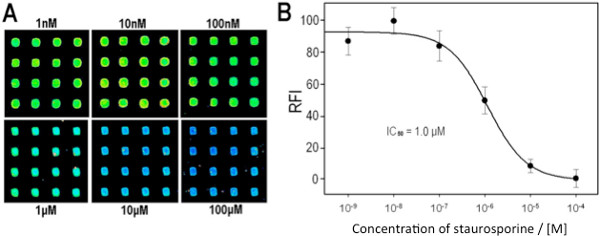
図8。 Inhibiti。p38a/MBPマイクロアレイ上でアッセイ(A)スタウロスポリンの濃度を変化させたoverspotted代表的なスポットを示したマイクロアレイの切片として(;合成画像は、明確にするために示されている画像は、同じスライドの単一のスキャンによって得た)を示した。 (B)IC 50曲線を分析配列画像から生成される。 100mMので得られた強度は、すべての画像から差し引いた他のすべての強度は、100%活性の値に10nMので得られた強度を設定することによって正規化した。参照8、著作権2013年米国化学会から許可を得て転載。
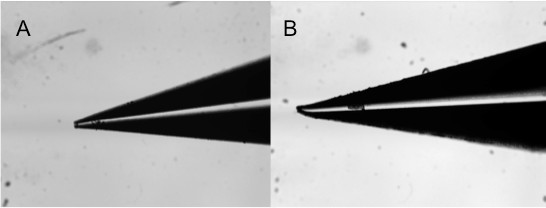
図9。様々な欠陥を示す接触ピン印刷に使用微視的ステルスピンの画像:(A)目詰まり、(B)曲がった。
ディスカッション
ここで説明する方法は、急速な材料の多数をスクリーニングすることなく、最適な材料を識別するための時間および費用対効果を生成する手順、コンタクトプリンタで印刷可能なゾル - ゲル由来の材料を識別するために最も適しとして選択した。 〜20,000電位の材料の合計から、単独でゲル化時間に基づいて、印刷に適していた200〜物質を同定することが可能であった。これは、大幅に後続の印刷試験のために準備する必要な材料の数を減少させた。これらの印刷可能な材料は、次いで、768スライド用材料の組み合わせの合計4摺動面上に印刷した。平均して、一つの材料の50スポット/複製は、サンプルローディング、スポット堆積とピンクリーニングを含む2〜3分で印刷することができます。これらのうち、155の材料、または約20%であり、溶液の取り込みごとのスポットの最大数を印刷するために許可され、再現性のスポットサイズを生じた。なお、4 SLとIDE面は、順番に、より良い印刷物テスト:アミン>エポキシ>アルデヒド> PMMAを、PMMAスライドを任意の材料のために有用な配列を生成しなかった。これは、おそらく表面コーティングの極性に起因するものであった。前述の摺動面を比較すると、より極性アミンとエポキシが良いPMMAスライドに比べ、水性ゾルに適していた。さらに、テスト表面の、アミン被覆スライドは、債券へのアニオン性のゾルを堆積するための潜在的な、正に帯電した表面を提供する。私たちは、疑う、スライドとゾルの間の界面におけるシリカナノ粒子は、表面に沿って対話します。エポキシおよびアルデヒド摺動面の両方が同じ初期電荷ベースの相互作用を欠いている。最適なスポット堆積を確保するためにそれは非常なArrayitなどのサプライヤーからプレコートスライドを使用することをお勧めします。社内のコーティングが悪いスポット再現性13とにつながる矛盾したサーフェスを生成、いくつかのケースでは、定量化の確率につながる可能性があります題。等しく重要なのは18、温度と湿度は、材料の"適性"を影響します。温度に関連する影響に関する詳細な研究が行われなかったものの、印刷が常に(23±3℃)を室温で行った。湿度(80%以上)は、小さな堆積量(nlの0.7から2.3)および蒸発による不規則な形状の堆積を防止するために、印刷チャンバ内に制御した。
材料画面はアセチルコリンエステラーゼおよびキナーゼ、タンパク質の両方のタイプのために働いた材料の小さなセットを同定したの印刷用に特別に最適なゾル - ゲル由来材料を特定の方に導かれていたが。実際、キナーゼマイクロアレイの製造のために識別された材料の両方がSS + PVA +グリセロールに基づいていた、両方の材料はまたマイクロアレイのAChEのために選択材料26内に同定された。これらの "最適な"材料はさらにproteを開発するための一般的な出発点を提供することがありますでドープされたゾル - ゲルベースのマイクロアレイ、およびこれらの組成物を中心とした小さな画面では、マイクロアレイの製造のためのより良い材料を識別することができる。注意すべき第二の点は、使用する酵素の重要性である。アセチルコリンエステラーゼ(むしろ堅牢な酵素)の場合には、アッセイ互換として識別原稿66の材料26(又は約40%)が捕捉されたアセチルコリンエステラーゼの活性を保持していた。しかし、より繊細69アッセイ互換組成物のわずか2キナーゼ、または材料の約3%のために、すべてのキナーゼの活性を保持することができた。異なる酵素の十分な数が決定的な文を作るために研究されていないが、比較的不安定な酵素で、その最適化アレイ製造表示されmutliplexedマイクロアレイの製造を可能にするために広範囲のタンパク質を捕捉することができる材料の同定につながる可能性がある。
選択されたタンパク質の独立した、印刷可能な材料を識別するための主要なカットオフ率は、長いの必要だった素材ゲル化時間(> 2.5時間)。 SS系ゾル - ゲル材料を開発するとき、それは、イオン交換、濾過後に、ゾルはpH約4であることを確実にするために非常に重要である。低い初期pHのゾル酵素活性に影響を与えることができるよりも低い中性pH、を持つ材料になることがあります。19 SSにダウエックス量(イオン交換樹脂)の調整は、ゾルの最終pHを変えることができます。樹脂の新しいバッチを調製する際SSへの樹脂の比率は、プロトコルのセクション2の手順に従って、pH約4でゾルを生成するように調整する必要がある。
生体分子捕捉用DGS系ゾルを使用した場合と同様に、結晶DGSの調製は、多くの場合、材料破壊に関連付けられたエラーの原因である。 、ここでは詳細には細心の注意が報告されていないがpolyglyceratedシリカを生産する合成中の水の存在を避けるために特に必要で、結晶DGSの合成中に注意する必要がむしろ単量DGSよりTES。また、DGSの吸湿性の性質のために、結晶試料は合成後6ヶ月以内に乾燥して使用格納する必要がある。 6ヶ月以上前の結晶DGSも酸性環境における超音波処理で(せいで部分的に凝縮ポリグリセリルシリケート材料に)完全に溶解しないことがあります。不完全DGSの溶解は、未知と制御不能シリカ含有量、したがって、より少ない堅牢な材料とゾルを生成します。
コンタクトプリントで注意すべき重要な点は、ピンの品質です。破損したり、誤っピン( 図9)が印刷されている物質の独立した再現可能な配列を作り出すことは決してありません。それは、壊れたり、詰まっピンが使用されていないことを確認するために解剖顕微鏡を用いてピンの品質をチェックすることをお勧めします。慎重な取り扱いにはピンの長寿命を保証します。ピンの自由な移動も重要である。水分が頭とピン、ピンの間にプリントヘッドの中に閉じ込めている場合で座席は正しく、したがって、材料の堆積の欠如、その結果、表面に適切な接触をすることはありませんではないでしょう。
結論として、我々は、高濃度ドープされたタンパク質ピン印刷されたマイクロアレイを開発するための詳細な多段スクリーニング法を提供している。スクリーニングは、より集中スクリーニング続い資材の印刷は、与えられた測定法との互換性と酵素活性を保持することができる物質を同定することを可能にする材料特性の最適化(ゲル化時間と印刷適性)が含まれます。この誘導物質のスクリーニング手法は、効率的な高密度マイクロアレイの製造にかかる時間とコストを削減するために追加のマイクロアレイフォーマットに適用することができる。
開示事項
我々は、開示することは何もありません。
謝辞
著者らは、タンパク質マイクロアレイの開発の支援のためにマリアモントン、ジュリーLebert、ジェサミンリトル、新Ge及びローラLautensに感謝します。また、作者はこの仕事に資金を供給するための自然科学とカナダの工学研究会(NSERC)に感謝。また、作者はこの仕事をサポートするためのイノベーションとオンタリオ州イノベーショントラストのためカナダ財団に感謝します。 JDBは、バイオ分析化学とBiointerfacesにおけるカナダリサーチチェアを保持しています。
資料
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Poly(vinyl alcohol) (PVA) | Sigma-Alderich | 360627 | 80% hydrolozyed, Mw 600 |
| Polyethylene glycol 600 (PEG) | Sigma-Alderich | 87333 | |
| Polyethylenimine (PEI) | Sigma-Alderich | 482595 | 50 wt% solution in water |
| Carboxyethylsilanetriol (Si-COOH) | Gelest, Inc. | SIC2263.0 | 25% in water |
| N-(3-triethoxysilylpropyl) gluconamide(GLS) | Gelest, Inc. | SIT8189.0 | 50% in ethanol |
| bis[(3-methyldimethoxysilyl)propyl]polypropylene oxide (MDSPPO) | Gelest, Inc. | SIB1660.0 | |
| Methyltrimethoxysilane (MTMS) | Gelest, Inc. | SIM6560.1 | |
| Bis(triethoxysiyly)ethane (Bis-TEOS) | Gelest, Inc. | SIB1817.0 | |
| 3-Aminopropyltriethoxysilane (APTES) | Gelest, Inc. | SIA0610.0 | |
| Glycerol | Sigma-Alderich | 49767 | |
| D-Sorbitol | Sigma-Alderich | 240850 | |
| D-(+)-Trehalose dihydrate | Sigma-Alderich | T9531 | |
| Triton X-100 | Sigma-Alderich | X-100 | |
| Nε-Acetyl-L-lysine | Sigma-Alderich | A4021 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Alderich | 154563 | |
| HEPES | Sigma-Alderich | H3375 | |
| Sodium hydroxide, 1.0 N | LabChem Inc. | LC24350-2 | |
| Hydrochloric Acid, 1.0 N/0.1 N | LabChem Inc. | LC15300-2/LC152220-2 | |
| Magnesium chloride | Sigma-Alderich | M8266 | |
| Diglycerolsilane (DGS) | Prepared in laboratory | ||
| Sodium silicate solution | Fisher Scientific | SS338-1 | |
| Dowex 50WX8-100 ion exchance resin | Sigma-Alderich | 217492 | |
| Acetylthiocholine iodide | Sigma-Alderich | 1480 | |
| Acetylcholinesterase from Electrophorus electricus (electric eel) | Sigma-Alderich | C2888 | |
| BODIPY FL L-Cystine | Invitrogen | B-20340 | |
| Pro-Q Diamond Phosphoprotein/Phosphopeptide Microarray Stain Kit | Invitrogen | P33706 | |
| Adenosine 5'triphosphate disodium salt (ATP) solution | Sigma-Alderich | A6559 | |
| MAP Kinase 2 (MAPK2) | EMD Millipore | 454850 | |
| p38α/SAPK2a (T106M), active | EMD Millipore | 14-687M | |
| Epidermal growth factor (EGFR) | EMD Millipore | Donated by Millipore | |
| Glycogen synthase kinase 3β (GSK-3β) | EMD Millipore | 14-306 | |
| Myelin basic protein (MBP) | EMD Millipore | Substrate for MAPK2 and p38α, Donated by Millipore | |
| GSM | EMD Millipore | 12-533 | Substrate for GSK-3β |
| Poly-glu-tyr polypeptide p(E4Y) | EMD Millipore | 12-440 | Substrate for EGFR |
| Stealth pin | ArrayIt | SMP3 | |
| Stealth pin | ArrayIt | SMP7 | |
| Amine coated slides | ArrayIt | SMM2 | |
| Aldehyde coated slides | ArrayIt | SMA2 | |
| Exposy coated slides | ArrayIt | SME2 | |
| Poly(methylmethacrylate) (PMMA) coated slides | Exakt Technologies Inc. | 41500 | |
| 0.2-μm syringe filter | PALL Life Sciences | 4612 | |
| Equipment | |||
| Virtek Contact Printer | BioRad | ||
| Novaray Fluorescence Slide Imager | Alpha Innotech Corporation | ||
| Desktop microarray centrifuge | ArrayIt | MHC110V | |
| MilliQ Synthesis A10 | Millipore | Used to filter all water required for experiments |
参考文献
- Schena, M. M., Shalon, D. D., Davis, R. W. R., Brown, P. O. P. Quantitative monitoring of gene expression patterns with a complementary DNA microarray. Science (New York, N.Y.). 270 (5235), 467-470 (1995).
- MacBeath, G., Schreiber, S. L. Printing proteins as microarrays for high-throughput function determination. Science (New York, N.Y.). 289 (5485), 1760-1763 (2000).
- Zhu, H. H., Bilgin, M. M., et al. Global analysis of protein activities using proteome chips. Science (New York, N.Y.). 293 (5537), 2101-2105 (2001).
- Hook, A. L., Chang, C. -. Y., et al. Combinatorial discovery of polymers resistant to bacterial attachment. Nature Biotechnology. , (2012).
- Monton, M. R. N., Lebert, J. M., Little, J. R. L., Nair, J. J., McNulty, J., Brennan, J. D. A Sol-Gel-Derived Acetylcholinesterase Microarray for Nanovolume Small-Molecule Screening. Analytical Chemistry. 82 (22), 9365-9373 (2010).
- Cho, E. J., Tao, Z., Tehan, E. C., Bright, F. V. Multianalyte pin-printed biosensor arrays based on protein-doped xerogels. Analytical Chemistry. 74 (24), 6177-6184 (2002).
- Cho, E. J., Tao, Z., et al. Tools to Rapidly Produce and Screen Biodegradable Polymer and Sol-Gel-Derived Xerogel Formulations. Applied Spectroscopy. Society for Applied Spectroscopy. 56 (11), 1385-1389 (2002).
- Ge, X., Lebert, J. M., Monton, M. R. N., Lautens, L. L., Brennan, J. D. Materials Screening for Sol-Gel-Derived High-Density Multi-Kinase Microarrays. Chemistry of Materials. 23 (16), 3685-3691 (2011).
- Rupcich, N., Green, J. R. A., Brennan, J. D. Nanovolume Kinase Inhibition Assay Using a Sol-Gel-Derived Multicomponent Microarray. Analytical Chemistry. 77 (24), 8013-8019 (2005).
- Rupcich, N. Coupled enzyme reaction microarrays based on pin-printing of sol-gel derived biomaterials. Analytica Chimica Acta. 500 (1-2), 3-12 (2003).
- MacBeath, G. G., Schreiber, S. L. S. Printing proteins as microarrays for high-throughput function determination. Science (New York, N.Y.). 289 (5485), 1760-1763 (2000).
- Stillman, B. A. B., Tonkinson, J. L. J. FAST slides: a novel surface for microarrays. BioTechniques. 29 (3), 630-635 (2000).
- Rupcich, N., Goldstein, A., Brennan, J. D. Optimization of sol-gel formulations and surface treatments for the development of pin-printed protein microarrays. Chemistry of Materials. 15 (9), 1803-1811 (2003).
- Gill, I., Ballesteros, A. Encapsulation of biologicals within silicate, siloxane, and hybrid sol-gel polymers: An efficient and generic approach. Journal of the American Chemical Society. 120 (34), 8587-8598 (1998).
- Brook, M. A., Chen, Y., et al. Proteins entrapped in silica monoliths prepared from glyceroxysilanes. Journal of Sol-gel Science and Technology. 31 (1), 343-348 (2004).
- Brook, M. A., Chen, Y., Guo, K., Zhang, Z., Brennan, J. D. Sugar-modified silanes: precursors for silica monoliths. Journal of Materials Chemistry. 14 (9), 1469 (2004).
- Zhang, J., Chung, T., Oldenburg, K. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- . Next generation of protein microarray support materials: Evaluation for protein and antibody microarray applications. Journal of Chromatography A. , 1-8 (2013).
- Bhatia, R. B., Brinker, C. J., Gupta, A. K., Singh, A. K. Aqueous Sol-Gel Process for Protein Encapsulation. Chemistry of Materials. 12 (8), 2434-2441 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved