Method Article
RNAscope的
摘要
在头颈部肿瘤组织中高危型HPV的存在是有利的结果有关。 原位杂交技术最近开发的RNA称为RNAscope允许的HPV E6/E7 mRNA在FFPE组织切片直接可视化。
摘要
对于致癌型HPV检测的“金标准”是肿瘤组织中转录活性的高危型HPV的示范。然而,检测E6/E7 mRNA的定量反转录聚合酶链反应(定量RT-PCR),需要RNA提取它破坏的形态相关的肿瘤组织方面至关重要,已经很难在常规的临床实践中被采纳。我们在原位杂交技术,RNAscope最近开发的RNA,允许在福尔马林固定,石蜡包埋(FFPE)组织与单分子灵敏度和单细胞分辨率,使高度敏感和特异的任何生物标记的RNA 原位分析的RNA直接可视化在日常临床标本。该RNAscope HPV检测的目的是检测七个高危HPV基因型采用基因型特异性探针池的E6/E7基因(HPV16,18,31,33,35,52,和58)。它具有卓越的灵敏度和特异性针对检测E6/E7 mRNA的定量RT-PCR检测目前的“金标准”方法。 HPV状态由RNAscope决定的强烈预后的口咽癌患者的临床疗效。
引言
全世界1高危型人乳头瘤病毒(HR-HPV)感染占所有癌症的约5%。 HPV相关口咽癌的发病率在过去几十年有所增加,特别是男性。 HPV阳性口咽鳞状细胞癌(OPSCC)将有可能在未来20年2占了绝大多数所有头部和颈部癌症在美国。由人乳头瘤病毒引起口咽部鳞状细胞癌都与良好的生存相关,与肿瘤HPV状态是生存3一个强大而独立的预后因素。
对于病毒癌基因E6和E7的转录激活的证据被视为黄金标准临床相关的HPV 4的存在。然而,从通过RT-PCR技术的新鲜肿瘤组织的检测E6/E7 mRNA的是不实用的常规临床实践中,并已限定于研究实验室。最近,我们甲肝Ë开发了一种名为RNAscope一个新的RNA原位杂交技术,使多重检测单个细胞在福尔马林固定,石蜡包埋组织标本(FFPE)的5-10单个RNA分子的灵敏度。我们提供了三个方面的证据进行单分子检测5。首先,RNAscope探针设计和信号放大系统允许检测在HeLa细胞和SK-BR-3细胞系中单个拷贝的HER2基因组DNA的目标。第二,当与HER2基因组DNA的信号进行比较,在HeLa细胞中的HER2 mRNA的信号点的荧光强度的分布与每点一个分子中是一致的。第三,每个细胞的HER2 mRNA的信号点的数目相匹配密切通过基于溶液的定量测定法估计的HER2 mRNA的拷贝数,进一步支持单分子检测。此外,用DAPI细胞核在荧光显微镜或用苏木在明亮的视野显微镜的复染允许单个核的可视化,WHICH从而允许检测和RNA靶标量化对单细胞基础10。分析基因表达的原位在日常临床标本的能力,使得RNAscope一个有前途的平台,为病理诊断,尤其是那些FFPE组织部分为基础的检测10,11。我们已经开发了一个RNAscope为基础的HPV检测方法的采用基因型特异性探针池七个高风险HPV基因型(HPV16,18,31,33,35,52,和58)E6/E7 mRNA的表达。我们最近在OPSCC的研究表明,人乳头状瘤病毒RNAscope检测具有高度的敏感性和特异性在确定FFPE组织12-17 HPV状态,并且也告知预后OPSCC 12,16。
该RNAscope技术的原理以前已经描述5。在这里,我们描述了完整的RNAscope分析方案,并展示其在HR-HPV在FFPE肿瘤组织切片检测中的应用。
研究方案
1。样品,设备和试剂准备
- 切割组织标本到3-4毫米厚的块,在新鲜的10%中性缓冲福尔马林中16-32小时,在室温(25℃)下固定并嵌入石蜡中。切FFPE为5±1微米的厚度从FFPE块部分,安装在幻灯片和空气干燥的部分。注:幻灯片可以被存储于下干燥室温下长达3个月。所安装的组织载玻片应进行烘烤,在干燥过在60℃下进行1小时前RNAscope测定。
- 把杂交炉至40°C。放置一个加湿纸的湿度控制盘。加入50 mL DH 2 O到加湿纸完全浸湿了。将覆盖托盘放入烤箱以prewarm使用前至少30分钟。
- 让700毫升1X 2预先处理解决方案(10 NL,pH为6的柠檬酸缓冲液)由卫生署2 O稀释10倍的预处理解决方案烧热1倍2预先处理解决方案煮沸和迈ntain之间100-104℃的温度,同时防止过沸。
- 使3升1X的洗涤缓冲液(0.1×SSC)由卫生署2 O稀释50倍预热洗涤液
- 制备2×200毫升二甲苯和2×200毫升100%乙醇脱蜡在通风橱。
- 制备50%的苏木精染色溶液和上蓝剂(0.01%氨水)进行后染色在通风橱。
- 制备200ml二甲苯中,70毫升200%,和200毫升100 2×%乙醇进行脱水在通风橱。
- Prewarm目标探针在40°C下10分钟,并把RTU检测试剂盒试剂至室温,包括RTU AMP1,AMP2,AMP3,AMP4,放5-布朗和AMP6 - 布朗,除了DAB显色棕色-A和棕色-B 。
2。 RNAscope含量
脱蜡和脱水
烘烤后,deparaffinize组织切片在二甲苯中的2×5分钟,频繁搅动,和脱水在100%乙醇为2×3分钟,频繁搅动。空气干燥5分钟,周围画具有疏水屏障笔的组织部分的疏水性屏障。
预处理
- 孵育组织切片与1预先处理在室温10分钟内源性过氧化物酶活性的淬火,清洗在DH 2 O。
- 孵育组织切片用2预先处理保持在沸点温度下15分钟进行RNA提取,在DH 2 O冲洗两次
- 孵育组织切片用3预先处理 30分钟,在40℃的蛋白质消化的HybEZ烤箱,在DH 2 O冲洗两次
目标探针杂交
目标探测HPV-HR 7池包括:HPV16,18,31,33,35,52,和58。添加HPV探针,泛素C(UBC)和细菌的dapB基因探针分别在三个相邻的组织切片。杂交于40℃在烘箱中2小时,然后用清水冲洗在1x洗涤液在室温2×2分钟。
信号放大
- 孵育组织切片与AMP1(前置放大器)30分钟,在40℃下,AMP2(背景减速机),15分钟,40℃,AMP3(放大器)30分钟,在40℃,AMP4(标记探针)15分钟于40℃在烘箱HybEZ。每个杂交步骤之后,冲洗在1x洗涤缓冲液在室温2×2分钟。
- 孵育组织切片与AMP5 30分钟,AMP6 15分钟,在RT。每个温育步骤后,用1X冲洗缓冲液中于室温2×2分钟。
信号检测
通过混合布朗-A和布朗的B在室温10分钟等体积孵育组织切片,用1:1民建联混合物,在DH 2 O冲洗两次
复染
染色组织切片与在室温2分钟,50%的苏木素溶液冲洗用DH 2 O,直到幻灯片清晰,同时组织保持紫色。浸滑入在DH 2 O 0.01%氨水5倍,随后用5蘸DH 2 O。滑动安装
脱水的组织切片在70%,100%和100%乙醇为每个2分钟,二甲苯5分钟,装入用二甲苯基安装介质。
结果
RNAscope HPV检测的工作流程
该RNAscope检测具有高度简化的工作流程,它类似于IHC( 图1)。它包括四个主要步骤:预处理,杂交,信号扩增和检测。它采用了独特的探头设计战略,以确保高保真信号放大5。在RNAscope HPV的测定中,7 HR-HPV探针组汇集起来,所有确认通过链接到辣根过氧化物酶(HRP)相同的信号放大系统。特异性杂交信号被检测为用HRP形成棕色沉淀物催化的显色反应用DAB作为底物,其可以通过标准的明场显微术可以容易地观察到。
对于HPV检测染色代表
图2显示了从头部和颈部鳞状细胞癌中染色FFPE部分示例图像。在HPV阳性的情况( 图URE 2A)时,HR-HPV探针检测特别是在肿瘤细胞点状强的信号。 UBC的探头检测到这两种肿瘤细胞和间质细胞( 图2B)许多点状细胞质的信号。细菌的dapB基因探针表现出干净的背景( 图2C)。在HPV阴性的情况下,HR-HPV探针和dapB的探头既没有检测到信号( 图2D和2F),而被利用UBC探头( 图2E)检测到的强信号。在该试验中,UBC作为阳性对照,以评估组织RNA的质量和dapB的作为阴性对照的背景信号。得分为HPV地位确定包括检查所有三个幻灯片,每个案件。在负对照载玻片(dapB的)滑动的染色水平作为截止:HPV阳性是由点状的细胞质和/或那是在dabpB滑动的信号高于核染色的存在来定义。

图1。 RNAscope法的流程图。插图RNAscope检测的工作流程。该RNAscope试验包含4个主要步骤,预处理,目标探针杂交,信号放大和信号检测。整个检测过程可在8小时内完成。 点击这里查看大图。
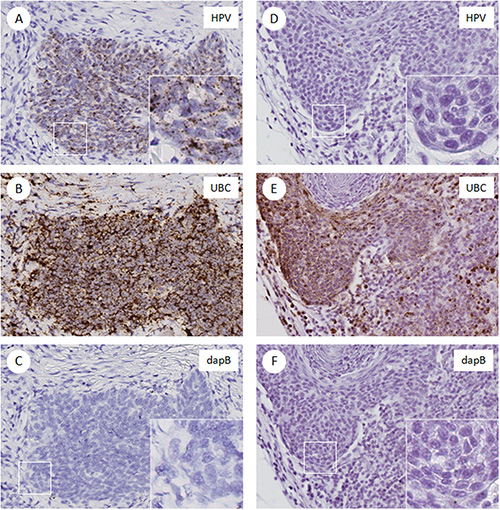
图2。的RNAscope染色玻片例如图像。FFPE切片染色用探针高危型HPV,不列颠哥伦比亚大学(阳性对照)和dapB的(阴性对照)从两个头颈部鳞癌的案件。 交流 。 HPV阳性的情况。 A,高危型HPV E6/E7 mRNA表达的肿瘤细胞。插图,40X放大倍率显示点状信号,B和C)相邻的组织切片显示出积极的UBC染色(B)和阴性的dapB(C),分别DF)HPV阴性的情况下,D)没有染色的HPV E6/E7 mRNA的,类似的dapB阴性对照组(F)E)UBC阳性染色。 点击这里查看大图。
讨论
该RNAscope HPV检测允许E6/E7 mRNA的直接可视化原位 HPV相关的头颈部鳞状细胞癌。该RNAscope测定法是用常规固定的肿瘤组织完全相容,并保留组织形态进行组织病理学的相关性( 图2)。比传统CISH方法RNAscope测定的一个重要优点是,它特异性地扩增杂交信号( 图2B和2E)未经放大的背景噪声( 图2C和2F)。
在实践中,RNAscope HPV检测程序可以在8小时内完成,或方便地划分超过两天。该RNAscope HPV检测已经被用来确定HPV状态在头颈部鳞状细胞癌12-16,采用实时荧光定量PCR检测的参考方法16表明97%的敏感性和93%的特异性。常规字符omogenic ISH为高危型HPV DNA是非常具体的,但有80〜12%的敏感性。免疫组织化学(IHC)染色的细胞的替代标记p16蛋白表现出优异的灵敏度,但可能会产生假阳性结果15,18,特别是在nonoropharyngeal头部和颈部癌症15。定量RT-PCR检测HPV E6/E7 mRNA的检测目前的“金标准”方法需要新鲜冰冻组织达到最佳的效果,并在技术上是复杂的,这限制了它的使用只研究实验室。此外,它需要的RNA提取,这使得它不可能关联HR-HPV E6/E7 mRNA表达与组织病理学。
有几个关键因素的RNAscope试验的成功。第一,为了获得最佳结果,组织应在室温下放置16-32小时,根据ASCO / CAP指南19固定在新鲜的10%中性缓冲福尔马林中。其次,HybEZ烤箱强烈推荐,因为它使S温度和湿度探针杂交和信号放大步骤的优化控制。第三,以除去多余的残留缓冲区每个步骤之前,但仍然保持了组织切片的干燥过程中任何一个步骤是很重要的。
这里所描述的手动RNAscope程序已经完全自动化的商用幻灯片自动染色系统10。这应该极大地方便了实验条件,并在临床病理实验室节省了宝贵的体力劳动标准化。此外,专用的图像分析软件已经开发10自动识别的数字化幻灯片,这应该有助于消除主观性和提高可重复性在得分细胞和染色信号。
综上所述,RNAscope HPV检测检测高危型HPV E6/E7 mRNA转录原位存在的FFPE组织。它有一个工作流程,熟悉临床病理实验室保守党通过允许直接可视化这些组织切片。它提供了用于检查(FFPE)组织样品的理想平台,并且可以很容易地通过了诊断病理学实验室。
披露声明
所有作者都通过和自己的股票在先进细胞诊断公司采用
致谢
由美国国立卫生研究院授予(R43/44CA122444)和国防部BRCP补助金(W81XWH-06-1-0682),以YL的部分支持。
材料
| Name | Company | Catalog Number | Comments |
| SuperFrost Plus slides | Fisher Scientific | 12-550-15 | |
| HybEZ Oven, Tray, and Rack | Advanced Cell Diagnostics | 310011, 310012, 310014 | |
| RNAscope 2.0 FFPE Reagent Kit - Brown | Advanced Cell Diagnostics | 310035 | |
| RNAscope HPV-HR7 Probe for HPV 16, 18, 31, 33, 35, 52, and 58, E6/E7 mRNA | Advanced Cell Diagnostics | 312351 | |
| ImmEdge Hydrophobic Barrier Pen | Vector Laboratory | H-4000 | |
| 100% EtOH | American Master Tech Scientific | ALREAGAL | |
| Xylene | Fisher Scientific | X3P-1GAL | |
| Gill's Hematoxylin I | American Master Tech Scientific | HXGHE1LT | |
| Ammonia hydroxide | Sigma-Aldrich | 320145-500mL | |
| Cover Glass 24 mm x 50 mm | Fisher Scientific | 12-545-F | |
| Hot Plate | Fisher Scientific | 11-300-49SHP | |
| Drying Oven | Capable of holding temperature at 60±1 °C | ||
| Water Bath | Capable of holding temperature at 40±1 °C |
参考文献
- Parkin, D. M. The global health burden of infection-associated cancers in the year 2002. Int. J. Cancer. 118 (12), 3030-3044 (2006).
- Chaturvedi, A. K., et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J. Clin. Oncol. 29 (32), 4294-4301 (2011).
- Ang, K. K., et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N. Engl. J. Med. 363 (1), 24-35 (2010).
- Smeets, S. J., et al. A novel algorithm for reliable detection of human papillomavirus in paraffin embedded head and neck cancer specimen. Int. J. Cancer. 121 (11), 2465-2472 (2007).
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. J. Mol. Diagn. 14 (1), 22-29 (2012).
- Liu, X., et al. Specific regulation of NRG1 isoform expression by neuronal activity. J. Neurosci. 31 (23), 8491-8501 (2011).
- Yan, K. S., et al. The intestinal stem cell markers Bmi1 and Lgr5 identify two functionally distinct populations. Proc. Natl. Acad. Sci. U.S.A. 109 (2), 466-471 (2012).
- Payne, R. E., et al. Viable circulating tumour cell detection using multiplex RNA in situ hybridisation predicts progression-free survival in metastatic breast cancer patients. Br. J. Cancer. 106 (11), 1790-1797 (2012).
- Bordeaux, J. M., et al. Quantitative in situ measurement of estrogen receptor mRNA predicts response to tamoxifen. PLoS One. 7 (5), (2012).
- Wang, Z., et al. Automated quantitative RNA in situ hybridization for resolution of equivocal and heterogeneous ERBB2 (HER2) status in invasive breast carcinoma. J. Mol. Diagn. 15 (2), 210-219 (2013).
- Tubbs, R. R., et al. Ultrasensitive RNA in situ Hybridization for Detection of Restricted Clonal Expression of Low Abundance Immunoglobulin Light Chain mRNA in B-Cell Lymphoproliferative Disorders. Am. J. Surg. Pathol. In press, (2013).
- Ukpo, O. C., Flanagan, J. J., Ma, X. J., Luo, Y., Thorstad, W. L., Lewis, J. S. High-risk human papillomavirus E6/E7 mRNA detection by a novel in situ hybridization assay strongly correlates with p16 expression and patient outcomes in oropharyngeal squamous cell carcinoma. Am. J. Surg. Pathol. 35 (9), 1343-1350 (2011).
- Lewis, J. S., et al. Transcriptionally-active high-risk human papillomavirus is rare in oral cavity and laryngeal/hypopharyngeal squamous cell carcinomas--a tissue microarray study utilizing E6/E7 mRNA in situ hybridization. Histopathology. 60 (6), 982-991 (2012).
- Lewis, J. S., et al. Partial p16 staining in oropharyngeal squamous cell carcinoma: extent and pattern correlate with human papillomavirus RNA status. Mod. Pathol. 25 (9), 1212-1220 (2012).
- Bishop, J. A., et al. Detection of transcriptionally active high-risk HPV in patients with head and neck squamous cell carcinoma as visualized by a novel E6/E7 mRNA in situ hybridization method. Am. J. Surg. Pathol. 36 (12), 1874-1882 (2012).
- Schache AG, ., et al. Validation of a novel diagnostic standard in HPV-positive oropharyngeal squamous cell carcinoma. Br. J. Cancer. 108 (6), 1332-1339 (2013).
- Mehrad, M., et al. Papillary Squamous Cell Carcinoma of the Head and Neck: Clinicopathologic and Molecular Features With Special Reference to Human Papillomavirus. Am. J. Surg. Pathol. Jun. , (2013).
- Jordan, R. C., et al. Validation of methods for oropharyngeal cancer HPV status determination in US cooperative group trials. Am. J. Surg. Pathol. 36, 945-954 (2012).
- Hammond, M. E., et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer (unabridged version). Arch. Pathol. Lab. Med. 134 (7), 48-72 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。