需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
测量生活中的斑马鱼胚胎蛋白质稳定性使用荧光衰减光转化后(FDAP)
摘要
在细胞和组织中的蛋白水平通常紧紧蛋白质生产和清除的平衡调节。使用荧光衰减光转化(FDAP)后,蛋白质的间隙动力学可以通过实验在体内测量。
摘要
蛋白质稳定性影响生物学的许多方面,并测定蛋白质的清除动力学可以提供重要的见解的生物系统。在FDAP实验中,生物体内蛋白质的间隙可以被测量。感兴趣的蛋白质将被标上photoconvertible荧光蛋白,在体内表达和光转换,并降低在光转换信号随时间被监测。然后,数据被配备有适当的间隙模型,以确定该蛋白的半衰期。重要的是,蛋白群的有机体的不同区室的清除动力学可以分别通过施加房室掩模检查。这种方法已被用于斑马鱼发育期间,以确定细胞内和细胞外的半衰期分泌信号蛋白。在这里,我们描述了一种协议,用于FDAP实验在斑马鱼胚胎。它应该是可能使用FDAP确定的间隙动力学任何taggable蛋白在任何光学访问的有机体。
引言
蛋白质在细胞和生物体的水平由生产和清除它们的速率来确定。蛋白质的半衰期的范围可以从几分钟到几天1-4。在许多生物系统,关键蛋白的稳定或间隙对细胞活性有重要影响。所需的细胞周期进展5,6,发育信号7-9,细胞凋亡10,和正常功能和维持神经元11,12的细胞内蛋白质稳定性调制。胞外蛋白的稳定性影响的分布和分泌的蛋白质,如形态发生13,14的可用性,组织内。
在过去的几十年中,蛋白质稳定性已经主要在细胞培养用放射性脉冲标记或放线菌酮追踪实验15评估。在这样的脉冲追踪实验,将细胞或者瞬时暴露于一个"脉冲"放射性氨基的酸前体掺入到新合成的蛋白质,或它们暴露于放线菌酮,抑制蛋白质的合成。培养的细胞,然后在不同时间点收集,并且任一免疫沉淀,随后进行放射自显影(放射性脉冲追踪实验)或免疫印迹(在放线菌酮的实验)被用来量化蛋白质的间隙随时间。
常规的蛋白质稳定性试验有几个不足之处。首先,在这些测定蛋白质通常不表达在其内源性的环境中,而是在组织培养,有时在来自不同物种的细胞。对于蛋白质的稳定性是依赖于上下文的,这种方法是有问题的。其次,它是不可能跟随蛋白清除在个体细胞或生物体随着时间的推移,而从这些分析中的数据反映了在不同时间点的平均细胞的不同种群。由于单个细胞可能已经开始用不同量的蛋白质,也可能采取了放射性标记或酮在不同的时间,或可具有不同的间隙动力学,例如聚合数据可能是误导性的。最后,在放线菌酮的追踪实验的情况下,另外的蛋白质合成抑制剂的可能产生意想不到的生理效果,可以人为地改变蛋白质稳定性16-18。这些缺点,可避免使用荧光衰减后光转化(FDAP),其利用photoconvertible蛋白质来动态测量在活生物体19-25蛋白清除的技术(见讨论用于FDAP技术的限制)。
Photoconvertible蛋白的荧光蛋白的激发和发射特性暴露于光26特定波长后更改。一种常用的变体是Dendra2,"绿色到红色"photoconvertible蛋白最初具有前引文和发射性质类似于绿色荧光蛋白,但暴露于UV轻"光转化"后-其激发/发射性能变得类似于红色荧光蛋白23,27。重要的是,光转化后产生的新的蛋白质将不会有相同的激发/发射性质的光转换蛋白,允许生产和清除的经光转化解耦光转换蛋白质的仅一个池和观察。标记与photoconvertible蛋白兴趣蛋白质从而提供了一个方便的方法来进行脉冲标记蛋白在完整的,光学访问的活生物体。
在FDAP测定( 图1A)中,感兴趣的蛋白被标记为一个photoconvertible蛋白和表达在生物体( 图1B)。该融合蛋白是光转换,并降低在光转换信号随着时间的推移由fluorescen监视CE显微镜( 图1C)。然后,数据被装有合适的模型,以确定融合蛋白( 图1D)的半衰期。
此处所描述的测定法FDAP被设计在早期胚胎发育19来确定外半衰期在斑马鱼胚胎分泌信号蛋白。但是,这种方法可以适用于任何透明模型生物体容忍实时成像,并且可以被用于监控任何taggable胞内或胞外蛋白的清除。此处所描述的技术的变型中培养的细胞20,23和22 果蝇和小鼠胚胎21已被执行。
研究方案
1.生成Photoconvertible融合构建和注射Dechorionated斑马鱼胚胎
- 产生含有融合到绿色到红色photoconvertible蛋白(见讨论 )感兴趣的蛋白质的功能性构建体,然后用体外转录以产生mRNA的加帽的融合蛋白编码如米勒等人,2012 19。
- 用链霉蛋白酶,从约30斑马鱼胚胎取出chorions在单细胞阶段。另外,手动dechorionate使用镊子28胚胎。
注:胚胎必须dechorionated后续成像。如果需要的话,胚胎可以通过绒毛膜注入和dechorionated后,刚好在成像。- 使5毫克/毫升股票评级从灰色链霉菌标准斑马鱼胚胎中19解决方案链霉的。摇动溶液轻轻在RT 10分钟,以允许蛋白酶溶解。分装2米升成离心管并冷冻在-20℃。
- 转印单细胞阶段的胚胎含有〜8毫升胚胎培养基一直径5cm的玻璃或琼脂糖涂覆塑料培养皿中。加2ml的解冻链霉蛋白酶原液盘子在室温下孵育5至10分钟。
- 避免暴露胚胎空气或塑料,与这两种接触会导致胚胎dechorionated破裂。填充胚胎培养基的200毫升玻璃烧杯中。通过倾斜培养皿而淹没它在介质中传输的胚胎到烧杯中。
- 后胚胎已结算到烧杯的底部,倾出大部分胚胎培养基中,再倒入新鲜胚胎培养基放入烧杯。倒入烧杯中的介质的温和涡旋导致胚胎失去其削弱chorions。
- 重复步骤1.2.4。
- 使用玻璃巴斯德吸管用火烧尖转移dechorionated胚胎琼脂糖涂覆注射皿29。熊熊枪头防止伤害胚胎的锯齿状边缘。
- 联合注入的mRNA和3 kDa的Alexa488葡聚糖结合29,30( 图1B;见讨论的建议mRNA和Alexa488葡聚糖金额)。直接注射到细胞中(未蛋黄)的中心,以确保均匀分布的mRNA和荧光染料一次切割开始。
注意:Alexa488信号将在数据分析期间被用来产生房室掩模,以便细胞内和细胞外荧光之间进行区分。 - 转印注射的胚胎至6孔塑料培养皿填充胚胎培养基的1-2%琼脂糖覆盖的孔。在28℃孵育在黑暗中直到胚胎已达到晚期阶段球体31(大约5小时受精后)。检查胚胎每到一地2小时在立体显微镜下,并删除了已死亡的胚胎产生的任何碎片。
2.安装斑马鱼胚胎的Photoconversion和成像上的倒置共聚焦显微镜
- 使用立体显微镜来确定一到五个健康的胚胎,并使用玻璃巴斯德吸管用火烧尖从菜中删除。
- 轻轻弹出胚胎成包含在1×Danieau的胚胎培养基〜1毫升熔化1%低熔点琼脂糖的微量离心管(参见材料列表)( 图2A)。
注意:琼脂糖应该有40和42℃之间的温度下较高的温度可能会损坏胚胎。 - 绘制胚胎放回吸管连同一些琼脂糖。轻轻弹出琼脂糖和胚胎到玻璃底培养皿( 图2B)的盖玻璃。确保玻璃盖的厚度与在共聚焦显微镜的物镜相兼容。
- 如果需要的话重新使用玻璃吸管。清洗残留琼脂糖出吸管和防止堵塞,迅速吸管胚胎介质向上和向下。放置一个15毫升的管中填充有〜5毫升胚胎培养基旁立体显微镜用于此目的。
- 使用金属探测器来定位的胚胎,使动物极(胚盘)朝向护罩玻璃。工作迅速,因为琼脂糖将在20-30秒凝固。利用体视显微镜监测胚胎的位置,并根据需要,直到琼脂糖变硬调整。
- 直到胚胎的期望数量的已被安装重复步骤2.1-2.4。
注:在一个典型的实验中,包含每个四五个胚胎4琼脂糖滴就会很容易地适应于玻璃盖。约16个胚胎可以在一个单一的理想实验( 图2C)进行成像。 - 当琼脂糖已经凝固,充满1X Danieau的胚胎中的玻璃底菜。
3. Photoconverting和测量光转换信号的减少
一个25X或40X水的目标,我š适合的尺寸和斑马鱼的胚胎的折射率。最好是使用浸油具有相同的折射率的水,而不是实际的水,因为水将五小时实验过程中蒸发。确保浸没油被设计成用与水(未油)目标使用。
- 放置在目标一大滴浸油的,以确保目标和盖玻璃之间的油膜不会打破作为台移动到不同的位置胚胎成像期间。安全地将玻璃底菜搬上舞台,这样的菜会不会当台移动转移。如果可能的话,使用加热阶段,在28°C,对于斑马鱼发育的最佳温度。
- 定义在激光共聚焦显微镜的软件包每个胚胎的位置。调整的z深度为每个胚,并尝试大致定位在同一平面中的每个胚胎。
注:约30微米的动物极是一展身手因为在这个深度,可避免胚胎的包封层外径深度,成像区被最大化,并且光散射极小。单个光学切片的厚度为〜3.3微米的提供足够的数据;没有必要取得的z栈(见第5章)。 - 在实验期间收集的两个信号:从Alexa488葡聚糖的"绿色"信号共轭,这将在数据分析期间用于分离细胞外和细胞内的荧光,并从该融合蛋白的"红色"信号,它是光转换之后。
- 激发Alexa488采用488 nm激光,并收集〜500和540纳米之间发出荧光。注意:光转化后,许多绿色到红色photoconvertible蛋白( 如 ,Dendra2)可兴奋与543 nm激光和发射之间〜550和650纳米的荧光。根据需要基于所使用的photoconvertible蛋白调节。
- 获得"预光转化"图像,并配置了共焦显微镜的软件将图像的每一个先前定义的位置(来自步骤3.2)与合适的成像条件的每10或20分钟为五个小时的时间过程(参见第5和 讨论)。
- 到photoconvert融合蛋白,切换到10X物镜和暴露胚基于UV光从汞弧光灯在100%的输出一〜300-400 nm的激发滤光片2分钟。移沿z轴,以促进均匀的光转化(见第5)的焦点。确保浸没油不经光期间滴到10倍的目标。
注意:聚焦的光转化过程中的换档可以以避免实验者间变异性是自动的。 - 光转化后,立即切换回25X 40X或目标。确保从步骤3.2以前定义的位置仍然是准确的。如果菜photoconv期间转移版为,重新定义了胚胎的位置。
- 开始在步骤3.4中创建的程序,并允许成像继续5小时。注意光转化和成像的开端每个胚胎之间的时间间隔。
- 偶尔检查试验。监视Danieau的介质的水平并在必要时添加更多。重新启动软件,如果它已经停滞。
- 为了确定将在数据分析期间被用来估算一个指数递减模型的渐近线的背景荧光值,包括一些胚胎已经注射了Alexa488葡聚糖而不是mRNA水平的实验。以确定仪器噪声,这也将在随后的数据分析中使用,取得图像在没有样品的。
4.分析使用PyFDAP数据
- 目视检查从每个胚胎的时间过程的数据集。从胚胎IMAG期间死亡丢弃的数据集ING,即显著移,具有光转换信号的非常低的水平,或包含细胞,看起来不寻常的,并已停止移动并除以(典型受伤或生病的胚胎)的区域。
注意:有时候,气泡在浸油或其他工件中会出现的一个或两个图像在另外可用的数据集。需要注意的是含有文物的任何图像;它们将在后丢弃,并且从这样的数据组的剩余时间点仍可以进行分析。 - 使用基于Python的软件包PyFDAP分析FDAP数据。 PyFDAP通过确定在每个图像的平均的细胞内和细胞外的红色荧光强度,并与一个指数递减函数56( 图3)拟合数据计算半衰期。
- 下载PyFDAP(见 材料清单)。
- 使用PyFDAP分离细胞内和细胞外光转换信号( 图3A,B)。我们e本Alexa488信号,它是严格的细胞内,以创建一个细胞内面膜。将此面膜相应的红色通道图像,以防止细胞内的像素从平均计算外强度时,正在考虑中。测定平均细胞内强度,反转掩码。
- 在PyFDAP,显示在步骤4.2.2产生的遮蔽图像。目视检查这些图像和丢弃的数据集,其中掩模不准确区分从细胞外空间内(这应该是罕见的;请注意,细胞膜被包括在其中的细胞外空间已掩蔽的图像,但它们可以通过改变阈值来去除算法或通过引入膜掩模( 例如 ,使用膜-CFP))。也放弃含工件( 如泡在浸油)在步骤4.1确定任何单一的图像。
- 使用PyFDAP计算平均细胞外和细胞内的荧光强度的EACħ形象。 PyFDAP和总结,通过像素相加的总数落在掩模和分割外的像素的强度计算这些平均值。
- 适合的荧光数据( 图3C)用下面的指数函数:
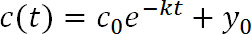
其中,t为时间后的光转化,C(t)是在t的给定值的强度,C 0是强度在t = 0,k为清除速率常数,而y 0是该函数接近荧光的渐近线降低( 图1D)。ÿ0可以基于在步骤3.8 19的测量来约束。 - 使用PyFDAP来计算使用以下的关系清除率常数(k)的胞外和胞内蛋白质的半衰期(τ):

5.控制实验,以评估漂白,不慎光转化,及经光均匀度
- 评估漂白
注意:漂白可能导致的荧光强度反映荧光蛋白除了感兴趣的蛋白质的间隙的漂白性能的人为的降低。- 为了评估可能的漂白,执行一组FDAP实验成像和第二组与成像之间20分钟间隔( 图4)之间10分钟间隔。如在第4节中所述分析来自两组使用PyFDAP实验的数据。
- 比较半衰期从10分钟和20分钟间隔的实验。半衰期较长,从20分钟的间隔实验表明显著漂白。如果半衰期从两个实验是相同的,辐透obleaching不是显著关注。
- 另外,评估由光转化后,立即取得了一系列〜30幅漂白。荧光强度显著降低表明显著漂白。
- 如果漂白检测,使用较低的激光功率,减少成像时间,或者考虑使用更耐光photoconvertible蛋白32。
- 评估不慎光转化。
注:Dendra2可以使用488纳米照明27光转换。当激动人心Alexa488与488纳米激光在步骤3.3.1,无意光转化并且因此一个人为的增加目的蛋白质的表观半衰期描述是可能的。然而,我们和其他人33人已经发现488纳米的照明光转化在斑马鱼胚胎的低效方法。- 使用步骤5.1.1中描述的对照实验来检测意外的光转化。比较半衰期从10分钟和20分钟间隔的实验。半衰期较短,从20分钟的间隔实验表明显著不慎光转化。如果半衰期从两个实验是相同的,无意光转化不是显著关注。
- 如果不慎光转化检测,使用较低的488nm的激光功率和更短的成像时间,以避免无意中photoconverting Dendra2。
- 评估光转化均匀。
注意:如果光转化偏向胚胎的动物极,在荧光的降低将通过蛋白扩散或小区移动到更深的平面( 图5A)的影响。- 以确定光转化是否是均匀的,表达分泌photoconvertible蛋白(用于与胞外融合蛋白的实验)或细胞质photoconvertible蛋白(对于实验与胞内融合蛋白)。 Photoconvert像往常一样,T母鸡获取Z堆叠包围大部分的胚盘的每20分钟80分钟。
- 如果光转化偏向动物极,在更深的平面上的荧光强度将随时间增加,由于扩散或细胞的运动( 图5B)。光转化过程中,如果非均匀光转化检测,着眼更深的胚胎。
结果
FDAP已被用来确定在斑马鱼胚胎19的半衰期外信号蛋白。胚胎34时其中的一个蛋白质,斜视,诱导mesendodermal基因的表达。斜视Dendra2激活mesendodermal基因的表达,在类似的未标记斜视的水平,就证明了定量RT-PCR和原位杂交检测19。胚胎被共注射Alexa488葡聚糖和mRNA编码斜视-Dendra2并经受FDAP测定。在细胞外光转换的信号强度的降低随时间是明显的( 图4A)。使用...
讨论
一个FDAP实验的成功依赖于官能photoconvertible融合蛋白的产生。标记的蛋白质可以影响其生物活性和/或生物物理特性,包括其局部化,溶解性和稳定性36-41。准备测试,以几个不同的融合构建活动找到一个处于活动状态。我们已发现,改变的蛋白相对于所感兴趣的蛋白的photoconvertible的位置或使用更长的接头( 例如 ,使用的氨基酸序列LGDPPVAT 19)可增强融合蛋白的活性。在信?...
披露声明
作者没有冲突披露。
致谢
笔者想感谢杰弗里·法雷尔,詹姆斯加格农和詹妮弗伯格曼对稿件的意见。 KWR是在FDAP法的发展过程中得到了国家科学基金会研究生研究奖学金计划。这项工作是由美国国立卫生研究院,以AFS赠款和由德国研究基金会(埃米诺特计划),马普学会和人类前沿科学计划(职业发展奖),以PM资助。
材料
| Name | Company | Catalog Number | Comments |
| PyFDAP (download from the following website: http://people.tuebingen.mpg.de/mueller-lab) | Install and operate using the instructions provided on the PyFDAP website; PyFDAP is compatible with Linux, Mac, and Windows operating systems. | ||
| mMessage mMachine Sp6 Transcription Kit | Life Technologies | AM1340 | To generate capped mRNA for injection into embryos |
| Alexa488-dextran conjugate, 3 kDa | Life Technologies | D34682 | Co-inject with mRNA to create intracellular and extracellular masks |
| 6-well plastic dish | BD Falcon | Incubate embryos in agarose-coated wells until ready for mounting | |
| Embryo medium | 250 mg/L Instant Ocean salt, 1 mg/L methylene blue in reverse osmosis water adjusted to pH 7 with NaHCO3 | ||
| Protease from Streptomyces griseus | Sigma | P5147 | Make a 5 mg/ml stock and use at 1 mg/ml to dechorionate embryos at the one-cell stage |
| 5 cm diameter glass Petri dish | For embryo dechorionation | ||
| 200 ml glass beaker | For embryo dechorionation | ||
| Microinjection apparatus | For injection of mRNA and dye into embryos at the one-cell stage | ||
| Stereomicroscope | For injecting and mounting embryos | ||
| 1x Danieau's medium | Dilute low melting point agarose and perform imaging in this medium; recipe: 0.2 mm filtered solution of 58 mM NaCl, 0.7 mM KCl, 0.4 mM MgSO4, 0.3 mM CaCl2, 5 mM HEPES pH 7.2 | ||
| UltraPure low melting point agarose | Invitrogen | 16520-100 | For mounting embryos; use at a concentration of 1% in Danieau's medium: add 200 mg to 20 ml Danieau's medium, microwave until dissolved, then aliquot 1 ml into microcentrifuge tubes; aliquots can be stored at 4 °C, re-melted at 70 °C, and cooled to 40–42 °C when ready to use |
| Glass Pasteur pipette | Kimble Chase (via Fisher) | 63A53WT | For mounting embryos; flame the tip to prevent jagged edges from injuring embryos |
| Metal probe | For positioning embryos during mounting | ||
| Glass bottom dishes | MatTek | P35G-1.5-14-C | Use the appropriate cover glass thickness for your objective; part number listed here is for cover glass No. 1.5 |
| 15 ml tube filled with ~5 ml embryo medium | BD Falcon | For rinsing residual agarose from the Pasteur pipette | |
| Inverted laser scanning confocal microscope | A mercury arc lamp, 488 nm laser, 543 nm laser, and the appropriate filter sets are required | ||
| Heated stage | To maintain embryos at the optimal temperature of 28 °C during the experiment | ||
| Confocal software capable of time-lapse imaging | Must be able to define multiple positions and automatically image them at defined intervals | ||
| 25X or 40X water objective | Objective for imaging | ||
| 10X air objective | Objective for photoconversion | ||
| Immersion oil | Immersion oil with the same refractive index as water |
参考文献
- Schwanhäusser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Boisvert, F. M., et al. A Quantitative Spatial Proteomics Analysis of Proteome Turnover in Human Cells. Molecular & Cellular Proteomics. 11 (3), 011429 (2012).
- Belle, A., Tanay, A., Bitincka, L., Shamir, R., O'Shea, E. K. Quantification of protein half-lives in the budding yeast proteome. Proceedings of the National Academy of Sciences of the United States of America. 103 (35), 13004-13009 (2006).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764-768 (2011).
- Parry, D. H., O'Farrell, P. H. The schedule of destruction of three mitotic cyclins can dictate the timing of events during exit from mitosis. Current Biology. 11 (9), 671-683 (2001).
- Holloway, S. L., Glotzer, M., King, R. W., Murray, A. W. Anaphase is initiated by proteolysis rather than by the inactivation of maturation-promoting factor. Cell. 73 (7), 1393-1402 (1993).
- Dharmasiri, N., Estelle, M. Auxin signaling and regulated protein degradation. Trends Plant Sci. 9 (6), 302-308 (2004).
- MacDonald, B. T., Tamai, K., He, X. Wnt/beta-catenin signaling: components, mechanisms, and diseases. Developmental Cell. 17 (1), 9-26 (2009).
- Chen, X., et al. Processing and turnover of the Hedgehog protein in the endoplasmic reticulum. The Journal of Cell Biology. 192 (5), 825-838 (2011).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Yi, J. J., Ehlers, M. D. Emerging Roles for Ubiquitin and Protein Degradation in Neuronal Function. Pharmacological Reviews. 59 (1), 14-39 (2007).
- Rubinsztein, D. C. The roles of intracellular protein-degradation pathways in neurodegeneration. Nature. 443 (7113), 780-786 (2006).
- Müller, P., Schier, A. F. Extracellular Movement of Signaling Molecules. Developmental Cell. 21 (1), 145-158 (2011).
- Eldar, A., Rosin, D., Shilo, B. -. Z., Barkai, N. Self-enhanced ligand degradation underlies robustness of morphogen gradients. Developmental Cell. 5 (4), 635-646 (2003).
- Zhou, P. Determining protein half-lives. Methods In Molecular Biology. 284, 67-77 (2004).
- Woodside, K. H. Effects of cycloheximide on protein degradation and gluconeogenesis in the perfused rat liver. Biochim Biophys Acta. 421 (1), 70-79 (1976).
- Schimke, R. T., Doyle, D. Control of enzyme levels in animal tissues. Annual Review of Biochemistry. 39, 929-976 (1970).
- Kenney, F. T. Turnover of rat liver tyrosine transaminase: stabilization after inhibition of protein synthesis. Science. 156 (3774), 525-528 (1967).
- Müller, P., et al. Differential Diffusivity of Nodal and Lefty Underlies a Reaction-Diffusion Patterning System. Science. 336 (6082), 721-724 (2012).
- Kiuchi, T., Nagai, T., Ohashi, K., Mizuno, K. Measurements of spatiotemporal changes in G-actin concentration reveal its effect on stimulus-induced actin assembly and lamellipodium extension. The Journal of Cell Biology. 193 (2), 365-380 (2011).
- Plachta, N., Bollenbach, T., Pease, S., Fraser, S. E., Pantazis, P. Oct4 kinetics predict cell lineage patterning in the early mammalian embryo. Nature Cell Biology. 13 (2), 17-123 (2011).
- Drocco, J. A., Grimm, O., Tank, D. W., Wieschaus, E. Measurement and Perturbation of Morphogen Lifetime: Effects on Gradient Shape. Biophys J. 101 (8), 1807-1815 (2011).
- Zhang, L., et al. Method for real-time monitoring of protein degradation at the single cell level. BioTechniques. 42 (4), 446-450 (2007).
- Miyawaki, A. Proteins on the move: insights gained from fluorescent protein technologies. Nat Rev Mol Cell Biol. 12 (10), 636-668 (2011).
- Pantazis, P., Supatto, W. Advances in whole-embryo imaging: a quantitative transition is underway. Nat Rev Mol Cell Biol. 15 (5), 327-339 (2014).
- Lukyanov, K. A., Chudakov, D. M., Lukyanov, S., Verkhusha, V. V. Innovation: Photoactivatable fluorescent proteins. Nat Rev Mol Cell Biol. 6 (11), 885-891 (2005).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nature Biotechnology. 24 (4), 461-465 (2006).
- Zou, J., Wei, X. Transplantation of GFP-expressing Blastomeres for Live Imaging of Retinal and Brain Development in Chimeric Zebrafish Embryos. Journal of Visualized Experiments. (41), (2010).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. Journal of Visualized Experiments. (27), (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. Journal of Visualized Experiments. (25), (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), (1995).
- McKinney, S. A., Murphy, C. S., Hazelwood, K. L., Davidson, M. W., Looger, L. L. A bright and photostable photoconvertible fluorescent protein. Nature Methods. 6 (2), 131-133 (2009).
- Dempsey, W. P., Qin, H., Pantazis, P. In Vivo Cell Tracking Using PhOTO Zebrafish. Methods in Molecular Biology. 1148, 217-228 (2014).
- Schier, A. F. Nodal Morphogens). Cold Spring Harbor Perspectives in Biology. 1 (5), a003459-a003459 (2009).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans Syst Man Cybern. 9 (1), 62-66 (1979).
- Pédelacq, J. -. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nature Biotechnology. 24 (1), 79-88 (2005).
- Swulius, M. T., Jensen, G. J. The Helical MreB Cytoskeleton in Escherichia coli MC1000/pLE7 Is an Artifact of the N-Terminal Yellow Fluorescent Protein Tag. Journal of Bacteriology. 194 (23), 6382-6386 (2012).
- Landgraf, D., Okumus, B., Chien, P., Baker, T. A., Paulsson, J. Segregation of molecules at cell division reveals native protein localization. Nature Methods. 9 (5), 480-482 (2012).
- Stadler, C., et al. Immunofluorescence and fluorescent-protein tagging show high correlation for protein localization in mammalian cells. Nature Methods. 10 (4), 315-323 (2013).
- Quattrocchio, F. M., Spelt, C., Koes, R. Transgenes and protein localization: myths and legends. Trends Plant Sci. 18 (9), 473-476 (2013).
- Morimoto, Y. V., Kojima, S., Namba, K., Minamino, T. M153R Mutation in a pH-Sensitive Green Fluorescent Protein Stabilizes Its Fusion Proteins. PLoS ONE. 6 (5), e19598 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Waters, J. C. Accuracy and precision in quantitative fluorescence microscopy. The Journal of Cell Biology. 185 (7), 1135-1148 (2009).
- Moll, U. M., Petrenko, O. The MDM2-p53 interaction. Mol Cancer Res. 1 (14), 1001-1008 (2003).
- Auer, T. O., Duroure, K., De Cian, A., Concordet, J. P., Del Bene, F. Highly efficient CRISPR/Cas9-mediated knock-in in zebrafish by homology-independent DNA repair. Genome Research. 24 (1), 142-153 (2014).
- Bedell, V. M., et al. In vivo genome editing using a high-efficiency TALEN system. Nature. 491 (7422), 114-118 (2012).
- Hruscha, A., et al. Efficient CRISPR/Cas9 genome editing with low off-target effects in zebrafish. Development. 140 (24), 4982-2987 (2013).
- Hwang, W. Y., et al. Heritable and Precise Zebrafish Genome Editing Using a CRISPR-Cas System. PLoS ONE. 8 (7), 68708 (2013).
- Hwang, W. Y., et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nature Biotechnology. 31 (3), 227-229 (2013).
- Zu, Y., et al. TALEN-mediated precise genome modification by homologous recombination in zebrafish. Nature Methods. 10 (4), 329-331 (2013).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of Zebrafish Early Embryonic Development by Scanned Light Sheet Microscopy. Science. 322 (5904), 1064-1069 (2008).
- Blanchet, M. H., et al. Cripto Localizes Nodal at the Limiting Membrane of Early Endosomes. Science Signaling. 1 (45), ra13-ra13 (2008).
- Jullien, J., Gurdon, J. Morphogen gradient interpretation by a regulated trafficking step during ligand-receptor transduction. Genes & Development. 19 (22), 2682-2694 (2005).
- Incardona, J. P., et al. Receptor-mediated endocytosis of soluble and membrane-tethered Sonic hedgehog by Patched-1. Proceedings of the National Academy of Sciences of the United States of America. 97 (22), 12044-12049 (2000).
- Scholpp, S., Brand, M. Endocytosis Controls Spreading and Effective Signaling Range of Fgf8 Protein. Current Biology. 14 (20), 1834-1841 (2004).
- Bläßle, A., Müller, P. . PyFDAP: Automated analysis of Fluorescence Decay After Photoconversion (FDAP) experiments. Bioinformatics. In Press, (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。