È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurare Protein Stabilità in Living embrioni di zebrafish Usando fluorescenza Decay Dopo Fotoconversione (FDAP)
In questo articolo
Riepilogo
I livelli di proteine nelle cellule e tessuti sono spesso strettamente regolati dal saldo della produzione di proteine e di liquidazione. Usando fluorescenza Decay Dopo Fotoconversione (FDAP), la cinetica di clearance di proteine possono essere sperimentalmente misurati in vivo.
Abstract
Stabilità della proteina influenza molti aspetti della biologia, e misurando la cinetica di clearance di proteine in grado di fornire importanti informazioni nei sistemi biologici. In esperimenti FDAP, la clearance di proteine negli organismi viventi può essere misurata. Una proteina di interesse è etichettato con una proteina fluorescente fotoconvertibile, espresso in vivo e photoconverted, e la diminuzione del segnale di photoconverted nel tempo è monitorato. I dati vengono poi dotata di un modello di clearance appropriato per determinare la proteina emivita. È importante sottolineare che la cinetica di clearance delle popolazioni di proteine in diversi comparti dell'organismo possono essere esaminati separatamente applicando maschere compartimentali. Questo approccio è stato utilizzato per determinare l'emivita intra- ed extracellulari di proteine di segnalazione secrete durante lo sviluppo zebrafish. Qui, descriviamo un protocollo per la sperimentazione FDAP in embrioni di zebrafish. Dovrebbe essere possibile utilizzare FDAP per determinare la cinetica di liquidazioneogni proteina oggetto di tag in ogni organismo otticamente accessibile.
Introduzione
I livelli di proteine nelle cellule ed organismi sono determinati dalla loro tassi di produzione e passaggio. Protein dimezzamento possono variare da minuti a giorni 1-4. In molti sistemi biologici, la stabilizzazione o liquidazione di proteine chiave ha effetti importanti sulla attività cellulare. È necessaria modulazione di stabilità proteina intracellulare per la progressione del ciclo cellulare 5,6, segnalazione di sviluppo 7-9, apoptosi 10, e la funzione normale e la manutenzione dei neuroni 11,12. Stabilità della proteina extracellulare influenza la distribuzione e la disponibilità di proteine secrete, come morphogens 13,14, all'interno di un tessuto.
Negli ultimi decenni, la stabilità della proteina è stata valutata principalmente in coltura cellulare utilizzando radioattivo pulse-etichettatura o esperimenti chase cicloesimide 15. In tali esperimenti pulse-chase, le cellule sono o transitoriamente esposti ad un "impulso" di amino radioattiviprecursori di acidi che sono incorporati in proteine di nuova sintesi, o sono esposti a cicloesimide, che inibisce la sintesi proteica. Cellule coltivate vengono poi raccolti in diversi momenti, e sia immunoprecipitazione seguita da autoradiografia (in radioattive esperimenti pulse-chase) o occidentale assorbente (in esperimenti cicloesimide) viene utilizzato per quantificare il gioco di proteine nel corso del tempo.
Test di stabilità proteica convenzionali hanno diverse lacune. Innanzitutto, proteine in questi saggi sono spesso non espressi in loro ambienti endogeni, ma piuttosto in coltura tissutale e talvolta in cellule di specie diverse. Per proteine la cui stabilità è dipendente dal contesto, questo approccio è problematico. In secondo luogo, non è possibile seguire la clearance proteine in singole cellule o organismi nel tempo, ed i dati da questi saggi riflette una media delle diverse popolazioni di cellule a tempi diversi. Poiché le cellule individuali possono avere iniziatocon diverse quantità di proteine, potrebbe aver preso l'etichetta o cicloesimmide radioattivo in tempi diversi, o può avere diverse cinetiche di liquidazione, tali dati aggregati potrebbero essere fuorvianti. Infine, nel caso di esperimenti chase cicloeximide, aggiunta del inibitore della sintesi proteica può avere effetti fisiologici indesiderati che potrebbero alterare artificialmente stabilità proteica 16-18. Queste carenze possono essere evitati utilizzando fluorescenza Decay Dopo Fotoconversione (FDAP), una tecnica che utilizza le proteine fotoconvertibile per misurare il gioco di proteine in modo dinamico in organismi viventi 19-25 (vedi la discussione per le limitazioni della tecnica FDAP).
Proteine fotoconvertibile sono proteine fluorescenti la cui eccitazione e di emissione di proprietà cambiare dopo l'esposizione a specifiche lunghezze d'onda della luce 26. Una variante comunemente usata è Dendra2, una proteina fotoconvertibile "green-to-rossa", che ha inizialmente excitazioni ed emissione proprietà simili alle proteine fluorescenti verdi, ma dopo l'esposizione a "fotoconversione" UV light- -il eccitazione / proprietà di emissione diventano simili a quelle delle proteine fluorescenti rosse 23,27. È importante sottolineare che, nuova proteina prodotta dopo fotoconversione non avrà le stesse proprietà di eccitazione / emissione come la proteina photoconverted, permettendo disaccoppiamento della produzione e la clearance su fotoconversione e l'osservazione di solo un pool di proteine photoconverted. Tagging proteine di interesse con le proteine fotoconvertibile fornisce quindi un modo conveniente per impulsi-label proteine intatte, organismi viventi otticamente accessibili.
In saggi FDAP (Figura 1A), una proteina di interesse è etichettato con una proteina fotoconvertibile ed espressa in un organismo vivente (Figura 1B). La proteina di fusione è photoconverted, e la diminuzione del segnale photoconverted nel tempo è monitorato da fluorescenmicroscopia ce (Figura 1C). I dati vengono poi dotato di un modello appropriato per determinare l'emivita della proteina di fusione (Figura 1D).
Il test FDAP qui descritto è stato progettato per determinare l'emivita extracellulari di proteine di segnalazione secrete in embrioni di zebrafish durante la prima embriogenesi 19. Tuttavia, questo approccio può essere adattato a qualsiasi organismo modello trasparente che tollera imaging dal vivo, e potrebbe essere usato per monitorare il passaggio di qualsiasi proteina intracellulare o extracellulare oggetto di tag. Variazioni della tecnica qui descritta sono stati effettuati in cellule in coltura 20,23 e 22 Drosophila e topo di 21 embrioni.
Protocollo
1. Creazione di un fotoconvertibile Fusion Costruire e Iniettare dechorionated embrioni di zebrafish
- Generare un costrutto funzionale contenente la proteina di interesse fusa ad una proteina fotoconvertibile verde a rosso (vedi Discussione), quindi utilizzare la trascrizione in vitro per generare capped mRNA codificante la proteina di fusione come nel Müller et al., 2012 19.
- Utilizzare pronasi per rimuovere le chorions da circa 30 embrioni di zebrafish allo stadio unicellulare. In alternativa, dechorionate manualmente embrioni usando pinze 28.
Nota: Gli embrioni devono essere dechorionated per l'imaging successiva. Se lo si desidera, gli embrioni possono essere iniettati attraverso il corion e dechorionated più tardi, appena prima di imaging.- Fare un / soluzione madre ml 5 mg di pronasi da Streptomyces griseus nello standard medio embrione zebrafish 19. Rock the soluzione lentamente a temperatura ambiente per 10 minuti per consentire la proteasi a sciogliere. Aliquota 2 ml in microprovette e congelare a -20 ° C.
- Trasferimento stadio unicellulare embrioni ad un vetro del diametro di 5 cm di plastica scatola di Petri agarosio rivestite contenente ~ 8 ml di mezzo embrione. Aggiungere 2 ml di soluzione di scongelata pronasi magazzino al piatto e incubare a RT per 5 a 10 min.
- Evitare di esporre embrioni all'aria o di plastica, come il contatto sia con causerà embrioni dechorionated rottura. Riempire un bicchiere di vetro da 200 ml con media embrione. Trasferire gli embrioni al becher inclinando la piastra di Petri mentre immergendo nel mezzo.
- Dopo gli embrioni sono depositata sul fondo del bicchiere, versare la maggior parte del mezzo dell'embrione, quindi versare mezzo embrione fresco nel bicchiere. Il vorticoso delicato del mezzo versare nel bicchiere fa embrioni perdono le loro chorions indeboliti.
- Ripetere il punto 1.2.4.
- Trasferire gli embrioni dechorionated ad un'iniezione piatto agarosio rivestite 29 con un bicchiere pipetta Pasteur con una punta fiammata. Fiammeggianteil puntale impedisce bordi frastagliati da embrioni feriti.
- Co-iniettare il mRNA e 3 kDa Alexa488-destrano coniugato 29,30 (Figura 1B, vedere Consigli per suggerito mRNA e quantità Alexa488-destrano). Iniettare direttamente al centro della cella (non il tuorlo) per assicurare una distribuzione uniforme del mRNA e colorante fluorescente volta clivaggio inizio.
Nota: Il segnale Alexa488 verrà utilizzato durante l'analisi dei dati per generare maschere compartimentali per distinguere tra intracellulare e fluorescenza extracellulare. - Trasferimento embrioni iniettati ad un agarosio rivestite bene di un piatto a sei ben plastica pieno di media embrione 1-2%. Incubare al buio a 28 ° C fino a quando gli embrioni hanno raggiunto la fase sfera tardi 31 (circa 5 ore dopo la fecondazione). Controllare embrioni ognuno di 2 ore allo stereomicroscopio e rimuovere eventuali detriti generati da embrioni che sono morti.
2. Montaggio embrioni di zebrafish per Photoconversion e imaging su un invertito confocale microscopio
- Utilizzare uno stereomicroscopio per identificare 1-5 embrioni sani, e utilizzare una pipetta Pasteur di vetro con una punta fiammata per rimuoverli dal piatto.
- Espellere delicatamente gli embrioni in una provetta contenente ~ 1 ml di fuso 1% a basso punto di fusione agarosio in mezzo embrione di 1x Danieau (vedi Materiali List) (Figura 2A).
Nota: agarosio deve avere una temperatura compresa tra 40 e 42 ° C; temperature più elevate potrebbero danneggiare gli embrioni. - Disegnare gli embrioni di nuovo nella pipetta insieme ad alcuni agarosio. Estrarre delicatamente l'agarosio ed embrioni sul vetro di copertura di un piatto fondo di vetro (Figura 2B). Assicurarsi che lo spessore del vetro di copertura è compatibile con l'obiettivo del microscopio confocale.
- Riutilizzare la pipetta di vetro se lo si desidera. Per pulire l'agarosio residua dalla pipetta e prevenire l'intasamento, rapidamente medio embrione pipetta su e giù.Inserire un tubo 15 ml riempito con ~ 5 ml di terreno dell'embrione accanto alla stereomicroscopio a questo scopo.
- Utilizzare una sonda di metallo per posizionare gli embrioni in modo che il polo animale (blastoderma) rivolto verso il vetro di copertura. Lavorare velocemente dal momento che l'agarosio si solidifica in 20-30 sec. Utilizzare lo stereomicroscopio di monitorare le posizioni degli embrioni e regolare, se necessario, fino a quando l'agarosio si indurisce.
- Ripetere i passaggi 2,1-2,4 fino è stato montato il numero desiderato di embrioni.
Nota: In un tipico esperimento, quattro gocce di agarosio contenente quattro o cinque embrioni ciascuno si adatta facilmente sul vetro di copertura. Circa 16 gli embrioni possono essere esposte in un singolo esperimento ideale (Figura 2C). - Quando l'agarosio si è solidificato, riempire il piatto di vetro-basso con media embrione di 1x Danieau.
3. Photoconverting e misurando la diminuzione del segnale Photoconverted
Un obiettivo 25X o 40X acqua is appropriato per la dimensione e l'indice di rifrazione di embrioni di zebrafish. È meglio usare olio per immersione con lo stesso indice di rifrazione acqua piuttosto che acqua reale, poiché l'acqua evapora durante il corso dell'esperimento cinque ore. Assicurarsi che l'olio di immersione è stato progettato per essere utilizzato con un acqua (non olio) obiettivo.
- Mettere un grande goccia di olio per immersione sull'obiettivo di garantire che il film d'olio tra l'obiettivo e il vetro di copertura non si romperà come stadio si sposta diverse posizioni dell'embrione durante l'imaging. Saldamente posizionare il piatto fondo di vetro sul palco in modo che il piatto non si sposterà quando il palco si muove. Se possibile, utilizzare una fase riscaldata a 28 ° C, la temperatura ottimale per lo sviluppo zebrafish.
- Definire la posizione di ogni embrione nel pacchetto software del microscopio confocale. Regolare la z approfondito per ogni embrione, e tentare di indirizzare o meno sullo stesso piano in ogni embrione.
Nota: A proposito di 30 micron dal polo animale è un andareod profondità poiché a questa profondità dello strato avvolgente dell'embrione può essere evitato, area di esposizione è massimizzata, e diffusione della luce è minima. Una singola fetta ottico con uno spessore di ~ 3,3 micron fornisce dati sufficienti; non vi è alcuna necessità di acquisire una z-stack (vedi sezione 5). - Raccogliere due segnali durante l'esperimento: il segnale "verde" dal Alexa488-destrano coniugato-che verrà utilizzata durante l'analisi dei dati per isolare extracellulare e intracellulare fluorescenza e il segnale "rosso" dalla proteina di fusione dopo che è photoconverted.
- Excite Alexa488 utilizzando un laser 488 nm, e raccogliere la fluorescenza emessa tra ~ 500 e 540 nm. Nota: Dopo la fotoconversione, molti verde a rosso proteine fotoconvertibile (ad esempio, Dendra2) può essere eccitato con un laser 543 nm ed emettono fluorescenza tra ~ 550 e 650 nm. Regolare, se necessario, sulla base di proteina fotoconvertibile utilizzato.
- Acquisire "pre-fotoconversione"Le immagini, e configurare il software del microscopio confocale a immagine ciascuna delle posizioni definite in precedenza (dal punto 3.2) con le condizioni di imaging appropriate ogni 10 o 20 minuti per un corso di tempo di cinque ore (vedi sezione 5 e Discussione).
- Per photoconvert la proteina di fusione, passare a un obiettivo 10X ed esporre gruppi di embrioni a luce UV da una lampada a vapori di mercurio con un filtro ~ 300-400 nm di eccitazione in uscita 100% per 2 min. Spostare l'attenzione lungo l'asse z per promuovere fotoconversione uniforme (vedi sezione 5). Assicurarsi che l'olio di immersione non cola sulla obiettivo 10x durante fotoconversione.
Nota: Lo spostamento di fuoco durante fotoconversione può essere automatizzato per evitare variabilità tra sperimentatori. - Tornare alla dell'obiettivo 25X o 40X immediatamente dopo fotoconversione. Assicurarsi che le posizioni precedentemente definite dal punto 3.2 sono ancora accurate. Se il piatto spostato durante photoconversion, ri-definire le posizioni degli embrioni.
- Avviare il programma creato nel passaggio 3.4 e permette l'imaging proseguire per 5 ore. Nota il tempo trascorso tra fotoconversione e l'inizio delle immagini per ogni embrione.
- Controllare di tanto in tanto l'esperimento. Monitorare il livello di supporto di Danieau e aggiungere più se necessario. Riavviare il software se è in fase di stallo.
- Per determinare i valori di fluorescenza di fondo che verranno utilizzati durante l'analisi dei dati per stimare il asintoto di un modello esponenziale decrescente, includere alcuni embrioni che sono stati iniettati con Alexa488-destrano ma non mRNA nell'esperimento. Per determinare il rumore strumento, che verrà utilizzata anche durante la successiva analisi dei dati, acquisire un'immagine in assenza di un campione.
4. Analizzare i dati utilizzando PyFDAP
- Ispezionare visivamente il tempo record di dati naturalmente da ogni embrione. Eliminare set di dati da embrioni morti durante imagING, che ha spostato in modo significativo, che hanno livelli molto bassi di segnale photoconverted, o che contengono regioni di cellule che sembrano insoliti e hanno smesso di muoversi e dividendo (tipico di embrioni feriti o ammalati).
Nota: Di tanto in tanto, bolle nell'olio immersione o altri artefatti appariranno in una o due immagini in un set di dati altrimenti utilizzabili. Prendere nota di eventuali immagini che contengono artefatti; saranno scartati dopo, e le restanti punti di tempo di tale insieme di dati possono ancora essere analizzati. - Utilizzare la sede a Python pacchetto software PyFDAP per analizzare i dati FDAP. PyFDAP calcola emivite determinando l'intensità media intracellulare ed extracellulare fluorescenza rossa in ogni immagine ed il montaggio dei dati con un esponenziale decrescente funzione 56 (Figura 3).
- Scarica PyFDAP (vedi Elenco dei materiali).
- Utilizzare PyFDAP per separare intracellulare ed extracellulare segnale photoconverted (Figura 3A, B). Noivia e il segnale Alexa488, che è strettamente intracellulare, per creare una maschera intracellulare. Applicare questa maschera per l'immagine del canale rosso corrispondente per evitare pixel intracellulari da essere considerato per il calcolo dell'intensità media extracellulare. Per misurare l'intensità media intracellulare, invertire la maschera.
- In PyFDAP, visualizzare le immagini mascherate generate nel passaggio 4.2.2. Controllare visivamente queste immagini ed eliminare set di dati in cui le maschere non distinguono accuratamente intracellulare dallo spazio extracellulare (questo dovrebbe essere raro, di notare che le membrane cellulari sono inclusi nelle immagini in cui lo spazio extracellulare è stato mascherato, ma potrebbero essere rimossi alterando la soglia algoritmo o introducendo una maschera membrana (ad esempio, utilizzando membrane-PCP)). Eliminare anche eventuali immagini singole contenenti manufatti (ad esempio, bolle nell'olio immersione) identificati nella fase 4.1.
- Utilizzare PyFDAP per calcolare la media intensità di fluorescenza extracellulari e intracellulari per each immagine. PyFDAP calcola queste medie sommando le intensità dei pixel che cadono al di fuori della maschera e la divisione per il numero totale di pixel sommati.
- Inserire i dati di fluorescenza (Figura 3C) con la seguente funzione esponenziale:
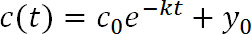
dove t è il tempo post-fotoconversione, c (t) è l'intensità ad un dato valore di t, c 0 è l'intensità a t = 0, k è la costante di velocità di clearance, e y 0 è l'asintoto che la funzione avvicina come fluorescenza diminuisce (Figura 1D). y 0 può essere limitato in base alle misure in fase 3.8 19. - Utilizzare PyFDAP per calcolare le proteine extracellulari e intracellulari emivita (τ) dalle costanti di velocità di liquidazione (k) con la seguente relazione:
5. Gli esperimenti di controllo per valutare Photobleaching, involontario Fotoconversione, e Fotoconversione Uniformità
- Valutare photobleaching
Nota: Photobleaching potrebbe causare una riduzione di artefatti di intensità di fluorescenza che riflette le proprietà sbiancanti della proteina fluorescente in aggiunta alla clearance della proteina di interesse.- Per valutare possibili photobleaching, eseguire una serie di esperimenti FDAP con 10 min intervalli tra immagini e una seconda serie con 20 min intervalli tra immagini (Figura 4). Analizzare i dati provenienti da due serie di esperimenti utilizzando PyFDAP come descritto nella Sezione 4.
- Confrontare l'emivita dei 10 e 20 intervalli min esperimenti. Emivita più lunga da 20 min esperimenti indicano intervallo significativo photobleaching. Se l'emivita di entrambi gli esperimenti sono identici, photobleaching non è un problema significativo.
- In alternativa, valutare photobleaching acquisendo una serie di ~ 30 immagini immediatamente dopo fotoconversione. Una diminuzione significativa fluorescenza indica significativo photobleaching.
- Se viene rilevato photobleaching, usare il potere del laser più basso, diminuire il tempo di imaging, o utilizzare un più fotostabili proteine fotoconvertibile 32.
- Valutare fotoconversione involontaria.
Nota: Dendra2 può essere photoconverted con illuminazione 488 nm 27. Quando eccitante Alexa488 con il laser 488 nm come descritto al punto 3.3.1, fotoconversione involontaria e quindi un aumento di artefatti nella emivita apparente della proteina di interesse è possibile. Tuttavia, abbiamo altri 33 abbiamo trovato che 488 nm illuminazione è un metodo inefficiente di fotoconversione in embrioni di zebrafish.- Utilizzare l'esperimento di controllo descritto al punto 5.1.1 per rilevare fotoconversione involontaria. Confrontare l'emivita dei 10 e 20 intervalli min esperimenti. Brevi tempi di dimezzamento di 20 min esperimenti indicano intervallo significativo fotoconversione involontario. Se l'emivita di entrambi gli esperimenti sono identici, fotoconversione involontario non è un problema significativo.
- Se viene rilevato fotoconversione involontario, utilizzare una potenza laser 488 nm inferiori e tempi di imaging più brevi per evitare inavvertitamente photoconverting Dendra2.
- Valutare uniformità fotoconversione.
Nota: Se fotoconversione è polarizzato verso il polo animale dell'embrione, la diminuzione della fluorescenza sarà influenzato dalla diffusione proteine o movimento cellulare in piani più profondi (Figura 5A).- Per determinare se fotoconversione è uniforme, esprimere una proteina secreta fotoconvertibile (per esperimenti con proteine di fusione extracellulari) o una proteina citoplasmatica fotoconvertibile (per esperimenti con proteine di fusione intracellulari). Photoconvert come al solito, tgallina acquisiscono una z-stack che comprende la maggior parte del blastoderma ogni 20 min per 80 min.
- Se fotoconversione è polarizzato verso il polo animale, l'intensità di fluorescenza in piani profondi aumenterà nel tempo a causa della diffusione o movimento cellulare (Figura 5B). Se viene rilevato non uniforme fotoconversione, concentrarsi più in profondità gli embrioni durante fotoconversione.
Risultati
FDAP è stata utilizzata per determinare l'emivita di proteine di segnalazione extracellulari in embrioni di zebrafish 19. Una di queste proteine, Squint, induce l'espressione di geni mesendodermal durante l'embriogenesi 34. Strabismo-Dendra2 attiva l'espressione di geni mesendodermal a livelli simili a untagged Squint, come dimostrato da qRT-PCR e ibridazione in situ test 19. Gli embrioni sono stati co-iniettate con Alexa488 destrano e mRNA codifica Squint...
Discussione
Il successo di un esperimento FDAP si basa sulla generazione di una proteina di fusione fotoconvertibile funzionale. Tagging una proteina può compromettere la sua attività biologica e / o proprietà biofisiche, tra cui la sua localizzazione, solubilità, stabilità e 36-41. Siate pronti a testare l'attività di diversi costrutti di fusione diversi al fine di trovare uno che è attiva. Abbiamo trovato che la modifica della posizione della proteina fotoconvertibile relativa alla proteina di interesse o ut...
Divulgazioni
Gli autori non hanno conflitti di rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Jeffrey Farrell, James Gagnon, e Jennifer Bergmann per i commenti sul manoscritto. KWR è stato sostenuto dal National Science Foundation Graduate Research Fellowship Program durante lo sviluppo del test FDAP. Questo lavoro è stato sostenuto da finanziamenti del NIH di AFS e da finanziamenti della Fondazione tedesca per la ricerca (Emmy Noether Program), il Max Planck Society, e il Programma Umana Frontier Science (Career Development Award) per PM.
Materiali
| Name | Company | Catalog Number | Comments |
| PyFDAP (download from the following website: http://people.tuebingen.mpg.de/mueller-lab) | Install and operate using the instructions provided on the PyFDAP website; PyFDAP is compatible with Linux, Mac, and Windows operating systems. | ||
| mMessage mMachine Sp6 Transcription Kit (Life Technologies, AM1340) | To generate capped mRNA for injection into embryos | ||
| Alexa488-dextran conjugate, 3 kDa (Life Technologies, D34682) | Co-inject with mRNA to create intracellular and extracellular masks | ||
| 6-well plastic dish (BD Falcon) | Incubate embryos in agarose-coated wells until ready for mounting | ||
| Embryo medium | 250 mg/l Instant Ocean salt, 1 mg/l methylene blue in reverse osmosis water adjusted to pH 7 with NaHCO3 | ||
| Protease from Streptomyces griseus (Sigma, P5147) | Make a 5 mg/ml stock and use at 1 mg/ml to dechorionate embryos at the one-cell stage | ||
| 5 cm diameter glass petri dish | For embryo dechorionation | ||
| 200 ml glass beaker | For embryo dechorionation | ||
| Microinjection apparatus | For injection of mRNA and dye into embryos at the one-cell stage | ||
| Stereomicroscope | For injecting and mounting embryos | ||
| 1x Danieau's medium | Dilute low melting point agarose and perform imaging in this medium; recipe: 0.2 mm filtered solution of 58 mM NaCl, 0.7 mM KCl, 0.4 mM MgSO4, 0.3 mM CaCl2, 5 mM HEPES pH 7.2 | ||
| UltraPure low melting point agarose (Invitrogen, 16520-100) | For mounting embryos; use at a concentration of 1% in Danieau's medium: add 200 mg to 20 ml Danieau's medium, microwave until dissolved, then aliquot 1 ml into microcentrifuge tubes; aliquots can be stored at 4 °C, re-melted at 70 °C, and cooled to 40 - 42 °C when ready to use | ||
| Glass Pasteur pipette (Kimble Chase (via Fisher), 63A53WT) | For mounting embryos; flame the tip to prevent jagged edges from injuring embryos | ||
| Metal probe | For positioning embryos during mounting | ||
| Glass bottom dishes (MatTek, P35G-1.5-14-C) | Use the appropriate cover glass thickness for your objective; part number listed here is for cover glass No. 1.5 | ||
| 15 ml tube (BD Falcon) filled with ~5 ml embryo medium | For rinsing residual agarose from the Pasteur pipette | ||
| Inverted laser scanning confocal microscope | A mercury arc lamp, 488 nm laser, 543 nm laser, and the appropriate filter sets are required | ||
| Heated stage | To maintain embryos at the optimal temperature of 28 °C during the experiment | ||
| Confocal software capable of time-lapse imaging | Must be able to define multiple positions and automatically image them at defined intervals | ||
| 25x or 40x water objective | Objective for imaging | ||
| 10x air objective | Objective for photoconversion | ||
| Immersion oil | Immersion oil with the same refractive index as water |
Riferimenti
- Schwanhäusser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Boisvert, F. M., et al. A Quantitative Spatial Proteomics Analysis of Proteome Turnover in Human Cells. Molecular & Cellular Proteomics. 11 (3), 011429 (2012).
- Belle, A., Tanay, A., Bitincka, L., Shamir, R., O'Shea, E. K. Quantification of protein half-lives in the budding yeast proteome. Proceedings of the National Academy of Sciences of the United States of America. 103 (35), 13004-13009 (2006).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764-768 (2011).
- Parry, D. H., O'Farrell, P. H. The schedule of destruction of three mitotic cyclins can dictate the timing of events during exit from mitosis. Current Biology. 11 (9), 671-683 (2001).
- Holloway, S. L., Glotzer, M., King, R. W., Murray, A. W. Anaphase is initiated by proteolysis rather than by the inactivation of maturation-promoting factor. Cell. 73 (7), 1393-1402 (1993).
- Dharmasiri, N., Estelle, M. Auxin signaling and regulated protein degradation. Trends Plant Sci. 9 (6), 302-308 (2004).
- MacDonald, B. T., Tamai, K., He, X. Wnt/beta-catenin signaling: components, mechanisms, and diseases. Developmental Cell. 17 (1), 9-26 (2009).
- Chen, X., et al. Processing and turnover of the Hedgehog protein in the endoplasmic reticulum. The Journal of Cell Biology. 192 (5), 825-838 (2011).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Yi, J. J., Ehlers, M. D. Emerging Roles for Ubiquitin and Protein Degradation in Neuronal Function. Pharmacological Reviews. 59 (1), 14-39 (2007).
- Rubinsztein, D. C. The roles of intracellular protein-degradation pathways in neurodegeneration. Nature. 443 (7113), 780-786 (2006).
- Müller, P., Schier, A. F. Extracellular Movement of Signaling Molecules. Developmental Cell. 21 (1), 145-158 (2011).
- Eldar, A., Rosin, D., Shilo, B. -. Z., Barkai, N. Self-enhanced ligand degradation underlies robustness of morphogen gradients. Developmental Cell. 5 (4), 635-646 (2003).
- Zhou, P. Determining protein half-lives. Methods In Molecular Biology. 284, 67-77 (2004).
- Woodside, K. H. Effects of cycloheximide on protein degradation and gluconeogenesis in the perfused rat liver. Biochim Biophys Acta. 421 (1), 70-79 (1976).
- Schimke, R. T., Doyle, D. Control of enzyme levels in animal tissues. Annual Review of Biochemistry. 39, 929-976 (1970).
- Kenney, F. T. Turnover of rat liver tyrosine transaminase: stabilization after inhibition of protein synthesis. Science. 156 (3774), 525-528 (1967).
- Müller, P., et al. Differential Diffusivity of Nodal and Lefty Underlies a Reaction-Diffusion Patterning System. Science. 336 (6082), 721-724 (2012).
- Kiuchi, T., Nagai, T., Ohashi, K., Mizuno, K. Measurements of spatiotemporal changes in G-actin concentration reveal its effect on stimulus-induced actin assembly and lamellipodium extension. The Journal of Cell Biology. 193 (2), 365-380 (2011).
- Plachta, N., Bollenbach, T., Pease, S., Fraser, S. E., Pantazis, P. Oct4 kinetics predict cell lineage patterning in the early mammalian embryo. Nature Cell Biology. 13 (2), 17-123 (2011).
- Drocco, J. A., Grimm, O., Tank, D. W., Wieschaus, E. Measurement and Perturbation of Morphogen Lifetime: Effects on Gradient Shape. Biophys J. 101 (8), 1807-1815 (2011).
- Zhang, L., et al. Method for real-time monitoring of protein degradation at the single cell level. BioTechniques. 42 (4), 446-450 (2007).
- Miyawaki, A. Proteins on the move: insights gained from fluorescent protein technologies. Nat Rev Mol Cell Biol. 12 (10), 636-668 (2011).
- Pantazis, P., Supatto, W. Advances in whole-embryo imaging: a quantitative transition is underway. Nat Rev Mol Cell Biol. 15 (5), 327-339 (2014).
- Lukyanov, K. A., Chudakov, D. M., Lukyanov, S., Verkhusha, V. V. Innovation: Photoactivatable fluorescent proteins. Nat Rev Mol Cell Biol. 6 (11), 885-891 (2005).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nature Biotechnology. 24 (4), 461-465 (2006).
- Zou, J., Wei, X. Transplantation of GFP-expressing Blastomeres for Live Imaging of Retinal and Brain Development in Chimeric Zebrafish Embryos. Journal of Visualized Experiments. (41), (2010).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. Journal of Visualized Experiments. (27), (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. Journal of Visualized Experiments. (25), (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), (1995).
- McKinney, S. A., Murphy, C. S., Hazelwood, K. L., Davidson, M. W., Looger, L. L. A bright and photostable photoconvertible fluorescent protein. Nature Methods. 6 (2), 131-133 (2009).
- Dempsey, W. P., Qin, H., Pantazis, P. In Vivo Cell Tracking Using PhOTO Zebrafish. Methods in Molecular Biology. 1148, 217-228 (2014).
- Schier, A. F. Nodal Morphogens). Cold Spring Harbor Perspectives in Biology. 1 (5), a003459-a003459 (2009).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans Syst Man Cybern. 9 (1), 62-66 (1979).
- Pédelacq, J. -. D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nature Biotechnology. 24 (1), 79-88 (2005).
- Swulius, M. T., Jensen, G. J. The Helical MreB Cytoskeleton in Escherichia coli MC1000/pLE7 Is an Artifact of the N-Terminal Yellow Fluorescent Protein Tag. Journal of Bacteriology. 194 (23), 6382-6386 (2012).
- Landgraf, D., Okumus, B., Chien, P., Baker, T. A., Paulsson, J. Segregation of molecules at cell division reveals native protein localization. Nature Methods. 9 (5), 480-482 (2012).
- Stadler, C., et al. Immunofluorescence and fluorescent-protein tagging show high correlation for protein localization in mammalian cells. Nature Methods. 10 (4), 315-323 (2013).
- Quattrocchio, F. M., Spelt, C., Koes, R. Transgenes and protein localization: myths and legends. Trends Plant Sci. 18 (9), 473-476 (2013).
- Morimoto, Y. V., Kojima, S., Namba, K., Minamino, T. M153R Mutation in a pH-Sensitive Green Fluorescent Protein Stabilizes Its Fusion Proteins. PLoS ONE. 6 (5), e19598 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Waters, J. C. Accuracy and precision in quantitative fluorescence microscopy. The Journal of Cell Biology. 185 (7), 1135-1148 (2009).
- Moll, U. M., Petrenko, O. The MDM2-p53 interaction. Mol Cancer Res. 1 (14), 1001-1008 (2003).
- Auer, T. O., Duroure, K., De Cian, A., Concordet, J. P., Del Bene, F. Highly efficient CRISPR/Cas9-mediated knock-in in zebrafish by homology-independent DNA repair. Genome Research. 24 (1), 142-153 (2014).
- Bedell, V. M., et al. In vivo genome editing using a high-efficiency TALEN system. Nature. 491 (7422), 114-118 (2012).
- Hruscha, A., et al. Efficient CRISPR/Cas9 genome editing with low off-target effects in zebrafish. Development. 140 (24), 4982-2987 (2013).
- Hwang, W. Y., et al. Heritable and Precise Zebrafish Genome Editing Using a CRISPR-Cas System. PLoS ONE. 8 (7), 68708 (2013).
- Hwang, W. Y., et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nature Biotechnology. 31 (3), 227-229 (2013).
- Zu, Y., et al. TALEN-mediated precise genome modification by homologous recombination in zebrafish. Nature Methods. 10 (4), 329-331 (2013).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of Zebrafish Early Embryonic Development by Scanned Light Sheet Microscopy. Science. 322 (5904), 1064-1069 (2008).
- Blanchet, M. H., et al. Cripto Localizes Nodal at the Limiting Membrane of Early Endosomes. Science Signaling. 1 (45), ra13-ra13 (2008).
- Jullien, J., Gurdon, J. Morphogen gradient interpretation by a regulated trafficking step during ligand-receptor transduction. Genes & Development. 19 (22), 2682-2694 (2005).
- Incardona, J. P., et al. Receptor-mediated endocytosis of soluble and membrane-tethered Sonic hedgehog by Patched-1. Proceedings of the National Academy of Sciences of the United States of America. 97 (22), 12044-12049 (2000).
- Scholpp, S., Brand, M. Endocytosis Controls Spreading and Effective Signaling Range of Fgf8 Protein. Current Biology. 14 (20), 1834-1841 (2004).
- Bläßle, A., Müller, P. . PyFDAP: Automated analysis of Fluorescence Decay After Photoconversion (FDAP) experiments. Bioinformatics. In Press, (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon