Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fotoçevrim sonra Floresans Bozunma kullanarak Oturma balığı Embriyolar protein stabilitesi ölçümü (FDAP)
Bu Makalede
Özet
Hücre ve dokularda protein seviyeleri, çoğu zaman sıkı bir şekilde protein üretimi ve temizlenmesi dengesi ile düzenlenir. Fotoçevrim (FDAP) sonra floresans Bozunma kullanan proteinlerin temizlenme kinetiği deneysel in vivo olarak ölçülebilir.
Özet
Protein istikrar biyoloji birçok açıdan etkiler ve proteinlerin temizlenmesi kinetik ölçüm biyolojik sistemlere önemli bilgiler sağlayabilir. FDAP deneylerde, canlı organizmalar içinde protein açıklık ölçülebilir. İlgi dahilindeki bir proteini, photoconvertible floresan protein with in vivo ifade photoconverted ve zaman içinde photoconverted sinyal azalması takip edilir. Veriler daha sonra, protein yarı ömrünü tayin etmek için uygun bir açıklık modeli ile donatılmıştır. Önemlisi, organizmanın farklı bölümlerinde protein popülasyonlarının açıklık kinetiği bölmeli maskeleri uygulayarak ayrı ayrı muayene edilebilir. Bu yaklaşım, zebra balığı gelişimi esnasında salgılanan sinyal proteinleri ve hücre içi ve hücre dışı yarılanma ömürlerine belirlemek için kullanılmıştır. Burada, biz Zebra balığı embriyolar FDAP deneyler için bir protokol açıklar. Bu klirensi kinetiklerini belirlemek için FDAP kullanmak mümkün olmalıdırherhangi bir optik olarak erişilebilir bir organizmada bir taggable proteini.
Giriş
hücre ve organizmalardaki protein seviyeleri, üretim ve klirens oranlarına göre belirlenmektedir. Protein yarı ömürleri dakika gün 1-4 aralığında olabilir. Birçok biyolojik sistemlerde, anahtar proteinlerin stabilizasyonu veya açıklık hücresel aktivite üzerinde önemli etkileri vardır. Hücre içi protein stabilitesi modülasyonu, hücre döngüsü ilerlemesinin 5,6, gelişim sinyal 7-9 apoptoz 10 ve normal fonksiyon ve nöronların 11,12 ettirilmesi için gereklidir. Hücre dışı protein kararlılığı bir doku içinde dağılımı ve morphogens 13,14 olarak salgılanan proteinler, kullanılabilirliğini etkiler.
Son birkaç yıldır, protein stabilitesi esas radyoaktif darbe-etiketleme ya da sikloheksimid kovalamaca deneyleri 15 kullanılarak hücre kültüründe değerlendirilmiştir. Böyle darbe kovalayıcı deneyler, hücreler ya da geçici olarak bir radyoaktif amino "darbe" maruzasit ön-maddeleri, yeni sentezlenmiş olan proteinlerle birleştirilmiştir, ya da protein sentezini inhibe sikloheksimid, maruz kaldığı. Kültürlenmiş hücreler, daha sonra farklı zaman noktalarında toplanır, ve ya (radyoaktif darbe kovalayıcı deneyler) otoradyografi ile takip immüno ya da (sikloheksimid deneylerinde) batı beneklemesinden zaman içinde protein açıklık ölçmek için kullanılır.
Konvansiyonel protein stabilitesi deneyleri bazı eksiklikleri vardır. İlk olarak, bu deneylerde proteinler genellikle endojen ortamlarda ifade edilmez, bunun yerine farklı türlerden elde edilen hücreler, doku kültürü içinde, bazen de. Stabiliteleri bağlam-bağımlı proteinleri için, bu yaklaşım sorunludur. İkinci olarak, zaman içinde tek tek hücreler ya da organizmalar protein açıklık takip etmek mümkün değildir, ve bu deneylerde elde edilen veriler, farklı zaman noktalarında farklı hücre popülasyonlarının ortalamasıdır. Tek tek hücreler başlamış olabilir bu yanaproteinin farklı miktarlarda farklı zamanlarda radyoaktif etiket ya da sikloheksimid almış olabilir, ya da farklı açıklık kinetiği, örneğin toplam veri yanıltıcı olabilecek olabilir. Son olarak, sikloheksimid takip deneylerinde durumunda, protein sentez önleyicisi ilave yapay protein kararlılığının 16-18 değiştirebilir istenmeyen fizyolojik etkilere sahip olabilir. Bu eksiklikler, Fotoçevrim (FDAP) sonra photoconvertible proteinler Organizma 19-25 canlı dinamik proteini açıklığını ölçmek için kullanan bir teknik Floresan Bozunma kullanılarak önlenebilir (FDAP teknik sınırlamaları için bölümüne bakınız).
Photoconvertible proteinler olan uyarma ve emisyon özellikleri hafif 26 özel dalga boylarına maruz kaldıktan sonra değiştirmek floresan proteinleri vardır. Genel olarak kullanılan bir varyant Dendra2 başlangıçta eski bir "yeşil için kırmızı" photoconvertible proteindiratıf ve emisyon yeşil floresan protein benzer özellikler, fakat UV ışık "Fotoçevrim" maruz kaldıktan sonra uyarma-onun / emisyon özellikleri kırmızı flüoresan protein 23,27 benzer hale gelir. Daha da önemlisi, Fotoçevrim sonra üretilen yeni bir protein photoconverted proteinin sadece bir havuz Fotoçevrim üzerine üretimi ve temizlenmesi ayrılmasına ve gözlem izin photoconverted protein ile aynı uyarım / emisyon özellikleri sahip olmayacaktır. Photoconvertible proteinleri ile ilgi proteinleri Etiketleme ve böylece darbe-etiket için sağlam, optik erişilebilir canlılarla proteinleri uygun bir yol sağlar.
FDAP deneyleri (Şekil 1A) 'de, ilgi konusu bir protein photoconvertible protein ile etiketlenir ve bir canlı organizmada (Şekil 1B) olarak ifade edilmiştir. Füzyon proteini photoconverted edilir ve zaman içinde photoconverted sinyal azalması flüoresan ile izlenirce mikroskobu (Şekil 1C). Veriler daha sonra füzyon proteininin (Şekil 1D) yarı ömrünü tayin etmek için uygun bir model ile donatılmıştır.
Burada anlatılan FDAP tahlil erken embriyogenez 19 döneminde Zebra balığı embriyolarının salgılanan sinyal proteinlerin hücre dışı yarım hayatlarını belirlemek için tasarlanmıştır. Bununla birlikte, bu yaklaşım, canlı görüntüleme tolere eder ve herhangi bir taggable hücre içi ya da hücre dışı proteinin açıklık izlemek için kullanılabilecek herhangi bir şeffaf model organizma için adapte edilebilir. Burada tarif edilen tekniğin varyasyonları kültürlenmiş hücreler 20,23 ve Drosophila 22 ve fare 21 embriyo olarak yapılmıştır.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Bir Photoconvertible Fusion Construct ve Damariçi dechorionated Zebra balığı Embriyolar Yaratma
- Daha sonra Müller ve ark., 2012, 19 olarak füzyon proteinini kodlayan başlıklı mRNA üretmek için, in vitro transkripsiyon kullanın yeşilden kırmızı photoconvertible protein (Tartışma) füzyonlanan ilgi konusu bir proteini ihtiva eden bir fonksiyonel yapı oluşturur.
- Tek hücre aşamasında yaklaşık 30 zebra balığı embriyoların chorions kaldırmak için pronase kullanın. Seçenek olarak ise, el forseps 28 kullanılarak embriyolar dechorionate.
Not: Embriyolar daha sonra görüntüleme için dechorionated gerekir. Arzu edildiği takdirde, embriyolar görüntüleme hemen önce, daha sonra koryon enjekte edilmiş ve dechorionated edilebilir.- Standart Zebra balığı embriyo orta 19 Streptomyces griseus gelen Pronaz bir 5 mg / ml stok solüsyonu olun. 10 dk proteaz eritmek için izin için hafifçe oda sıcaklığında çözüm Kaya. Kısım 2 m,-20 ° C'de mikrosantrifüj tüplerine L ve dondurularak.
- ~ 8 mi embriyo orta ihtiva eden bir 5 cm çapında bir cam ya da agaroz kaplı plastik Petri tabağına aktarın tek hücreli aşamada embriyolar. Çanak çözülmüş Pronaz stok çözeltisi 2 ml ilave edilir ve 5-10 dakika boyunca oda sıcaklığında inkübe edilir.
- Dechorionated embriyolar yırtılmasına neden olur biriyle temas gibi, hava veya plastik embriyolar maruz bırakmayın. Embriyo ortamı ile 200 ml'lik bir cam beher. Orta daldırarak ise Petri kabı eğerek beher embriyolar transfer.
- Embriyolar beher altına yerleşmiş sonra, daha sonra beher içine taze embriyo orta dökün, embriyo orta çoğu dökmek. beher içine boşaltılarak orta hafif dönen embriyolar zayıflamış chorions kaybetmenize neden olur.
- Adımı yineleyin 1.2.4.
- Bir Alevli ucu bir cam Pasteur pipet kullanarak bir agaroz kaplı enjeksiyon çanak 29 dechorionated embriyolar transfer. Yananpipet yaralandı embriyolar tırtıklı kenarları engeller.
- (Şekil 1B, önerilen mRNA ve Alexa488-dekstran tutarlar için Tartışma) mRNA ve 3 kDa Alexa488-dekstran konjuge 29,30 Eş-enjekte. Bölünme başlar kez bile mRNA dağılımını ve floresan boya sağlamak için hücrenin (değil sarısı) merkezine doğrudan enjekte edilir.
Not: Alexa488 sinyal hücre içi ve hücre dışı floresan ayırt etmek için bölmeli maskeleri oluşturmak için veri analizi sırasında kullanılan olacaktır. - Embriyo maddesi ile dolu bir altı-çukurlu, plastik çanak 1-2% agaroz kaplı oyuk transfer enjekte embriyolar. Embriyolar geç küre sahne 31 (yaklaşık 5 saat sonra döllenme) ulaşana kadar 28 ° C'de karanlıkta inkübe edin. Steromikroskopla embriyolar her biri 2 saat kontrol edin ve ölen embriyolar tarafından oluşturulan herhangi bir enkaz kaldırmak.
2. P Zebra balığı Embriyolar MontajBir Ters Konfokal Mikroskop üzerinde hotoconversion ve Görüntüleme
- 04:59 sağlıklı embriyolar tespit ve çanak bunları kaldırmak için bir Alevli ucu ile bir cam Pasteur pipet kullanmak için Stereomikroskopta kullanın.
- Yavaşça 1x Danieau embriyo orta eridi% 1 düşük erime noktası agaroz ~ 1 ml içeren bir mikrosantrifüj tüp içine embriyolar çıkarmak (Şekil 2A) (Malzemeler Listesi bakınız).
Not: Agaroz, 40 ve 42 ° C arasındaki bir sıcaklığa sahip olmalıdır; yüksek sıcaklıklar embriyolar zarar verebilir. - Bazı agaroz ile birlikte geri pipet içine embriyolar çizin. Yavaşça bir cam alt çanak (Şekil 2B) kapak camına agaroz ve embriyolar çıkarmak. Kapak cam kalınlığı konfokal mikroskop hedefi ile uyumlu olduğundan emin olun.
- İsterseniz cam pipet yeniden kullanın. Pipet dışarı kalan agaroz temizlemek ve yukarı ve aşağı hızla tıkanma, pipet embriyo orta önlemek için.Aşağıdaki Bu amaçla stereomikroskop embriyo ortamının ~ 5 ml ile dolu bir 15 ml'lik tüp yerleştirin.
- Hayvan kutup (blastoderm) cam kapak bakacak şekilde embriyolar konumlandırmak için bir metal prob kullanın. Agaroz 20-30 saniye içinde katılaşmaya beri hızla çalışın. Embriyolar 'pozisyonları izlemek ve agaroz sertleşir kadar gerekli yeniden ayarlamak için stereomikroskopta kullanın.
- Embriyo istenilen sayıda monte edilene kadar tekrarlayın 2,1-2,4 adımları.
Not: Tipik bir deneyde, dört ya da beş embriyolar her içeren dört agaroz damla kapak camına kolayca uyum sağlayacaktır. Yaklaşık 16 embriyolar tek ideal bir deneyde (Şekil 2C) sırasında görüntülenebilir. - Agaroz katılaşmış sonra, 1x Danieau embriyo orta ile cam alt çanak doldurun.
3. Photoconverting ve Photoconverted Sinyal azalması Ölçme
Bir 25X veya 40X su amacı iboyut ve zebra balığı embriyoların kırılma endeksi için uygun s. Su, beş saatlik deney sırasında buharlaşır beri, su yerine gerçek su gibi aynı kırılma indeksi ile daldırma yağı kullanmak en iyisidir. Daldırma yağı bir su (değil yağ) amacı ile kullanılmak üzere tasarlanmış olduğundan emin olun.
- Objektif ve kapak cam arasındaki yağ filmi görüntüleme sırasında farklı embriyo pozisyonlara sahne hamle olarak kırmak olmaz sağlamak için objektif immersiyon büyük bir damla yerleştirin. Çanak zaman sahne hamle kayması olmaz ki güvenli sahneye cam alt çanak yerleştirin. Mümkünse, 28 ° C, zebra balığı gelişimi için en uygun sıcaklıkta bir ısıtılmış bölmesi kullanırlar.
- Konfokal mikroskop yazılım paketinde her embriyonun konumunu tanımlayın. Her embriyo z-derinliğini ayarlayın ve her embriyo kabaca aynı uçağı hedef çalışmayın.
Not: Yaklaşık 30 mikron hayvan kutup bir gitmek olduğunuEmbriyonun kuşatıcı tabaka önlenebilir, bu derinlikte beri od derinliği, görüntüleme alanı maksimize edilir ve ışık saçılması düzeydedir. ~ 3.3 um bir kalınlığa sahip tek bir optik dilim yeterli veri sağlar; z-yığını (bakınız Bölüm 5) elde etmek için herhangi bir ihtiyaç vardır. - Deney sırasında iki sinyal toplayın: Alexa488-dekstran "yeşil" sinyali eşlenik hangi photoconverted sonra hücre içi ve hücre floresan-ve füzyon proteini "kırmızı" sinyali izole veri analizi sırasında kullanılacaktır.
- 488 nm lazer kullanarak Alexa488 Excite ve ~ 500 ve 540 nm arasında yayılan floresan toplamak. Not: Fotoçevrim sonra çok sayıda yeşil için kırmızı photoconvertible proteinler (ör Dendra2) bir 543 nm lazer ile uyarılmasına ve ~ 550 ve 650 nm arasında floresan yayabilir. Kullanılan photoconvertible proteine dayalı olarak gerekli ayarlayın.
- Edinme "ön-Fotoçevrim"Görüntüleri ve görüntüye uygun görüntüleme koşulları (adım 3.2) daha önce tanımlanmış pozisyonların her konfokal mikroskop yazılımını yapılandırmak beş saatlik zaman kurs için her 10 veya 20 dakika (bakınız Bölüm 5 ve Tartışma).
- Füzyon proteinini photoconvert için, 2 dakika boyunca% 100 çıkışında bir ~ 300-400 nm eksitasyon filtreli bir cıva arklı lambadan gelen UV ışığı embriyo grupları 10X objektif geçmek ve maruz kalmaktadır. . Tekdüze Fotoçevrim (Bölüm 5) teşvik etmek z-ekseni boyunca odak kayması daldırma yağ Fotoçevrim sırasında 10x objektif üzerine damlamamasını emin olun.
Not: Fotoçevrim sırasında odaklama kaydırma deneyi arasında değişkenlik önlemek için otomatik olarak yapılabilir. - Hemen Fotoçevrim sonra geri 25X veya 40X objektif geçin. Adım 3.2 daha önce tanımlanmış pozisyon hala doğru olduğundan emin olun. Çanak photoconv sırasında kaymıştır Eğerersion, embriyoların pozisyonları yeniden tanımlamak.
- Adım 3.4 oluşturulan programını başlatın ve görüntüleme 5 saat devam etmesine izin. Fotoçevrim ve her embriyo için görüntüleme başlangıcı arasında geçen süre unutmayın.
- Bazen deney kontrol. Danieau en ortamının seviyesini izlemek ve gerekirse daha eklemek. O durdu, eğer yazılımı yeniden başlatın.
- Katlanarak azalan modeli asimptota tahmin etmek için veri analizi sırasında kullanılacak eşiğe değerlerini belirlemek için, deneyde Alexa488-dekstran ancak mRNA enjekte edilmiş bazı embriyoları içerir. Ayrıca müteakip veri analizi sırasında kullanılacak alet gürültü, belirlemek için, bir numunenin yokluğunda bir görüntü kazanır.
4. PyFDAP kullanma Veri Analizi
- Görme her embriyo zaman ders veri setleri inceleyin. Imag sırasında ölen embriyolar veri setleri atınphotoconverted sinyalin çok düşük seviyelerde olması, ya da alışılmadık bakmak ve hareketli ve (yaralı veya hasta embriyoların tipik) bölünmesi durduruldu hücre bölgeleri ihtiva önemli ölçüde değiştirdi ing,.
Not: Bazen, immersiyon kabarcıkları veya diğer eserler bir başka kullanışlı veri kümesi içinde bir ya da iki resim görünecektir. Eserler içeren herhangi bir resim Not; daha sonra atılır ve bu veri setinden diğer zaman noktaları yine analiz edilebilir. - FDAP verilerini analiz etmek için Python tabanlı yazılım paketi PyFDAP kullanın. PyFDAP her görüntünün ortalama hücre içi ve hücre dışı kırmızı floresans yoğunluğunu belirlemek ve katlanarak azalan işlevi 56 (Şekil 3) ile veri oturtulması ile yarı ömürleri hesaplar.
- PyFDAP İndir (bkz Malzeme Listesi).
- Kullanım PyFDAP hücre içi ve hücre dışı photoconverted sinyal (Şekil 3A, B) ayırmak için. BizeBir hücre içi maske oluşturmak için, kesinlikle içi olan Alexa488 sinyali, e. Ortalama dışı yoğunluğunu hesaplanırken düşünülen hücre içi piksel engellemek için gelen kırmızı kanal görüntü bu maskeyi uygulayın. Ortalama hücre içi yoğunluğunu ölçmek için, maske ters.
- PyFDAP, adım 4.2.2 oluşturulan maskeli görüntüleri. Görme bu görüntüleri incelemek ve maskeler doğru dışı alandan hücre içi (bu nadir olmalı ayırt etmeyen veri setleri atmak; o hücre zarları dışı uzay maskeli edildiği görüntülerde yer almaktadır dikkat ancak eşikleme değiştirerek kaldırılmış olabilir algoritması ya da bir zar maske sokulması (örn kullanılarak membran CFP)). Ayrıca adım 4.1 tanımlanan eserler (örneğin, immersiyon kabarcıkları) içeren herhangi bir tek görüntüleri atın.
- EAC ortalama hücre dışı ve hücre içi floresan yoğunlukları hesaplamak için PyFDAP kullanarakh görüntüsü. PyFDAP özetlenebilir toplam piksel sayısına göre maske ve bölme dışında kalan piksel yoğunlukları toplanmasıyla bu ortalamalar hesaplar.
- Aşağıdaki üstel fonksiyonu ile floresan verilerini (Şekil 3C) Fit:
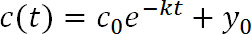
t, zamandır sonrası Fotoçevrim, C (t), t, belirli bir değerde yoğunluğu olduğu, c, 0, t = 0 yoğunluğu, k temizlenme hızı sabittir, ve y, 0 fonksiyonu floresan gibi yaklaşımlar asimptot olan azaltır (Şekil 1D). y, 0 adım 3.8 19 ölçümlere göre kısıtlanabilir. - Aşağıdaki ilişkiyi kullanarak temizlenme oranı sabitleri (k) hücre dışı ve hücre içi protein yarı-ömürleri (τ) hesaplamak için PyFDAP kullanın:

5. Kontrol Deneyleri foto ağartıcı, istenmeden Fotoçevrim ve Fotoçevrim üniformluğunu değerlendirmek için
- Değerlendirme photobleaching
Not: ışıkla ağartma ilgili proteinin klirens ek olarak floresan protein ağartma özelliklerini yansıtan, flüoresans yoğunluğunda bir suni kaybına neden olabilir.- Mümkün photobleaching değerlendirmek görüntüleme ve görüntüleme arasında 20 dakika aralıklarla (Şekil 4) ile ikinci sette arasında 10 dakikalık aralıklarla FDAP deneyler bir set yapmak. Bölüm 4'de tarif edildiği gibi PyFDAP kullanıldığı deneylerde her iki seti verilerini analiz edin.
- 10 ve 20 dakika süre deneyler yarı ömürleri karşılaştırın. Daha uzun yarılanma ömürleri 20 dakika süre deneyler önemli photobleaching gösterir. Her iki deneyden olan yarı-ömürleri aynı ise, ışık birimiobleaching önemli bir endişe değildir.
- Alternatif olarak, hemen Fotoçevrim sonra ~ 30 görüntülerin bir dizi satın alarak photobleaching değerlendirmek. Flüoresans yoğunluğunda önemli bir azalma önemli photobleaching gösterir.
- Photobleaching tespit edilirse, alt lazer gücünü kullanmak görüntüleme süresini azaltmak, ya da bir daha ışığa photoconvertible protein 32 kullanmayı düşünün.
- Yanlışlıkla Fotoçevrim değerlendirilmesi.
Not: Dendra2 488 nm aydınlatma 27 kullanılarak photoconverted edilebilir. 488 nm lazer ile verici Alexa488 ilgili proteinin belirgin yarı ömrü aşama 3.3.1 yanlışlıkla Fotoçevrim ve bu nedenle suni artış tarif edildiği gibi zaman mümkündür. Ancak bizler ve başkaları 33 488 nm aydınlatma zebra balığı embriyolar Fotoçevrim verimsiz bir yöntem olduğu bulunmuştur.- Yersiz Fotoçevrim tespit etmek için aşama 5.1.1 tarif kontrol deneyini kullanarak. 10 ve 20 dakika süre deneyler yarı ömürleri karşılaştırın. 20 dakika süre deneylerden daha kısa yarı ömürleri önemli ölçüde istenmeyen Fotoçevrim göstermektedir. Her iki deneylerden yarı ömürleri aynı ise, yanlışlıkla Fotoçevrim önemli bir endişe değildir.
- Yanlışlıkla Fotoçevrim tespit edilirse, Dendra2 photoconverting yanlışlıkla önlemek için daha düşük bir 488 nm lazer gücü ve daha kısa görüntüleme kez kullanmak.
- Fotoçevrim tekdüzelik değerlendirilmesi.
Not: Fotoçevrim embriyo hayvan kutbuna doğru bastırılmaktadır ise, floresan azalma derin düzlemler (Şekil 5A); proteinin difüzyon ya da hücre hareketi ile etkilenecektir.- Fotoçevrim düzgün olup olmadığını belirlemek için, (hücre dışı füzyon proteinleri ile deneyler için), salgılanan, photoconvertible protein ya da (hücre içi füzyon proteinleri ile deneyler için), sitoplazmik photoconvertible proteini ifade eder. Her zamanki gibi Photoconvert ttavuk 80 dakika boyunca her 20 dakikada blastodermin en kapsayan z-yığını kazanır.
- Fotoçevrim hayvan kutup karşı önyargılı ise, derin düzlemlerde floresan yoğunluğu nedeniyle difüzyon veya hücre hareketi (Şekil 5B) zamanla artacaktır. Muntazam olmayan Fotoçevrim tespit edilirse, Fotoçevrim sırasında embriyonun içine derin odaklanır.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
FDAP zebra balığı embriyolar 19 hücre dışı sinyal gönderme proteinleri yarı ömürleri belirlemek için kullanılmıştır. Bu proteinlerden biri olan şaşılıklarını embriyojenez 34 boyunca mesendodermal genlerin ekspresyonuna neden olur. Şaşı Dendra2 QRT-PCR ile ve in situ hibridizasyon deneyleri 19 de gösterildiği gibi, etiketsiz perspektif benzer seviyelerde mesendodermal genlerin ifadesini aktive eder. Embriyolar Alexa488-dekstran ve mRNA şaşı ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bir FDAP deney başarısı fonksiyonel photoconvertible füzyon proteininin üretimi dayanır. Bir protein etiketleme onun biyolojik aktivitesini ve / veya yerleşim yeri, çözünürlük ve stabilite 36-41 dahil olmak üzere biyo-fiziksel özelliklerini etkileyebilir. Aktif aktiviteleri için çok sayıda farklı füzyon yapılarının aktivitesi test etmek için hazırlanabilir. Bunun ötesinde ilgili protein için photoconvertible proteini göre konumunu değiştirmek veya daha fazla bağlayıcılar ile
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa etmek çatışmaları hiçbir var.
Teşekkürler
Yazarlar yazının yorumları için Jeffrey Farrell, James Gagnon, ve Jennifer Bergmann teşekkür etmek istiyorum. KWR FDAP testinin geliştirilmesi sırasında Ulusal Bilim Vakfı Lisansüstü Araştırma Bursu Programı tarafından desteklenmiştir. Bu çalışma AFS NIH hibe yoluyla ve Alman Araştırma Vakfı (Emmy Noether Programı), Max Planck Kurumu ve PM İnsan Frontier Bilim Programı (Kariyer Geliştirme Ödülü) hibe ile desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| PyFDAP (download from the following website: http://people.tuebingen.mpg.de/mueller-lab) | Install and operate using the instructions provided on the PyFDAP website; PyFDAP is compatible with Linux, Mac, and Windows operating systems. | ||
| mMessage mMachine Sp6 Transcription Kit | Life Technologies | AM1340 | To generate capped mRNA for injection into embryos |
| Alexa488-dextran conjugate, 3 kDa | Life Technologies | D34682 | Co-inject with mRNA to create intracellular and extracellular masks |
| 6-well plastic dish | BD Falcon | Incubate embryos in agarose-coated wells until ready for mounting | |
| Embryo medium | 250 mg/L Instant Ocean salt, 1 mg/L methylene blue in reverse osmosis water adjusted to pH 7 with NaHCO3 | ||
| Protease from Streptomyces griseus | Sigma | P5147 | Make a 5 mg/ml stock and use at 1 mg/ml to dechorionate embryos at the one-cell stage |
| 5 cm diameter glass Petri dish | For embryo dechorionation | ||
| 200 ml glass beaker | For embryo dechorionation | ||
| Microinjection apparatus | For injection of mRNA and dye into embryos at the one-cell stage | ||
| Stereomicroscope | For injecting and mounting embryos | ||
| 1x Danieau's medium | Dilute low melting point agarose and perform imaging in this medium; recipe: 0.2 mm filtered solution of 58 mM NaCl, 0.7 mM KCl, 0.4 mM MgSO4, 0.3 mM CaCl2, 5 mM HEPES pH 7.2 | ||
| UltraPure low melting point agarose | Invitrogen | 16520-100 | For mounting embryos; use at a concentration of 1% in Danieau's medium: add 200 mg to 20 ml Danieau's medium, microwave until dissolved, then aliquot 1 ml into microcentrifuge tubes; aliquots can be stored at 4 °C, re-melted at 70 °C, and cooled to 40–42 °C when ready to use |
| Glass Pasteur pipette | Kimble Chase (via Fisher) | 63A53WT | For mounting embryos; flame the tip to prevent jagged edges from injuring embryos |
| Metal probe | For positioning embryos during mounting | ||
| Glass bottom dishes | MatTek | P35G-1.5-14-C | Use the appropriate cover glass thickness for your objective; part number listed here is for cover glass No. 1.5 |
| 15 ml tube filled with ~5 ml embryo medium | BD Falcon | For rinsing residual agarose from the Pasteur pipette | |
| Inverted laser scanning confocal microscope | A mercury arc lamp, 488 nm laser, 543 nm laser, and the appropriate filter sets are required | ||
| Heated stage | To maintain embryos at the optimal temperature of 28 °C during the experiment | ||
| Confocal software capable of time-lapse imaging | Must be able to define multiple positions and automatically image them at defined intervals | ||
| 25X or 40X water objective | Objective for imaging | ||
| 10X air objective | Objective for photoconversion | ||
| Immersion oil | Immersion oil with the same refractive index as water |
Referanslar
- Schwanhäusser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Boisvert, F. M., et al. A Quantitative Spatial Proteomics Analysis of Proteome Turnover in Human Cells. Molecular & Cellular Proteomics. 11 (3), 011429(2012).
- Belle, A., Tanay, A., Bitincka, L., Shamir, R., O'Shea, E. K. Quantification of protein half-lives in the budding yeast proteome. Proceedings of the National Academy of Sciences of the United States of America. 103 (35), 13004-13009 (2006).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764-768 (2011).
- Parry, D. H., O'Farrell, P. H. The schedule of destruction of three mitotic cyclins can dictate the timing of events during exit from mitosis. Current Biology. 11 (9), 671-683 (2001).
- Holloway, S. L., Glotzer, M., King, R. W., Murray, A. W. Anaphase is initiated by proteolysis rather than by the inactivation of maturation-promoting factor. Cell. 73 (7), 1393-1402 (1993).
- Dharmasiri, N., Estelle, M. Auxin signaling and regulated protein degradation. Trends Plant Sci. 9 (6), 302-308 (2004).
- MacDonald, B. T., Tamai, K., He, X. Wnt/beta-catenin signaling: components, mechanisms, and diseases. Developmental Cell. 17 (1), 9-26 (2009).
- Chen, X., et al. Processing and turnover of the Hedgehog protein in the endoplasmic reticulum. The Journal of Cell Biology. 192 (5), 825-838 (2011).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Yi, J. J., Ehlers, M. D. Emerging Roles for Ubiquitin and Protein Degradation in Neuronal Function. Pharmacological Reviews. 59 (1), 14-39 (2007).
- Rubinsztein, D. C. The roles of intracellular protein-degradation pathways in neurodegeneration. Nature. 443 (7113), 780-786 (2006).
- Müller, P., Schier, A. F. Extracellular Movement of Signaling Molecules. Developmental Cell. 21 (1), 145-158 (2011).
- Eldar, A., Rosin, D., Shilo, B. -Z., Barkai, N. Self-enhanced ligand degradation underlies robustness of morphogen gradients. Developmental Cell. 5 (4), 635-646 (2003).
- Zhou, P. Determining protein half-lives. Methods In Molecular Biology. 284, 67-77 (2004).
- Woodside, K. H. Effects of cycloheximide on protein degradation and gluconeogenesis in the perfused rat liver. Biochim Biophys Acta. 421 (1), 70-79 (1976).
- Schimke, R. T., Doyle, D. Control of enzyme levels in animal tissues. Annual Review of Biochemistry. 39, 929-976 (1970).
- Kenney, F. T. Turnover of rat liver tyrosine transaminase: stabilization after inhibition of protein synthesis. Science. 156 (3774), 525-528 (1967).
- Müller, P., et al. Differential Diffusivity of Nodal and Lefty Underlies a Reaction-Diffusion Patterning System. Science. 336 (6082), 721-724 (2012).
- Kiuchi, T., Nagai, T., Ohashi, K., Mizuno, K. Measurements of spatiotemporal changes in G-actin concentration reveal its effect on stimulus-induced actin assembly and lamellipodium extension. The Journal of Cell Biology. 193 (2), 365-380 (2011).
- Plachta, N., Bollenbach, T., Pease, S., Fraser, S. E., Pantazis, P. Oct4 kinetics predict cell lineage patterning in the early mammalian embryo. Nature Cell Biology. 13 (2), 17-123 (2011).
- Drocco, J. A., Grimm, O., Tank, D. W., Wieschaus, E. Measurement and Perturbation of Morphogen Lifetime: Effects on Gradient Shape. Biophys J. 101 (8), 1807-1815 (2011).
- Zhang, L., et al. Method for real-time monitoring of protein degradation at the single cell level. BioTechniques. 42 (4), 446-450 (2007).
- Miyawaki, A. Proteins on the move: insights gained from fluorescent protein technologies. Nat Rev Mol Cell Biol. 12 (10), 636-668 (2011).
- Pantazis, P., Supatto, W. Advances in whole-embryo imaging: a quantitative transition is underway. Nat Rev Mol Cell Biol. 15 (5), 327-339 (2014).
- Lukyanov, K. A., Chudakov, D. M., Lukyanov, S., Verkhusha, V. V. Innovation: Photoactivatable fluorescent proteins. Nat Rev Mol Cell Biol. 6 (11), 885-891 (2005).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nature Biotechnology. 24 (4), 461-465 (2006).
- Zou, J., Wei, X. Transplantation of GFP-expressing Blastomeres for Live Imaging of Retinal and Brain Development in Chimeric Zebrafish Embryos. Journal of Visualized Experiments. (41), (2010).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. Journal of Visualized Experiments. (27), (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. Journal of Visualized Experiments. (25), (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), (1995).
- McKinney, S. A., Murphy, C. S., Hazelwood, K. L., Davidson, M. W., Looger, L. L. A bright and photostable photoconvertible fluorescent protein. Nature Methods. 6 (2), 131-133 (2009).
- Dempsey, W. P., Qin, H., Pantazis, P. In Vivo Cell Tracking Using PhOTO Zebrafish. Methods in Molecular Biology. 1148, 217-228 (2014).
- Schier, A. F. Nodal Morphogens). Cold Spring Harbor Perspectives in Biology. 1 (5), a003459-a003459 (2009).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans Syst Man Cybern. 9 (1), 62-66 (1979).
- Pédelacq, J. -D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nature Biotechnology. 24 (1), 79-88 (2005).
- Swulius, M. T., Jensen, G. J. The Helical MreB Cytoskeleton in Escherichia coli MC1000/pLE7 Is an Artifact of the N-Terminal Yellow Fluorescent Protein Tag. Journal of Bacteriology. 194 (23), 6382-6386 (2012).
- Landgraf, D., Okumus, B., Chien, P., Baker, T. A., Paulsson, J. Segregation of molecules at cell division reveals native protein localization. Nature Methods. 9 (5), 480-482 (2012).
- Stadler, C., et al. Immunofluorescence and fluorescent-protein tagging show high correlation for protein localization in mammalian cells. Nature Methods. 10 (4), 315-323 (2013).
- Quattrocchio, F. M., Spelt, C., Koes, R. Transgenes and protein localization: myths and legends. Trends Plant Sci. 18 (9), 473-476 (2013).
- Morimoto, Y. V., Kojima, S., Namba, K., Minamino, T. M153R Mutation in a pH-Sensitive Green Fluorescent Protein Stabilizes Its Fusion Proteins. PLoS ONE. 6 (5), e19598(2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Waters, J. C. Accuracy and precision in quantitative fluorescence microscopy. The Journal of Cell Biology. 185 (7), 1135-1148 (2009).
- Moll, U. M., Petrenko, O. The MDM2-p53 interaction. Mol Cancer Res. 1 (14), 1001-1008 (2003).
- Auer, T. O., Duroure, K., De Cian, A., Concordet, J. P., Del Bene, F. Highly efficient CRISPR/Cas9-mediated knock-in in zebrafish by homology-independent DNA repair. Genome Research. 24 (1), 142-153 (2014).
- Bedell, V. M., et al. In vivo genome editing using a high-efficiency TALEN system. Nature. 491 (7422), 114-118 (2012).
- Hruscha, A., et al. Efficient CRISPR/Cas9 genome editing with low off-target effects in zebrafish. Development. 140 (24), 4982-2987 (2013).
- Hwang, W. Y., et al. Heritable and Precise Zebrafish Genome Editing Using a CRISPR-Cas System. PLoS ONE. 8 (7), 68708(2013).
- Hwang, W. Y., et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nature Biotechnology. 31 (3), 227-229 (2013).
- Zu, Y., et al. TALEN-mediated precise genome modification by homologous recombination in zebrafish. Nature Methods. 10 (4), 329-331 (2013).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of Zebrafish Early Embryonic Development by Scanned Light Sheet Microscopy. Science. 322 (5904), 1064-1069 (2008).
- Blanchet, M. H., et al. Cripto Localizes Nodal at the Limiting Membrane of Early Endosomes. Science Signaling. 1 (45), ra13-ra13 (2008).
- Jullien, J., Gurdon, J. Morphogen gradient interpretation by a regulated trafficking step during ligand-receptor transduction. Genes & Development. 19 (22), 2682-2694 (2005).
- Incardona, J. P., et al. Receptor-mediated endocytosis of soluble and membrane-tethered Sonic hedgehog by Patched-1. Proceedings of the National Academy of Sciences of the United States of America. 97 (22), 12044-12049 (2000).
- Scholpp, S., Brand, M. Endocytosis Controls Spreading and Effective Signaling Range of Fgf8 Protein. Current Biology. 14 (20), 1834-1841 (2004).
- Bläßle, A., Müller, P. PyFDAP: Automated analysis of Fluorescence Decay After Photoconversion (FDAP) experiments. Bioinformatics. In Press, forthcoming (2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır