Method Article
质粒来源的DNA链置换盖茨实施化学反应网络
摘要
This protocol describes a method for deriving DNA strand displacement gates from plasmids and testing them using fluorescence kinetics measurements. Gates can be modularly composed into multi-component systems to approximate the behavior of formal chemical reaction networks (CRN), demonstrating a new use for CRNs as a molecular programming language.
摘要
DNA nanotechnology requires large amounts of highly pure DNA as an engineering material. Plasmid DNA could meet this need since it is replicated with high fidelity, is readily amplified through bacterial culture and can be stored indefinitely in the form of bacterial glycerol stocks. However, the double-stranded nature of plasmid DNA has so far hindered its efficient use for construction of DNA nanostructures or devices that typically contain single-stranded or branched domains. In recent work, it was found that nicked double stranded DNA (ndsDNA) strand displacement gates could be sourced from plasmid DNA. The following is a protocol that details how these ndsDNA gates can be efficiently encoded in plasmids and can be derived from the plasmids through a small number of enzymatic processing steps. Also given is a protocol for testing ndsDNA gates using fluorescence kinetics measurements. NdsDNA gates can be used to implement arbitrary chemical reaction networks (CRNs) and thus provide a pathway towards the use of the CRN formalism as a prescriptive molecular programming language. To demonstrate this technology, a multi-step reaction cascade with catalytic kinetics is constructed. Further it is shown that plasmid-derived components perform better than identical components assembled from synthetic DNA.
引言
Watson-Crick碱基配对的可预测性使得动态DNA纳米技术成为一个可编程的方式来设计分子器件的动态性能1,2。特别是,DNA链置换 - 一个可编程的,有竞争力的杂交反应 - 已被证明是一个强大的机制,为工程动态DNA系统。在DNA链置换反应,进入的寡核苷酸取代之前被绑定的"输出"从一个互补结合配偶链。多个这样的反应可以被链接在一起成为多步反应级联具有高程度的控制的次序和个别反应的定时执行步骤3。 DNA链置换级联已被用于创建数字和模拟分子电路4-7,可切换的纳米结构8-10,自主分子马达11-15和非共价催化放大器13,16-21。此外,D使用链置换反应NA设备可以模拟和设计为使用电脑辅助设计软件22-24的各种应用。
目前,化学合成的DNA用作DNA纳米技术的主要材料。然而,在DNA合成过程中的错误,并将所得不完善寡核苷酸,被认为通过使错误的副反应,以限制动态脱氧核糖核酸设备的性能。例如,"泄漏"的反应可能会导致一个输出寡核苷酸即使在不存在反应触发的释放。这样的效果是最明显的在催化反应级联,其中初始泄漏的甚至最小量,最终会造成在级联19,20的完全激活。相反地,反应往往不能达到活化性的预期水平,因为一些组件甚至不以预期的输入7,25的存在下引发。为了使性能基于DNA的纳米器件可比其生物蛋白质基对口,例如错误模式需要被显着减少。
细菌质粒或其它生物的DNA可作为高纯度DNA纳米技术的应用相对便宜的来源。可以通过复制在细菌中产生的大量的DNA和生命系统的固有校对能力确保所得DNA的纯度。事实上,最近的一些论文已经认识到生物体DNA的纳米技术应用21,26-28的潜在效用。然而,质粒DNA的完全双链性质迄今禁止使用作为用于制造动态脱氧核糖核酸设备,其典型地由多个寡核苷酸,并含有两个双链和单链结构域的材料。在最近的论文29这个问题被解决,而且主要由有缺口的双链DNA(ndsDNA)一个新的DNA栅极架构是引入ð。
重要的是,ndsDNA门系统可以设计实现由任何正式的化学反应网络(CRN)29所指定的动力学。 ndsDNA门因此可以使用,在原则上,创造,表现出震荡和混乱,双稳态和记忆,布尔逻辑或算法的行为30-38动力系统。例如,参考文献29展示了三个反应CRN所提供的分子实施的"共识"的协议,一个类型的分布式计算算法29,39,40。这项工作首次证明的新用途为CRN形式主义作为一种"编程语言",用于快速合成功能分子体系( 图1A)。
这里,提供了一种用于从质粒DNA ndsDNA栅极的详细协议。首先是程序设计过程中的审查。然后接着含有如何合成寡核苷酸的解释栅极序列克隆到质粒和序列验证,并经由细菌培养扩增。接着,它示出了如何ndsDNA门可以从质粒通过酶处理而衍生( 参见图2)。最后,对于使用荧光动力学测定法测试栅极行为的方法概述。
反应机理
作为一个例子,该协议的重点是催化化学反应A + B-> B + C。物种A,B和 C("信号", 图1B)的所有对应于不同的单链DNA分子。这些分子的序列是完全独立的,股线不相互直接反应。所有信号的序列具有两种不同的功能性结构域,例如,亚序列,其作用一起在链置换反应:1)一个短立足点域(标签TA,TB,TC),其用于链偏差R引发反应的影响,和2)一个长域(标签的a,b,c)在确定信号的身份。
信号链之间的相互作用是由带切口的双链DNA(ndsDNA)栅极络合物介导的(称为加入AB和叉子BC)和辅助单链物种(,,和)。正式反应A + B-> B + C是通过一系列的链置换反应步骤,其中每个反应步骤暴露立足点用于随后的反应(图1B)执行。在这个例子中, 信号 A和B最初游离在溶液中,同时信号 C被结合到叉栅极。在反应B和C的端部都在溶液中。更一般地,绑定到一个栅极信号是无效的,而这是在溶液中游离的信号是活动的,即,它们可参与链置换反应作为输入。反应的时间过程是使用荧光报告策略(图1C)执行。在先前的工作29,证实该反应机理,不仅实现了正确的化学计量,而且目标反应的动力学。
研究方案
1.序列设计
注:序列设计概述:在本节中,战略设计质粒来源的DNA门描述。放置在门的任一端上切酶位点,以允许完全双链栅极消化后释放。切口位点,然后放置,使得酶创建在顶链缺刻,以创建最终ndsDNA栅极。最后,剩余的序列被选择为使得独立结构域彼此正交并且不表现出的二级结构。
- 放置Nt.BstNBI切口位点四种核苷酸远离各长域的3'端(A,B,C,R,和i)。放置Nb.BsrDI切口位点上的每个长域的5'端(A,B,c和河注意,域I没有任何Nb.BsrDI切口位点)。 图2C示出的详细序列视图加入AB和BC叉大门。
- 放置PvuⅡ限制位点上ndsDNA门的两端以便PvuⅡ位消化可以释放从质粒的栅极(见图2C)。
- 通过以下两个原则设计其他无约束的序列:(1)链不应表现出的二级结构(DNA结构可以使用Nupack 41预测),和(b)所有的域应正交以减少串扰。
- 放置ndsDNA序列在栅极模板的中心。放置在栅模板的两端30-40 bp的随机间隔序列中,每个隔离物作为唯一结合位点对下列聚合酶链反应(PCR)。
2.克隆NdsDNA盖茨到质粒
注意:本节介绍吉布森克隆方法插入4份门到质粒骨架。
- 为了ndsDNA栅极模板作为从一个制造商的DNA双链基因组块(栅极模板序列示在表1中;链发生在ndsDNA栅极示于表2;域级别序列示于表3)。
- 接收到有序的DNA后,旋含有基因组块的管子在10,000-14,000×g离心1分钟,以确保所有的干燥的DNA是在管的底部。
- 重悬在无DNA酶的水将干燥的基因组块,以实现10毫微克/微升的最终浓度。
注意:可替换地,DNA可使用1倍的Tris乙二胺四乙酸(EDTA)缓冲液重悬(TE缓冲液:10mM Tris和1mM EDTA的,pH为8.0)。然而,EDTA是一种螯合剂二价阳离子和能抑制PCR。 - 生成与通过标准PCR不同重叠区具有高保真DNA聚合酶( 见图 3A)4栅极片段。引物序列在表4中详细(这些引物熔解温度为62℃)。
- 运行在1 2%琼脂糖凝胶40 V在室温30分钟(为一个详细的琼脂糖凝胶电泳协议见42),并切对应于每个PCR频带扩增片段从凝胶中。然后纯化使用凝胶提取试剂盒(请参考材料),按照制造商的说明将凝胶切片。
- 根据制造商的方案消化高拷贝数质粒骨架(见材料)用PvuII-HF和PstⅠ-HF,于37℃进行1小时( 见表 5)。 PvuII位-HF和PstI-HF是高保真限制性内切酶,显着降低非特异性切割。
- 运行1.5%琼脂糖凝胶和削减线性主链(通常运行在RT凝胶在140 V代表30-40分钟)。然后提取由使用凝胶提取试剂盒根据制造商的说明,将凝胶切片的脱氧核糖核酸。
- 与线性化载体和纯化的PCR片段进行吉布森组件 43(见表6和图3B )在50℃下1小时。
- 从步骤2.8到大肠杆菌(大肠杆菌)和板在含有氨苄青霉素抗生素(以100μg/ ml的浓度)一个LB培养基(LB)琼脂平板变换吉布森组装品。通过电穿孔或热激方法44,45进行转换,并使用相应的大肠杆菌大肠杆菌菌株 。例如,使用E. JM109株热休克改造,并使用DH5α电感受态E.大肠杆菌细胞的电穿孔。
注意:使用的质粒主链中含有一个氨苄青霉素抗性盒。如果使用不同的选择标记,使用适当的抗生素,而不是氨苄青霉素。
3.细菌培养扩增及质量控制
注意:本节介绍了大批量生产含有质量控制后,DNA大门质粒和隔离。
- 挑取单个菌落从氨苄青霉素选择性板从步骤2.9和孵化的3毫升含氨苄青霉素抗生素富集培养基中培养(以100μg/ ml的浓度)。标记菌落,使得它可以再在随后的实验步骤被利用。成长的文化,在37°CO / N剧烈振荡(200-300转)。通常情况下,孵育16-24小时。
- 提取使用Mini-prep试剂盒按照制造商的说明,将细菌培养物的质粒DNA。
- 测量使用按照制造商的说明,用分光光度计的纯化质粒DNA。典型的产量范围为50-1000纳克/微升。
- 获得所提取的质粒DNA通过将样品发送到DNA测序公司测序。测序引物应上游位于约100个核苷酸和该区域的下游待测序;测序引物为质粒(见材料质粒)具有以下序列:ATTACCGCCTTTGAGTGAGC。
没有德:如果顺序错误或重组的插入ndsDNA门,从步骤2.9中选择从板块不同的殖民地。按照步骤3.1-3.4验证插入门的顺序是正确的。 - 验证所述序列是正确的之后,挑从氨苄青霉素选择性板(来自步骤2.9)中相应的集落,和孵育的含有氨苄青霉素的抗生素800毫升了不起肉汤(TB)的培养(以100μg/ ml的浓度)。生长的培养在37℃进行16-24小时,剧烈振荡(200-300转)结核病尤其非常适合于高产质粒的生产。
注意:可替换地,LB也可用于生长的细菌虽然质粒产量可能是一个问题。 - 净化用马克西prep试剂盒按照制造商的说明将DNA。
- 按照步骤3.3-3.4,检查顺序是否正确。如果有任何重组发生,请参见下面的注意事项。否则,继续前进到第4步。
注:这里的一个可能的问题是,插入门中的质粒多个副本可能由于重组DNA修复。为了解决这个问题,使用大肠杆菌大肠杆菌菌株缺乏的recA蛋白(与DNA修复蛋白质),例如JM109或DH5α转化先前序列验证质粒(即没有任何序列的错误和重组)。然后选择从该板块一个菌落,并送样到DNA测序公司核实质粒序列。
4.酶处理
注意:这部分描述的过程用于消化,使得它们被切割和缺口在正确的位置,并准备用于动力学实验的质粒。
- 消化从步骤3.7中纯化的质粒DNA用限制性酶PvuⅡ位-HF 1小时,在37℃( 见表 7)。通常情况下消化质粒与4个单位1毫克质粒的PvuⅡ-HF的。高FIDelity限制性内切酶,建议使用,因为它们极大地降低非特异性切割。
- 对样品进行乙醇沉淀。
- 添加冰冷的无水乙醇2等体积的样品。
- 在-80℃下孵育混合物至少1小时(该混合物还可以坐在在-80℃为O / N)。
- 离心机在10,000-14,000×g离心在0℃下30分钟。
- 去除上清。
- 添加1000微升的RT 95%乙醇到样品,并倒转10-15次。
- 离心机在10,000-14,000×g离心在4℃下进行10分钟。
- 取下板凳上清,空气干燥10-20分钟。
- 重悬DNA沉淀核酸自由H 2 O(通常为100-200微升)的适当的音量。增加超过200微升一般会做出样品太稀了在动力学实验中使用。
- 测量以下的米使用分光光度计,将重新悬浮的DNAanufacturer的说明。
- 消化连接栅极与切口酶Nb.BsrDI在65℃下1小时使用每1微克质粒4单位的酶(见表8);消化叉栅极与切口酶Nt.BstNBI在55℃1小时使用每1微克质粒8单位的酶(见表9)。
注:步骤4.2去除酶消化缓冲液,并有助于集中闸门的动力学实验。 4.2步可以跳过加入大门,因为这两个限制性内切酶的PvuⅡ-HF和切口酶Nb.BsrDI共享相同的消化缓冲液。在步骤4.2.8,核酸酶游离H 2 O来代替TE因为EDTA是一种螯合剂二价阳离子和能抑制需要这些离子的功能限制酶。
注:加入的酶的过量可能导致大量的初始电路泄漏(图4),这很可能是由过度消化46引起的。这个问题CAn乘优化酶的量来处理( 见图 4)。典型的范围酶为1-10个/ 1微克质粒。
5.制备单链寡核苷酸的
注意:这部分描述的协议重悬浮和定量化学合成出的单链DNA(ssDNA),将用于信号股线和辅助链。为链序列见表 10。请注意,以下方案是制备10μM的单链DNA的一个例子。其它浓度的ssDNA可类似地制备。
- 从制造商的DNA寡聚接收后,旋含有DNA的管子在10,000-14,000×g离心1分钟,以确保所有的干燥的DNA是在管的底部。
- 重悬使用1倍的Tris乙二胺四乙酸(EDTA)缓冲液的DNA(TE缓冲液:10mM Tris和1mM的EDTA,pH8.0)中以达到100μM的终浓度。对于例如,重悬8纳摩尔的DNA在80微升TE缓冲液中。
- 混合10微升的DNA,在100μM与90微升水分子在微量离心管中,这应该达到10μM的最终浓度。
- 测量使用按照制造商的说明,用分光光度计DNA样品的确切浓度。以下方案提供了如何DNA浓度可以测量的一个例子。
- 空白用2微升水分子的分光光度计。
- 测量吸光度在DNA样品为260nm(A 260)。使用下面的公式来计算的库存浓度。
注:样品浓度为M = 260 /消光系数。消光系数可以在规范数据表由该DNA制造商中找到。
6.准备荧光记者的
注意:本节介绍协议用 于制备记者℃,其它荧光报告可以类似地组装。
- 订购高效液相色谱法(HPLC)纯化的寡核苷酸ROX- ( 记者C的顶部链)和 -rq由DNA制造商( 记者C的底部股)( 见表 10的序列)。
- 在接收到合成的寡核苷酸,重悬和定量的步骤5中说明的样品。
- 混合记者顶部和底部股( 即 ROX- 和 -rq)在1X的Tris醋酸-EDTA(TAE)与12.5毫米的镁离子(见表11的详细食谱)。注意,这里30%过量的猝灭剂标记链的 -rq加入到装配记者,这确保了所有荧光团标记的链被骤冷,即使不完美的化学计量。
- 退火使用热循环仪的记者C复合体 ,从95℃冷却至20℃以1℃/ min的速率。样品可以贮存于4℃。
7.荧光测量
注意:部分描述的一般协议,用于荧光动力学测量(参见图5为实验程序),并将该协议将在步骤8,9被使用,和10.还要注意,该协议是一种使用一荧光分光光度计的。可替代地,这些实验也可以在平板读数器进行,尽管灵敏度,油井到井变化和缺乏在长期实验的温度控制可能是一个问题。
- 设定温度控制器至25℃,并等待温度稳定。利用温度控制器可以是可导致温度变化的信号中减少可变性。
- 设置适当的参数FO- [R动力学测量的荧光分光光度计的数据采集软件。具体的例子设置如下:
- 设置狭缝宽度为2.73纳米为激发和发射单色器。
- 对于每60秒的时间点设置的积分时间为10秒。总的测量时间设置为24小时。
- 设置的激发/发射波长,以匹配在实验中使用荧光团。实施例的波长如下:ROX(588毫微米/ 608毫微米)和TAMRA(559毫微米/ 583毫微米)。
- 添加核酸自由H 2 O和10倍含125毫米镁离子(10X TAE / 镁离子),以合成石英细胞的Tris-乙酸乙二胺四乙酸缓冲。 参见表12,13,和14例如卷以使用。
- 添加聚T股以达到〜1μM的(见表12,13,和 14卷)的终浓度,然后涡合成石英细胞10-15秒。一般情况下,枪头将非特异性结合的DNA。加入高浓度的聚T股线可以减少这种非特异性结合的错误。
- 加入记者和辅助链。 见表12,13,和14例如卷以使用。注意,对于记者校准,不需要辅助链。
- 加入10%十二烷基硫酸钠(SDS)以达到0.15%的SDS的终浓度。注意:SDS用于分离来自质粒衍生的栅极酶,因为酶可以与链置换反应(见图6)干扰。 SDS这里推荐,而不是酶的热变性,以避免分解和栅极股线,从而对电路的功能产生不利影响的不正确重组。
- [跳过对记者校准这一步。]
- 添加加入和叉门(见表13和14卷)到合成石英池中并吹打它向上和向下混合溶液进行至少20次(不涡反应杯因为涡旋溶液用SDS可导致气泡,这将影响荧光动力学的测量)。
- 另外,将移动到以下测量步骤尽快因为泄漏反应加入加入和叉门对合成石英细胞后立即启动。
- 放置合成石英细胞进入一个分光的腔室。
- 启动动力学测量。
- 5分钟后测量的,输入链(见表12,13,和 14卷)添加到合成石英池中并混合反应吹打它向上和向下的至少20倍。注意,样品应温和地混合,以避免气泡。而数据采集程序暂停,以避免测量信号由外部触发执行此步骤光。
- 记录反应动力学,直到达到稳定状态。反应动力学显示在电脑上。
8.校准荧光记者
注意:本节介绍的协议使荧光记者的校正曲线。校正曲线将被用于任意的荧光单位转换为摩尔浓度信号。
- 校准荧光报告下列步骤7.使用的反应物和缓冲液的体积中描述的协议如概括在表12中的标准浓度在这个例子是为50nM(1倍)。记者们在3倍;输入为1个。为的情况下输入是在0.25×,0.5×,0.75倍,调节核酸酶游离H的容积2 O相应于保持每个反应的最终体积为600微升。的示例性数据示于图7A。
- 使的校准曲线记者通过对信号 C的初始浓度的最终的荧光值的线性拟合,-C(一个例子校准曲线示于图7B)。该校准曲线可用于任意的荧光单位转换为它的相应的信号的浓度。
9.量化质粒衍生ndsDNA盖茨的浓度
注意:每个独立处理一批质粒得到ndsDNA门导致不同的收益率功能的门,而这部分描述了一个协议,用于量化质粒得到ndsDNA门的浓度。
- 量化以下作为总结在表13中步骤7.使用反应试剂的量描述的协议质粒衍生ndsDNA栅的浓度注: 表13描述的示例配方叉公元前定量加入 。 AB和其他门可以类似地进行,但使用不同的输入链,辅助丝以及记者。
- 转换在该实验测量到信号 C的使用校准曲线从步骤8.2的浓度的最终荧光值。然后回到-计算ndsDNA门口集中。例如,对于栅极量化实验对应于设在图7B的校正曲线上25nM的信号 C(0.5×)的最终荧光值。因为叉BC的储液稀释40倍,该反应中,原料浓度的叉公元前栅极的是1微米。
10.动力学测量反应A + B-> B + C
注意:本节描述了一个协议,用于测试的DNA实现利用荧光动力学测量一个正式的化学反应。
- 每形式动力学测量通过以下中的试剂和缓冲液的步骤7.使用卷描述的协议如表14。
结果
对于功能测试,脱氧核糖核酸实现双分子催化反应( 即A + B-> B + C)的创建。的质粒衍生门的性能进行了比较门从合成的DNA装配。催化反应是一个很好的测试门纯度,因为一个错误的门可以不可逆陷阱的催化剂,导致产品的量不成比例的影响产生的18,19。在同一时间,导致催化信号的未触发释放的小泄漏反应将被线性放大,从而导致不成比例误差信号。对于质粒衍生并合成门实验数据显示在图8B和8C分别。在实验中,信号链A的浓度是固定的,而催化信号B的量是变化的。 信号 C是用来读出反应的进行,而无需中断催化周期。催化用的数据可以观察到,因为反应接近完成,即使催化剂 B的量超过A的量要小得多。因为SDS没有添加到实验用合成的系统来完成,反应速度(即可能受到影响通过加入SDS的)不进行比较和分析的焦点是代替上催化周转(详细如下)。
进行该反应的催化周转的进一步分析。营业额被定义为产生用于在给定时间各催化剂B中的量信号 C。具体而言,营业额从我们的实验数据通过将泄漏减去信号 C通过催化剂b的加成初始量来计算。对于理想的催化系统,该转换数应该随时间线性增加,并且,只要在基板并不限制独立催化剂的量的。在实际系统中,出现故障门可以禁用的猫 alysts和营业额将达到即使不是所有可用的底物转化成产物的最大值。最高成交值表示有多少基体( 信号 A)的催化剂( 信号 B)可以变得灭活之前进行转换。这里,可以观察到合成体系从营业额的理想线性增加比质粒衍生系统早得多偏离那样,通过一个不希望的副反应( 图8D),表明该催化剂的封存。周转比较仅示出为低浓度,因为在高浓度的催化剂,所有闸门将被触发并释放信号 C.电路泄漏也进行比较,可以观察到漏信号的使用质粒衍生的栅极比大于10小时的反应(图8E)之后,使用合成的栅极少约8%。
尔斯/ ftp_upload / 53087 / 53087fig1.jpg"/>
图1(A)CRNS作为指令性的编程语言。的DNA反应网络可以被设计来近似一个正式的CRN的动力学(B)的 DNA的实现的示例化学指令:A + B-> B + C。 DNA链被绘制为箭头线在3'端和*表示的互补性。所有的信号链 A(,绿),B( B>,橙色) 和 C(,红)都包括一辆立足点域(标记为TA,TB和TC)和一个标识域(标记为a,b和c)。双分子反应A + B-> B + C需要两个多股复合加入AB和BC叉 ,和四个辅助股,,和<我TC>。该反应通过七个步骤链置换的,其中每个步骤开始s的立足点结合。(C)记者策略。该反应使用报告,其中,底链标记有荧光团(红点)和顶链附着到淬灭剂(黑点),随后。因为共定位的荧光团和猝灭剂的,记者荧光淬灭在原封记者。 信号 C可以取代记者的顶链,从而增加荧光。 (这个数字已经被修改编号29)。 请点击此处查看该图的放大版本。
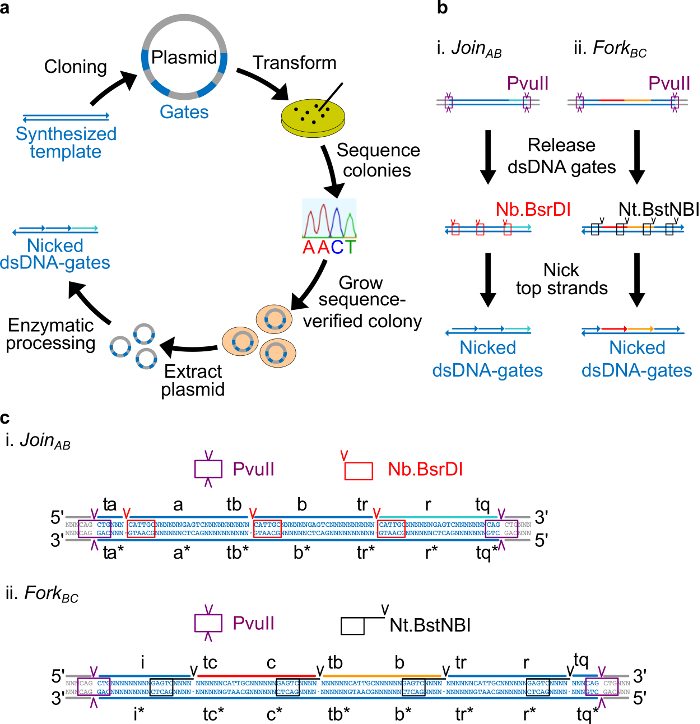
图2.(A)NdsDNA门从细菌质粒DNA进行。双链ndsDNA栅极模板的多个拷贝被克隆到质粒。克隆的质粒是ñ 转化 E. 的大肠杆菌细胞和在平板上菌落序列验证。一旦序列被证实,质粒DNA被扩增和萃取。最后,将双链质粒被加工成通过酶处理所需ndsDNA栅极。ndsDNA门(B)的酶处理。限制性内切酶PvuII位被用来从质粒释放门。所释放的栅极被使用切口酶进一步处理:Nb.BsrDI用于产生刻痕为加入AB(面板ⅰ); Nt.BstNBI用于产生刻痕为叉公元前 (面板ⅱ)。限制和切口部位被表示为颜色编码框。栅极模板(C)顺序图加入AB(面板i)和叉BC(第二小组) 的 PvuⅡ限制位点(紫色框高亮显示)是在两端的ndsDNA大门。该Nb.BsrDI和NT.BstNBI切口部位用红色和黑色框高亮显示。切口的位置都标有箭头。序列N是任何核苷酸。 (这个数字已经修改与参考29的许可。) 点击此处查看该图的放大版本。
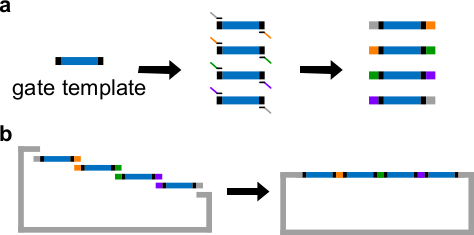
图3.(A)PCR的DNA门模板。一种DNA栅极模板包含两端在中心ndsDNA栅极序列(蓝色区域),和间隔序列(黑色区域;这两个端序列是正交的)。引物可以结合到栅极模板的间隔序列,并产生四个重叠的DNA片段通过PCR(重叠序列是彩色编码在图中)。(B)的吉布森组件。四扩增的DNA fragmenTS然后再组装成通过吉布森装配方法43的线性质粒骨架。 (这个数字已经修改与参考29的许可。) 点击此处查看该图的放大版本。
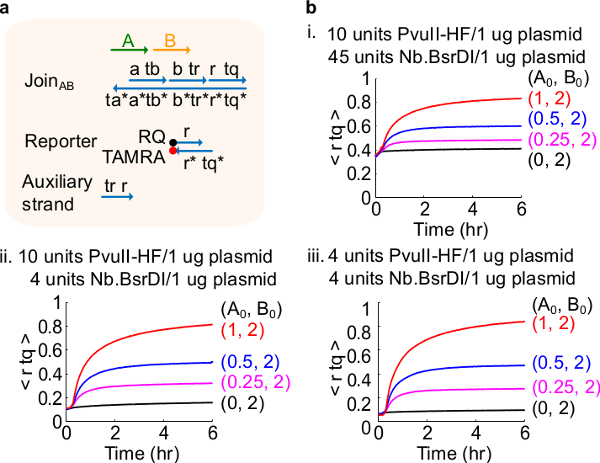
图4.电路的性能,不同的酶量。(A)用于相应的实验门口,记者,副股和信号链的简化表示。(B)动力学实验质粒衍生加入AB处理不同的酶量。一世。 10单位的PvuⅡ-HF和45单位Nb.BsrDI的每1质粒微克;二。 10单位的PvuⅡ-HF的和4个单位Nb.BsrDI每1微克的质粒;三。 4单位的PvuⅡ-HF的和4个单位Nb.BsrDI每1微克质粒。所有辅助股均在2倍(1X = 10nM的)。栅极络合物是1.5倍,并且该实验在35℃于1×TAE / 镁离子进行。 (这个数字已经修改与参考29的许可。) 点击此处查看该图的放大版本。
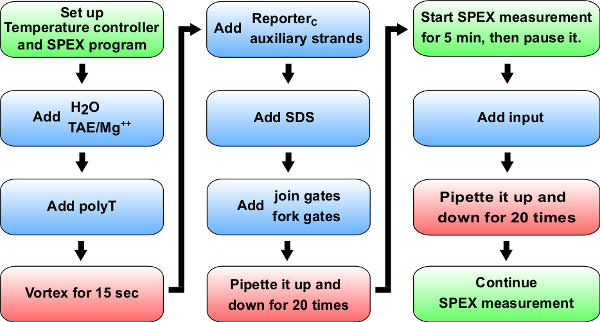
图5流程图动力学实验蓝:材料添加到比色皿(0.875毫升合成石英电池)。 参考表14的特定卷添加为A + B动力学实验- > B + C。绿色:说明一个荧光分光光度计(标记为SPEX)的。红色:混合说明。53087fig5large.jpg"目标="_空白">点击此处查看该图的放大版本。
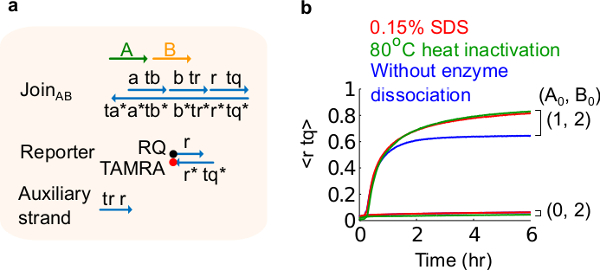
图6.酶的解离和电路行为。(A)用于相应的实验门口,记者,副股和信号链的简化表示。(二)质粒衍生加入AB用80℃的热动力学实验失活(绿色迹线),0.15%十二烷基硫酸钠(SDS)(红色),以及无热灭活或加成物的SDS(蓝色)的控制。标准浓度为1×= 10纳米,以及所有辅助股和输入B组的2倍。栅极络合物是1.5倍,并且该实验在35℃在含12.5毫镁离子(1×TAE / 镁离子1×Tris-醋酸-EDTA缓冲液进行)。 (这个数字已经被修改编号29)。 请点击此处查看该图的放大版本。
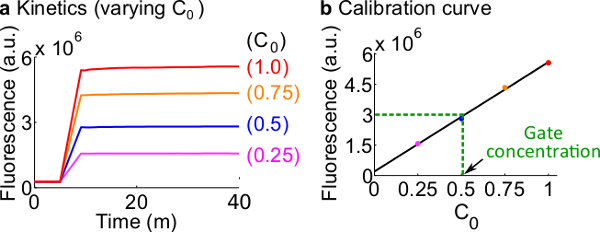
图7.记者校准。(A) 记者Ç 动力学。记者的浓度为在3×(1×= 50纳米),和信号 C的初始浓度被表示在图中。(B)的信号C的测量终点(40分钟)的荧光水平显示了一个线性关系信号 C的初始浓度。在公元前叉门(绿色虚线)的量化的例子, 叉BC的荧光值是衡量d为1 3×10 6(AU),相当于25纳米(0.5倍)的校准曲线。 请点击此处查看该图的放大版本。
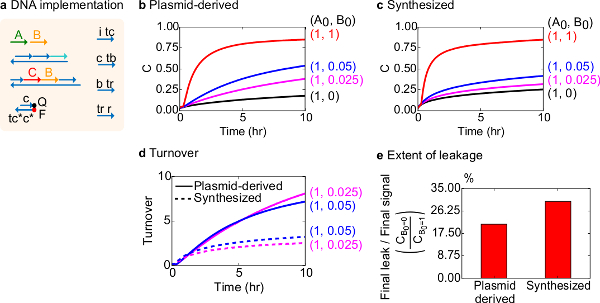
图8,双分子催化反应动力学(A + B-> B + C)。(A)简化了门,记者,副股,并用于相应的实验信号链的表示。实验在含12.5毫镁离子(1×TAE / 镁离子)1×Tris-乙酸-EDTA缓冲液中运行。所有栅极复合物,在75纳米浓度(1.5倍),和辅助的股粘度在100nM浓度(2×)。动力学质粒衍生门和数据的数据合成栅极示于(B)和(C)的 ,分别。信号是在50纳米(1倍)。的不同量的信号(催化剂)的系统中进行了介绍,并且将反应混合物在35℃下测试。(D)的质粒衍生的栅极发挥周转时相比,加入少量的输入的合成的DNA栅极更高。(E)的范围泄漏。条形图显示了最终泄漏到最终信号(C B 0 = 0 / C B0 = 1)在端点(10小时)的比值。 (这个数字已经被修改编号29)。 请点击此处查看该图的放大版本。
| 门模板 | 序列 | 长度(NT) |
| JoinAB | TCTAGTTCGATCAGAGCGTTATTACCAGTAGTCGATTGCTCAGCTGCTACATTGCTTCTACGAGTCATCCTTCCACCATTGCACCTTAGAGTCCGAATCCTACCATTGCTTAACCGAGTCTCACAACCAGCTGTCATTATGGACTTGACACACAGATTACACGGGAAAGTTGC | 173 |
| FORKBC | TCTAGTTCGATCAGAGCGTTATTACCAGTAGTCGATTGCTCAGCTGCCATCATAAGAGTCACCATACCCACATTGCCACATCGAGTCCCTTTTCCACCATTGCACCTTAGAGTCCGAATCCTACCATTGCTTAACCGAGTCTCACAACCAGCTGTCATTATGGACTTGACACACAGATTACACGGGAAAGTTGC | 194 |
表1的ndsDNA门模板序列。
| 门 | 缕 | 下链的长度(NT) |
| JoinAB | JoinAB底,,, | 87 |
| ForkBC | ForkBC底,,,, | |
| 108 |
表2。钢绞线,包括加入AB和BC叉 (该表已被修改,从文献29)。
| 域 | 序列 | 长度(NT) |
| TA | CTGCTA | 6 |
| TB | TTCCAC | 6 |
| TC | TACCCA | 6 |
| TR | TCCTAC | 6 |
| TQ | AACCAG | 6 |
| 一个 | CATTGCTTCTACGAGTCATCC | 21 |
| b | CATTGCACCTTAGAGTCCGAA | 21 |
| C | CATTGCCACATCGAGTCCCTT | 21 |
| ř | CATTGCTTAACCGAGTCTCAC | 21 |
| 一世 | CTGCCATCATAAGAGTCACCA | 21 |
| 引物链 | 序列 | 长度(NT) |
| 正向引物-1 | AAGAGAGACCACATGGTCCTTCTTGAGTTTGTAACAG CGTTATTACCAGTAGTCGATTGC | 60 |
| 反向引物-1 | ACTACTATTTACTAATCCCATTGCGTGTTCTTATT TAATCTGTGTGTCAAGTCCATAATG | 60 |
| 正向引物2 | AATAAGAACACGCAATGGGATTAGTAAATAGTAGT CGTTATTACCAGTAGTCGATTGC | 58 |
| 反向引物-2 | GCGAAACTAGCTTGTGGTGATATTGTCTCGTGTGT TAATCTGTGTGTCAAGTCCATAATG | 60 |
| 正向引物3 | ACACACGAGACAATATCACCACAAGCTAGTTTCGC CGTTATTACCAGTAGTCGATTGC | 58 |
| 反向引物3 | ACATTGTACGCCTAAATCATCAAGAATAATTGTTG TAATCTGTGTGTCAAGTCCATAATG | 60 |
| 正向引物-4 | CAACAATTATTCTTGATGATTTAGGCGTACAATGT CGTTATTACCAGTAGTCGATTGC | 58 |
| 反向引物-4 | GAGCGCAGCGAGTCAGTGAGCGAGGAAGCCTGCAG TAATCTGTGTGTCAAGTCCATAATG | 60 |
表4。对于ndsDNA PCR的栅极模板的引物序列。
| 试剂 | 对于1个反应体积(微升) |
| 高拷贝质粒骨架(〜300纳克/微升) | 10 |
| PvuII位-HF(20,000单位/ ml) | 2 |
| 的PstI-HF(20,000单位/ ml) | 2 |
| 10X切割智能缓冲 | 2 |
| H 2 O的 | 4 |
| 总成交量 | 20 D> |
表5,协议的质粒骨架摘要。
| 试剂 | 对于1个反应体积(微升) |
| DNA载体(〜50毫微克/微升) | 1 |
| PCR扩增片段-1(〜50毫微克/微升) | 1 |
| PCR扩增片段-2(〜50毫微克/微升) | 1 |
| PCR扩增片段-3(〜50毫微克/微升) | 1 |
| PCR扩增片段-4(〜50毫微克/微升) | 1 |
| 2个吉布森大会预混 | 五 |
| 总成交量 | 10 |
| 试剂 | 对于1个反应体积(微升) |
| 质粒DNA(约1微克/微升浓度) | 1000 |
| PvuII位-HF(20,000单位/ ml) | 200 |
| 10X切割智能缓冲 | 133.3 |
| 总成交量 | 1333.3 |
表7。协议插入的限制性内切酶的PvuⅡ-HF质粒消化ndsDNA门。
| 试剂 | 卷(微升) |
| 加入门(〜5微克/微升浓度) | 150 |
| Nb.BsrDI(10,000单位/ ml) | 300 |
| 10X切割智能缓冲 | 50 |
| 总成交量 | 500 |
表8,协议加入门消化与切口酶Nb.BsrDI。
| 试剂 | 卷(微升) |
| 叉门(〜5微克/微升浓度) | 150 |
| Nt.BstNBI(10,000单位/ ml) | 600 |
| 10X NEB缓冲3.1 | 83.3 |
| 总成交量 | 833.3 |
表9协议叉门消化与切口酶Nt.BstNBI。
表10为实现化学反应链序列+ B - > B + C(该表已被修改,从参考文献29)
| 试剂 | 卷(微升) | 最终浓度 |
| ROX- 100μM | 10 | 10微米(1个) |
| -rq在100μ,M | 13 | 13微米(1.3倍) |
| 10X TAE与125毫米镁离子 | 10 | 1X TAE与12.5毫米的镁离子 |
| H 2 O的 | 67 | - |
| 总成交量 | 100 | 10微米(1个) |
表11.协议组装记者℃。
| 试剂 | 卷(微升) | 最终浓度 |
| H 2 O的 | 514 | - |
| 10X TAE与125毫米镁离子 | 60 | 1X TAE与12.5毫米的镁离子 |
| 聚T在300μ,M | 2 | 1μM |
| 记者在 10微米Ç | 9 | 150纳米(3次) |
| 10%SDS中 | 9 | 0.15% |
| 5微米 | 6 | 50纳米(1个) |
| 总成交量 | 600 | - |
这里提供的卷台12。议定书为记者C的校准。为600微升(对应于使用0.875 ml的合成石英小区)的总反应体积,但可以调整具有不同尺寸的电池工作。
| 试剂 | 卷(微升) | 最终CON中心定位 |
| H 2 O的 | 493 | - |
| 10X TAE与125毫米镁离子 | 60 | 1X TAE与12.5毫米的镁离子 |
| 聚T在300微米 | 2 | 1μM |
| 记者在 10微米Ç | 9 | 150纳米(3次) |
| <我TC> 100μM | 3 | 10倍 |
| 100μM | 3 | 10倍 |
| 100μM | 3 | 10倍 |
| 10%SDS中 | 9 | 0.15% |
| 公元前叉在约1微米(浓度未知) | 15 | 〜0.5X |
| 100μM | 3 | 10倍 |
| 总成交量 | 600 | - |
表13。议定书为叉BC的校准。这里提供的体积为600微升的总反应体积,但可以调整具有不同尺寸的电池工作。
| 试剂 | 卷(微升) | 最终浓度 | |
| H 2 O的 | 407.2 | - | |
| 10X TAE与125毫米镁离子 | 52.8 | 12.5毫米的镁离子 | |
| 聚T在300微米 | 2 | 1μM | |
| 记者在 10微米Ç | 9 | 150纳米(3次) | |
| <我TC> 10μM | 6 | 100纳米(2个) | |
| 10μM | 6 | 100纳米(2个) | |
| 10μM | 6 | 100纳米(2个) | |
| 6 | 100纳米(2个) | ||
| 10%SDS中 | 9 | 0.15% | |
| 加入AB为1μm | 45 | 75纳米(1.5倍) | |
| 叉公元前 1μM | 45 | 75纳米(1.5倍) | |
| 10μM | 3 | 50纳米(1个) | |
| 10μM | 3 | 50纳米(1个) | |
| 总成交量 | 600 | - | |
表14.协议化学反应A + B-> B + C。这里提供的体积为600微升的总反应体积,但可以调整具有不同尺寸的电池工作。
| 合成门 | 质粒衍生栅极 | ||||
| 描述 | 成本 | 加入门 | 叉门 | ||
| PAGE纯长链(100新台币;担任过门的底部股) | 〜$ 75个 | 说明</ STRONG> | 成本 | 描述 | 成本 |
| PAGE纯化短链(〜30 nt的,担任过门顶股) | 〜$ 185个 | 门模板 | 〜$ 100个 | 门模板 | 〜$ 100个 |
| 总 | 〜$ 260 | 质粒提取试剂盒 | 〜$ 26日 | 质粒提取试剂盒 | 〜$ 26日 |
| 限制性内切酶(PvuII位-HF) | 〜$ 11个 | 限制性内切酶(PvuII位-HF) | 〜$ 11个 | ||
| 切口酶(Nt.BsrDI,加入门) | 〜$ 29日 | 切口酶(Nt.BstNBI,叉门) | 〜$ 62个 | ||
| 总 | 〜$ 166个 | 总 | 〜$ 199个 |
保持与- previous.within页="总是"> 质粒得到的门和合成门之间的表15成本比较 (该表已被修改,从参考文献29)
| 合成门 | 质粒衍生栅极 | ||
| 处理 | 处理时间 | 处理 | 处理时间 |
| 退火 | 1小时 | 克隆 | 5小时 |
| PAGE纯化 | 2小时 | 质粒提取 | 2小时 |
| 总 | 3小时 | 两步酶消化 | 0.5小时 |
| 乙醇沉淀 | 1小时 | ||
| 总 | 8.5小时 | ||
质粒衍生的门和合成门之间的表16。处理时间比较。(该表已被修改,从文献29)。
讨论
本文介绍了由高纯度的质粒DNA衍生ndsDNA门的方法。此外,协议提出了使用荧光动力学分析表征门的性能。实验数据表明,该质粒衍生系统优于其合成对应物,即使合成系统从股线用聚丙烯酰胺凝胶电泳(PAGE)纯化组装。可能的是,质粒衍生门的改进的性能主要是由于该生物的DNA的纯度非常高。合成的DNA含有的各种错误,特别是造成在长度为n-1,和这样的副产物的寡核苷酸通常不在PAGE或高效液相色谱(HPLC)纯化过程完全除去特定缺失。类似的改进这里报告的那些也观察到催化的发夹放大器,使用的DNA生物来源21衍生的先前的研究。
然而,即使使用的质粒衍生门不能完全消除在栅性能错误,为此,至少有两个原因:第一过消化或缺乏切割精度可导致门有太多在错误的位置上刻痕或刻痕。在这两种情况下,门更可能参与不希望的反应。这样的问题可以通过优化所用酶的量( 见图 4)得到缓解。第二,在这些实验中,大部分的输入和辅助股粘度合成DNA并因此包含缺失和突变。原则上,所有单链输入和辅助链也可从噬菌粒DNA的通过预编码M13病毒基因组26的一个切口酶消化获得。也许使用单链DNA从细菌基因组的电路的性能可进一步改善。
而采用质粒衍生门被发现改善电路的性能,一个分析的成本和处理时间显示,同时生产质粒衍生栅极稍便宜(表15),它需要2-3倍更长的处理时间相比,装配和大门的纯化从商业合成的寡核苷酸(表16)。质粒衍生门的主要成本是基因合成和使用限制酶。对于300皮摩尔门(足以让15反应在30纳米),估计成本加入大门大约是$ 170和$ 200叉门,成本差异是由于使用不同的切口酶的。与此相反,在股线为大约$ 260个相同的栅极费用,包括一个PAGE纯化费的化学合成。主要的时间成本质粒得到的门是克隆过程,其中,就像DNA的合成,可以外包给一个基因合成公司研究。然而,一旦组装,质粒衍生门具有主机质粒能够容易地复制的优点次可以存储在细菌甘油原液的形式。这使得有可能超过重用栅极多次。
展望未来,质粒衍生的门性能的提高可以使更大范围的动态行为,不是已经被实验证明,到目前为止与DNA CRNS。例如,最近的理论工作47,48建议,在宏观尺度自组织的空间形态可以通过一个反应扩散机制来实现与DNA CRNS。这里介绍的方法提供了用于构建潜在的分子组分的这种自图案化的DNA材料的可行路径。虽然具有挑战性,发展宏观形态在可编程的方式将有领域从生物材料研究,再生医学显著影响。
披露声明
The authors declare no competing financial interests.
致谢
图1,2,3,4,6,8和表2,3,10,15,16是从文献29改性。这项工作是由美国国家科学基金会(NSF授予-CCF 1117143和NSF-CCF 1162141至GS)。 Y.-JC是由台湾政府奖学金支持。 SDR是由美国国家科学基金会研究生研究奖学金计划(GRFP)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Phusion High-Fidelity PCR Master Mix with HF Buffer | NEB | M0531S | |
| PvuII-HF | NEB | R3151L | |
| PstI-HF | NEB | R3140S | |
| Gibson Assembly Master Mix | NEB | E2611S | |
| Terrific Broth, Modified | SIGMA-ALDRICH | T0918-250G | |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | |
| QIAGEN Hispeed Maxi-prep Kit | QIAGEN | 12662 | |
| Nb.BsrDI | NEB | R0648L | |
| Nt.BstNBI | NEB | R0607L | |
| NanoDrop 2000c | Thermo Scientific | ||
| Double-stranded Genomic Blocks | IDT | ||
| Horiba Jobin-Yvon Spex Fluorolog-3 Fluorimeter | Horiba/Jobin Yvon | ||
| Synthetic Quartz Cells | Starna | 23-5.45-S0G-5 | |
| QIAGEN Gel Extraction Kit | QIAGEN | 28706 | |
| Plasmid Backbones | BioBrick | E0240-pSB1A2 | High copy number plasmid with Ampicillin resistance. Sequence can be found from http://parts.igem.org |
参考文献
- Zhang, D. Y., Seelig, G. Dynamic DNA nanotechnology using strand-displacement reactions. Nat. Chem. 3, 103-113 (2011).
- Krishnan, Y., Simmel, F. C. Nucleic acid based molecular devices. Angew. Chem. Int. Ed. Engl. 50, 3124-3156 (2011).
- Zhang, D. Y., Winfree, E. Control of DNA strand displacement kinetics using toehold exchange. J. Am. Chem. Soc. 131, 17303-17314 (2009).
- Qian, L., Winfree, E., Bruck, J. Neural network computation with DNA strand displacement cascades. Nature. 475, 368-372 (2011).
- Qian, L., Winfree, E. Scaling up digital circuit computation with DNA strand displacement cascades. Science. 332, 1196-1201 (2011).
- Zadegan, R. M., Jepsen, M. D., Hildebrandt, L. L., Birkedal, V., Kjems, J. Construction of a fuzzy and boolean logic gates based on DNA. Small. 11, 1811-1817 (2015).
- Seelig, G., Soloveichik, D., Zhang, D. Y., Winfree, E. Enzyme-free nucleic acid logic circuits. Science. 314, 1585-1588 (2006).
- Zadegan, R. M., et al. Construction of a 4 zeptoliters switchable 3D DNA box origami. ACS Nano. 6, 10050-10053 (2012).
- Andersen, E. S., et al. Self-assembly of a nanoscale DNA box with a controllable lid. Nature. 459, 73-76 (2009).
- Zhang, D. Y., Hariadi, R. F., Choi, H. M., Winfree, E. Integrating DNA strand-displacement circuitry with DNA tile self-assembly. Nat. Commun. 4, (1965).
- Yurke, B., Turberfield, A. J., Mills, A. P., Simmel, F. C., Neumann, J. L. A DNA-fuelled molecular machine made of DNA. Nature. 406, 605-608 (2000).
- Green, S. J., Lubrich, D., Turberfield, A. J. DNA hairpins: fuel for autonomous DNA devices. Biophys. J. 91, 2966-2975 (2006).
- Venkataraman, S., Dirks, R. M., Rothemund, P. W., Winfree, E., Pierce, N. A. An autonomous polymerization motor powered by DNA hybridization. Nat. Nanotechnol. 2, 490-494 (2007).
- Green, S. J., Bath, J., Turberfield, A. J. Coordinated chemomechanical cycles: a mechanism for autonomous molecular motion. Phys. Rev. Lett. 101, 238101 (2008).
- Omabegho, T., Sha, R., Seeman, N. C. A bipedal DNA Brownian motor with coordinated legs. Science. 324, 67-71 (2009).
- Turberfield, A. J., et al. DNA fuel for free-running nanomachines. Phys. Rev. Lett. 90, 118102 (2003).
- Dirks, R. M., Pierce, N. A. Triggered amplification by hybridization chain reaction. Proc. Natl. Acad. Sci. U. S. A. 101, 15275-15278 (2004).
- Seelig, G., Yurke, B., Winfree, E. Catalyzed relaxation of a metastable DNA fuel. J. Am. Chem. Soc. 128, 12211-12220 (2006).
- Zhang, D. Y., Turberfield, A. J., Yurke, B., Winfree, E. Engineering entropy-driven reactions and networks catalyzed by DNA. Science. 318, 1121-1125 (2007).
- Yin, P., Choi, H. M., Calvert, C. R., Pierce, N. A. Programming biomolecular self-assembly pathways. Nature. 451, 318-322 (2008).
- Chen, X., Briggs, N., McLain, J. R., Ellington, A. D. Stacking nonenzymatic circuits for high signal gain. Proc. Natl. Acad. Sci. U. S. A. 110, 5386-5391 (2013).
- Phillips, A., Cardelli, L. A programming language for composable DNA circuits. J. R. Soc. Interface. 6, S419-S436 (2009).
- Lakin, M. R., Youssef, S., Polo, F., Emmott, S., Phillips, A. Visual DSD: a design and analysis tool for DNA strand displacement systems. Bioinformatics. 27, 3211-3213 (2011).
- Lakin, M. R., Youssef, S., Cardelli, L., Phillips, A. Abstractions for DNA circuit design. J. R. Soc. Interface. 9, 470-486 (2012).
- Zhang, D. Y., Winfree, E. Robustness and modularity properties of a non-covalent DNA catalytic reaction. Nucleic Acids Res. 38, 4182-4197 (2010).
- Ducani, C., Kaul, C., Moche, M., Shih, W. M., Hogberg, B. Enzymatic production of 'monoclonal stoichiometric' single-stranded DNA oligonucleotides. Nat. Methods. 10, 647-652 (2013).
- Lin, C., et al. In vivo cloning of artificial DNA nanostructures. Proc. Natl. Acad. Sci. U. S. A. 105, 17626-17631 (2008).
- Bhatia, D., et al. Icosahedral DNA nanocapsules by modular assembly. Angew. Chem. Int. Ed. Engl. 48, 4134-4137 (2009).
- Chen, Y. J., et al. Programmable chemical controllers made from DNA. Nat. Nanotechnol. 8, 755-762 (2013).
- Arkin, A., Ross, J. Computational functions in biochemical reaction networks. Biophys. J. 67, 560-578 (1994).
- Érdi, P., Tóth, J. . Mathematical models of chemical reactions: theory and applications of deterministic and stochastic models. , (1989).
- Magnasco, M. O. Chemical kinetics is Turing universal. Phys. Rev. Lett. 78, 1190 (1997).
- Oishi, K., Klavins, E. Biomolecular implementation of linear I/O systems. IET Syst. Biol. 5, 252-260 (2011).
- Senum, P., Riedel, M. Rate-independent constructs for chemical computation. PLoS One. 6, (2011).
- Soloveichik, D., Cook, M., Winfree, E., Bruck, J. Computation with finite stochastic chemical reaction networks. Natural Computing. 7, 615-633 (2008).
- Soloveichik, D., Seelig, G., Winfree, E. DNA as a universal substrate for chemical kinetics. Proc. Natl. Acad. Sci. U. S. A. 107, 5393-5398 (2010).
- Tyson, J. J., Chen, K. C., Novak, B. Sniffers, buzzers, toggles and blinkers: dynamics of regulatory and signaling pathways in the cell. Curr. Opin. Cell. Biol. 15, 221-231 (2003).
- Cardelli, L. Two-domain DNA strand displacement. Math. Struct. Comput. Sci. 23, 247-271 (2013).
- Angluin, D., Aspnes, J., Eisenstat, D. A simple population protocol for fast robust approximate majority. Distrib. Comput. 21, 87-102 (2008).
- Cardelli, L., Csikasz-Nagy, A. The cell cycle switch computes approximate majority. Sci. Rep. 2, 656 (2012).
- Zadeh, J. N., et al. NUPACK: Analysis and design of nucleic acid systems. J. Comput. Chem. 32, 170-173 (2011).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. , (2012).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat. Methods. 6, 343-345 (2009).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J. Vis. Exp. , e253 (2007).
- Lessard, J. C. Transformation of E. coli via electroporation. Methods Enzymol. 529, 321-327 (2013).
- Nasri, M., Thomas, D. Alteration of the specificity of PvuII restriction endonuclease. Nucleic Acids Res. 15, 7677-7687 (1987).
- Dalchau, N., Seelig, G., Phillips, A. Computational design of reaction-diffusion patterns using DNA-based chemical reaction networks. DNA Computing and Molecular Programming. , 84-99 (2014).
- Scalise, D., Schulman, R. Designing modular reaction-diffusion programs for complex pattern formation. Technology. 2, 55-66 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。