Method Article
Плазмиды, полученные ДНК замещения цепи Гейтс для реализации химической реакции сети
В этой статье
Резюме
This protocol describes a method for deriving DNA strand displacement gates from plasmids and testing them using fluorescence kinetics measurements. Gates can be modularly composed into multi-component systems to approximate the behavior of formal chemical reaction networks (CRN), demonstrating a new use for CRNs as a molecular programming language.
Аннотация
DNA nanotechnology requires large amounts of highly pure DNA as an engineering material. Plasmid DNA could meet this need since it is replicated with high fidelity, is readily amplified through bacterial culture and can be stored indefinitely in the form of bacterial glycerol stocks. However, the double-stranded nature of plasmid DNA has so far hindered its efficient use for construction of DNA nanostructures or devices that typically contain single-stranded or branched domains. In recent work, it was found that nicked double stranded DNA (ndsDNA) strand displacement gates could be sourced from plasmid DNA. The following is a protocol that details how these ndsDNA gates can be efficiently encoded in plasmids and can be derived from the plasmids through a small number of enzymatic processing steps. Also given is a protocol for testing ndsDNA gates using fluorescence kinetics measurements. NdsDNA gates can be used to implement arbitrary chemical reaction networks (CRNs) and thus provide a pathway towards the use of the CRN formalism as a prescriptive molecular programming language. To demonstrate this technology, a multi-step reaction cascade with catalytic kinetics is constructed. Further it is shown that plasmid-derived components perform better than identical components assembled from synthetic DNA.
Введение
Предсказуемость Уотсона-Крика спаривания оснований позволило нанотехнологии динамический ДНК появляться как программируемый способ разработки молекулярных устройств с динамическими свойствами 1,2. В частности, цепь ДНК смещения - программируемый, конкурентоспособная реакцию гибридизации - оказалось мощным механизмом для проектирования динамических систем ДНК. В реакции вытеснения цепи ДНК, входящий олигонуклеотид вытесняет ранее связанный "выход" из прядь дополнительного связывания партнера. Несколько таких реакций могут быть соединены друг с другом в многоэтапных реакции каскадов с высокой степенью контроля над порядка и сроков индивидуальной реакции шаги 3. Каскады ДНК замещения цепи были использованы для создания цифровых и аналоговых схем молекулярных 4-7, переключаемых наноструктур 8-10, автономных молекулярных моторов 11-15, и нековалентные каталитические усилители 13,16-21. Кроме того, DУстройства, использующие Н.А. реакции замещения цепи могут быть смоделированы и разработаны для различных приложений, использующих компьютерного проектирования программного обеспечения 22-24.
В настоящее время, химически синтезированная ДНК служит в качестве основного материала для ДНК нанотехнологии. Тем не менее, ошибки в процессе синтеза ДНК, и в результате несовершенных олигонуклеотиды, как полагают, чтобы ограничить производительность динамических устройств ДНК, вызывая ошибочные побочных реакций. Например, "утечка" реакции могут привести к выбросу выходного олигонуклеотида, даже при отсутствии реакционной триггера. Такие эффекты наиболее очевидны в автокаталитических каскадов реакций, где даже минимальное количество исходного утечки в конечном итоге приводят к полной активации каскада 19,20. С другой стороны, реакции часто не удается достичь ожидаемого уровня активации, так как некоторые компоненты не вызывают даже в присутствии предполагаемого ввода 7,25. Для того, чтобы производительность на основе ДНКнаноустройств, сопоставимые с их биологические аналоги на основе белка, такие режимы об ошибках должны быть резко сокращены.
Бактериальные плазмиды или другие биологические ДНК может служить сравнительно дешевого источника высокочистого ДНК для нанотехнологических приложений. Большие количества ДНК могут быть получены путем репликации в бактериях и внутренние корректуры способности живых систем обеспечения чистоты полученного ДНК. На самом деле, несколько недавних работ признали потенциальную полезность биологического ДНК для применения нанотехнологий 21,26-28. Тем не менее, полностью двухцепочечной характер плазмидной ДНК до сих пор запрещено его использование в качестве материала для изготовления динамических устройств ДНК, которые, как правило, состоят из множества олигонуклеотидов и содержащие оба двухцепочечные и одноцепочечные домены. В недавней работе 29 этот вопрос был рассмотрен и новой архитектуры ворот ДНК, которая состоит в основном из порезал двухцепочечной ДНК (ndsDNA) был представитьд.
Важно отметить, что системы ndsDNA ворот могут быть разработаны, что реализовать динамику, указанные любой формальной химической реакции сети (CRN) 29. ndsDNA ворота, таким образом, может быть использован, в принципе, для создания динамических систем, которые обладают колебания и хаос, бистабильность и память, логическое логику или алгоритмические поведения 30-38. Например, в работе 29. Продемонстрировала три реакции CRN, который обеспечил молекулярную реализацию протокола "консенсус", тип распределенной вычислительной алгоритма 29,39,40. Эта работа впервые продемонстрировала новое применение для формализма CRN как "язык программирования" для синтеза функциональных быстро молекулярных систем (Рис. 1А)
Здесь Подробный протокол для получения ndsDNA ворота из плазмидной ДНК обеспечивается. Во-первых это обзор процесса проектирования последовательности. Затем следует объяснение того, как синтетических олигонуклеотидов, содержащихпоследовательности ворота клонируют в плазмиды и последовательность подтверждали и усиливается с помощью бактериальной культуры. Далее, показано, как ворота ndsDNA могут быть получены из плазмид путем ферментативного обработки (рисунок 2). Наконец, метод для тестирования поведения затвора с помощью кинетики флуоресценции пробы изложена.
Механизм реакции
В качестве примера, протокол фокусируется на каталитическом химической реакции A + B-> B + C. Вид A, B, C и ("сигналы", рис 1B) все соответствуют другим одноцепочечной молекулы ДНК. Последовательности этих молекул полностью независимы и нити не реагируют друг с другом непосредственно. Последовательности всех сигналов имеют два различных функциональных областей, то есть подпоследовательности, которые действуют вместе в реакциях замещения цепи: 1) короткий домен плацдарм (этикетки TA, TB, TC), который используется для инициирования замещения цепи Reaction и 2) длинный домен (этикетки A, B, C), который определяет идентичность сигнала.
Взаимодействие между сигнальными нитями опосредуется изрубленными двухцепочечной ДНК (ndsDNA) ворота комплексов (называемых Регистрация AB и вилка до н.э.) и вспомогательные одноцепочечной видов (, <б тр>, <с ТБ> и <я дц >). Формальная реакцию А + В> B + C выполняется через серию замещения цепи реакционных стадий, где каждый шаг реакции подвергает опоры для последующей реакции (Фиг.1В). В этом примере сигналы А и В изначально в растворе в свободном, а сигнал С связан с вилкой ворот. В конце реакции В и С находятся в растворе. В более общем, сигналы, которые связаны с затвором неактивны, а сигналы, которые свободны в растворе являются активными, то есть они могут участвовать в реакции замещения цепи, каквход. Временной ход реакции отслеживают с помощью флуоресцентного репортера стратегии (рис 1c). В предыдущей работе 29 было показано, что этот механизм реакции не только осуществляет правильную стехиометрии, но и кинетику реакции целевой.
протокол
1. Последовательность Дизайн
Примечание: обзор дизайн последовательности: В этом разделе, стратегия проектирования плазмиды, полученные ворота ДНК описано. Ферментные сайты, размещенные на любом конце ворот, чтобы для выпуска полностью двухцепочечных ворот после пищеварения. Перекреста сайты помещают таким образом, что ферменты создать ники на верхней нити, чтобы создать окончательные ворота ndsDNA. Наконец, остальные последовательности выбирают таким образом, что независимые домены являются ортогональными друг к другу и не проявляют вторичную структуру.
- Поместите перекреста сайт Nt.BstNBI четыре нуклеотида от конца 3 'каждой длинной домен (, B, C, R, и я). Поместите перекреста сайт Nb.BsrDI на 5 'конце каждого долгого домена (а, б, в, г. Обратите внимание, что домен я не имеет никакого Nb.BsrDI перекреста сайт). Рисунок 2C показывает детальный вид следования Присоединяйтесь AB и BC Вилка ворота.
- Поместите рестрикции PvuII сайт на обоих концах ndsDNA ворот, так что PvuII пищеварения может выпустить ворота из плазмид (см фиг.2с).
- Конструкция другие неограниченные последовательности, следуя двум принципам: (а) нити не должны показывать вторичные структуры (структуры ДНК может быть предсказано с помощью NuPack 41), и (б) все домены должны быть ортогональными, чтобы минимизировать перекрестные помехи.
- Поместите последовательности ndsDNA в центре шаблона ворота. Поместите 30-40 п.н. случайных последовательностей распорные на обоих концах шаблона затвора, каждая прокладка служит уникальным сайтом связывания для следующей полимеразной цепной реакции (ПЦР).
2. Клонирование NdsDNA Гейтс в плазмид
Примечание: В этом разделе описывается метод клонирования Gibson для вставки 4 копии ворот в плазмиды позвоночника.
- Заказать ndsDNA шаблоны ворота как двухцепочечной геномной блоков от производителя ДНК (последовательности шаблона ворота показаныв таблице 1; Нити происходят в ndsDNA ворот приведены в таблице 2; последовательности на уровне домена, приведены в таблице 3).
- После получения ДНК, заказанный, спина пробирки, содержащие геномные блоки на 10,000-14,000 мкг в течение 1 мин, чтобы гарантировать, что все Высушенную ДНК находится в нижней части трубы.
- Ресуспендируют сушеные геномных блоков в ДНКазы без воды, чтобы достичь конечной концентрации 10 нг / мкл.
Примечание: В качестве альтернативы, ДНК может быть снова суспендируют с помощью 1x Трис этилендиаминтетрауксусной кислоты (ЭДТА) буфера (буфера ТЕ: 10 мМ Трис и 1 мМ ЭДТА, рН 8,0). Тем не менее, ЭДТА хелатирующий агент для двухвалентных катионов и может ингибировать ПЦР. - Создание 4 фрагментов ворота с разных регионов перекрытия с помощью стандартного ПЦР с High-Fidelity ДНК-полимеразы (рис 3а). Последовательности праймеров приведены в Табл 4 (температура плавления этих праймеров 62 ° С).
- Запуск 2% агарозном геле в 140 В в течение 30 мин при комнатной температуре (подробное агарозном геле протокола см 42) и сократить полос, соответствующих каждой амплификации методом ПЦР фрагмента из геля. Затем очистить ломтики гель, используя набора для экстракции гелей (пожалуйста, обратитесь к материалам) в соответствии с инструкциями изготовителя.
- Дайджест высокого числа копий плазмиды основу (см материалы) с PvuII-HF и PstI-HF при 37 ° С в течение 1 ч (таблица 5) в соответствии с протоколом производителя. PvuII-HF и PstI-HF высоки верность рестриктаз, которые резко сократить неспецифические сокращений.
- Запуск 1,5% агарозном геле и сократить линеаризованную позвоночник (как правило, запустить гель при 140 V в течение 30-40 мин при комнатной температуре). Затем извлечь ДНК из куска геля с использованием набора для экстракции геля в соответствии с инструкциями изготовителя.
- Выполните сборку Gibson 43 с линеаризованной вектора и очищенных ПЦР-фрагментов (табл 6 и рис 3B ) при 50 ° С в течение 1 часа.
- Преобразование сборки продукта со стадии Gibson 2,8 в кишечной палочки (E.coli) и пластины на лизогении бульон (LB) агаром, содержащих ампициллин антибиотики (при концентрации 100 мкг / мл). Выполните преобразование через электропорации или способом теплового шока 44,45, и использовать соответствующую Е. Штамм. Например, можно использовать Е. Штамм JM109 для теплового шока трансформации, и использовать DH5 & Электрокомпетентные Е. палочки для электропорации клетки.
Примечание: Эту плазмиду использовали основой содержит кассету сопротивления к ампициллину. При использовании другого селективного маркера, использовать соответствующие антибиотики вместо ампициллина.
3. Бактериальные культуры Усиление и контроль качества
Примечание: В этом разделе описывается массовое производство и выделение плазмид, содержащих ДНК ворота после контроля качества.
- Выберите одну колониюот ампициллин селективного пластины со стадии 2.9, и инкубируют культуры 3 мл обогащенной среды, содержащей ампициллин антибиотики (при концентрации 100 мкг / мл). Отметьте, что колонии, такие Она может быть использована снова в последующих экспериментальных этапов. Растут культуры при 37 ° CO / N с энергичного встряхивания (200-300 оборотов в минуту). Как правило, инкубировать в течение 16-24 ч.
- Извлечение ДНК плазмиды из бактериальной культуры с использованием мини-Prep Kit в соответствии с инструкциями изготовителя.
- Измерьте плазмидной ДНК с помощью спектрофотометра в соответствии с инструкциями изготовителя. Типичные диапазоны доходности от 50-1,000 нг / мкл.
- Получить извлеченный плазмидной ДНК секвенировали с помощью отправки образца в ДНК последовательностей компании. Праймеры для секвенирования должны быть расположены около 100 нуклеотидов выше и ниже области, подлежащие секвенированию; секвенирование грунтовка для плазмиды (см материалы для плазмиды) имеет следующую последовательность: ATTACCGCCTTTGAGTGAGC.
НетTe: Если есть ошибка последовательность или рекомбинация в вставленной ndsDNA ворот, выберите другую колонию из пластины с шага 2.9. Последующие шаги 3.1-3.4, чтобы убедиться, что последовательности вставленных ворот верны. - После проверки последовательности правильны, выбрать соответствующий колонию селективного пластины ампициллин (из стадии 2.9), и инкубируют культуры 800 мл бульона Terrific (ТБ), содержащей ампициллин антибиотики (при концентрации 100 мкг / мл). Выращивают культуру при 37 ° С в течение 16-24 ч, с энергичном встряхивании (200-300 оборотов в минуту). ТБ особенно хорошо подходит для высокодоходного производства плазмиды.
Примечание: В качестве альтернативы, LB также могут быть использованы бактерии расти хотя выход плазмида может быть проблемой. - Очищают ДНК с использованием Макси-Prep Kit в соответствии с инструкциями изготовителя.
- Следуйте шаг 3,3-3,4 проверить, правильны ли последовательности. Если какой-либо рекомбинация происходит, увидеть следующее примечание. В противном случае, переходите к шагу 4. <ш /> Примечание: Один из возможных проблема здесь в том, что несколько копий вставленных ворот в плазмиды могут рекомбинировать в результате ремонта ДНК. Чтобы решить эту проблему, используйте Е. Штамм не хватает белка RecA (белок связан с репарации ДНК), такие как JM-109 или DH5 & alpha превратить ранее последовательность-проверено плазмиды (т.е., без каких-либо ошибок последовательности и рекомбинации). Затем выберите один из колонии этой пластинки и проверить последовательность плазмиды, отправив образца в секвенирования ДНК компании.
4. Ферментативный Обработка
Примечание: В этом разделе описывается процесс для переваривания плазмиды, так что они вырезать и порезал в правильных местах и готовы быть использованы для кинетики экспериментов.
- Дайджест Очищенную плазмидную ДНК из стадии 3.7 рестриктазой PvuII-HF в течение 1 ч при 37 ° С (см таблицу 7). Обычно переварить плазмиду с 4 единицами PvuII-HF на 1 мг плазмиды. Высокая FIDферменты рестрикции elity рекомендуется для использования, так как они значительно уменьшить неспецифические сокращений.
- Выполнение осаждением этанолом на образце.
- Добавить 2 эквивалентные объемы ледяной абсолютного этанола к образцу.
- Выдержите смесь при температуре -80 ° С в течение по меньшей мере 1 ч (эта смесь также может сидеть при -80 ° С в течение O / N).
- Центрифуга на 10,000-14,000 мкг при 0 ° С в течение 30 мин.
- Удалить супернатант.
- Добавить 1000 мкл RT 95% этанола на образец, и инвертировать в 10-15 раз.
- Центрифуга на 10,000-14,000 мкг при 4 ° С в течение 10 мин.
- Удалить супернатант и сухой воздух на скамейке в течение 10-20 мин.
- Ресуспендируют гранул ДНК в соответствующем объеме нуклеазы свободного H 2 O (обычно 100-200 мкл). Добавление более 200 мкл, как правило, делают выборку слишком разбавленных для использования в экспериментах кинетики.
- Измерить ресуспендировали ДНК с помощью спектрофотометра, следующего за мИнструкции по anufacturer.
- Дайджест присоединиться ворота с уменьшение поперечного сечения фермента Nb.BsrDI при 65 ° С в течение 1 часа с использованием 4 единиц фермента на 1 мкг плазмиды (см Таблицу 8); дайджест вилки ворота с уменьшение поперечного сечения фермента Nt.BstNBI при 55 ° С в течение 1 часа с использованием 8 единиц фермента на 1 мкг плазмиды (см таблицу 9).
Примечание: Шаг 4.2 удаляет фермента буфер пищеварение и помогает сосредоточиться ворота для кинетики экспериментов. Шаг 4.2 могут быть пропущены для присоединиться ворота, потому что оба фермента PvuII, ограничение ВЧ-и уменьшение поперечного сечения фермент Nb.BsrDI один и тот же буфер пищеварение. На шаге 4.2.8, нуклеазы свободной H 2 O используется вместо ТЕ потому ЭДТА хелатирующий агент для двухвалентных катионов и может ингибировать ферменты рестрикции, которые должны эти ионы функционировать.
Примечание: добавление избыточных количеств ферментов может привести к высоким содержанием начального утечки цепи (рис 4), который, скорее всего, из-за чрезмерного пищеварения 46. Этот вопрос чап решить путем оптимизации ферментные суммы (рисунок 4). Типичный диапазон ферментов от 1-10 единиц / мкг плазмидной 1.
5. Подготовка одноцепочечной олигонуклеотидов
Примечание: В этом разделе описывается протокол ресуспендированием и количественного химически синтезированные на одноцепочечной ДНК (оцДНК), который будет использоваться для сигнальных цепей и вспомогательных цепей. Для нити последовательностей см таблицу 10. Обратите внимание, что следующий протокол является примером подготовки 10 мкм оцДНК. Другие концентрации оцДНК можно получить аналогично.
- После получения олигонуклеотидов от производителя ДНК, спина пробирки, содержащие ДНК в 10,000-14,000 мкг в течение 1 мин, чтобы гарантировать, что все Высушенную ДНК находится в нижней части трубы.
- Ресуспендируют ДНК с использованием 1x Трис этилендиаминтетрауксусной кислоты (ЭДТА) буфере (ТЕ-буфера: 10 мМ Трис и 1 мМ ЭДТА, рН 8,0) до конечной концентрации 100 мкМ. ДляНапример, ресуспендируют 8 нмоль ДНК в 80 мкл ТЕ-буфера.
- Смешайте 10 мкл ДНК при 100 мкМ с 90 мкл молекулярной воды в микроцентрифужных трубки, которые должны достичь конечной концентрации 10 мкМ.
- Измерьте точную концентрацию образца ДНК с использованием спектрофотометра в соответствии с инструкциями изготовителя. Следующий протокол дает пример того, как концентрация ДНК может быть измерена.
- Бланк спектрофотометр с 2 мкл молекулярной воды.
- Измеряют поглощение при 260 нм (А 260) образца ДНК. Используйте следующее уравнение для расчета концентрации акций.
Примечание: Концентрация образца М = коэффициент 260 / исчезновения. Коэффициент экстинкции можно найти на спецификации спецификации производителем ДНК.
6. Подготовка флуоресцентных Репортеры
Примечание: В этом разделе описываетсяПротокол для приготовления Reporter C, флуоресцентные репортеры Другие могут быть собраны аналогично.
- Заказать высокоэффективной жидкостной хроматографии (ВЭЖХ), очищенный олигонуклеотидов ROX- <с * TC *> (верхняя нить Reporter С) и <с> -rq (нижняя нить Reporter C) от производителя ДНК (см таблицу 10 для последовательностей ).
- После получения синтезированных олигонуклеотидов, ресуспендируют и количественного образцы как описано в шаге 5.
- Смешайте репортер верхнюю и нижнюю нити (т.е. ROX- <с * TC *> и <с> -rq) в 1x Трис-ацетат-ЭДТА (TAE) с 12,5 мм Mg 2+ (см таблицу 11 для детального рецепта ). Обратите внимание, что здесь 30% избыток утоления помечены нити <с> -rq добавляется собрать репортер, который гарантирует, что все флуорофорные меченных пряди гасили даже с несовершенным стехиометрии.
- Отжиг репортер C комплекс с использованием термоциклера, охлаждение от 95 ° С до 20 ° С со скоростью 1 ° С / мин. Образцы можно хранить при температуре 4 ° С.
7. Измерения флуоресценции
Примечание: раздел описывает общий протокол кинетики флуоресценции измерений (рисунок 5 для экспериментальной процедуры), и этот протокол будет использоваться на этапах 8, 9 и 10. Отметим также, что этот протокол для использования в спектрофлуориметре. Кроме того, эти эксперименты также могут быть выполнены в планшет-ридере, хотя чувствительность, хорошо в скважине вариации и отсутствие контроля температуры в долгосрочных экспериментов может быть проблемой.
- Установите регулятор температуры на 25 ° С, и ждать стабилизации температуры. Использование регулятора температуры могут уменьшить вариабельность в сигнал, который может возникнуть в результате изменения температуры.
- Установите правильные параметры FOг кинетика измерения в программном обеспечении сбора данных в спектрофлуориметре. Подробные параметры, например, являются следующие:
- Установите ширину щели до 2.73 нм для обеих возбуждения и эмиссии монохроматорами.
- Установить время интеграции до 10 сек для каждого 60 сек временной точке. Установите общее время измерения до 24 часов.
- Установка длины волн возбуждения / испускания чтобы соответствовать флуорофоров, используемых в эксперименте. Пример длины волн следующим образом: ROX (588 нм / 608 нм), TAMRA (559 нм / 583 нм).
- Добавить нуклеазы свободного H 2 O и 10-кратным Трис-ацетат-ЭДТА буфера, содержащего 125 мМ Mg 2+ (10x TAE / Mg 2+) к синтетическому кварцевую кювету. См Таблицы 12, 13, и 14 объемов, например, для использования.
- Добавить polyT пряди для достижения конечной концентрации ~ 1 мкМ (табл 12, 13, и 14 для объемов), а затем вихрь синтетическиекварцевые клетки для 10-15 сек. Вообще, наконечники будут неспецифически связывать ДНК. Добавление высоких концентраций polyT нитей может уменьшить этот неспецифического связывания ошибку.
- Добавить журналистам и вспомогательные жилы. Таблицу 12, 13, и 14 для объемов например, чтобы использовать. Обратите внимание, что для калибровки репортера, без вспомогательных пряди не нужны.
- Добавить 10% додецилсульфата натрия (SDS), чтобы достичь конечной концентрации 0,15% SDS. Примечание: SDS используется для диссоциации ферментов из плазмиды, полученные из-за воротами ферменты могут мешать реакции замещения цепи (рисунок 6). SDS рекомендуется здесь вместо тепловой денатурации ферментов, чтобы избежать диссоциации и рекомбинации неправильный ворот нитей, которые могут негативно повлиять на функцию цепи.
- [Пропустите этот шаг, для калибровки репортера.]
- Добавить присоединиться и вилки ворота (табл 13 и 14 по объемам)к синтетическому кварцевой кювете и перемешать раствор с помощью пипетки вверх и вниз, по крайней мере в 20 раз (не вихрь кювету, потому что встряхиванием решения с SDS может привести к пузырей, которые будут влиять на измерения кинетики флуоресценции).
- Кроме того, перейти на следующих шагов измерения как можно скорее, потому что реакция утечки инициирует сразу после добавления присоединиться и вилки ворот к синтетическим кварцевой кювете.
- Поместите синтетические кварцевые клеток в камере спектрофлуориметре.
- Начните измерение кинетики.
- Через 5 мин измерения, добавить входные нитей (табл 12, 13 и 14 для объемов) с синтетическим кварцевую кювету и перемешивают реакцию с помощью пипетки вверх и вниз, по крайней мере в 20 раз. Следует отметить, что образец следует смешать осторожно, чтобы избежать пузырьков. Выполните этот шаг, пока программа сбора данных приостанавливается, чтобы избежать измерения сигналов, вызванных внешнимилегкий.
- Запись кинетики реакции, пока не достигнет устойчивого состояния. Кинетика реакции отображаются на компьютере.
8. Калибровка Люминесцентные Журналисты
Примечание: В этом разделе описывается протокол для принятия калибровочные кривые флуоресцентных журналистами. Калибровочные кривые будут использоваться для преобразования единиц флуоресценции произвольные концентрации молярной сигнала.
- Калибровка флуоресцентные журналистам следуя протоколу, описанному в 7. Использовать объемов реагентов и буферов, как приведены в таблице 12 Стандарт концентрация в данном примере составляет 50 нМ (1x). репортеры в 3x; вход 1x. Для случаев, когда вход находятся на 0.25x, 0,5 × 0,75 раза, отрегулируйте громкость нуклеазы свободного H 2 O соответственно, чтобы сохранить конечный объем каждой реакции в 600 мкл. Пример данные показаны на фиг.7А.
- Сделать калибровочной кривой изReporter С помощью линейной подгонки значений флуоресценции конечных против исходной концентрации сигнала C (Пример калибровочной кривой показано на фиг.7В). Эта калибровка кривая может быть использован для преобразования произвольных единицах флуоресценции на соответствующий концентрации сигнала.
9. вычислить концентрацию плазмиды-производного ndsDNA Гейтс
Примечание: каждый независимо обрабатываемый партию плазмид-разветвленного ndsDNA ворот приводит к различной мощности функциональных ворот, и в этом разделе описывается протокол для количественной оценки концентрации плазмид-разветвленного ndsDNA ворот.
- Количественная концентрации плазмиды, полученные ndsDNA ворот следуя протоколу, описанному в 7. Использовать объемов реагентов, как приведены в таблице 13. Примечание: В таблице 13 приведен пример рецепт Вилка до н.э. количественного Регистрация. > AB и другие ворота могут быть выполнены так же, но с использованием различных входных цепей, вспомогательные жилы и журналистам.
- Преобразование окончательное значение флуоресценции, измеренную в эксперименте, до концентрации сигнала C с использованием калибровочной кривой с шага 8.2. Потом обратно-расчета концентрации ворота ndsDNA. Например, конечное значение флуоресценции для ворот количественного эксперимента соответствует 25 нМ сигнала C (0,5 ×) на основе калибровочной кривой на фиг.7В. Поскольку запас Fork до н.э. разбавляют в 40 раз в этой реакции, концентрация запас ворот Вилка до н.э. составляет 1 мкм.
10. Кинетика измерения для реакции А + В-> B + C
Примечание: В этом разделе описывается протокол для тестирования ДНК реализацию формального химической реакции с использованием флуоресцентных измерений кинетики.
- ЗаФорма кинетики измерений, следуя протоколу, описанному в Шаг 7. Использование объемов реагентов и буферов, как приведены в таблице 14.
Результаты
Для функционального тестирования, была создана реализация ДНК бимолекулярного каталитической реакции (то есть, А + В-> В + С). Производительность плазмид-разветвленного ворот сравнивали с воротами, собранных из синтетического ДНК. Каталитические реакции являются хорошей проверкой на чистоту ворота, потому что неисправный ворота могут необратимо ловушку катализатором, в результате чего непропорционально большое воздействие на сумму продукта, произведенного 18,19. В то же время, небольшой реакционный утечки в результате неуправляемых газовых выпуска каталитического сигнала будет линейно усиленный, что приводит к непропорциональному сигнала ошибки. Экспериментальные данные для плазмид-разветвленного и синтезированы ворот показаны на рисунке 8Б и 8В, соответственно. В экспериментах, концентрация сигнала цепи A фиксируется в то время как количество каталитического сигнала B изменяется. Сигнал С используется для считывания ход реакции, не прерывая каталитическогоЦикл. Катализ можно наблюдать в данных, так как реакции подходить к завершению даже с количеством катализатора В намного меньших, чем количества. Так SDS не был добавлен в эксперименты, проведенные с синтезированной системы, скорость реакции (которые могут быть затронуты добавлением SDS) не сравниваются, и аналитический фокус, а не на каталитическом оборота (подробно следующим).
Был проведен дополнительный анализ каталитического оборота этой реакции. Оборот определяется как сумма сигнала C производится для каждого катализатора В в данный момент времени. В частности, оборот рассчитывали из наших экспериментальных данных путем деления утечки вычитается сигнал С на начальное количество катализатора Б добавленной. Для идеального каталитической системы, это число оборотов должно линейно возрастать со временем и не зависит от количества катализатора тех пор, пока подложка не ограничивает. В реальной системе, неисправные ворота можно отключить кота alysts, а оборот достигнет максимального значения, даже если не все имеющиеся субстрат превращается в продукт. Максимальное значение оборот показывает, сколько субстраты (сигнал А) катализатора (сигнал В) можно преобразовать, прежде чем стать инактивируется. Здесь следует отметить, что синтезированный система отклоняется от идеального линейного роста оборота значительно раньше, чем в системе плазмиды, полученные делает, указывающий поглощения катализатора через нежелательной побочной реакции (рис 8D). Сравнение оборот показывается только для низких концентрациях, поскольку при высоких концентрациях катализаторов, все ворота будут срабатывать и освободить сигнал С. Утечка цепи также сравнивать и следует отметить, что отношение сигнала утечки с помощью плазмид-разветвленного ворота составляет около 8% меньше, чем, что с помощью синтезированных ворот после 10 ч реакции (рис 8E).
Иль / ftp_upload / 53087 / 53087fig1.jpg "/>
Рисунок 1. (A) КДЧ служить предписывающий языка программирования. Сети реакции ДНК могут быть сконструированы, чтобы приблизить динамику официального CRN реализацию (B), ДНК в качестве примера химической инструкции:. A + B-> B + C. Нити ДНК взяты в виде линий со стрелками на конце "3 * и показывает взаимодополняемость. Все сигнал нити А (<Т.А.>, зеленый), B (, оранжевый), и С (, красный) состоятся из одного домена опоры (помечены как TA, TB и TC) и один домен идентичности (помечены как, б, в). Бимолекулярной реакции А + В-> В + С, требует два многожильный комплексы Регистрация AB и BC вилка, и четыре вспомогательных пряди , , <с ТБ> и <я TC>. Реакция протекает через семь шагов цепи смещения, где каждый шаг началас с опоры связывания. (C) стратегии Reporter. Реакция последовала помощью репортера, в которой нижняя нить с надписью с флуорофора (красная точка) и верхней нити прикреплен к гасителя (черная точка). Из-за совместной локализации флуорофора и гасителя, репортер флуоресценции гасится в интактной репортера. Сигнал С может заменить верхнюю прядь репортера, что приводит к увеличению флуоресценции. (Эта цифра была изменена с Ref 29). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
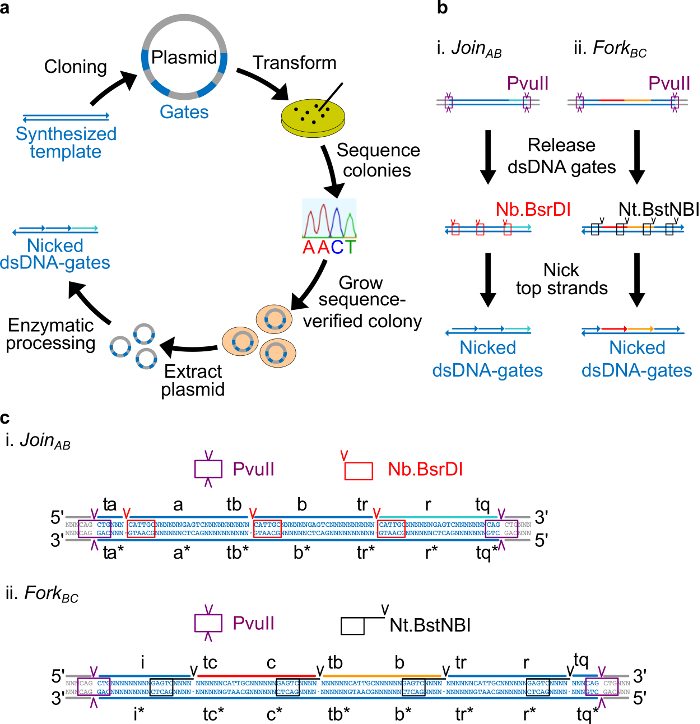
Рисунок 2. (А) NdsDNA ворота, сделанные из бактериальной плазмиды ДНК. Несколько копий на мель шаблона двухзатворного ndsDNA клонируют в плазмиды. Клонированные плазмиды являютсяп трансформируют в E. палочки клетки и колонии на пластины последовательность подтверждали. После того, как последовательность подтверждена, плазмидная ДНК амплифицируют и экстрагируют. Наконец, двухцепочечную плазмиду переработан в требуемый ndsDNA ворота, через обработки ферментативной. (Б) Ферментативный обработки ndsDNA ворот. Рестриктаза PvuII используется, чтобы освободить затвор из плазмиды. Освобожденные ворота дополнительно обрабатываются с помощью ферментов однонитевых разрывов: Nb.BsrDI используется для генерации ников для регистрации AB (Панель I); Nt.BstNBI используется для генерации ников для вилки до н.э. (Секция II). Ограничение и однонитевых разрывов сайты обозначаются как цветных коробок. (С) Последовательность вид шаблона затвора Присоединяйтесь AB (панель ввода) и вилки до н.э. (Секция II). Сайт ограничение PvuII (выделены фиолетовым коробки) находится на обоих концах из ndsDNA ворот. Nb.BsrDI и Nt.BstNBI Однонитевых разрывов сайты будут выделены в красных и черных ящиков, соответственно. Места резания отмечены стрелками. Последовательность N является любой нуклеотид. (Эта цифра была изменена с разрешения из работы 29). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
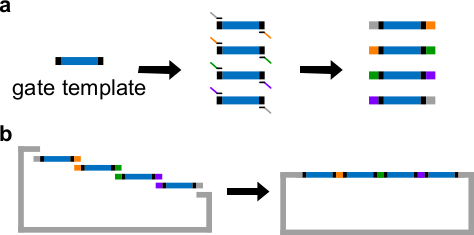
Рисунок 3. (А) ПЦР шаблона затвора ДНК. Шаблон ворота ДНК содержит последовательности ворота ndsDNA в центре (синий региона) и распорных последовательности на обоих концах (черные регионов; эти две концевые последовательности ортогональных). Грунтовки могут связываться с распорными последовательностей шаблона ворота, и генерировать четыре перекрывающихся фрагментов ДНК через ПЦР (перекрывающихся последовательности цветом на рисунке). (Б) в сборе Гибсон. Четыре усиленные Фрагмена ДНКTS затем собираются в линеаризованной плазмиды позвоночника через Гибсон метода сборки 43. (Эта цифра была изменена с разрешения из работы 29). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
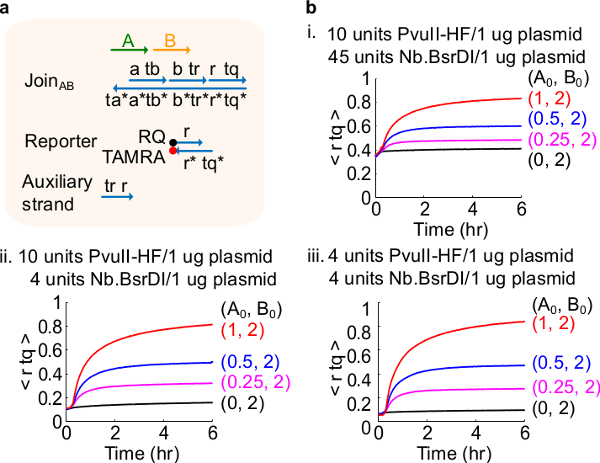
Рисунок 4. Схема производительности с различным количеством ферментов. (A) упрощенное представление ворот, репортер, вспомогательные пряди, и сигнальных цепей, используемых для соответствующих экспериментов. (Б) Кинетика эксперименты с плазмиды, полученные Регистрация АВ обрабатываются с различными количествами фермента , я. 10 единиц PvuII-HF и 45 единиц Nb.BsrDI в 1 мкг плазмиды; II. 10 единиц PvuII-HF и 4 единицы Nb.BsrDI на 1 мкг Плазмида; III. 4 единицы PvuII-HF и 4 единицы Nb.BsrDI на 1 мкг плазмиды. Все вспомогательные жилы были на 2х (1x = 10 нМ). Ворота комплекса 1.5x, а эксперименты проводились при 35 ° С в 1x TAE / Mg 2+. (Эта цифра была изменена с разрешения из работы 29). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
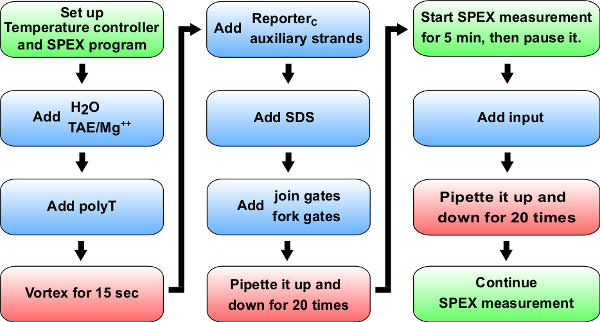
. Рисунок 5 Блок-схема кинетики экспериментов Синий:. Материалы, чтобы добавить к кювету (0,875 мл синтетического кварцевую ячейку). Справочная таблица 14 для конкретных объемов, чтобы добавить для кинетического эксперимента A + B -> B + C. Зеленый: Инструкции в спектрофлуориметре (помечены как SPEX). Красный: Смешивание инструкции.53087fig5large.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть большую версию этой фигуры.
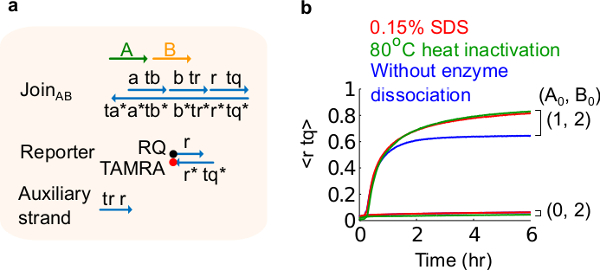
Рисунок 6. Фермент диссоциации и цепь поведение. (A) упрощенное представление ворот, репортер, вспомогательные пряди, и сигнальных цепей, используемых для соответствующих экспериментов. (Б) Кинетика эксперименты плазмиды, полученные с помощью Присоединяйтесь AB 80 ° C тепла инактивации (зеленые следы), 0,15% додецилсульфата натрия (SDS) (красный), а управление без инактивации нагреванием или добавлением SDS (синий). Стандартная концентрация была 1x = 10 нМ, и все вспомогательные жилы и вход В были в 2 раза. Ворота комплекса 1.5x, а эксперименты проводились при 35 ° С в 1x трис-ацетата с ЭДТА буфере, содержащем 12,5 мМ Mg 2+ (1x TAE / Mg 2+ ). (Эта цифра была изменена с Ref 29). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
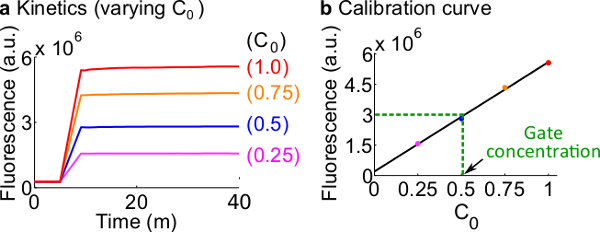
Рисунок 7. Репортер калибровки. (А) Корреспондент С кинетики. Концентрация репортер был в 3 раза (1x = 50 нМ), и начальная концентрация сигнал С показано на рисунке. (Б) Уровни флуоресценции сигнала C на конечной точки измерения (40 мин) показывает линейную зависимость с Начальная концентрация сигнала C. В примере количественного определения Fork до н.э. ворот (зеленый пунктир), значение флуоресценции Fork до н.э. был меройd, как 3 х 10 6 (АС), что соответствует 25 нМ (0,5 ×) на основе калибровочной кривой. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
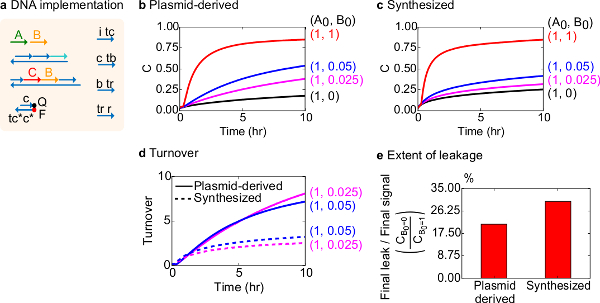
Рисунок 8. Бимолекулярные каталитические реакции кинетика (А + В-> В + С). (А) упрощенное представление ворот, репортер, вспомогательных цепей, и сигнальных цепей, используемых для соответствующих экспериментов. Эксперименты проводились в 1x Трис-ацетат ЭДТА буфере, содержащем 12,5 мМ Mg 2+ (1x TAE / Mg 2+). Все задвижки комплексы при 75 нМ концентрации (1.5x), и вспомогательные жилы были на 100 нМ концентрации (2х). Кинетика данные для плазмид-разветвленного ворот и данные для синтезированных ворот показаны на (B) и (C) , соответственно. Сигнал был 50 нМ (1x). Различные количества сигнала (катализатора) были введены в систему, и реакционную смесь испытывали при 35 ° С. (D) плазмид-разветвленного ворота выставлены более высокий оборот, чем синтезированных ворот ДНК, когда были добавлены небольшие количества входных данных. (Е) Степень Утечка. Гистограмма показывает соотношение конечного утечки до конечного сигнала (С В0 = 0 / С В0 = 1) в конце пункта (10 ч). (Эта цифра была изменена с Ref 29). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Ворота Шаблоны | Последовательности | Длина (NT) |
| JoinAB | TCTAGTTCGATCAGAGCGTTATTACCAGTAGTCGATTGCTCAGCTGCTACATTGCTTCTACGAGTCATCCTTCCACCATTGCACCTTAGAGTCCGAATCCTACCATTGCTTAACCGAGTCTCACAACCAGCTGTCATTATGGACTTGACACACAGATTACACGGGAAAGTTGC | 173 |
| FORKBC | TCTAGTTCGATCAGAGCGTTATTACCAGTAGTCGATTGCTCAGCTGCCATCATAAGAGTCACCATACCCACATTGCCACATCGAGTCCCTTTTCCACCATTGCACCTTAGAGTCCGAATCCTACCATTGCTTAACCGAGTCTCACAACCAGCTGTCATTATGGACTTGACACACAGATTACACGGGAAAGTTGC | 194 |
Таблица 1. Последовательности шаблонов ворот ndsDNA.
| Ворота | Прядь | Длина нижней ветви (NT) |
| JoinAB | JoinAB-Боттом, , <б тр>, <г TQ> | 87 |
| ForkBC | ForkBC-Боттом, <я>, , , | |
| 108 |
Таблица 2. Прядей, содержащих Регистрация AB и вилка до нашей эры. (Эта таблица была изменена из работы 29).
| Домен | Последовательность | Длина (NT) |
| та | CTGCTA | 6 |
| ТБ | TTCCAC | 6 |
| TC | TACCCA | 6 |
| TR | TCCTAC | 6 |
| TQ | AACCAG | 6 |
| CATTGCTTCTACGAGTCATCC | 21 | |
| б | CATTGCACCTTAGAGTCCGAA | 21 |
| С | CATTGCCACATCGAGTCCCTT | 21 |
| р | CATTGCTTAACCGAGTCTCAC | 21 |
| я | CTGCCATCATAAGAGTCACCA | 21 |
| Грунтовка прядь | Последовательности | Длина (NT) |
| Прямой праймер-1 | AAGAGAGACCACATGGTCCTTCTTGAGTTTGTAACAG CGTTATTACCAGTAGTCGATTGC | 60 |
| Обратный праймер-1 | ACTACTATTTACTAATCCCATTGCGTGTTCTTATT TAATCTGTGTGTCAAGTCCATAATG | 60 |
| Прямой праймер-2 | AATAAGAACACGCAATGGGATTAGTAAATAGTAGT CGTTATTACCAGTAGTCGATTGC | 58 |
| Обратный праймер-2 | GCGAAACTAGCTTGTGGTGATATTGTCTCGTGTGT TAATCTGTGTGTCAAGTCCATAATG | 60 |
| Прямой праймер-3 | ACACACGAGACAATATCACCACAAGCTAGTTTCGC CGTTATTACCAGTAGTCGATTGC | 58 |
| Обратный праймер-3 | ACATTGTACGCCTAAATCATCAAGAATAATTGTTG TAATCTGTGTGTCAAGTCCATAATG | 60 |
| Прямой праймер-4 | CAACAATTATTCTTGATGATTTAGGCGTACAATGT CGTTATTACCAGTAGTCGATTGC | 58 |
| Обратный праймер-4 | GAGCGCAGCGAGTCAGTGAGCGAGGAAGCCTGCAG TAATCTGTGTGTCAAGTCCATAATG | 60 |
Таблица 4. Последовательности праймеров для ПЦР ndsDNA шаблонов ворот.
| Реагент | Объем для реакции 1x (мкл) |
| Высокая плазмидой костяк (~ 300 нг / мкл) | 10 |
| PvuII-HF (20000 единиц / мл) | 2 |
| PstI-HF (20000 единиц / мл) | 2 |
| 10x Вырезать умный буфер | 2 |
| H 2 O | 4 |
| Общий объем | 20 d> |
Таблица 5. Протокол плазмиды магистральной дайджеста.
| Реагент | Объем для реакции 1x (мкл) |
| ДНК-вектор (~ 50 нг / мкл) | 1 |
| ПЦР амплифицированный фрагмент-1 (~ 50 нг / мкл) | 1 |
| ПЦР амплифицированный фрагмент-2 (~ 50 нг / мкл) | 1 |
| ПЦР амплифицированный фрагмент-3 (~ 50 нг / мкл) | 1 |
| ПЦР амплифицированный фрагмент-4 (~ 50 нг / мкл) | 1 |
| Master Mix 2x Гибсон Ассамблея | 5 |
| Общий объем | 10 |
| Реагент | Объем для реакции 1x (мкл) |
| Плазмидную ДНК (~ 1 мкг / мкл концентрации) | 1000 |
| PvuII-HF (20000 единиц / мл) | 200 |
| 10x Вырезать умный буфер | 133,3 |
| Общий объем | 1333,3 |
Таблица 7. Протокол ndsDNA ворот вставленных плазмиды переварить рестриктазой PvuII-HF.
| Реагент | Объем (мкл) |
| Регистрация ворота (~ 5 мкг / мкл концентрации) | 150 |
| Nb.BsrDI (10000 единиц / мл) | 300 |
| 10x Вырезать умный буфер | 50 |
| Общий объем | 5 часов |
Таблица 8. Протокол присоединиться ворота переварить с засечек фермента Nb.BsrDI.
| Реагент | Объем (мкл) |
| Вилка ворота (~ 5 мкг / мкл концентрации) | 150 |
| Nt.BstNBI (10000 единиц / мл) | 600 |
| 10x НЭБ буфера 3.1 | 83,3 |
| Общий объем | 833,3 |
Таблица 9 Протокол вилка ворота переварить с засечек фермента Nt.BstNBI.
. Таблица 10 Strand последовательности для реализации химической реакции A + B -.> B + C (. Эта таблица была изменена из работы 29)
| Реагент | Объем (мкл) | Конечная концентрация |
| ROX- <с * TC *> 100 мкм на | 10 | 10 мкМ (1x) |
| <с> -rq на 100 ц; М | 13 | 13 мкМ (1.3x) |
| 10x TAE с 125 мм Mg 2+ | 10 | 1x TAE 12,5 мМ Mg 2+ |
| H 2 O | 67 | - |
| Общий объем | 100 | 10 мкМ (1x) |
Таблица 11. Протокол по сборке Reporter C.
| Реагент | Объем (мкл) | Конечная концентрация |
| H 2 O | 514 | - |
| 10x TAE с 125 мм Mg 2+ | 60 | 1x TAE 12,5 мМ Mg 2+ |
| PolyT 300 ц; М | 2 | 1 мкМ |
| Корреспондент С при 10 мкМ | 9 | 150 нм (3x) |
| 10% ДСН | 9 | 0,15% |
| 5 мкм на | 6 | 50 нМ (1x) |
| Общий объем | 600 | - |
Таблица 12. Протокол калибровки Reporter С. Объемы, представленная здесь для общем реакционном объеме 600 мкл (соответствующих использованием 0,875 мл синтетического кварца клетки), но может быть настроен на работу с различными клетками размера.
| Реагент | Объем (мкл) | Финал концентрация |
| H 2 O | 493 | - |
| 10x TAE с 125 мм Mg 2+ | 60 | 1x TAE 12,5 мМ Mg 2+ |
| polyT 300 мкМ | 2 | 1 мкМ |
| Корреспондент С при 10 мкМ | 9 | 150 нм (3x) |
| <я TC> 100 мкм на | 3 | 10x |
| <с ТБ> 100 мкм на | 3 | 10x |
| <б тр> 100 мкм на | 3 | 10x |
| 10% ДСН | 9 | 0,15% |
| Вилка до н.э. на ~ 1 мкм (концентрация неизвестна) | 15 | ~ 0.5x |
| <г TQ> 100 мкм на | 3 | 10x |
| Общий объем | 600 | - |
Таблица 13. Протокол калибровки Fork до нашей эры. Объемы, предоставляемые здесь для полного реакционного объема 600 мкл в, но может быть настроен на работу с различными клетками размера.
| Реагент | Объем (мкл) | Конечная концентрация | |
| H 2 O | 407,2 | - | |
| 10x TAE с 125 мм Mg 2+ | 52,8 | 12,5 мм Mg 2+ | |
| polyT 300 мкМ | 2 | 1 мкМ | |
| Корреспондент С при 10 мкМ | 9 | 150 нм (3x) | |
| <я TC> в 10 мкМ | 6 | 100 нм (2x) | |
| <с ТБ> в 10 мкМ | 6 | 100 нм (2x) | |
| в 10 мкМ | 6 | 100 нм (2x) | |
| 6 | 100 нм (2x) | ||
| 10% ДСН | 9 | 0,15% | |
| Присоединяйтесь AB на 1 мкМ | 45 | 75 нМ (1.5x) | |
| Вилка до н.э. на 1 мкМ | 45 | 75 нМ (1.5x) | |
| <Т.А.> в 10 мкМ | 3 | 50 нМ (1x) | |
| в 10 мкМ | 3 | 50 нМ (1x) | |
| Общий объем | 600 | - | |
Таблица 14. Протокол химической реакции A + B-> В + С. Объемы, представленная здесь для общем реакционном объеме 600 мкл, но может регулироваться для работы с различными клетками размера.
| Синтезированные ворота | Плазмиды, полученные ворота | ||||
| Описание | Стоимость | Присоединяйтесь ворота | Вилка ворота | ||
| СТР очищенная длинная прядь (100 нт; служил нижних прядей ворот) | ~ $ 75 | Описание </ STRONG> | Стоимость | Описание | Стоимость |
| СТР очищенная короткие нити (~ 30 нт, служил топ нитей ворот) | ~ $ 185 | Ворота шаблон | ~ $ 100 | Ворота шаблон | ~ $ 100 |
| Всего | ~ $ 260 | Набор для выделения плазмиды | ~ $ 26 | Набор для выделения плазмиды | ~ $ 26 |
| Ограничение фермента (PvuII-HF) | ~ $ 11 | Ограничение фермента (PvuII-HF) | ~ $ 11 | ||
| Перекреста фермента (Nt.BsrDI, Регистрация ворота) | ~ $ 29 | Перекреста фермента (Nt.BstNBI, вилка ворота) | ~ $ 62 | ||
| Всего | ~ $ 166 | Всего | ~ $ 199 |
FO:.. Keep-с-previous.within-странице = "всегда"> Таблица 15 Сравнение затрат между плазмиды, полученные ворот и синтезированных ворот (. Эта таблица была изменена из работы 29)
| Синтезированные ворота | Плазмиды, полученные ворота | ||
| Обработка | Время обработки | Обработка | Время обработки |
| Отжиг | 1 час | Клонирование | 5 ч |
| Очистка СТРАНИЦА | 2 ч | Добыча плазмиды | 2 ч |
| Всего | 3 ч | Два шага ферментом | 0,5 ч |
| Этанол осадков | 1 ч | ||
| Всего | 8.5 ч | ||
Сравнительная таблица 16. Время обработки между плазмиды, полученные ворот и синтетических ворот. (Эта таблица была изменена из работы 29).
Обсуждение
Эта статья описывает способ получения ndsDNA ворота из высокочистого плазмидной ДНК. Кроме того, протокол представлен для характеристики производительности ворота с помощью кинетики флуоресценции анализа. Экспериментальные данные показывают, что система плазмид-разветвленного превосходит его аналог синтетического даже если синтетическое система собрана из нитей очищали с использованием электрофореза в полиакриламидном геле (PAGE). Скорее всего, улучшенные характеристики плазмиды, полученные ворот, прежде всего, из-за очень высокой чистоты биологического ДНК. Синтетической ДНК содержит множество ошибок, в частности делеций, которые приводят к олигонуклеотидов длиной N-1, и таких побочных продуктов, как правило, не удаляется полностью в ПААГ или высокоэффективная жидкостная хроматография (ВЭЖХ) методик очистки. Похожие улучшения тех сообщенных здесь также наблюдается в предыдущем исследовании усилителя катализируемой шпильки, которые раньше ДНК, полученной из биологических источников 21.
Тем не менее, даже использование плазмиды, полученные ворот не может полностью исключить ошибки в исполнении ворота, для которых Есть по крайней мере две причины: во-первых более-пищеварения или отсутствия вырезать точностью может привести к воротам слишком много ники или ники в чужие позиции. В любом случае, ворота, скорее всего, участвовать в нежелательных реакций. Такие проблемы могут быть ослаблены путем оптимизации количества используемого фермента (смотри рисунок 4). Во-вторых, в этих экспериментах, большинство входов и вспомогательные жилы были синтетической ДНК и, таким образом делеции и мутации. В принципе, все одноцепочечной ввода и вспомогательные жилы могут быть также получены из фагемидный ДНК через уменьшение поперечного сечения ферментом из предварительно кодированного геном m13 26 вирусной. Возможно выполнение схемы может быть дополнительно улучшена с помощью оцДНК, полученный из бактериального генома.
Хотя использование плазмид-разветвленного ворот было обнаружено, чтобы улучшить производительность цепи, анализстоимости и обработки раз показал, что в то время как производство плазмиды, полученные ворот немного дешевле (Таблица 15), она занимает в 2-3 раза больше времени обработки по сравнению с сборки и очистки ворот из коммерчески синтезируемых олигонуклеотидов (таблица 16). Первичные затраты плазмид-разветвленного ворота синтез генов и использование ферментов рестрикции. Для 300 пмоль ворот (достаточно в течение 15 реакций при 30 нМ), по оценкам, затраты на Регистрация ворота примерно $ 170 и $ 200 за Вилка ворот, разница в стоимости является в связи с использованием различных ферментов перекреста. В противоположность этому, химический синтез нитей для одних и тех же затратах затвора около $ 260, включая плату очистки страницы. Основная стоимость время плазмид, полученных ворот находится в процедуре клонирования, которая, как и синтеза ДНК, могут быть переданы в синтез гена компании. Тем не менее, После сборки плазмид-разветвленного ворота имеют то преимущество, что хост плазмиды могут быть легко воспроизведеныго могут быть сохранены в виде бактериальных запасов глицерина. Это делает возможным повторное использование ворот много раз.
Заглядывая вперед, улучшенные характеристики плазмиды, полученные ворот может позволить гораздо больший диапазон динамики поведения, чем экспериментально продемонстрирована до сих пор с ДНК КДЧ. Например, недавние теоретические работы 47,48 предположили, что самоорганизующиеся пространственные структуры на макроуровне может быть реализован с ДНК КДЧ с помощью механизма диффузии реакция. Метод, представленный здесь обеспечивает реальный путь для построения основные молекулярные компоненты для таких самостоятельных рисунка материалов ДНК. Хотя сложной, развитие макро-масштабе морфологии в программируемой образом будет иметь значительные последствия в областях, начиная от исследования биоматериалов в регенеративной медицине.
Раскрытие информации
The authors declare no competing financial interests.
Благодарности
На рисунках 1, 2, 3, 4, 6, 8 и таблицы 2, 3, 10, 15, 16 будут изменены из работы 29. Эта работа была поддержана Национальным научным фондом (NSF-предоставлять CCF 1117143 и NSF-CCF 1162141 в GS). Ю.-х была поддержана тайваньское правительство стипендий. СДР при поддержке Национального научного фонда Высшей научно-исследовательского Программы стипендий (GRFP).
Материалы
| Name | Company | Catalog Number | Comments |
| Phusion High-Fidelity PCR Master Mix with HF Buffer | NEB | M0531S | |
| PvuII-HF | NEB | R3151L | |
| PstI-HF | NEB | R3140S | |
| Gibson Assembly Master Mix | NEB | E2611S | |
| Terrific Broth, Modified | SIGMA-ALDRICH | T0918-250G | |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | |
| QIAGEN Hispeed Maxi-prep Kit | QIAGEN | 12662 | |
| Nb.BsrDI | NEB | R0648L | |
| Nt.BstNBI | NEB | R0607L | |
| NanoDrop 2000c | Thermo Scientific | ||
| Double-stranded Genomic Blocks | IDT | ||
| Horiba Jobin-Yvon Spex Fluorolog-3 Fluorimeter | Horiba/Jobin Yvon | ||
| Synthetic Quartz Cells | Starna | 23-5.45-S0G-5 | |
| QIAGEN Gel Extraction Kit | QIAGEN | 28706 | |
| Plasmid Backbones | BioBrick | E0240-pSB1A2 | High copy number plasmid with Ampicillin resistance. Sequence can be found from http://parts.igem.org |
Ссылки
- Zhang, D. Y., Seelig, G. Dynamic DNA nanotechnology using strand-displacement reactions. Nat. Chem. 3, 103-113 (2011).
- Krishnan, Y., Simmel, F. C. Nucleic acid based molecular devices. Angew. Chem. Int. Ed. Engl. 50, 3124-3156 (2011).
- Zhang, D. Y., Winfree, E. Control of DNA strand displacement kinetics using toehold exchange. J. Am. Chem. Soc. 131, 17303-17314 (2009).
- Qian, L., Winfree, E., Bruck, J. Neural network computation with DNA strand displacement cascades. Nature. 475, 368-372 (2011).
- Qian, L., Winfree, E. Scaling up digital circuit computation with DNA strand displacement cascades. Science. 332, 1196-1201 (2011).
- Zadegan, R. M., Jepsen, M. D., Hildebrandt, L. L., Birkedal, V., Kjems, J. Construction of a fuzzy and boolean logic gates based on DNA. Small. 11, 1811-1817 (2015).
- Seelig, G., Soloveichik, D., Zhang, D. Y., Winfree, E. Enzyme-free nucleic acid logic circuits. Science. 314, 1585-1588 (2006).
- Zadegan, R. M., et al. Construction of a 4 zeptoliters switchable 3D DNA box origami. ACS Nano. 6, 10050-10053 (2012).
- Andersen, E. S., et al. Self-assembly of a nanoscale DNA box with a controllable lid. Nature. 459, 73-76 (2009).
- Zhang, D. Y., Hariadi, R. F., Choi, H. M., Winfree, E. Integrating DNA strand-displacement circuitry with DNA tile self-assembly. Nat. Commun. 4, (1965).
- Yurke, B., Turberfield, A. J., Mills, A. P., Simmel, F. C., Neumann, J. L. A DNA-fuelled molecular machine made of DNA. Nature. 406, 605-608 (2000).
- Green, S. J., Lubrich, D., Turberfield, A. J. DNA hairpins: fuel for autonomous DNA devices. Biophys. J. 91, 2966-2975 (2006).
- Venkataraman, S., Dirks, R. M., Rothemund, P. W., Winfree, E., Pierce, N. A. An autonomous polymerization motor powered by DNA hybridization. Nat. Nanotechnol. 2, 490-494 (2007).
- Green, S. J., Bath, J., Turberfield, A. J. Coordinated chemomechanical cycles: a mechanism for autonomous molecular motion. Phys. Rev. Lett. 101, 238101 (2008).
- Omabegho, T., Sha, R., Seeman, N. C. A bipedal DNA Brownian motor with coordinated legs. Science. 324, 67-71 (2009).
- Turberfield, A. J., et al. DNA fuel for free-running nanomachines. Phys. Rev. Lett. 90, 118102 (2003).
- Dirks, R. M., Pierce, N. A. Triggered amplification by hybridization chain reaction. Proc. Natl. Acad. Sci. U. S. A. 101, 15275-15278 (2004).
- Seelig, G., Yurke, B., Winfree, E. Catalyzed relaxation of a metastable DNA fuel. J. Am. Chem. Soc. 128, 12211-12220 (2006).
- Zhang, D. Y., Turberfield, A. J., Yurke, B., Winfree, E. Engineering entropy-driven reactions and networks catalyzed by DNA. Science. 318, 1121-1125 (2007).
- Yin, P., Choi, H. M., Calvert, C. R., Pierce, N. A. Programming biomolecular self-assembly pathways. Nature. 451, 318-322 (2008).
- Chen, X., Briggs, N., McLain, J. R., Ellington, A. D. Stacking nonenzymatic circuits for high signal gain. Proc. Natl. Acad. Sci. U. S. A. 110, 5386-5391 (2013).
- Phillips, A., Cardelli, L. A programming language for composable DNA circuits. J. R. Soc. Interface. 6, S419-S436 (2009).
- Lakin, M. R., Youssef, S., Polo, F., Emmott, S., Phillips, A. Visual DSD: a design and analysis tool for DNA strand displacement systems. Bioinformatics. 27, 3211-3213 (2011).
- Lakin, M. R., Youssef, S., Cardelli, L., Phillips, A. Abstractions for DNA circuit design. J. R. Soc. Interface. 9, 470-486 (2012).
- Zhang, D. Y., Winfree, E. Robustness and modularity properties of a non-covalent DNA catalytic reaction. Nucleic Acids Res. 38, 4182-4197 (2010).
- Ducani, C., Kaul, C., Moche, M., Shih, W. M., Hogberg, B. Enzymatic production of 'monoclonal stoichiometric' single-stranded DNA oligonucleotides. Nat. Methods. 10, 647-652 (2013).
- Lin, C., et al. In vivo cloning of artificial DNA nanostructures. Proc. Natl. Acad. Sci. U. S. A. 105, 17626-17631 (2008).
- Bhatia, D., et al. Icosahedral DNA nanocapsules by modular assembly. Angew. Chem. Int. Ed. Engl. 48, 4134-4137 (2009).
- Chen, Y. J., et al. Programmable chemical controllers made from DNA. Nat. Nanotechnol. 8, 755-762 (2013).
- Arkin, A., Ross, J. Computational functions in biochemical reaction networks. Biophys. J. 67, 560-578 (1994).
- Érdi, P., Tóth, J. . Mathematical models of chemical reactions: theory and applications of deterministic and stochastic models. , (1989).
- Magnasco, M. O. Chemical kinetics is Turing universal. Phys. Rev. Lett. 78, 1190 (1997).
- Oishi, K., Klavins, E. Biomolecular implementation of linear I/O systems. IET Syst. Biol. 5, 252-260 (2011).
- Senum, P., Riedel, M. Rate-independent constructs for chemical computation. PLoS One. 6, (2011).
- Soloveichik, D., Cook, M., Winfree, E., Bruck, J. Computation with finite stochastic chemical reaction networks. Natural Computing. 7, 615-633 (2008).
- Soloveichik, D., Seelig, G., Winfree, E. DNA as a universal substrate for chemical kinetics. Proc. Natl. Acad. Sci. U. S. A. 107, 5393-5398 (2010).
- Tyson, J. J., Chen, K. C., Novak, B. Sniffers, buzzers, toggles and blinkers: dynamics of regulatory and signaling pathways in the cell. Curr. Opin. Cell. Biol. 15, 221-231 (2003).
- Cardelli, L. Two-domain DNA strand displacement. Math. Struct. Comput. Sci. 23, 247-271 (2013).
- Angluin, D., Aspnes, J., Eisenstat, D. A simple population protocol for fast robust approximate majority. Distrib. Comput. 21, 87-102 (2008).
- Cardelli, L., Csikasz-Nagy, A. The cell cycle switch computes approximate majority. Sci. Rep. 2, 656 (2012).
- Zadeh, J. N., et al. NUPACK: Analysis and design of nucleic acid systems. J. Comput. Chem. 32, 170-173 (2011).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. , (2012).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat. Methods. 6, 343-345 (2009).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J. Vis. Exp. , e253 (2007).
- Lessard, J. C. Transformation of E. coli via electroporation. Methods Enzymol. 529, 321-327 (2013).
- Nasri, M., Thomas, D. Alteration of the specificity of PvuII restriction endonuclease. Nucleic Acids Res. 15, 7677-7687 (1987).
- Dalchau, N., Seelig, G., Phillips, A. Computational design of reaction-diffusion patterns using DNA-based chemical reaction networks. DNA Computing and Molecular Programming. , 84-99 (2014).
- Scalise, D., Schulman, R. Designing modular reaction-diffusion programs for complex pattern formation. Technology. 2, 55-66 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены