Method Article
플라스미드 유래 구현 화학 반응 네트워크 용 DNA 가닥 변위 게이츠
요약
This protocol describes a method for deriving DNA strand displacement gates from plasmids and testing them using fluorescence kinetics measurements. Gates can be modularly composed into multi-component systems to approximate the behavior of formal chemical reaction networks (CRN), demonstrating a new use for CRNs as a molecular programming language.
초록
DNA nanotechnology requires large amounts of highly pure DNA as an engineering material. Plasmid DNA could meet this need since it is replicated with high fidelity, is readily amplified through bacterial culture and can be stored indefinitely in the form of bacterial glycerol stocks. However, the double-stranded nature of plasmid DNA has so far hindered its efficient use for construction of DNA nanostructures or devices that typically contain single-stranded or branched domains. In recent work, it was found that nicked double stranded DNA (ndsDNA) strand displacement gates could be sourced from plasmid DNA. The following is a protocol that details how these ndsDNA gates can be efficiently encoded in plasmids and can be derived from the plasmids through a small number of enzymatic processing steps. Also given is a protocol for testing ndsDNA gates using fluorescence kinetics measurements. NdsDNA gates can be used to implement arbitrary chemical reaction networks (CRNs) and thus provide a pathway towards the use of the CRN formalism as a prescriptive molecular programming language. To demonstrate this technology, a multi-step reaction cascade with catalytic kinetics is constructed. Further it is shown that plasmid-derived components perform better than identical components assembled from synthetic DNA.
서문
왓슨 - 크릭 염기 쌍의 예측은 동적 DNA 나노 기술은 동적 속성 1, 2와 분자 장치를 설계하는 프로그램 방법으로 등장 할 수있다. 특히, DNA 가닥 변위 - 프로그램, 경쟁력 혼성화 반응 - 동적 DNA 시스템 엔지니어링을위한 강력한기구 인 것을 입증했다. DNA의 나선 치환 반응에서, 들어오는 올리고 뉴클레오티드 상보 적 결합 파트너의 결합 이전에 "출력"가닥 변위. 다수의 이러한 반응은 반응 순서 및 개개의 타이밍을 3 단계에 걸쳐 고도의 제어와 다단계 반응 캐스케이드로 서로 연결된다. DNA 나선 치환 캐스케이드은 디지털 및 아날로그 회로 분자 4-7, 8-10 나노 전환, 자율 분자 모터 11-15 및 비공유 증폭기 13,16-21 촉매를 생성하는데 사용되어왔다. 또한, D가닥 치환 반응을 사용하여 NA 디바이스 시뮬레이션 및 컴퓨터 보조 설계 소프트웨어를 사용하여 22-24의 다양한 애플리케이션을 위해 설계 될 수있다.
현재, 화학적으로 합성 된 DNA는 DNA 나노 기술의 주요 재료로 작용한다. 그러나, DNA 합성 과정에서 오류 및 결과 불완전한 올리고 뉴클레오티드, 잘못된 부반응시킴으로써 DNA 동적 장치의 성능을 제한하는 것으로 여겨진다. 예를 들어, "누설"반응에도 반응 트리거 부재 출력 올리고 뉴클레오타이드의 방출을 초래할 수있다. 이러한 효과는 초기 누출의 경우에도 최소한 결국 캐스케이드 (19, 20)의 전체 활성화가 발생합니다 촉매 반응 계곡에서 가장 명백하다. 반대로, 반응은 종종 일부 구성도 의도 입력 7,25의 존재하에 유발하지 않기 때문에 활성화 기대 수준에 도달하지 못한다. 의 성능을 확인하기 위해 DNA를 기반생물학적 단백질 기반 대상에 필적 나노 소자는, 예컨대 에러 모드 대폭 저감 할 필요가있다.
세균의 플라스미드 또는 다른 생물학적 DNA는 나노 기술 응용 프로그램을위한 고순도의 DNA의 상대적으로 저렴한 소스의 역할을 할 수있다. 많은 양의 DNA가 박테리아에서 복제함으로써 생성 될 수 있고, 생명체의 극한 교정 능력 얻어진 DNA의 순도를 보장한다. 사실, 몇 가지 최근의 논문은 나노 기술 응용 21,26-28에 대한 생물학적 DNA의 잠재적 인 유틸리티를 인정했다. 그러나, 플라스미드 DNA의 완전 이중 가닥 특성은 지금까지 일반적으로 다수의 올리고 뉴클레오티드로 구성되며, 이중 가닥과 단일 가닥 영역 모두를 포함하는 DNA 동적 장치를 제조하기위한 재료로서 사용을 금지하고있다. 최근 종이 (29)이 문제가 해결되었고, 주로 흠 이중 가닥 DNA (ndsDNA)로 구성되어 새로운 DNA 게이트 구조에서 소개했다디.
중요한 ndsDNA 게이트 시스템은 임의의 형식적인 화학 반응 네트워크 (CRN) (29)에 의해 지정된 역학을 실현하는 설계 될 수있다. ndsDNA 게이트 따라서 진동과 혼란, 쌍 안정성 및 메모리, 부울 논리 또는 알고리즘 행동 30-38을 나타내는 동적 시스템을 만들 원칙적으로 사용될 수있다. 예를 들어, 참조 번호. 29 "합의"프로토콜의 구현 분자량, 분산 컴퓨팅 29,39,40 알고리즘의 타입을 제공하는 세 CRN 반응을 보여 주었다. 이 작품은 처음 빠르게 기능 분자 시스템을 (그림 1A)를 합성하는 "프로그래밍 언어"로 CRN의 형식주의에 대한 새로운 사용을 보여 주었다.
여기서, 플라스미드 DNA에서 ndsDNA 게이트를 유도 상세한 프로토콜이 제공된다. 먼저 시퀀스 설계 프로세스를 검토한다. 그런 다음이 포함 방법 합성 올리고 뉴클레오티드에 대한 설명을 다음과게이트 서열은 플라스미드에 클로닝하고 서열을 확인 및 세균 배양을 통해 증폭. ndsDNA 게이트가 효소 처리에 의해 플라스미드로부터 유도 될 수있는 방법 다음에,이 도시되어있다 (도 2 참조). 마지막으로, 형광 역학 분석을 이용하여 게이트 작동을 테스트하는 방법이 요약되어있다.
반응 메커니즘
예로서, 프로토콜은 촉매 화학 반응 A + B-> B + C에 초점을 맞춘다. 종 A, B, 및 C ( "신호",도 1b)가 다른 모든 단일 가닥 DNA 분자에 대응한다. 이들 분자의 서열과 완전히 무관 한 가닥은 서로 직접 반응하지 않는다. 모든 신호들의 시퀀스, 즉 두 개의 다른 기능 영역, 나선 치환 반응에서 함께 작용 시퀀스 : 1)으로 발 짧은 도메인 (나선 치환 라벨 (R)의 개시를 위해 사용되며, TB, TC) TAeaction, 2) 긴 도메인 (를 A, B, C) 즉, 신호 식별을 결정 라벨.
신호 가닥 사이의 상호 작용은 흠 이중 가닥 DNA (ndsDNA) 게이트 단지로 및 보조 단일 가닥 종 (, 와 AB와 포크 기원전 가입) 매개되는 >). + B-> B + C 공식 반응은 각각의 반응 단계가 후속 반응 (도 1b) 용으로 발을 노출 나선 치환 반응 단계들의 시리즈를 통해 실행된다. 신호 C는 포크 게이트에 결합 된 상태에서이 예에서, 신호 A와 B는 초기 용액에 자유 롭다. 반응 B와 C의 끝에 용액이다. 보다 일반적으로, 게이트에 결합되는 신호들은 용액에서 자유롭게 신호가 활성화되어있는 동안, 즉, 그들이 나선 치환 반응에 참여할 수있는 등의 비활성입력. 반응 시간 코스는 형광 리포터 전략 (도 1C)를 사용하여 이어진다. 이전의 연구 (29)에,이 반응 메커니즘은 정확한 화학량뿐만 아니라 대상의 반응 속도론을 행하게하는 것이 입증되었다.
프로토콜
1. 시퀀스 디자인
참고 : 시퀀스 설계 개요 :이 섹션에서는, 플라스미드 유래 DNA 게이트를 설계하기위한 전략을 설명한다. 게이트의 양쪽 끝에 배치 효소 사이트는 소화 후 완전히 이중 가닥 게이트의 석방을 허용합니다. 칼자국을내는 사이트는 효소가 최종 ndsDNA 게이트를 만들기 위해 상단 가닥에 흠을 만들 수 있도록 배치됩니다. 마지막으로, 나머지 서열은 독립 도메인이 서로 직교하며 이차 구조를 나타내지 않는다되도록 선택된다.
- 네 개의 뉴클레오티드 길이 떨어진 각 도메인의 3 '말단으로부터의 칼자국을내는 Nt.BstNBI 사이트를 배치 (A, B, C, R, 및 I). (. A, B, C, 및 R 도메인 내가 어떤 Nb.BsrDI 새김 사이트를하지 않습니다) 각 긴 도메인의 5 '말단에 Nb.BsrDI의 칼자국을내는 사이트를 놓습니다. 그림 2C는의 세부 순서보기를 보여줍니다 AB와 포크 BC 게이트에 가입하세요.
- PvuII 처리 물은 플라스미드에서 문을 해제 할 수 있도록 ndsDNA 게이트의 양쪽에 PvuII 제한 사이트를 놓습니다 (그림 2C 참조).
- (a) 가닥 (DNA 구조가 Nupack 41을 사용하여 예측 될 수있다) 2 차 구조를 나타내지해야하고, (b)는 모든 도메인은 크로스 토크를 최소화 직교한다 : 두 원리에 따라 다른 제약되지 않은 서열을 디자인.
- 게이트 템플릿의 중심에 ndsDNA 시퀀스를 놓습니다. 게이트 템플릿의 양단에 스페이서 30-40 bp의 랜덤 시퀀스를 배치, 각 스페이서는 다음 중합 효소 연쇄 반응 (PCR)에 대한 독특한 결합 부위로서 작용한다.
플라스미드에 NdsDNA 게이츠 2. 복제
참고 :이 섹션은 플라스미드 백본으로 게이트의 4 복사본을 삽입 깁슨 복제 방법을 설명합니다.
- DNA 제조업체에서 이중 가닥 게놈 블록으로 주문 ndsDNA 게이트 템플릿 (게이트 템플릿 시퀀스가 표시됩니다표 1; 가닥은 표 2에 나타낸다 ndsDNA 게이트에서 발생; 레벨 도메인 서열)을 표 3에 나타낸다.
- 지시를 수신 한 후 DNA, DNA는 모두 건조 튜브의 바닥에있을 것을 보장하기 위해 1 분 동안 10,000-14,000 XG에 유전체 블록을 포함하는 튜브를 스핀.
- 10 NG / μL의 최종 농도를 달성하기의 DNase없는 물에 건조 유전체 블록을 재현 탁.
주 : 대안 적으로, DNA는 1X 트리스 에틸렌 디아민 테트라 아세트산 (EDTA) 완충액에 재현 탁하여 수 (TE 완충액 : 10 mM 트리스 및 1 mM의 EDTA, pH를 8.0). 그러나, EDTA는 가의 양이온 대 킬레이트 제이며 PCR을 억제 할 수있다. - 고 충실도 DNA 중합 효소와 표준 PCR을 통해 다른 중첩 영역 (그림 3A 참조) 4 게이트 조각을 생성합니다. 프라이머 서열은 표 4에 자세히 설명되어 있습니다 (이 프라이머의 녹는 온도는 62 ° C이다).
- 1의 2 % 아가로 오스 겔을 실행할RT에서 30 분 동안 40 V 겔에서 단편을 증폭 (상세한 아가 로스 겔 전기 영동 프로토콜 42 참조)에 대응하는 각각의 PCR 밴드를 잘라. 그런 다음 제조업체의 지침에 따라 겔 추출 키트 (자료 참조)를 사용하여 겔 조각을 정화.
- 제조사의 프로토콜에 따라 1 시간 (표 5 참조)를 37 ℃에서 HF-PvuII 및 PstI로-HF와 높은 카피 수의 플라스미드 백본 (자료 참조) 다이제스트. PvuII-HF와 PstI로-HF 극적으로 불특정 컷을 줄일 높은 충실도 제한 효소이다.
- 선형화 된 백본을 1.5 % 아가로 오스 겔을 실행하고 절단 (일반적으로 실온에서 30 ~ 40 분 동안 140 V에서 젤을 실행). 그런 다음 제조업체의 지침에 따라 겔 추출 키트를 사용하여 겔 조각에서 DNA를 추출한다.
- 선형화 된 벡터와 정제 된 PCR 단편과 깁슨 어셈블리 (43)를 수행 (표 6과 그림 (b)를 참조 )에서 1 시간 동안 50 ℃에서.
- (100 μg / ml의 농도) 항생제 암피실린을 함유 원성 브로 쓰 (LB) 한천 플레이트에서의 대장균 (대장균) 및 판으로 단계 2.8로부터 깁슨 조립체 제품 변형. 전기 또는 열 충격 방법 (44,45)를 통해 변환을 수행하고, 적절한 E.를 사용 대장균 균주. 예를 들어, E.를 사용 콜라이 균주 열충격 형질 전환 JM109, E. 및 DH5α electrocompetent를 사용 전기에 대한 대장균 세포.
참고 : 사용되는 플라스미드 백본 암피실린 내성 카세트를 포함한다. 다른 선택 마커를 사용하는 경우, 대신 암피실린의 적절한 항생제를 사용합니다.
3. 세균 문화 증폭 및 품질 관리
참고 :이 부분은 품질 관리 후 DNA 게이트를 포함하는 플라스미드의 대량 생산과 분리에 대해 설명합니다.
- 하나의 식민지를 선택단계 2.9에서 암피실린 선택적 판에서 3 ml의 암피실린 항생제를 포함하는 풍부한 매체의 문화를 배양 (100 μg / ml의 농도). 이 후속 실험 단계에 다시 이용 될 수있는 콜로니를 표시한다. 격렬한 흔들림 (200 ~ 300 RPM)와 37 ° CO / N에서 문화를 성장. 일반적으로 16 ~ 24 시간 동안 배양한다.
- 제조업체의 지침에 따라 미니 준비 키트를 사용하여 세균 배양에서 플라스미드 DNA를 추출합니다.
- 제조업체의 지시에 따라, 분광 광도계를 사용하여 정제하여 플라스미드 DNA를 측정한다. 50 ~ 1,000 NG / μL에서 전형적인 수율 범위.
- DNA 염기 서열 회사에 샘플을 보내 서열 추출 된 플라스미드 DNA를 가져옵니다. 시퀀싱 프라이머는 상류 약 100 뉴클레오티드를 위치해야하고 지역의 하류 서열 할; 플라스미드에 대한 시퀀싱 프라이머는 (플라스미드에 대한 자료 참조) 다음과 같은 순서가 있습니다 ATTACCGCCTTTGAGTGAGC.
아니테 : 순서 오류 또는 삽입 ndsDNA 게이트의 재결합이있는 경우, 단계 2.9에서 판에서 다른 식민지를 선택합니다. 팔로우 삽입 된 게이트의 순서가 올바른지 확인하기 위해 3.1-3.4 단계를 반복합니다. - 서열이 올바른지 확인한 후 (단계 2.9에서) 암피실린 선택적 판에서 해당 식민지를 선택하고, (100 μg / ml의 농도) 암피실린 항생제가 포함 된 800 ml의 좋아요 국물 (TB)의 문화를 품어. 격렬한 흔들림 (200 ~ 300 RPM)와 16 ~ 24 시간 동안 37 ° C에서 문화를 성장. TB는 특히 높은 수율 플라스미드 생산에 적합하다.
주 : 플라스미드 수율이 문제가 될 수 있지만, 대안 적으로, LB는 박테리아 성장을 사용할 수있다. - 제조업체의 지시에 따라 맥시 프렙 키트를 사용하여 DNA를 정제.
- 서열이 올바른지 여부를 확인하는 단계 3.3-3.4를 수행합니다. 어떤 재조합이 발생하면, 다음과 같은 메모를 참조하십시오. 그렇지 않으면, 4 단계로 이동
참고 : 여기에 한 가지 문제는 플라스미드에 삽입 게이트의 여러 사본이 DNA 복구로 인해 재결합 수 있다는 것이다. 이 문제를 해결하기 위해, E. 사용 이러한 JM109 또는 DH5α로 RECA 단백질 (DNA 복구에 관련된 단백질)이 부족 대장균 균주 (모든 시퀀스 오류와 재결합하지 않고, IE) 이전에 순서 검증 된 플라스미드를 변환한다. 그런 다음이 플레이트에서 콜로니 하나를 선택 및 DNA 시퀀싱 회사에 샘플을 전송하여 플라스미드 서열을 확인.
4. 효소 처리
주 :이 항목은 절단하고 정확한 위치에 칼자국 동력학 및 실험에 사용될 준비가되도록 상기 플라스미드를 분해하는 과정을 설명하기로한다.
- 37 ° C (표 7 참조)에서 1 시간 동안 제한 효소 PvuII-HF와 단계 3.7로부터의 정제 된 플라스미드 DNA를 소화. 일반적으로 플라스미드의 1 mg의 당 PvuII-HF의 4 대와 플라스미드를 소화. 높은 버팀대그들은 극적으로 불특정 상처를 줄일 수 있기 때문에 elity 제한 효소 사용을 권장합니다.
- 샘플에 에탄올 침전을 수행합니다.
- 샘플 얼음처럼 차가운 무수 에탄올의 2 동등한 볼륨을 추가합니다.
- 적어도 1 시간 (이 혼합물은 또한 O / N -80 ° C에서 앉을 수) -80 ℃에서 혼합물을 품어.
- 30 분 동안 0 ℃에서 10,000-14,000 XG에 원심 분리기.
- 상층 액을 제거합니다.
- 샘플 RT 95 % 에탄올 1,000 μl를 추가하고, 10 ~ 15 번 반전.
- 10 분 동안 4 ℃에서 10,000-14,000 XG에 원심 분리기.
- 10 ~ 20 분 동안 벤치에 뜨는 공기 건조를 제거합니다.
- 뉴 클레아 무료 H 2 O (일반적으로 100 ~ 200 μL)의 적절한 볼륨 DNA 펠렛을 재현 탁. 200 개 이상의 μl를 추가하면 일반적으로 샘플이 너무 동력학 실험에 사용하기 위해 희석 할 것입니다.
- m 다음 분광 광도계를 사용하여 재현 탁 DNA를 측정anufacturer의 지시.
- 다이제스트 (표 8 참조) 플라스미드의 1 μg의 당 효소의 4 단위를 사용하여 1 시간 동안 65 ℃에서 효소 Nb.BsrDI을 새김으로 게이트에 가입; 플라스미드의 1 μg의 당 효소의 8 대를 사용하여 1 시간 동안 55 ° C에서 효소 Nt.BstNBI을 새김으로 포크 게이트 다이제스트 (표 9 참조).
참고 : 단계 4.2 효소 소화 버퍼를 제거하고 반응 속도 실험에 문을 집중하는 데 도움이됩니다. 제한 효소 PvuII-HF와 새김 효소가 동일한 소화 버퍼를 공유 Nb.BsrDI 때문에 문을 조인 단계 4.2 건너 뛸 수 있습니다. EDTA가 가의 양이온 대 킬레이트 제이며 작동이 이온 필요 제한 효소를 억제 할 수 있기 때문에 단계 4.2.8에서 클레아 무료 H 2 O TE 대신 사용된다.
참고 : 효소를 초과하는 금액의 추가 가능성이 가장 높은 오버 소화 (46)에 의해 발생 초기 회로 누설 (그림 4), 많은 양의가 발생할 수 있습니다. 이 문제 캘리포니아N 효소 양을 최적화함으로써 해결 (도 4 참조). 효소의 일반적인 범위는 1 ~ 10 단위 / 1 μg의 플라스미드에서입니다.
단일 가닥 올리고 뉴클레오티드 5. 준비
참고 :이 부분은 재 부유 및 신호 가닥 및 보조 가닥에 사용되는 화학적로 합성 단일 가닥 DNA (ssDNA를)를 정량을위한 프로토콜을 설명합니다. 가닥 서열은 표 10 참조. 이하 프로토콜은 10 μM의 ssDNA를 제조의 일례이다. ssDNA를 다른 농도는 유사하게 제조 할 수있다.
- DNA 제조로부터 올리고를 수신 한 후, 건조하여 모든 DNA가 튜브의 바닥에있을 것을 보장하기 위해 1 분 동안 10,000-14,000 XG에서 DNA를 함유하는 튜브를 스핀.
- 100 μM의 최종 농도를 달성하기 위해 : (10 mM 트리스과 1mM의 EDTA, pH가 8.0 TE 버퍼) 1X 트리스 에틸렌 디아민 테트라 아세트산 (EDTA) 완충액을 사용하여 DNA를 재현 탁. 에 대한예를 들면, TE 완충액 80 μL에 8 nmol의 DNA를 재현 탁.
- 10 μM의 최종 농도를 달성한다 microcentrifuge 관 분자 물 90 μL, 100 μM에서 DNA의 10 μL를 혼합한다.
- 제조업체의 지시에 따라, 분광 광도계를 사용하여 DNA 샘플의 정확한 농도를 측정한다. 다음 프로토콜은 DNA 농도를 측정 할 수있는 방법의 예를 제공한다.
- 물 분자의 2 μL와 분광 광도계 빈.
- DNA 샘플의 260 nm의 (260)에서의 흡광도를 측정한다. 스톡 농도를 계산하기 위해 다음 식을 사용한다.
주의 : 샘플 농도가 260 M / 흡광 계수 =이다. 흡광 계수는 DNA의 제조업체 사양 데이터 시트에서 확인할 수 있습니다.
형광 기자 6. 준비
참고 :이 부분은 설명리포터 C 제조용 프로토콜은 다른 형광 리포터는 유사하게 조립 될 수있다.
- 고성능 액체 크로마토 그래피 (HPLC)로 정제 된 올리고 뉴클레오티드 주문 ROX- (리포터 C의 위쪽 가닥) 및 -rq DNA 제조업체 (리포터 C의 바닥 가닥) (서열 표 10 참조 ).
- 및 합성 올리고 뉴클레오티드, 재현 탁을받은 후하는 등 5 단계에서 설명한 샘플을 정량.
- 12.5 밀리미터 마그네슘과 리포터 상단과 1X 트리스 - 아세테이트 - EDTA (TAE)의 바닥 가닥 (즉, ROX- 와 -rq) 혼합 2+ (자세한 조리법에 대한 표 11 참조 ). 여기에 30 %를 초과 끄는 표지 가닥 -rq 모든 형광 표지 가닥도 불완전한 화학 양론으로 급냉되는 것을 보장 기자를 조립하기 위해 추가합니다.
- 1 ℃ / 분의 속도로 20 ° C로 95 ° C에서 냉각, 열 사이 클러를 사용하여 리포터 C 복합체 어닐링. 샘플은 4 ° C에 저장할 수 있습니다.
7. 형광 측정
주 : 절 형광 동력학 측정 (실험 절차도 5 참조)에 대한 일반적인 프로토콜을 설명하고,이 프로토콜은 단계 (8, 9)에 사용되며, (10)은이 프로토콜 spectrofluorimeter의 사용되어 있습니다. 감도, 웰 - 투 - 웰 변형 및 장기 실험에서 온도 제어의 부족 문제가 될 수 있지만, 대안 적으로, 이들 실험은 또한 플레이트 판독기에서 수행 될 수있다.
- 25 ° C의 온도 컨트롤러를 설정하고 온도가 안정 될 때까지 기다립니다. 온도 제어기를 사용하면 온도 변화에 기인 할 수있는 신호의 변동을 감소시킬 수있다.
- FO 설정 적절한 매개 변수spectrofluorimeter의 데이터 수집 소프트웨어 R 동력학 측정. 다음과 같이 자세한 예를 들어 설정은 다음과 같습니다
- 모두 여기 및 방출 단색화에 대한 2.73 nm의 슬릿 폭을 설정합니다.
- 매 60 초 시간 지점을 10 초에 통합 시간을 설정합니다. 24 시간에 총 측정 시간을 설정합니다.
- 실험에 사용 된 형광 물질과 일치하도록 여기 / 방출 파장을 설정한다. ROX (588 ㎚ / 608 ㎚), 및 TAMRA (559 나노 미터 / 583 nm의) : 예를 들어 다음과 같이 파장이다.
- 뉴 클레아 무료 H 2 O 및 합성 석영 셀에 125 밀리미터의 Mg 2+ (10 배 TAE / mg의 2+)를 포함 10 배 트리스 - 아세테이트 - EDTA 버퍼를 추가합니다. 예 볼륨 사용할 테이블 12, 13 및 14 참조.
- ~ 1 ㎛ (표 12, 13, 및 볼륨 14)의 최종 농도를 달성하기 위해 polyT 가닥을 추가하고 합성 와동10 ~ 15 초 동안 석영 세포. 일반적으로, 피펫 팁은 비특이적 DNA를 결합합니다. polyT 가닥의 고농도 첨가하면이 비 - 특이 적 결합 오류를 줄일 수있다.
- 기자 및 보조 가닥을 추가합니다. 사용 예 볼륨 표 12, 13, 14을 참조하십시오. 기자 교정, 더 보조 가닥이 필요하지 않습니다 있습니다.
- SDS 0.15 %의 최종 농도를 달성하기 위해 10 % 황산 도데 실 나트륨 (SDS)을 추가한다. 주 : SDS 효소는 나선 치환 반응 (도 6 참조)을 방해 할 수 있기 때문에 플라스미드 유래 게이트로부터 효소를 해리하기 위해 사용된다. SDS는 해리에 악영향 회로 기능에 영향을 미칠 수있는 게이트 가닥의 잘못된 재결합을 방지하기 위해 대신 효소의 열 변성 여기에 좋습니다.
- [기자 교정에 대해이 단계를 건너 뛰십시오.]
- 가입 추가 포크 게이트 (표 13 참조 및 볼륨 14)합성 석영 셀에 적어도 20 회 (SDS와 소용돌이로 교반 솔루션은 형광 반응 속도 측정에 영향을 미칠 것입니다 거품을 초래할 수 있기 때문에 큐벳 와동하지 않음)에 대해 그것을 피펫 팅에 의해 아래로 솔루션을 섞는다.
- 누설 반응 합성 석영 셀에 가입 포크 게이트의 첨가 직후에 개시 있기 때문에, 가능한 한 빨리 측정은 다음 단계로 이동한다.
- spectrofluorimeter의 챔버로 합성 석영 세포를 놓습니다.
- 반응 속도 측정을 시작합니다.
- 측정 5 분 후, 합성 석영 셀에 입력 가닥 (볼륨의 표 12, 13 및 14 참조)를 첨가하고, 적어도 20 시간 정도 올려 피펫 팅 내려 반응을 섞는다. 샘플이 거품을 피하기 위해 부드럽게 혼합해야합니다. 데이터 취득 프로그램이 외부 트리거 신호를 측정 피하기 위해 일시 정지 된 상태에서이 단계를 수행빛.
- 이 정상 상태에 도달 할 때까지 반응 속도를 기록한다. 반응 속도가 컴퓨터에 표시됩니다.
8. 보정 형광 기자
참고 :이 부분은 형광 기자의 교정 곡선을 만들기위한 프로토콜을 설명합니다. 검량선은 몰 농도 신호로 임의의 형광 단위를 변환하는 데 사용된다.
- 표 12에 요약 된 바와 같이 7 단계를 사용하여 반응물과 버퍼의 볼륨에 기술 된 프로토콜 다음 형광 기자 보정이 예를 들어, 표준 농도는 50 nM의 (1 배)입니다.; 기자는 3 배에있다; 입력은 1 배입니다. 입력 0.25 배씩, 0.5 배, 0.75에있는 경우를 들어, 600 μL로 각 반응의 최종 부피를 유지하기 위해 2 O 대응 클레아 무료 H의 볼륨을 조정합니다. 예시적인 데이터가도 7a에 도시되어있다.
- 의 검량선을신호 C의 초기 농도에 대하여 최종 형광 값의 선형 피팅에 의한 리포터 C (예 보정 곡선은도 7b에 도시되어있다). 이 검량선은 해당 신호의 임의의 농도로 형광 단위로 변환하는데 사용될 수있다.
9. 플라스미드 유래 ndsDNA 게이츠의 농도를 정량화
기능 게이트의 다른 수율 플라스미드 유래 ndsDNA 게이트 결과를 각각 독립적으로 처리 배치를하고,이 부분은 플라스미드 유래 ndsDNA 게이트의 농도를 정량화하기위한 프로토콜을 설명합니다.
- 표 13에 요약 된 바와 같이 단계 7. 시약의 볼륨에 기술 된 프로토콜 다음 플라스미드 유래 ndsDNA 게이트의 농도를 정량화 참고 :. 표 13 포크 BC 정량에 대한 예제 레시피를 설명하세요. AB 및 다른 게이트는 유사하게 수행하지만 다른 입력 가닥, 보조 가닥 기자를 사용 할 수 있습니다.
- 단계 8.2로부터 검량선을 이용하여 신호 (C)의 농도로이 실험에서 측정 된 최종 형광 값을 변환한다. 그런 다음 ndsDNA 게이트 농도를 역 계산합니다. 예를 들어,도 7b에 검량선에 기초하여 25 nM의 신호 C (0.5 배)에 해당하는 게이트의 정량 실험 최종 형광 값. 포크 BC의 콘텐츠가이 반응에 40 배 희석되기 때문에, 포크 BC 게이트 스톡 농도는 1 μM이다.
반응 A + B -> B + C 10. 속도론 측정
주 :이 항목은 형광 동력학 측정을 사용하여 공식적 화학 반응의 DNA 실현을 테스트 프로토콜을 설명한다.
- 당표 14에 요약 된 바와 같이 시약 및 버퍼의 7 단계를 사용하여 볼륨에 기술 된 프로토콜을 수행하여 양식 반응 속도 측정.
결과
기능 테스트를 위해, 생체 분자 촉매 반응 (즉, A + B -> B + C)의 DNA 구현을 만들었습니다. 플라스미드 유래 게이트들의 성능은 합성 DNA로부터 조립 게이트들과 비교 하였다. 고장난 게이트가 비가 역적으로 트랩 생성물의 양에 불균형을 일으키는 효과 촉매, 18, 19을 생성 할 수 있기 때문에 촉매 반응은 게이트 순도 좋은 시험이다. 동시에, 촉매 신호의 트리거되지 않은 방출을 초래 작은 누설 반응물 선형 불균형 에러 신호 선도, 증폭 될 것이다. 플라스미드 유래 및 합성 게이트에 대한 실험 데이터는 각각 그림 8B 및 8C에 표시됩니다. 촉매 신호 B의 양이 변화하는 동안 실험에서 신호 가닥의 농도가 고정되어있다. 신호 C는 촉매를 방해하지 않고 반응의 진행을 판독하는 데 사용되는주기. 반응은 짝수의 양보다 훨씬 적은 양의 촉매 B로 완성 접근 보낸 촉매는 데이터에서 관찰 될 수있다. SDS는 합성 시스템과 함께 행해진 실험에 부가 없었기 때문에, 반응 속도 (즉이 SDS의 첨가에 의해 영향을받을 수있다)와 비교하지 않고 분석 초점 (이하 상세한) 대신에 촉매 회전율이다.
이 반응의 촉매 회전율의 추가 분석을 수행 하였다. 회전율은 주어진 시간에 각각의 촉매 B를 위해 생성 된 양 신호 C로서 정의된다. 구체적 회전율은 B 첨가 촉매의 초기 량에 의해 누설 신호를 감산 C 나눔으로써 우리의 실험 데이터로부터 계산 하였다. 적합한 촉매 시스템은이 턴 오버 수는 시간에 따라 선형으로 증가해야하고 긴 기판은 제한되지 않기 때문에, 촉매의 양을 독립적으로. 실제 시스템에서 결함이 게이트는 고양이를 비활성화 할 수 있습니다 alysts 및 회전율 모든 가능한 기재가 생성물로 전환되는 경우에도, 최대 값에 도달한다. 최대 거래 대금은 많은 기판 (신호) 촉매 (신호 B)가 불 활성화되기 전에 변환 할 수 있습니다 나타냅니다. 여기서, 합성 시스템이 플라스미드 유래의 시스템보다 훨씬 이전의 회전율 이상적인 선형 증가 벗어나는 것이 관찰되어 바람직하지 않은 부반응 (도 8D)을 통해 촉매의 격리를 나타내는 않는다. 매출 비교에만 때문에 촉매의 높은 농도에서 낮은 농도에 대해 표시됩니다, 모든 게이트는 트리거 신호 (C)를 출시한다. 누설 회로는 비교되며, 이는 게이트 유도 된 플라스미드를 사용하여 누설 신호의 비율은 반응 10 시간 (도 8E)으로 합성 후의 그 게이트에 비해 약 8 % 이하로하는 것이 관찰된다.
세틸 / ftp_upload / 53087 / 53087fig1.jpg "/>
그림 1. (A) CRNs는 규정 프로그래밍 언어의 역할을한다. DNA 반응 네트워크는 공식 CRN의 역학을 근사화하기 위해 설계 될 수있는 예시적인 화학 명령어 (B) DNA 구현 :. + B-> B + C를. DNA 가닥은 3 '말단에 화살표가있는 선으로 그려 *는 보완을 나타냅니다. 모든 신호가 가닥 A, B (<결핵 B>, 오렌지) 및 C (, 빨간색) 중 하나 발붙일 도메인으로 구성되어있다 (<타>, 녹색) (TB, TA로 표시하고, TC) 및 (A, B 및 C로 표시된) 하나의 아이덴티티 도메인. 이분자 반응 A + B -> B + C는 두 개의 멀티 가닥 단지는 AB와 포크 BC 가입이 필요합니다, 4 보조 가닥 , , 및 B. 반응물 나선 치환 일곱 단계, 각 단계의 개시를 통해 진행발붙일 바인딩. (C) 리포터 전략의. 반응물 바닥 스트랜드 형광 (빨간 점)로 표지되고 상부 스트랜드 소광 (검은 점)에 부착 된 리포터를 사용 이어진다. 이 때문에 형광 소광과의 공동 지역화, 리포터 형광 리포터 그대로 급냉된다. 신호 (C)는 형광의 증가로 이어지는 기자의 상단 가닥을 대체 할 수 있습니다. (이 그림은 참고 문헌 29에서 수정되었습니다.) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
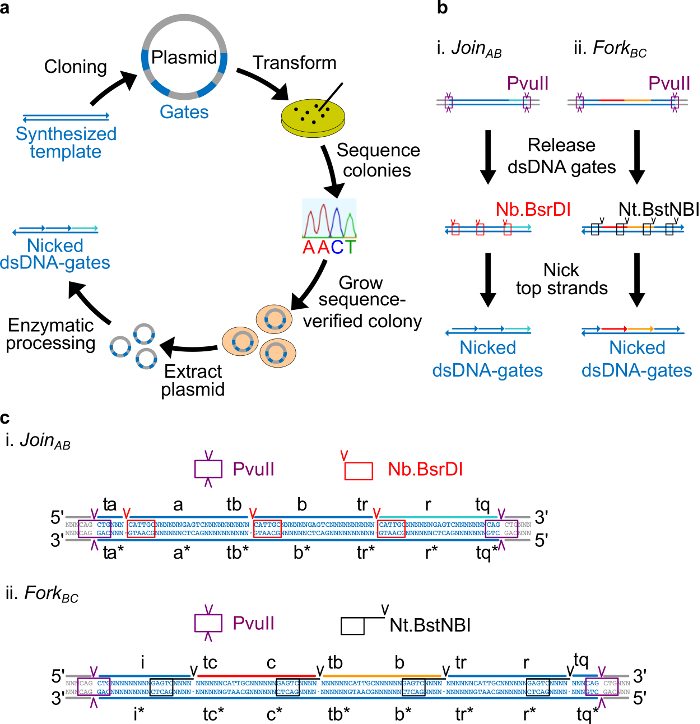
세균의 플라스미드 DNA로 만든 그림 2. (A) NdsDNA 게이트. 이중 가닥 ndsDNA 게이트 템플릿의 여러 사본 플라스미드로 복제됩니다. 복제 된 플라스미드이다N E.로 변환 대장균 세포와 접시에 식민지 순서 확인됩니다. 서열이 확인되면, 플라스미드 DNA는 증폭되고 추출된다. 마지막으로, 이중 가닥 플라스미드. 효소 처리를 통해 원하는 ndsDNA 게이트로 가공된다 ndsDNA 게이트 (B) 효소 처리. 제한 효소 PvuII는 플라스미드로부터 게이트를 분리하는데 사용된다. 출시 게이트는 더 새김 효소를 사용하여 처리됩니다 Nb.BsrDI은 AB (패널 i)를 가입에 대한 흠을 생성하는 데 사용됩니다; Nt.BstNBI 포크 BC (패널 II)에 대한 닉스를 생성하는 데 사용됩니다. 제한 및 새김 사이트를 색으로 구분 상자로 표시됩니다.의 게이트 템플릿 (C) 순서보기 AB (패널 i) 및 포크 BC (패널 II)에 가입. PvuII 제한 사이트 (보라색 상자에 강조)은 양쪽 끝입니다 ndsDNA 게이트. Nb.BsrDI 및 수 (Nt).BstNBI 새김 사이트는 각각 빨간색과 검은 색 상자에 강조 표시됩니다. 절단의 위치는 화살촉으로 표시됩니다. 순서 N은 어떤 염기이다. (이 그림은 참고 문헌 (29)의 허가를 수정되었습니다.) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
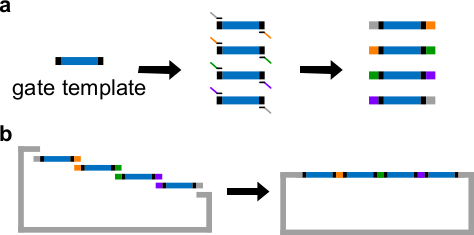
DNA 게이트 템플릿 그림 3. (A) PCR. DNA 게이트 템플릿은 양쪽 끝의 중앙에 ndsDNA 게이트 시퀀스 (파란색 영역), 및 스페이서 시퀀스 (이들 두 끝 시퀀스는 직교 검은 색 영역)가 포함되어 있습니다. 프라이머는 게이트 템플릿의 스페이서 서열에 결합합니다. (B) 깁슨 어셈블리 (중복 시퀀스를 색으로 구분 그림에) PCR을 통해 네 개의 중첩 된 DNA 절편을 생성 할 수 있습니다. 네 증폭 된 DNA fragmenTS는 그 다음 깁슨 조립 방법 (43)을 통해 선형화 플라스미드 백본 내로 조립된다. (이 그림은 참고 문헌 (29)의 허가를 수정되었습니다.) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
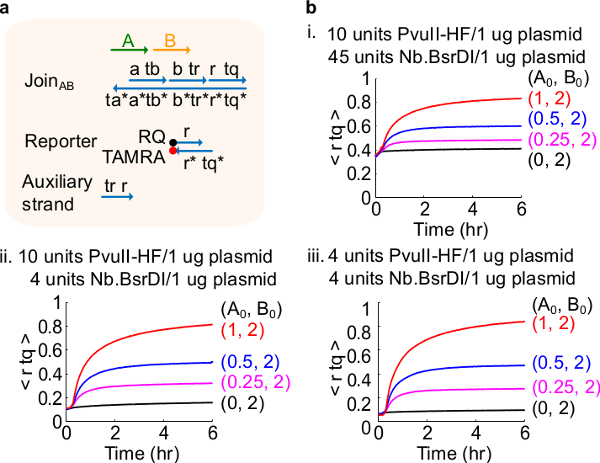
다른 효소 량으로도 4 회로 성능. (A)의 해당 실험에 사용 게이트, 리포터, 보조 가닥 및 신호 가닥의 단순화 표현. (B) 플라스미드 유래가 AB 다른 효소 량으로 처리 가입과 키네틱 실험 . 나는. PvuII-HF의 10 단위와 1 플라스미드의 μg의 당 Nb.BsrDI 45 단위; II. PvuII-HF의 10 단위와 1 μg의 당 Nb.BsrDI의 4 대 플라스미드; III. PvuII-HF의 4 대 플라스미드의 1 μg의 당 Nb.BsrDI의 4 대. 모든 보조 가닥은 2 배 (1 배 = 10 ㎚)에 있었다. 게이트 복합체는 1.5이었고, 실험 1X TAE 35 ° C / 2 + Mg를 수행 하였다. (이 그림은 참고 문헌 (29)의 허가를 수정되었습니다.) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
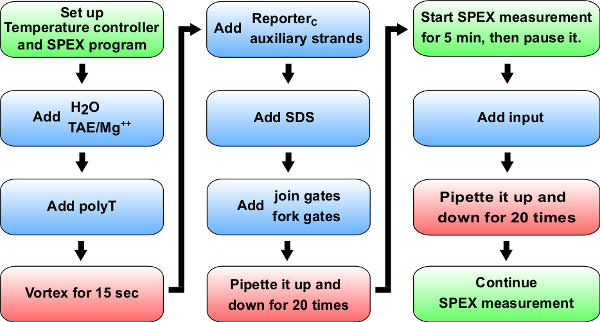
. 그림 5는 반응 속도 실험의 차트 흐름 블루 :. 재료 큐벳에 추가 할 (0.875 ml의 합성 석영 셀). > B + C - 특정 볼륨에 대한 참조 표 (14)는 A + B의 운동 실험에 추가 할 수 있습니다. 녹색 : (SPEX로 표시) spectrofluorimeter의 지침입니다. 레드 : 지시 사항을 혼합.53087fig5large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
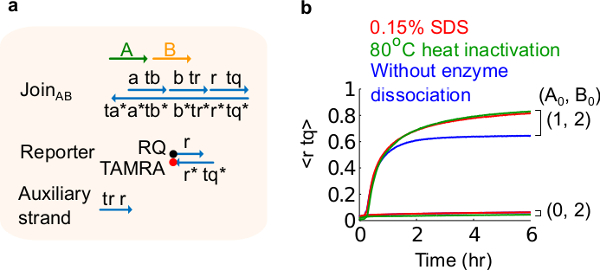
도 6 효소 분해 및 회로 동작. (A)의 해당 실험에 사용 게이트, 리포터, 보조 가닥 및 신호 가닥의 간략화 된 표현. (B) 플라스미드 유래 AB 가입하여 80 ° C의 열 동력학 실험 불 활성화 (녹색 트레이스), 0.15 % 소듐 도데 실 설페이트 (SDS) (적색), 열 불 활성화 또는 SDS (청색)의 첨가없이 제어. 표준 농도는 1X = 10 nm였다, 모든 보조 가닥 입력 B는 2 배에 있었다. 게이트 복합체는 1.5이었고, 실험은 12.5 밀리미터의 Mg 2+ 2+ (1X TAE / ㎎을 함유하는 트리스 - 아세테이트 (1X)-EDTA 완충액에서 35 ℃에서 수행 하였다 까지. (이 그림은 참고 문헌 29에서 수정되었습니다.) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
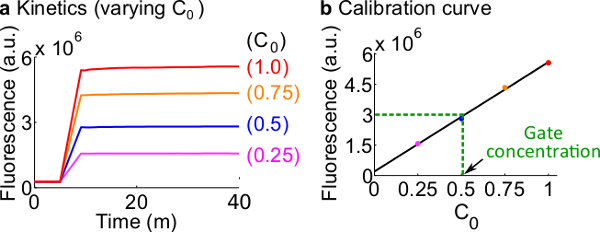
도 7 리포터 교정. (A) 기자 C 동력학. 리포터 농도 3X (1X = 50 ㎚)에서이고, 신호 C의 초기 농도는 도면에 표시된다. (B)는 측정 종료 시점 (40 분)에서의 신호 (C)의 형광 레벨을 갖는 선형 관계를 나타낸다 신호 C의 초기 농도. 포크 BC 게이트 (녹색 점선)의 정량 예에서, 포크 BC의 형광 값을 측정했다D 검량선을 기준으로 25 nm의 (0.5 배)에 해당하는 3 × 10 6 (AU)로. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
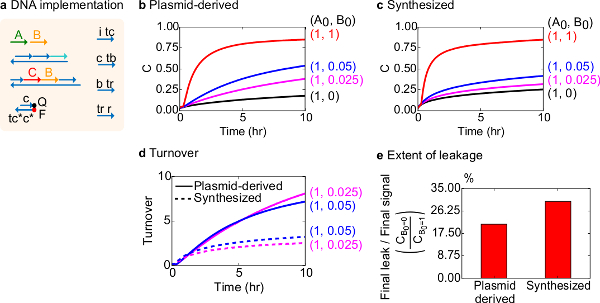
도 8. 이분자 촉매 반응 속도론 (A + B-> B + C). (A)는 대응하는 실험에 사용되는 게이트, 리포터, 보조 가닥 및 신호 가닥의 표현을 단순화. 실험은 12.5 밀리미터의 Mg 2+ (1X TAE / mg의 2+)를 포함 1X 트리스 - 아세테이트 - EDTA 버퍼에서 실행되었다. 모든 게이트 단지는 75 nM의 농도 (1.5 배)에 있었다, 및 보조 가닥 100 nM의 농도 (배)에 있었다. 합성 게이트 용 동력학 플라스미드 유래 게이트 및 데이터에 대한 데이터 (B)에 도시되어있다 (C) 을 각각. 신호는 50 nM의 (1 배)에 있었다. 의 신호 (촉매)의 상이한 양이 시스템에 도입하고, 반응은 35 ℃에서 시험 하였다. (D) 플라스미드 유래의 게이트 입력 소량 첨가 하였다 합성 DNA 게이트보다 더 높은 회전율을 나타냈다. (E) 넓이 누출. 막대 그래프는 종단점 (10 시간)에서 마지막 신호 (C B0 = 0 / C B0 = 1)에 대한 최종 누설 비율을 나타낸다. (이 그림은 참고 문헌 29에서 수정되었습니다.) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 게이트 템플릿 | 시퀀스 | 길이 (NT) |
| JoinAB | TCTAGTTCGATCAGAGCGTTATTACCAGTAGTCGATTGCTCAGCTGCTACATTGCTTCTACGAGTCATCCTTCCACCATTGCACCTTAGAGTCCGAATCCTACCATTGCTTAACCGAGTCTCACAACCAGCTGTCATTATGGACTTGACACACAGATTACACGGGAAAGTTGC | 173 |
| FORKBC | TCTAGTTCGATCAGAGCGTTATTACCAGTAGTCGATTGCTCAGCTGCCATCATAAGAGTCACCATACCCACATTGCCACATCGAGTCCCTTTTCCACCATTGCACCTTAGAGTCCGAATCCTACCATTGCTTAACCGAGTCTCACAACCAGCTGTCATTATGGACTTGACACACAGATTACACGGGAAAGTTGC | (194) |
표 1. ndsDNA 게이트 템플릿의 시퀀스.
| 문 | 바닷가 | 바닥 가닥의 길이 (NT) |
| JoinAB | JoinAB - 바닥, , , | 87 |
| ForkBC | ForkBC - 하단, , , <결핵 B>, | |
| (108) |
표 2. AB와 포크 BC 가입 포함 가닥이. (이 표는 참고 문헌 29에서 수정되었습니다.)
| 도메인 | 순서 | 길이 (NT) |
| 고마워 | CTGCTA | (6) |
| 결핵 | TTCCAC | (6) |
| TC | TACCCA | (6) |
| TR | TCCTAC | (6) |
| TQ | AACCAG | (6) |
| 에이 | CATTGCTTCTACGAGTCATCC | (21) |
| 비 | CATTGCACCTTAGAGTCCGAA | (21) |
| 기음 | CATTGCCACATCGAGTCCCTT | (21) |
| 아르 자형 | CATTGCTTAACCGAGTCTCAC | (21) |
| 나는 | CTGCCATCATAAGAGTCACCA | (21) |
| 프라이머 가닥 | 시퀀스 | 길이 (NT) |
| 앞으로 프라이머-1 | AAGAGAGACCACATGGTCCTTCTTGAGTTTGTAACAG CGTTATTACCAGTAGTCGATTGC | (60) |
| 역방향 프라이머-1 | ACTACTATTTACTAATCCCATTGCGTGTTCTTATT TAATCTGTGTGTCAAGTCCATAATG | (60) |
| 앞으로 프라이머-2 | AATAAGAACACGCAATGGGATTAGTAAATAGTAGT CGTTATTACCAGTAGTCGATTGC | (58) |
| 역방향 프라이머-2 | GCGAAACTAGCTTGTGGTGATATTGTCTCGTGTGT TAATCTGTGTGTCAAGTCCATAATG | (60) |
| 앞으로 프라이머-3 | ACACACGAGACAATATCACCACAAGCTAGTTTCGC CGTTATTACCAGTAGTCGATTGC | (58) |
| 역방향 프라이머-3 | ACATTGTACGCCTAAATCATCAAGAATAATTGTTG TAATCTGTGTGTCAAGTCCATAATG | (60) |
| 앞으로 프라이머-4 | CAACAATTATTCTTGATGATTTAGGCGTACAATGT CGTTATTACCAGTAGTCGATTGC | (58) |
| 역방향 프라이머-4 | GAGCGCAGCGAGTCAGTGAGCGAGGAAGCCTGCAG TAATCTGTGTGTCAAGTCCATAATG | (60) |
표 4. PCR ndsDNA의 게이트 템플릿 프라이머 시퀀스.
| 시약 | 1X 반응 볼륨 (μL) |
| 높은 복사 플라스미드 백본 (~ 300 NG / μL) | (10) |
| PvuII-HF (20,000 단위 / ㎖) | (2) |
| 을 PstI-HF (20,000 단위 / ㎖) | (2) |
| 10 배 컷 스마트 버퍼 | (2) |
| H 2 O | 4 |
| 총 볼륨 | (20) D> |
표 5. 플라스미드 백본 다이제스트 프로토콜.
| 시약 | 1X 반응 볼륨 (μL) |
| DNA 벡터 (~ 50 NG / μL) | 1 |
| 이 PCR 단편을 증폭 -1- (~ 50 NG / μL) | 1 |
| PCR은 단편-2를 증폭 (~ 50 NG / μL) | 1 |
| 이 PCR 단편을 증폭 -3- (~ 50 NG / μL) | 1 |
| 이 PCR 단편을 증폭 -4- (~ 50 NG / μL) | 1 |
| 배 깁슨 조립 마스터 믹스 | (5) |
| 총 볼륨 | (10) |
| 시약 | 1X 반응 볼륨 (μL) |
| 플라스미드 DNA (~ 1 μg의 / μL 농도) | 1,000 |
| PvuII-HF (20,000 단위 / ㎖) | (200) |
| 10 배 컷 스마트 버퍼 | 133.3 |
| 총 볼륨 | 1333.3 |
표 7. 프로토콜 플라스미드를 제한 효소 PvuII-HF 다이제스트 삽입 ndsDNA 게이트합니다.
| 시약 | 볼륨 (μL) |
| 가입 게이트 (~ 5 μg의 / μL 농도) | (150) |
| Nb.BsrDI (10,000 단위 / ㎖) | (300) |
| 10 배 컷 스마트 버퍼 | (50) |
| 총 볼륨 | (500) |
표 8. 문이 효소 Nb.BsrDI을 새김으로 소화 가입을위한 프로토콜.
| 시약 | 볼륨 (μL) |
| 포크 게이트 (~ 5 μg의 / μL 농도) | (150) |
| Nt.BstNBI (10,000 단위 / ㎖) | (600) |
| 10 배 NEB 버퍼 3.1 | 83.3 |
| 총 볼륨 | 833.3 |
표 9 프로토콜 포크 게이트 효소 Nt.BstNBI을 새김으로 소화합니다.
| 바닷가 | 도메인 | 순서 | 길이 (NT) |
| JoinAB-바닥 | TQ * R의 * 그럴 * B 형 * 결핵 * * 타 * | CTGGTT GTGAGACTCGGTTAAGCAATG GTAGGA TTCGGACTCTAAGGTGCAATG GTGGAA GGATGACTCGTAGAAGCAATG TAGCAG | 87 |
| FORKBC-바닥 | TQ * R의 * 그럴 * ㄴ * 결핵 * C의 *의 기술위원회 * 난 * | CTGGTT GTGAGACTCGGTTAAGCAATG GTAGGA TTCGGACTCTAAGGTGCAATG GTGGAA AAGGGACTCGATGTGGCAATG TGGGTA TGGTGACTCTTATGATGGCAG | (108) |
| <타> | CTGCTA CATTGCTTCTACGAGTCATCC | (27) | |
| <결핵 B> | 따 | TTCCAC CATTGCACCTTAGAGTCCGAA | (27) |
| 결핵 B | TACCCA CATTGCCACATCGAGTCCCTT | (27) | |
| TC의 C | CATTGCTTCTACGAGTCATCC TTCCAC | (27) | |
| TB | CATTGCACCTTAGAGTCCGAA TCCTAC | (27) | |
| B의 TR | CATTGCTTAACCGAGTCTCAC AACCAG | (27) | |
| R의 TQ | CTGCCATCATAAGAGTCACCA | (21) | |
| 나는 | TCCTAC CATTGCTTAACCGAGTCTCAC | (27) | |
| 그럴 R | CTGCCATCATAAGAGTCACCA TACCCA | (27) | |
| 내가 TC | CATTGCCACATCGAGTCCCTT TCCTAC | (27) | |
| C의 TR | CATTGCCACATCGAGTCCCTT TTCCAC | (27) | |
| C 결핵 | CATTGCACCTTAGAGTCCGAA TCCTAC | (27) | |
| <내가 TB> | B의 TR | CTGCCATCATAAGAGTCACCA TTCCAC | (27) |
| 내가 TB | CATTGCACCTTAGAGTCCGAA TTCCAC | (27) | |
| B 결핵 | CATTGCACCTTAGAGTCCGAA TACCCA | (27) | |
| B의 TC | CATTGCCACATCGAGTCCCTT TCCTAC | (27) | |
| C의 TR | CATTGCACCTTAGAGTCCGAA TCCTAC | (27) | |
| ROX- | B의 TR | / 56 ROXN / AAGGGACTCGATGTGGCAATG TGGGTA | (27) |
| -rq | C * TC * | CATTGCCACATCGAGTCCCTT / 3IAbRQSp / | (21) |
| - TAMRA | C | CTGGTT GTGAGACTCGGTTAAGCAATG / 36 TAMTSp / | (27) |
| RQ- | TQ의 * 연구 * | / 5IAbRQ / CATTGCTTAACCGAGTCTCAC | (21) |
| 아르 자형 |
. 표 10 가닥 서열을 화학 반응을 실행하기위한 B + -.> B + C (.이 테이블은 참조 번호 29에서 수정 된)
| 시약 | 볼륨 (μL) | 최종 농도 |
| 100 μM에서 ROX- | (10) | 10 μm의 (1X) |
| -rq 100 μ에서;엠 | (13) | 13 μM (1.3 배) |
| 10 배 TAE와 125 밀리미터의 Mg 2+ | (10) | 1X TAE와 12.5 밀리미터의 Mg 2+ |
| H 2 O | 67 | - |
| 총 볼륨 | (100) | 10 μm의 (1X) |
리포터 C를 조립 표 11. 프로토콜.
| 시약 | 볼륨 (μL) | 최종 농도 |
| H 2 O | (514) | - |
| 10 배 TAE와 125 밀리미터의 Mg 2+ | (60) | 1X TAE와 12.5 밀리미터의 Mg 2+ |
| 300 μ에서 PolyT;엠 | (2) | 1 μm의 |
| 10 μm의에서 리포터 C | 9 | 150㎚의 (3X) |
| 10 % SDS | 9 | 0.15 % |
| 5 μm의에서 | (6) | 50 nM의 (1X) |
| 총 볼륨 | (600) | - |
리포터 C의 보정 테이블 (12). 프로토콜. 여기에 제공된 부피는 600 μL (0.875 mL의 합성 석영 셀의 이용에 상당)의 총 반응 부피에 대한, 그러나 다른 크기의 전지로 작동하도록 조절 될 수있다.
| 시약 | 볼륨 (μL) | 최종 사기꾼자기 중심 |
| H 2 O | 493 | - |
| 10 배 TAE와 125 밀리미터의 Mg 2+ | (60) | 1X TAE와 12.5 밀리미터의 Mg 2+ |
| 300 μM에서 polyT | (2) | 1 μm의 |
| 10 μm의에서 리포터 C | 9 | 150㎚의 (3X) |
| 100 μM에서 <나는 TC> | 3 | 10 배 |
| 100 μm의에서 | 3 | 10 배 |
| 100 μM에서 | 3 | 10 배 |
| 10 % SDS | 9 | 0.15 % |
| ~ 1 μm의 포크 BC (농도 알 수 없음) | (15) | ~ 0.5 배 |
| 100 μm의에서 | 3 | 10 배 |
| 총 볼륨 | (600) | - |
표 13. 포크 BC의 교정을위한 프로토콜. 여기에 제공된 부피는 600 ㎕의 총 반응 부피에 대한, 그러나 다른 크기의 전지로 작동하도록 조절 될 수있다.
| 시약 | 볼륨 (μL) | 최종 농도 | |
| H 2 O | 407.2 | - | |
| 10 배 TAE와 125 밀리미터의 Mg 2+ | 52.8 | 12.5 밀리미터의 Mg 2+ | |
| 300 μM에서 polyT | (2) | 1 μm의 | |
| 10 μm의에서 리포터 C | 9 | 150㎚의 (3X) | |
| 10 μm의에서 <나는 TC> | (6) | 100 nm의 (2 배) | |
| 10 μm의에서 | (6) | 100 nm의 (2 배) | |
| 10 μm의에서 | (6) | 100 nm의 (2 배) | |
| (6) | 100 nm의 (2 배) | ||
| 10 % SDS | 9 | 0.15 % | |
| 1 μM에서 AB 가입 | (45) | 75 nM의 (1.5 배) | |
| 1 μm의 포크 BC | (45) | 75 nM의 (1.5 배) | |
| <타> 10 μm의 | 3 | 50 nM의 (1X) | |
| 10 μm의에서 <결핵 B> | 3 | 50 nM의 (1X) | |
| 총 볼륨 | (600) | - | |
화학 반응 A + B-> B + C 표 14 프로토콜. 여기에 제공된 부피는 600 ㎕의 총 반응 부피에 대한, 그러나 다른 크기의 전지로 작동하도록 조절 될 수있다.
| 합성 게이트 | 플라스미드 유래 게이트 | ||||
| 기술 | 비용 | 게이트 가입 | 포크 게이트 | ||
| PAGE 정제 긴 가닥 (100 NT는, 게이트의 바닥 가닥을 역임) | ~ $ 75 | 설명 <> / STRONG | 비용 | 기술 | 비용 |
| PAGE 정제 짧은 가닥 (~ 30 NT, 게이트 맨 가닥을 역임) | ~ $ 185 | 게이트 템플릿 | ~ $ 100 | 게이트 템플릿 | ~ $ 100 |
| 합계 | ~ $ 260 | 플라스미드 추출 키트 | ~ $ 26 | 플라스미드 추출 키트 | ~ $ 26 |
| 제한 효소 (PvuII-HF) | ~ $ 11 | 제한 효소 (PvuII-HF) | ~ $ 11 | ||
| 효소를 새김 (Nt.BsrDI는 게이트에 참여하기) | ~ $ 29 | 칼자국을내는 효소 (Nt.BstNBI, 포크 게이트) | ~ $ 62 | ||
| 합계 | ~ $ 166 | 합계 | ~ $ 199 |
:.. 유지-으로-previous.within 페이지 = "항상"> 플라스미드 유래 게이트 및 합성 게이트 사이의 표 15 비용 비교 (.이 표는 참고 29에서 수정되었습니다)
| 합성 게이트 | 플라스미드 유래 게이트 | ||
| 처리 | 처리 시간 | 처리 | 처리 시간 |
| 가열 냉각 | 1 시간 | 복제 | 5 시간 |
| 페이지 정화 | 2 시간 | 플라스미드 추출 | 2 시간 |
| 합계 | 3 시간 | 효소 소화의 두 단계 | 0.5 시간 |
| 에탄올 침전 | 1 시간 | ||
| 합계 | 8.5 시간 | ||
플라스미드 유래 게이트 및 합성 게이트 사이의 표 16. 처리 시간 비교. (이 표는 참고 문헌 29에서 수정되었습니다.)
토론
이 논문은 고순도의 플라스미드 DNA에서 ndsDNA 게이트를 유도하는 방법을 설명합니다. 또한, 프로토콜은 형광 동력학 분석을 이용하여 게이트의 성능을 특징으로 제시된다. 실험 데이터는 합성 시스템은 폴리 아크릴 아미드 겔 전기 영동 (PAGE)을 이용하여 정제 가닥 조립 되더라도 플라스미드 유래 된 시스템의 성능을 능가 합성 대응을 보여준다. 가능성, 플라스미드 유래 게이트의 향상된 성능은 생물학적 DNA의 매우 높은 순도에 주로 기인한다. 합성 DNA는 일반적으로 완전히 PAGE 또는 고성능 액체 크로마토 그래피 (HPLC) 정제 과정에서 제거되지 않은 길이 n-1, 및 부 생성물의 발생, 특히 올리고 뉴클레오티드의 결실 다양한 오류를 포함한다. 여기에보고 된 것과 유사한 개선은 또한 생물학적 소스 (21)로부터 유래 된 DNA를 사용하는 촉매 헤어핀 증폭기의 이전 연구에서 관찰되었다.
그러나, 플라스미드 유래의 게이트에도 사용이 완전히 적어도 두 가지 이유가있는 게이트 성능 오차 제거 할 수 너무 많은와 게이트에 이어질 수있는 제 오버 분해 또는 절단 정밀도 부족 잘못된 위치에 흠이나 흠. 두 경우 모두, 게이트는 바람직하지 않은 반응에 참여할 가능성이 높습니다. 이러한 문제점은 사용 된 효소의 양 (도 4 참조)의 최적화에 의해 완화 될 수있다. 둘째,이 실험에서 대부분의 입력과 보조 가닥 합성 DNA이었다 따라서 삭제 및 돌연변이가 포함되어 있습니다. 원칙적으로, 모든 단일 가닥 및 보조 입력 스트랜드는 또한 사전 부호화 M13 바이러스 게놈 (26)의 칼자국을내는 효소 절단을 통해 파지 미드 DNA로부터 수득 될 수있다. 아마도 회로 성능은 또한 세균 유래의 게놈을 ssDNA를 사용하여 향상시킬 수있다.
플라스미드 유래 게이트의 사용은 회로 성능을 개선하는 것으로 확인되었지만, 분석비용과 처리 시간의 플라스미드 유래 게이트의 생산이 다소 저렴 (표 15)이지만, 상업적으로 합성 올리고 (표 16)에서 조립 및 게이트의 정화에 비해 처리 시간이 2 ~ 3 배 더 오래 걸립니다 것으로 나타났다. 플라스미드 유래 게이트의 기본 비용 유전자 합성 및 제한 효소의 사용이다. (30 nm에서 15 반응에 대한 충분한) 게이트의 300 pmole의 경우, 게이트에 참여하기위한 예상 비용 때문에 다른 새김 효소의 사용으로 약 $ 170, 포크 게이트되는 비용 차이에 대한 $ 200. 대조적으로, PAGE 정제 비용을 포함해서 약 $ 260 같은 게이트 비용 가닥의 화학적 합성. 플라스미드 유래 게이트 용 기본 시간 비용은 DNA 합성과 마찬가지로 합성 유전자 회사에 아웃소싱 될 수 있고, 클로닝 절차이다. 그러나, 한번 조립 플라스미드 유래의 게이트는 숙주 플라스미드 쉽게 복제 될 수있는 이점을 가지고ND 세균성 글리세롤 주식의 형태로 저장 될 수있다. 이로써 위에 게이트 여러 번 재사용 할 수있다.
기대, 플라스미드 유래 게이트의 향상된 성능을 실험적으로 지금까지 DNA CRNs으로 입증 된 것보다 다이나믹 행동의 훨씬 더 큰 범위를 가능하게 할 수있다. 예를 들어, 최근의 이론적 워크 47, 48은 매크로 스케일에서 자기 조직화 공간 패턴이 반응 확산 장치를 통해 DNA CRNs로 실현 될 수 있음을 제안 하였다. 여기에 제시된 방법은 자기 패터닝 재료 용 DNA 분자 기본 요소를 구성하기위한 가능한 경로를 제공한다. 도전하지만, 프로그래밍 방식으로 매크로 규모의 형태학을 개발하는 것은 생체 재료 연구에서 재생 의학에 이르기까지 다양한 분야에서 상당한 영향을 미칠 것입니다.
공개
The authors declare no competing financial interests.
감사의 말
도 1, 2, 3, 4, 6, 8, 표 2, 3, 10, 15, 16은 참조 번호 (29)에서 수정된다. 이 작품은 국립 과학 재단 (National Science Foundation)에 의해 지원되었다 (NSF-CCF 1,117,143 및 GS에 NSF-CCF 1162141을 부여). Y.-JC는 대만 정부 동호회에 의해 지원되었다. SDR은 국립 과학 재단 (National Science Foundation) 대학원 연구 활동 프로그램 (GRFP)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Phusion High-Fidelity PCR Master Mix with HF Buffer | NEB | M0531S | |
| PvuII-HF | NEB | R3151L | |
| PstI-HF | NEB | R3140S | |
| Gibson Assembly Master Mix | NEB | E2611S | |
| Terrific Broth, Modified | SIGMA-ALDRICH | T0918-250G | |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | |
| QIAGEN Hispeed Maxi-prep Kit | QIAGEN | 12662 | |
| Nb.BsrDI | NEB | R0648L | |
| Nt.BstNBI | NEB | R0607L | |
| NanoDrop 2000c | Thermo Scientific | ||
| Double-stranded Genomic Blocks | IDT | ||
| Horiba Jobin-Yvon Spex Fluorolog-3 Fluorimeter | Horiba/Jobin Yvon | ||
| Synthetic Quartz Cells | Starna | 23-5.45-S0G-5 | |
| QIAGEN Gel Extraction Kit | QIAGEN | 28706 | |
| Plasmid Backbones | BioBrick | E0240-pSB1A2 | High copy number plasmid with Ampicillin resistance. Sequence can be found from http://parts.igem.org |
참고문헌
- Zhang, D. Y., Seelig, G. Dynamic DNA nanotechnology using strand-displacement reactions. Nat. Chem. 3, 103-113 (2011).
- Krishnan, Y., Simmel, F. C. Nucleic acid based molecular devices. Angew. Chem. Int. Ed. Engl. 50, 3124-3156 (2011).
- Zhang, D. Y., Winfree, E. Control of DNA strand displacement kinetics using toehold exchange. J. Am. Chem. Soc. 131, 17303-17314 (2009).
- Qian, L., Winfree, E., Bruck, J. Neural network computation with DNA strand displacement cascades. Nature. 475, 368-372 (2011).
- Qian, L., Winfree, E. Scaling up digital circuit computation with DNA strand displacement cascades. Science. 332, 1196-1201 (2011).
- Zadegan, R. M., Jepsen, M. D., Hildebrandt, L. L., Birkedal, V., Kjems, J. Construction of a fuzzy and boolean logic gates based on DNA. Small. 11, 1811-1817 (2015).
- Seelig, G., Soloveichik, D., Zhang, D. Y., Winfree, E. Enzyme-free nucleic acid logic circuits. Science. 314, 1585-1588 (2006).
- Zadegan, R. M., et al. Construction of a 4 zeptoliters switchable 3D DNA box origami. ACS Nano. 6, 10050-10053 (2012).
- Andersen, E. S., et al. Self-assembly of a nanoscale DNA box with a controllable lid. Nature. 459, 73-76 (2009).
- Zhang, D. Y., Hariadi, R. F., Choi, H. M., Winfree, E. Integrating DNA strand-displacement circuitry with DNA tile self-assembly. Nat. Commun. 4, (1965).
- Yurke, B., Turberfield, A. J., Mills, A. P., Simmel, F. C., Neumann, J. L. A DNA-fuelled molecular machine made of DNA. Nature. 406, 605-608 (2000).
- Green, S. J., Lubrich, D., Turberfield, A. J. DNA hairpins: fuel for autonomous DNA devices. Biophys. J. 91, 2966-2975 (2006).
- Venkataraman, S., Dirks, R. M., Rothemund, P. W., Winfree, E., Pierce, N. A. An autonomous polymerization motor powered by DNA hybridization. Nat. Nanotechnol. 2, 490-494 (2007).
- Green, S. J., Bath, J., Turberfield, A. J. Coordinated chemomechanical cycles: a mechanism for autonomous molecular motion. Phys. Rev. Lett. 101, 238101 (2008).
- Omabegho, T., Sha, R., Seeman, N. C. A bipedal DNA Brownian motor with coordinated legs. Science. 324, 67-71 (2009).
- Turberfield, A. J., et al. DNA fuel for free-running nanomachines. Phys. Rev. Lett. 90, 118102 (2003).
- Dirks, R. M., Pierce, N. A. Triggered amplification by hybridization chain reaction. Proc. Natl. Acad. Sci. U. S. A. 101, 15275-15278 (2004).
- Seelig, G., Yurke, B., Winfree, E. Catalyzed relaxation of a metastable DNA fuel. J. Am. Chem. Soc. 128, 12211-12220 (2006).
- Zhang, D. Y., Turberfield, A. J., Yurke, B., Winfree, E. Engineering entropy-driven reactions and networks catalyzed by DNA. Science. 318, 1121-1125 (2007).
- Yin, P., Choi, H. M., Calvert, C. R., Pierce, N. A. Programming biomolecular self-assembly pathways. Nature. 451, 318-322 (2008).
- Chen, X., Briggs, N., McLain, J. R., Ellington, A. D. Stacking nonenzymatic circuits for high signal gain. Proc. Natl. Acad. Sci. U. S. A. 110, 5386-5391 (2013).
- Phillips, A., Cardelli, L. A programming language for composable DNA circuits. J. R. Soc. Interface. 6, S419-S436 (2009).
- Lakin, M. R., Youssef, S., Polo, F., Emmott, S., Phillips, A. Visual DSD: a design and analysis tool for DNA strand displacement systems. Bioinformatics. 27, 3211-3213 (2011).
- Lakin, M. R., Youssef, S., Cardelli, L., Phillips, A. Abstractions for DNA circuit design. J. R. Soc. Interface. 9, 470-486 (2012).
- Zhang, D. Y., Winfree, E. Robustness and modularity properties of a non-covalent DNA catalytic reaction. Nucleic Acids Res. 38, 4182-4197 (2010).
- Ducani, C., Kaul, C., Moche, M., Shih, W. M., Hogberg, B. Enzymatic production of 'monoclonal stoichiometric' single-stranded DNA oligonucleotides. Nat. Methods. 10, 647-652 (2013).
- Lin, C., et al. In vivo cloning of artificial DNA nanostructures. Proc. Natl. Acad. Sci. U. S. A. 105, 17626-17631 (2008).
- Bhatia, D., et al. Icosahedral DNA nanocapsules by modular assembly. Angew. Chem. Int. Ed. Engl. 48, 4134-4137 (2009).
- Chen, Y. J., et al. Programmable chemical controllers made from DNA. Nat. Nanotechnol. 8, 755-762 (2013).
- Arkin, A., Ross, J. Computational functions in biochemical reaction networks. Biophys. J. 67, 560-578 (1994).
- Érdi, P., Tóth, J. . Mathematical models of chemical reactions: theory and applications of deterministic and stochastic models. , (1989).
- Magnasco, M. O. Chemical kinetics is Turing universal. Phys. Rev. Lett. 78, 1190 (1997).
- Oishi, K., Klavins, E. Biomolecular implementation of linear I/O systems. IET Syst. Biol. 5, 252-260 (2011).
- Senum, P., Riedel, M. Rate-independent constructs for chemical computation. PLoS One. 6, (2011).
- Soloveichik, D., Cook, M., Winfree, E., Bruck, J. Computation with finite stochastic chemical reaction networks. Natural Computing. 7, 615-633 (2008).
- Soloveichik, D., Seelig, G., Winfree, E. DNA as a universal substrate for chemical kinetics. Proc. Natl. Acad. Sci. U. S. A. 107, 5393-5398 (2010).
- Tyson, J. J., Chen, K. C., Novak, B. Sniffers, buzzers, toggles and blinkers: dynamics of regulatory and signaling pathways in the cell. Curr. Opin. Cell. Biol. 15, 221-231 (2003).
- Cardelli, L. Two-domain DNA strand displacement. Math. Struct. Comput. Sci. 23, 247-271 (2013).
- Angluin, D., Aspnes, J., Eisenstat, D. A simple population protocol for fast robust approximate majority. Distrib. Comput. 21, 87-102 (2008).
- Cardelli, L., Csikasz-Nagy, A. The cell cycle switch computes approximate majority. Sci. Rep. 2, 656 (2012).
- Zadeh, J. N., et al. NUPACK: Analysis and design of nucleic acid systems. J. Comput. Chem. 32, 170-173 (2011).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. , (2012).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat. Methods. 6, 343-345 (2009).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J. Vis. Exp. , e253 (2007).
- Lessard, J. C. Transformation of E. coli via electroporation. Methods Enzymol. 529, 321-327 (2013).
- Nasri, M., Thomas, D. Alteration of the specificity of PvuII restriction endonuclease. Nucleic Acids Res. 15, 7677-7687 (1987).
- Dalchau, N., Seelig, G., Phillips, A. Computational design of reaction-diffusion patterns using DNA-based chemical reaction networks. DNA Computing and Molecular Programming. , 84-99 (2014).
- Scalise, D., Schulman, R. Designing modular reaction-diffusion programs for complex pattern formation. Technology. 2, 55-66 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유