Method Article
Plazmid kökenli Uygulama Kimyasal Reaksiyon Ağları için DNA Strand Deplasman kapıları
Bu Makalede
Özet
This protocol describes a method for deriving DNA strand displacement gates from plasmids and testing them using fluorescence kinetics measurements. Gates can be modularly composed into multi-component systems to approximate the behavior of formal chemical reaction networks (CRN), demonstrating a new use for CRNs as a molecular programming language.
Özet
DNA nanotechnology requires large amounts of highly pure DNA as an engineering material. Plasmid DNA could meet this need since it is replicated with high fidelity, is readily amplified through bacterial culture and can be stored indefinitely in the form of bacterial glycerol stocks. However, the double-stranded nature of plasmid DNA has so far hindered its efficient use for construction of DNA nanostructures or devices that typically contain single-stranded or branched domains. In recent work, it was found that nicked double stranded DNA (ndsDNA) strand displacement gates could be sourced from plasmid DNA. The following is a protocol that details how these ndsDNA gates can be efficiently encoded in plasmids and can be derived from the plasmids through a small number of enzymatic processing steps. Also given is a protocol for testing ndsDNA gates using fluorescence kinetics measurements. NdsDNA gates can be used to implement arbitrary chemical reaction networks (CRNs) and thus provide a pathway towards the use of the CRN formalism as a prescriptive molecular programming language. To demonstrate this technology, a multi-step reaction cascade with catalytic kinetics is constructed. Further it is shown that plasmid-derived components perform better than identical components assembled from synthetic DNA.
Giriş
Watson-Crick baz eşleşmesi öngörülebilirliği dinamik DNA nanoteknoloji dinamik özelliklerinin 1,2 ile moleküler cihazlar tasarlamak için programlanabilir bir yolu olarak ortaya sağladı. Özellikle, DNA zinciri değiştirme - programlanabilir, rekabetçi melezleme tepki - Dinamik DNA sistemleri mühendisliği için güçlü bir mekanizma olduğunu kanıtlamıştır. Bir DNA sarmal yer değiştirme reaksiyonunda, gelen bir oligonükleotid, bir tamamlayıcı bağlama ortağı ile ilgili daha önce bağlanmış "Çıkış" strand değiştirir. Birden tür reaksiyonlar düzen ve bireysel tepki zamanlaması 3. adımları üzerinde kontrol yüksek derecede çok adımlı reaksiyon kaskadları halinde bir araya zincirleme olabilir. DNA zincir değiştirme kaskadları dijital ve analog devreler moleküler 4-7, değiştirilebilir nano 8-10, özerk moleküler motorlar 11-15 ve non-kovalent katalitik yükselticiler 13,16-21 oluşturmak için kullanılmıştır. Ayrıca, DŞerit değiştirme reaksiyonları kullanılarak NA cihazlar simüle ve bilgisayar destekli tasarım yazılımı kullanılarak 22-24 farklı uygulamalar için dizayn edilebilir.
Şu anda, kimyasal olarak sentezlenmiş DNA, DNA nanoteknoloji ana malzeme olarak işlev görür. Bununla birlikte, DNA sentezi işleminde hatalar ve elde edilen kusurlu oligonükleotitler, yanlış bir yan reaksiyonların neden olarak, dinamik bir DNA cihazların performansı sınırladığına inanılır. Örneğin, "kaçak" reaksiyonlar, hatta bir reaksiyon tetikleyici yokluğunda bir çıkış oligonükleotidin serbest bırakılması ile sonuçlanabilir. Bu etkiler ilk sızıntı bile az miktarda sonunda çağlayan 19,20 tam aktivasyonuna neden olur otokatalitik tepki kaskadları en ortada. Tersine, tepkiler genellikle bazı bileşenler bile amaçlanan giriş 7,25 varlığında tetiklemek çünkü aktivasyon beklenen seviyeye ulaşmak için başarısız. Performansını yapmak için DNA temellibiyolojik protein bazlı muadillerine karşılaştırılabilir nanoaygıtlar, böyle bir hata modları önemli ölçüde azalır gerekmektedir.
Bakteriyel plazmidler veya diğer biyolojik DNA nanoteknoloji uygulamaları için, son derece saf bir DNA nispeten ucuz kaynağı olarak hizmet edebilir. DNA'nın büyük miktarlarda bakteri de kopyalama ile üretilmiş olabilir ve canlı sistemlerin içsel düzeltme okuması özellikler elde edilen DNA saflığı sağlamak. Aslında, birçok yeni belgeler nanoteknoloji uygulamaları 21,26-28 biyolojik DNA potansiyel yarar tanıdı. Bununla birlikte, plasmid DNA, tam çift sarmal yapısı şimdiye kadar, tipik olarak çok sayıda oligonükleotitlerin oluşur ve Çift dallı ve tek dallı domeynini içeren dinamik bir DNA aygıtları yapmak için bir malzeme olarak kullanımı yasaklamıştır. Son kağıdı 29 bu konu ele alındı ve öncelikle çentikli çift iplikli DNA (ndsDNA) oluşan yeni bir DNA kapı mimarisinde tanıtmak oldud.
Önemlisi, ndsDNA kapıları sistemleri herhangi bir resmi kimyasal reaksiyon ağı (CRN) 29 tarafından belirlenen dinamikleri fark etmesi dizayn edilebilir. ndsDNA kapıları böylece salınımları ve kaos, İki sabit ve hafıza, Boole mantığı veya algoritmik davranışlar sergilemek 30-38 dinamik sistemler oluşturmak için prensipte kullanılabilir. Örneğin, Ref. 29, bir "konsensüs" protokol bir molekül uygulanması, dağıtık bilgisayar algoritması 29,39,40 bir tür mesafede üç Reaksiyon CRN gösterdi. Bu çalışma ilk olarak hızla fonksiyonel moleküler sistemleri (Şekil 1A) sentezlemek için bir "programlama dili" olarak CRN biçimcilik için yeni bir kullanım göstermiştir.
Burada, plasmid DNA ndsDNA kapıları türetmek için detaylı bir protokol verilmektedir. İlk dizi tasarım sürecinin bir yorum olduğunu. Daha sonra içeren ne kadar, sentetik oligonükleotidlerin bir açıklama aşağıdaKapı dizileri plasmidler klonlanır ve sekansı doğrulanır ve bakteri kültürü ile amplifiye edilmiştir. NdsDNA kapılar, enzimatik işlemle plazmidlerden türetilebilir kadar Daha sonra, gösterilir (bakınız Şekil 2). Son olarak, flüoresan kinetik analizleri kullanılarak kapı davranışı test etmek için bir yöntem, ana hatlarıyla verilmiştir.
Reaksiyon mekanizması
Bir örnek olarak, iletişim kuralı, katalitik kimyasal reaksiyon A + B-> B + C yöneliktir. Türleri A, B, ve C ("sinyalleri", Şekil 1B) her biri farklı bir tek sarmallı bir DNA molekülüne karşılık gelir. Bu moleküllerin dizileri tamamen bağımsızdır ve şeritler birbirleriyle doğrudan reaksiyona girmeyen. Tüm sinyaller sekansları, yani, iki farklı fonksiyonel alanları, sarmal yer değiştirme reaksiyonlarında birlikte hareket dizilerine sahiptir: 1) kısa bir toehold alanı (etiketler sarmal yer değiştirme r başlatılması için kullanılır, tb, tc) taeaction ve 2) uzun bir etki (a, b, c) sinyal kimliğini belirleyen etiketler.
Sinyal teller arasındaki etkileşimler tırtıklı çift iplikli DNA (ndsDNA) kapı kompleksleriyle ve yardımcı tek sarmallı türler (, ve AB ve Çatal BC Katıl) aracılık >). + B-> B + C formal Reaksiyon bir biçimde her bir reaksiyon aşaması, bir sonraki reaksiyon (Şekil 1B) bir toehold ortaya sarmal yer değiştirme reaksiyon aşamalarının, bir dizi yürütülür. Sinyal Cı çatal geçidine bağlıdır Bu örnekte, A ve B sinyalleri ilk solüsyonda serbest olan. Reaksiyon B ve C sonunda çözelti içinde bulunmaktadır. Daha genel olarak, bir kapı bağlı olan sinyaller solüsyonda serbest olan sinyaller etkin iken, yani, bir sarmal yer değiştirme reaksiyonu olarak katılabilir inaktiftirBir giriş. Reaksiyon süresi programı bir flüoresan raportör stratejisi (Şekil 1C) ile takip edilir. Önceki çalışmaları 29, bu reaksiyon mekanizmaları doğru stoikiometriyi yanı sıra hedef reaksiyon kinetiklerini fark sadece bu gösterilmiştir.
Protokol
1. Sıra Tasarım
Not: Sıra tasarım bakış: Bu bölümde, plazmid kaynaklı DNA kapıları tasarımı için strateji tarif edilmiştir. Kapılarının her iki ucuna yerleştirilir enzim siteleri sindirim sonra tam olarak iki iplikçikli kapılarının serbest kalmasına imkan vermek için. Nicking siteleri daha sonra enzimler son ndsDNA kapıları oluşturmak için üst iplikçikteki nickini oluşturmak gibi yerleştirilir. Son olarak, diğer diziler, bağımsız etki birbirine ortogonal olan ve ikincil yapı sergilemeyen şekilde seçilir.
- Dört nükleotid uzakta her uzun etki 3 'ucundan Nt.BstNBI nickleme sitesini yerleştirin (a, b, c, r, i). (. A, b, c, ve r etki ben herhangi bir Nb.BsrDI nicking site var olmadığını unutmayın) her uzun alanın 5 'ucundaki Nb.BsrDI nickleme sitesini yerleştirin. Şekil 2C detaylı dizisi görünümünü göstermektedir AB ve Çatal M.Ö. kapıları katılın.
- Pvull sindirim plazmidlerden kapıları serbest böylece ndsDNA kapılarının her iki ucunda PvuII kısıtlama alanı yerleştirin (bakınız Şekil 2c).
- (A) ipliklerini (DNA yapıları Nupack 41 kullanılarak tahmin edilebilir) ikincil yapılar sergilemek olmamalı, ve (b) tüm alanlarda karışma en aza indirmek için dik olmalıdır: İki ilkelerini izleyerek diğer serbest dizileri tasarlayın.
- Bir kapı şablon merkezinde ndsDNA dizileri yerleştirin. Kapı şablonu her iki ucunda 30-40 bp rastgele aralama dizileri yerleştirin, her bir boşluk, aşağıdaki Polimeraz Zincir Reaksiyonu (PCR) için benzersiz bir bağlanma yeri olarak görev yapmaktadır.
Plazmidler içine NdsDNA Gates 2. Klonlama
Not: Bu bölüm bir plazmid omurgasına kapısının 4 kopya eklemek için Gibson klonlama yöntemi açıklamaktadır.
- DNA üreticisinden çift sarmallı genomik blok olarak al ndsDNA kapı şablonları (kapı şablon dizileri gösterilirTablo 1 'de; şeritler Tablo 2'de gösterilmektedir ndsDNA kapıları oluşur; etki seviyesi dizileri), Tablo 3 de gösterilmiştir.
- Sipariş DNA aldıktan sonra, tüm kuru DNA tüpün altında olmasını sağlamak için 1 dakika için 10,000-14,000 xg'de genomik blokları içeren tüpler dönerler.
- 10 ng / ul'lik bir nihai konsantrasyona ulaşmak için DNase içermeyen su içinde kurutuldu, genomik blokları yeniden süspanse edin.
Not: Alternatif olarak, DNA 1 x Trıs etilendiamintetraasetik asit (EDTA) tampon maddesi ile yeniden süspansiyon haline getirilmiş olabilir (TE tamponu: 10 mM Tris ve 1 mM EDTA, pH 8.0). Bununla birlikte, EDTA iki değerli katyonları için bir kenetleme maddesi ve PCR inhibe edebilir. - Bir Yüksek Sadakat DNA polimeraz ile standart PCR aracılığıyla farklı örtüşme bölgelerinde (Şekil 3A bakınız) 4 kapı parçaları oluşturun. Primer sekansları, Tablo 4'te ayrıntılı olarak (bu primerlerin erime sıcaklığı 62 ° C).
- 1 ile% 2 agaroz jeli başlatOda sıcaklığında 30 dakika boyunca 40 V jel üzerinden fragmanını amplifiye (detaylı bir agaroz jel elektroforez protokol 42) ve her bir PCR tekabül eden bantlar kesilmiş. Daha sonra, üreticinin talimatlarına uygun olarak, bir jel özütleme kiti (Malzeme bakınız) kullanılarak jel dilimleri arındırmak.
- Üreticinin protokolüne uygun olarak 1 saat (Tablo 5'e bakınız), 37 ° C 'de PvuII-HF ve Pstl-HF olan yüksek kopya plazmid sayısı omurga (materyalleri bakınız) Digest. PvuII-HF ve Pstl-HF dramatik belirsiz kesim azaltmak yüksek sadakat kısıtlama enzimleri vardır.
- Doğrusallaştırılmış omurgası, bir% 1.5 agaroz jel üzerinde çalıştırıldı ve kesme (tipik olarak oda sıcaklığında, 30-40 dakika boyunca 140 V'ta jel çalıştırın). Daha sonra imalatçının talimatlarına uygun olarak jel özütleme kiti kullanılarak jel dilim DNA ekstrakte edin.
- Doğrusallaştırılmış vektörün ve saf halde, PCR fragmanları ile Gibson düzeneği 43 gerçekleştirme (Tablo 6 ve Şekil 3B, bkz ) 1 saat süre ile 50 ° C 'de.
- (100 ug / ml'lik bir konsantrasyonda) ampisilin ihtiva eden bir antibiyotik lizojeni Broth (LB) agar plaka üzerine Escherichia coli (E. coli) ve plaka içine adım 2.8 Gibson düzeneği ürün dönüşümü. Elektroporasyon veya ısı şoku yöntemiyle 44,45 ile dönüşümü gerçekleştirmek ve uygun E. kullanın coli suşu. Örneğin, E. kullanımı coli suşu ısı şoku dönüşümü için JM109 ve DH5α elektrokompetan E. kullanmak elektroporasyon coli hücreleri.
Not: kullanılan plazmid omurgası, bir ampisilin direnç kasedi içerir. Farklı bir seçim kalem kullanarak, bunun yerine Ampisilin uygun antibiyotik kullanın.
3. Bakteriyel Kültür Amplifikasyon ve Kalite Kontrol
Not: Bu bölüm kalite kontrolünden sonra DNA kapıları içeren plazmidler seri üretime ve izolasyonunu anlatmaktadır.
- Tek bir koloni seçinAşama 2.9 den Ampisilin seçici plakasından ve 3 ml Ampisilin ihtiva eden zenginleştirilmiş ortam antibiyotik kültürünü inkübe (100 ug / ml'lik bir konsantrasyonda). Daha sonraki deney adımda tekrar kullanılabilir, öyle ki koloni işaretleyin. Dinç sallayarak (200-300 rpm) ile 37 ° CO / N kültür büyütün. Tipik haliyle, 16-24 saat boyunca inkübe edilir.
- Üreticinin talimatlarına göre bir mini hazırlık kiti kullanılarak bakteriyel kültürden plazmid DNA ekstrakte edin.
- Üreticinin talimatlarını takip bir spektrofotometre kullanılarak arıtılmış, plazmid DNA ölçün. 50-1,000 ng / ul tipik verim aralığındadır.
- Bir DNA dizileme şirkete numune göndererek dizisi Çıkartılan plazmid DNA alın. Sıralayıcı primerler, yukan yaklaşık 100 nükleotid yer almalıdır ve bölgenin alt sekanslanacak olan; plasmidi için dizileme primeri (plazmid için malzeme bakınız), alttaki sekansa sahiptir: ATTACCGCCTTTGAGTGAGC.
Hayırte: sırası hatası ya da yerleştirilmiş ndsDNA kapıları rekombinasyon varsa, Aşama 2,9 plakanın farklı koloni seçin. Takip eklenen geçitlerin dizileri doğru olduğunu doğrulamak için 3.1-3.4 adımları tekrarlayın. - Dizileri doğru doğruladıktan sonra (Aşama 2,9 den) Ampisilin seçici plaka karşılık gelen koloni almak ve (100 ug / ml'lik bir konsantrasyonda) ampisilin ihtiva eden 800 ml antibiyotik Terrific Broth (TB) bir kültür inkübe edin. Sertçe çalkalandı (200-300 rpm) ile 16-24 saat boyunca 37 ° C 'de kültür büyütün. TB özellikle yüksek verim plazmid üretimi için uygundur.
Not: plazmid verimi bir sorun olabilir, ancak alternatif olarak, LB ayrıca bakteri büyümesi için kullanılan olabilir. - Üreticinin talimatlarına göre bir Maxi-prep kiti kullanılarak DNA saflaştırılır.
- Dizileri doğru olup olmadığını kontrol etmek için adım 3,3-3,4 izleyin. Herhangi bir rekombinasyon meydana geldiyse, aşağıdaki nota bakın. Aksi durumda, 4. adıma geçin
Not: Burada olası bir sorun plazmid takılı kapıları çoklu kopyaları DNA tamiri nedeniyle rekombine olmasıdır. Bu sorunu çözmek için, E. kullanın örneğin JM109 veya DH5α olarak recA protein (DNA tamiri ile ilgili bir protein) eksik E. coli suşu (herhangi bir dizi hata ve rekombinasyon olmayan örneğin,) önceden dizisi doğrulanmış plasmid dönüştürmek için. Sonra bu plakadan bir koloni almak ve bir DNA dizileme şirkete numune göndererek plazmid dizisi doğrulayın.
4. Enzimatik işleme
Not: Bu bölüm, bu kesme ve doğru konumlarda çentikli ve kinetik deneyler için kullanılmaya hazır hale gelir, öyle ki plazmid sindirerek işlemi tarif etmektedir.
- 37 ° C (Tablo 7 ye bakınız), 1 saat boyunca, kısıtlayıcı enzim PvuII-HF ile adım 3,7 saflaştırılmış plazmid DNA Digest. Tipik plazmid 1 mg başına PvuII-HF 4 birimleri ile plazmid sindiremez. Yüksek fidonlar dramatik belirsiz kesim azaltmak için elity kısıtlama enzimleri kullanılması tavsiye edilir.
- Örnek etanol çökeltme gerçekleştirin.
- Örnek buz soğukluğunda mutlak etanol 2 eşdeğer miktarlar ekleyin.
- En az 1 saat (bu karışım O / N -80 ° C'de oturabilir) -80 ° C 'de inkübe karışımı.
- 30 dakika boyunca 0 ° C'de 10,000-14,000 x g'de santrifüjleyin.
- Süpernatantı.
- Örnek RT% 95 etanol 1000 ul ekleyin ve 10-15 kez ters çevirin.
- 10 dakika boyunca 4 ° C 'de 10,000-14,000 x g'de santrifüjleyin.
- 10-20 dakika süreyle bankta süpernatant ve kuru hava çıkarın.
- Nükleazlar serbest H2O (tipik olarak 100-200 ul) uygun hacimde bir DNA pelet yeniden süspanse edin. 200'ün ul eklemek genellikle örneği de kinetik deneylerde kullanılmak üzere seyreltik yapacaktır.
- M aşağıdaki bir spektrofotometre kullanılarak yeniden süspanse DNA ölçünanufacturer talimatları.
- Digest (Tablo 8'e bakınız) plazmid 1 ug başına enzimin 4 birimlerini kullanarak 1 saat boyunca 65 ° C'de enzim Nb.BsrDI çentmeye geçitleri katılması; plazmid 1 ug başına enzimin 8 birimleri kullanarak 1 saat boyunca 55 ° C'de enzim Nt.BstNBI çentmeye çatal kapı sindirimi (bakınız Tablo 9).
Not: Adım 4.2 enzim sindirim tampon kaldırır ve kinetik deneyler için kapılarını konsantre olur. Sınırlama enzim PvuII-HF ve çentme enzimin de aynı sindirim tampon paylaşan Nb.BsrDI için kapıları birleştirme Adım 4,2 atlanabilir. EDTA, iki değerli katyonları için bir kenetleme maddesi ve çalışması için, bu iyonların gereken kısıtlama enzimleri inhibe eder, çünkü aşama 4.2.8 içinde, nükleaz içermeyen H 2 O yerine TE kullanılır.
Not: enzimlerin fazla miktarda eklenmesi muhtemelen aşırı sindirim 46 neden olduğu başlangıç devresi sızıntı (Şekil 4), yüksek miktarda yol açabilir. Bu sorun can enzim miktarları optimize tarafından ele alınması (Şekil 4). Enzimler 'in tipik aralık 1-10 birim / 1 ug plazmid arasındadır.
Tek iplikli oligonükleotid 5. hazırlanması
Not: Bu bölüm, yeniden süspansiyon haline getirilmesini ve sinyal şeritlerin ve yardımcı şeritler için kullanılacak kimyasal sentezlenmiş, tek sarmallı DNA (ssDNA) ölçülmesi için protokol açıklamaktadır. Şerit dizileri için Tablo 10'a bakınız. Aşağıdaki protokol 10 uM ssDNA'yı hazırlama örneği olduğunu unutmayın. SsDNA diğer konsantrasyonları benzer şekilde hazırlanabilir.
- DNA, üretici tarafından oligos aldıktan sonra, tüm kuru DNA tüpün altında olmasını sağlamak için 1 dakika için 10,000-14,000 xg DNA ihtiva eden tüpler dönerler.
- 100 uM'lik bir son konsantrasyon elde etmek için: (10 mM Tris, 1 mM EDTA ve pH 8,0 TE tamponu) 1 x Trıs etilendiamintetraasetik asit (EDTA) tampon kullanılarak DNA yeniden süspanse edin. İçinÖrnek, TE tamponu 80 ul DNA 8 nmol yeniden süspanse edin.
- 10 uM'lik bir son konsantrasyon elde etmek gereken bir mikrosantrifüj tüpü içinde, moleküler su 90 ul, 100 uM'de DNA 10 ul karıştırın.
- Üreticinin talimatları izleyerek bir spektrofotometre kullanılarak DNA örneği tam konsantrasyonunu ölçün. Aşağıdaki protokol DNA konsantrasyonu ölçülebilir nasıl bir örnek verir.
- Moleküler su 2 ul ile spektrofotometre boş.
- DNA örneği 260 nm (A 260) absorbans ölçülür. Hisse senedi konsantrasyonunu hesaplamak için aşağıdaki denklemi kullanın.
Not: Örnek konsantrasyonu M A 260 / sönüm katsayısı = olduğunu. Yok olma katsayısı DNA, üretici tarafından şartname veri sayfasında bulunabilir.
Floresan Muhabirleri 6. hazırlanması
Not: Bu bölümdeReporter C hazırlanması için bir protokol, diğer floresan muhabir Benzer monte edilebilir.
- Yüksek performanslı sıvı kromatografisi (HPLC) ile saflaştırılmıştır oligonükleotitleri Sipariş ROX- (Raportör C üst iplik) ve -RQ DNA, üretici ile ilgili (Raportör C alt sicim) (dizileri için Tablo 10'a bakınız ).
- Ve sentezlenmiş oligonükleotidler, tekrar süspansiyon aldıktan sonra olduğu gibi Adım 5 açıklanan örnekleri quantitate.
- 12.5 mM Mg ile muhabir üst ve 1x Tris-Asetat-EDTA (TAE) alt ipliklerini (yani, ROX- ve -RQ) karıştırın 2+ (ayrıntılı tarifi için Tablo 11'e bakınız ). Burada% 30 aşırı söndürücü etiketli şerit -RQ tüm fluoroforla işaretlenmiş şeritler daha kusurlu stokiyometri ile söndürüldü olmasını sağlar muhabir birleştirmek için, eklendiğine dikkat edin.
- 1 ° C / dk bir oranda 20 ° C'ye kadar 95 ° C soğutma, termal devir cihazı aracılığıyla Reporter Cı kompleksi tavlanması. Numuneler 4 ° C'de saklanabilir.
7. Floresan Ölçümler
Not: Bölüm floresans Kinetik ölçümleri (deneysel prosedür için bakınız Şekil 5) için genel bir protokol açıklar ve bu protokol adımlar 8, 9 kullanılacak ve 10 Ayrıca, bu protokol, bir spektroflorimetre kullanımı içindir. Hassasiyet, iyi-to-oyuk varyasyonları ve uzun süreli deneylerde sıcaklık kontrol eksikliği bir sorun olabilir, ancak alternatif olarak, bu deneyler bir levha okuyucu içinde gerçekleştirilebilir.
- 25 ° C sıcaklık kontrolörü ayarlayın ve sıcaklık stabilize etmek için bekleyin. Sıcaklık kontrolörü kullanarak sıcaklık değişimlerine neden olabilir sinyal değişkenliği azaltabilir.
- Fo ayarlayın uygun parametrelerspektroflorimetre veri toplama yazılımı r kinetik ölçümleri. Aşağıdaki gibi detaylı bir örnek ayarları şunlardır:
- Hem uyarma ve emisyon monokromatörler için 2.73 nm yarık genişliğini ayarlayın.
- Her 60 sn zaman noktası için 10 sn entegrasyon süresini ayarlayın. 24 saat toplam ölçüm saati ayarlayın.
- Deneyde kullanılan fluorophores maç uyarma / emisyon dalga boylarında ayarlayın. ROX (588 nm / 608 nm) ve TAMRA (559 nm / 583 nm) aşağıdaki gibidir: Örnek dalga boyları vardır.
- Nükleazlar serbest H2O ve bir sentetik kuvars hücre 125 mM Mg + 2 (10x TAE / Mg2 +) ihtiva eden 10x Tris-asetat-EDTA tamponu ekleyin. Örnek hacimleri kullanmak için masalar 12, 13 ve 14 Bkz.
- ~ 1 uM (bakınız Tablo 12, 13 ve hacimleri için 14) bir son konsantrasyon elde etmek için polyT ipliklerini ekleyin ve sonra sentetik girdap10-15 saniye için kuartz hücreler. Genellikle, pipet uçları non-spesifik DNA bağlayacaktır. PolyT şeritlerin yüksek konsantrasyonlarda eklenmesi, bu spesifik olmayan bağlanma hata azaltabilir.
- Gazetecilere ve yardımcı ipliklerini ekleyin. Kullanmak için, örneğin hacim için Tablo 12, 13 ve 14'e bakın. Raportör kalibrasyonu için, hiçbir yardımcı şeritler gerekli olduğunu not edin.
- % 0.15 SDS bir son konsantrasyon elde etmek için,% 10 sodyum dodesil sülfat (SDS) ekleyin. Not: SDS enzimleri iplik değiştirme reaksiyonu (bakınız Şekil 6) engel olabilir, çünkü plazmid kaynaklı kapılarından enzimleri ayırmak için kullanılır. SDS ayrışma ve olumsuz devre fonksiyonunu etkileyebilir kapı teller, yanlış rekombinasyonunu önlemek için yerine enzimler ısı denatürasyonu burada tavsiye edilir.
- [Muhabir kalibrasyonu için bu adımı atlayın.]
- Katılmak ekleyin ve çatal kapıları (Tablo 13 görmek ve hacimleri için 14)Sentetik kuvars hücreye ve en az 20 kere (SDS ile vorteksleme çözümleri floresan kinetik ölçümleri etkileyecek kabarcıklar neden olabilir, çünkü küvet vorteks yok) için o kadar pipetleme ve aşağı çözüm karıştırın.
- Kaçak reaksiyonu sentetik kuvars hücreye katılmak ve çatal kapılarının yanı sıra hemen sonra başlatır çünkü Ayrıca, en kısa sürede aşağıdaki ölçüm adımlara geçin.
- Bir spektroflorimetre bölmesine sentetik kuvars hücrelerini yerleştirin.
- Kinetik ölçümü başlatın.
- Ölçüm 5 dakika sonra, sentetik kuvarz hücre giriş şeritleri (hacim için Tablo 12, 13 ve 14'e bakınız) ekleyin ve en azından 20 kez için pipetleme aşağı reaksiyonu karıştırın. Örnek kabarcıklarını önlemek için hafifçe karıştırılmış gerektiğine dikkat edilmelidir. Veri toplama programı harici tarafından tetiklenen sinyallerin ölçüm önlemek için duraklatılmışken bu adımı gerçekleştirinIşık.
- O kararlı duruma ulaşana kadar reaksiyon kinetiği kaydedin. Reaksiyon kinetiği bilgisayarda görüntülenir.
8. Kalibre Floresan Gazeteciler
Not: Bu bölüm floresan gazetecilere kalibrasyon eğrilerini yapmak için protokol tanımlamaktadır. Kalibrasyon eğrileri molar sinyal konsantrasyonuna keyfi floresan birimleri dönüştürmek için kullanılacaktır.
- Tablo 12'de özetlendiği üzere Adım 7. Kullanım reaktanlann ve tampon hacim tanımlanan protokol ile floresan haberci kalibre Bu örnek için standart konsantrasyon 50 nM (1x) 'dir.; gazetecilere 3x altındadır; Giriş 1x olduğunu. Giriş 0.25X, 0.5x, 0.75x altındadır durumlarda, 600 ul olmak için her reaksiyonun son hacmi tutmak için 2 O buna Nükleazlar serbest H ses seviyesini ayarlamak. Bir örnek veriler, Şekil 7A'da gösterilmektedir.
- Bir kalibrasyon eğrisi yapınSinyal C'nin ilk konsantrasyonuna karşı son floresans değerlerinin doğrusal bir geçme ile Reporter C (bir örnek kalibrasyon eğrisi Şekil 7B 'de gösterilmiştir). Bu kalibrasyon eğrisi karşılık gelen sinyal konsantrasyonuna rasgele floresans birimleri dönüştürmek için kullanılabilir.
9. Plazmid kökenli ndsDNA Gates Konsantrasyon niceliğini
Fonksiyonel kapıları farklı bir verimle plazmid kaynaklı ndsDNA kapıları sonuçların her biri bağımsız işlenmiş toplu ve bu bölüm plazmid kaynaklı ndsDNA kapılarının konsantrasyonunu ölçülmesi için bir protokol tanımlamaktadır: Not.
- Tablo 13'de özetlendiği üzere Adım 7. Kullanım reaktifler hacimleri açıklanan protokol izlenerek plasmid türevli ndsDNA kapıları konsantrasyonunu ölçmek Not:. Tablo 13 Çatal BC ölçümü için bir örnek tarif tarif eder katıl. AB ve diğer kapıları benzer gerçekleştirilen ancak farklı giriş ipliklerini, yardımcı ipliklerini ve gazetecilere kullanarak yapılabilir.
- Aşama 8.2 kalibrasyon eğrisi kullanılarak sinyali C'de bir konsantrasyona Bu deneyde ölçülen son floresan değeri dönüştürün. Sonra ndsDNA kapısı konsantrasyonunu geri hesaplamak. Örneğin, Şekil 7B'de kalibrasyon eğrisine göre 25 nM sinyali C'de (0.5x) karşılık gelir kapısı miktar deney için son bir floresans değer. Çatal M.Ö. stoku bu reaksiyonda 40 defa seyreltilmiş olduğundan, Çatal M.Ö. kapısının stok konsantrasyonu 1 uM'dir.
Reaksiyon A + B-> B + C 10. Kinetik Ölçümleri
Not: Bu bölüm floresan kinetik ölçümleri kullanarak resmi bir kimyasal tepkime DNA gerçekleşmesini test etmek için bir protokol tanımlamaktadır.
- BaşınaTablo 14'de özetlendiği gibi reaktifler ve tamponların Adım 7. hacimlerinde anlatılan protokol izlenerek form kinetiği ölçümü.
Sonuçlar
Fonksiyonel bir test için bimoleküler katalitik reaksiyonu (yani A + B-> B + C) DNA uygulaması oluşturuldu. Plasmid türevli kapılarının performanslı sentetik DNA monte kapıları ile karşılaştırılmıştır. Hatalı kapısı geri dönüşümsüz tuzak ürün miktarı üzerinde orantısız bir etkiye neden bir katalizör, 18,19 üretilen çünkü Katalitik reaksiyonlar kapısı saflık için iyi bir test vardır. Aynı zamanda, katalitik sinyalin untriggered bırakılmasına neden olur küçük bir sızıntı Reaksiyon doğrusal orantısız bir hata sinyaline neden amplifiye edilecektir. Plasmid türevli ve sentezlenmiş kapıları için deneysel veriler, sırasıyla Şekil 8B ve 8C'de gösterilmiştir. Katalitik sinyal B miktarı değişmektedir ise deneylerde, sinyal iplik A konsantrasyonu sabittir. Sinyal C katalitiği kesmeden reaksiyonun ilerlemesini okumak için kullanılırdöngüsü. Reaksiyonlar, hatta A miktarı çok daha küçük bir katalizör B miktarları ile tamamlanması gelmesi nedeniyle, kataliz veri gözlemlenebilir. SDS sentezlenen sistemi ile yapılan deneyler eklenmedi beri, reaksiyon hızı (yani SDS eklenerek etkilenebilir) göre değildir ve analitik odak (aşağıda detaylı) yerine katalitik ciro olduğunu.
Bu reaksiyon katalitik devir daha fazla analizi yapılmıştır. Devir belirli bir zamanda, her katalizörün B için üretilen bir miktar sinyal C olarak tanımlanır. Spesifik olarak, devir B ilave katalizörü ilk miktarda sızıntı çıkarılır sinyali C bölünmesiyle deneysel verilerden hesaplanmıştır. İdeal bir katalitik sistem, bu devir sayısı zamanla lineer olarak artmalıdır ve sürece alt-tabaka sınırlayıcı değildir halinde katalizör miktarı bağımsız olduğu. Gerçek bir sistemde, hatalı kapıları kedi devre dışı bırakabilirsiniz katalizörler, ve ciro değil mevcut tüm substrat ürüne dönüştürülür bile maksimum değere ulaşacaktır. Maksimum ciro değeri birçok yüzeyler (sinyal A) bir katalizör (sinyal B) inaktive olma önce dönüştürebilirsiniz nasıl gösterir. Burada, bu sentezlenen sistem plazmid kaynaklı sisteme göre daha erken ciro ideal lineer artış sapma görülmektedir istenmeyen yan reaksiyonu (Şekil 8D) aracılığıyla katalizör sekestrasyonunu gösteren yok. Ciro karşılaştırması nedeniyle sadece katalizörlerin yüksek konsantrasyonlarda düşük konsantrasyonlarda için gösterilen bütün kapıları tetiklenen ve sinyal C bırakın edilecektir. Devre kaçağı da karşılaştırılır ve bu plasmid türevli kapılar ile sızıntı sinyalinin oranı, reaksiyonun 10 saat (Şekil 8E) bundan sonra kullanılarak sentez kapıları yaklaşık% 8 daha az olduğu görülmektedir.
iles / ftp_upload / 53087 / 53087fig1.jpg "/>
Şekil 1. (A) CRNs bir kuralcı programlama dili olarak hizmet vermektedir. DNA reaksiyon ağları resmi CRN dinamiklerini yaklaştığı tasarlanmış olabilir bir örnek kimyasal talimatının (B) DNA uygulaması:. A + B-> B + C. DNA ipliklerini 3 'ucunda oklarla çizgiler olarak çizilir ve * tamamlayıcılık gösterir. Tüm sinyal ipliklerini A, B (, turuncu) ve C (, kırmızı), bir toehold etki oluşmaktadır edilir (, yeşil) (tb, ta olarak etiketlenmiş ve tc) ve (a, b ve c olarak adlandırılan), bir kimlik alanı. Bimolecular reaksiyon A + B-> B + C iki çok telli kompleksleri AB ve Çatal BC katılın gerektirir ve dört yardımcı ipliklerini , ve . Reaksiyon şerit değiştirme yedi adımda, her adımda baştan ilerlertoehold bağlayıcı. (C) Raportör stratejisiyle s. Reaksiyon alt koluna kadar bir flüorofor (kırmızı nokta) ile etiketlenir ve üst iplik, bir söndürücü (siyah nokta) bağlı olduğu bir raportör kullanılarak takip edilir. Çünkü florofor ve söndürücü eş-lokalizasyonu, raportör flöresan sağlam muhabir söndürülür. Sinyal Cı floresans bir artışa yol açan, raportör üst iplikçik yerini alabilir. (Bu rakam Ref 29 modifiye edilmiştir.) Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
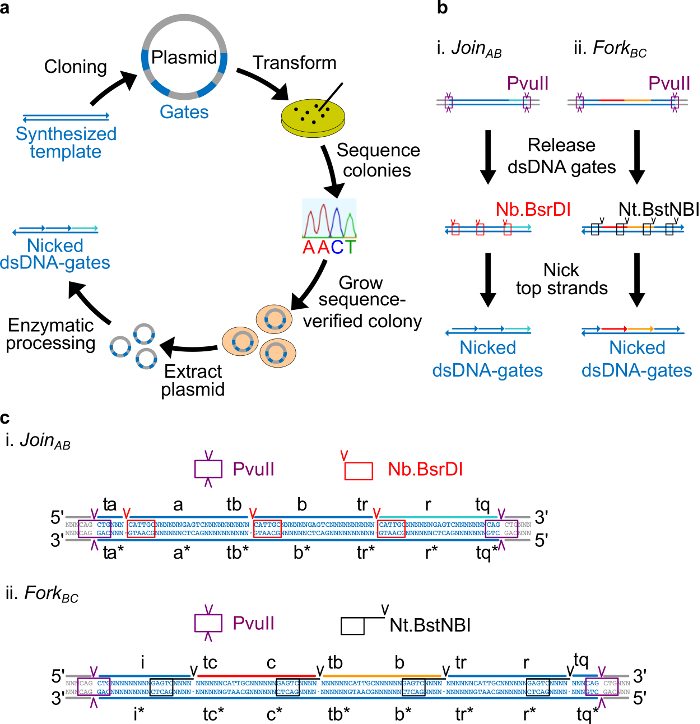
Bakteriyel bir plasmid DNA dan yapılır Şekil 2. (A) NdsDNA kapıları. Çift zincirli ndsDNA kapısı şablonunun birkaç kopyası, bir plazmid içine klonlanır. Klonlanmış plasmitlerdirn E. dönüştürülmüştür E. coli hücreleri ve plaka üzerinde koloniler sekansı doğrulanır. Dizisi onaylandıktan sonra, plazmit DNA yükseltilir ve ekstraksiyon işlemine tabi tutulmaktadır. Son olarak, iki iplikçikli plazmid. Enzimatik işleme yoluyla istenen ndsDNA kapılar içine işlenir ndsDNA kapılarının (B) Enzimatik işlem. Pvull sınır enzimi plazmidden kapı serbest bırakmak için kullanılır. Serbest kapıları daha nicking enzimleri kullanılarak işlenir: Nb.BsrDI AB (Panel i) Kayıt için nickini oluşturmak için kullanılır; Nt.BstNBI Çatal M.Ö. (Panel ii) için nickini oluşturmak için kullanılır. Kısıtlama ve nicking siteler renk kodlu kutular olarak belirtilmiştir. Kapısı şablon (C) Sıra görünümü AB (Panel i) ve Çatal BC (Panel ii) katılın. PvuII kısıtlama alanı (mor kutu içinde vurgulanan) iki ucunda olduğunu ndsDNA kapılarının. Nb.BsrDI ve Nt.BstNBI Nicking siteleri sırasıyla kırmızı ve siyah kutularda vurgulanır. Kesim yerleri ok uçları ile işaretlenir. Sıra, N'nin herhangi bir nükleotid. (Bu rakam Ref 29 izni ile modifiye edilmiştir.) Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
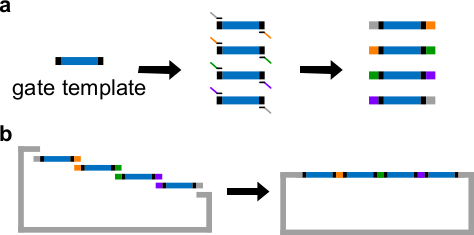
DNA kapısı şablon Şekil 3. (A) PCR. Bir DNA kapısı şablonu iki ucunda merkezinde ndsDNA kapı dizileri (mavi bölge) ve boşluk dizilerini (; bu iki uç dizileri dik siyah bölgeler) içerir. Primerler kapısı şablonun boşluk dizilerine bağlanan ve. (B) Gibson tertibatı (üst üste binen sekanslar, renk kodlu şekil olarak ifade edilmiştir) PCR ile dört örtüşen DNA fragmanlarının üretebilir. Dört yükseltilmiş DNA fragments sonra Gibson montaj yönteminin 43 ile linearize plazmid omurgası içine monte edilir. (Bu rakam Ref 29 izni ile modifiye edilmiştir.) Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
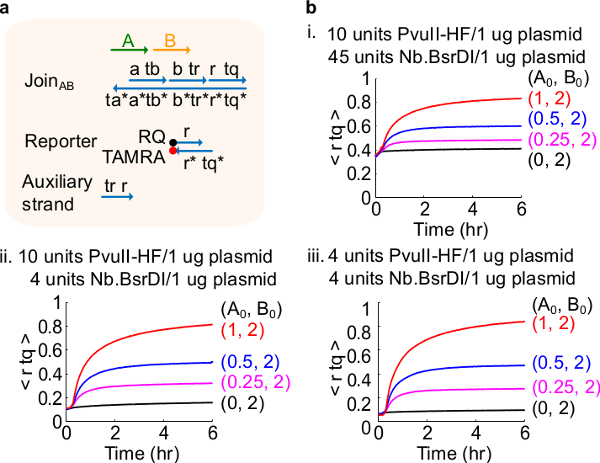
Farklı bir enzim miktarları ile Şekil 4. Devre performansı. (A) karşılık gelen deneyleri için kullanılan kapı, muhabir, yardımcı şeritler ve sinyal şeritlerin basitleştirilmiş bir gösterimidir. (B) ya plasmid türevli AB farklı bir enzim miktarları ile işleme birleşim ile kinetiği deneyleri . ben. PvuII-HF 10 adet ve 1 plazmid mikrogram başına Nb.BsrDI 45 ünite; ii. PvuII-HF 10 adet ve 1 ug başına Nb.BsrDI 4 adet plazmid; iii. PvuII-HF 4 adet plazmid 1 mcg başına Nb.BsrDI 4 adet. Tüm yardımcı ipliklerini 2x (1x = 10nM) idi. Kapı kompleksi 1.5x idi ve deneyler 1x TAE 35 ° C / Mg2 + yapıldı. (Bu rakam Ref 29 izni ile modifiye edilmiştir.) Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
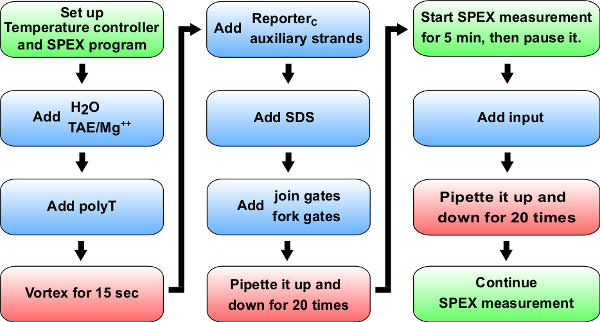
. Şekil 5 kinetik deneyler akış şeması Mavi:. Malzeme küvete eklemek için (0.875 ml sentetik kuvars hücresi). > B + C - Belirli birimler için referans Tablo 14 A + B kinetik deney için ekleyin. Yeşil: (Spex olarak işaretlenmiş) bir spektroflorimetre Talimatı. Kırmızı: talimatları Karıştırma.53087fig5large.jpg "target =" _ blank "> bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
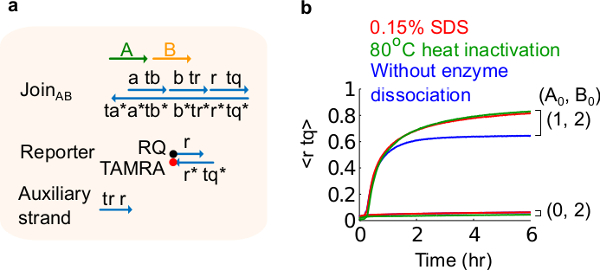
Şekil 6. Enzim ayrışma ve devre davranışı. (A) karşılık gelen deneyleri için kullanılan kapı, muhabir, yardımcı ipliklerini ve sinyal şeritlerinin basitleştirilmiş gösterimi. (B) plazmid kaynaklı AB Üyelik kullanılarak 80 ° C ısı Kinetiği deneyleri inaktivasyonu (yeşil eser miktarda),% 0.15 sodyum dodesil sülfat (SDS) (kırmızı) ve ısı inaktivasyonu veya SDS (mavi) ilave edilmeden bir kontrol. Standart konsantrasyonu 1x = 10 nM ve tüm yardımcı ipliklerini ve giriş B 2x vardı. Kapı kompleksi 1.5x idi ve deneyler 2+ 12,5 mM Mg + 2 (1x TAE / Mg içeren 1x Tris-asetat-EDTA tampon maddesi içinde 35 ° C 'de gerçekleştirildi yedekleyin. (Bu rakam Ref 29 modifiye edilmiştir.) Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
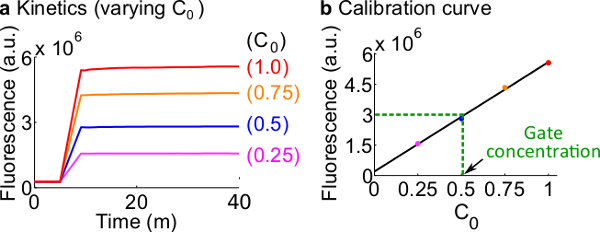
Şekil 7. Muhabir kalibrasyonu. (A) Muhabir C kinetik. Bildirici konsantrasyonu 3 x (1 x = 50 nM), ve bir sinyal C başlangıç konsantrasyonu şekilde belirtilmiştir. (B) ölçümü son noktasına (40 dakika) sinyal C floresan seviyeleri ile doğrusal bir ilişki gösterir sinyali C'de başlangıç konsantrasyonu. Çatal BC kapısı (yeşil kesikli çizgi) bir miktar örnek olarak, Çatal M.Ö. floresan değeri ölçüsü oldud kalibrasyon eğrisine dayalı 25 nM (0.5x) karşılık 3 x 10 6 (au) gibi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
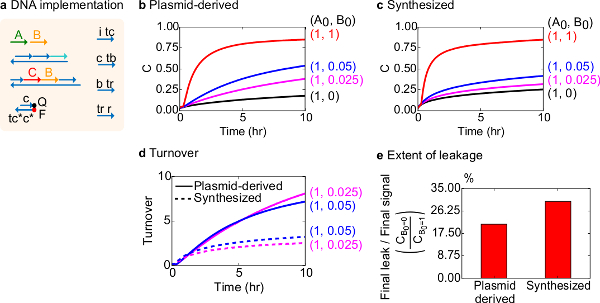
Şekil 8. Biyomoleküller katalitik reaksiyon kinetiği (A + B-> B + C). (A) karşılık gelen deneyleri için kullanılan kapısı, muhabir, yardımcı şerit ve sinyal şeritlerin temsil basitleştirilmiş. Deneyler, 12,5 mM Mg + 2 (1x TAE / Mg2 +) ihtiva eden 1x Tris-asetat-EDTA tampon maddesi içinde gerçekleştirilmiştir. Tüm kapı kompleksleri 75 nM konsantrasyonu (1.5x) idi ve yardımcı şeritler 100 nM konsantrasyonu (2x) idi. Sentezlenen kapılar kinetiği plasmid türevli kapıları ve veriler için veri (B) 'de gösterilen ve (C) , sırasıyla. Sinyal 50 nM (1x) oldu. Sinyali (katalizörü) farklı miktarlarda sisteme tanıtılan edildi ve reaksiyon, 35 ° C'de test edilmiştir. (D) Plazmid türetilmiş kapıları girişinin düşük miktarda ilave edildi sentezlenen DNA kapıları daha yüksek devir sergilemiştir. (E) kapsamı kaçak. Çubuk grafik uç noktalarına (10 saat) final sinyali (C B0 = 0 / C B0 = 1) nihai kaçak oranını göstermektedir. (Bu rakam Ref 29 modifiye edilmiştir.) Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| Kapı Şablonlar | Diziler | Uzunluk (nt) |
| JoinAB | TCTAGTTCGATCAGAGCGTTATTACCAGTAGTCGATTGCTCAGCTGCTACATTGCTTCTACGAGTCATCCTTCCACCATTGCACCTTAGAGTCCGAATCCTACCATTGCTTAACCGAGTCTCACAACCAGCTGTCATTATGGACTTGACACACAGATTACACGGGAAAGTTGC | 173 |
| FORKBC | TCTAGTTCGATCAGAGCGTTATTACCAGTAGTCGATTGCTCAGCTGCCATCATAAGAGTCACCATACCCACATTGCCACATCGAGTCCCTTTTCCACCATTGCACCTTAGAGTCCGAATCCTACCATTGCTTAACCGAGTCTCACAACCAGCTGTCATTATGGACTTGACACACAGATTACACGGGAAAGTTGC | 194 |
Tablo 1. ndsDNA kapı şablonları dizileri.
| kapı | Iplik | Alt şeridinin uzunluğu (nt) |
| JoinAB | JoinAB-Bottom, , | 87 |
| ForkBC | ForkBC-Bottom, , , | |
| 108 |
Tablo 2. AB ve Çatal BC katılın içeren Tellerinin. (Bu tablo Ref 29 modifiye edilmiştir.)
| Domain | Sekans | Uzunluk (nt) |
| ta | CTGCTA | 6 |
| tb | TTCCAC | 6 |
| tc | TACCCA | 6 |
| tr | TCCTAC | 6 |
| tq | AACCAG | 6 |
| bir | CATTGCTTCTACGAGTCATCC | 21 |
| b | CATTGCACCTTAGAGTCCGAA | 21 |
| c | CATTGCCACATCGAGTCCCTT | 21 |
| r | CATTGCTTAACCGAGTCTCAC | 21 |
| ben | CTGCCATCATAAGAGTCACCA | 21 |
| Primer iplikli | Diziler | Uzunluk (nt) |
| İleri primer-1 | AAGAGAGACCACATGGTCCTTCTTGAGTTTGTAACAG CGTTATTACCAGTAGTCGATTGC | 60 |
| Ters primer-1 | ACTACTATTTACTAATCCCATTGCGTGTTCTTATT TAATCTGTGTGTCAAGTCCATAATG | 60 |
| İleri primer-2 | AATAAGAACACGCAATGGGATTAGTAAATAGTAGT CGTTATTACCAGTAGTCGATTGC | 58 |
| Ters primer-2 | GCGAAACTAGCTTGTGGTGATATTGTCTCGTGTGT TAATCTGTGTGTCAAGTCCATAATG | 60 |
| İleri primer-3 | ACACACGAGACAATATCACCACAAGCTAGTTTCGC CGTTATTACCAGTAGTCGATTGC | 58 |
| Ters primer-3 | ACATTGTACGCCTAAATCATCAAGAATAATTGTTG TAATCTGTGTGTCAAGTCCATAATG | 60 |
| İleri primer-4 | CAACAATTATTCTTGATGATTTAGGCGTACAATGT CGTTATTACCAGTAGTCGATTGC | 58 |
| Ters primer-4 | GAGCGCAGCGAGTCAGTGAGCGAGGAAGCCTGCAG TAATCTGTGTGTCAAGTCCATAATG | 60 |
Tablo 4. PCR ndsDNA kapısı şablonları için Primer dizileri.
| Ayıraç | 1x reaksiyon için Cilt (ul) |
| Yüksek kopya plazmid omurgası (~ 300 ng / ul) | 10 |
| Pvull-HF (20.000 ünite / ml) | 2 |
| Pstl-HF (20.000 ünite / ml) | 2 |
| 10x Cut akıllı tampon | 2 |
| H2O | 4 |
| Toplam ses | 20 d> |
Tablo 5.. Plazmid omurgası sindirmek için protokol.
| Ayıraç | 1x reaksiyon için Cilt (ul) |
| DNA vektörü (~ 50 ng / | il), | 1 |
| PCR parçası-1 amplifiye (~ 50 ng / | il), | 1 |
| PCR parçası-2 amplifiye (~ 50 ng / | il), | 1 |
| PCR parçası-3 amplifiye (~ 50 ng / | il), | 1 |
| PCR parçası-4 amplifiye (~ 50 ng / | il), | 1 |
| 2x Gibson Meclisi ana Mix | 5 |
| Toplam ses | 10 |
| Ayıraç | 1x reaksiyon için Cilt (ul) |
| Plasmid DNA (~ 1 mg / ml konsantrasyon) | 1000 |
| Pvull-HF (20.000 ünite / ml) | 200 |
| 10x Cut akıllı tampon | 133.3 |
| Toplam ses | 1333,3 |
Tablo 7. Protokol plazmid Kısıtlama enzimi Pvull-HF ile sindirmek eklenen ndsDNA kapıları için.
| Ayıraç | Hacim (ul) |
| Üyelik kapıları (~ 5 mg / ml konsantrasyon) | 150 |
| Nb.BsrDI (10.000 ünite / ml) | 300 |
| 10x Cut akıllı tampon | 50 |
| Toplam ses | 500 |
Tablo 8. Kapılar enzim Nb.BsrDI nicking ile sindirmek katılmak için protokol.
| Ayıraç | Hacim (ul) |
| Çatal kapıları (~ 5 ug / ul konsantrasyon) | 150 |
| Nt.BstNBI (10.000 ünite / ml) | 600 |
| 10x NEB tamponu 3.1 | 83.3 |
| Toplam ses | 833,3 |
Tablo 9 Protokol çatal kapıları enzim Nt.BstNBI nicking ile sindirmek için.
. Tablo 10 Strand dizileri kimyasal reaksiyon A uygulanması için + B -.> B + C (. Bu tabloda, Ref 29 değişiklikler yapılarak elde edilmiş olan)
| Ayıraç | Hacim (ul) | Nihai konsantrasyon |
| 100 uM'deki ROX- | 10 | 10 uM (1x) |
| -RQ 100 mikron atM | 13 | 13 uM (1.3 x) |
| 10x TAE ile 125 mM Mg 2+ | 10 | 1x TAE ile 12.5 mM Mg 2+ |
| H2O | 67 | - |
| Toplam ses | 100 | 10 uM (1x) |
Muhabir C montajı için Tablo 11. Protokol.
| Ayıraç | Hacim (ul) | Nihai konsantrasyon |
| H2O | 514 | - |
| 10x TAE ile 125 mM Mg 2+ | 60 | 1x TAE ile 12.5 mM Mg 2+ |
| 300 u da PolyTM | 2 | 1 uM |
| 10 uM'deki Muhabir C | 9 | 150 nM (3x) |
| % 10 SDS | 9 | % 0.15 |
| 5 mcM | 6 | 50 nM (1x) |
| Toplam ses | 600 | - |
Reporter C kalibrasyonu için Tablo 12. Protokolü. Burada verilen miktarlar 600 ul (0,875 mi, bir sentetik kuvars hücrenin kullanımı karşılık gelen) bir toplam reaksiyon hacmi için, ancak farklı boyut hücreleri ile çalışmak üzere ayarlanabilir.
| Ayıraç | Hacim (ul) | Nihai consentrasyonu |
| H2O | 493 | - |
| 10x TAE ile 125 mM Mg 2+ | 60 | 1x TAE ile 12.5 mM Mg 2+ |
| 300 uM'de polyT | 2 | 1 uM |
| 10 uM'deki Muhabir C | 9 | 150 nM (3x) |
| 100 uM'deki | 3 | 10x |
| 100 uM'de | 3 | 10x |
| 100 mcM | 3 | 10x |
| % 10 SDS | 9 | % 0.15 |
| ~ 1 uM'de Çatal BC (konsantrasyon bilinmeyen) | 15 | ~ 0.5x |
| 100 uM'de | 3 | 10x |
| Toplam ses | 600 | - |
Tablo 13. Çatal BC kalibrasyonu için protokol. Burada verilen miktarlar 600 ul toplam reaksiyon hacmi için olmakla birlikte, farklı boyut hücreleri ile çalışmak üzere ayarlanabilir.
| Ayıraç | Hacim (ul) | Nihai konsantrasyon | |
| H2O | 407,2 | - | |
| 10x TAE ile 125 mM Mg 2+ | 52.8 | 12.5 mM Mg 2+ | |
| 300 uM'de polyT | 2 | 1 uM | |
| 10 uM'deki Muhabir C | 9 | 150 nM (3x) | |
| 10 uM'deki | 6 | 100 nM (2x) | |
| 10 mcM | 6 | 100 nM (2x) | |
| 10 mcM | 6 | 100 nM (2x) | |
| 6 | 100 nM (2x) | ||
| % 10 SDS | 9 | % 0.15 | |
| 1 uM'deki AB Üyelik | 45 | 75 nM (1.5x) | |
| 1 uM'deki Çatal BC | 45 | 75 nM (1.5x) | |
| 10 uM | 3 | 50 nM (1x) | |
| 10 uM'deki | 3 | 50 nM (1x) | |
| Toplam ses | 600 | - | |
Kimyasal bir reaksiyon A + B-> B + C için Tablo 14. protokol. Burada verilen miktarlar 600 ul toplam reaksiyon hacmi için olmakla birlikte, farklı boyut hücreleri ile çalışmak üzere ayarlanabilir.
| Sentezlenen kapıları | Plazmid türetilmiş kapıları | ||||
| Açıklama | Maliyet | Kapıları katılın | Çatal kapıları | ||
| SAYFA saflaştırılmış uzun iplikli (100 nt, bir kapının alt ipliklerini olarak hizmet) | ~ 75 $ | Açıklama </ strong> | Maliyet | Açıklama | Maliyet |
| SAYFA saflaştırılmış kısa iplikli (~ 30 nt, bir kapının üst ipliklerini olarak hizmet) | ~ 185 $ | Kapı şablonu | ~ 100 $ | Kapı şablonu | ~ 100 $ |
| Toplam | ~ 260 $ | Plazmid ekstraksiyon kiti | ~ 26 $ | Plazmid ekstraksiyon kiti | ~ 26 $ |
| Kısıtlama enzimi (PvuII-HF) | ~ 11 $ | Kısıtlama enzimi (PvuII-HF) | ~ 11 $ | ||
| Enzimi nickleme (Nt.BsrDI, kapıları Katıl) | ~ 29 $ | Nicking enzim (Nt.BstNBI, Çatal kapıları) | ~ 62 $ | ||
| Toplam | ~ 166 $ | Toplam | ~ 199 $ |
fo.:. keep-ile-previous.within sayfa = "always"> plazmid kökenli kapıları ve sentezlenmiş kapıları arasındaki Tablo 15 Maliyet karşılaştırması (. Bu tablo Ref 29 den modifiye edilmiştir)
| Sentezlenen kapıları | Plazmid türetilmiş kapıları | ||
| İşleme | İşlem süresi | İşleme | İşlem süresi |
| Tavlama | 1 saat | Klonlama | 5 saat |
| SAYFA arıtma | 2 saat | Plazmid çıkarma | 2 saat |
| Toplam | 3 saat | Enzim sindirimi iki adım | 0.5 saat |
| Etanol yağış | 1 saat | ||
| Toplam | 8.5 saat | ||
Plazmid kaynaklı kapıları ve sentetik kapıları arasındaki Tablo 16. İşlem süresi karşılaştırılması. (Bu tablo Ref 29 modifiye edilmiştir.)
Tartışmalar
Bu çalışma, yüksek derecede saf plazmid DNA'sından ndsDNA kapıları çıkarmak için bir yöntem tarif eder. Ayrıca, bir protokol bir floresan kinetik analizi kullanılarak kapı performansını karakterize etmek için sunulmuştur. Deneysel veriler, sentetik sistemi poliakrilamid jel elektroforezi (PAGE) ile arıtılmış, şeritlerin monte bile plasmid türevli sistemi sentetik muadili daha iyi performans göstermektedir. Olasılıkla, plazmid kaynaklı kapılarının geliştirilmiş performans biyolojik DNA çok yüksek saflıkta öncelikle kaynaklanmaktadır. Sentetik DNA, tipik olarak bütünüyle PAGE ve yüksek performanslı sıvı kromatografisi (HPLC), saflaştırma prosedürleri kaldırılmaz uzunluğu n-1, ve bu tür yan ürünlerin oligonükleotidlerin neden, özellikle silme hataların çeşitli içerir. Burada bildirilenlere benzer gelişmeler de biyolojik kaynaklardan elde edilen 21 DNA kullanılan katalize firkete yükseltecinin bir önceki çalışmada tespit edilmiştir.
Ancak, plazmid kaynaklı kapılarının kullanımı bile tamamen en az iki nedeni vardır hangi kapı performans hataları, yok edemez: çok olan kapıları yol açabilir ilk aşırı sindirim ya da kesilmiş hassasiyet eksikliği Yanlış pozisyonlarda çentik veya çentikler. Her iki durumda da, kapılar arzu edilmeyen reaksiyonlara katılma olasılığı daha yüksektir. Bu tür sorunlar, kullanılan enzim miktarı (bakınız Şekil 4) optimize hafifletti edilebilir. İkinci olarak, bu deneylerde, en fazla giriş ve yardımcı şeritler sentetik DNA ve dolayısıyla silmeler ve mutasyonlar ihtiva etmiştir. Prensip olarak, her tek sarmallı giriş ve yardımcı şeritler, ayrıca ön-kodlanmış m13 viral genomun 26 bir çentikleme enzimi sindirimi yoluyla fajemid DNA elde edilebilir. Belki de devresi performansı, bakteriyel genom türetilmiş ssDNA kullanılarak geliştirilebilir.
Plasmid türevli kapılarının kullanımı devre performansını geliştirdiği bulunmuştur birlikte, bir analizmaliyet ve üretim koşulları kez ya plasmid türevli kapıların üretimi biraz daha ucuz (Tablo 15) ise, bu ticari olarak sentezlenir oligolar (Tablo 16) için montaj ve kapılar saflaştırılması göre işlem süresi 2-3 kat daha uzun sürer olduğunu ortaya koymuştur. Plasmid türevli kapılarının primer maliyetleri gen sentezi ve sınır enzimleri kullanımı vardır. (30 nM'de 15 reaksiyonlar için yeterli) kapıları 300 pmol için kapıları Üyelik için tahmini maliyeti nedeniyle farklı nicklemek enzimlerin kullanımına yaklaşık 170 $ ve Çatal kapıları, varlık maliyet farkı 200 $ olduğunu. Buna karşılık, bir SAYFA arıtma ücreti dahil 260 $ civarında, aynı kapı masrafları için şeritlerin kimyasal sentez. Plazmid kaynaklı kapıları için birincil saat maliyeti sadece DNA sentezi gibi, bir gen sentezi şirkete taşeron olabilir, klonlama prosedürü yer almaktadır. Bununla birlikte, bir kez monte plasmid türevli kapıları konakçı plasmidler kolayca çoğaltılabilir avantajınd bakteriyel gliserol stokları halinde saklanabilir. Bu mümkün üzerinde Gates birçok kez yeniden yapar.
İleriye yönelik olarak, plazmid kaynaklı kapılarının iyileştirilmiş performans deneysel kadar DNA CRNs ile ortaya konmuştur daha dinamik davranışları çok daha büyük bir yelpazede sağlayabilir. Örneğin, son teorik çalışma 47,48 makro ölçekte kendi kendine organize mekansal desen bir reaksiyon difüzyon mekanizması aracılığıyla DNA CRNs ile gerçekleştirilebilir önerdi. Burada sunulan yöntem, öz-desenlendirme DNA malzemeler için altta yatan moleküler bileşenleri oluşturmak için uygun bir yol sağlar. Zorlu olsa da, programlanabilir bir şekilde makro ölçekli morfolojileri gelişmekte biyomalzemeler araştırma rejeneratif tıp kadar alanlarda önemli etkileri olacaktır.
Açıklamalar
The authors declare no competing financial interests.
Teşekkürler
Şekiller 1, 2, 3, 4, 6, 8 ve Tablolar 2, 3, 10, 15, 16 Ref 29 modifiye edilmiştir. Bu çalışma, Ulusal Bilim Vakfı tarafından desteklenmiştir (NSF-CCF 1117143 ve GS NSF-CCF 1162141 hibe). Y.-JC Tayvanlı hükümet Bursu ile desteklenmiştir. SDR Ulusal Bilim Vakfı Lisansüstü Araştırma Bursu Programı (GRFP) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Phusion High-Fidelity PCR Master Mix with HF Buffer | NEB | M0531S | |
| PvuII-HF | NEB | R3151L | |
| PstI-HF | NEB | R3140S | |
| Gibson Assembly Master Mix | NEB | E2611S | |
| Terrific Broth, Modified | SIGMA-ALDRICH | T0918-250G | |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | |
| QIAGEN Hispeed Maxi-prep Kit | QIAGEN | 12662 | |
| Nb.BsrDI | NEB | R0648L | |
| Nt.BstNBI | NEB | R0607L | |
| NanoDrop 2000c | Thermo Scientific | ||
| Double-stranded Genomic Blocks | IDT | ||
| Horiba Jobin-Yvon Spex Fluorolog-3 Fluorimeter | Horiba/Jobin Yvon | ||
| Synthetic Quartz Cells | Starna | 23-5.45-S0G-5 | |
| QIAGEN Gel Extraction Kit | QIAGEN | 28706 | |
| Plasmid Backbones | BioBrick | E0240-pSB1A2 | High copy number plasmid with Ampicillin resistance. Sequence can be found from http://parts.igem.org |
Referanslar
- Zhang, D. Y., Seelig, G. Dynamic DNA nanotechnology using strand-displacement reactions. Nat. Chem. 3, 103-113 (2011).
- Krishnan, Y., Simmel, F. C. Nucleic acid based molecular devices. Angew. Chem. Int. Ed. Engl. 50, 3124-3156 (2011).
- Zhang, D. Y., Winfree, E. Control of DNA strand displacement kinetics using toehold exchange. J. Am. Chem. Soc. 131, 17303-17314 (2009).
- Qian, L., Winfree, E., Bruck, J. Neural network computation with DNA strand displacement cascades. Nature. 475, 368-372 (2011).
- Qian, L., Winfree, E. Scaling up digital circuit computation with DNA strand displacement cascades. Science. 332, 1196-1201 (2011).
- Zadegan, R. M., Jepsen, M. D., Hildebrandt, L. L., Birkedal, V., Kjems, J. Construction of a fuzzy and boolean logic gates based on DNA. Small. 11, 1811-1817 (2015).
- Seelig, G., Soloveichik, D., Zhang, D. Y., Winfree, E. Enzyme-free nucleic acid logic circuits. Science. 314, 1585-1588 (2006).
- Zadegan, R. M., et al. Construction of a 4 zeptoliters switchable 3D DNA box origami. ACS Nano. 6, 10050-10053 (2012).
- Andersen, E. S., et al. Self-assembly of a nanoscale DNA box with a controllable lid. Nature. 459, 73-76 (2009).
- Zhang, D. Y., Hariadi, R. F., Choi, H. M., Winfree, E. Integrating DNA strand-displacement circuitry with DNA tile self-assembly. Nat. Commun. 4, (1965).
- Yurke, B., Turberfield, A. J., Mills, A. P., Simmel, F. C., Neumann, J. L. A DNA-fuelled molecular machine made of DNA. Nature. 406, 605-608 (2000).
- Green, S. J., Lubrich, D., Turberfield, A. J. DNA hairpins: fuel for autonomous DNA devices. Biophys. J. 91, 2966-2975 (2006).
- Venkataraman, S., Dirks, R. M., Rothemund, P. W., Winfree, E., Pierce, N. A. An autonomous polymerization motor powered by DNA hybridization. Nat. Nanotechnol. 2, 490-494 (2007).
- Green, S. J., Bath, J., Turberfield, A. J. Coordinated chemomechanical cycles: a mechanism for autonomous molecular motion. Phys. Rev. Lett. 101, 238101 (2008).
- Omabegho, T., Sha, R., Seeman, N. C. A bipedal DNA Brownian motor with coordinated legs. Science. 324, 67-71 (2009).
- Turberfield, A. J., et al. DNA fuel for free-running nanomachines. Phys. Rev. Lett. 90, 118102 (2003).
- Dirks, R. M., Pierce, N. A. Triggered amplification by hybridization chain reaction. Proc. Natl. Acad. Sci. U. S. A. 101, 15275-15278 (2004).
- Seelig, G., Yurke, B., Winfree, E. Catalyzed relaxation of a metastable DNA fuel. J. Am. Chem. Soc. 128, 12211-12220 (2006).
- Zhang, D. Y., Turberfield, A. J., Yurke, B., Winfree, E. Engineering entropy-driven reactions and networks catalyzed by DNA. Science. 318, 1121-1125 (2007).
- Yin, P., Choi, H. M., Calvert, C. R., Pierce, N. A. Programming biomolecular self-assembly pathways. Nature. 451, 318-322 (2008).
- Chen, X., Briggs, N., McLain, J. R., Ellington, A. D. Stacking nonenzymatic circuits for high signal gain. Proc. Natl. Acad. Sci. U. S. A. 110, 5386-5391 (2013).
- Phillips, A., Cardelli, L. A programming language for composable DNA circuits. J. R. Soc. Interface. 6, S419-S436 (2009).
- Lakin, M. R., Youssef, S., Polo, F., Emmott, S., Phillips, A. Visual DSD: a design and analysis tool for DNA strand displacement systems. Bioinformatics. 27, 3211-3213 (2011).
- Lakin, M. R., Youssef, S., Cardelli, L., Phillips, A. Abstractions for DNA circuit design. J. R. Soc. Interface. 9, 470-486 (2012).
- Zhang, D. Y., Winfree, E. Robustness and modularity properties of a non-covalent DNA catalytic reaction. Nucleic Acids Res. 38, 4182-4197 (2010).
- Ducani, C., Kaul, C., Moche, M., Shih, W. M., Hogberg, B. Enzymatic production of 'monoclonal stoichiometric' single-stranded DNA oligonucleotides. Nat. Methods. 10, 647-652 (2013).
- Lin, C., et al. In vivo cloning of artificial DNA nanostructures. Proc. Natl. Acad. Sci. U. S. A. 105, 17626-17631 (2008).
- Bhatia, D., et al. Icosahedral DNA nanocapsules by modular assembly. Angew. Chem. Int. Ed. Engl. 48, 4134-4137 (2009).
- Chen, Y. J., et al. Programmable chemical controllers made from DNA. Nat. Nanotechnol. 8, 755-762 (2013).
- Arkin, A., Ross, J. Computational functions in biochemical reaction networks. Biophys. J. 67, 560-578 (1994).
- Érdi, P., Tóth, J. . Mathematical models of chemical reactions: theory and applications of deterministic and stochastic models. , (1989).
- Magnasco, M. O. Chemical kinetics is Turing universal. Phys. Rev. Lett. 78, 1190 (1997).
- Oishi, K., Klavins, E. Biomolecular implementation of linear I/O systems. IET Syst. Biol. 5, 252-260 (2011).
- Senum, P., Riedel, M. Rate-independent constructs for chemical computation. PLoS One. 6, (2011).
- Soloveichik, D., Cook, M., Winfree, E., Bruck, J. Computation with finite stochastic chemical reaction networks. Natural Computing. 7, 615-633 (2008).
- Soloveichik, D., Seelig, G., Winfree, E. DNA as a universal substrate for chemical kinetics. Proc. Natl. Acad. Sci. U. S. A. 107, 5393-5398 (2010).
- Tyson, J. J., Chen, K. C., Novak, B. Sniffers, buzzers, toggles and blinkers: dynamics of regulatory and signaling pathways in the cell. Curr. Opin. Cell. Biol. 15, 221-231 (2003).
- Cardelli, L. Two-domain DNA strand displacement. Math. Struct. Comput. Sci. 23, 247-271 (2013).
- Angluin, D., Aspnes, J., Eisenstat, D. A simple population protocol for fast robust approximate majority. Distrib. Comput. 21, 87-102 (2008).
- Cardelli, L., Csikasz-Nagy, A. The cell cycle switch computes approximate majority. Sci. Rep. 2, 656 (2012).
- Zadeh, J. N., et al. NUPACK: Analysis and design of nucleic acid systems. J. Comput. Chem. 32, 170-173 (2011).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. , (2012).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat. Methods. 6, 343-345 (2009).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J. Vis. Exp. , e253 (2007).
- Lessard, J. C. Transformation of E. coli via electroporation. Methods Enzymol. 529, 321-327 (2013).
- Nasri, M., Thomas, D. Alteration of the specificity of PvuII restriction endonuclease. Nucleic Acids Res. 15, 7677-7687 (1987).
- Dalchau, N., Seelig, G., Phillips, A. Computational design of reaction-diffusion patterns using DNA-based chemical reaction networks. DNA Computing and Molecular Programming. , 84-99 (2014).
- Scalise, D., Schulman, R. Designing modular reaction-diffusion programs for complex pattern formation. Technology. 2, 55-66 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır