Method Article
多功能,微管为基础的法团细菌机械敏感离子通道与刺激的液滴界面双层膜
摘要
细菌机械敏感性通道可以用作生物分子器件mechanoelectrical换能器。液滴界面双层(的DIB),细胞启发积木这样的设备,代表新的平台,其中包含与刺激机械敏感通道。在这里,我们表现出成形的DIB,允许在机械刺激机械敏感性通道的研究的一个新的微管为基础的方法。
摘要
元富,大导机械敏感性通道(MSC),是一种普遍存在的渗压放气阀,可以帮助细菌生存突然低渗冲击。已发现并使用膜片钳技术近30年来严格的研究。其基本转换施加到细胞膜进入渗透性响应张力的作用,使得它的有力候选充当mechanoelectrical传感器在人工膜的基于生物分子器件。作为构建块这样的装置,液滴界面双层(的DIB)可被用作用于加入MsCl通道的掺入和刺激的新平台。在这里,我们描述了微量基法来形成的DIB和测量的掺入MSCL通道的活性。该方法包括脂质包裹锚定在两个对立(同轴定位)硼硅玻璃微尖水滴的。当液滴接触,脂双层界面是形成。这种技术提供的控制的化学成分和各小滴的大小,以及双层界面的尺寸。具有连接到谐波压电致动器的微量之一提供递送所期望的振荡的刺激的能力。通过变形时的微滴的形状的分析,在界面产生的张力可以被估计。使用这种技术,将报告的MsCl通道在一个DIB系统的第一活性。此外MS频道,其它类型的信道的活动可以使用该方法进行研究,证明这一平台的多功能性。这里介绍的方法,使产生基本膜性能的测量,提供了更大的控制对称和非对称膜的形成,并且是刺激和研究机械敏感性通道的另一种方法。
引言
在过去的十年中,人工脂质双层大会已基本穿过液滴界面双层方法的发展推进。被称为稳定和强大,征收的DIB自己作为替代模型系统,以古典彩绘(穆勒)和折叠(Montal -穆勒)平面双层1。虽然使用滴创建脂质双层的想法可以追溯到20世纪60年代2,它并没有得到普及,直到最近。第一次成功尝试被报道由Takeushi组3,接着几项研究表明使用液滴的网络由贝利组4-6双层形成。最近,提出了利奥集团7-9,谁率先使用的DIB作为新的刺激响应材料系统10积木概念的封装技术。在以前的研究中,的DIB证明其电气9,11,化学反应能力的iCal 10,12,和光刺激13。各种生物分子与不同的刺激响应功能都当在DIB 10,14重组得到有效激发。鉴于这些成功的尝试的一个重要问题是提出:可以以机械刺激的响应DIB在适当的时候将生物分子结合?作用在一个DIB的界面力不同于其它双层系统15,16不同。因此,在由液滴保持的双层的张力可以通过调节张力在水 - 脂质 - 油界面进行控制;概念不适用与油漆或折叠的双层系统。
元富渠道,广泛地称为渗透调节物质的释放阀和细菌胞浆膜的基本要素,应对增加的膜张力17,18。在低渗震荡时,驻留在一个小细胞的膜几个通道 19可以生成一个马斯西伯渗透性响应迅速释放离子和小分子,从20裂解节省细菌。生物物理,元富被很好地研究,并通过突出的膜片钳技术21-23特点为主。可靠的结构模型解释元富的门控机制24,25是根据它的同系物的晶体结构26,27,造型28,以及大量的试验24,29-31结果提出。下的〜施加的张力为10mN / m时,封闭通道它由跨膜螺旋的一紧捆的,转变成的大大倾斜螺旋形成一〜28充满水的导电孔21,24,32的环。还已经确定,紧栅的疏水性,位于内TM1域的交叉点,确定信道33的激活阈值。相应地,人们发现,通过降低栅极的疏水性,所述tensioN门限可以降低22。的MsCl的这种特性成为可能的各种控制阀门34的设计,主要用于药物递送的目的。对于上述所有特性,并根据翻译细胞膜过度紧张到电活动的基础性作用,元富使得非常适合作为mechanoelectrical换能器的DIB。
在这篇文章中,我们提出了一个原始的微管为基础的方法来形成的DIB和衡量下的机械刺激所并入元富渠道的活动。我们报告的第一次,的DIB的机械刺激和加入MsCl中的DIB 35 V23T低阈突变体的功能重建的响应。
实验系统由脂质包裹锚固到两个相对的硼硅酸盐玻璃微尖端含水液滴。当液滴接触脂质双层界面为foRmed指。这种技术提供控制每个液滴(散装)的化学组成和大小,以及双层界面的尺寸。此外,非对称膜,在每个小叶各种脂质组合物可以很容易地形成。具有连接到谐波压电致动器的微量之一,提供了以应用预编程单周期或振荡刺激的能力。张力通过两个液滴支撑它的压缩输送到人工膜。作为液滴变形的结果,水 - 脂质 - 油界面的增加,同时液滴之间的角度的区域减小,导致增加膜张力和短暂的MsCl活化。通过变形时的微滴的形状的分析,在界面产生的张力可以被估计。尽管本文中的重点是在DIB的机械性转导性质,我们也强调,其他类型的生物分子,如丙甲菌素,可通过将本多功能平台被激活。我们在座的,准备,组装,并进行测量,在一步一步地这一新方法的所有技术问题。
研究方案
1.准备PEG-DMA水凝胶的
- 为应用程序选择一个合适的测量/混合容器(烧瓶,烧杯等 )。使用清洁剂和水彻底清洁,然后用不起毛的组织雨刷擦拭。
- 戴上手套,以避免污染的玻璃器皿从指尖油。冲洗该容器具有足够的去离子水以去除洗涤剂残留物。
- 擦拭容器用不起毛的组织,以摆脱的水,然后喷洒异丙醇(IPA,99.5%)擦拭,直至干净。将其放置在真空室中,让所有IPA完全蒸发。清洗在用蒸馏水将水凝胶形成过程中使用的实验室设备的其余部分。
- 以制备40%(重量/体积)的PEG-DMA水凝胶溶液,称量4克聚(乙二醇)二甲基丙烯酸酯(PEG-DMA; MW = 1,000克/摩尔)的使用实验室规模的聚合物。
- 使用超声波仪浴4放置称量PEG-DMA入烧瓶中,并热5-55°C,直到固体PEG-DMA已经液化。在此过程中,盖用Parafilm /蜡纸烧瓶的开口,以保持水的。
- 一旦PEG-DMA已液化,添加缓冲液(500mM的氯化钾,10mM的MOPS,pH7.0)中,直到总体积达到〜10毫升(足够几个实验超过6个月的期间)。
- 添加固化剂,在0.5%(重量/体积)。在这种情况下,添加0.05克的固化剂的10毫升混合物中。将烧瓶放回超声波仪浴,并允许各组分溶解于溶液(大约10分钟,250个瓦)。
注意 :一旦固化剂已被添加到该溶液中,水凝胶会固化(固化),如果暴露在任何光源的时间足够量。为了帮助解决这个问题,换了瓶/箱用黑色胶带,并将其存储在一个黑暗的地方。这种溶液可以贮存数周,在室温(22℃)。
2.准备Lipos的omes
- 通过加入10ml缓冲液(500mM的氯化钾,10mM的MOPS,pH 7.0)中到20mg 1,2- diphytanoyl- SN -glycero -3-磷酸胆碱(DPhPC)合成制备10毫升的2毫克/毫升脂质溶液脂类购买的冻干粉。确保两个脂质囊泡和缓冲液充分混合(混合物应该是均匀而朦胧,当一切都被溶解)。
- 冷冻(-20℃)并完全溶解,总共六次新脂质混合物。让该混合物在室温下解冻,从未在加热的环境中。
- 使用市售的挤出机,通过一个0.1微米的膜滤器迫使整个脂质悬浮液首先通过0.4μm的聚碳酸酯膜过滤器,然后六次挤出脂质。这个方法产生的粒子直径接近100纳米(等于过滤器的孔尺寸)。
注:其他脂质和脂质的比率可以使用此我准备的ThOD。脂质体应贮存在4℃几周。
3,元富分离与重组
- 条纹出的温度琼脂糖平板,含有100μg/ ml氨苄青霉素,E。大肠杆菌 MJF465细胞与pB10b质粒携带V23T的MsCl基因延长在3'端(C端)一个6-组氨酸标记。允许该板培养过夜(12-16小时),在37℃在一个静止的培养箱。该质粒被选择为并保留在细胞用100μg/ ml氨苄青霉素中标准LB培养基。第二天地方20个毫升LB培养基与100微克/毫升氨苄青霉素在培养囊泡(50ml烧瓶或什么是可用来保存培养)。采取这一培养过夜盘和从盘选择落转移(接种),以准备20毫升LB培养基用无菌接种棒。允许20毫升培养至在37℃下以250rpm在摇床生长过夜(12-16小时)。
- 倒出20毫升overn飞行文化融入到2-4大号LB培养基中。氨苄青霉素不再需要。摇在振荡培养箱中于250rpm下将烧瓶在37℃,直到OD 600达到0.5。添加异丙基β-D-1-硫代半乳糖苷(IPTG)至0.6mM的终浓度,并让培养去一小时(至OD 600 = 0.8-1.0)。
- 放在冰瓶寒意培养,然后通过离心收集细菌。使用6 400个毫升锥形管中,在7438×g离心其足够以沉淀细菌(或多达允许由所用的转子)离心5-8分钟。滗析出上清液,并重复上述步骤,直至从媒体所有收获细胞。需要自旋的次数取决于培养物已生长的量和所用的转子。为2升的培养它只需要降速细胞一次。传输所有收集的细胞成一个单一的离心管中。
- 重悬在细胞沉淀约20毫升法国压榨缓冲液(100mM KPi和5mM的氯化镁 ,pH7.4)中。该悬挂应密实(如奶油或牛奶)。紧接之前法国按压暂停添加蛋白酶抑制剂苯甲基磺酰氟(PMSF)至2mM的最终浓度,并剧烈混合。
- 法国按文化,的35ml法国的压力细胞,在10,000到16,000磅。降速悬浮液以分离出完整的细胞在7438×g离心,于4℃10分钟。
- 把上清液在一个单独的管中,并添加到它溶菌酶和DNA酶(0.2mg / ml的每个)。让上清液翻转10分钟,在室温下进行。
注意:DNA酶是可选的;它减少了粘度为高速离心。溶菌酶是至关重要的;它消化细胞壁的残余,并有助于提高膜提取用温和的非变性去污剂进行的产率。
- 分发的上清液组合成两个超速离心管和自旋他们在106,883-153,911×g离心(根据转子)在4℃下40分钟。离心后,倾去上清液,并在底部的褐色沉淀(总膜部分)可以在管被冻结长期储存( - 80℃)或用于直接蛋白质纯化。
- 准备0.5-1 l高咪唑缓冲液:100毫米氯化钠+ 500 mM咪唑,滴定至pH值7.2-7.4用浓盐酸。需要注意的是咪唑是一个很好的缓冲物质本身。
- 制备0.5-1升低咪唑缓冲液:100mM NaCl的,+ 15 mM咪唑,通过适当地稀释以上用100mM NaCl的缓冲液。不需要pH调节。
- 取100-150毫升每个缓冲器的在单独的瓶,并加入1%(重量/体积)B-辛基吡喃葡萄糖苷(OG)。搅拌该溶液井,并通过0.22μm滤器过滤。这些解决方案是低和高咪唑色谱解决方案。
- 制备的提取缓冲液,取50个ml的低咪唑缓冲液中,并加入3%(重量/体积)OG和过滤缓冲器。
- 使用0.5-2克湿重的膜颗粒的蛋白分离。加入5-7毫升提取缓冲液,重悬沉淀,并均匀化它在30ml的手驱动的玻璃 - 活塞均化器。 5-10温柔的笔触进行均匀的悬浮液没有肿块。要小心,剪切应力是已知会导致蛋白质变性。
- 降速不溶颗粒(中档离心机,固定角转子,38,478-68,405×g离心,于4℃,15分钟)。同时,取3毫升镍NTA珠(6毫升悬浮液中)和低咪唑缓冲(W / O OG)摇动他们在一个15毫升螺旋帽筒,一旦把它们洗干净。让珠定居在底部(〜5-7分钟)或旋下来,在129-201 XG在4℃一分钟。一旦颗粒形成,小心倒出上清液用手重复上述步骤。平衡珠粒用2-3毫升的3%OG提取缓冲液。
- 从3混合匀化混合物(膜沉淀和提取缓冲液)。12 3-3.5毫升镍NTA珠。让在螺旋盖管60分钟(分批装载)混合翻滚。旋转珠下来201×g离心(30秒),用手工倒出上清液,并用1%的OG低咪唑缓冲珠一次。再次沉淀珠在3.13和悬浮他们20-30毫升新鲜低咪唑缓冲。
- 包小柱(装有上部流适配器)与镍NTA珠,并让小珠沉降通过打开旋塞,让通过流浸膏(不允许珠粒干燥)。同为10ml低咪唑缓冲液(1%OG)与止水栓开一个等份洗珠。
- 加载机色谱纯低和高咪唑缓冲剂大约各25毫升在机器定义流率(每机而异);这是通过:首先使低咪唑缓冲通过系统进行。零OD 260(基准线)的光学记录仪。请注意,缓冲器有很大不同,因为水低档咪唑具有ⅰmpurities它吸收紫外线。将流量适配器到列,并将其连接到本机。
- 低咪唑缓冲器再次洗柱(以1ml /分钟),直至通过附带到达基线流动的外径(它可能需要10-20毫升)。这将删除该列的未结合的蛋白。
- 应用20的咪唑的线性梯度至500mM,30分钟后,以1毫升/分钟。开始收集4毫升分数时,OD 600显示增加。前两个级分都充满松散结合的蛋白质,而加入MsCl-的6His开始洗脱在〜线性梯度的40%。大多数蛋白的出现在级分3至8个。
注:外径的线性上升将因咪唑的增加%观察到。 - 池部分3-4,5-6和7-8在一起。可选,分别集中在分数。浓缩的部分采用离心过滤器6-10倍。一个20分钟旋在804×g离心,于4℃后,小心地悬浮浓缩的蛋白质,蛋白质趋于粘在过滤器。
- 提款50微升等份,用SDS样品缓冲液混匀,并检查蛋白质纯度使用PAGE电泳。
注:加入MsCl将迁移为约17 kDa的到凝胶底部的模糊条带。 - 使用浓缩的级分来量化使用蛋白质测定试剂盒的蛋白质,根据制造商的指令。典型的产率从0.8克膜沉淀是到的合并的馏分0.2毫克纯蛋白质。
- 通过透析每瓶V23T元富成DPhPC脂质体。取10毫克/毫升的氯仿DPhPC的它的溶液和等分0.5毫升(即5毫克脂质)分成三个一次性圆底(12×130个毫米)的玻璃试管中。干燥氮气流下的脂质和在真空下除去(4-6小时)的氯仿的残余。
- 加入粉状OG 15 20mg至干脂质在每个管中,溶解在2ml的透析缓冲液(100mM的KCl,5mM的KPi中,pH值7.2),涡旋,并英里的ldly超声。在OG-溶解血脂应该形成一个明确的解决方案。
- 加浓V23T加入MsCl的解决方案,每个管来实现1:100,1:300和1:1000蛋白质与脂质比和旋涡良好。切,洗透析管的三件(〜12厘米长)(截留分子量8000,直径为7.5毫米,三对准备编号的剪辑。)
- 将溶解的脂质 - 蛋白质的混合物的管内,小心地关闭与剪辑的端部,和透析针对2升缓冲液(100mM的氯化钾,5mM的KPi和pH7.2的)48小时,在4℃下的4变化缓冲器每隔12小时。透析后,PROTEO脂质体已准备就绪。
注 :脂质体溶液可以补充了2mM NaN3的的(叠氮化钠),并储存在4℃。避免结冰。
4.制造的油藏
- 钻两个相对的孔(直径1.0mm)的所有方式,通过一个直径为2英寸的壁,1.5厘米长的丙烯酸缸因德尔在1厘米从底部(图1A)。
- 钻两个4毫米的孔同心之前钻出的1毫米的孔。孔的深度应为每次1毫米(确保不钻一路)。这些孔是由以适合橡胶垫圈。
- 地方和胶两种橡胶垫片具有以防止油泄漏,在更大的孔1毫米内径。
- 胶加工气缸到10厘米×10厘米使用任何通用的环氧树脂薄丙烯酸系片材( 图1)。
在实验的日子
5.制备电极的
- 切两个250微米直径的银导线7厘米长,然后浸入其尖端在漂白两小时以形成氯化银(AgCl电极)的涂层。灰色表示的氯化银涂层已经形成( 图2E)。
- 使用玻璃切割机,劈有10厘米长,1 / 0.58 OD /内径mm硼硅类capil毛细管成两个5厘米毛细血管。
- 使用34计microfil针填充毛细管的PEG-DMA水凝胶。为了防止水合水凝胶从隆起的毛细管,保持3毫米间隙的提示,并确保有没有气泡的毛细血管。
- 插入的Ag / AgCl电极插入该水凝胶填充的毛细管(图2E)。
- 固化的PEG-DMA水凝胶通过在暴露于UV光2分钟自由基光聚合在1 W使用UV点焊枪。
6.设置实验
注:实验是下一个法拉第笼接地到贴片上的放大器的接地连接设置。
- 附加微量之一的直微电极保持器,其具有阳连接器(图2E)。
- 微电极保持器连接到补丁放大器 (图2A)的探头。要连接老天dstage到地面,焊接18号绝缘铜导线适当连接器的探头。
- 安装在一个3轴手动显微的探头。附加探头安装板(应当与显微购买沿着或在机加工车间定制)的显微然后将探头连接到使用合适的螺钉安装板。
- 通过实验室制造的连接器连接的第二微量到线性致动器,然后在一个第二显微(图2B)装入两者。的微量应彼此相对的,对齐的,并水平放置。注意:在机器人的品牌和风格并不重要。
- 在玻璃小瓶中,混合0.1毫升DPhPC脂质体的含0.01毫升V23T的MsCl脂蛋白溶液。
注:此步骤是必要的,以减少蛋白质与脂质比(〜0.0002),这是一个稳定的脂质bilaye形成临界河
- 使用34计microfil针,请在两个微量的技巧与脂蛋白的解决方案( 图3A)。
- 放置在一个直立式显微镜的顶储,并且通过相对的1毫米的孔(图2B)喂微量。注意:任何显微镜可以只要在液滴可以清楚地看到使用。
- 填料容器与十六烷(99%)的表面上。的十六烷不需要进一步纯化。
- 以形成球形液滴在微量的尖端,使用第三10微米直径的硼硅酸盐玻璃微,安装在第三显微,以分配在微量的尖端稀释V23T的MsCl脂蛋白溶液(〜0.00052毫升)并形成液滴(图3)。
- 控制液滴的大小(通过减少或增加的体积)根据需要,让他们休息10分钟,为单层以形成完全(Figure 3)。
- 使液滴接触,会发生在1至2分钟,双层形成。
7.安装软件和设备
- 通过接通计算机,显微镜,压电振子控制器,函数发生器,贴片放大器和低噪声的数据采集系统准备软件。
注意:任何补丁放大器可用于和下面的说明是针对我们使用与所述一个列在材料和设备清单。 - 在补丁功放的前面板,设置" 模式"旋钮VHOLD / IHOLD和V-CLAMP。
- 在前面板上设置了" 低通"贝塞尔滤波器为1 kHz和输出增益为2。
- 将" 配置",以全细胞β= 1。
- 确保旋钮的其余部分被设置为零或在中间位置。
- 样品所有DIB电流测量在5千赫用1KHz贝塞尔抗混叠滤波器。
- 运行软件,通过双击桌面上的图标。
- 点击"配置>数字转换器",打开" 数字化仪 "对话框,然后单击"更改"按钮 。
- 在 "更改数字化仪"对话框中的"数字化仪类型"列表中选择"Digidata 1440系列"。
- 点击扫描按钮来检测数字化仪。
- 点击"确定"退出"更改数字转换器"对话框,然后单击"确定"退出了 " 数字化仪"对话框。
- 点击"配置>实验台 "。
- 在实验台上的输入信号标签,选择模拟在在数字化通道。设定比例因子至0.002。
8.形成脂质双层的
- 使用BNC电缆,连接AW输出aveform发生器到外部指令输入前交换(数据采集系统的背板上)。发送10赫兹,500 mV的峰 - 峰值三角波的探头。
- 使用显微操作,水平移动玻璃微带来的液滴接触,直到它们略微触及和等待双层减薄发生(通常为约1至2分钟)( 图3C和3D)。
注 :该双层的形成过程的进展可以在视觉上可以看到通过显微镜,并且可以通过电流测量(图4)进行监测。
- 调整双层大小(〜250微米的直径),通过控制安装在致动器的液滴的位置,用显微。注意:该双层大小可以目视通过显微镜来估计。此方法使得更容易为研究者通过容易控制双层的大小移动使用显微操作液滴。
9,动态激励和元富门控
- 一旦双层已经形成和稳定(即双层未打破或导电),通过使用函数发生器发送一个正弦信号刺激液滴。
- 刺激在双层掺入的元富蛋白质,发送具有175微米的峰 - 峰振幅,0.2赫兹频率,和在压电伺服控制器50%占空比的正弦波形。 (各种类型波形可以具有不同的频率,振幅和工作循环被发送)
10.处理与解释结果
- 保存当前的测量,使用该数据采集系统记录,在.ABF格式。使用函数文件"abfload"导入数据(.ABF格式)MATLAB,然后分析和处理数据。而"abfload"的文件都可以在网上免费。
- 估算吨他张力在双层和液滴的面积扩大,在该使用了适当的相机记录的充分致动循环使用液滴的视频。
- 过程录像在Matlab,通过处理使用图像处理技术来估计水/油界面的面积,以及液滴之间的角度单个帧。注意:使用从视频截取的2D帧,检测所述水-油界面(液滴的即边缘),然后通过旋转估计的表面积。
结果
图1和2显示的实验装置和设备用于在脂双层膜的机械性刺激的过程中记录的蛋白质的活性。为了最大限度地减少电气噪声成我们的测量,工作站放置在实验室制造的法拉第笼中,接地在AxoPatch 200乙放大器接地连接。
稳定的绝缘脂质双层的形成是在这项研究中的关键一步。在这种布置中,一个脂质单层组装在浸入有机溶剂浴的水性液滴的油/水界面。当液滴接触放置,多余的油被消除,与对置的脂质单层薄到两分子厚脂质双层。在双层表征中使用的最常见的技术是电压钳。与电压钳,跨双层的电压维持在一个恒定值,而电流的测量。 图4 的描绘了最初的双层形成了典型的实时电流记录。知道特定的电容(〜0.6μF/ cm 2)的5 DPhPC脂质双层的,所形成的双层的面积可以计算。双层面积可以通过改变液滴(图4A)的位置来控制。使用该压电致动器,不同类型的波形(正弦,正方形,三角形等 ),在不同的频率,振幅,和占空比的可应用于液滴横向和轴向摆动他们,因此,双层张力和面积可以改变(图4B)。
当该DIB被机械刺激,同时保持膜两侧恒定的DC电势,一个低阈值(获得性功能)V23T的MsCl的突变体产生可靠的活动,包括主要子导电状态和偶尔完全打开事件( 图5) 。这些电动车已废除的那些相同使用从重构与纯化V23T的MsCl完好内大肠杆菌膜和脂质体的膜片钳技术记录。结果在图5中证明门控发生响应于张力增加,因为所有的电流尖峰是在峰压缩观察。在峰值压缩,相对面膨胀的液滴的是最大的,因此,张力在界面处是最大的。
丙甲菌素,电压门控离子通道和研究最多的肽之一,增加了膜的渗透性,当直流电压时穿过膜36施加。脂双层接口到主机跨膜蛋白质和肽的能力也可以通过使用丙甲菌素肽进行电压 - 门控电流的录音进行测试。丙甲菌素混合与磷脂溶液至100毫微克/毫升的最终浓度。 图6示出了根据电流测量电压钳(+115毫伏)。在这个实验中的微滴,从而实现小的双层界面,因此较高的电阻和较小的电容拉开。丙甲菌素的肽的门控行为通过的电流( 图6)的不连续的步骤中所示。右侧的图的直方图示出了从基级(0.0962 NS),这基本上是信道本身的第一电导水平的变化电导。

图1:示意图说明了主要部件和油藏规模储油槽,在弗吉尼亚理工大学机械厂制造的。它由一个加工后的圆柱丙烯酸管粘的丙烯酸类片材的表面的。的尺寸和设计可以被修改,以适应不同的应用或两个以上的微量。/53362/53362fig1large.jpg"目标="_空白">点击此处查看该图的放大版本。
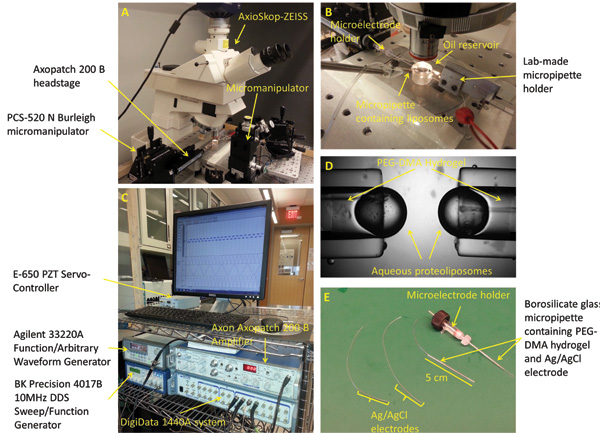
图2:实验装置和微量制备(A)中的标准工作站用于形成的,机械刺激,并且表征所述接口双层包括显微镜,3轴操纵器,数字照相机,压电振子,振动隔离台,和一法拉第笼(未示出)。 (B)的实验装置包括水平地定位在十六烷油浴两个相对的PEG-DMA水凝胶填充微量。每个微量的含有Ag / AgCl电极,以提供电连接。第三微量填充有脂蛋白溶液用于形成液滴在另一微量的尖端。 (C)中的DIB的电流响应,可以测量使用patch放大器和低噪声的数据采集系统的组合。 (D)一种封闭起来的画面示出形成在微量的前端的水滴。 (E)的Ag / AgCl电极是通过浸渍两个250微米的银线的前端在漂白制成。电极,然后通过两个硼硅玻璃毛细管填充有PEG-DMA的水凝胶,其被固化用UV光固化送入。与阳连接器的直微电极保持器是用来连接的微量到贴片放大器的探头中的一个。
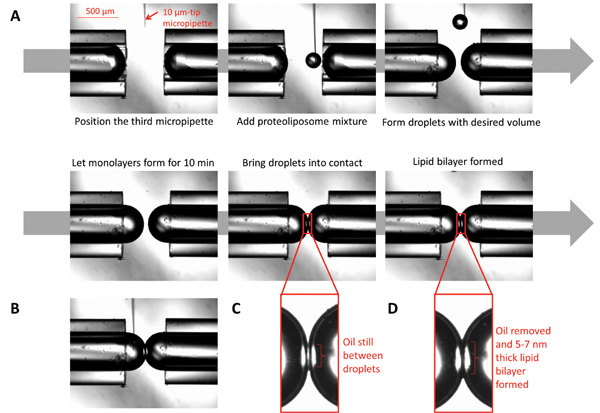
图3:示出液滴界面双层形成图像(A)10微米的微量充满脂蛋白定位显微镜在接近微量的提示下。使用连接到微量注射器,取少量的蛋白脂质体的形成球形液滴所需的音量。通过允许液滴坐了十分钟让单层形式。把水滴接触;双层将形成后的所有的油在界面被消除。 (B)当该双层形成,在界面两侧的化学组合物可通过注射所需的化学品使用的微小尺寸的微量控制。 (C)在第一接触的瞬间的液滴。 (D)的形成脂质双层时的液滴。
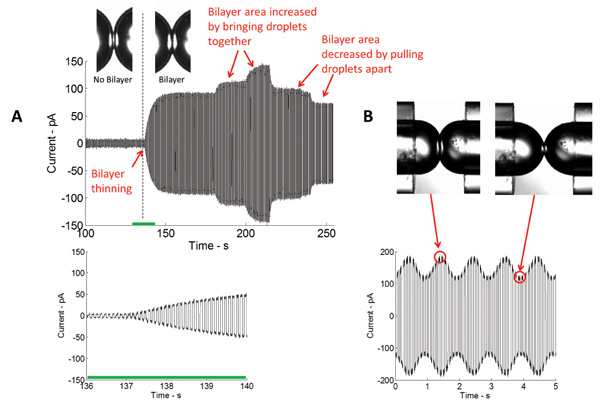
图4:实时测量显示了初始变薄和接口的随后的膨胀通过的三角电势的应用中的双层形成的过程中进行测定(A)电流。测得的电流的大小成正比的卡帕奇tance,和双层界面从而面积。液滴汇集越接近,更大的接口,反之亦然的区域。 (B)在施加机械激励的,的双层界面的面积增大,并在相同的频率刺激信号减小。
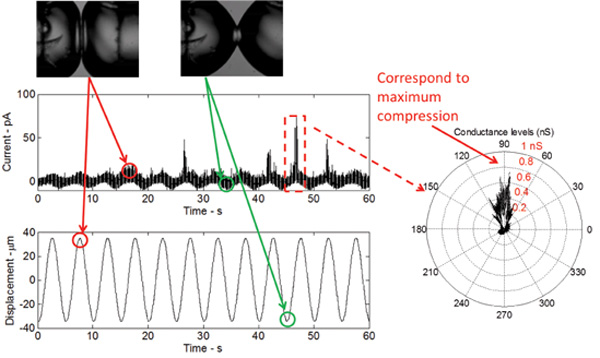
图5:实时测量显示该双层对机械激励的响应,以及加入MsCl的V23T突变体的选通电流响应的形状是正弦的,而在双层电容涉及正弦变化的结果双层面积变化。电流尖峰,在每个周期的峰值发生,指示V23T突变体的子电导门控。极坐标图还指出,选通发生在峰值压缩,这反映了双层界面的张力增加。
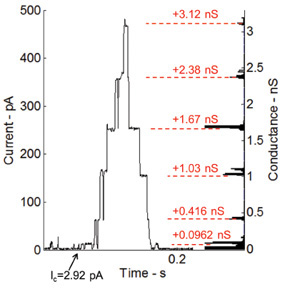
图6:根据电压钳和传导水平的用于掺入丙甲菌素通道的门控活性的相应直方图电流测量的丙甲菌素肽的门控行为通过在当前离散逐步增加所示。电导水平相匹配非常好,我们的研究小组在弗吉尼亚理工大学7执行先前的测量。
讨论
机械感觉表示第一感官转导通路,在生物体进化中的一个。利用此现象对于研究和理解DIB的机械 - 电性能,是向着官能刺激响应材料的关键步骤。它涉及到一个机械敏感性通道,加入MsCl,在DIB作为mechanoelectrical传感器和应变仪来检测张力增加脂质双层界面的掺入和激活。在另一方面,MS通道的功能可以通过脂质双层包括厚度,内在曲率,和压缩的基本材料特性进行调节。鉴于前述的,微量移液器为基础的技术提供了一种有价值的工具,允许研究者研究MS通道中的DIB和提供了深入了解脂双层的结构,以及脂质 - 蛋白质相互作用的能力。
在过去的三十年S,膜片钳是主要的方法来研究的MS信道,因为它允许这两个电压和张力的夹紧。然而,膜片钳需要庞大的设备,不适合小型化,需要的感觉和转换装置的工程的属性。由于其简单性,稳定性和紧凑的DIB表示一个合适的环境,研究的MsCl的活性。在这里,我们通过提出一种微量为基础的技术,用来控制液滴和双层接口的大小,每个液滴的化学组成,以及通过动态刺激张力界面处的能力延伸在DIB形成技术以前的进步。该技术包括固定水滴,含蛋白脂质体,以同轴反对玻璃毛细管的提示。液滴被放置在有机溶剂的浴接触时带来了脂质双层形式在界面处。
的微量附着为piezoelectric振荡器,使液滴的水平位移。动态压缩液滴,结果在增加界面张力在水油界面,因此,增加了双层张力。两个主要方面区别于同类和最近公布的接触泡沫双层(CBB)技术,37这个方法。使用本文中所呈现的技术中,双层的大小使用而被控制显微操作,因此,液滴的体积保持恒定,不像在CBB方法。此外,CBB技术要求的压力泵,其不需要在本文使其更简单,更容易建立提出的方法。
我们能够掺入和刺激细菌的MsCl首次不使用一膜片吸管或化学修饰38。由于该系统有助于鲁棒不对称脂双层膜的形成,它更紧密地模仿升IPID不对称生物膜中。这让我们来研究的MsCl的活性控制的膜组合物或不对称的效应。此外,通过图像处理技术,这种方法有助于估计张力在双层界面。在理解的DIB体积和表面力之间相互转换的原则,这种技术的助攻,促进基本膜性能的测量,并提高响应元富的理解,对膜的张力。
虽然这种方法使我们更近一步向生物分子刺激响应材料体系和不同的生理环境,研究的MsCl,有限制的系统。张力在此系统不能被由于脂质贮存在各小滴,这往往会缓解张力在油/水界面脂质体的形式存在夹紧。因此,目前机械敏感性通道可刺激在的DIB只在一个动态的制度。气泡在系统中存在显著影响实验的精度和再现性。存在于水凝胶的气泡可能导致的损失,如果电连接。
尽管我们描述了使用微吸管基于方法的MsCl的刺激,该技术可以被用来研究其它类型的MS的信道,并具有要使用的研究人员研究了各种生物分子的潜力。例如,类似的设置已使用在我们的实验室研究一个信道的无液滴界面双层膜的mechanoelectrical响应。各种蛋白质可重构和使用这种高度控制的设置激活时,也要考虑到各个生物分子的重构环境而变化。本文中介绍的方法倒是一个相当广泛的应用潜力仅限于研究人员的想象。
披露声明
作者什么都没有透露。
致谢
研报本出版物中是通过科学研究基本计划资助FA9550-12-1-0464空军办公室的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Corning | 430624 | |
| 1,2-diphytanoy-sn-glycero-3-phosphocholine (DPhPC) | Avanti Polar Lipids | 850356P | Purchased as lyophilized powder |
| 34-gauge microfil | World Precision Instruments | MF24G-5 | |
| 400 mL Centrifuge bottels | ThermoFisher | 3141 | Nalgene |
| Agilent Function/Arbitrary Waveform Generator, 20 MHz | Keysight Technologies | 33220A | |
| Ampicillian | ThermoFisher | BP1760 | ACS Grade |
| Avanti® Mini-Extruder | Avanti Polar Lipids | 610000 | |
| Axio Scope.A1 | Carl Zeiss | - | |
| AxioCam HSm | Carl Zeiss | - | |
| Axopatch 200B Amplifier | Molecular Devices | - | |
| BCA protein assay kit | Pierce | 23225 | |
| BK Precision 4017B 10 MHz DDs Sweep/Function Generator | Digi-Key | BK4017B-ND | |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100F-4 | |
| Dialysis tubing | 7 Spectra/Por | 132113 | MWCO 8000, 7.5 mm diameter |
| DigiData 1440A system | Molecular Devices | - | |
| DNAse | Sigma-Aldrich | DN25 | |
| DPhPC | Avanti | 850356C | |
| E-625 PZT Servo-Controller | Physik Instrumente | E-526 | |
| FPLC System | Pharmacia Biotech | - | |
| HCl | J.T. Baker | 9535-33 | |
| Hexadecane, 99% | Sigma-Aldrich | 544-76-3 | |
| Homoginizer | Wheaton | 357426 | 15 mL |
| Imidazole | Sigma-Aldrich | I5513 | |
| IPTG | Affymetrix | 17886 | |
| IRGACURE® 2959 | IRGACURE® | 555047962 | |
| Isopore Membrane Filters | EMD Millipore | VCTP02500 | |
| Isopropyl Alcohol | VWR International | BDH1133-4LP | |
| KCl | Sigma-Aldrich | P3911 | ACS Grade |
| KH2PO4 | Mallinckrodt | 7100 | ACS Grade |
| Kimble-Chase | Kontes | 420401-1515 | Flex-Column |
| LED-100 UV Spot Curing System | Electro-Lite, corp. | 81170 | |
| Lysozyme | Sigma-Aldrich | L6876 | |
| Manual Patch-Clamp Micromanipulators | Thorlabs | PCS-520N | |
| MgCl2 | ThermoFisher | M33 | ACS Grade |
| Microelectrode Holder | World Precision Instruments | MEH1S | |
| Micropipette Puller | Sutter Instruments | P-1000 | |
| MOPS, minimum 99.5% titration | Sigma-Aldrich | M1254-100G | |
| N2 Gas | Airgas | UN1066 | |
| NaCl | EMD | SX0420-1 | ACS Grade |
| Ni NTA agarose beads | Qiagen | 1000632 | |
| Optically Clear Cast Acrylic Tube, 2-1/2" OD x 2" ID | McMaster-Carr | 8486K545 | |
| P-601 PiezoMove Flexure-Guided Linear Actuator | Physik Instrumente | P-601 | |
| PAGE gel | Bio-Rad | 456-9033 | |
| Parafilm M® All-Purpose Laboratory Film | Parafilm® | PM999 | |
| Phenylmethylsulfonyl fluoride | Sigma-Aldrich | P7626 | |
| Poly(ethylene glycol)1000 dimethacrylate | Polysciences, Inc. | 15178-100 | |
| Polycarbonate (PCTE) Membrane Filters, Black, 0.4 Micron, 25mm, 100/Pk | Sterlitech Corporation | PCTB0425100 | |
| Potassium Chloride | Sigma-Aldrich | P5405-500G | |
| Powder Free Soft Nitrile Examination Gloves | VWR International | CA89-38-272 | |
| Replacement Gasket 1.0mm | World Precision Instruments | GO1-100 | |
| SDS | Sigma-Aldrich | L5750 | |
| Silver wire | GoodFellow | 147-346-94 | Different diameters could be used depending on the application |
| Sodium Azide | Affymetrix | 21610 | |
| Test tubes | ThermoFisher | 14-961-27 | 12 x 130 mm |
| Tryptone | ThermoFisher | BP1421 | |
| Ultracal 30K | Millipore | UFC803024 | Amicore Ultra 30 MWCO |
| VWR Light-Duty Tissue Wipers | VWR International | 82003-820 | |
| VWR Scientific 50D Ultrasonic Cleaner | VWR International | 13089 | |
| Water Purifier | Barnstead | D11931 | |
| Yeast | ThermoFisher | BP1422 | |
| β-octylglucopyranoside | Anatrace | O311S |
参考文献
- Montal, M., Mueller, P. Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties. P NATL ACAD SCI USA. 69, 3561-3566 (1972).
- Tsofina, L., Liberman, E., Babakov, A. Production of bimolecular protein-lipid membranes in aqueous solution. Nature. , (1966).
- Funakoshi, K., Suzuki, H., Takeuchi, S. Lipid Bilayer Formation by Contacting Monolayers in a Microfluidic Device for Membrane Protein Analysis. ANAL CHEM. 78, 8169-8174 (2006).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. J AM CHEM SOC. 129, 8650-8655 (2007).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. J AM CHEM SOC. 130, 5878-5879 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nat Nano. 4, 437-440 (2009).
- Sarles, S. A., Stiltner, L. J., Williams, C. B., Leo, D. J. Bilayer formation between lipid-encased hydrogels contained in solid substrates. ACS APPL MATER INTER. 2, 3654-3663 (2010).
- Sarles, S. A., Leo, D. J. Regulated attachment method for reconstituting lipid bilayers of prescribed size within flexible substrates. ANAL CHEM. 82, 959-966 (2010).
- Sarles, S. A. . Physical Encapsulation of Interface Bilayers. , (2010).
- Sarles, S. A., Leo, D. J. Membrane-based biomolecular smart materials. SMART MATER STRUCT. 20, 094018 (2011).
- Sarles, S. A. The use of virtual ground to control transmembrane voltages and measure bilayer currents in serial arrays of droplet interface bilayers. SMART MATER STRUCT. 22, 094023 (2013).
- Sarles, S. A., Leo, D. J. Cell-inspired electroactive polymer materials incorporating biomolecular materials. SPIE Smart Structures and Materials+ Nondestructive Evaluation and Health Monitoring. , 797626 (2011).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130, 5878-5879 (2008).
- Bayley, H., et al. Droplet interface bilayers. MOL BIOSYST. 4, 1191-1208 (2008).
- White, S. H. Analysis of the torus surrounding planar lipid bilayer membranes. BIOPHYS J. 12, 432 (1972).
- Tien, H. T., Ottova, A. L. The lipid bilayer concept and its experimental realization: from soap bubbles, kitchen sink, to bilayer lipid membranes. J MEMBRANE SCI. 189, 83-117 (2001).
- Perozo, E. Gating prokaryotic mechanosensitive channels. NAT REV MOL CELL BIO. 7, 109-119 (2006).
- Kung, C., Martinac, B., Sukharev, S. Mechanosensitive channels in microbes. ANNU REV MICROBIOL. 64, 313-329 (2010).
- Bialecka-Fornal, M., Lee, H. J., DeBerg, H. A., Gandhi, C. S., Phillips, R. Single-cell census of mechanosensitive channels in living bacteria. PLoS ONE. 7, e33077 (2012).
- Levina, N., et al. Protection of Escherichia coli cells against extreme turgor by activation of MscS and MscL mechanosensitive channels: identification of genes required for MscS activity. The EMBO Journal. 18, 1730-1737 (1999).
- Chiang, C. -. S., Anishkin, A., Sukharev, S. Gating of the large mechanosensitive channel in situ: estimation of the spatial scale of the transition from channel population responses. BIOPHYS J. 86, 2846-2861 (2004).
- Anishkin, A., Chiang, C. -. S., Sukharev, S. Gain-of-function mutations reveal expanded intermediate states and a sequential action of two gates in MscL. J GEN PHYSIOL. 125, 155-170 (2005).
- Sukharev, S. I., Sigurdson, W. J., Kung, C., Sachs, F. Energetic and Spatial Parameters for Gating of the Bacterial Large Conductance Mechanosensitive Channel, MscL. J GEN PHYSIOL. 113, 525-540 (1999).
- Deplazes, E., Louhivuori, M., Jayatilaka, D., Marrink, S. J., Corry, B. Structural investigation of MscL gating using experimental data and coarse grained MD simulations. PLOS COMPUT BIOL. 8, e1002683 (2012).
- Kubalski, A., Martinac, B. . Bacterial ion channels and their eukaryotic homologs. , (2005).
- Chang, G., Spencer, R. H., Lee, A. T., Barclay, M. T., Rees, D. C. Structure of the MscL homolog from Mycobacterium tuberculosis: a gated mechanosensitive ion channel. Science. 282, 2220-2226 (1998).
- Steinbacher, S., Bass, R., Strop, P., Rees, D. C. Structures of the prokaryotic mechanosensitive channels MscL and MscS. Mechanosensitive Ion Channels, Part A. , 1-24 (2007).
- Sukharev, S., Durell, S. R., Guy, H. R. Structural models of the MscL gating mechanism. BIOPHYS J. 81, 917-936 (2001).
- Perozo, E., Cortes, D. M., Sompornpisut, P., Kloda, A., Martinac, B. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418, 942-948 (2002).
- Betanzos, M., Chiang, C. -. S., Guy, H. R., Sukharev, S. A large iris-like expansion of a mechanosensitive channel protein induced by membrane tension. NAT STRUCT MOL BIOL. 9, 704-710 (2002).
- Corry, B., Jayatilaka, D. Simulation of structure, orientation, and energy transfer between AlexaFluor molecules attached to MscL. BIOPHYS J. 95, 2711-2721 (2008).
- Wang, Y., et al. Single Molecule FRET Reveals Pore Size and Opening Mechanism of MscL. eLife. 3, e01834 (2014).
- Anishkin, A., Akitake, B., Kamaraju, K., Chiang, C., Sukharev, S. Hydration properties of mechanosensitive channel pores define the energetics of gating. J Phys Condens Matter. 22, 454120 (2010).
- Koçer, A., Walko, M., Meijberg, W., Feringa, B. L. A light-actuated nanovalve derived from a channel protein. Science. 309, 755-758 (2005).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. Mechanosensitive Channels Activity in a Droplet Interface Bilayer System. MRS Proceedings. 1621, (2014).
- Fox, R. O., Richards, F. M. A voltage-gated ion channel model inferred from the crystal structure of alamethicin at 1.5-Å resolution. Nature. 300, 325-330 (1982).
- Iwamoto, M., Oiki, S. Contact Bubble Bilayers with Flush Drainage. Sci Rep. 5, (2015).
- Barriga, H. M., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. J R Soc Interface. 11, 20140404 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。