Method Article
Multifonctionnel, Micropipette à base Méthode de constitution et la stimulation de la société Bacterial mécanosensible Canaux ioniques en gouttelettes interface Bilayers
Dans cet article
Résumé
Canaux mécanosensibles bactériennes peuvent être utilisés comme capteurs dans des dispositifs mécano biomoléculaires. Bicouches gouttelettes d'interface (DIB), blocs de construction inspiré de cellule à ces dispositifs, représentent de nouvelles plateformes pour intégrer et stimuler les canaux mécanosensibles. Ici, nous démontrons une nouvelle méthode de formation de DIB, permettant l'étude des canaux mécanosensibles sous stimulation mécanique basé micropipette.
Résumé
MscL, un canal mécanosensible grande conductance (MSC), est une soupape de libération osmolyte omniprésente qui aide les bactéries survivent chocs hypo-osmotique brusques. Il a été découvert et étudié rigoureusement en utilisant la technique de patch-clamp pendant près de trois décennies. Son rôle de base de la conversion tension appliquée à la membrane cellulaire en réponse à perméabilité en fait un candidat solide pour fonctionner comme un transducteur mécano biomoléculaires dans des dispositifs à base de membranes artificielles. Servir comme blocs de construction de tels appareils, bicouches d'interface des gouttelettes (de DIB) peuvent être utilisés comme une nouvelle plateforme pour l'intégration et la stimulation des canaux MscL. Ici, nous décrivons une méthode basée micropipette pour former DIB et de mesurer l'activité des canaux MscL incorporés. Cette méthode consiste à gouttelettes aqueuses lipides enfermé ancrés aux conseils de deux opposées (coaxiale) positionnés micropipettes de verre borosilicate. Lorsque les gouttelettes sont mises en contact, une interface bicouche lipidique estformée. Cette technique permet de contrôler la composition chimique et la taille de chaque gouttelette, ainsi que les dimensions de l'interface à deux couches. Ayant l'une des micropipettes attachés à un actionneur piézo-électrique harmonique permet de délivrer une impulsion d'oscillation désirée. Grâce à l'analyse de la forme des gouttelettes lors de la déformation, la tension créée à l'interface peut être estimée. En utilisant cette technique, la première activité des canaux MsCl dans un système de DIB est rapporté. Outre les canaux MS, activités d'autres types de canaux peuvent être étudiés en utilisant cette méthode, prouvant la multi-fonctionnalité de cette plate-forme. La méthode présentée ici permet la mesure des propriétés de la membrane fondamentale, offre un plus grand contrôle sur la formation des membranes symétriques et asymétriques, et est une autre façon de stimuler et étudier canaux mécanosensibles.
Introduction
Dans la dernière décennie, l'assemblage des bicouches lipidiques artificielles a été avancé à travers sensiblement la mise au point de la méthode de la double couche d'interface des gouttelettes. Connu comme stable et robuste, DIB se sont imposés comme des systèmes de modèle alternatif à la classique peint (Mueller) et pliés (Montal-Mueller) planes bicouches 1. Bien que l'idée d'utiliser des gouttelettes de créer bicouches lipidiques remonte aux années 1960 2, il n'a pas gagné en popularité jusqu'à récemment. La première tentative réussie a été rapporté par le groupe Takeushi 3, suivie par plusieurs études démontrant la formation de bicouche en utilisant un réseau de gouttelettes par le groupe Bayley 4-6. Plus récemment, des techniques d'encapsulation ont été proposées par le groupe Leo 7-9, qui a lancé le concept de l'utilisation de fichiers DIB comme blocs de construction de 10 nouveaux systèmes matériels stimuli-sensibles. Dans des études antérieures, DIB ont prouvé leur capacité à répondre à 9,11 électrique, chemical 10,12, et 13 stimuli optique. Diverses biomolécules avec des fonctionnalités différentes de stimuli-sensibles ont été effectivement stimulé lorsqu'il est reconstitué dans la DIB 10,14. À la lumière de ces tentatives réussies une question importante se pose: la DIB pourrait répondre à un stimulus mécanique lors de biomolécules appropriées sont incorporés? Les forces interfaciales agissant sur un DIB diffèrent de ceux des autres 15,16 système bicouche. Par conséquent, la tension dans la bicouche est tenue par des gouttelettes peut être contrôlée par le contrôle de la tension aux interfaces eau-lipide-huile; un concept pas applicable aux systèmes bicouches peintes ou pliées.
MscL canaux, largement connu que les vannes osmolyte de libération et les éléments fondamentaux de la membrane cytoplasmique bactérienne, réagissent à l'augmentation de la tension de la membrane 17,18. Dans le cas de chocs hypo-osmotique, plusieurs canaux résidant dans la membrane d'une petite cellule 19 peut générer un masréponse de perméabilité sive pour libérer rapidement les ions et les petites molécules, sauver les bactéries de lyse 20. Biophysique, MscL est bien étudié et caractérisé principalement par le biais de la technique de patch clamp éminent 21-23. Modèles structurels fiables expliquant le mécanisme de déclenchement de 24,25 de MscL sont proposées sur la base de la structure de son homologue de cristal 26,27, 28 modélisation, et les résultats d'une expérimentation 24,29-31. Sous une tension appliquée de ~ 10 mN / m, le canal fermé qui est constitué d'un faisceau serré des hélices transmembranaires, se transforme en un anneau d'hélices fortement inclinés formant un ~ 28 Å rempli d'eau pores conducteur 21,24,32. Il a également été établi que le caractère hydrophobe de la porte étanche, placé à l'intersection des domaines TM1 interne, détermine le seuil d'activation de la voie 33. En conséquence, il a été trouvé que l'hydrophobicité en diminuant de la porte, le tensioseuil de n 22 pourrait être abaissé. Cette propriété de MscL rendu possible la conception de diverses vannes contrôlables 34, principalement à des fins de délivrance de médicaments. Pour toutes les propriétés mentionnées ci-dessus et sur la base de son rôle fondamental de traduire la membrane cellulaire des tensions excessives dans les activités électrophysiologiques, MscL fait un grand ajustement comme un transducteur mécano dans DIB.
Dans cet article, nous présentons une méthode basée sur la micropipette d'origine pour former des DIB et de mesurer l'activité des canaux MscL constituée en vertu de la stimulation mécanique. Nous rapportons pour la première fois, la réponse de DIB à un stimulus mécanique et la reconstitution fonctionnelle du mutant V23T faible seuil de MscL dans DIB 35.
Le système expérimental est constitué de lipides enfermé gouttelettes aqueuses ancrés aux conseils de deux micropipettes de verre borosilicate opposées. Lorsque les gouttelettes sont mises en contact d'une interface de bicouche lipidique est formée. Cette technique permet de contrôler la composition chimique et la taille de chaque gouttelette (en vrac), ainsi que les dimensions de l'interface à deux couches. En outre, des membranes asymétriques avec différentes compositions lipidiques dans chaque feuillet pourraient facilement être formés. Ayant l'une des micropipettes attachés à un actionneur piézo-électrique harmonique, permet d'appliquer un seul cycle préprogrammé ou stimulus oscillatoire. La tension est fournie à la membrane artificielle par la compression de deux gouttelettes qui le soutiennent. À la suite de la déformation de la gouttelette, les domaines de l'eau-huile-lipide interfaces augmentation, et simultanément l'angle entre les gouttelettes diminue, ce qui provoque une augmentation de la tension de la membrane et MscL activation transitoire. Grâce à l'analyse de la forme des gouttelettes lors de la déformation, la tension créée à l'interface peut être estimé. Même si l'accent dans cet article est sur les propriétés mécano-transduction de la DIB, nous soulignons également que d'autres types de biomolécules, telles que alaméthicine, peuvent être activés par cette plate-forme multi-fonctionnel. Nous présentons ici, tous les aspects techniques de la préparation, de l'assemblage, et en prenant des mesures avec cette nouvelle méthode d'une manière étape-par-étape.
Protocole
1. Préparation d'hydrogels de PEG-DMA
- Sélectionnez un récipient de mesure / mélange approprié (flacon, gobelet, etc.) Pour l'application. Nettoyez soigneusement avec du détergent et de l'eau, puis essuyez-le avec essuie chiffon non pelucheux.
- Portez des gants pour éviter de contaminer la verrerie avec les huiles du bout des doigts. Rincer le récipient avec de l'eau déminéralisée suffisant pour enlever les résidus de détergent.
- Essuyez le récipient avec un tissu non pelucheux pour se débarrasser de l'eau, puis vaporiser avec de l'alcool isopropylique (IPA, 99,5%) et essuyer jusqu'à ce que propre. Placez-le dans une chambre à vide pour permettre à tous IPA pour évaporer complètement. Nettoyez le reste du matériel de laboratoire utilisé dans le processus de formation d'hydrogel avec de l'eau distillée.
- Pour préparer un 40% (p / v) de solution de PEG-DMA hydrogel, pèse 4 g de poly (éthylène-glycol) diméthacrylate (PEG-DMA; MM = 1000 g / mol) polymère en utilisant une échelle de laboratoire.
- Placez le PEG-DMA pesé dans flacon et de la chaleur en utilisant un bain de sonication à 45-55 ° C jusqu'à ce que le solide PEG-DMA a liquéfié. Pendant le processus, couvrir l'ouverture de la fiole avec Parafilm papier / de cire pour empêcher l'eau.
- Une fois que le PEG-DMA a liquéfié, ajouter la solution tampon (500 mM de KCl, 10 mM de MOPS, pH 7,0) jusqu'à ce que le volume total atteint ~ 10 ml (suffisamment pour plusieurs expériences sur une période de six mois).
- Ajouter l'agent de durcissement à raison de 0,5% (p / v). Dans ce cas, ajouter 0,05 g de l'agent de durcissement au mélange 10 ml. Placer le ballon dans le bain de sonication et permettre aux composants de se dissoudre dans la solution (environ 10 min, à 250 watts).
NOTE: Une fois que l'agent de durcissement a été ajouté à la solution, les hydrogels permet de guérir (consolider) en cas d'exposition à une source de lumière pour un laps de temps suffisant. Pour lutter contre cela, envelopper le flacon / récipient avec du ruban adhésif noir et le stocker dans un endroit sombre. Cette solution peut être conservée pendant plusieurs semaines à température ambiante (22 ° C).
2. Préparation de Liposomes
- Préparer 10 ml d'une / ml de solution de 2 mg de lipide par addition de 10 ml de tampon (500 mM de KCl, 10 mM de MOPS, pH 7,0) à 20 mg de 1,2-sn-glycéro-diphytanoyl- 3-phosphocholine (DPhPC) synthétique lipides achetés sous forme de poudre lyophilisée. Vérifiez que les deux vésicules lipidiques et solution tampon sont bien mélangés (le mélange doit avoir un aspect homogène et brumeux quand tout est dissous).
- Freeze (-20 ° C) et dégeler complètement le nouveau mélange de lipides pour un total de six fois. Laissez le dégel du mélange à la température ambiante, jamais dans un environnement chauffé.
- Utilisation d'une extrudeuse disponible dans le commerce, extruder les lipides tout en forçant la suspension de lipides à travers un filtre première membrane de polycarbonate de 0,4 um et ensuite six fois à travers un filtre de 0,1 um de la membrane. Ce procédé permet d'obtenir des particules ayant des diamètres proches de 100 nm (égal à la taille des pores du filtre).
NOTE: D'autres lipides et les ratios lipidiques peut être préparé en utilisant cela methode. Liposomes doivent être conservés à 4 ° C pendant plusieurs semaines.
3. Isolement et MscL Reconstitution
- Tués sur une plaque d'agarose de température, contenant 100 ug / ml d'ampicilline, E. MJF465 cellules coli avec un plasmide portant le gène pB10b V23T MscL prolongé avec une étiquette 6-His à l'extrémité 3 '(C-terminale). Permettre à la plaque de la nuit de la culture (12-16 h) à 37 ° C dans un incubateur stationnaire. Le plasmide est choisi et retenu dans les cellules avec 100 ug / ml d'ampicilline dans un milieu LB standard. Le prochain endroit de jour 20 ml de milieu LB avec 100 pg / ml d'ampicilline dans une vésicule de culture (un flacon de 50 ml ou de ce qui est disponible pour maintenir la culture). Prenez la plaque qui a été cultivé pendant une nuit, puis sélectionnez une colonie de la plaque de transfert (inoculer) au prêt de 20 ml du milieu LB avec un bâton inoculation stérile. Laisser la culture de 20 ml de croître pendant la nuit (12-16 h) à 37 ° C à 250 tpm dans un incubateur à agitation.
- Décanter le 20 ml overnculture ight dans 2-4 L de milieu LB. L'ampicilline est plus nécessaire. Agiter les flacons dans un incubateur à agitation à 250 tours par minute à 37 ° C jusqu'à DO 600 atteigne 0,5. Ajouter isopropilene β-D-1-thiogalactopyranoside (IPTG) à une concentration finale de 0,6 mM et laissez la culture aller pendant une heure (à DO600 = 0,8-1,0).
- Mettez les flacons sur la glace pour refroidir les cultures et collecter les bactéries par centrifugation. Utilisez six tubes coniques 400 ml (ou autant que permis par le rotor utilisé) et centrifuger pendant 5-8 min à 7438 xg qui est suffisant pour sédimenter les bactéries. Décanter le surnageant, et répéter la procédure jusqu'à ce que toutes les cellules des médias sont récoltées. Le nombre de tours requis varie en fonction de la quantité de la culture qui a été cultivé et le rotor utilisé. Pour un 2 L culture, il est seulement nécessaire de tourner vers le bas les cellules une fois. Transférez toutes les cellules récoltées dans un tube de centrifugeuse unique.
- Reprendre les culots cellulaires à ~ 20 ml de tampon de presse française (KP 100 mMi et 5 mM de MgCl2, pH 7,4). La suspension devrait être dense (comme la crème ou du lait). Immédiatement avant-français appuyant sur la suspension ajouter le fluorure de phénylméthylsulfonyle d'inhibiteur de protéase (PMSF) à une concentration finale de 2 mM et mélanger vigoureusement.
- Français-appuyez sur la culture, dans une cellule française de pression de 35 ml, à 10.000 à 16.000 psi. Isoler la suspension pour séparer les cellules non rompues à 7438 xg, 10 min à 4 ° C.
- Mettez le surnageant dans un tube séparé, et ajoutez-y le lysozyme et DNase (0,2 mg / ml chacun). Laissez-linge surnageant pendant 10 min à température ambiante.
REMARQUE: DNase est facultative; elle réduit la viscosité de la centrifugation à grande vitesse. Le lysozyme est critique; il digère les restes de la paroi cellulaire et permet d'augmenter le rendement de l'extraction de la membrane fait avec un détergent doux non dénaturant.
- Distribuer le mélange de surnageant dans deux tubes d'ultracentrifugation et tourner eux à106,883-153,911 xg (selon le rotor) à 4 ° C pendant 40 min. Après centrifugation, le surnageant est décanté et le culot au fond brunâtre (la fraction totale de la membrane) peut être congelé dans le tube pour le stockage à long terme (- 80 ° C) ou utilisé pour la purification de la protéine immédiate.
- Préparer 0,5-1 L de tampon Haute Imidazole: 100 mM de NaCl + mM d'imidazole 500, titrer à pH 7,2-7,4 avec HCl concentré. Notez que imidazole est une bonne substance tampon par lui-même.
- Préparation de 0,5 à 1 L de tampon imidazole Low: NaCl 100 mM, imidazole 15 mM +, en diluant de manière appropriée avec le tampon ci-dessus 100 mM de NaCl. Aucun ajustement de pH est nécessaire.
- Prendre 100 à 150 ml de chaque tampon dans des flacons séparés, et à 1% (p / v) b-octyl glucopyranoside (OG). Bien agiter la solution et filtrer à travers un filtre de 0,22 um. Ces solutions sont les solutions de chromatographie basse et haute imidazole.
- Préparer tampon d'extraction, prendre 50 ml de tampon Basse-imidazole, et ajoutez 3% (p / v)OG et filtrer le tampon.
- Utilisez pastilles membranaires de 0,5-2 g de poids humide pour l'isolement de la protéine. Ajouter 5-7 ml de tampon d'extraction, resuspendre le culot, et l'homogénéiser dans un homogénéiseur verre-piston 30 ml entraînée à la main. Avec 5-10 caresses faire une suspension homogène sans grumeaux. Faites preuve de prudence, contrainte de cisaillement est connu pour provoquer la dénaturation des protéines.
- Isoler les particules insolubles (milieu de gamme de centrifugeuses, à angle fixe rotor, 38,478-68,405 XG, à 4 ° C pendant 15 min). Pendant ce temps, prendre 3 ml de perles Ni NTA (6 ml de suspension) et les laver une fois avec le tampon de faible imidazole (w / o OG) en les secouant dans un 15 ml à bouchon à vis tube. Laissez les billes se déposent sur le fond (~ 5-7 min) ou spin-les à 129-201 g pendant une minute à 4 ° C. Une fois la pastille est formée, décanter soigneusement le surnageant par la main et répétez la procédure. Equilibrer les billes avec 2-3 ml de tampon d'extraction de OG 3%.
- Mélanger le mélange homogénéisé (culot de membrane et un tampon d'extraction) à partir de trois.12 avec 3-3,5 ml perles Ni NTA. Laissez la chute de mélange dans un tube à bouchon à vis pour 60 min (lot-chargement). Faites tourner les billes vers le bas à 201 xg (30 sec), décanter le surnageant par la main, et se laver les billes avec 1% OG tampon faible imidazole fois. Pellet les perles comme en 3.13 à nouveau et remettre en suspension dans 20-30 ml de tampon frais à faible imidazole.
- Emportez une petite colonne (équipé d'une carte de débit supérieure) avec les perles Ni NTA, et laisser les perles se déposent en ouvrant le robinet de laisser le flux d'extrait à travers (ne pas laisser les perles à sec). Laver les billes avec une aliquote de 10 ml à faible imidazole tampons (1% OG) avec le robinet d'arrêt ouverte.
- Charger la machine de la chromatographie avec faible pur et de haute tampons imidazole à environ 25 ml de chaque à la vitesse d'écoulement de la machine défini (varie par machine); cela se fait par passage du tampon imidazole-bas par l'intermédiaire du premier système. Zéro l'enregistreur optique à 260 OD (ligne de base). Notez que le tampon est tout à fait différente de l'eau parce imidazole de bas grade a impurities qui absorbent les UV. Insérez l'adaptateur de courant à la colonne et l'attacher à la machine.
- Laver la colonne à nouveau avec un tampon à faible imidazole (à 1 ml / min) jusqu'à ce que la DO de l'écoulement à travers la ligne de base est atteint (il peut prendre 10-20 ml). Cela supprime les protéines non liées à partir de la colonne.
- Appliquer un gradient linéaire d'imidazole de 20 à 500 mM, pendant 30 minutes, à 1 ml / min. Début de la collecte fractions de 4 ml quand OD 600 montre une augmentation. Les deux premières fractions sont pleins de protéines liées de manière lâche, alors que MscL-6His commence son élution à environ 40% du gradient linéaire. La majorité de la protéine apparaît dans les fractions 3 à 8.
REMARQUE: une augmentation linéaire de OD sera observée en raison de l'augmentation% d'imidazole. - Rassembler les fractions 4/3, 6/5, 8/7 et ensemble. Eventuellement, on concentre les fractions individuellement. Concentrer les fractions 6-10 fois en utilisant des filtres centrifuges. Après un spin de 20 min à 804 xg et à 4 ° C, mélanger soigneusement la protéine concentrée,la protéine a tendance à coller au filtre.
- Retirer aliquotes de 50 ul, les mélanger avec un tampon d'échantillon SDS, et vérifier la pureté des protéines par électrophorèse sur gel de PAGE.
REMARQUE: MscL migre comme une bande floue d'environ 17 kDa à la partie inférieure du gel. - Les fractions concentrées à quantifier la protéine en utilisant un kit de dosage de protéine, en suivant les instructions du fabricant. Un rendement typique d'une membrane 0,8 g granulés est jusqu'à 0,2 mg de protéine pure dans les fractions combinées.
- Reconstituer V23T MscL dans des liposomes DPhPC par dialyse. Prendre une solution à 10 mg / ml de chloroforme et DPhPC aliquote de 0,5 ml (soit 5 mg de lipide) de celui-ci en trois jetable à fond rond (12 x 130 mm) des tubes de verre. Sécher le lipide sous le jet d'azote et enlever les restes de chloroforme sous vide (4-6 h).
- Ajouter 15 mg de 20 poudre OG au lipide sec dans chaque tube, le dissoudre dans 2 ml de tampon de dialyse (100 mM de KCl, 5 mM de KPi, pH 7,2), vortex, et misonicat ldly. Les lipides OG-solubilisé devraient former une solution claire.
- Ajouter V23T solutions concentrées MsCl dans chaque tube à atteindre 1: 100, 1: 300 et 1: 1,000 protéine-lipide à-vortex et ainsi des ratios. Couper et laver trois pièces (~ 12 cm de long) du tube de dialyse (MWCO 8000, diamètre de 7,5 mm, ont trois paires de clips numérotés prêts.)
- Placez les mélanges lipides-protéines solubilisées à l'intérieur du tube, fermer soigneusement les extrémités avec des clips, et dialyser contre 2 litres de tampon (100 mM de KCl, mM KPi 5, pH 7,2) pendant 48 heures à 4 ° C avec quatre changements de la tampon toutes les 12 heures. Après dialyse, les Proteo-liposomes sont prêts.
REMARQUE: La solution de liposome peut être complété avec 2 mM de NaN3 (de l'azoture de sodium) et stocké à 4 ° C. Éviter le gel.
4. Fabrication du réservoir d'huile
- Percez deux trous opposés (1,0 mm de diamètre) tout le chemin à travers la paroi d'un diamètre de 2 pouces, 1,5 cm de long acrylique cylinder à 1 cm du fond (figure 1A).
- Percez deux trous de 4 mm concentriques à l'précédemment forés 1 mm trous. Les profondeurs des trous doit être de 1 mm chacune (assurez-vous de ne pas percer tout le chemin). Ces trous sont faites pour adapter les joints en caoutchouc.
- La place et de la colle de deux joints en caoutchouc ayant des diamètres internes de 1 mm dans les trous plus grands afin d'éviter les fuites d'huile.
- Collez le cylindre usiné pour 10 cm x 10 cm de la feuille acrylique mince en utilisant n'importe quel époxy polyvalente (Figure 1).
Le jour de l'expérience:
5. Préparation d'électrodes
- Couper une longueur de 7 cm de deux fils d'argent 250 um de diamètre, puis plonger leurs conseils à l'eau de Javel pour deux heures pour former un chlorure d'argent (AgCl) de revêtement. Une couleur grise indique qu'un revêtement AgCl a été formé (figure 2E).
- Utilisation d'un coupe-verre, diviser un 10 cm de long, 1 / 0.58 OD / ID mm Capil de classe de borosilicatelary en deux 5 cm capillaires.
- En utilisant une aiguille de calibre 34 Microfil remplir les capillaires avec l'hydrogel PEG-DMA. Pour éviter l'hydrogel hydraté de l'enflure du capillaire, garder un dégagement de 3 mm sur les conseils et assurez-vous qu'il n'y a pas de bulles d'air dans les capillaires.
- Insérer les électrodes Ag / AgCl dans l'hydrogel rempli capillaires (figure 2e).
- Guérir l'hydrogel PEG-DMA par photopolymérisation radicaux libres lors de l'exposition à la lumière UV pendant 2 min à 1 W en utilisant un pistolet spot UV.
6. Configuration de l'Expérience
NOTE: L'expérience est installé dans une cage de Faraday à la terre pour une connexion de terre de l'amplificateur de patch.
- Fixez l'un des micropipettes à un titulaire de microélectrodes droite qui a un connecteur mâle (figure 2E).
- Connectez le support de microélectrodes à l'headstage de l'amplificateur de patch (figure 2A). Pour connecter le HEAdstage à la terre, souder un fil de cuivre isolé de calibre 18 à un connecteur approprié pour le headstage.
- Montez le headstage sur un 3-axe micromanipulateur manuel. Fixez la plaque de montage headstage (il devrait être acheté avec le micromanipulateur ou fait sur mesure dans un atelier d'usinage) au micromanipulateur puis connectez le headstage à la plaque de montage en utilisant des vis appropriées.
- Attacher le deuxième micropipette à l'actionneur linéaire à travers un connecteur de laboratoire faites et ensuite monter à la fois sur un deuxième micromanipulateur (figure 2B). Les micropipettes devraient être opposés l'un à l'autre, alignés et nivelés horizontalement. Remarque: la marque et le style des manipulateurs ne comptent pas.
- Dans un flacon en verre, mélanger 0,1 ml de liposomes DPhPC avec 0,01 ml de la solution de protéoliposome V23T MscL.
Remarque: Cette étape est nécessaire pour réduire le rapport protéines-lipides (~ 0,0002), ce qui est essentiel à la formation d'un lipide bilaye stabler.
- En utilisant une aiguille de calibre 34 Microfil, remplissez les conseils des deux micropipettes avec protéoliposome solution (figure 3A).
- Placez le réservoir sur le dessus d'un microscope droit, et de nourrir les micropipettes à travers les trous opposés 1 mm (figure 2B). REMARQUE: toute microscope pourrait être utilisé tant dans les gouttelettes peuvent être clairement visibles.
- Remplir le réservoir à la surface avec hexadécane (99%). L'hexadécane n'a pas besoin de purification ultérieure.
- Pour former les gouttelettes sphériques à la pointe des micropipettes, utiliser un troisième 10 um diamètre micropipette en verre borosilicate, monté sur un troisième micromanipulateur, pour distribuer la solution de V23T dilué MscL de protéoliposome (~ 0,00052 ml) à la pointe des micropipettes et former le des gouttelettes (figure 3).
- Contrôler la taille des gouttelettes (en diminuant ou en augmentant le volume) comme désiré et laisser reposer pendant 10 minutes pour former des monocouches de complètement (Figure 3).
- Amener les gouttelettes en contact, la formation de bicouche aura lieu dans 1 à 2 min.
7. Configuration du logiciel et de l'équipement
- Préparer le logiciel en tournant sur les ordinateurs, microscopes, contrôleur de l'oscillateur piézo-électrique, générateurs de fonctions, l'amplificateur de patch, et le système d'acquisition de données à faible bruit.
REMARQUE: un amplificateur de patch peut être utilisé et les instructions suivantes sont spécifiquement pour celui que nous avons utilisé et qui est répertorié dans la liste des matériaux et de l'équipement. - Sur le panneau avant de l'amplificateur de patch, de placer le bouton «Mode» pour VHOLD / IHOLD et V-Clamp.
- Sur le panneau avant réglé le "passe-bas" filtre de Bessel à 1 kHz et gain de sortie à 2.
- Réglez le "Configuration" à l'ensemble de β CELL = 1.
- Assurez-vous que le reste des boutons sont mis à zéro ou en position neutre.
- Échantillonner toutes les mesures actuelles DIB à 5 kHzavec un filtre de Bessel anti-aliasing de 1 kHz.
- Exécutez le logiciel en double-cliquant sur l'icône sur le bureau.
- Cliquez sur "Configurer> Digitizer" pour ouvrir la boîte de dialogue "Digitizer", puis cliquez sur le bouton "Modifier".
- Dans la boîte de dialogue "Changer Digitizer", sélectionnez "Digidata 1440 Series" de la liste "Digitizer Type".
- Cliquez sur le bouton Scan pour détecter le numériseur.
- Cliquez sur "OK" pour quitter la boîte de dialogue "Changer Digitizer", puis cliquez sur "OK" pour quitter la boîte de dialogue "Digitizer".
- Cliquez sur "Configurer> paillasse".
- Dans l'onglet Signaux d'entrée de la table de laboratoire, sélectionnez analogique dans un sous Digitizer Chaînes. Réglez le facteur d'échelle à 0,002.
8. La formation de la bicouche lipidique
- L'utilisation d'un câble BNC, branchez la sortie de awgénérateur aveform à l'avant d'entrée de commande externe commuté (sur le panneau arrière du système d'acquisition de données). Envoyer une forme d'onde 10 Hz, 500 mV crête-à-crête triangulaire à l'headstage.
- Utilisation du micromanipulateur, déplacer les micropipettes de verre horizontalement pour apporter les gouttelettes en contact jusqu'à ce qu'ils touchent légèrement et attendre bicouche amincissement de se produire (généralement autour de 1 à 2 min) (figures 3C et 3D).
REMARQUE: La progression du processus de formation de la bicouche peut être vu visuellement au microscope et peut être contrôlée par la mesure du courant (figure 4).
- Ajuster la taille de la bicouche (~ 250 um de diamètre) en contrôlant la position de la gouttelette monté sur l'actionneur, à l'aide du micromanipulateur. Remarque: la taille de la bicouche peut être estimée visuellement à travers le microscope. Cette méthode rend plus facile pour le chercheur de contrôler la taille de la bicouche facilement pardéplacer les gouttelettes en utilisant les micromanipulateurs.
9. excitation dynamique et MscL Gating
- Une fois que le bicouche est formé et est stable (à savoir la double couche est non conductrice ou rupture), de stimuler les gouttelettes par l'envoi d'un signal sinusoïdal à l'aide d'un générateur de fonction.
- Pour stimuler la protéine MscL incorporé dans la bicouche, envoyer une onde sinusoïdale avec une amplitude de 175 um crête-à-crête, la fréquence de 0,2 Hz, et le cycle de service de 50% à la servo-contrôleur piézoélectrique. (Différents types de formes d'onde peuvent être envoyés avec des amplitudes différentes, les fréquences et cyclique)
10. Traitement et Interprétation des résultats
- Sauvegardez les mesures actuelles, enregistrées en utilisant le système d'acquisition de données, en format .ABF. Importation de données (en format .ABF) à Matlab en utilisant un fichier de fonction "abfload", puis analyser et traiter les données. Le fichier "abfload" est disponible gratuitement en ligne.
- Estimation til tension dans la bicouche et l'expansion de surface des gouttelettes, en utilisant des vidéos de la goutte pendant les cycles d'actionnement complets qui sont enregistrés à l'aide d'une caméra appropriée.
- Vidéos de processus dans Matlab, par le traitement des images individuelles en utilisant des techniques de traitement d'image pour estimer la superficie de l'interface eau / huile, ainsi que l'angle entre les gouttelettes. NOTE: l'utilisation d'une trame 2D prise de la vidéo, la détection de l'interface eau-huile (par exemple le bord de la goutte), puis estimer la surface de révolution.
Résultats
Figures 1 et 2 affichage de la configuration et de l'équipement expérimental utilisé pour enregistrer l'activité de la protéine au cours de la stimulation mécanique de la membrane bicouche lipidique. Pour minimiser le bruit électrique dans nos mesures, le poste de travail est placé dans une cage de Faraday de laboratoire réalisés, à la terre pour une connexion de terre sur la Axopatch 200 B Amplificateur.
Formation d'une écurie isolant bicouche lipidique est une étape clé dans cette étude. Dans cet agencement, une monocouche lipidique assemble à l'interface huile / eau des gouttelettes aqueuses immergés dans un bain d'un solvant organique. Lorsque les gouttelettes sont mises en contact, l'excès d'huile est éliminée, et les monocouches lipidiques opposées mince à une épaisseur de deux molécules bicouche lipidique. La technique la plus couramment utilisée dans la caractérisation bicouche est voltage-clamp. Avec voltage-clamp, la tension aux bornes de la double couche est maintenue à une valeur constante tandis que le courant est mesuré. Figure 4 dépeint un enregistrement actuel en temps réel typique de la formation initiale de la bicouche. La connaissance de la capacité spécifique (~ 0,6 uF / cm 2) de la 5 bicouche lipidique DPhPC, la zone de la bicouche formée a pu être calculée. La zone de la bicouche peut être contrôlée en changeant la position des gouttelettes (figure 4A). Utilisation de l'actionneur piézo-électrique, différents types de formes d'onde (sinusoïdale, carrée, triangulaire, etc.) À des fréquences différentes, des amplitudes et des cycles de service pourraient être appliquées aux gouttelettes à horizontalement et axialement entre eux oscillent et donc, la tension de la bicouche et de la zone pourraient être modifiées (Figure 4B).
Si la DIB est mécaniquement stimulée, tout en conservant un potentiel continu constant à travers la membrane, un seuil bas (gain de fonction) mutant V23T de MscL génère des activités fiables, y compris surtout les États sous-conducteurs et des événements parfois pleins d'ouverture (Figure 5) . Ces events sont identiques à ceux enregistrés en utilisant la technique patch-clamp de membranes intactes intérieures E. coli et des liposomes reconstitués avec le V23T MscL purifiée. Les résultats de la figure 5 montrent que déclenchement se produit en réponse à une augmentation de la tension, étant donné que toutes les pointes de courant sont observés à la compression maximale. Au compression de crête, l'expansion par rapport surfacique des gouttelettes est maximale et, par conséquent, la tension à l'interface est maximale.
Alaméthicine, un canal ionique voltage-dépendant et l'un des peptides les plus étudiés, augmente la perméabilité de la membrane lorsqu'une tension continue est appliquée à travers la membrane 36. La capacité de l'interface lipide bicouche d'accueillir transmembranaires protéines et des peptides est également testée en effectuant des enregistrements de courant à tension gating en utilisant alaméthicine peptide. Alaméthicine est mélangé avec la solution de phospholipide à une concentration finale de 100 ng / ml. La figure 6 montre les mesures de courant de moins de pince de tension (115 mV). Les gouttelettes dans cette expérience sont séparés afin de réaliser petite interface à deux couches et donc une résistance plus élevée et plus faible capacité. Le comportement de déclenchement du peptide alaméthicine est représenté par les étapes discrètes de courant (figure 6). L'histogramme sur le côté droit de la parcelle présente les variations de la conductance de la niveau de base (0.0962 ns), qui est essentiellement le premier niveau de la chaîne elle-même de la conductance.

Figure 1:. Un schéma décrivant les principales parties et les dimensions du réservoir d'huile Le réservoir d'huile est fabriqué dans l'atelier d'usinage à Virginia Tech. Il se compose d'un tube cylindrique usiné acrylique collé à la surface d'une feuille acrylique. Les dimensions et le design peuvent être modifiés pour accueillir différentes applications ou plus de deux micropipettes./53362/53362fig1large.jpg "Target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
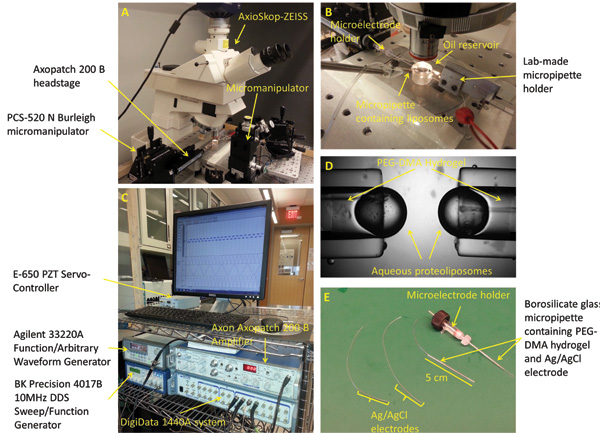
Figure 2:. Configuration et micropipettes expérimentale préparation (A) Le poste de travail standard pour former, mécaniquement stimulant, et la caractérisation des bicouches d'interface comprend un microscope, manipulateurs à 3 axes, un appareil photo numérique, un oscillateur piézo-électrique, table d'isolation des vibrations, et une cage de Faraday (pas montré). (B) Le dispositif expérimental se compose de deux opposés PEG-DMA hydrogel rempli micropipettes placés horizontalement dans un bain d'huile Hexadécane. Chacune des micropipettes contient une électrode Ag / AgCl pour fournir une connexion électrique. Un troisième micropipette remplie de protéoliposome solution est utilisée pour former des gouttelettes à la pointe des autres micropipettes. (C) La réponse en courant peut être mesuré de DIBen utilisant une combinaison de l'amplificateur de patch et le système d'acquisition de données à faible bruit. (D) Un fermé photo montrant les gouttelettes aqueuses formées à la pointe des micropipettes. Électrodes (E) Ag / AgCl sont fabriqués en trempant le bout de deux 250 um fils d'argent dans l'eau de Javel. Les électrodes sont ensuite introduites à travers les deux tubes capillaires en verre de borosilicate remplis d'hydrogel de PEG-DMA, qui est durci avec de la lumière UV à se solidifier. Le titulaire de microélectrodes droite avec connecteur mâle est utilisé pour connecter un des micropipettes à l'headstage de l'amplificateur de patch.
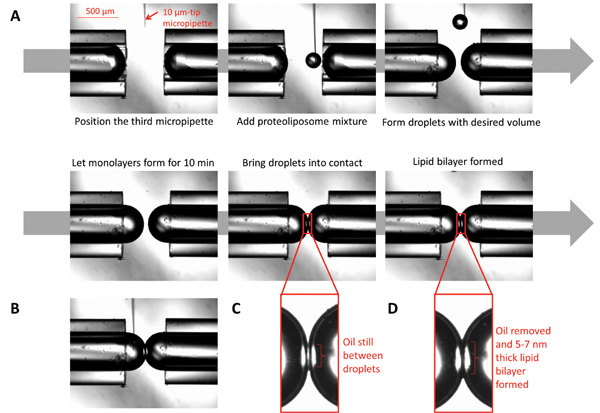
Figure 3:. Images qui illustrent la formation de bicouches gouttelettes d'interface (A) à 10 pm micropipette remplie de protéoliposomes est placé sous le microscope à proximité de la pointe de micropipette. En utilisant une seringue reliée à la micropipette, distribuer de petits volumesdes protéoliposomes pour former des gouttelettes sphériques de volume désiré. Laissez la forme de monocouche en permettant aux gouttelettes reposer pendant dix minutes. Apportez les gouttelettes en contact; la bicouche se forme après toute l'huile à l'interface est éliminée. (B) Pendant la bicouche est formé, la composition chimique des deux côtés de l'interface peut être contrôlé par l'injection de produits chimiques désirés au moyen d'un micro-taille micropipette. (C) Les gouttelettes au moment du premier contact. (D) Les gouttelettes lorsque la bicouche lipidique est formée.
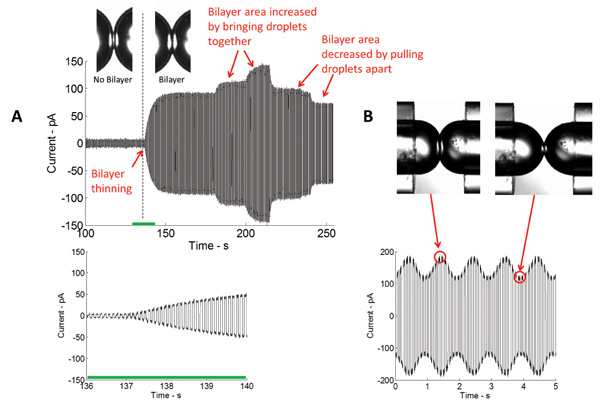
Figure 4: Mesures en temps réel montrent à la fois l'amincissement initial et l'expansion subséquente de l'interface (A) actuelle mesurée au cours de la formation de bicouche par l'application d'un potentiel électrique triangulaire.. L'intensité du courant mesurée est directement proportionnelle à la capacidistance, et donc la zone de l'interface à deux couches. Plus les gouttelettes sont amenées ensemble, plus la zone de l'interface et vice versa. (B) Lors de l'application de l'excitation mécanique, la zone de l'interface bicouches augmente et diminue à la même fréquence que le signal de stimulation.
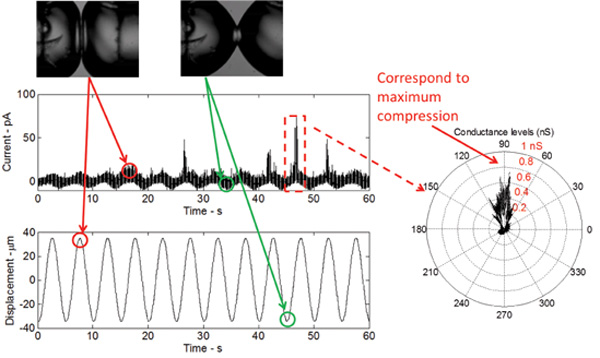
Figure 5:. Mesures en temps réel Les montrent la réponse de la bicouche à une excitation mécanique ainsi que le déclenchement du mutant V23T de MscL La forme de la réponse en courant est sinusoïdal, qui se rapporte à un changement sinusoïdal en bicouche capacité à la suite de le changement de zone de bicouche. Les pointes de courant, se produisant à la pointe de chaque cycle, indiquent sous-conductance déclenchement du mutant V23T. Un tracé polaire indique en outre que déclenchement se produit à la compression de pointe, ce qui reflète une augmentation de la tension à l'interface de la bicouche.
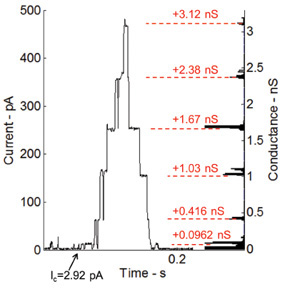
Figure 6:. Les mesures de courant dans le cadre de serrage et de tension correspondant histogramme de niveaux de conductance de l'activité de déclenchement de canaux incorporés alaméthicine Le comportement de déclenchement du peptide alaméthicine est signalée par l'augmentation par étapes discrètes en cours. Les niveaux de conductance correspondent très bien avec les mesures précédentes effectuées par notre groupe de recherche à Virginia Tech 7.
Discussion
Mécanosensibilité signifie l'une des premières voies de transduction sensorielle qui ont évolué dans les organismes vivants. L'utilisation de ce phénomène pour l'étude et la compréhension des propriétés mécano-électrique de la DIB, est une étape cruciale vers matériaux stimuli-sensibles fonctionnels. Elle implique l'incorporation et l'activation d'un canal mécanosensible, MscL, dans la DIB comme un transducteur mécano et une jauge de contrainte pour détecter l'augmentation de la tension dans l'interface lipidique bicouche. Sur une autre note, la fonction de canaux MS pourrait être réglementée par les propriétés du matériau de base de bicouches lipidiques, y compris l'épaisseur, la courbure intrinsèque, et la compressibilité. À la lumière de ce qui précède, la technique basée-micropipette fournit un outil précieux permettant au chercheur d'étudier la capacité des canaux dans la SEP DIB et donne un aperçu de la structure dans la bicouche lipidique, ainsi que les interactions lipide-protéine.
Au cours des trois dernières annéess, patch-clamp était la principale méthode pour étudier les canaux MS, car elle permet à la fois de la tension de serrage et de tension. Cependant, patch-clamp nécessite un équipement encombrant et ne convient pas pour la miniaturisation, une propriété nécessaire pour l'ingénierie des dispositifs sensoriels et de conversion. DIB en raison de leur simplicité, de stabilité, et la compacité représentent un environnement approprié pour étudier l'activité de MscL. Ici, nous présentons avances précédentes dans les techniques de formation DIB en proposant une technique basée micropipette, avec la capacité de contrôler la taille des gouttelettes et de l'interface de deux couches, la composition chimique de chaque gouttelette, et la tension à l'interface à travers la stimulation dynamique. La technique consiste à ancrer gouttelettes aqueuses, contenant des protéoliposomes, aux extrémités opposées de façon coaxiale capillaires en verre. Les gouttelettes sont placés dans un bain de solvant organique et lorsqu'ils sont mis en contact un lipide formes bicouches à l'interface.
Les micropipettes sont attachés à piezoelectric oscillateurs, ce qui permet un déplacement horizontal de gouttelettes. Comprimer dynamiquement les gouttelettes entraîne une augmentation de la tension interfaciale à l'interface eau-huile et donc une augmentation de la tension de la bicouche. Deux aspects majeurs différencient cette méthode à partir de la technique 37 contacts bulle similaire et a récemment publié bicouche (CBB). Utilisation de la technique présenté ici, la taille de la bicouche est contrôlé en utilisant des micromanipulateurs et donc les volumes des gouttelettes restent constantes, contrairement à la méthode CBB. En outre, la technique CBB appelle des pompes à pression, qui ne sont pas nécessaires dans la méthode présentée dans ce document rendant plus simple et plus facile à construire.
Nous sommes en mesure d'intégrer et de stimuler MscL bactérienne pour la première fois sans l'utilisation d'une pipette de patch ou de modifications chimiques 38. Étant donné que le système facilite la formation de membranes asymétriques robustes bicouches lipidiques, il imite plus étroitement la lasymétrie ipid trouvé dans les membranes biologiques. Cela nous permet d'étudier les effets de la composition de la membrane contrôlée ou d'asymétrie sur l'activité de MscL. En outre, grâce à des techniques de traitement d'image, ce procédé permet d'estimer la tension à l'interface de deux couches. Cette technique aide à comprendre les principes de interconversion entre les forces de surface et de volume dans la DIB, facilite les mesures des propriétés fondamentales de la membrane, et améliore la compréhension de la réponse à la membrane MscL tension.
Bien que cette méthode nous emmène un pas de plus vers un système matériel de stimuli-sensibles biomoléculaire et à un environnement physiologique différente pour étudier MscL, il ya des limites au système. La tension dans ce système ne peut pas être serré en raison de la présence du réservoir de lipide sous la forme de liposomes dans chaque gouttelette, ce qui tend à réduire la tension à l'interface huile / eau. Par conséquent, à l'heure actuelle les canaux mécanosensibles peut être stimuléedans DIB que dans un régime dynamique. La présence de bulles d'air dans le système affecte de manière significative la précision et la reproductibilité des expériences. Les bulles d'air présentes dans les hydrogels pourraient entraîner la perte si la connexion électrique.
Bien que nous décrivons l'utilisation de la méthode de la micro-pipette pour la stimulation de MscL, la technique peut être utilisée pour étudier d'autres types de canaux de sclérose en plaques et a le potentiel d'être utilisée par les chercheurs pour étudier une variété de biomolécules. Par exemple, la configuration similaire a été utilisée dans notre laboratoire pour étudier la réponse de mécano une interface gouttelette membrane bicouche libre en forme de canal. Diverses protéines pourraient être reconstituées et activés à l'aide de cette configuration très contrôlé, en prenant en considération que les environnements de reconstitution de chaque biomolécule varient. La méthode décrite dans cet article touche à un potentiel d'application beaucoup plus large qui est limitée seulement à l'imagination du chercheur.
Déclarations de divulgation
Les auteurs ont rien à révéler.
Remerciements
Recherche présentée dans cette publication est soutenue par l'Office de la Force aérienne de l'Initiative de recherche scientifique fondamentale Grant FA9550-12-1-0464.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Corning | 430624 | |
| 1,2-diphytanoy-sn-glycero-3-phosphocholine (DPhPC) | Avanti Polar Lipids | 850356P | Purchased as lyophilized powder |
| 34-gauge microfil | World Precision Instruments | MF24G-5 | |
| 400 mL Centrifuge bottels | ThermoFisher | 3141 | Nalgene |
| Agilent Function/Arbitrary Waveform Generator, 20 MHz | Keysight Technologies | 33220A | |
| Ampicillian | ThermoFisher | BP1760 | ACS Grade |
| Avanti® Mini-Extruder | Avanti Polar Lipids | 610000 | |
| Axio Scope.A1 | Carl Zeiss | - | |
| AxioCam HSm | Carl Zeiss | - | |
| Axopatch 200B Amplifier | Molecular Devices | - | |
| BCA protein assay kit | Pierce | 23225 | |
| BK Precision 4017B 10 MHz DDs Sweep/Function Generator | Digi-Key | BK4017B-ND | |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100F-4 | |
| Dialysis tubing | 7 Spectra/Por | 132113 | MWCO 8000, 7.5 mm diameter |
| DigiData 1440A system | Molecular Devices | - | |
| DNAse | Sigma-Aldrich | DN25 | |
| DPhPC | Avanti | 850356C | |
| E-625 PZT Servo-Controller | Physik Instrumente | E-526 | |
| FPLC System | Pharmacia Biotech | - | |
| HCl | J.T. Baker | 9535-33 | |
| Hexadecane, 99% | Sigma-Aldrich | 544-76-3 | |
| Homoginizer | Wheaton | 357426 | 15 mL |
| Imidazole | Sigma-Aldrich | I5513 | |
| IPTG | Affymetrix | 17886 | |
| IRGACURE® 2959 | IRGACURE® | 555047962 | |
| Isopore Membrane Filters | EMD Millipore | VCTP02500 | |
| Isopropyl Alcohol | VWR International | BDH1133-4LP | |
| KCl | Sigma-Aldrich | P3911 | ACS Grade |
| KH2PO4 | Mallinckrodt | 7100 | ACS Grade |
| Kimble-Chase | Kontes | 420401-1515 | Flex-Column |
| LED-100 UV Spot Curing System | Electro-Lite, corp. | 81170 | |
| Lysozyme | Sigma-Aldrich | L6876 | |
| Manual Patch-Clamp Micromanipulators | Thorlabs | PCS-520N | |
| MgCl2 | ThermoFisher | M33 | ACS Grade |
| Microelectrode Holder | World Precision Instruments | MEH1S | |
| Micropipette Puller | Sutter Instruments | P-1000 | |
| MOPS, minimum 99.5% titration | Sigma-Aldrich | M1254-100G | |
| N2 Gas | Airgas | UN1066 | |
| NaCl | EMD | SX0420-1 | ACS Grade |
| Ni NTA agarose beads | Qiagen | 1000632 | |
| Optically Clear Cast Acrylic Tube, 2-1/2" OD x 2" ID | McMaster-Carr | 8486K545 | |
| P-601 PiezoMove Flexure-Guided Linear Actuator | Physik Instrumente | P-601 | |
| PAGE gel | Bio-Rad | 456-9033 | |
| Parafilm M® All-Purpose Laboratory Film | Parafilm® | PM999 | |
| Phenylmethylsulfonyl fluoride | Sigma-Aldrich | P7626 | |
| Poly(ethylene glycol)1000 dimethacrylate | Polysciences, Inc. | 15178-100 | |
| Polycarbonate (PCTE) Membrane Filters, Black, 0.4 Micron, 25mm, 100/Pk | Sterlitech Corporation | PCTB0425100 | |
| Potassium Chloride | Sigma-Aldrich | P5405-500G | |
| Powder Free Soft Nitrile Examination Gloves | VWR International | CA89-38-272 | |
| Replacement Gasket 1.0mm | World Precision Instruments | GO1-100 | |
| SDS | Sigma-Aldrich | L5750 | |
| Silver wire | GoodFellow | 147-346-94 | Different diameters could be used depending on the application |
| Sodium Azide | Affymetrix | 21610 | |
| Test tubes | ThermoFisher | 14-961-27 | 12 x 130 mm |
| Tryptone | ThermoFisher | BP1421 | |
| Ultracal 30K | Millipore | UFC803024 | Amicore Ultra 30 MWCO |
| VWR Light-Duty Tissue Wipers | VWR International | 82003-820 | |
| VWR Scientific 50D Ultrasonic Cleaner | VWR International | 13089 | |
| Water Purifier | Barnstead | D11931 | |
| Yeast | ThermoFisher | BP1422 | |
| β-octylglucopyranoside | Anatrace | O311S |
Références
- Montal, M., Mueller, P. Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties. P NATL ACAD SCI USA. 69, 3561-3566 (1972).
- Tsofina, L., Liberman, E., Babakov, A. Production of bimolecular protein-lipid membranes in aqueous solution. Nature. , (1966).
- Funakoshi, K., Suzuki, H., Takeuchi, S. Lipid Bilayer Formation by Contacting Monolayers in a Microfluidic Device for Membrane Protein Analysis. ANAL CHEM. 78, 8169-8174 (2006).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. J AM CHEM SOC. 129, 8650-8655 (2007).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. J AM CHEM SOC. 130, 5878-5879 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nat Nano. 4, 437-440 (2009).
- Sarles, S. A., Stiltner, L. J., Williams, C. B., Leo, D. J. Bilayer formation between lipid-encased hydrogels contained in solid substrates. ACS APPL MATER INTER. 2, 3654-3663 (2010).
- Sarles, S. A., Leo, D. J. Regulated attachment method for reconstituting lipid bilayers of prescribed size within flexible substrates. ANAL CHEM. 82, 959-966 (2010).
- Sarles, S. A. . Physical Encapsulation of Interface Bilayers. , (2010).
- Sarles, S. A., Leo, D. J. Membrane-based biomolecular smart materials. SMART MATER STRUCT. 20, 094018 (2011).
- Sarles, S. A. The use of virtual ground to control transmembrane voltages and measure bilayer currents in serial arrays of droplet interface bilayers. SMART MATER STRUCT. 22, 094023 (2013).
- Sarles, S. A., Leo, D. J. Cell-inspired electroactive polymer materials incorporating biomolecular materials. SPIE Smart Structures and Materials+ Nondestructive Evaluation and Health Monitoring. , 797626 (2011).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130, 5878-5879 (2008).
- Bayley, H., et al. Droplet interface bilayers. MOL BIOSYST. 4, 1191-1208 (2008).
- White, S. H. Analysis of the torus surrounding planar lipid bilayer membranes. BIOPHYS J. 12, 432 (1972).
- Tien, H. T., Ottova, A. L. The lipid bilayer concept and its experimental realization: from soap bubbles, kitchen sink, to bilayer lipid membranes. J MEMBRANE SCI. 189, 83-117 (2001).
- Perozo, E. Gating prokaryotic mechanosensitive channels. NAT REV MOL CELL BIO. 7, 109-119 (2006).
- Kung, C., Martinac, B., Sukharev, S. Mechanosensitive channels in microbes. ANNU REV MICROBIOL. 64, 313-329 (2010).
- Bialecka-Fornal, M., Lee, H. J., DeBerg, H. A., Gandhi, C. S., Phillips, R. Single-cell census of mechanosensitive channels in living bacteria. PLoS ONE. 7, e33077 (2012).
- Levina, N., et al. Protection of Escherichia coli cells against extreme turgor by activation of MscS and MscL mechanosensitive channels: identification of genes required for MscS activity. The EMBO Journal. 18, 1730-1737 (1999).
- Chiang, C. -. S., Anishkin, A., Sukharev, S. Gating of the large mechanosensitive channel in situ: estimation of the spatial scale of the transition from channel population responses. BIOPHYS J. 86, 2846-2861 (2004).
- Anishkin, A., Chiang, C. -. S., Sukharev, S. Gain-of-function mutations reveal expanded intermediate states and a sequential action of two gates in MscL. J GEN PHYSIOL. 125, 155-170 (2005).
- Sukharev, S. I., Sigurdson, W. J., Kung, C., Sachs, F. Energetic and Spatial Parameters for Gating of the Bacterial Large Conductance Mechanosensitive Channel, MscL. J GEN PHYSIOL. 113, 525-540 (1999).
- Deplazes, E., Louhivuori, M., Jayatilaka, D., Marrink, S. J., Corry, B. Structural investigation of MscL gating using experimental data and coarse grained MD simulations. PLOS COMPUT BIOL. 8, e1002683 (2012).
- Kubalski, A., Martinac, B. . Bacterial ion channels and their eukaryotic homologs. , (2005).
- Chang, G., Spencer, R. H., Lee, A. T., Barclay, M. T., Rees, D. C. Structure of the MscL homolog from Mycobacterium tuberculosis: a gated mechanosensitive ion channel. Science. 282, 2220-2226 (1998).
- Steinbacher, S., Bass, R., Strop, P., Rees, D. C. Structures of the prokaryotic mechanosensitive channels MscL and MscS. Mechanosensitive Ion Channels, Part A. , 1-24 (2007).
- Sukharev, S., Durell, S. R., Guy, H. R. Structural models of the MscL gating mechanism. BIOPHYS J. 81, 917-936 (2001).
- Perozo, E., Cortes, D. M., Sompornpisut, P., Kloda, A., Martinac, B. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418, 942-948 (2002).
- Betanzos, M., Chiang, C. -. S., Guy, H. R., Sukharev, S. A large iris-like expansion of a mechanosensitive channel protein induced by membrane tension. NAT STRUCT MOL BIOL. 9, 704-710 (2002).
- Corry, B., Jayatilaka, D. Simulation of structure, orientation, and energy transfer between AlexaFluor molecules attached to MscL. BIOPHYS J. 95, 2711-2721 (2008).
- Wang, Y., et al. Single Molecule FRET Reveals Pore Size and Opening Mechanism of MscL. eLife. 3, e01834 (2014).
- Anishkin, A., Akitake, B., Kamaraju, K., Chiang, C., Sukharev, S. Hydration properties of mechanosensitive channel pores define the energetics of gating. J Phys Condens Matter. 22, 454120 (2010).
- Koçer, A., Walko, M., Meijberg, W., Feringa, B. L. A light-actuated nanovalve derived from a channel protein. Science. 309, 755-758 (2005).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. Mechanosensitive Channels Activity in a Droplet Interface Bilayer System. MRS Proceedings. 1621, (2014).
- Fox, R. O., Richards, F. M. A voltage-gated ion channel model inferred from the crystal structure of alamethicin at 1.5-Å resolution. Nature. 300, 325-330 (1982).
- Iwamoto, M., Oiki, S. Contact Bubble Bilayers with Flush Drainage. Sci Rep. 5, (2015).
- Barriga, H. M., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. J R Soc Interface. 11, 20140404 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon