Method Article
Multifuncional, Micropipeta basada en el Método de Incorporación y la estimulación de Canales bacteriana mechanosensitive Ion en Gotita de interfaz Bilayers
En este artículo
Resumen
Canales mechanosensitive bacterianas se pueden utilizar como transductores mechanoelectrical en dispositivos biomoleculares. Bicapas Gotita de interfaz (DIB), bloques de construcción de células de inspiración a este tipo de dispositivos, representan nuevas plataformas para incorporar y estimular canales mechanosensitive. Aquí, demostramos un nuevo método basado en la micropipeta de formar DIB, lo que permite el estudio de los canales mechanosensitive bajo estimulación mecánica.
Resumen
MscL, un canal mechanosensitive gran conductancia (MSC), es una válvula de liberación de osmolito ubicua que ayuda a las bacterias sobreviven choques hipo-osmótico abruptos. Se ha descubierto y estudiado rigurosamente mediante la técnica de patch-clamp durante casi tres décadas. Su función básica de la traducción de tensión aplicada a la membrana celular en respuesta permeabilidad hace que sea un candidato fuerte para funcionar como un transductor de mechanoelectrical en dispositivos biomoleculares basados en membranas artificiales. Sirviendo como bloques de construcción de este tipo de dispositivos, bicapas interfaz gotita (DIB) se pueden utilizar como una nueva plataforma para la incorporación y la estimulación de los canales MsCl. A continuación, describimos un método basado en micropipeta para formar DIB y medir la actividad de los canales MscL incorporadas. Este método consiste en gotitas acuosas de lípidos-encerrado anclados a las puntas de dos (coaxialmente posicionado) micropipetas de vidrio de borosilicato opuestas. Cuando las gotas se ponen en contacto, una interfaz de bicapa lipídica esformado. Esta técnica ofrece control sobre la composición química y el tamaño de cada gotita, así como las dimensiones de la interfaz de bicapa. Tener uno de los micropipetas unidos a un actuador piezoeléctrico armónico proporciona la capacidad de ofrecer un estímulo oscilatorio deseado. Mediante el análisis de las formas de las gotitas durante la deformación, la tensión creada en la interfaz puede ser estimado. Mediante esta técnica, se reportó la primera actividad de los canales MsCl en un sistema DIB. Además de los canales de la EM, actividades de otros tipos de canales pueden ser estudiados mediante este método, lo que demuestra la multifuncionalidad de esta plataforma. El método que aquí se presenta permite la medición de propiedades de la membrana fundamental, proporciona un mayor control sobre la formación de membranas simétricas y asimétricas, y es una forma alternativa para estimular y estudiar canales mechanosensitive.
Introducción
En la última década, el montaje de bicapas lipídicas artificiales se ha avanzado sustancialmente mediante el desarrollo del método de doble capa de interfaz de gotas. Conocido como estable y robusto, DIB impusieron a sí mismos como sistemas modelo alternativo a la clásica pintada (Mueller) y dobladas bicapas (Montal-Mueller) planas 1. Aunque la idea de usar las gotas para crear bicapas lipídicas se remonta a la década de 1960 2, no ha ganado popularidad hasta hace poco. El primer intento exitoso fue reportado por el grupo Takeushi 3, seguido de varios estudios que demuestran la formación de dos capas usando una red de gotitas por el grupo Bayley 4-6. Más recientemente, las técnicas de encapsulación fueron propuestas por el grupo Leo 7-9, que fue pionero en el concepto de usar DIB como bloques de construcción de nuevos sistemas de materiales-estímulos sensibles 10. En estudios anteriores, DIB han demostrado su capacidad para responder a 9,11 eléctrica, químicaical 10,12, y óptico estímulos 13. Varios biomoléculas con diferentes funcionalidades estímulos sensibles han estimulado de manera efectiva cuando se reconstituye en el DIB 10,14. A la luz de estos intentos exitosos se planteó una pregunta importante: ¿podría el DIB responden a estímulos mecánicos cuando se incorporan biomoléculas adecuadas? Las fuerzas interfaciales que actúan sobre un DIB difieren de las de otro 15,16 sistema bicapa. Por lo tanto, la tensión en la bicapa en poder de las gotitas puede ser controlado mediante la regulación de la tensión en las interfaces lípido-agua-aceite; un concepto no es aplicable a los sistemas bicapa pintadas o doblados.
Canales MsCl, ampliamente conocidas como válvulas de liberación osmolito y elementos fundamentales de la membrana citoplasmática bacteriana, reaccionan al aumento de la tensión de la membrana 17,18. En caso de choques hipo-osmótica, varios canales que reside en la membrana de una célula pequeña 19 puede generar un masrespuesta permeabilidad sive para liberar rápidamente los iones y moléculas pequeñas, ahorrando bacterias de lisis 20. Biofísico, MscL está bien estudiado y se caracteriza principalmente por medio de la técnica de patch clamp prominente 21-23. Modelos estructurales fiables que explican mecanismo de puerta de 24,25 MscL se propusieron basan en la estructura de su homólogo de cristal de 26,27, el modelado de 28, y los resultados de una amplia experimentación 24,29-31. Bajo una tensión aplicada de ~ 10 mN / m, el canal cerrado que consiste en un paquete apretado de hélices transmembrana, se transforma en un anillo de hélices en gran medida inclinadas que forman un lleno de agua ~ 28 Å de poro conductor 21,24,32. También se ha establecido que la hidrofobicidad de la puerta apretado, posicionado en la intersección de los dominios TM1 interiores, determina el umbral de activación del canal 33. Correspondientemente, se encontró que al disminuir la hidrofobicidad de la puerta, el tension umbral podría reducirse 22. Esta propiedad de MscL hizo posible el diseño de diversas válvulas controlables 34, principalmente para fines de administración de fármacos. Para todas las propiedades antes mencionadas y en base a su papel fundamental de la traducción de la membrana celular tensiones excesivas en las actividades electrofisiológicos, MscL hace un gran ajuste como un transductor mechanoelectrical en DIB.
En este artículo, presentamos un método basado en la micropipeta originales para formar DIB y medir la actividad de los canales MsCl constituidas conforme a la estimulación mecánica. Se presenta por primera vez, la respuesta de DIB a estímulos mecánicos y la reconstitución funcional de la mutante V23T bajo umbral de MscL en DIB 35.
El sistema experimental consiste en gotitas acuosas de lípidos encerrado anclados a las puntas de dos micropipetas de vidrio de borosilicato opuestas. Cuando las gotas se ponen en contacto una interfaz de bicapa lipídica es formó. Esta técnica ofrece control sobre la composición química y tamaño de cada gotita (a granel), así como las dimensiones de la interfaz de bicapa. Además, las membranas asimétricas con diversas composiciones de lípidos en cada valva podrían formarse fácilmente. Tener uno de los micropipetas unidos a un actuador piezoeléctrico armónica, proporciona la capacidad de aplicar un solo ciclo preprogramado o estímulo oscilatorio. La tensión se suministra a la membrana artificial a través de la compresión de ambas gotitas apoyan. Como resultado de la deformación de las gotas, las áreas de interfaces de aumento de lípidos-agua-aceite, y al mismo tiempo el ángulo entre las gotitas disminuye, causando un aumento en la tensión de la membrana y la activación MscL transitoria. Mediante el análisis de las formas de las gotitas durante la deformación, la tensión creada en la interfaz puede ser estimado. A pesar de que el enfoque de este artículo es sobre las propiedades mecano-transducción de la DIB, también destacamos que otros tipos de biomoléculas, tales como alameticina, pueden ser activados por esta plataforma multi-funcional. Presentamos aquí, todos los aspectos técnicos de la preparación, montaje, y la toma de medidas con este nuevo método de una manera paso a paso.
Protocolo
1. Preparación de PEG-DMA hidrogeles
- Seleccione una medición apropiada / mezcla contenedor (frasco, cubilete, etc.) Para la aplicación. Limpiar a fondo el uso de detergente y agua, y luego limpie con limpiadores de tejidos sin pelusa.
- Use guantes para evitar la contaminación de la cristalería con aceites de los dedos. Enjuague el recipiente con suficiente agua desionizada para eliminar los restos de detergente.
- Limpie el recipiente con papel sin pelusa para deshacerse del agua, y luego rociar con alcohol isopropílico (IPA, 99,5%) y limpie hasta que esté limpio. Colóquelo en una cámara de vacío para permitir todo el IPA se evapore por completo. Limpiar el resto del equipo de laboratorio utilizado en el proceso de formación de hidrogel con agua destilada.
- Para preparar un 40% (w / v) solución de PEG-DMA de hidrogel, pesa 4 g de la poli (etilen-glicol) dimetacrilato (PEG-DMA; MW = 1000 g / mol) polímero utilizando una escala de laboratorio.
- Coloque el pesado PEG-DMA en el frasco y el calor usando un baño de ultrasonidos a las 45-55 ° C hasta que el sólido PEG-DMA ha licuado. Durante el proceso, cubra la abertura del frasco con papel / cera Parafilm para mantener el agua fuera.
- Una vez que el PEG-DMA ha licuado, añadir solución tampón (KCl 500 mM, MOPS 10 mM, pH 7,0) hasta que el volumen total alcanza unos 10 ml (suficiente para varios experimentos en un período de seis meses).
- Añadir el agente de curado a 0,5% (w / v). En este caso, añadir 0,05 g del agente de curado a la mezcla de 10 ml. Colocar el matraz de nuevo en el baño de ultrasonidos y permitir que los componentes se disuelven en solución (alrededor de 10 min, 250 vatios).
NOTA: Una vez que el agente de curado ha sido añadido a la solución, los hidrogeles curarán (solidificar) si se expone a cualquier fuente de luz durante una cantidad de tiempo suficiente. Para ayudar a combatir esto, envuelva el vial / recipiente con cinta negro y guárdelo en un lugar oscuro. Esta solución se puede almacenar durante varias semanas a temperatura ambiente (22 ° C).
2. Preparación de Liposomes
- Preparar 10 ml de una solución de lípidos 2 mg / ml mediante la adición de 10 ml de tampón (KCl 500 mM, MOPS 10 mM, pH 7,0) a 20 mg de 1,2-sn -glicero diphytanoyl--3-fosfocolina (DPhPC) sintética lípidos comprar como polvo liofilizado. Hacer vesículas que ambos lípidos y solución tampón se mezclan a fondo (la mezcla debe ser homogénea y turbia cuando se disuelve todo).
- Freeze (-20 ° C) y descongelar completamente la nueva mezcla de lípidos para un total de seis veces. Deje que el deshielo mezcla a temperatura ambiente, nunca en un ambiente caliente.
- El uso de un extrusor comercialmente disponible, extruir los lípidos al obligar a toda la suspensión de lípidos primero a través de un filtro de membrana de policarbonato de 0,4 micras y luego seis veces a través de un filtro de 0,1 micras membrana. Este proceso produce partículas con diámetros de cerca de 100 nm (igual al tamaño de poro del filtro).
NOTA: Otros lípidos y proporciones de lípidos se puede preparar usando este meDTO. Los liposomas deben ser almacenados a 4 ° C durante varias semanas.
3. MscL Aislamiento y Reconstitución
- Streak cabo una placa de agarosa de temperatura, que contiene 100 mg / ml de ampicilina, E. células MJF465 coli con un plásmido que lleva el gen pB10b V23T MscL ampliado con un 6-His tag en el extremo 3 '(C-terminal). Permitir la placa para una noche de cultivo (12-16 horas) a 37 ° C en una incubadora estacionaria. El plásmido se selecciona para y retenido en las células con 100 g / ml de ampicilina en medio LB estándar. El siguiente lugar los días 20 ml de medio LB con 100 mg / ml de ampicilina en una vesícula cultivo (un matraz de 50 ml o lo que está disponible para sostener la cultura). Tome la placa que se cultivó durante la noche y seleccione una colonia de la placa para transferir (inocular) al preparado 20 ml de medio LB con un palo de inoculación estéril. Permitir que la cultura 20 ml de crecer durante la noche (12-16 h) a 37 ° C a 250 rpm en un incubador con agitación.
- Decantar el 20 ml Overnla cultura de vuelo en 2-4 l de medio LB. La ampicilina ya no es necesaria. Agitar los matraces en una incubadora de agitación a 250 rpm a 37 ° C hasta que OD 600 alcanza 0,5. Añadir isopropílico β-D-tiogalactopiranósido 1-(IPTG) a una concentración final de 0,6 mM y dejar que la cultura de ir a por otra hora (a OD 600 = 0,8-1,0).
- Ponga los frascos en el hielo para enfriar las culturas y luego recoger las bacterias por centrifugación. Usar seis tubos cónicos de 400 ml (o tantos como permitido por el rotor usado) y centrifugar durante 5-8 min a 7.438 xg que es suficiente para sedimentar las bacterias. Decantar el sobrenadante, y repita el procedimiento hasta que se cosechan todas las células de los medios de comunicación. El número de giros necesarios varía en función de la cantidad de la cultura que se ha crecido y el rotor utilizado. Para un cultivo de 2 L que sólo se necesita hacer girar hacia abajo las células una vez. Transfiera todas las células recogidas en un solo tubo de centrífuga.
- Resuspender los sedimentos celulares en 20 ~ ml de tampón de prensa francesa (mM KP 100i y 5 mM de MgCl 2, pH 7,4). La suspensión debe ser denso (como crema o leche). Inmediatamente antes de francés de prensado en la suspensión agregar la fluoruro de fenilmetilsulfonilo inhibidor de la proteasa (PMSF) a una concentración final de 2 mM y mezclar vigorosamente.
- Francés-presione la cultura, en una celda Francés-presión de 35 ml, a 10.000 a 16.000 psi. Centrifugar la suspensión para separar las células intactas a 7438 xg, 10 min a 4 ° C.
- Ponga el sobrenadante en un tubo separado, y añadir a la misma lisozima y ADNasa (0,2 mg / ml cada uno). Deje caída sobrenadante durante 10 min a temperatura ambiente.
NOTA: DNasa es opcional; que reduce la viscosidad para la centrifugación a alta velocidad. La lisozima es crítica; que digiere los restos de pared celular y ayuda a aumentar el rendimiento de la extracción de la membrana hecha con un detergente suave no desnaturalizante.
- Distribuir la mezcla de sobrenadante en dos tubos de ultracentrífuga y spin ellos en106,883-153,911 xg (dependiendo del rotor) a 4 ° C durante 40 min. Después de la centrifugación se decanta el sobrenadante y el sedimento de color marrón en la parte inferior (la fracción total de membrana) se puede congelar en el tubo para el almacenamiento a largo plazo (- 80 ° C) o se utiliza para la purificación de proteínas inmediata.
- Preparar 0,5 a 1 L de tampón de alta imidazol: NaCl 100 mM + imidazol 500 mM, se valora a pH 7.2 hasta 7.4 con HCl concentrado. Tenga en cuenta que el imidazol es un buen sustancia tamponante por sí mismo.
- Preparar 0,5 a 1 L de tampón de baja imidazol: NaCl 100 mM, imidazol 15 mM +, diluyendo apropiadamente el anterior tampón con NaCl 100 mM. No es necesario ajustar el pH.
- Tome de 100-150 ml de cada tampón en botellas separadas, y añadir 1% (w / v) glucopiranósido b-octilo (OG). Agitar bien la solución y filtrar a través de un filtro de 0,22 micras. Estas soluciones son las soluciones de cromatografía de baja y alta de imidazol.
- Preparar tampón de extracción, tomar 50 ml de tampón de baja imidazol, y añadir 3% (w / v)OG y filtrar el búfer.
- Utilice sedimentos de membrana de 0,5 a 2 g de peso húmedo para el aislamiento de proteínas. Añadir 5 a 7 ml de tampón de extracción, resuspender el precipitado, y homogeneizar en un homogeneizador de vidrio-pistón 30 ml impulsada por la mano. Con 5-10 movimientos suaves hacer una suspensión homogénea y sin grumos. Tenga cuidado, es conocida esfuerzo cortante para causar la desnaturalización de proteínas.
- Centrifugar las partículas insolubles (centrífuga de gama media, rotor de ángulo fijo, 38,478-68,405 xg, a 4 ° C durante 15 minutos). Mientras tanto, tomar 3 ml de perlas Ni NTA (6 ml de suspensión) y lavarlos una vez con el bajo-imidazol tampón (w / o OG) agitando en unos 15 ml con tapón de rosca de tubo. Deje que los granos se depositan en el fondo (~ 5-7 minutos) o girar hacia abajo a 129 hasta 201 xg durante un minuto a 4 ° C. Una vez formado el pellet, se decanta el sobrenadante cuidadosamente a mano y repita el procedimiento. Equilibrar las perlas con 2-3 ml de tampón de extracción OG 3%.
- Mezclar la mezcla homogeneizada (sedimento de membrana y tampón de extracción) a partir de 3.12 con 3-3.5 ml perlas Ni NTA. Deje que el tambor de mezcla en un tubo con tapón de rosca de 60 min (lote de carga). Girar las perlas hacia abajo a 201 xg (30 seg), decantar el sobrenadante a mano, y lavar las perlas con 1% OG tampón de baja-imidazol de una vez. Sedimentar las perlas como en 3.13 de nuevo y volver a suspender en 20-30 ml de tampón de baja imidazol fresco.
- Empaque una pequeña columna (equipado con un adaptador de flujo superior) con las cuentas Ni NTA, y dejar que los granos se asientan al abrir la llave de paso para permitir que el flujo a través de extracto (no permita que los granos se sequen). Lave las perlas con una alícuota de 10 ml bajo imidazol de amortiguación (1% OG) con la llave de paso abierta.
- Cargar la máquina cromatografía con bajos puro y de alta imidazol buffers sobre 25 ml de cada uno a la tasa de flujo de máquina definida (varía por máquina); esto se realiza haciendo pasar el tampón de bajo-imidazol a través del sistema primero. Cero la grabadora óptica a OD 260 (línea de base). Tenga en cuenta que la memoria intermedia es bastante diferente de agua porque imidazol de bajo grado tiene impurities que absorben UV. Inserte el adaptador de corriente a la columna y adjuntarlo a la máquina.
- Lavar la columna con tampón de nuevo bajo imidazol (a 1 ml / min) hasta que la DO del flujo a través viene alcanza la línea de base (que puede tomar 10 a 20 ml). Esto elimina las proteínas no unidas de la columna.
- Aplicar un gradiente lineal de imidazol de 20 y 500 mM, durante 30 min, a 1 ml / min. Comience a recoger fracciones de 4 ml cuando OD 600 muestra un incremento. Las dos primeras fracciones están llenos de proteínas unidas débilmente, mientras que MscL-6His comienza elución a ~ 40% de la gradiente lineal. La mayoría de la proteína aparece en las fracciones 3 a 8.
NOTA: un aumento lineal de OD se observó debido a la creciente% de imidazol. - Aunar las fracciones 3-4, 5-6 y 7-8 en conjunto. Opcionalmente, concentrar las fracciones individualmente. Se concentran las fracciones 6-10 veces utilizando filtros centrífugos. Después de un giro 20 min a 804 xg y a 4 ° C, resuspender cuidadosamente la proteína concentrada,la proteína tiende a pegarse al filtro.
- Retirar 50 alícuotas, se mezclan con tampón de muestra SDS, y comprobar la pureza de proteínas mediante electroforesis en gel PÁGINA.
NOTA: MscL migrará como una banda difusa de aproximadamente 17 kDa a la parte inferior del gel. - Use las fracciones concentradas para cuantificar la proteína utilizando un kit de ensayo de proteínas, siguiendo las instrucciones del fabricante. Un rendimiento típico a partir de un sedimento de membrana 0,8 g es de hasta 0,2 mg de proteína pura en las fracciones combinadas.
- Reconstituir V23T MscL en liposomas DPhPC través de diálisis. Tome una solución 10 mg / ml de cloroformo y DPhPC alícuota de 0,5 ml (es decir, 5 mg de lípidos) de él en tres desechable de fondo redondo (12 x 130 mm) tubos de vidrio. Seque el lípido bajo la corriente de nitrógeno y eliminar los restos de cloroformo a vacío (4-6 horas).
- Añadir 15 20 mg de polvo OG al lípido seco en cada tubo, se disuelven en 2 ml de tampón de diálisis (100 mM de KCl, 5 mM KPi, pH 7,2), vórtice, y misonicado ldly. Los lípidos OG-solubilizado deben formar una solución clara.
- Añadir soluciones concentradas V23T MscL a cada tubo para lograr 1: 100, 1: 300 y 1: 1.000 proteína-lípido ratios y así vórtice. Cortar y lavar tres piezas (~ 12 cm de largo) de tubos de diálisis (MWCO 8000, 7,5 mm de diámetro, tres pares de clips numerados listos.)
- Coloque las mezclas lípido-proteína solubilizados en el interior del tubo, cerrar cuidadosamente los extremos con clips y diálisis frente a 2 l de tampón (KCl 100 mM, 5 mM KPi, pH 7,2) durante 48 horas a 4 ° C con cuatro cambios de la tampón cada 12 hr. Después de la diálisis, los proteo-liposomas están listos.
NOTA: La solución de liposomas se puede complementar con 2 mM de NaN3 (azida de sodio) y se almacenó a 4 ° C. Evite la congelación.
4. Elaboración del depósito de aceite
- Taladre dos agujeros opuestos (1,0 mm de diámetro) todo el camino a través de la pared de un diámetro de 2 pulgadas, 1,5 cm cil larga acrílicoInder a 1 cm de la parte inferior (Figura 1A).
- Taladre dos agujeros de 4 mm concéntricos a la previamente perforados agujeros de 1 mm. Las profundidades de los agujeros deben ser de 1 mm cada uno (asegúrese de no perforar hasta el final). Estos agujeros se hacen para adaptarse a las juntas de goma.
- Lugar y pegamento de dos juntas de goma que tienen diámetros de 1 mm interiores en los agujeros más grandes con el fin de evitar que el aceite se escape.
- Pegue el cilindro mecanizada a 10 cm x 10 cm de hoja de acrílico fina utilizando cualquier epoxi de usos múltiples (Figura 1).
En el día del experimento:
5. Preparación de electrodos
- Cortar una longitud de 7 cm de dos alambres de plata 250 micras de diámetro y, a continuación, sumerja sus consejos en lejía durante dos horas para formar una plata-cloruro de recubrimiento (AgCl). Un color gris indica que un recubrimiento de AgCl se ha formado (Figura 2E).
- Usando un cortador de vidrio, dividir un 10 cm de largo, 1 / 0,58 OD / ID mm capil clase de borosilicatolary en dos 5 cm capilares.
- El uso de una aguja de calibre 34 Microfil llenar los capilares con el hidrogel de PEG-DMA. Para evitar que el hidrogel hidratado de inflamación de los capilares, mantenga una distancia de 3 mm en las puntas y asegúrese de que no haya burbujas de aire en los capilares.
- Inserte los electrodos de Ag / AgCl en los capilares de hidrogel llenado (Figura 2E).
- Curar el hidrogel de PEG-DMA a través de la fotopolimerización por radicales libres tras la exposición a luz UV durante 2 min a 1 W utilizando una pistola de punto de UV.
6. Configuración del Experimento
NOTA: El experimento se configura bajo una jaula de Faraday a tierra a una conexión a tierra en el amplificador de parche.
- Adjunte una de las micropipetas a un titular de microelectrodos recta que tiene un conector macho (Figura 2E).
- Conectar el titular microelectrodo al cabezal de la platina del amplificador de patch (Figura 2A). Para conectar el headstage a tierra, soldar un alambre de cobre aislado de calibre 18 a un conector adecuado para el cabezal de la platina.
- Montar el cabezal de la platina en un micromanipulador manual de 3 ejes. Fije la placa de montaje de cabezal de la platina (debe ser comprado junto con el micromanipulador o hecho a medida en un taller mecánico) para el micromanipulador y luego conectar el cabezal de la platina a la placa de montaje con los tornillos adecuados.
- Una el segundo micropipeta al actuador lineal a través de un conector de laboratorio a medida y luego montar tanto en un segundo micromanipulador (Figura 2B). Las micropipetas deben oponen entre sí, alineados, y horizontalmente nivelados. Nota: la marca y el estilo de los manipuladores no importan.
- En un vial de vidrio, mezclar 0,1 ml de los liposomas DPhPC con 0,01 ml de la solución de proteoliposoma V23T MscL.
NOTA: Este paso es necesario para reducir la proporción de proteína a lípido (~ 0,0002), que es fundamental para la formación de un lípido estable bilayer.
- El uso de una aguja de calibre 34 Microfil, llenar los consejos de ambas micropipetas con proteoliposoma solución (Figura 3).
- Coloque el depósito en la parte superior de un microscopio vertical, y alimentar a las micropipetas a través de los agujeros opuestos 1 mm (Figura 2B). NOTA: cualquier microscopio podría ser utilizado siempre en las gotas se podían ver con claridad.
- Llenar el depósito a la superficie con Hexadecane (99%). El Hexadecano no necesita purificación adicional.
- Para formar las gotitas esféricas en la punta de las micropipetas, utilizar una tercera 10 micras de diámetro micropipeta de vidrio de borosilicato, montado en un tercio micromanipulador, para dispensar solución V23T diluido MscL proteoliposoma (~ 0.00052 ml) en las puntas de las micropipetas y formar el gotitas (Figura 3).
- Controlar el tamaño de las gotitas (disminuyendo o aumentando el volumen) como se desee y dejar reposar durante 10 min para las monocapas para formar por completo (Figura 3).
- Llevar las gotitas en contacto, formación de bicapa ocurrirá dentro de 1 a 2 min.
7. Configuración del Software y Equipos
- Preparar el software mediante la activación de las computadoras, microscopios, controlador oscilador piezoeléctrico, generadores de funciones, amplificador de parches, y el sistema de adquisición de datos de bajo ruido.
NOTA: cualquier amplificador parche podría ser utilizada y las siguientes instrucciones son específicamente para la que utilizamos y que aparece en la lista de materiales y equipos. - En el panel frontal del amplificador de patch, ajuste las perillas de "Mode" para VHOLD / IHOLD y V-CLAMP.
- En el panel frontal establecer el "paso bajo" filtro de Bessel a 1 kHz y Ganancia de salida a 2.
- Ajuste la "Configuración" para TODA LA CÉLULA β = 1.
- Asegúrese de que el resto de los mandos se ponen a cero o en punto muerto.
- Muestra todas las mediciones actuales DIB a 5 kHzcon un filtro de Bessel anti-aliasing 1 kHz.
- Ejecute el software haciendo doble clic en el icono en el escritorio.
- Haga clic en "Configurar> Digitalizador" para abrir el diálogo "digitalizador" y, a continuación, haga clic en el botón "Cambiar".
- En el cuadro de diálogo "Cambiar digitalizador" seleccione "Digidata Serie 1440" de la lista "Tipo digitalizador".
- Haga clic en el botón Scan para detectar el digitalizador.
- Haga clic en "Aceptar" para salir del cuadro de diálogo "Cambiar digitalizador" y haga clic en "Aceptar" para salir del cuadro de diálogo "digitalizador".
- Haga clic en "Configuración> Banco Lab".
- En la pestaña Señales de entrada de la mesa de laboratorio, seleccione analógico en un bajo Canales digitalizador. Ajuste el factor de escala de 0.002.
8. La formación de la bicapa lipídica
- El uso de un cable BNC, conecte la salida del awgenerador aveform al frente entrada de comando externa conmutada (en el panel posterior del sistema de adquisición de datos). Enviar una forma de onda triangular 10 Hz, 500 mV-pk-pk para el cabezal de la platina.
- Utilizando el micromanipulador, mover las micropipetas de vidrio horizontalmente para llevar gotitas en contacto hasta que tocan ligeramente y esperar a que se produzca adelgazamiento bicapa (generalmente alrededor de 1 a 2 minutos) (Figuras 3C y 3D).
NOTA: La progresión del proceso de formación de bicapa se puede ver visualmente a través del microscopio y puede ser monitorizado por medición de corriente (Figura 4).
- Ajuste el tamaño bicapa (~ 250 micras de diámetro) mediante el control de la posición de la gotita montado en el actuador, mediante el micromanipulador. Nota: el tamaño bicapa podría estimarse visualmente a través del microscopio. Este método hace que sea más fácil para el investigador para controlar el tamaño de la bicapa fácilmente pormover las gotitas utilizando los micromanipuladores.
9. Dinámica de excitación y MscL Gating
- Una vez se ha formado la bicapa y es estable (es decir, la bicapa no se rompa o conductora), estimular las gotitas mediante el envío de una señal sinusoidal utilizando un generador de funciones.
- Para estimular la proteína MscL incorporado en la bicapa, envíe una forma de onda sinusoidal con una amplitud de 175 micras de pico a pico, la frecuencia de 0,2 Hz, y el ciclo de trabajo del 50% a la servo-controlador piezoeléctrico. (Varios tipos de formas de onda podrían ser enviados con diferentes amplitudes, frecuencias y ciclo de trabajo)
10. Procesamiento e Interpretación Resultados
- Guardar las medidas de corriente, grabadas con el sistema de adquisición de datos, en formato .ABF. Importar datos (en formato .ABF) a Matlab utilizando un archivo de función "abfload", a continuación, analizar y procesar los datos. El archivo "abfload" está disponible gratuitamente en Internet.
- Estimación tque la tensión en la bicapa y expansión superficial de las gotas, usando videos de la gota durante los ciclos completos de actuación que se graban con una cámara apropiada.
- Vídeos de proceso en Matlab, por el procesamiento de fotogramas individuales usando técnicas de procesamiento de imágenes para estimar el área de la interfase agua / aceite, así como el ángulo entre las gotitas. NOTA: el uso de un marco 2D tomada del vídeo, detección de la interfaz agua-aceite (es decir, el borde de la gota) y luego calcular el área de superficie de revolución.
Resultados
Las figuras 1 y 2 muestran la instalación y equipamiento experimental utilizado para registrar la actividad de proteínas en el transcurso de la estimulación mecánica de la membrana bicapa lipídica. Para reducir al mínimo el ruido eléctrico en nuestras mediciones, la estación de trabajo se coloca dentro de una jaula de Faraday laboratorio a medida, a tierra a una conexión a tierra en el Axopatch 200 B del amplificador.
Formación de un aislante estable bicapa lipídica es un paso clave en este estudio. En esta disposición, una monocapa lipídica ensambla en la interfase aceite / agua de las gotitas acuosas sumergido en un baño de un disolvente orgánico. Cuando las gotas se ponen en contacto, el exceso de aceite se elimina, y las monocapas de lípidos opuestas delgada a una molécula de espesor de dos bicapa lipídica. La técnica más común utilizado en la caracterización de bicapa es voltaje-clamp. Con voltaje-clamp, el voltaje a través de la bicapa se mantiene a un valor constante mientras se mide la corriente. Figura 4 retrata un típico grabación actual en tiempo real de la formación inicial bicapa. Conociendo la capacitancia específica (~ 0,6 mF / cm 2) 5 de la bicapa lipídica DPhPC, se pudo calcular el área de la bicapa formada. El área bicapa podría ser controlado cambiando la posición de las gotas (figura 4A). Utilizando el actuador piezoeléctrico, diferentes tipos de formas de onda (sinusoidal, cuadrada, triangular, etc.) A diferentes frecuencias, amplitudes, y ciclos de trabajo se podrían aplicar a las gotitas a horizontal y axialmente ellos oscilan y, por tanto, la tensión bicapa y el área podrían ser alterados (Figura 4B).
Cuando la DIB es estimulado mecánicamente, mientras se mantiene un potencial de CC constante a través de la membrana, un bajo umbral (ganancia de función) mutante V23T de MscL genera actividades confiables incluyendo estados principalmente sub-conductores y eventos en ocasiones llenos de apertura (Figura 5) . Estos evpadres son idénticos a los registrados utilizando la técnica de patch-clamp de membranas intactas interiores de E. coli y liposomas reconstituidos con la V23T purificada MscL. Los resultados en la Figura 5 demuestran que gating se produce en respuesta a un aumento de la tensión, ya que todos los picos de corriente se observan en la compresión máxima. En la compresión de pico, la expansión de área relativa de las gotitas es máxima y, por tanto, la tensión en la interfase es máxima.
Alameticina, un canal iónico dependiente de voltaje y uno de los péptidos más estudiados, aumenta la permeabilidad de la membrana cuando se aplica una tensión de CC a través de la membrana 36. La capacidad de la interfaz de bicapa lipídica para albergar proteínas transmembrana y péptidos también se prueba mediante la realización de las grabaciones actuales de tensión-gating usando alameticina péptido. Alameticina se mezcla con la solución de fosfolípido a una concentración final de 100 ng / ml. La Figura 6 muestra las mediciones de corriente menores fijación de voltaje (115 mV). Las gotitas en este experimento se separan con el fin de lograr pequeña interfaz de bicapa y por lo tanto mayor resistencia y menor capacitancia. El comportamiento gating del péptido alameticina se muestra a través de los pasos discretos de corriente (Figura 6). El histograma en el lado derecho de la trama muestra los cambios en la conductancia de el nivel de base (0.0962 NS), que es básicamente el primer nivel de conductancia del canal en sí.

Figura 1:. Un esquema que describe los componentes y dimensiones del depósito de aceite principales El depósito de aceite se fabrica en el taller de mecánica en la Universidad Virginia Tech. Se compone de un tubo de acrílico cilíndrica mecanizada, pegada a la superficie de una hoja acrílica. Las dimensiones y el diseño pueden ser modificados para adaptarse a diferentes aplicaciones o más de dos micropipetas./53362/53362fig1large.jpg "Target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
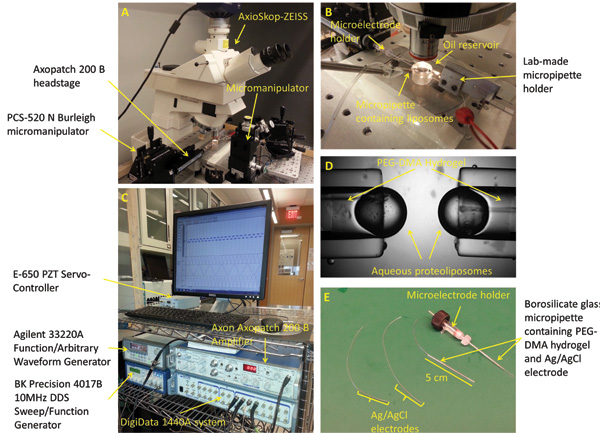
Figura 2:. Preparación configuración y micropipetas Experimental (A) La estación de trabajo estándar para formar, mecánicamente estimulante, y caracterización de las bicapas de interfaz incluye un microscopio, manipuladores 3 ejes, una cámara digital, oscilador piezoeléctrico, mesa de aislamiento de vibración, y una jaula de Faraday (no mostrada). (B) La configuración experimental consta de dos opuestos PEG-DMA de hidrogel llenos de micropipetas horizontalmente colocado dentro de un baño de aceite de hexadecano. Cada una de las micropipetas contiene un electrodo de Ag / AgCl para proporcionar conexión eléctrica. Una tercera micropipeta llena de proteoliposoma solución se utiliza para formar las gotas en la punta de los demás micropipetas. (C) La respuesta de corriente DIB podría medirseusando una combinación del amplificador de parche y el sistema de adquisición de datos de bajo nivel de ruido. (D) Una cerró imagen que muestra las gotas acuosas formadas en la punta de las micropipetas. Electrodos (E) de Ag / AgCl se realizan por inmersión de la punta de dos 250 micras alambres de plata en lejía. Los electrodos se alimentan entonces a través de dos tubos capilares de vidrio de borosilicato llenos de hidrogel de PEG-DMA, que se cura con luz UV para solidificar. El titular de microelectrodos recta con conector macho se utiliza para conectar una de las micropipetas al cabezal de la platina del amplificador parche.
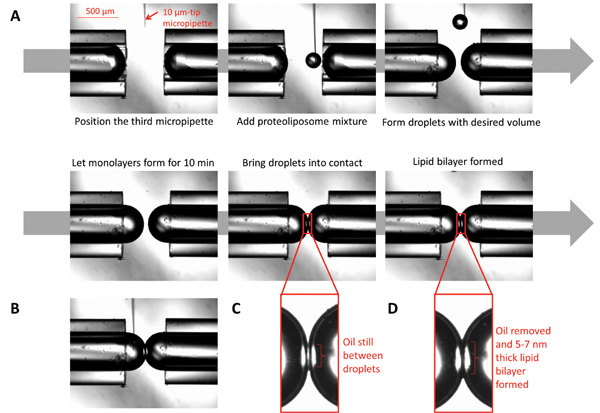
Figura 3:. Imágenes que ilustran la formación de bicapas de interfaz de gotitas (A) A 10 micras micropipeta llena de proteoliposomas se coloca bajo el microscopio en la proximidad de las puntas de micropipeta. Usando una jeringa conectada a la micropipeta, dispensar pequeños volúmenesde los proteoliposomas para formar gotitas esféricas a volumen deseado. Que la forma monocapa al permitir que las gotas para sentarse por diez minutos. Traiga las gotitas en contacto; formará la bicapa después de todo el aceite en la interfaz se elimina. (B) mientras se forma la bicapa, la composición química a ambos lados de la interfaz podría ser controlada mediante la inyección de productos químicos deseados utilizando una micropipeta de tamaño micro. (C) Las gotitas en el momento del primer contacto. (D) Las gotitas cuando se forma la bicapa lipídica.
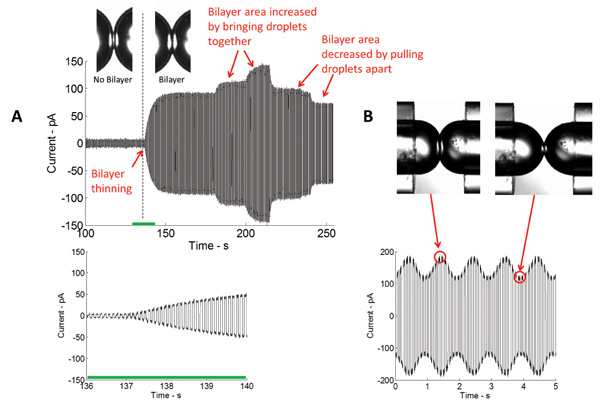
Figura 4: en tiempo real mediciones muestran tanto el adelgazamiento inicial y posterior expansión de la interfaz (A) Corriente medida en el curso de formación de bicapa mediante la aplicación de un potencial eléctrico triangular.. La magnitud de la corriente medida es directamente proporcional a la capacidistancia, y por lo tanto el área de la interfaz de bicapa. Cuanto más cerca de las gotas se unen, más grande es el área de la interfaz y viceversa. (B) Tras la aplicación de excitación mecánica, el área de la interfaz de bicapa aumentos y disminuciones en la misma frecuencia que la señal estimulante.
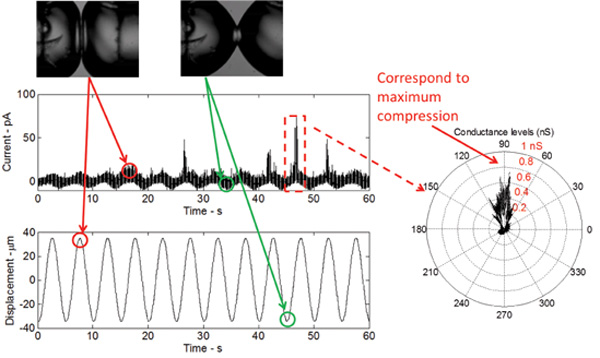
Figura 5:. Mediciones en tiempo real muestran la respuesta de la bicapa a la excitación mecánica, así como la compuerta del mutante V23T de MscL La forma de la respuesta de corriente es sinusoidal, que se refiere a un cambio sinusoidal en la capacitancia bicapa como resultado de el cambio área bicapa. Los picos de corriente, que se producen en la cima de cada ciclo, indican sub-conductancia compuerta del mutante V23T. Un diagrama polar indica además que gating ocurre en la compresión de pico, lo que refleja un aumento de la tensión en la interfase bicapa.
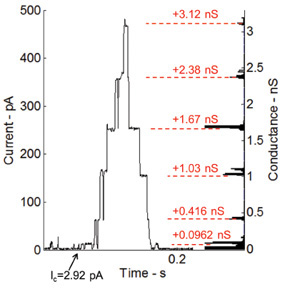
Figura 6:. Las mediciones de corriente bajo tensión de la abrazadera y el correspondiente histograma de niveles de conductancia para la actividad compuerta de canales alameticina incorporadas El comportamiento compuerta del péptido alameticina se muestra a través del aumento gradual discreta en curso. Los niveles de conductancia coinciden muy bien con las mediciones anteriores realizadas por nuestro grupo de investigación en la Universidad Virginia Tech 7.
Discusión
Mechanosensation significa una de las primeras vías de transducción sensorial que evolucionaron en los organismos vivos. El uso de este fenómeno para el estudio y la comprensión de las propiedades mecano-eléctrica de la DIB, es un paso crucial para materiales estímulos sensibles funcionales. Se trata de la incorporación y activación de un canal mechanosensitive, MscL, en el DIB como un transductor mechanoelectrical y un medidor de deformación para detectar aumento de tensión en la interfaz de bicapa lipídica. Por otro lado, la función de los canales de EM podría ser regulada a través de las propiedades de los materiales básicos de bicapas lipídicas, incluyendo espesor, la curvatura intrínseca, y compresibilidad. A la luz de lo anterior, la técnica basada en la micropipeta proporciona una valiosa herramienta que permite al investigador la capacidad de estudiar canales de EM en DIB y proporciona información detallada sobre la estructura de la bicapa lipídica, así como las interacciones proteína-lípido.
Durante la última tres décadass, patch-clamp era el método primario para estudiar canales de MS, ya que permite la sujeción de la tensión y la tensión. Sin embargo, patch-clamp requiere un equipo voluminoso y no es adecuado para la miniaturización, una propiedad necesaria para la ingeniería de dispositivos sensoriales y de conversión. DIB debido a su simplicidad, la estabilidad y compacidad representan un entorno adecuado para estudiar la actividad de MscL. Aquí, extendemos avances anteriores en las técnicas de formación de DIB proponiendo una técnica basada en la micropipeta, con la capacidad de controlar el tamaño de las gotitas y la interfaz de bicapa, la composición química de cada gotita, y la tensión en la interfaz a través de la estimulación dinámica. La técnica consiste en el anclaje de gotitas acuosas, que contiene proteoliposomas, a las puntas de coaxialmente opuestas capilares de vidrio. Las gotitas se colocaron en un baño de disolvente orgánico y cuando se pone en contacto se forma una bicapa de lípidos en la interfase.
Las micropipetas se adjuntan a la posciladores iezoelectric, lo que permite el desplazamiento horizontal de las gotitas. Comprimir dinámicamente las gotitas, resulta en un aumento de la tensión interfacial en la interfase aceite de agua y por tanto un aumento en la tensión bicapa. Dos aspectos importantes diferencian este método de la técnica de doble capa de burbujas de contacto similar y recientemente publicado (CBB) 37. Usando la técnica presentada en este documento, el tamaño de la bicapa se controla utilizando micromanipuladores y por lo tanto los volúmenes de las gotas permanece constante, a diferencia de en el método CBB. Además, la técnica CBB exige bombas de presión, que no son necesarios en el método presentado en este trabajo por lo que es más simple y más fácil de construir.
Somos capaces de incorporar y estimular MscL bacteriana por primera vez sin el uso de una pipeta de parche o modificaciones químicas 38. Dado que el sistema facilita la formación de membranas bicapa de lípidos asimétricos robustos, que imita más estrechamente la lasimetría IPID encuentra en las membranas biológicas. Esto nos permite estudiar los efectos de la composición de la membrana controlada o asimetría en la actividad de MscL. Además, a través de técnicas de procesamiento de imágenes, este método ayuda a estimar la tensión en la interfase bicapa. Esta técnica ayuda a la comprensión de los principios de la interconversión entre las fuerzas a granel y de la superficie en el DIB, facilita las mediciones de las propiedades fundamentales de la membrana, y mejora la comprensión de la respuesta a la membrana MscL tensión.
Aunque este método nos lleva un paso más hacia un sistema material estímulos sensible biomolecular y para un entorno fisiológico diferente para estudiar MscL, hay limitaciones en el sistema. La tensión en este sistema no se puede sujetar debido a la presencia del depósito de lípidos en forma de liposomas en cada gotita, que tiende a aliviar la tensión en la interfase aceite / agua. Por lo tanto, en la actualidad canales mechanosensitive puede ser estimuladaen DIB solamente en un régimen dinámico. La presencia de burbujas de aire en el sistema afecta de manera significativa la precisión y la reproducibilidad de los experimentos. Las burbujas de aire presentes en los hidrogeles podrían dar como resultado la pérdida de si la conexión eléctrica.
Mientras que se describe el uso del método basado en micro-pipeta para la estimulación de MscL, la técnica podría ser utilizado para estudiar otros tipos de canales de MS y tiene el potencial de ser utilizado por los investigadores para estudiar una variedad de biomoléculas. Por ejemplo, configuración similar se ha utilizado en nuestro laboratorio para estudiar la respuesta mechanoelectrical de una interfaz gotita membrana de bicapa-canal libre. Varias proteínas podrían ser reconstituidos y activan utilizando esta configuración altamente controlado, tomando en consideración que los entornos de reconstitución de cada biomolécula varían. El método descrito en este artículo toca en un potencial de aplicación considerablemente más amplio que sólo se limita a la imaginación del investigador.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Las investigaciones realizadas en esta publicación con el apoyo de la Oficina de la Fuerza Aérea de Investigación Científica Básica Iniciativa subvención FA9550-12-1-0464.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Corning | 430624 | |
| 1,2-diphytanoy-sn-glycero-3-phosphocholine (DPhPC) | Avanti Polar Lipids | 850356P | Purchased as lyophilized powder |
| 34-gauge microfil | World Precision Instruments | MF24G-5 | |
| 400 mL Centrifuge bottels | ThermoFisher | 3141 | Nalgene |
| Agilent Function/Arbitrary Waveform Generator, 20 MHz | Keysight Technologies | 33220A | |
| Ampicillian | ThermoFisher | BP1760 | ACS Grade |
| Avanti® Mini-Extruder | Avanti Polar Lipids | 610000 | |
| Axio Scope.A1 | Carl Zeiss | - | |
| AxioCam HSm | Carl Zeiss | - | |
| Axopatch 200B Amplifier | Molecular Devices | - | |
| BCA protein assay kit | Pierce | 23225 | |
| BK Precision 4017B 10 MHz DDs Sweep/Function Generator | Digi-Key | BK4017B-ND | |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100F-4 | |
| Dialysis tubing | 7 Spectra/Por | 132113 | MWCO 8000, 7.5 mm diameter |
| DigiData 1440A system | Molecular Devices | - | |
| DNAse | Sigma-Aldrich | DN25 | |
| DPhPC | Avanti | 850356C | |
| E-625 PZT Servo-Controller | Physik Instrumente | E-526 | |
| FPLC System | Pharmacia Biotech | - | |
| HCl | J.T. Baker | 9535-33 | |
| Hexadecane, 99% | Sigma-Aldrich | 544-76-3 | |
| Homoginizer | Wheaton | 357426 | 15 mL |
| Imidazole | Sigma-Aldrich | I5513 | |
| IPTG | Affymetrix | 17886 | |
| IRGACURE® 2959 | IRGACURE® | 555047962 | |
| Isopore Membrane Filters | EMD Millipore | VCTP02500 | |
| Isopropyl Alcohol | VWR International | BDH1133-4LP | |
| KCl | Sigma-Aldrich | P3911 | ACS Grade |
| KH2PO4 | Mallinckrodt | 7100 | ACS Grade |
| Kimble-Chase | Kontes | 420401-1515 | Flex-Column |
| LED-100 UV Spot Curing System | Electro-Lite, corp. | 81170 | |
| Lysozyme | Sigma-Aldrich | L6876 | |
| Manual Patch-Clamp Micromanipulators | Thorlabs | PCS-520N | |
| MgCl2 | ThermoFisher | M33 | ACS Grade |
| Microelectrode Holder | World Precision Instruments | MEH1S | |
| Micropipette Puller | Sutter Instruments | P-1000 | |
| MOPS, minimum 99.5% titration | Sigma-Aldrich | M1254-100G | |
| N2 Gas | Airgas | UN1066 | |
| NaCl | EMD | SX0420-1 | ACS Grade |
| Ni NTA agarose beads | Qiagen | 1000632 | |
| Optically Clear Cast Acrylic Tube, 2-1/2" OD x 2" ID | McMaster-Carr | 8486K545 | |
| P-601 PiezoMove Flexure-Guided Linear Actuator | Physik Instrumente | P-601 | |
| PAGE gel | Bio-Rad | 456-9033 | |
| Parafilm M® All-Purpose Laboratory Film | Parafilm® | PM999 | |
| Phenylmethylsulfonyl fluoride | Sigma-Aldrich | P7626 | |
| Poly(ethylene glycol)1000 dimethacrylate | Polysciences, Inc. | 15178-100 | |
| Polycarbonate (PCTE) Membrane Filters, Black, 0.4 Micron, 25mm, 100/Pk | Sterlitech Corporation | PCTB0425100 | |
| Potassium Chloride | Sigma-Aldrich | P5405-500G | |
| Powder Free Soft Nitrile Examination Gloves | VWR International | CA89-38-272 | |
| Replacement Gasket 1.0mm | World Precision Instruments | GO1-100 | |
| SDS | Sigma-Aldrich | L5750 | |
| Silver wire | GoodFellow | 147-346-94 | Different diameters could be used depending on the application |
| Sodium Azide | Affymetrix | 21610 | |
| Test tubes | ThermoFisher | 14-961-27 | 12 x 130 mm |
| Tryptone | ThermoFisher | BP1421 | |
| Ultracal 30K | Millipore | UFC803024 | Amicore Ultra 30 MWCO |
| VWR Light-Duty Tissue Wipers | VWR International | 82003-820 | |
| VWR Scientific 50D Ultrasonic Cleaner | VWR International | 13089 | |
| Water Purifier | Barnstead | D11931 | |
| Yeast | ThermoFisher | BP1422 | |
| β-octylglucopyranoside | Anatrace | O311S |
Referencias
- Montal, M., Mueller, P. Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties. P NATL ACAD SCI USA. 69, 3561-3566 (1972).
- Tsofina, L., Liberman, E., Babakov, A. Production of bimolecular protein-lipid membranes in aqueous solution. Nature. , (1966).
- Funakoshi, K., Suzuki, H., Takeuchi, S. Lipid Bilayer Formation by Contacting Monolayers in a Microfluidic Device for Membrane Protein Analysis. ANAL CHEM. 78, 8169-8174 (2006).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. J AM CHEM SOC. 129, 8650-8655 (2007).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. J AM CHEM SOC. 130, 5878-5879 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nat Nano. 4, 437-440 (2009).
- Sarles, S. A., Stiltner, L. J., Williams, C. B., Leo, D. J. Bilayer formation between lipid-encased hydrogels contained in solid substrates. ACS APPL MATER INTER. 2, 3654-3663 (2010).
- Sarles, S. A., Leo, D. J. Regulated attachment method for reconstituting lipid bilayers of prescribed size within flexible substrates. ANAL CHEM. 82, 959-966 (2010).
- Sarles, S. A. Physical Encapsulation of Interface Bilayers. , Virginia Polytechnic Institute and State University. (2010).
- Sarles, S. A., Leo, D. J. Membrane-based biomolecular smart materials. SMART MATER STRUCT. 20, 094018(2011).
- Sarles, S. A. The use of virtual ground to control transmembrane voltages and measure bilayer currents in serial arrays of droplet interface bilayers. SMART MATER STRUCT. 22, 094023(2013).
- Sarles, S. A., Leo, D. J. Cell-inspired electroactive polymer materials incorporating biomolecular materials. SPIE Smart Structures and Materials+ Nondestructive Evaluation and Health Monitoring. , 797626(2011).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130, 5878-5879 (2008).
- Bayley, H., et al. Droplet interface bilayers. MOL BIOSYST. 4, 1191-1208 (2008).
- White, S. H. Analysis of the torus surrounding planar lipid bilayer membranes. BIOPHYS J. 12, 432(1972).
- Tien, H. T., Ottova, A. L. The lipid bilayer concept and its experimental realization: from soap bubbles, kitchen sink, to bilayer lipid membranes. J MEMBRANE SCI. 189, 83-117 (2001).
- Perozo, E. Gating prokaryotic mechanosensitive channels. NAT REV MOL CELL BIO. 7, 109-119 (2006).
- Kung, C., Martinac, B., Sukharev, S. Mechanosensitive channels in microbes. ANNU REV MICROBIOL. 64, 313-329 (2010).
- Bialecka-Fornal, M., Lee, H. J., DeBerg, H. A., Gandhi, C. S., Phillips, R. Single-cell census of mechanosensitive channels in living bacteria. PLoS ONE. 7, e33077(2012).
- Levina, N., et al. Protection of Escherichia coli cells against extreme turgor by activation of MscS and MscL mechanosensitive channels: identification of genes required for MscS activity. The EMBO Journal. 18, 1730-1737 (1999).
- Chiang, C. -S., Anishkin, A., Sukharev, S. Gating of the large mechanosensitive channel in situ: estimation of the spatial scale of the transition from channel population responses. BIOPHYS J. 86, 2846-2861 (2004).
- Anishkin, A., Chiang, C. -S., Sukharev, S. Gain-of-function mutations reveal expanded intermediate states and a sequential action of two gates in MscL. J GEN PHYSIOL. 125, 155-170 (2005).
- Sukharev, S. I., Sigurdson, W. J., Kung, C., Sachs, F. Energetic and Spatial Parameters for Gating of the Bacterial Large Conductance Mechanosensitive Channel, MscL. J GEN PHYSIOL. 113, 525-540 (1999).
- Deplazes, E., Louhivuori, M., Jayatilaka, D., Marrink, S. J., Corry, B. Structural investigation of MscL gating using experimental data and coarse grained MD simulations. PLOS COMPUT BIOL. 8, e1002683(2012).
- Bacterial ion channels and their eukaryotic homologs. Kubalski, A., Martinac, B. , (2005).
- Chang, G., Spencer, R. H., Lee, A. T., Barclay, M. T., Rees, D. C. Structure of the MscL homolog from Mycobacterium tuberculosis: a gated mechanosensitive ion channel. Science. 282, 2220-2226 (1998).
- Steinbacher, S., Bass, R., Strop, P., Rees, D. C. Structures of the prokaryotic mechanosensitive channels MscL and MscS. Mechanosensitive Ion Channels, Part A. , 1-24 (2007).
- Sukharev, S., Durell, S. R., Guy, H. R. Structural models of the MscL gating mechanism. BIOPHYS J. 81, 917-936 (2001).
- Perozo, E., Cortes, D. M., Sompornpisut, P., Kloda, A., Martinac, B. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418, 942-948 (2002).
- Betanzos, M., Chiang, C. -S., Guy, H. R., Sukharev, S. A large iris-like expansion of a mechanosensitive channel protein induced by membrane tension. NAT STRUCT MOL BIOL. 9, 704-710 (2002).
- Corry, B., Jayatilaka, D. Simulation of structure, orientation, and energy transfer between AlexaFluor molecules attached to MscL. BIOPHYS J. 95, 2711-2721 (2008).
- Wang, Y., et al. Single Molecule FRET Reveals Pore Size and Opening Mechanism of MscL. eLife. 3, e01834(2014).
- Anishkin, A., Akitake, B., Kamaraju, K., Chiang, C., Sukharev, S. Hydration properties of mechanosensitive channel pores define the energetics of gating. J Phys Condens Matter. 22, 454120(2010).
- Koçer, A., Walko, M., Meijberg, W., Feringa, B. L. A light-actuated nanovalve derived from a channel protein. Science. 309, 755-758 (2005).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. Mechanosensitive Channels Activity in a Droplet Interface Bilayer System. MRS Proceedings. 1621, (2014).
- Fox, R. O., Richards, F. M. A voltage-gated ion channel model inferred from the crystal structure of alamethicin at 1.5-Å resolution. Nature. 300, 325-330 (1982).
- Iwamoto, M., Oiki, S. Contact Bubble Bilayers with Flush Drainage. Sci Rep. 5, (2015).
- Barriga, H. M., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. J R Soc Interface. 11, 20140404(2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados