Method Article
Multifunzionale, Metodo Micropipetta-based per la Costituzione e la stimolazione della batteriche meccanosensibili Ion Canali in Droplet Interface bilayers
In questo articolo
Riepilogo
Canali meccanosensibili batteriche possono essere usati come trasduttori mechanoelectrical nei dispositivi biomolecolari. Bistrati interfaccia Droplet (DIB), cellula di ispirazione blocchi di costruzione di tali dispositivi, rappresentano nuove piattaforme per incorporare e stimolare canali meccanosensibili. Qui, dimostriamo un nuovo metodo basato micropipetta-di formare DIB, permettendo lo studio di canali meccanosensibili sotto stimolazione meccanica.
Abstract
MscL, un canale meccanosensibili grande conduttanza (MSC), è una valvola di rilascio osmolyte onnipresente che aiuta i batteri sopravvivono shock ipo-osmotico bruschi. E 'stato scoperto e rigorosamente studiato con la tecnica del patch-clamp per quasi tre decenni. Il suo ruolo essenziale di tradurre tensione applicata alla membrana cellulare in risposta permeabilità rende un candidato forte per funzionare come un trasduttore mechanoelectrical nei dispositivi biomolecolari basati sulle membrane artificiali. Servire come elementi costitutivi di tali dispositivi, doppi strati di interfaccia gocciolina (DIB) possono essere utilizzati come una nuova piattaforma per l'integrazione e la stimolazione dei canali MscL. Qui, si descrive un metodo basato micropipetta a formare DIB e misurare l'attività dei canali MscL incorporati. Questo metodo consiste di goccioline lipidiche acquose-incassato ancorati alle estremità delle due opposte (coassialmente) posizionate micropipette vetro borosilicato. Quando le goccioline vengono portati a contatto, un'interfaccia doppio strato lipidico èformata. Questa tecnica offre il controllo sulla composizione chimica e la dimensione di ogni gocciolina, nonché le dimensioni dell'interfaccia doppio strato. Avere uno dei micropipette collegati ad un attuatore piezoelettrico armonico fornisce la capacità di fornire uno stimolo oscillatorio desiderato. Attraverso l'analisi delle forme delle goccioline durante la deformazione, la tensione creata all'interfaccia può essere stimata. Usando questa tecnica, viene riportata la prima attività di canali in un sistema MscL DIB. Oltre canali MS, attività di altri tipi di canali possono essere studiate usando questo metodo, dimostrando la multifunzionalità di questa piattaforma. Il metodo qui presentato permette di misurare proprietà di membrana fondamentale, fornisce un maggiore controllo sulla formazione delle membrane simmetrici e asimmetrici, ed è un modo alternativo per stimolare e studiare canali meccanosensibili.
Introduzione
Negli ultimi dieci anni, il montaggio di doppi strati lipidici artificiali è stata sostanzialmente avanzato attraverso lo sviluppo del metodo di doppio strato di interfaccia delle gocce. Conosciuto come stabile e robusto, DIB si imposero come sistemi modello alternativi alla classica dipinta (Mueller) e piegati bistrati (Montal-Mueller) planari 1. Anche se l'idea di utilizzare gocce per creare doppi strati lipidici risale al 1960 2, non ha guadagnato la popolarità fino a tempi recenti. Il primo tentativo di successo è stato segnalato dal gruppo Takeushi 3, seguito da diversi studi che dimostrano formazione doppio strato utilizzando una rete di goccioline dal gruppo Bayley 4-6. Più recentemente, tecniche di incapsulamento sono stati proposti dal gruppo Leo 7-9, che ha introdotto il concetto di usando DIB come elementi costitutivi di nuovi sistemi materiali stimoli-reattiva 10. In studi precedenti, DIB hanno dimostrato la loro capacità di rispondere alle elettrica 9,11, chemiCal 10,12, e ottica 13 stimoli. Vari biomolecole con diverse funzionalità stimoli-reattiva sono stati effettivamente stimolato quando ricostituita nel DIB 10,14. Alla luce di questi tentativi riusciti una domanda importante è sollevata: potrebbe rispondono DIB di stimolo meccanico quando biomolecole appropriate sono incorporati? Le forze interfacciali che agiscono su un DIB differiscono da quelli degli altri 15,16 sistema doppio strato. Pertanto, la tensione nel doppio strato in possesso delle goccioline potrebbe essere controllata regolando la tensione alle interfacce acqua-lipide-olio; un concetto non applicabile con i sistemi doppio strato dipinti o piegati.
Canali MscL, notoriamente conosciuto come valvole di rilascio osmolyte e gli elementi fondamentali della membrana citoplasmatica dei batteri, reagiscono ad un aumento della tensione della membrana 17,18. In caso di shock ipo-osmotico, più canali residente nella membrana di una piccola cella 19 può generare un masrisposta permeabilità sive di rilasciare rapidamente ioni e piccole molecole, salvando i batteri da lisi 20. Biofisico, MscL è ben studiato e caratterizzato in primo luogo attraverso la patch clamp prominente tecnica 21-23. Modelli strutturali affidabili che spiegano il meccanismo di gating 24,25 del MscL sono proposti in base alla struttura del suo omologo di cristallo 26,27, modellando 28, e risultati di un'ampia sperimentazione 24,29-31. Sotto una tensione applicata di ~ 10 mN / m, il canale chiuso che consiste in uno stretto fascio di eliche transmembrana, si trasforma in un anello di eliche fortemente inclinate formando un ~ 28 Å di riempimento d'acqua dei pori conduttivo 21,24,32. È stato anche dimostrato che l'idrofobicità del cancello stretto, posizionato all'intersezione dei domini TM1 interne, determina la soglia di attivazione del canale 33. Corrispondentemente, si è constatato che diminuendo la idrofobicità del cancello, la tension soglia potrebbe essere abbassata 22. La struttura, di MscL reso possibile la progettazione di varie valvole controllabili 34, principalmente per motivi di consegna della droga. Per tutte le proprietà di cui sopra e in base al suo ruolo fondamentale di tradurre membrana cellulare tensioni eccessive in attività elettrofisiologiche, MscL rende una grande misura come trasduttore mechanoelectrical in DIB.
In questo articolo, vi presentiamo un metodo basato micropipetta-originale per formare DIB e misurare l'attività dei canali MscL incorporati sotto stimolazione meccanica. Segnaliamo per la prima volta, la risposta di DIB di stimolo meccanico e la ricostituzione funzionale del mutante V23T a bassa soglia di MscL in DIB 35.
Il sistema sperimentale è costituito da lipidi incassato goccioline acquose ancorate alla punta delle due opposte micropipette vetro borosilicato. Quando le goccioline vengono portati a contatto un'interfaccia doppio strato lipidico è foconfermate. Questa tecnica offre il controllo sulla composizione chimica e le dimensioni di ogni goccia (bulk), nonché le dimensioni dell'interfaccia doppio strato. Inoltre, le membrane asimmetriche con varie composizioni lipidiche in ciascun foglio potrebbero essere facilmente formate. Avere uno dei micropipette collegati ad un attuatore piezoelettrico armonica, fornisce la possibilità di applicare un ciclo singolo preprogrammato o stimolo oscillatorio. La tensione è consegnato alla membrana artificiale attraverso la compressione dei due goccioline sostengono. Come risultato della gocciolina deformazione, le aree di interfacce aumento acqua-lipide-olio, e contemporaneamente l'angolo tra le goccioline diminuisce, causando un aumento della tensione della membrana e l'attivazione transiente MscL. Attraverso l'analisi delle forme delle goccioline durante la deformazione, la tensione creata all'interfaccia potrebbe essere stimato. Anche se l'attenzione in questo articolo è sulle proprietà meccano-trasduzione del DIB, abbiamo anche sottolineare che altri tipi di biomolecole, come alameticina, possono essere attivati da questa piattaforma multifunzionale. Presentiamo qui, tutti gli aspetti tecnici della preparazione, assemblaggio, e prendendo le misure con questo nuovo metodo in modo step-by-step.
Protocollo
1. Preparazione di PEG-DMA idrogel
- Selezionare un appropriato di misurazione / miscelazione contenitore (fiasco, coppa, ecc.) Per l'applicazione. Pulire accuratamente con acqua e sapone, e poi pulirla con tergicristalli di tessuto privo di lanugine.
- Indossare guanti per evitare di contaminare la vetreria con oli di punta delle dita. Sciacquare il contenitore con abbastanza acqua deionizzata per rimuovere i residui di detersivo.
- Pulire il contenitore con il tessuto privo di lanugine per eliminare l'acqua, quindi spruzzare con alcool isopropilico (IPA, 99,5%) e strofinare fino a completa pulizia. Metterla in una camera a vuoto per consentire a tutti IPA evaporare completamente. Pulire il resto delle attrezzature di laboratorio utilizzati nel processo di formatura idrogel con acqua distillata.
- Per preparare un 40% (w / v) di PEG-DMA idrogel, pesare 4 g di poli (glicole etilenico) dimetacrilato (PEG-DMA; PM = 1000 g / mol) di polimero utilizzando una scala di laboratorio.
- Posizionare il pesato PEG-DMA nel pallone e calore utilizzando un bagno di sonicazione a 45-55 ° C fino a che il solido PEG-DMA è liquefatto. Durante il processo, coprire l'apertura del pallone di carta / cera Parafilm per mantenere l'acqua fuori.
- Una volta che il PEG-DMA ha liquefatto, aggiungere soluzione tampone (500 mM KCl, 10 mM MOPS, pH 7,0) fino a volume totale raggiunge ~ 10 ml (sufficienti per alcuni esperimenti su un periodo di sei mesi).
- Aggiungere il catalizzatore nel 0,5% (w / v). In questo caso, aggiungere 0,05 g dell'agente indurente alla miscela 10 ml. Porre il pallone indietro nel bagno sonicatore e consentire ai componenti di sciogliere in soluzione (circa 10 minuti, a 250 watt).
NOTA: Una volta che il catalizzatore è stato aggiunto alla soluzione, gli idrogeli cureranno (solidificare) se esposto a qualsiasi fonte di luce per un periodo di tempo sufficiente. Per contribuire a combattere questo, avvolgere la fiala / contenitore con nastro adesivo nero e riporlo in un luogo buio. Questa soluzione può essere conservata per diverse settimane a temperatura ambiente (22 ° C).
2. Preparazione di Liposomes
- Preparare 10 ml di una / ml soluzione lipidica 2 mg aggiungendo 10 ml di tampone (500 mM KCl, 10 mM MOPS, pH 7,0) a 20 mg di 1,2-diphytanoyl- sn -glycero-3-fosfocolina (DPhPC) sintetica lipidi acquistato come polvere liofilizzata. Assicurarsi che sia lipidi vescicole e soluzione tampone siano ben amalgamati (la miscela dovrebbe essere omogeneo e nebbioso quando tutto è sciolto).
- Congelamento (-20 ° C) e scongelare completamente la nuova miscela lipidica per un totale di sei volte. Lasciare disgelo miscela a temperatura ambiente, non in un ambiente riscaldato.
- Utilizzando un estrusore disponibile in commercio, estrudere i lipidi forzando l'intera sospensione lipidica prima attraverso un filtro a membrana di policarbonato 0,4 micron e poi sei volte attraverso un filtro 0,1 micron membrana. Questo processo produce particelle con diametri vicino 100 nm (pari alla dimensione dei pori del filtro).
NOTA: Altri lipidi e rapporti lipidici può essere preparato utilizzando questo miThOD. I liposomi devono essere conservati a 4 ° C per diverse settimane.
3. Isolamento MscL e Ricostituzione
- Consecutive su una piastra di agarosio temperatura, contenente 100 mg / ml ampicillina, E. cellule coli MJF465 con un plasmide pB10b che porta il gene V23T MscL esteso con un suo 6 tag all'estremità 3 '(C-terminale). Lasciare la piastra di coltura durante la notte (12-16 ore) a 37 ° C in un incubatore stazionaria. Il plasmide è selezionato e mantenuto in cellule con 100 ug / ml ampicillina in terreno LB standard. Il prossimo luogo il giorno 20 ml di LB supporti con 100 mg / ml di ampicillina in una vescicola coltura (un pallone da 50 ml o ciò che è disponibile per contenere la cultura). Prendere la piastra che è stato coltivato durante la notte e selezionare una colonia dalla piastra di trasferire (inoculare) al preparato 20 ml LB media con un bastone inoculazione sterile. Lasciare la cultura 20 ml di crescere durante la notte (12-16 ore) a 37 ° C a 250 rpm in un incubatore agitazione.
- Decantare il 20 ml overncultura ight in 2-4 L di terreno LB. Ampicillina non è più necessaria. Agitare i flaconi in un incubatore agitazione a 250 rpm a 37 ° C fino a OD 600 raggiunge 0,5. Aggiungere isopropil β-D-1-thiogalactopyranoside (IPTG) ad una concentrazione finale di 0,6 mM e lasciate cultura andare per un'altra ora (a OD 600 = 0,8-1,0).
- Mettere i palloni sul ghiaccio per raffreddare le culture e quindi raccogliere i batteri per centrifugazione. Utilizzare sei provette coniche 400 ml (o come molti come consentito dal rotore utilizzato) e centrifugare per 5-8 min a 7.438 xg che è sufficiente per far sedimentare i batteri. Decantare il surnatante, e ripetere la procedura fino a quando tutte le celle da parte dei media sono raccolti. Il numero di giri richiesto varia in base alla quantità di cultura che è stato coltivato e il rotore utilizzato. Per una cultura 2 L è necessaria solo per far girare le cellule una volta. Trasferire tutte le cellule raccolte in un unico tubo da centrifuga.
- Risospendere il pellet di cellule in ~ 20 ml di tampone stampa francese (KP 100 mMie 5 mM MgCl 2, pH 7,4). La sospensione deve essere denso (come crema o latte). Immediatamente prima French-pressatura della sospensione aggiungere il phenylmethylsulfonyl fluoruro di inibitore della proteasi (PMSF) ad una concentrazione finale di 2 mM e mescolare vigorosamente.
- French-press della cultura, in una cella francese pressione 35 ml, a 10.000 a 16.000 psi. Centrifugare la sospensione per separare le cellule intatte a 7.438 xg, 10 min a 4 ° C.
- Mettere il supernatante in un tubo separato, e aggiungere ad esso lisozima e DNasi (0,2 mg / ml). Lasciate caduta surnatante per 10 minuti a temperatura ambiente.
NOTA: DNasi è facoltativo; riduce la viscosità per la centrifugazione ad alta velocità. Il lisozima è critica; digerisce i resti di parete cellulare e aiuta ad aumentare la resa di estrazione a membrana fatto con un detergente non denaturazione mite.
- Distribuire il mix surnatante in due tubi ultracentrifuga e girare a106,883-153,911 xg (a seconda del rotore) a 4 ° C per 40 min. Dopo centrifugazione, il surnatante viene decantato e il pellet brunastro in basso (la frazione di membrana totale) può essere congelato nel tubo per la conservazione a lungo termine (- 80 ° C) o utilizzata per la purificazione della proteina immediata.
- Preparare 0,5-1 L di tampone alta Imidazolo: NaCl 100 mM imidazolo + 500 mm, titolare a pH 7,2-7,4 con HCl concentrato. Si noti che imidazolo è una buona sostanza tampone da solo.
- Preparare 0,5-1 L di tampone Low Imidazolo: NaCl 100 mM, imidazolo 15 mM +, diluendo opportunamente il buffer sopra con NaCl 100 mM. Non è richiesto alcun aggiustamento del pH.
- Prendere 100-150 ml di ciascun buffer in bottiglie separate, e aggiungere 1% (w / v) glucopyranoside b-ottil (OG). Agitare bene la soluzione e filtrare attraverso un filtro di 0,22 micron. Queste soluzioni sono le soluzioni cromatografiche basso e ad alto imidazolici.
- Preparare tampone di estrazione, prendere 50 ml di tampone a bassa imidazolo, e aggiungere 3% (w / v)OG e filtrare il buffer.
- Utilizzare pellet membrana di 0.5-2 g di peso umido per l'isolamento delle proteine. Aggiungere 5-7 ml di tampone di estrazione, risospendere il pellet, e omogeneizzare in un omogeneizzatore vetro-pistone 30 ml mano azionato. Con 5-10 movimenti delicati fare una sospensione omogenea e senza grumi. Prestare attenzione, sforzo di taglio è noto per provocare la denaturazione delle proteine.
- Centrifugare le particelle insolubili (intermedio centrifuga, rotore ad angolo fisso, 38,478-68,405 xg, a 4 ° C per 15 min). Nel frattempo, prendere 3 ml di perline Ni NTA (6 ml di sospensione) e lavare una volta con il buffer di basso-imidazolo (w / o OG) da loro agitando in 15 ml tappo a vite del tubo. Lasciate che le perline si depositano sul fondo (~ 5-7 min) o girare giù a 129-201 xg per un minuto a 4 ° C. Una volta che il pellet è formato, decantare attentamente il supernatante a mano e ripetere la procedura. Equilibrare le perline con 2-3 ml di 3% tampone di estrazione OG.
- Mescolare la miscela omogeneizzata (membrana pellet e tampone di estrazione) da 3.12 con 3-3,5 ml Ni NTA perline. Lasciate che la caduta miscela in una provetta con tappo a vite per 60 minuti (batch-carico). Spin le perle fino a 201 g (30 sec), decantare il surnatante a mano, e lavare le perline con 1% OG tampone basso imidazolo una volta. Pellet di nuovo le perle come in 3.13 e risospendere in 20-30 ml di tampone fresco a basso imidazolo.
- Portate con voi un piccolo colonna (dotato di un adattatore di flusso superiore) con le perline Ni NTA, e lasciare che le perle si depositano aprendo il rubinetto di arresto per permettere il flusso estratto attraverso (non consentono le perline ad asciugare). Lavare le perline con un'aliquota di 10 ml a bassa imidazolo tampone (1% OG) con il rubinetto aperto.
- Caricare la macchina cromatografia con bassa pura e alta imidazolo buffer circa 25 ml di ciascuna alla portata del computer definita (varia per macchina); questo viene fatto passando buffer low-imidazolo attraverso il sistema prima. Azzerare il masterizzatore a OD 260 (baseline). Si noti che il buffer è molto diverso da acqua a causa di basso grado imidazolo ha impurities che assorbono UV. Inserire l'adattatore di flusso alla colonna e collegarlo alla macchina.
- Lavare nuovamente la colonna con tampone di bassa-imidazolo (a 1 ml / min) fino al diametro esterno del flusso attraverso la linea di base viene raggiunge (può richiedere 10-20 ml). Questo rimuove le proteine non legate dalla colonna.
- Applicare un gradiente lineare di imidazolo da 20 a 500 mM, per 30 minuti, a 1 ml / min. Inizia la raccolta di 4 ml frazioni quando OD 600 mostra un aumento. Le prime due frazioni sono pieni di proteine debolmente legate, considerando MscL-6His inizia eluizione a ~ 40% del gradiente lineare. La maggior parte della proteina appare in frazioni da 3 a 8.
NOTA: un aumento lineare della OD sarà osservato a causa della crescente% di imidazolo. - Pool frazioni 3-4, 5-6, e 7-8 insieme. Opzionalmente, concentrare le frazioni singolarmente. Concentrare le frazioni 6-10 volte utilizzando filtri centrifughe. Dopo 20 min a 804 xg rotazione ed a 4 ° C, risospendere accuratamente la proteina concentrata,la proteina tende ad attaccarsi al filtro.
- Ritirare aliquote di 50 microlitri, mescolarle con tampone campione SDS, e verificare la presenza di proteine purezza mediante elettroforesi PAGE gel.
NOTA: MscL migrerà come banda confusa di circa 17 kDa al fondo del gel. - Utilizzare frazioni concentrate di quantificare la proteina utilizzando un kit di analisi di proteine, seguendo le istruzioni del produttore. Una resa tipica di un 0,8 g pellet membrana è fino a 0,2 mg di proteina pura in frazioni riunite.
- Ricostituire V23T MscL nei liposomi DPhPC attraverso la dialisi. Prendete un / soluzione di 10 mg ml di cloroformio di DPhPC e aliquota 0,5 ml (cioè 5 mg di lipidi) di esso in tre usa e getta a fondo tondo (12 x 130 mm), tubi di vetro. Essiccare il lipide sotto il flusso di azoto e rimuovere i residui di cloroformio sotto vuoto (4-6 ore).
- Aggiungere 15 20 mg di polvere OG al lipide secca in ogni provetta, scioglierlo in 2 ml di tampone di dialisi (KCl, 5 Kpi mM, pH 7,2 100 mM), vortex, e misonicare ldly. I lipidi OG-solubilizzazione dovrebbero costituire una soluzione limpida.
- Aggiungere le soluzioni V23T MscL concentrate in ogni provetta di raggiungere 1: 100, 1: 300 e 1: 1.000 proteina-to-lipidico rapporti e vortice bene. Tagliare e lavare tre pezzi (~ 12 cm di lunghezza) di tubo di dialisi (MWCO 8000, diametro 7,5 millimetri, hanno tre paia di clip numerati pronti.)
- Posizionare le miscele solubilizzate lipide-proteina all'interno del tubo, chiudere con cura le estremità con clip e dializzare contro 2 L di tampone (KCl 100 mM, 5 mM Kpi, pH7.2) per 48 ore a 4 ° C con quattro cambiamenti del tampone ogni 12 ore. Dopo la dialisi, Proteo-liposomi sono pronte.
NOTA: La soluzione di liposomi può essere integrato con 2 mM di NaN3 (sodio azide) e conservato a 4 ° C. Evitare il congelamento.
4. Produzione di serbatoio dell'olio
- Praticare due fori contrapposti (1,0 mm di diametro) tutto il percorso attraverso la parete di diametro 2 pollici, 1,5 cm cyl acrilici lunghiinder a 1 cm dal fondo (Figura 1A).
- Praticare due fori di 4 mm concentrici al già forato 1 Fori mm. Le profondità dei fori devono essere di 1 mm ciascuno (fare attenzione a non forare fino in fondo). Questi fori sono fatte per misura le guarnizioni in gomma.
- Posizionare e colla due guarnizioni in gomma aventi diametri 1 mm interni nei fori più grandi per evitare perdite d'olio.
- Incollare il cilindro lavorato per 10 cm x 10 cm foglio acrilico sottile utilizzando qualsiasi epossidica multiuso (Figura 1).
Il giorno dell'esperimento:
5. Preparazione di elettrodi
- Tagliare una lunghezza di 7 cm di due fili d'argento 250 micron di diametro, e quindi immergere le loro punte in candeggina per due ore per formare un argento-cloruro (AgCl) rivestimento. Un colore grigio indica che un rivestimento AgCl è stato formato (figura 2E).
- Utilizzando un tagliatore di vetro, dividere una lunga 10 cm, 1 / 0,58 OD / ID mm CAPIL classe borosilicatolary in due 5 cm capillari.
- Utilizzando un ago Microfil 34 calibro riempire i capillari con l'idrogel PEG-DMA. Per evitare che l'idrogel idratata da gonfiore fuori del capillare, mantenere una distanza tre millimetri alle estremità e assicurarsi che non vi siano bolle d'aria nei capillari.
- Inserire gli elettrodi Ag / AgCl nelle idrogel pieno capillari (Figura 2E).
- Curare l'idrogel PEG-DMA attraverso fotopolimerizzazione radicali liberi in seguito all'esposizione ai raggi UV per 2 min a 1 W con una pistola macchia UV.
6. di iniziare l'esperimento
NOTA: L'esperimento è installato sotto una gabbia di Faraday a terra a una messa a terra dell'amplificatore patch.
- Attaccare una delle micropipette per un titolare microelettrodo rettilineo che ha un connettore maschio (Figura 2E).
- Collegare il titolare microelettrodo al headstage dell'amplificatore patch (Figura 2A). Per collegare il headstage a terra, saldare un filo di rame isolato 18 gauge a un connettore appropriato per headstage.
- Montare headstage su 3 assi micromanipolatore manuale. Fissare la piastra di montaggio headstage (che dovrebbe essere acquistato insieme al micromanipolatore o su misura in un negozio di macchina) micromanipolatore e quindi collegare il headstage alla piastra di montaggio con viti appropriate.
- Fissare la seconda micropipetta all'attuatore lineare attraverso un connettore lab-made e poi montare sia su un secondo micromanipolatore (Figura 2B). Le micropipette devono essere opposti tra loro, allineati e livellati in orizzontale. Nota: il marchio e lo stile dei manipolatori non contano.
- In una fiala di vetro, mescolare 0,1 ml di liposomi DPhPC con 0,01 ml della soluzione proteoliposome V23T MscL.
NOTA: Questo passo è necessario per ridurre il rapporto proteina-to-lipidi (~ 0,0002), che è fondamentale per la formazione di un lipide bilaye stabiler.
- Utilizzando un Microfil ago 34 gauge, riempire le punte di entrambi micropipette con proteoliposome soluzione (Figura 3A).
- Posizionare serbatoio su di un microscopio in posizione verticale, e alimentare i micropipette attraverso le opposte fori di 1 mm (Figura 2B). NOTA: qualsiasi microscopio potrebbe essere usato come lungo le gocce possono essere chiaramente visibili.
- Riempire il serbatoio alla superficie con Esadecano (99%). Il Esadecano non ha bisogno di ulteriore purificazione.
- Per formare le goccioline sferiche sulla punta delle micropipette, utilizzare un terzo 10 micron di diametro vetro borosilicato micropipetta, montato su un terzo micromanipolatore per erogare la soluzione V23T diluita MscL proteoliposome (~ 0.00052 ml) alle punte delle micropipette e formare la goccioline (Figura 3).
- Controllare la dimensione delle gocce (diminuendo o aumentando il volume) come desiderato e lasciate riposare per 10 min per i monostrati di formare completamente (FIGURA 3).
- Portare le goccioline in contatto, formazione bistrato avviene entro 1 a 2 min.
7. configurazione del software e Impianti
- Preparare il software girando sui computer, microscopio, controllore oscillatore piezoelettrico, generatori di funzioni, amplificatore di patch, e il sistema di acquisizione dati a basso rumore.
NOTA: qualsiasi amplificatore cerotto potrebbe essere utilizzato e le seguenti istruzioni sono specificamente per quello che abbiamo usato e che è elencato nella lista materiali e attrezzature. - Sul pannello frontale dell'amplificatore patch, impostare le manopole "Mode" per VHOLD / IHOLD e V-CLAMP.
- Sul pannello frontale impostare il "passa-basso" Bessel Filtro a 1 kHz e guadagno in uscita a 2.
- Impostare la "Configurazione" a cellula intera β = 1.
- Assicurarsi che il resto delle manopole sono impostati a zero o in posizione neutra.
- Esempio di tutte le misure di corrente DIB a 5 kHzcon un 1 kHz Bessel filtro anti-aliasing.
- Eseguire il software facendo doppio clic sull'icona sul desktop.
- Fai clic su "Configura> Digitizer" per aprire la finestra di dialogo "digitalizzatore", e quindi fare clic sul pulsante "Modifica".
- Nella finestra di dialogo "Modifica digitalizzatore" selezionare "Digidata 1440 Series" dalla lista "digitalizzatore Type".
- Fare clic sul pulsante Scan per rilevare il digitalizzatore.
- Fare clic su "OK" per uscire dalla finestra "Modifica digitalizzatore", e quindi fare clic su "OK" per uscire dalla finestra "digitalizzatore".
- Fai clic su "Configura> Lab Bench".
- Nella scheda segnali di ingresso del laboratorio Panchina, selezionare analogico in un sotto Digitizer Canali. Impostare il fattore di scala di 0.002.
8. Formazione del doppio strato lipidico
- Utilizzando un cavo BNC, collegare l'uscita del awgeneratore aveform al fronte all'ingresso comando esterno acceso (sul pannello posteriore del sistema di acquisizione dati). Invia un pk-pk-a forma d'onda triangolare 10 Hz, 500 mV per headstage.
- Utilizzando il micromanipolatore, spostare le micropipette di vetro in senso orizzontale per portare le goccioline a contatto fino a quando non toccano leggermente ed attendere doppio strato diradamento a verificarsi (di solito circa 1-2 min) (Figure 3C e 3D).
NOTA: progressione del processo di formazione doppio strato può essere visto visivamente attraverso il microscopio e può essere monitorato mediante misurazione di corrente (Figura 4).
- Regolare le dimensioni doppio strato (~ 250 micron di diametro) controllando la posizione della goccia montato sull'attuatore, utilizzando micromanipolatore. Nota: la dimensione del doppio strato potrebbe essere stimato visivamente attraverso il microscopio. Questo metodo rende più facile per il ricercatore per controllare la dimensione del doppio strato da facilmentespostando le goccioline usando micromanipolatori.
9. dinamica eccitazione e MscL Gating
- Una volta che il doppio strato è formato ed è stabile (cioè il doppio strato non rompersi o conduttivo), stimolare le goccioline inviando un segnale sinusoidale utilizzando un generatore di funzione.
- Per stimolare la proteina MscL incorporato nel doppio strato, invia una forma d'onda sinusoidale di ampiezza 175 micron da picco a picco, frequenza di 0,2 Hz, e il 50% duty cycle al servo-regolatore piezoelettrico. (Vari tipi di forme d'onda possono essere inviati con diverse ampiezze, frequenze e duty cycle)
10. Trattamento e Risultati Interpretazione
- Salvare le misure di corrente, registrati con il sistema di acquisizione dati, in formato .ABF. Importazione di dati (in formato .ABF) a Matlab utilizzando un file funzione "abfload", quindi analizzare ed elaborare i dati. Il file "abfload" è disponibile gratuitamente online.
- Stima tha tensione nel doppio strato e l'espansione areale delle goccioline, utilizzando video della goccia durante cicli completi di azionamento che sono registrati utilizzando una telecamera appropriata.
- Video processo nel Matlab, dalla trasformazione singoli fotogrammi utilizzando tecniche di elaborazione delle immagini per stimare l'area dell'interfaccia acqua / olio, e l'angolo tra le goccioline. NOTA: utilizzando un telaio 2D preso dal video, rileva all'interfaccia acqua-olio (cioè il bordo della goccia) e quindi stimare la superficie dalla rivoluzione.
Risultati
Figure 1 e 2 mostra la configurazione e attrezzature sperimentale utilizzato per registrare l'attività della proteina in corso di stimolazione meccanica della membrana doppio strato lipidico. Per ridurre al minimo il rumore elettrico nelle nostre misurazioni, la workstation viene collocato all'interno di una gabbia di Faraday laboratorio artigianale, a terra per un collegamento a terra sul Axopatch 200 B amplificatore.
La formazione di una stabile isolante doppio strato lipidico è un passo fondamentale in questo studio. In questa disposizione, un monostrato lipidico assembla all'interfaccia olio / acqua delle goccioline acquose immersi in un bagno di un solvente organico. Quando le goccioline sono posti in contatto, l'olio in eccesso viene eliminato, e monostrati lipidici opposti fino ad una spessa due molecola doppio strato lipidico. La tecnica più comunemente usata nella caratterizzazione doppio strato è voltage-clamp. Con tensione-clamp, la tensione attraverso il doppio strato è mantenuta ad un valore costante mentre la corrente viene misurata. Figura 4 ritrae un tipico registrazione corrente in tempo reale della formazione doppio strato iniziale. Conoscendo la capacità specifica (~ 0,6 mF / cm 2) 5 del doppio strato lipidico DPhPC, l'area del doppio strato formato potrebbe essere calcolato. L'area doppio strato può essere controllato variando la posizione delle gocce (Figura 4A). Utilizzando l'attuatore piezoelettrico, diversi tipi di forme d'onda (sinusoidale, quadra, triangolare, ecc.) A diverse frequenze, ampiezze, e cicli di lavoro possono essere applicate alle goccioline di orizzontalmente ed assialmente li oscillano e, quindi, la tensione doppio strato e la zona potrebbero essere alterati (Figura 4B).
Quando il DIB è stimolato meccanicamente, pur mantenendo un potenziale DC costante attraverso la membrana, una bassa soglia (guadagno di funzione) V23T mutante di MscL genera attività affidabili compresi gli stati principalmente sub-conduttivi ed eventi di apertura occasionalmente completi (figura 5) . Questi evEnt sono identici a quelli registrati con la tecnica del patch-clamp da intatte interne membrane di E. coli e liposomi ricostituiti con la V23T purificato MscL. I risultati in figura 5 dimostrano che gating si verifica in risposta ad un aumento della tensione, poiché tutti picchi di corrente sono osservati a compressione picco. A compressione picco, l'espansione areale relativa delle goccioline è massima e quindi, la tensione all'interfaccia è massima.
Alameticina, un canale ionico voltaggio-dipendenti e uno dei peptidi più studiati, aumenta la permeabilità della membrana quando viene applicata una tensione continua attraverso la membrana 36. La capacità dell'interfaccia doppio strato lipidico per ospitare proteine transmembrana e peptidi è anche testato eseguendo registrazioni corrente-tensione gating utilizzando alameticina peptide. Alameticina viene miscelato con la soluzione fosfolipide ad una concentrazione finale di 100 ng / ml. La Figura 6 mostra le misure di corrente sotto morsetto di tensione (115 mV). Le goccioline in questo esperimento sono allontanati per conseguire piccola interfaccia doppio strato e quindi una maggiore resistenza e minore capacità. Il comportamento gating del peptide alameticina si manifesta attraverso i passi discreti di corrente (Figura 6). L'istogramma sul lato destro del grafico mostra le variazioni di conduttanza dal livello di base (0.0962 nS), che è sostanzialmente il primo livello di conduttanza del canale stesso.

Figura 1:. Uno schema che descrive le parti principali e le dimensioni del serbatoio dell'olio Il serbatoio dell'olio è fabbricato in officina al Virginia Tech. È costituito da un tubo acrilico cilindrica lavorata incollata alla superficie di un foglio acrilico. Le dimensioni e il design possono essere modificati per ospitare diverse applicazioni o più di due micropipette./53362/53362fig1large.jpg "Target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
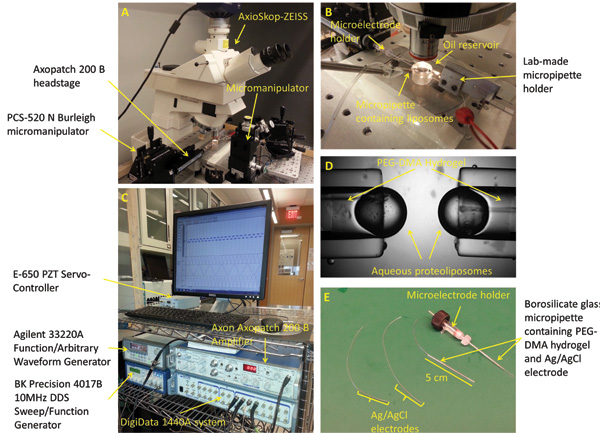
Figura 2:. Experimental setup e micropipette preparazione (A) La workstation standard per formare meccanicamente stimolante, e caratterizzare i bistrati interfaccia comprende un microscopio, manipolatori 3 assi, una fotocamera digitale, oscillatore piezoelettrico, tavolo isolamento dalle vibrazioni, e una gabbia di Faraday (non mostrato). (B) L'apparato sperimentale è costituito da due opposti PEG-DMA idrogel riempita micropipette posizionati orizzontalmente all'interno di un bagno d'olio Esadecano. Ciascuna delle micropipette contiene un elettrodo Ag / AgCl per fornire collegamento elettrico. Un terzo micropipetta riempito con proteoliposome soluzione viene utilizzata per formare le goccioline sulla punta delle altre micropipette. (C) La risposta attuale DIB potrebbe essere misuratautilizzando una combinazione dell'amplificatore cerotto e il sistema di acquisizione dati a basso rumore. (D) Un chiuso immagine che mostra le goccioline acquose formate sulla punta delle micropipette. Elettrodi (E) Ag / AgCl sono fatti immergendo la punta di due 250 micron fili d'argento in candeggina. Gli elettrodi vengono poi alimentati attraverso due capillari di vetro borosilicato riempiti con PEG-DMA idrogel, che viene curato con luce UV a solidificare. Un supporto microelettrodo diritto con connettore maschio viene utilizzato per collegare una delle micropipette al headstage dell'amplificatore patch.
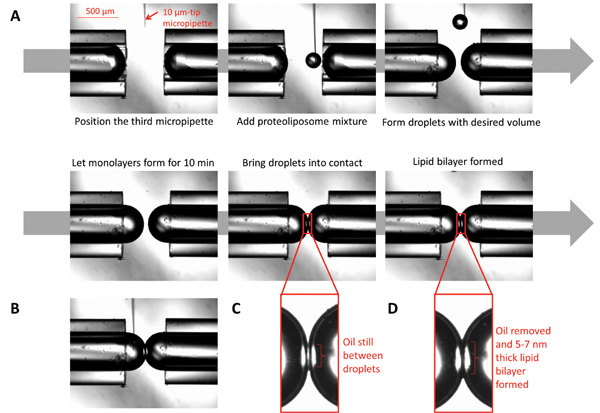
Figura 3:. Immagini che illustrano la formazione di bistrati interfaccia gocciolina (A) A 10 micron micropipetta riempito con proteoliposomi è posizionato sotto il microscopio in prossimità delle punte micropipetta. Utilizzando una siringa collegata alla micropipetta, dispensare piccoli volumidei proteoliposomi per formare goccioline sferiche a volume desiderato. Lasciate che il modulo monostrato, consentendo le goccioline di sedersi per dieci minuti. Portare le goccioline in contatto; il doppio strato formerà dopo tutto l'olio all'interfaccia è eliminato. (B) Mentre il doppio strato è formato, la composizione chimica su entrambi i lati della interfaccia potrebbe essere controllata iniettando chimici desiderati utilizzando una micropipetta micro dimensioni. (C) Le goccioline al momento del primo contatto. (D) Le goccioline quando si forma il doppio strato lipidico.
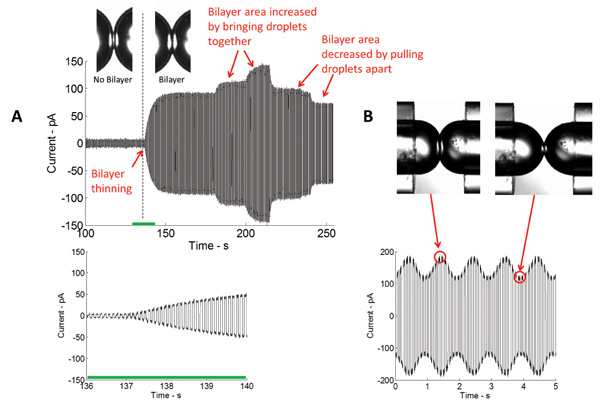
Figura 4: tempo reale misurazioni mostrano sia il diradamento iniziale e successiva espansione dell'interfaccia (A) Corrente misurata nel corso della formazione di doppio strato attraverso l'applicazione di un potenziale elettrico triangolare.. L'entità della corrente misurata è direttamente proporzionale alla Capacitanza, e così l'area dell'interfaccia doppio strato. Più le goccioline sono riuniti, maggiore è l'area dell'interfaccia e viceversa. (B) In applicazione di eccitazione meccanica, l'area dell'interfaccia doppio strato aumenta e diminuisce con la stessa frequenza del segnale di stimolazione.
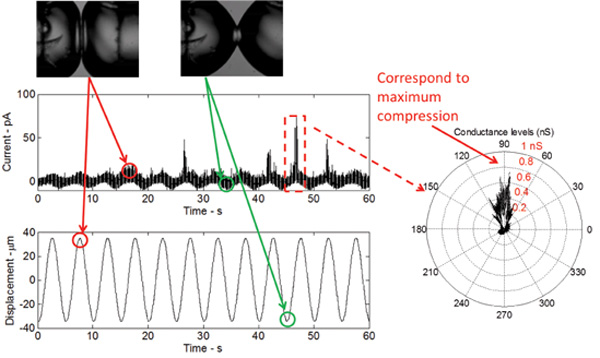
Figura 5:. Misurazioni in tempo reale mostrano la risposta del doppio strato all'eccitazione meccanica e il gating del mutante V23T di MscL La forma della risposta corrente è sinusoidale, che si riferisce ad una variazione sinusoidale in bistrato capacità come risultato di la modifica dell'area doppio strato. I picchi di corrente, che si verificano al picco di ciascun ciclo, indicano sub-conduttanza gating del mutante V23T. Un diagramma polare indica inoltre che gating verifica a compressione di picco, che riflette un aumento della tensione all'interfaccia doppio strato.
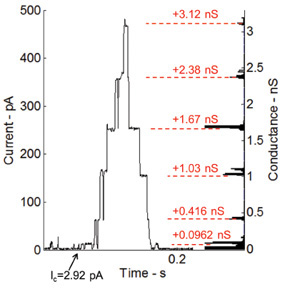
Figura 6:. Misure di corrente sotto tensione morsetto e corrispondente istogramma dei livelli di conduttanza per l'attività di controllo dell'immagine canali alameticina incorporati Il comportamento gating del peptide alameticina è mostrato attraverso l'aumento graduale discreta corrente. I livelli di conduttanza abbinano molto bene con le misurazioni precedenti eseguite dal nostro gruppo di ricerca al Virginia Tech 7.
Discussione
Mechanosensation significa una delle prime vie di trasduzione sensoriale che si sono evoluti negli organismi viventi. L'utilizzo di questo fenomeno per lo studio e la comprensione delle proprietà meccano-elettrica del DIB, è un passo cruciale verso materiali stimoli-reattiva funzionali. Essa implica l'incorporazione e l'attivazione di un canale meccanosensibili, MscL, nel DIB come trasduttore mechanoelectrical e un estensimetro per rilevare aumento tensione nell'interfaccia doppio strato lipidico. In un'altra nota, la funzione di canali SM potrebbe essere regolata tramite le proprietà del materiale di base di bistrati lipidici, quali spessore, curvatura intrinseca e compressibilità. Alla luce di quanto sopra, la tecnica basata micropipetta-fornisce un valido strumento che consente al ricercatore la capacità di studiare canali MS in DIB e fornisce lo studio della struttura del doppio strato lipidico, nonché le interazioni proteina-lipide.
Negli ultimi tre decennios, patch-clamp era il metodo primario per studiare canali MS, in quanto consente di bloccaggio sia tensione e tensione. Tuttavia, patch-clamp richiede attrezzature ingombranti e non adatto per la miniaturizzazione, una proprietà necessaria per la progettazione di dispositivi sensoriali e di conversione. DIB per la loro semplicità, stabilità, e compattezza rappresentano un ambiente adatto per studiare l'attività di MscL. Qui, estendiamo precedenti progressi nelle tecniche di formazione DIB proponendo una tecnica basata micropipetta-, con la capacità di controllare la dimensione delle goccioline e l'interfaccia doppio strato, la composizione chimica di ogni goccia, e la tensione all'interfaccia attraverso la stimolazione dinamica. La tecnica consiste di ancorare goccioline acquose, contenente proteoliposomi, fino alla punta delle coassiale opposte capillari di vetro. Le goccioline sono poste in un bagno di solvente organico e quando vengono portate in contatto un doppio strato lipidico forme all'interfaccia.
Le micropipette sono collegati a poscillatori iezoelectric, permettendo lo spostamento orizzontale delle goccioline. Dinamicamente comprimendo le goccioline, determina un aumento della tensione interfacciale all'interfaccia olio acqua e quindi un aumento della tensione doppio strato. Due importanti aspetti differenziano questo metodo dal simile e recentemente pubblicato contatto bolla doppio strato (CBB) tecnica 37. Utilizzando la tecnica qui presentata, la dimensione del doppio strato è controllato usando micromanipolatori e quindi i volumi delle goccioline rimangono costanti, a differenza del metodo CBB. Inoltre, la tecnica CBB richiede pompe a pressione, che non sono necessari nel metodo presentato in questo documento rendendo più semplice e più facile da costruire.
Possiamo incorporare e stimolare batterica MscL per la prima volta senza l'uso di una pipetta patch o modificazioni chimiche 38. Poiché il sistema facilita la formazione di robuste membrane asimmetriche doppio strato lipidico, imita più da vicino il lasimmetria IPID trovato nelle membrane biologiche. Questo ci permette di studiare gli effetti di composizione della membrana controllato o asimmetria sull'attività di MscL. Inoltre, attraverso tecniche di elaborazione delle immagini, questo metodo permette di stimare la tensione all'interfaccia doppio strato. Questa tecnica aiuta a comprendere i principi di interconversione tra le forze di massa e di superficie nel DIB, facilita le misure delle proprietà di membrana fondamentali, e migliora la comprensione della risposta MscL a membrana tensione.
Anche se questo metodo ci porta un passo avanti verso un sistema materiale stimoli-responsive biomolecolari e ad un ambiente fisiologico diverso per studiare MscL, vi sono limitazioni al sistema. Tensione in questo sistema non può essere bloccato a causa della presenza del serbatoio lipidi in forma di liposomi in ogni goccia, che tende per alleviare la tensione all'interfaccia acqua / olio. Pertanto, attualmente i canali meccanosensibili può essere stimolatoin DIB solo in un regime dinamico. La presenza di bolle d'aria nel sistema influenza significativamente la precisione e la riproducibilità degli esperimenti. Le bolle d'aria presenti nel idrogel potrebbe provocare perdita se il collegamento elettrico.
Mentre si descrive l'uso del metodo basato micro-pipetta per la stimolazione della MscL, la tecnica potrebbe essere utilizzata per studiare altri tipi di canali SM e ha il potenziale per essere utilizzato dai ricercatori per studiare una varietà di biomolecole. Per esempio, configurazione simile è stata utilizzata nel nostro laboratorio per studiare la risposta mechanoelectrical di un'interfaccia gocciolina membrana a doppio strato libero-channel. Varie proteine potrebbero essere ricostituito e attivate con questa configurazione altamente controllato, prendendo in considerazione che gli ambienti di ricostituzione di ogni biomolecole variano. Il metodo descritto in questo articolo tocca una potenziale applicazione notevolmente più ampio che è limitato solo alla fantasia del ricercatore.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ricerca riportata in questa pubblicazione è sostenuta dall'Ufficio Air Force di ricerca scientifica di base dell'iniziativa di Grant FA9550-12-1-0464.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Corning | 430624 | |
| 1,2-diphytanoy-sn-glycero-3-phosphocholine (DPhPC) | Avanti Polar Lipids | 850356P | Purchased as lyophilized powder |
| 34-gauge microfil | World Precision Instruments | MF24G-5 | |
| 400 mL Centrifuge bottels | ThermoFisher | 3141 | Nalgene |
| Agilent Function/Arbitrary Waveform Generator, 20 MHz | Keysight Technologies | 33220A | |
| Ampicillian | ThermoFisher | BP1760 | ACS Grade |
| Avanti® Mini-Extruder | Avanti Polar Lipids | 610000 | |
| Axio Scope.A1 | Carl Zeiss | - | |
| AxioCam HSm | Carl Zeiss | - | |
| Axopatch 200B Amplifier | Molecular Devices | - | |
| BCA protein assay kit | Pierce | 23225 | |
| BK Precision 4017B 10 MHz DDs Sweep/Function Generator | Digi-Key | BK4017B-ND | |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100F-4 | |
| Dialysis tubing | 7 Spectra/Por | 132113 | MWCO 8000, 7.5 mm diameter |
| DigiData 1440A system | Molecular Devices | - | |
| DNAse | Sigma-Aldrich | DN25 | |
| DPhPC | Avanti | 850356C | |
| E-625 PZT Servo-Controller | Physik Instrumente | E-526 | |
| FPLC System | Pharmacia Biotech | - | |
| HCl | J.T. Baker | 9535-33 | |
| Hexadecane, 99% | Sigma-Aldrich | 544-76-3 | |
| Homoginizer | Wheaton | 357426 | 15 mL |
| Imidazole | Sigma-Aldrich | I5513 | |
| IPTG | Affymetrix | 17886 | |
| IRGACURE® 2959 | IRGACURE® | 555047962 | |
| Isopore Membrane Filters | EMD Millipore | VCTP02500 | |
| Isopropyl Alcohol | VWR International | BDH1133-4LP | |
| KCl | Sigma-Aldrich | P3911 | ACS Grade |
| KH2PO4 | Mallinckrodt | 7100 | ACS Grade |
| Kimble-Chase | Kontes | 420401-1515 | Flex-Column |
| LED-100 UV Spot Curing System | Electro-Lite, corp. | 81170 | |
| Lysozyme | Sigma-Aldrich | L6876 | |
| Manual Patch-Clamp Micromanipulators | Thorlabs | PCS-520N | |
| MgCl2 | ThermoFisher | M33 | ACS Grade |
| Microelectrode Holder | World Precision Instruments | MEH1S | |
| Micropipette Puller | Sutter Instruments | P-1000 | |
| MOPS, minimum 99.5% titration | Sigma-Aldrich | M1254-100G | |
| N2 Gas | Airgas | UN1066 | |
| NaCl | EMD | SX0420-1 | ACS Grade |
| Ni NTA agarose beads | Qiagen | 1000632 | |
| Optically Clear Cast Acrylic Tube, 2-1/2" OD x 2" ID | McMaster-Carr | 8486K545 | |
| P-601 PiezoMove Flexure-Guided Linear Actuator | Physik Instrumente | P-601 | |
| PAGE gel | Bio-Rad | 456-9033 | |
| Parafilm M® All-Purpose Laboratory Film | Parafilm® | PM999 | |
| Phenylmethylsulfonyl fluoride | Sigma-Aldrich | P7626 | |
| Poly(ethylene glycol)1000 dimethacrylate | Polysciences, Inc. | 15178-100 | |
| Polycarbonate (PCTE) Membrane Filters, Black, 0.4 Micron, 25mm, 100/Pk | Sterlitech Corporation | PCTB0425100 | |
| Potassium Chloride | Sigma-Aldrich | P5405-500G | |
| Powder Free Soft Nitrile Examination Gloves | VWR International | CA89-38-272 | |
| Replacement Gasket 1.0mm | World Precision Instruments | GO1-100 | |
| SDS | Sigma-Aldrich | L5750 | |
| Silver wire | GoodFellow | 147-346-94 | Different diameters could be used depending on the application |
| Sodium Azide | Affymetrix | 21610 | |
| Test tubes | ThermoFisher | 14-961-27 | 12 x 130 mm |
| Tryptone | ThermoFisher | BP1421 | |
| Ultracal 30K | Millipore | UFC803024 | Amicore Ultra 30 MWCO |
| VWR Light-Duty Tissue Wipers | VWR International | 82003-820 | |
| VWR Scientific 50D Ultrasonic Cleaner | VWR International | 13089 | |
| Water Purifier | Barnstead | D11931 | |
| Yeast | ThermoFisher | BP1422 | |
| β-octylglucopyranoside | Anatrace | O311S |
Riferimenti
- Montal, M., Mueller, P. Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties. P NATL ACAD SCI USA. 69, 3561-3566 (1972).
- Tsofina, L., Liberman, E., Babakov, A. Production of bimolecular protein-lipid membranes in aqueous solution. Nature. , (1966).
- Funakoshi, K., Suzuki, H., Takeuchi, S. Lipid Bilayer Formation by Contacting Monolayers in a Microfluidic Device for Membrane Protein Analysis. ANAL CHEM. 78, 8169-8174 (2006).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. J AM CHEM SOC. 129, 8650-8655 (2007).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. J AM CHEM SOC. 130, 5878-5879 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nat Nano. 4, 437-440 (2009).
- Sarles, S. A., Stiltner, L. J., Williams, C. B., Leo, D. J. Bilayer formation between lipid-encased hydrogels contained in solid substrates. ACS APPL MATER INTER. 2, 3654-3663 (2010).
- Sarles, S. A., Leo, D. J. Regulated attachment method for reconstituting lipid bilayers of prescribed size within flexible substrates. ANAL CHEM. 82, 959-966 (2010).
- Sarles, S. A. Physical Encapsulation of Interface Bilayers. , Virginia Polytechnic Institute and State University. (2010).
- Sarles, S. A., Leo, D. J. Membrane-based biomolecular smart materials. SMART MATER STRUCT. 20, 094018(2011).
- Sarles, S. A. The use of virtual ground to control transmembrane voltages and measure bilayer currents in serial arrays of droplet interface bilayers. SMART MATER STRUCT. 22, 094023(2013).
- Sarles, S. A., Leo, D. J. Cell-inspired electroactive polymer materials incorporating biomolecular materials. SPIE Smart Structures and Materials+ Nondestructive Evaluation and Health Monitoring. , 797626(2011).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130, 5878-5879 (2008).
- Bayley, H., et al. Droplet interface bilayers. MOL BIOSYST. 4, 1191-1208 (2008).
- White, S. H. Analysis of the torus surrounding planar lipid bilayer membranes. BIOPHYS J. 12, 432(1972).
- Tien, H. T., Ottova, A. L. The lipid bilayer concept and its experimental realization: from soap bubbles, kitchen sink, to bilayer lipid membranes. J MEMBRANE SCI. 189, 83-117 (2001).
- Perozo, E. Gating prokaryotic mechanosensitive channels. NAT REV MOL CELL BIO. 7, 109-119 (2006).
- Kung, C., Martinac, B., Sukharev, S. Mechanosensitive channels in microbes. ANNU REV MICROBIOL. 64, 313-329 (2010).
- Bialecka-Fornal, M., Lee, H. J., DeBerg, H. A., Gandhi, C. S., Phillips, R. Single-cell census of mechanosensitive channels in living bacteria. PLoS ONE. 7, e33077(2012).
- Levina, N., et al. Protection of Escherichia coli cells against extreme turgor by activation of MscS and MscL mechanosensitive channels: identification of genes required for MscS activity. The EMBO Journal. 18, 1730-1737 (1999).
- Chiang, C. -S., Anishkin, A., Sukharev, S. Gating of the large mechanosensitive channel in situ: estimation of the spatial scale of the transition from channel population responses. BIOPHYS J. 86, 2846-2861 (2004).
- Anishkin, A., Chiang, C. -S., Sukharev, S. Gain-of-function mutations reveal expanded intermediate states and a sequential action of two gates in MscL. J GEN PHYSIOL. 125, 155-170 (2005).
- Sukharev, S. I., Sigurdson, W. J., Kung, C., Sachs, F. Energetic and Spatial Parameters for Gating of the Bacterial Large Conductance Mechanosensitive Channel, MscL. J GEN PHYSIOL. 113, 525-540 (1999).
- Deplazes, E., Louhivuori, M., Jayatilaka, D., Marrink, S. J., Corry, B. Structural investigation of MscL gating using experimental data and coarse grained MD simulations. PLOS COMPUT BIOL. 8, e1002683(2012).
- Bacterial ion channels and their eukaryotic homologs. Kubalski, A., Martinac, B. , (2005).
- Chang, G., Spencer, R. H., Lee, A. T., Barclay, M. T., Rees, D. C. Structure of the MscL homolog from Mycobacterium tuberculosis: a gated mechanosensitive ion channel. Science. 282, 2220-2226 (1998).
- Steinbacher, S., Bass, R., Strop, P., Rees, D. C. Structures of the prokaryotic mechanosensitive channels MscL and MscS. Mechanosensitive Ion Channels, Part A. , 1-24 (2007).
- Sukharev, S., Durell, S. R., Guy, H. R. Structural models of the MscL gating mechanism. BIOPHYS J. 81, 917-936 (2001).
- Perozo, E., Cortes, D. M., Sompornpisut, P., Kloda, A., Martinac, B. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418, 942-948 (2002).
- Betanzos, M., Chiang, C. -S., Guy, H. R., Sukharev, S. A large iris-like expansion of a mechanosensitive channel protein induced by membrane tension. NAT STRUCT MOL BIOL. 9, 704-710 (2002).
- Corry, B., Jayatilaka, D. Simulation of structure, orientation, and energy transfer between AlexaFluor molecules attached to MscL. BIOPHYS J. 95, 2711-2721 (2008).
- Wang, Y., et al. Single Molecule FRET Reveals Pore Size and Opening Mechanism of MscL. eLife. 3, e01834(2014).
- Anishkin, A., Akitake, B., Kamaraju, K., Chiang, C., Sukharev, S. Hydration properties of mechanosensitive channel pores define the energetics of gating. J Phys Condens Matter. 22, 454120(2010).
- Koçer, A., Walko, M., Meijberg, W., Feringa, B. L. A light-actuated nanovalve derived from a channel protein. Science. 309, 755-758 (2005).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. Mechanosensitive Channels Activity in a Droplet Interface Bilayer System. MRS Proceedings. 1621, (2014).
- Fox, R. O., Richards, F. M. A voltage-gated ion channel model inferred from the crystal structure of alamethicin at 1.5-Å resolution. Nature. 300, 325-330 (1982).
- Iwamoto, M., Oiki, S. Contact Bubble Bilayers with Flush Drainage. Sci Rep. 5, (2015).
- Barriga, H. M., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. J R Soc Interface. 11, 20140404(2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon