Method Article
为马科动物疱疹病毒2诊断的呼吸道液体定量PCR检测方法的开发和验证
摘要
Here, we present a protocol for the development and validation of a quantitative PCR method used for the detection and quantification of EHV-2 DNA in equine respiratory fluids. The EHV-2 qRT-PCR validation protocol involves a three-part procedure: development, characterization of qRT-PCR assay alone, and characterization of the whole analytical method.
摘要
The protocol describes a quantitative RT-PCR method for the detection and quantification of EHV-2 in equine respiratory fluids according to the NF U47-600 norm. After the development and first validation step, two distinct characterization steps were performed according to the AFNOR norm: (a) characterization of the qRT-PCR assay alone and (b) characterization of the whole analytical method. The validation of the whole analytical method included the portrayal of all steps between the extraction of nucleic acids and the final PCR analysis.
Validation of the whole method is very important for virus detection by qRT-PCR in order to get an accurate determination of the viral genome load. Since the extraction step is the primary source of loss of biological material, it may be considered the main source of error of quantification between one protocol and another. For this reason, the AFNOR norm NF-U-47-600 recommends including the range of plasmid dilution before the extraction step. In addition, the limits of quantification depend on the source from which the virus is extracted. Viral genome load results, which are expressed in international units (IU), are easier to use in order to compare results between different laboratories.
This new method of characterization of qRT-PCR should facilitate the harmonization of data presentation and interpretation between laboratories.
引言
马科动物疱疹病毒-2(EHV-2)参与了呼吸综合征,具有潜在的临床表现,如鼻分泌物,咽炎和淋巴结肿大1-3。这种病毒也怀疑与马的差性能,这可能导致对赛马业2显著和负面经济影响有关。
到现在为止,黄金标准伽玛超高压(γ-超高压)的检测是细胞培养法。这个过程的第一不便之处是不存在的EHV-2和其它区分γ-超高压的( 例如,EHV-5)。第二不便是细胞病变的过程,从12至28天采取体现4,5的发展缓慢。
一验证和标准化定量实时聚合酶链反应的发展(QRT-PCR)方法将有助于快速检测病毒,EHV-2和EHV-区分5,并研究了病毒基因组负荷和疾病由于量化方面之间的关系。
聚合酶链反应(PCR)是首次于1986年6穆利斯描述即将成为大多数生物诊断(人类,环境和兽医)等领域的新的黄金标准。该方法中,这是基于病原体的基因组的一部分的放大,具有许多优点:特异性,灵敏度和快速性。此外,扩增子污染的风险,因为定量RT-PCR检测的出现和质量保证7退去。然而,PCR方法作为新的黄金标准方法识别必要不仅仅是改进的性能数据,而且在整个方法的开发和验证步骤的控制的无性能随时间的退化的示范多。
用于检测的第一分子工具EHV-2分别为时刻c接着测序8与巢式PCR onsuming和参与非特异性扩增。疱疹病毒的靶基因是脱氧核糖核酸(DNA)聚合酶和DNA包装9。然而,嵌套式PCR显示按扩增子污染的高风险。自那时以来,常规PCR试 验已设计用于扩增白细胞介素10样基因或糖蛋白B的基因,在2009年2审查。最近,为EHV-2 10的定量进行了描述实时PCR特性,但没有数据可用关于整个方法包括提取过程的验证。
在这个协议中,开发和验证程序为根据协会法国标准化中马呼吸流体超高压-2 DNA的检测和定量的定量PCR方法描述(AFNOR)NF标准U47-600 -3,11,12-,这是法国代表国际标准化委员会。此规范详细介绍11,12了"动物卫生分析方法兽医PCR的实施,开发和验证要求和建议",根据NF EN ISO / CEI 17025 2005 13和OIE(世界动物卫生组织) 。建议2010年14超高压-2实时定量RT-PCR验证协议包括三部分过程:(一)实时定量RT-PCR检测方法的建立(二)实时荧光定量PCR检测的单独表征及(c)整体表征分析方法(从生物样品的PCR分析的核酸提取)。
的定量RT-PCR检测的,整个分析方法的特征包括的两个限制的定义:检测限(LOD)的限制和定量限(LOQ)的限制。检测限的95%的PCR表示最低数目的,可以在所有CA的95%待检测的每单位体积的核酸拷贝上课。定量限95%的PCR表示的,可以被确定考虑到不确定性核酸拷贝的最低量。
这种定量RT-PCR方法允许精确的检测和呼吸流体超高压-2快速定量。此外,该方法可以在其他实验室应用,以确保其他新的qRT-PCR测定的开发的标准处理程序和通用模板。
研究方案
注意:参考所有在图1所示的不同的步骤。
1.核酸的提取
注意:在通风橱下执行抽取,以限制与核酸气道受到污染。包括用DEPC处理过的水抽出的阴性对照,以确保没有试剂的被污染的不必要的DNA。
- 根据先前描述的方案15和制造商的方案从生物样品中提取核酸。
- 添加140微升生物样品的560微升裂解缓冲液(AVL缓冲液)孵育在室温下10分钟。添加560微升乙醇。施加第一630微升该溶液(样品+裂解液+乙醇)至硅胶柱和离心机。
- 申请的其余630微升该溶液以相同的二氧化硅柱和离心机。然后用500μl冲洗柱子2个不同的洗涤液(AW1和AW2)。
- 洗脱核酸用50μl洗脱缓冲液(AVE缓冲液),并平衡至室温。关闭盖并在室温下孵育1分钟。离心在6000克1分钟。
2.扩增程序
- 准备22.5微升反应混合物的每个反应。添加12.5微升PCR主混合物,×20μM正向引物的微升,20μM反向引物,以达到22.5微升需要10μM探头和zÿ微升微升超纯水的X-微升(X,得到y和z卷滴定后,见第3.2.3和3.2.6)。
- 等分试样22.5微升合适的反应混合物到井在96孔板的每个反应的。
注:包括萃取阴性对照和进行PCR,以确保没有试剂的被污染的不必要的DNA。 - 添加2.5微升样品,2.5微升提取是负面的e控制,PCR阴性对照的2.5微升和2.5微升阳性样品(参考株或质粒)到相应的反应井。分配后,盖上粘性板密封板。在6000克离心10秒的板。
- 放置板实时PCR系统。选择试验布局模板,并开始运行。使用PCR程序设置:在95℃在95℃10分钟,随后15秒的45个循环,在60℃( 表1)1分钟。
- 从实时PCR系统传输的原始数据到电子表格。设置阈值中的扩增曲线的基线的上方和指数增长区域内,以获得每个样品的阈值循环。绘制各点的标准设定为标准曲线,以获得线性。计算用于基于标准曲线上的不同样品的拷贝数。
3.定量RT-PCR的研制
注:定量RT-PCR试验的发展需要参考株,具体的滴定质粒,以及不同的控制,并引起该引物和探针的滴定。
- 初步测试
- 设计引物和探针与根据先前的建议16专用软件。
- 提取参考菌株如第1节。
- 与900纳米为引物的终浓度为250纳米探针的终浓度在第2描述的扩增。如第2.5节所述分析信号。
- 与此同时,执行标准菌株DNA扩增没有探针(如3.1.3节所述)。测序通过Sanger法17,18中得到的扩增子。通过运行核苷酸BLAST 19分析序列。
- 引物和探针的滴定
- 制备3种不同的混合物与探针250 1nM终浓度和不同的最终精矿正向的ations和用于阳性样本和阴性对照的3次重复反向引物(50纳米/ 50纳米,300纳米/ 300纳米,900纳米/ 900纳米)。对于每一个组合,添加20μM的正向引物相同的适当体积和20μM的反向引物(0.25微升,得到50nM的最终浓度,1.5微升,得到300nM的终浓度或4.5微升,得到900 1nM终浓度) 50微升PCR主混合物,2.5微升10μM的探针和超纯水的要求达到90微升。
- 在第2节进行放大操作。
- 选择最好的条件来获得放大的最高水平,最早的循环阈值(CT)和3个条件之间最好的可重复性。确定最佳浓度和相应的数量×微升正向和反向引物。
- 准备4个样品5不同混合(阳性样品的3个重复和阴性对照)带探头的5种不同终浓度(50纳米,100纳米,150纳米,200纳米,250纳米)。对于每一个组合,添加X微升20μM正向引物和X微升20μM反向引物(先前确定的,在3.2.3节),50微升PCR扩增预混,10μM探头适当的体积(0.5μl到获得50nM的浓度,将1μl得到的100nM的浓度,1.5微升,得到为150nM浓度,2微升获得200nM的浓度或2.5微升,得到250纳米浓度)和超纯水的要求达到90微升。
- 在第2节进行放大操作。
- 选择最佳的条件,以获得扩增的最高水平,最早循环阈值(CT)和5条件之间最佳重复性。确定最佳的浓度和相应的音量Ÿ微升的探头。
4.定量表征的雷阿L-time PCR检测(定量RT-PCR)
注意:最佳条件的显影步骤和判定使用后,在PCR的表征步骤包括的特异性,检测限,线性范围和定量RT-PCR的定量限。
- 制备及质粒的滴定
- 订购包含选择用于PCR DNA靶基因的相关片段的商业质粒(在这个协议中,核苷酸EHV-2糖蛋白B基因的2081年至2381年, 见表1)。
注意:为了限制与合成DNA气污染的风险,在一个单独的房间中的开发和验证过程的所有步骤在通风橱下执行的质粒的系列稀释,用稀的DNA的工作。 - 重悬用超纯水该质粒在50纳克/毫升制备贮备液。涡短暂离心质粒原液。
注:确定质粒STO的实际浓度为了计算该质粒的拷贝数重新悬浮后放溶液。 - 加入1μl质粒的分光光度计。读在230nm,260 nm和280nm处的光密度(OD)。读出的分光光度计软件(OD,260纳米)的DNA浓度。
- 计算使用阿伏伽德罗数(N A)和式质粒的拷贝数:
拷贝数/微升=(N A [以ng质粒/微升)/(质粒长×10 9×平均体重碱基对)=(6022×10 23 X [质粒])/(质粒长×10 9× 660)
- 订购包含选择用于PCR DNA靶基因的相关片段的商业质粒(在这个协议中,核苷酸EHV-2糖蛋白B基因的2081年至2381年, 见表1)。
- 测试定量RT-PCR的特异性(包容性和排他性)
- 测试PCR系统的包容性。选择超高压-2阳性的DNA样本,以前的特点测序(建立积极的状态)。
- 在第2节进行放大操作。
- 分析如在2.5节所述对每个样品PCR数据。检查第4.2.1节中选择所有样本的指数曲线的存在,并确认PCR的包容性。
- 测试使用DNA提取物与遗传相似性病原体至目标的PCR体系的排他性(在此情况下,作为所述的其它马科动物疱疹病毒如EHV-1,EHV-4,EHV-3,EHV-5和愚蠢疱疹病毒5在表2中)和涉及在宿主的呼吸系统疾病的其他病原体(在这种情况下,马动脉炎病毒,马流感病毒, 贝氏柯克斯体,马红球菌,链球菌球菌 , 链球菌兽疫,衣原体流产和肺炎克雷伯菌 , 见表2)。
- 在第2节进行放大操作。
- 如在第2.5节中所述分析每个样品的PCR数据。检查没有指数曲线的所有样品中选择第4.2.4确认PCR的排他性。
- 定量RT-PCR的检测限
- 分配90微升的超纯水为6管。
- 执行质粒6十倍系列稀释为目标的消减区数(Ct检测损失)。转移10微升来自质粒工作稀释到管90微升超纯水。涡短暂离心管。重复步骤4.3.2直到在连续稀释的最后管已接收到质粒。
- 如在第2描述的执行该质粒的6十倍系列稀释的扩增。
- 确定消减区:质粒的最后稀释呈现阳性信号和第一稀释而不检测之间的区域(参见图2)。
- 要启动6两倍连续稀释,选择质粒的最后稀释度给出了阳性信号(参见4.3.4)。
注:执行3个独立的三ALS确定检测定量RT-PCR(LOD 95%PCR)的极限 - 分配25μl的超纯水为6管。
- 执行质粒6的两倍连续稀释。转自质粒工作液25微升,如第4.3.5确定,在管与25微升超纯水。涡短暂离心管。重复步骤4.3.7直到在连续稀释的最后管已接收到质粒。
- 如在部分所述进行质粒的6两倍连续稀释的扩增2.重复步骤4.3.7至4.3.8两次,得到3试验与每个6十倍的8次重复(24次重复)质粒的系列稀释液。
注意:检测定量RT-PCR检测限(LOD 95%的PCR)的极限被定义为在95%的病例检测体积单元的最低DNA拷贝数。 - 计算阳性重复数出24个重复质粒concentra每一级化。
- 确定LOD 95%PCR。检测限的95%的PCR是其导致在检测的23阳性重复出24次重复的水平。
- 线性范围和定量RT-PCR方法定量限
注意:用质粒的6十倍系列稀释液进行4个独立的试验,以保证在范围使用的最低浓度对应于检测限的95%的PCR在4.3.10预先确定。- 分配45微升的超纯水在6管。
- 开始用质粒工作稀释的相当于10 7的LOD 95%的PCR浓度6十倍系列稀释。
- 执行质粒6十倍系列稀释。传递来自质粒工作稀释度(在第4.4.2节确定的)与45微升的超纯水的管5微升。涡短暂离心管。在连续稀释重复步骤4.4.3,直到最后管已接收到的Plasmid。
- 如在第2描述的扩增质粒的6十倍系列稀释。
- 迹线性回归Y = AX + B,其中A为斜率和b为截距( 图3)。
- 计算从标准曲线的斜率的扩增效率(E)的使用方程(参见4.4.5):
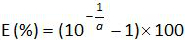 。
。
重复步骤4.4.1至4.4.6三次。
注意:扩增效率表示的每个周期后PCR产物的增加量。一种理想的反应达到效率接近100%。在实践中,E(%)为75%和125%之间。更高E可表示的非特异性产物,或在连续稀释移液误差放大。较低的E也能表明,在连续稀释,可怜的引物设计和非最佳反应条件移液错误。 - 计算偏差( 表3)。验证每个质粒级别的绝对偏差值小于临界偏压值(0.25日志10)。确定平均偏差和线性的不确定性(U 的LiNi)对于每种质粒水平( 见表3)以评价线性回归为EHV-2的qPCR的性能( 图4):U 的LiNi是计算每个确定的线性不确定我质粒水平从标准偏差(SD'i)和平均偏差。确定由下式给出将合并的线性不确定性(U LIN)EHV-2的qPCR的:

注意:偏置接受由实验室指定(通常绝对偏差0.25日志10)和对应于最低值和0.5日志10(数量在日志10拷贝数测定)的最高值之间的差。 üLIN 值可以帮助比较来自不同实验室的qPCR的性能。 - 确定定量RT-PCR(LOQ PCR)的定量限:LOQ PCR是最低的浓度与用于线性范围( 表3)的偏置0.25日志10。
5.表征全体分析方法(从DNA提取到定量RT-PCR结果)
注意:在整个方法的特性是必要的,以获得的qRT-PCR数据( 即所有步骤的验证,从呼吸道样品DNA的提取(见第1)至靶的扩增和定量(见第2 ))。
- 建立在PCR反应中的拷贝数和本与式生物样品中的拷贝数之间的对应关系:
 。
。
该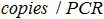 是质粒拷贝在PCR反应的数目,
是质粒拷贝在PCR反应的数目, 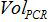 被加入到PCR样品的体积混合进行放大,
被加入到PCR样品的体积混合进行放大, 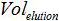 被缓冲液AVE的体积来洗脱核酸和
被缓冲液AVE的体积来洗脱核酸和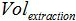 是所提取的样品的体积。
是所提取的样品的体积。 - 测试整个分析方法的灵敏度和特异性
注意:只有知超高压-2阳性(或负)样品在本节中使用。- 由目标(超高压-2)分析阳性样品测试的定量RT-PCR方法的"敏感性"。
- 选择超高压-2阳性的DNA样本,以前的特点(正状态)。
- 如第1描述为第2节进行扩增过程中提取的核酸。
- 确定真正的阳性(阳性样品数量它们是正与该RT-PCR)和假阴性(阳性样品这是负与该RT-PCR的许多已知的)。
- 通过分析阴性样品测试的定量RT-PCR方法的"专一"
- 选择超高压-2阴性DNA样本(负面状态)。
- 如第1描述为第2节进行扩增过程中提取的核酸。
- 确定真实底片(这是已知的与本的RT-PCR阴性阴性样品)和假阳性(称为负样本它们是正与该RT-PCR)的数目的数目。
- 计算"诊断的敏感性"(SE)和"诊断特异性"全法(SP)( 表4)如下:SE =和SP =实数实阳性数/(真阳性+假阴性的数量)真正的负底片/(数S +假阳性)( 见表4)。
- 计算与格瑞纳和加德纳关系12,20的公式整个方法的敏感性和特异性的95%置信区间:
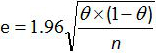
其中e是估计误差,θ是硒(或SP)和正分析的样品的数目。
注意:对于一个小数目的样本,使用施瓦茨表根据AFNOR规范12来计算整个方法的敏感性和特异性的95%置信区间。
- 由目标(超高压-2)分析阳性样品测试的定量RT-PCR方法的"敏感性"。
- 资源负材料的制备整个分析方法的表征
注意:为了决定整个方法(LOD 方法和LOQ 法 )的检测和定量的极限,质粒的已知浓度添加到已知是自由的生物样品的目标(EHV-2在这种情况下)。这些样品中,与量化质粒一起,构成与确定LOD 方法和LOQ 方法阳性标准。- 确认用于构造阳性标准的生物样品在不存在靶的(EHV-2)。
- 选择不同的已知的负面生物样品。
- 如第1描述为第2节执行扩增程序中提取生物样本。
- 经确认不存在这些样品中的PCR信号的缺失目标。
注意:使用同一底片资源材质为5.4和5.5之间的所有步骤。
- 池不同的负样本以获得15毫升资源负材料(必要的完整的验证一个体积)。免除135微升这种消极的资源材料为100管。保持管在+ 4℃或在-80℃下长期贮存。
- 确认用于构造阳性标准的生物样品在不存在靶的(EHV-2)。
- 利米整体分析方法的检测效应的T
- 决定整个方法的消减区。
- 分配45微升的超纯水在6管。
- 执行质粒6十倍系列稀释。传送从对应于10 7的LOD 95%的PCR(如第4.3.10确定)到管45微升超纯水的质粒工作稀释度5微升。涡短暂离心管。在连续稀释重复步骤5.4.1.2,直到最后管已收到质粒。
- 从质粒的每个稀释至2管135微升阴性资源材料转移5微升获得2个重复的6绝对的标准。涡短暂离心。
- 如第1描述为第2节执行扩增程序执行2重复了6个阳性标准提取。
- 确定减排区域:最后浓度之间的区域质粒给出阳性信号和表示无信号第一浓度的entration。
- 方法的检测(LOD 方法 )的限制,通过2个独立试验所确定
注:执行2个独立的试验,以确定检测整个方法(LOD 法 )的限制。- 开始用质粒工作稀释度是4倍以上的浓缩该给了一个阳性信号质粒的最后浓度(见5.4.1.5)6两倍连续稀释。
- 分配25μl的超纯水在6管。
- 执行质粒的5两倍连续稀释液。传递来自质粒工作稀释25微升(如第5.4.2.1测定)与25微升的超纯水的管。涡短暂离心管。在连续稀释重复步骤5.4.2.3,直到最后管已收到质粒。
- 从plasmi每个稀释度将5微升d可4管135微升负的资源材料,以获得4个重复的5绝对的标准。涡,短暂离心管。
- 如第1描述为第2节执行扩增程序执行4个重复的5个阳性标准提取。
- 重复步骤5.4.2.1至5.4.2.5一旦获得8次重复质粒浓度的每个级别。
- 计数阳性重复出8重复次数为质粒浓度的每个级别。
- 确定LOD 方法 。该方法检测限是指8复制出8次重复是积极的(如第5.4.2.7所述)最后一个级别。
- 决定整个方法的消减区。
- 线性范围和限价整体分析方法的测定
注意:要确定整个方法(LOQ 法 )定量限,加质粒的已知浓度生物已知的样品是免费的目标(超高压-2在这种情况下)的。这些样本构成绝对的标准来确定定量限方法 。- 分配45微升的超纯水在6管。
- 执行质粒6十倍系列稀释。传送从对应于10 7的LOD 方法 (如在第5.4.2.8确定)到管45微升超纯水的质粒工作稀释度5微升。涡短暂离心管。重复步骤5.5.2直到在连续稀释的最后管已接收到质粒。
- 将5微升从质粒的每个稀释至2管135微升负的生物资源材料获得2次重复的6绝对的标准。涡短暂离心。
- 如第1的描述执行扩增程序部分所述执行2重复了6个阳性标准提取2.重复步骤5.5.1到5.5.4三次。
- 为了评估和验证方法的定量性定义一个准确资料。
- 定义为实验室整个方法的可接受极限。在这个协议中,可接受限制由鲮定义为±0.75日志10 弗兰克·邓库姆。
- 对于一项试验中,微量的第一线性回归Y = AX + B(a是斜率,b是截距)与对应于各估计值的标准曲线的Ct值中的一个复制。与该第一线性回归,计算Ct值的用于该第一标准曲线的重复拷贝数的实验值。重复步骤5.5.5.2与Ct值的第二次重复,以获得一第二线性回归并计算用于第二标准曲线的Ct值的第二次重复的拷贝数的实验值。
- 重复步骤5.5.5.2与第二和第三个试验。
- 计算根据NF U47-600-2 12各质粒级别的精度,真实性和准确性的限制。
- 创建电子表格来编译所有标准点(5.5.5.4)的信息,并创建与5.5.5.1先前定义的可接受范围的精度信息和数据的沿正确度的下限和上限值的精度在5.5计算.5.4( 图5)。
- 确定LOQ 方法 :这对应于与正确度0.75日志10标准曲线的最低浓度作为用于5.5.5.5计算出的线性范围。
- 重复性和再现性评价
注意:使用和重复测量(变异系数,或CV =标准偏差的平均值的标准差之间的比率检查重复性和再现性/意思)。- 1分析员评估整体方法的重复性:
- 选择3与3个不同的病毒基因组的负载(先前PCR中检测例如)生物样品。
- 提取8次重复的3个样品的如第1描述为第2节进行放大操作。
- 计算的平均值和收集每个样品的Ct值的标准偏差。
- 计算使用下式CV =标准偏差内的测定的CV /平均。
- 3分析师评估整体方法的再现:
- 选择3生物样品与3个不同的病毒基因组的负载(以前在PCR检测为例)
- 提取2次重复在5.6.2.1所选择的3个样品的(如在第1节中所述)。在第2节重复2独立分析师5.6.2.2描述的步骤进行扩增过程。
- 计算平均值和标准偏差收集每个样品的Ct值。
- 计算使用公式CV =标准偏差的测定间CV /意思。
- 1分析员评估整体方法的重复性:
结果
定量RT-PCR法中,如上所述,被实施,以检测和呼吸液体量化马科动物疱疹病毒-2。 图1示出了根据AFNOR标准NF的定量RT-PCR法的开发和验证的示意流程图表U47-600。引物和探针的特异性一步一步发展PCR的过程中进行了验证。仅EHV-2菌株在本系统中扩增。随后,定量RT-PCR检测的性能必须表征。
首先,估计检测限的PCR,进行6十倍系列稀释液,以建立该减弱区( 图2)。在这个例子中,6十倍系列稀释液10 -5和10 -10之间进行估算LOD PCR(26,000 0.26拷贝/ 2.5微升样品之间)。的减排区间l的10 -9和10 -10稀释之间IES(2.6和0.26个拷贝/ 2.5微升样品之间)。为了确定这种情况下的LOD PCR值,质粒的6两倍连续稀释在此消减区作了5.2和0.16个拷贝/ 2.5微升样品之间。该LOD PCR值2.6张/ 2.5微升样品。
为了确定线性范围和LOQ 的PCR,所述的LOD PCR值被用来启动的6十倍系列稀释液的范围内,2.6(LOD PCR)和26万拷贝/ 2.5微升样品之间。 图3示出了用于EHV2线性回归定量RT-PCR从一个试验。线性回归( 图4)的性能在使用表3所述的计算一式四份进行了验证。执行的计算根据标准来定义的线性范围绝对偏差我 VALUE≤0.25日志10,质粒负荷的任何水平的我 。在这种情况下,线性范围铺设2.6和26万之间拷贝/ 2.5微升样品。该LOQ PCR是在线性范围的最低浓度( 即 2.6拷贝/在这种情况下,2.5微升样品)。 üLIN被确定为0.12日志10范围2.6-260,000拷贝/ 2.5微升的DNA。
发展( 图1,蓝色)和定量RT-PCR( 图1,黄色)表征之后,AFNOR NF U47-600规范建议从DNA提取到QRT-PCR( 图1,橙色)全分析方法表征。如表4中描述的方法计算出的诊断的敏感性和特异性。在定量RT-PCR全分析方法的定量性能进行评价和验证,精确度轮廓( 的图5)。
该协议,它使用先进设备,最先进的分子生物学技术,使我们能够检测和量化,从与呼吸系统疾病和/或感染的临床怀疑马获得172鼻拭子样品超高压-2病毒基因组的负载。超高压-2场(生物)样品的发生率在这一人群中为50%(172分之86)。的定量分析表明,EHV-2的病毒基因组的负载在年轻马匹显著更高和病毒基因组的负载的重新分配与年龄( 图6)降低。在本研究中,在马驹检测到最高EHV-2病毒基因组的负载(1.9×10 11拷贝/ ml)( 图6)。
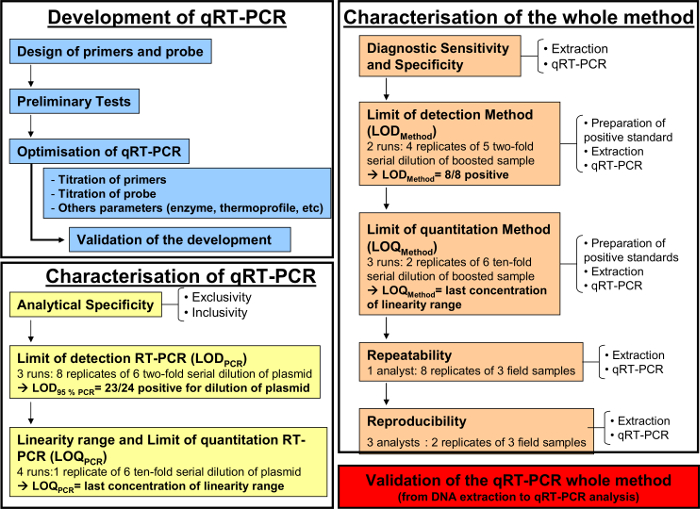
图1:用于开发(蓝色)的工作流图中,定量RT-PCR的表征根据AFNOR标准NF U47-600-2(黄色)和从DNA提取到定量RT-PCR(橙色),整个分析方法的特征。该工作流程图恢复为发展的不同步骤中,定量RT的表征-PCR和DNA提取到定量RT-PCR全分析方法的表征。对于每一个步骤,工作流图表显示运行所需的数量,稀释被执行和所需分析师的数量。 请点击此处查看该图的放大版本。
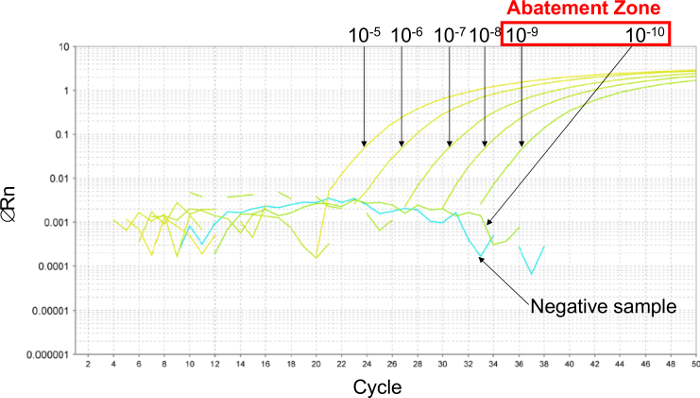
图2:来自用质粒的6十倍系列稀释液得到的实时PCR曲线的代表性结果消减区的测定 。为了估计减排区,6个十倍串行稀释液10 -5之间进行(26000拷贝/ 2.5微升样品)和10 -10(0.26份/ 2.5微升样品)。减排区位于10 -9稀释之间(2.6张/ 2.5微升样品)和10 -10(0.26份/ 2.5微升样品)。在这种情况下,质粒的6两倍连续稀释在这个减排区分别以确定LOD 95%PCR,5.2和0.16拷贝/ 2.5微升样品之间。 请点击此处查看该图的放大版本。
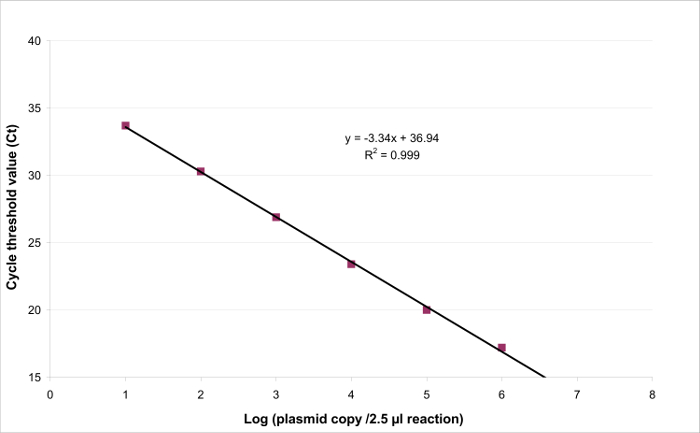
图3:线性回归为EHV2定量RT-PCR定量检测的线性是产生结果成比例的存在于一个特定范围内的目标的浓度的能力。这可以通过进行建模线性回归的仪器响应(循环阈值或CT)与目标量的对数之间(Y = AX + B)(目标拷贝/ 2.5微升样品数)。 请点击此处查看该图的放大版本。
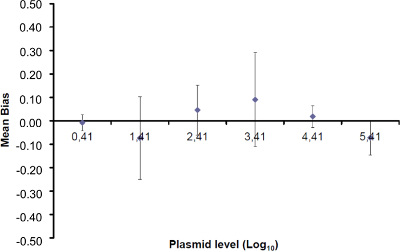
图4:EHV-2的qPCR的线性回归的性能平均偏压代表所测量的质粒数量之间的平均差( 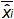 ),并为每个质粒水平的理论质粒量(X'i)中 。竖线代表由下式给出的线性不确定性(U·利尼 )
),并为每个质粒水平的理论质粒量(X'i)中 。竖线代表由下式给出的线性不确定性(U·利尼 ) 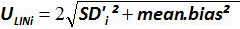
其中,SD'i为标准偏差Ø F量度质粒数量。 请点击此处查看该图的放大版本。
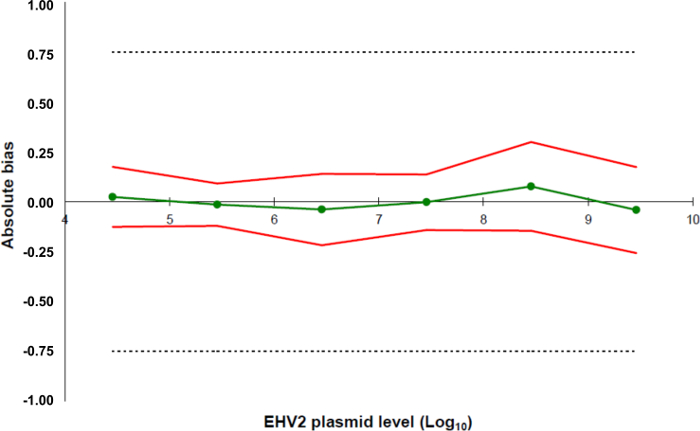
图5:基于所述EHV-2定量RT-PCR法的验证结果的准确度轮廓的绿线(圆)表示数据的真实性(系统误差或偏差)。的可接受限制由实验室(虚线)在±0.75日志10限定。在较低和较高的精度限制,确定从平均偏差±可靠性数据(红色线)的两倍标准差的每个质粒的负荷水平。 请点击此处查看该图的放大版本。
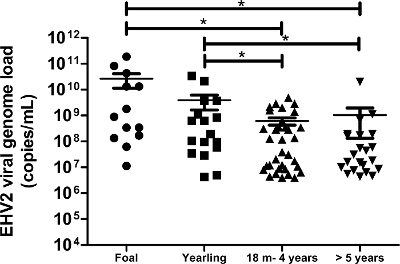
图6:根据年龄EHV-2的病毒基因组的负载的定量 EHV-2鼻拭子样品中检测的病毒基因组的载荷分布被表示为不同的年龄组。水平线代表标准偏差(M =个月)内的中间值。 *通过ANOVA显着不同与纽曼-两比较事后检验(P <0.05)。 请点击此处查看该图的放大版本。
| 靶基因 | 引物,探针和plasmide序列(5'-3') | 核苷酸位点 | 产品尺寸(核苷酸) | 的热循环条件 | 参考 | |||
| EHV2的gB (HQ247755.1) | 前锋:GTGGCCAGCGGGGTGTTC | 2113至30年 | 78 | 95℃5分钟 | 11 | |||
| 反向:CCCCCAAAGGGATTYTTGAA | 2189年至2170年 | 95℃15秒 | 45个循环 | |||||
| 探头:FAM-CCCTCTTTGGGAGCATAGTCTCGGGG-MGB | 2132年至2157年 | 60℃1分钟 | ||||||
| 质粒: ACCTGGGCACCATAGGCAAGGTGGTGGTCA ATGTGGCCAGCGGGGTGTTCTCCCTCTTTG GGAGCATAGTCTCGGGGGTGATAAGCTTTTT CAAAAATCCCTTTGGGGGCATGCTGCTCATA GTCCTCATCATAGCCGGGGTAGTGGTGGTG TACCTGTTTATGACCAGGTCCAGGAGCATAT ACTCTGCCCCCATTAGAATGCTCTACCCCGG GGTGGAGAGGGCGGCCCAGGAGCCGGGCG CGCACCCGGTGTCAGAAGACCAAATCAGGA ACATCCTGATGGGAATGCACCAATTTCAG | 2081年至2381年 | |||||||
表1:在该协议中使用的引物,探针和阳性合成DNA对照序列的质粒的序列(正合成DNA)对应核苷酸位置EHV2gB序列(HQ247755.1)的2081至2381年。通过使用特定的软件获得的在该协议中使用的引物和探针的设计。
| 病原体 | 参考(来源) | 菌株数 | 结果 |
| 超高压-2 | |||
| 超高压-2 | VR701(ATCC) | 20 | 正面的 |
| 20个样品(FDL集合) | |||
| 超高压-5 | KD05(GERC) | 20 | 负 |
| 20个样品(FDL集合) | |||
| 超高压-3 | VR352(ATCC) | 2 | 负 |
| T934 WSV(GERC) | |||
| 超高压-1 | 肯塔基州肯塔基州株A(ATCC) | 3 | 负 |
| 2个样本(FDL集合) | |||
| 超高压-4 | VR2230(ATCC) | 1 | 负 |
| 愚蠢的疱疹病毒AHV5 | FDL系列 | 1 | 负 |
| 马流感病毒 | A /马/ Jouars / 4/2006的(H3N8) | 1 | 负 |
| (登记号JX091752) | |||
| 马动脉炎病毒 | VR796(ATCC) | 2 | 负 |
| 马红球菌 | FDL系列 | 1 | 负 |
| 马链球菌亚种。兽疫 | FDL系列 | 1 | 负 |
| 马链球菌亚种。球菌 | FDL系列 | 1 | 负 |
| 贝氏柯克斯体 | ADI-142-100(Adiagene) | 1 | 负 |
| 流产衣原体 | ADI-211-50(Adiagene) | 1 | 负 |
| 克雷伯菌PNEUmoniae | FDL系列 | 1 | 负 |
表2:用于EHV-2定量RT-PCR的分析的特异性。
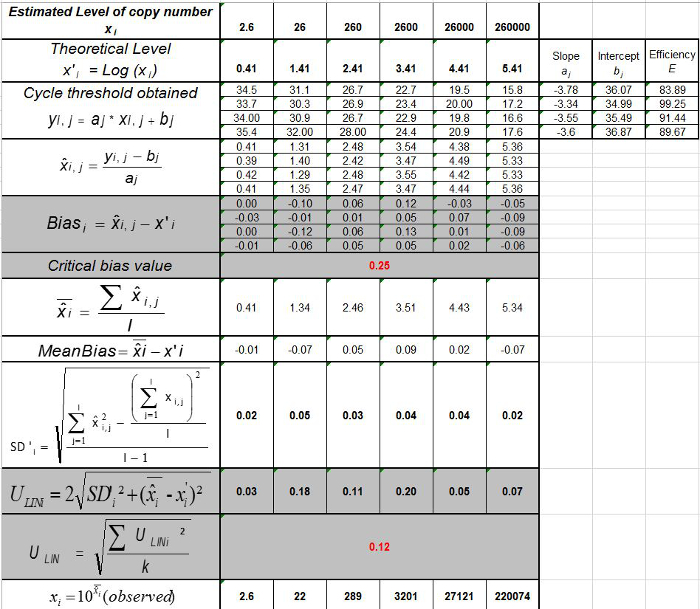
表3:偏置和线性度的不确定性(改编自NF U47-600-2 12) 的计算 。对于每一个试验中,线性回归的性能(Y = AX + b)的使用,其中y是所得到的循环阈值表的验证; a是斜率得到; x是质粒水平和b是截距i是质粒级别(ⅰ从1变化至K的水平);在叔k是使用质粒电平的数目( 例如 ,k = 6 的他的表); j是试验(J从1到I期试验); I是试验的次数,包括(在该表例如 I = 4)3和6试验间X I是每个所估计的质粒数量。 我质粒的水平。X' 我是方程x获得的理论质粒量"每个质粒我 i级= 10日志(X I)。在每个Ĵ试验中,对于每个i中得到的循环阈值 质粒级别与线性回归计算 Y I,J = 第j X I,J + B 学家 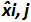 是审判Ĵ期间测得的质粒数量。 我偏 子>是测量质粒数量和用于每个试验的理论质粒数量和各质粒水平之间观察到的差异。
是审判Ĵ期间测得的质粒数量。 我偏 子>是测量质粒数量和用于每个试验的理论质粒数量和各质粒水平之间观察到的差异。 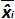 是的平均值
是的平均值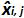 由每个i质粒水平; SD'i是测量的量的标准偏差
由每个i质粒水平; SD'i是测量的量的标准偏差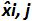 对于每个i 质粒水平; 平均偏差是偏向我的均值;ü 利尼是每个确定的线性不确定我从质粒计算SD'i水平和平均偏差 。 请点击此处查看该图的放大版本。
对于每个i 质粒水平; 平均偏差是偏向我的均值;ü 利尼是每个确定的线性不确定我从质粒计算SD'i水平和平均偏差 。 请点击此处查看该图的放大版本。
表4: 整个方法的 诊断敏感性计算(SE) 和特异性(SP)所用的施瓦茨表计算confid在如NF U47-600-2描述的整个方法的敏感性和特异性的95%EnCE的间隔。
讨论
自2000年代,实时PCR已在越来越多的实验室取代金标准技术(细胞培养物和细菌培养方法)。该技术的实现是比较容易的。然而实验方法验证了分子检测和病原体量化必须确保准确,可重复的和可靠的数据。
由于提取步骤是生物材料的损失的主要来源,它可被认为是一个协议和另一个之间的量化误差的主要来源。因此,定量RT-PCR过程中的DNA质粒的标准曲线,主要文献报道的建立,表明病毒基因组的负载,但不考虑提取步骤。
在AFNOR标准NF U47-600-2整个方法验证过程从头策略的说明表示在这方面显著的进展。如在所示本文的EHV-2在马,或由他人在蜜蜂21,这就需要开发步骤,并与整个方法中PCR的表征和鉴定验证步骤之间明显不同。在这个有趣的方法的一个限制是,在协议的任何改变将导致重新验证的完整过程可能是非常昂贵的义务。这种限制也被事实量化的范围取决于从该病毒被提取( 例如,呼吸液,器官,血液或尿液)的源上突出显示。事实上,每个矩阵呈现不同特异性在其物理化学特征和独立地定义用于通过qRT-PCR的病毒检测和定量的每个不同的矩阵是重要的。因此,每个生物样品的病毒基因组的负载可以更精确地从提取定量。表征还考虑到热循环模埃尔并且当使用预先充分表征的方法( 例如,本文描述的EHV-2定量PCR法)就必须在父实验室或其他实验室新类型的机器,必须确认仪器的性能。一个qPCR分析的性能的确认是一个先决条件为所有测试带来到实验室。这通常是通过分析与已知特性的参考样品来实现的。这种检查是一个先决条件,并认为强制由NF 47-600-1 AFNOR标准为了验证的定量PCR(LOD,LOQ效率)的性能和整个方法(LOD,LOQ)的鲁棒性要求。不仅在开发和表征步骤,但在研究或诊断目的时,也,风险因素可以识别和很好的控制,以确保该协议的标准化。特别值得关注的是足够的员工培训,高素质的人才,耗材的质量控制使用和储存,立即环境条件和计量条件的认识,可能会影响参与试验的科学仪器的性能控制。对于实验室间比使用的参考样本也可以帮助控制的不确定性。在这种方式下,实验室之间的数据的比较可以容易。事实上,实验室间的水平测试是必要的,以评估和确认方法的再现性。
这是在分析生物基质的国际单位(IU)表达的病毒基因组的负载的结果(IU:拷贝/ ml用于流体或副本组织/ g)的更易于使用,以比较不同实验室之间的结果。所有LOQ上方的结果表示为拷贝/ ml和LOD和LOQ之间的结果被作为不可计量的阳性结果。以这种方式呈现所述基因组的定量数据符合更精确到PROCES分析第(基因组的扩增)。实际上,在细胞培养实验中,通过TCID 50的病毒载量的表达(中值组织培养感染剂量) 依赖于细胞和病毒株的性质。每一株行拥有其独特的感染动力学和一些病毒如超高压-2可能需要数天前的第一个细胞病变效应是明显的。
总之,定量RT-PCR表征的新方法应促进实验室之间的数据演示和解释的协调统一。这将是在将来像建立截止值的对的疾病状态的声明,而不是仅仅是病原体的存在或不存在下定量RT-PCR检测的潜在的新的应用中是非常有用的。
披露声明
作者宣称,他们没有竞争的经济利益。
致谢
The authors would like to thank Sophie Castagnet and Nadia Doubli-Bounoua for their technical support. This work received financial support from the General Council of Calvados and the agreement of Region Basse-Normandie and French Government (CPER 2007-2013; project R25 p3). The authors would like to thank the experts of the AFNOR group and particularly Jean-Philippe Buffereau and Eric Dubois.
材料
| Name | Company | Catalog Number | Comments |
| AB-1900 natural color ABgene 96 well plate | Dutsher | 16924 | |
| Adhesive film qPCR Absolute | Dutsher | 16629 | Adhesive film used for sealing the plate prior to the qRT-PCR run |
| 0.5 ml microtubes, skirted, caps | Dutsher | 039258 | |
| Ethanol 98% | Sodipro | SAF322941000 | |
| Primers | Eurofins | Custom order | |
| Probe | Life Technologies | Custom order | |
| Plasmid | Eurofins | Custom order | |
| QIAamp RNA viral Mini Kit (containing: QIAamp Mini column, AVL buffer, AW1 buffer, AW2 buffer, AVE buffer, collection tubes) | Qiagen | 52906 | AVL buffer: pre-warm 5 min at 72 °C |
| Sequencing by Sanger method | Eurofins | Custom order | |
| Taqman Universal PCR Master Mix | Life Technologies | 4364340 | |
| Tris-EDTA buffer solution | Santa Cruz | sc-296653A | |
| NanoDrop 2000c Spectrophotometer | Thermoscientific | ND-2000C | |
| StepOnePlus Real-Time PCR systems | Life Technologies | 4376600 | pre-warm 15 min |
参考文献
- Brault, S. A., et al. The immune response of foals to natural infection with equid herpesvirus-2 and its association with febrile illness. Vet.Immunol.Immunopathol. 137 (1-2), 136-141 (2010).
- Fortier, G., Van Erck, E., Pronost, S., Lekeux, P., Thiry, E. Equine gammaherpesviruses: pathogenesis, epidemiology and diagnosis. Vet.J. 186 (2), 148-156 (2010).
- Hue, E. S., et al. Detection and quantitation of equid gammaherpesviruses (EHV-2, EHV-5) in nasal swabs using an accredited standardised quantitative PCR method. J Virol.Methods. 198 (1), 18-25 (2014).
- Diallo, I. S., et al. Multiplex real-time PCR for the detection and differentiation of equid herpesvirus 1 (EHV-1) and equid herpesvirus 4 (EHV-4). Vet.Microbiol. 4 (1-3), 93-103 (2007).
- Williams, K. J., et al. Equine multinodular pulmonary fibrosis: a newly recognized herpesvirus-associated fibrotic lung disease. Vet.Pathol. 44 (6), 849-862 (2007).
- Mullis, K., et al. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Cold Spring Harb.Symp.Quant.Biol. 51 (1), 263-273 (1986).
- EPA Office of Water (4607). EPA-815-B-04-001. Quality Assurance/Quality Control Guidance for Laboratories Performing PCR Analyses on Environmental Samples. , (2004).
- Telford, E. A., et al. Equine herpesviruses 2 and 5 are gamma-herpesviruses. Virology. 195 (2), 492-499 (1993).
- Fortier, G., et al. Identification of equid herpesvirus-5 in respiratory liquids: A retrospective study of 785 samples taken in 2006-2007. Vet.J. 182 (2), 346-348 (2009).
- Brault, S. A., Bird, B. H., Balasuriya, U. B., MacLachlan, N. J. Genetic heterogeneity and variation in viral load during equid herpesvirus-2 infection of foals. Vet.Microbiol. 147 (3-4), 253-261 (2011).
- Association Francaise de Normalisation. NFU 47-600-1. Animal health analysis methods-PCR-Part 1: Requirements and recommandations for the implementation of veterinary PCR. , (2015).
- Association Francaise de Normalisation. NFU 47-600-2. Animal health analysis methods-PCR-Part 2: Requirements and recommendations for the development and the validation of veterinary PCR. , (2015).
- ISO. EN ISO-CEI 17025. General requirements for the competence of testing and calibration laboratories. , (2005).
- Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2010. Chapter1.1.1.4/ 5. Principles and Methods of Validation of Diagnostic Assay for Infectious Diseases. , This thoroughly revised chapter replaces Chapter 1.1.4 Principles of validation of diagnostic assays for infectious diseases and Chapter 1.1.5 Validation and quality control of polymerase chain reaction methods used for the diagnosis of infectious diseases from the sixth edition of the OIE Terrestrial Manual (2009).
- Apaza, S., et al. Detection and genogrouping of noroviruses from children's stools by Taqman One-step RT-PCR. J Vis.Exp. (65), e3232(2012).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis.Exp. (63), e3998(2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol.Biol. 94 (3), 441-448 (1975).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proc.Natl.Acad.Sci.U.S.A. 74 (12), 5463-5467 (1977).
- NCBI. BLAST Homepage and Selected Search Pages. Introducing the BLAST homepage and form elements/functions of selected search pages. , (2015).
- Greiner, M., Gardner, I. A. Application of diagnostic tests in veterinary epidemiologic studies. Prev.Vet Med. 45 (1-2), 43-59 (2000).
- Blanchard, P., Regnault, J., Schurr, F., Dubois, E., Ribiere, M. Intra-laboratory validation of chronic bee paralysis virus quantitation using an accredited standardised real-time quantitative RT-PCR method. J Virol.Methods. 180 (1-2), 26-31 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。