Method Article
פיתוח ותיקוף של שיטת ה- PCR כמותי עבור Equid ההרפס-2 אבחון בנוזלי הנשימה
In This Article
Summary
Here, we present a protocol for the development and validation of a quantitative PCR method used for the detection and quantification of EHV-2 DNA in equine respiratory fluids. The EHV-2 qRT-PCR validation protocol involves a three-part procedure: development, characterization of qRT-PCR assay alone, and characterization of the whole analytical method.
Abstract
The protocol describes a quantitative RT-PCR method for the detection and quantification of EHV-2 in equine respiratory fluids according to the NF U47-600 norm. After the development and first validation step, two distinct characterization steps were performed according to the AFNOR norm: (a) characterization of the qRT-PCR assay alone and (b) characterization of the whole analytical method. The validation of the whole analytical method included the portrayal of all steps between the extraction of nucleic acids and the final PCR analysis.
Validation of the whole method is very important for virus detection by qRT-PCR in order to get an accurate determination of the viral genome load. Since the extraction step is the primary source of loss of biological material, it may be considered the main source of error of quantification between one protocol and another. For this reason, the AFNOR norm NF-U-47-600 recommends including the range of plasmid dilution before the extraction step. In addition, the limits of quantification depend on the source from which the virus is extracted. Viral genome load results, which are expressed in international units (IU), are easier to use in order to compare results between different laboratories.
This new method of characterization of qRT-PCR should facilitate the harmonization of data presentation and interpretation between laboratories.
Introduction
הרפס-2 Equid (EHV-2) מעורב תסמונת נשימתית, עם ביטויים קליניים פוטנציאליים כגון ונזלת, דלקת הלוע ואת בלוטות לימפה נפוחות 1-3. וירוס זה הוא חשוד גם יקושר עם ביצועים הירודים של סוסים, אשר עלול לגרום השפעה כלכלית משמעותית ושלילית עבור תעשיית הסוס 2.
עד עכשיו, את תקן הזהב עבור גמא EHV (γ-EHV) זיהוי הייתה השיטה תרבית תאים. על אי הנוחות הראשונה של הליך זה היה העדר אפליה בין EHV-2 ואחרים γ-EHV של (למשל, EHV-5). על אי הנוחות השנייה הייתה ההתפתחות האיטית של תהליך cytopathic, אשר לוקח 12 עד 28 ימים להתבטא 4,5.
פיתוח של תגובת שרשרת פולימראז כמותי בזמן אמת תוקף מנורמל (qRT-PCR) שיטה יעזור לזהות את נגיף במהירות, להפלות בין EHV-2 ו EHV-5 וכדי ללמוד את הקשר בין עומס הגנום הנגיפי ואת הודות המחלה להיבט כימות.
תגובת שרשרת פולימראז (PCR) תוארה לראשונה בשנת 1986 על ידי מוליס 6 והוא עומד להפוך לסטנדרט זהב החדש ברוב בתחומי אבחון ביולוגי (אדם, סביבת וטרינרים). שיטה זו, המבוססת על ההגברה של חלק מהגנום של פתוגנים, מציגה יתרונות רבים: סגולית, רגישות במהירות. יתר על כן, את הסיכון של זיהום amplicon נסוג מאז כניסתו של qRT-PCR והבטיח איכות 7. עם זאת, הכרת PCR כשיטה סטנדרט זהב חדשה צריכה יותר נתוני ביצועים משופרים רק אלא גם הפגנת הבקרה של צעדי פיתוח ותיקוף של השיטה כולה ללא שפלה של ביצועים לאורך זמן.
הכלי המולקולרי הראשון השתמש לצורך זיהוי של EHV-2 היו זמן גהגברה הלא ספציפית onsuming ומעורב עם PCR מקוננות ואחריו רצף 8. הגנים הממוקדים עבור נגיפי ההרפס היו חומצת deoxyribonucleic (DNA) פולימראז ו- DNA אריזת 9. עם זאת, מקוננים PCR מהווה סיכון גבוה של זיהום על ידי amplicons. מאז, בדיקות PCR קונבנציונליות עוצבו כדי להגביר את interleukin גן 10 דמוי או גן B גליקופרוטאין, ביקורת בשנת 2009 2. לאחרונה, מאפייני PCR בזמן אמת תוארו עבור כימות של EHV-2 10 אבל לא התקבלו נתונים לגבי אימות של השיטה כולה כולל תהליך החילוץ.
בפרוטוקול זה, הליכי פיתוח ותיקוף מתוארים ביחס שיטה PCR כמותי עבור איתור וכימות של DNA EHV-2 בנוזלי הנשימה סוסים פי נורמליזציה האגודה Française de (AFNOR) הנורמה NF U47-600 3,11,12, שהוא הנציג הצרפתיועדת הנורמליזציה הבינלאומית. נורמה זו מפרט את "דרישות והמלצות ליישום, פיתוח ותיקוף PCR וטרינרית שיטת ניתוח הגנריקה" 11,12, על פי NF EN ISO / CEI 17025, 2005 13 וכדי OIE (הארגון העולמי לבריאות בעלי חיים) . המלצות 2010 14 פרוטוקול אימות EHV-2 qRT-PCR כרוך הליך בת שלושה חלקים: (א) פיתוח של assay qRT-PCR, (ב) אפיון של assay qRT-PCR לבד (ג) אפיון של השלם שיטת אנליטית (מתוך מיצוי של חומצות גרעין מן המדגם הביולוגי ניתוח PCR).
האפיון של assay qRT-PCR ושל השיטה אנליטית כולו כולל הגדרה של שתי מגבלות: הגבלה על זיהוי (לוד) וגבול כימות (LOQ). ה- PCR 95% לוד מייצג את המספר הנמוך ביותר של עותקי חומצות גרעין ליחידת נפח כי ניתן לאתר ב -95% מכלל CASes. ה- PCR 95% LOQ מייצג את הכמות הנמוכה ביותר של עותקי חומצות גרעין שיכול להיקבע תוך התחשבות הוודאויות.
שיטת qRT-PCR זה מאפשר איתור מדויק וכימות המהירה של EHV-2 בנוזלי הנשימה. יתר על כן, השיטה יכולה להיות מיושמת במעבדות אחרות כדי להבטיח הליך סטנדרטי ותבנית כללית לפיתוח מבחני qRT-PCR חדשים אחרים.
Protocol
הערה: עיין בכל השלבים השונים כי הם באיור 1.
1. הפקת חומצות גרעין
הערה: בצע החילוץ תחת במנדף להגביל זיהום דרכי הנשימה עם חומצות גרעין. כלול פקד חילוץ שלילי עם מי DEPC שטופל על מנת להבטיח שאף אחד ריאגנטים הם מזוהמים DNA לא רצוי.
- חלץ חומצות גרעין מן המדגם הביולוגי על פי פרוטוקול של ויצרן 15 פרוטוקול שתואר לעיל.
- להוסיף 140 μl של מדגם ביולוגי 560 μl של פתרון תמוגה (חיץ AVL) דגירה במשך 10 דקות בטמפרטורת החדר. להוסיף 560 μl של אתנול. החל את 630 μl הראשון של הפתרון הזה (פתרון מדגם + תמוגה + אתנול) לעמודה סיליקה צנטריפוגות.
- החל את 630 μl הנותרים של פתרון זה לעמודת סיליקה אותו צנטריפוגות. לאחר מכן לשטוף את העמודה עם 500 μlשל 2 מאגרים לשטוף שונים (AW1 ו AW2).
- Elute חומצות גרעין עם 50 μl של חיץ elution (חיץ AVE) ו לאזן לטמפרטורת החדר. סגור את המכסה דגירה בטמפרטורת החדר למשך 1 דקה. צנטריפוגה ב 6000 גרם דקות 1.
2. נוהל הגברה
- כן 22.5 μl של תערובת תגובה עבור כל תגובה. להוסיף 12.5 μl של תמהיל מאסטר PCR, x μl של 20 פריימר מיקרומטר קדימה, x μl של 20 מיקרומטר פריימר הפוכה, y μl של 10 מיקרומטר בדיקה z μl מים ultrapure כנדרש להגיע 22.5 μl (x, y ו כרכים z מתקבלים לאחר טיטרציה, ראו סעיפים 3.2.3 ו 3.2.6).
- Aliquot 22.5 μl של תערובת התגובה המתאימה לכל תגובה גם בצלחת 96-היטב.
ההערה: כלול בקרות שליליות להפקה עבור PCR על מנת להבטיח שאף אחד ריאגנטים הם מזוהמים DNA לא רצוי. - להוסיף 2.5 μl של המדגם, 2.5 μl של מיצוי negativשליטת דואר, 2.5 μl של בקרה שלילית PCR ו -2.5 μl של מדגם חיובי (זן התייחסות או פלסמיד) התגובה המקבילה היטב. לאחר החלוקה, מכסים את הצלחת עם חותם צלחת דבק. צנטריפוגה את הצלחת למשך 10 שניות ב 6000 g.
- מניחים את הצלחת מערכת real-time PCR. בחר את התבנית עבור פריסת assay ולהתחיל הריצה. השתמש בהגדרה תוכנית ה- PCR: 10 דק 'ב 95 ° C ואחריו 45 מחזורים של 15 שניות על 95 מעלות צלזיוס ו 1 דקות ב 60 ° C (טבלה 1).
- מעבירים את הנתונים הגולמיים ממערכת real-time PCR לגיליון אלקטרוני. הגדר את סף בחלקות הגברה מעל לקו הבסיס ובתוך באזור גידול מעריכי לקבל מחזור סף עבור כל דגימה. מגרש כל תקן נקודה להגדיר כמו עקומת סטנדרט להשיג ליניאריות. לחשב את מספר עותק עבור מדגמים שונים המבוססים על עקומת סטנדרט.
3. פיתוח כמותי RT-PCR
הערה: הפיתוח של מבחן qRT-PCR דורש זני התייחסות, פלסמיד טיטרציה מבוקש, בקרות שונות כרוך טיטרציה של פריימרים ואת החללית.
- מבחן ראשוני
- פריימרים וזונדים עיצוב עם תוכנה ספציפית על פי המלצות קודמות 16.
- חלץ זני התייחסות כמפורט בסעיף 1.
- להגביר כמתואר בסעיף 2 עם 900 ננומטר עבור הריכוז הסופי של פריימרים ו -250 ננומטר עבור הריכוז הסופי של חללית. לנתח את האות כמפורט בסעיף 2.5.
- במקביל, לבצע הגברה של זני התייחסות DNA (כמפורט בסעיף 3.1.3) ללא בדיקות. שממפה את amplicons שהתקבלה מהפעלת השיטה סנגר 17,18. נתח את הרצפים באמצעות הרצת נוקלאוטיד יפציץ 19.
- טיטרציה של תחל Probe
- כן 3 תערובות שונות עם 250 לריכוז סופי ננומטר של חללית ועם concentr הסופית שונהations של קדימה פריימרים הפוכים (50 ננומטר / 50 ננומטר, 300 ננומטר / 300 ננומטר, 900 ננומטר / 900 ננומטר) עבור 3 המשכפל של המדגם החיובי כביקורת שלילית. עבור כל שילוב, להוסיף את אותו נפח מתאים של 20 פריימר מיקרומטר קדימה ו -20 מיקרומטר פריימר הפוכה (0.25 μl להשיג את הריכוז הסופי 50 ננומטר, 1.5 μl להשיג את μl ריכוז או 4.5 סופי 300 ננומטר כדי להשיג את הריכוז הסופי 900 ננומטר) , 50 μl של תמהיל מאסטר PCR, 2.5 μl של חללית 10 מיקרומטר ומי ultrapure כנדרש כדי להגיע ל -90 μl.
- בצע את הליך ההגברה כמתואר בסעיף 2.
- בחר במצב הטוב ביותר כדי להשיג את הרמה הגבוהה ביותר של הגברה, סף מחזור המוקדם (CT) ואת הדירות הטובות ביותר בין 3 התנאים. קבע את הריכוז הטוב ביותר ואת x נפח המקביל μl של קדימה לאחור פריימרים.
- כן 5 תערובות שונות עבור 4 הדגימות (3 משכפל של המדגם החיובי כביקורת שלילית)עם 5 ריכוזי הבדיקה סופיים שונים (50 ננומטר, 100 ננומטר, 150 ננומטר, 200 ננומטר, 250 ננומטר). עבור כל שילוב, להוסיף x μl של 20 פריימר x מיקרומטר קדימה μl של 20 מיקרומטר פריימר הפוכה (נקבע בעבר, בסעיף 3.2.3), 50 μl של תמהיל מאסטר PCR, נפח מתאים של 10 מיקרומטר בדיקה (0.5 μl כדי להשיג את ריכוז 50 ננומטר, 1 μl להשיג ריכוז 100 ננומטר, 1.5 μl להשיג ריכוז 150 ננומטר, 2 μl להשיג ריכוז 200 ננומטר או 2.5 μl להשיג ריכוז 250 ננומטר) ומים ultrapure כנדרש כדי להגיע ל -90 μl.
- בצע את הליך ההגברה כמתואר בסעיף 2.
- בחר במצב הטוב ביותר כדי להשיג את הרמה הגבוהה ביותר של הגברה, סף מחזור המוקדם (CT) ואת הדירות הטובות ביותר בין 5 התנאים. קבע את הריכוז הטוב ביותר ואת μl y נפח המקביל עבור החללית.
אפיון 4. כמוני Real אמת PCR (qRT-PCR)
הערה: לאחר שלב הפיתוח וקביעה את התנאים הטובים ביותר לשימוש, צעד האפיון של PCR כולל את הספציפיות, לגבול של זיהוי, בטווח ליניאריות וגבול הכימות של qRT-PCR.
- הכנת טיטרציה של פלסמיד
- להזמין פלסמיד מסחרי המכיל את השבר הרלוונטי של גן מטרת DNA שנבחר PCR (בפרוטוקול זה, נוקלאוטידים 2081-2381 של גן B גליקופרוטאין EHV-2, ראו טבלה 1).
הערה: כדי לצמצם את הסיכון של זיהום דרכי הנשימה עם דנ"א סינתטי, לבצע דילולים סדרתי של פלסמידים תחת במנדף בחדר נפרד ולעבוד עם DNA מדולל במהלך כל השלבים של פיתוח הליך אימות. - Re- להשעות את הפלסמיד עם מים ultrapure להכין פתרון המניה ב 50 ng / ml. וורטקס ו צנטריפוגות בקצרה את הפתרון מניות פלסמיד.
הערה: קבע את הריכוז האמיתי של STO פלסמידפתרון ck לאחר מחדש ההשעיה כדי לחשב את מספר עותק של פלסמיד. - הוסף 1 μl של פלסמיד ספקטרופוטומטר. קראו את הצפיפות האופטית (OD) ב 230 ננומטר, 260 ננומטר ו -280 ננומטר. קראו את ריכוז ה- DNA על התוכנה ספקטרופוטומטר (OD, 260 ננומטר).
- לחשב את מספר עותק של פלסמיד באמצעות מספר אבוגדרו (נ א) ואת הנוסחה:
העתק מספר / μl = (נ א [פלסמיד ב ng / μl]) / (אורך פלסמיד x 10 9 x המשקל הממוצע של זוג בסיס) = (6022 x 10 x 23 [פלסמיד]) / (אורך פלסמיד x 10 9 x 660)
- להזמין פלסמיד מסחרי המכיל את השבר הרלוונטי של גן מטרת DNA שנבחר PCR (בפרוטוקול זה, נוקלאוטידים 2081-2381 של גן B גליקופרוטאין EHV-2, ראו טבלה 1).
- בדיקה הסגולית (להכללה ובלעדיות) של qRT-PCR
- בדוק את להכללה של מערכת ה- PCR. EHV-2 בחר דגימות DNA חיוביות, מאופיין בעבר על ידי רצף (הוקם מצב חיובי).
- בצע את הליך ההגברה כמתואר בסעיף 2.
- ניתוחנתונים PCR עבור כל דגימה כמפורט בסעיף 2.5. בדוק את הנוכחות של עקומה מעריכית עבור כל הדגימות נבחרו בסעיף 4.2.1 ולאשר להכללה של PCR.
- בדוק את הבלעדיות של מערכת ה- PCR באמצעות תמציות דנ"א פתוגנים עם דמיון גנטי אל היעד (במקרה זה, herpesviruses equid אחרים כגון EHV-1, EHV-4, EHV-3, EHV-5 ו הרפס-5 מטופש כמתואר בטבלה 2) ופתוגנים אחרים המעורבים במחלות הנשימה של המארח (במקרה זה, וירוס arteritis סוסים, וירוס שפעת סוסים, burnetii Coxiella, שוה Rhodococcus, סטרפטוקוקוס שוה שוה, סטרפטוקוקוס שוה zooepidemicus, Chlamydophila abortus ו Klebsiella pneumoniae, ראה טבלה 2).
- בצע את הליך ההגברה כמתואר בסעיף 2.
- לנתח את הנתונים PCR עבור כל דגימה כמפורט בסעיף 2.5. בדקו בהעדר עקום מעריכית עבור כל הדגימות נבחרותסעיף 4.2.4 לאשר את הבלעדיות של PCR.
- לגבול של זיהוי של qRT-PCR
- לוותר 90 μl של מים ultrapure לתוך 6 צינורות.
- בצע 6 דילולים סדרתי פי עשרה של פלסמיד למקד לאזור ההפחתה (הפסד של זיהוי CT). העברת 10 μl מן הפלסמיד עובד דילול אל הצינור עם 90 μl של מים ultrapure. וורטקס בקצרה צנטריפוגות הצינור. חזור על שלב 4.3.2 עד הצינור האחרון דילול סדרתי קבל את הפלסמיד.
- בצע את ההגברה של הדילולים סדרו פי עשרה 6 של פלסמיד כמתואר בסעיף 2.
- קבע את אזור ההפחתה: האזור בין הדילול האחרון של פלסמיד הצגת איתות חיובית ואת הדילול הראשון ללא זיהוי (ראה איור 2).
- כדי להפעיל את כפולת 6 דילולי סדרתי, לבחור את הדילול האחרון של פלסמיד אשר נותן איתות חיובית (ראה סעיף 4.3.4).
הערה: בצע 3 תלת עצמאייםals כדי לקבוע את גבול הגילוי של qRT-PCR (לוד 95% PCR) - לוותר 25 μl של מים ultrapure לתוך 6 צינורות.
- בצע 6 דילולים סדרתי כפולה של הפלסמיד. העברת 25 μl מדילול עובד פלסמיד, כפי שנקבע בסעיף 4.3.5, אל הצינור עם 25 μl של מים ultrapure. וורטקס בקצרה צנטריפוגות הצינור. חזור על שלב 4.3.7 עד הצינור האחרון דילול סדרתי קבל את הפלסמיד.
- בצעו את ההגברה של דילולים סדרתי כפול 6 של פלסמיד כמתואר בסעיף 2. חזור על שלבים 4.3.7 עד 4.3.8 פעמיים, כדי להשיג 3 ניסויים עם 8 משכפל (24 משכפל) של כל אחד 6 פי עשרה דילולים סדרתי של הפלסמיד.
הערה: המגבלה של זיהוי של qRT-PCR (לוד 95% PCR) מוגדרת כמספר עותקי DNA הנמוכים ביותר על ידי יחידה נפח כי הוא זוהה ב -95% ממקרים. - לחשב את מספר משכפל החיובי מתוך 24 משכפל עבור כל רמה של פלסמיד Concentration.
- קבע את PCR 95% לוד. ה- PCR 95% לוד הוא הרמה שתוצאתה זיהוי של 23 משכפל חיובי מתוך 24 חזרות.
- ליניאריות טווח ואת המגבלה של כימות qRT-PCR
הערה: בצע 4 ניסויים עצמאיים עם 6 דילולים סדרו פי עשרה של הפלסמיד על מנת להבטיח כי הריכוז הנמוך ביותר בשימוש בטווח מתאים% 95 לוד PCR נקבע בעבר 4.3.10.- לוותר 45 μl של מי ultrapure ב 6 צינורות.
- הפעל את הדילולים סדרו פי עשרה 6 עם הריכוז של דילול עובד פלסמיד המתאים 10 7 לוד 95% PCR.
- בצע 6 דילולים סדרו פי עשרה של הפלסמיד. העברת 5 μl מדילול עובד פלסמיד (הקבוע בסעיף 4.4.2) אל הצינור עם 45 μl של מים ultrapure. וורטקס בקצרה צנטריפוגות הצינור. חזור על שלב 4.4.3 עד הצינור האחרון דילול סדרתי קבל plasmid.
- הגבר את הדילולים סדרו פי עשרה 6 של פלסמיד כמתואר בסעיף 2.
- עקוב אחר רגרסיה ליניארית y = ax + b עם עבור המדרון ב לנקודת החיתוך (איור 3).
- חשבת את יעילות ההגברה (E) מן המדרון של עקומת סטנדרט (ראה 4.4.5) באמצעות המשוואה:
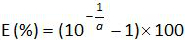 .
.
חזור על שלבים 4.4.1 עד 4.4.6 שלוש פעמים.
הערה: יעילות הגברה מייצגת את כמות גידול מוצר PCR לאחר כל מחזור. תגובה אידיאלית מגיעה יעילות קרובה ל -100%. בפועל, E (%) הייתה בין 75% עד 125%. E גבוהה יכולה להצביע הגברה של מוצרים שאינם ספציפיים או טעות pipetting של דילול סדרתי. תחתון E יכול גם להצביע על שגיאת pipetting של דילול סדרתי, עיצוב פריימר עני או תנאי תגובה הלא-אופטימליים. - חשב את ההטיה (לוח3). אמת עבור כל רמת פלסמיד שערך ההטיה המוחלט הוא פחות מערך ההטיה הקריטי (0.25 יומן 10). לקבוע את ההטיה מהמוצעת ואי הוודאות ליניאריות (U Lini) עבור כל רמת פלסמיד (לוח 3) כדי להעריך את הביצועים של רגרסיה ליניארית עבור EHV-2 qPCR (איור 4). U Lini הוא חוסר הוודאות ליניאריות שנקבעה לכל i פלסמיד רמה מחושבת מ סטיית התקן (SD'i) ולהתכוון משוא פנים. קבע את אי הוודאות ליניאריות משולב (U LIN) של EHV-2 qPCR המחושבת על פי הנוסחה:

הערה: קבלת הטיה שצוינה על-ידי המעבדה (ב הטיה כללית מוחלטת 0.25 יומן 10) ומקבילים ההבדל בין הערך הנמוך ביותר ואת הערך הגבוה ביותר של 0.5 יומן 10 (כמות נמדדת במספר עותק יומן 10). U LIN יכול לעזור כדי להשוות את הביצועים של qPCR ממעבדות שונות. - קבע את הגבול של כימות של qRT-PCR (LOQ PCR): LOQ PCR הוא הריכוז הנמוך ביותר עם יומן הטיה 0.25 10 המשמש בטווח ליניאריות (לוח 3).
5. אפיון של שיטה אנליטית שלמים (מ הפקת DNA לתוצאות qRT-PCR)
הערה: האפיון של השיטה כולה הוא האימות של כל הצעדים הנדרשים על מנת לקבל נתוני qRT-PCR (כלומר, מתוך המיצוי של DNA מדגימת הנשימה (ראה סעיף 1) אל ההגברה וכימות של היעד (ראה סעיף 2 )).
- הקמת התכתבות בין מספר עותקי תגובת PCR וההווה מספר עותקים במדגם הביולוגי עם הנוסחא:
 .
.
ה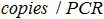 הוא מספר עותק פלסמיד תגובת PCR,
הוא מספר עותק פלסמיד תגובת PCR, 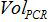 הוא היקף המדגם להוסיף PCR לערבב הגברה,
הוא היקף המדגם להוסיף PCR לערבב הגברה, 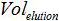 משמש נפח של הצפת AVE כדי elute חומצות גרעין
משמש נפח של הצפת AVE כדי elute חומצות גרעין 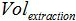 הנפח של המדגם שחולץ.
הנפח של המדגם שחולץ. - בדוק את הרגישות והסגוליות של שיטה אנליטית הפריטים
הערה: ידוע רק EHV-2 חיובי (או שלילי) דגימות משמשים בסעיף זה.- בדוק את "הרגישות" של שיטת qRT-PCR על ידי ניתוח דגימות חיוביות עבור היעד (EHV-2).
- EHV-2 בחר דגימות DNA חיוביות, מאופיין בעבר (מצב חיובי).
- חלץ את חומצות גרעין כמתואר בסעיף 1. בצע הליך הגברה כמתואר בסעיף 2.
- קבע את מספר תוצאות חיוביות אמיתי (דגימות חיוביותאשר הם חיוביים עם זה RT-PCR) והמספר השלילי שווא (הידוע דגימות חיוביות אשר הן שליליים עם זה RT-PCR).
- בדוק את "סגולי" של שיטת qRT-PCR על ידי ניתוח דגימות שליליות
- EHV-2 בחר דגימות DNA שליליות (מצב שלילי).
- חלץ את חומצות גרעין כמתואר בסעיף 1. בצע הליך הגברה כמתואר בסעיף 2.
- לקבוע את מספר נגטיבים האמיתיים (דגימות שליליות אשר ידוע להיות שלילי עם זה RT-PCR) ומספר תוצאות חיוביות שגויות (דגימות שליליות ידועות שהן חיוביים עם זה RT-PCR).
- חשבתי את "רגישות האבחון" (Se) ו "סגולי אבחון" (SP) של השיטה כולה (לוח 4) כדלקמן: Se = מספר תוצאות חיוביות אמיתי / (מספר תוצאות חיוביות אמיתי + שליליים שגוי) ו Sp = מספר אמיתי תשלילים / (מספר ריאלי שלילי+ s תוצאות חיוביות שגויות) (ראה טבלה 4).
- ולחשב את רווח הסמך 95% עבור הרגישות והסגוליות של השיטה כולה עם הנוסחה של ביחס גריינר ו גרדנר 12,20:
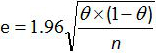
כאשר e הוא השגיאה המשוערת, θ הוא Se (או Sp) ו- n מספר הדגימות מנותחות.
הערה: עבור מספר קטן של דוגמאות, השתמש בטבלה שוורץ פי הנורמה AFNOR 12 כדי לחשב את מרווח ביטחון של 95% עבור הרגישות והסגוליות של השיטה כולה.
- בדוק את "הרגישות" של שיטת qRT-PCR על ידי ניתוח דגימות חיוביות עבור היעד (EHV-2).
- הכנת חומר משאבים שלילי עבור אפיון של שיטת אנליטית הפריטים
זהירות: כדי לקבוע את גבולות איתור וכימות של השיטה כולה (LOD שיטה ואת שיטת LOQ), להוסיף ריכוזים ידועים של פלסמיד דגימות ביולוגיות שאינן ידועות להיות חופשישל היעד (EHV-2 במקרה זה). דגימות אלה, יחד עם הפלסמיד כמותית, מהוות סטנדרטים חיוביים עם על מנת לקבוע את שיטת לוד שיטת LOQ.- אשר בהעדר היעד (2-EHV) בדגימות הביולוגיות המשמשות לבניית סטנדרטים חיוביים.
- בחר דגימות ביולוגיות ידועות שונות שליליות.
- חלץ דגימות ביולוגיות כמתואר בסעיף 1. בצע את ההליך הגברה כמתואר בסעיף 2.
- אשר בהעדר היעד על ידי בהעדר אות PCR בדגימות אלה.
הערה: השתמש באותו חומר המשאב שלילי עבור כל הצעדים בין 5.4 ו -5.5.
- פינת הדגימות השליליות השונות כדי להשיג 15 מיליליטר של חומר משאב שלילי (נפח הדרושים האימות המלאה). לוותר 135 μl של חומר משאב שלילי זה לתוך 100 צינורות. שמור צינורות ב +4 מעלות צלזיוס או ב -80 מעלות צלזיוס לאחסון ארוך.
- אשר בהעדר היעד (2-EHV) בדגימות הביולוגיות המשמשות לבניית סטנדרטים חיוביים.
- Limit של איתור של שיטת אנליטית הפריטים
- קבע את אזור ההפחתה של השיטה כולה.
- לוותר 45 μl של מי ultrapure ב 6 צינורות.
- בצע 6 דילולים סדרו פי עשרה של הפלסמיד. העברת 5 μl מדילול עובד פלסמיד המתאים 10 7 לוד 95% PCR (כפי שנקבע בסעיף 4.3.10) אל הצינור עם 45 μl של מים ultrapure. וורטקס בקצרה צנטריפוגות הצינור. חזור על שלב 5.4.1.2 עד הצינור האחרון דילול סדרתי קבל פלסמיד.
- ההעברה 5 μl מכל דילול של פלסמיד 2 צינורות עם 135 μl של חומר משאבים השלילי להשיג 2 משכפל עבור 6 בסטנדרטים החיוביים. וורטקס ו צנטריפוגות בקצרה.
- בצע חילוץ של 2 משכפל עבור 6 בסטנדרטים החיוביים כמתואר בסעיף 1. בצע את הליך ההגברה כמתואר בסעיף 2.
- קבע את אזור ההפחתה: האזור בין הקונצרט כלשהו האחרוןentration של פלסמיד נותן איתות חיובית ואת הריכוז הראשון שמראה אין אות.
- לגבול של זיהוי של השיטה (שיטת LOD) נקבע על ידי 2 ניסויים עצמאיים
הערה: בצע 2 ניסויים עצמאיים כדי לקבוע את גבול הגילוי של השיטה השלמה (שיטת לוד).- הפעל את דילולי סדר כפולים 6 עם הדילול עובד פלסמיד כי הוא פי 4 יותר מרוכז כי הריכוז האחרון של פלסמיד כי נתן איתות חיובית (ראה סעיף 5.4.1.5).
- לוותר 25 μl של מי ultrapure ב 6 צינורות.
- בצע 5 דילולים סדרתי כפולה של הפלסמיד. העברת 25 μl מדילול עובד פלסמיד (כפי שנקבע בסעיף 5.4.2.1) אל הצינור עם 25 μl של מים ultrapure. וורטקס בקצרה צנטריפוגות הצינור. חזור על שלב 5.4.2.3 עד הצינור האחרון דילול סדרתי קבל פלסמיד.
- העברת 5 μl מכל דילול של plasmiד עד 4 צינורות עם 135 μl של חומר משאבים השלילי להשיג 4 משכפל 5 בסטנדרטים החיוביים. וורטקס ו צנטריפוגות צינורות בקצרה.
- בצע חילוץ של 4 משכפל עבור 5 בסטנדרטים החיוביים כמתואר בסעיף 1. בצע את הליך ההגברה כמתואר בסעיף 2.
- חזור על שלבים 5.4.2.1 כדי 5.4.2.5 פעם להשיג 8 משכפל עבור כל רמה של ריכוז פלסמיד.
- ספירת משכפל חיובי מתוך 8 משכפל עבור כל רמה של ריכוז פלסמיד.
- קבע את השיטה בלוד. שיטת לוד היא הרמה האחרונה שבה 8 משכפל מתוך 8 משכפל הוא חיוביים (כמפורט בסעיף 5.4.2.7).
- קבע את אזור ההפחתה של השיטה כולה.
- ליניאריות טווח ואת מגבלה של כימות של שיטת אנליטית הפריטים
הערה: כדי לקבוע את גבול הכימות של השיטה כולה (שיטה LOQ), להוסיף ריכוזים ידועים של פלסמיד ביולוגידגימות שאינם ידועים להיות חופשיות של היעד (EHV-2 במקרה זה). דגימות אלה מהווים תקנים חיוביים כדי לקבוע את שיטת LOQ.- לוותר 45 μl של מי ultrapure ב 6 צינורות.
- בצע 6 דילולים סדרו פי עשרה של הפלסמיד. העברת 5 μl מדילול עובד פלסמיד המתאים 10 שיטה 7 לוד (כפי שנקבע בסעיף 5.4.2.8) אל הצינור עם 45 μl של מים ultrapure. וורטקס בקצרה צנטריפוגות הצינור. חזור על שלב 5.5.2 עד הצינור האחרון דילול סדרתי קבל את הפלסמיד.
- העברה 5 μl מכל דילול של פלסמיד 2 צינורות עם 135 μl של חומר משאבים ביולוגיים שלילי להשיג 2 משכפל של 6 בסטנדרטים החיוביים. וורטקס ו צנטריפוגות בקצרה.
- בצע חילוץ של 2 משכפל עבור 6 בסטנדרטים החיוביים כמתואר בסעיף 1. בצע את הליך ההגברה כמתואר בסעיף 2. חזור על שלבי 5.5.1כדי 5.5.4 שלוש פעמים.
- להגדיר פרופיל דיוק על מנת להעריך ולאמת את הביצועים הכמותיים של השיטה.
- הגדר את גבולות הקבילות של השיטה כולה עבור במעבדה. בפרוטוקול זה, גבולות הקבילות מוגדרים ± 0.75 יומן 10 על ידי LABéO פרנק Duncombe.
- למשפט אחד, להתחקות אחר y רגרסיה ליניארית הראשון = ax + b (a הוא המדרון b הוא ליירט) עם לשכפל אחד ערכי ה- CT המתאים לכל אחד מהשווי המוערך של עקומת סטנדרט. עם רגרסיה ליניארית הראשונה, לחשב את ערך ניסיוני של מספר העותק עבור המשכפל של ערכי ה- CT משמש עקומת הסטנדרט ראשונה זה. חזור על שלב 5.5.5.2 עם המשכפל השני של ערכי ה- CT כדי השיג רגרסיה ליניארית שנייה ולחשב את הערך הניסיוני של מספר העותק עבור המשכפל השני של ערכי ה- CT משמש עקומת הסטנדרט השנייה.
- חזור על שלב 5.5.5.2 עם הניסויים השניים ושלישיים.
- חשב את הדיוק, trueness ומגבלות דיוק עבור כל רמת פלסמיד פי NF U47-600-2 12.
- צור גיליון אלקטרוני כדי ללקט את המידע לגבי כל נקודות הסטנדרטיות (5.5.5.4) וליצור פרופיל דיוק במגבלות המקובלות שהוגדרו קודם לכן 5.5.5.1 ואת אמיתות הנתונים יחד עם תחתון ואת גבולות דיוק העליונים כפי שחושב 5.5 .5.4 (איור 5).
- קבע את שיטת LOQ: זו תואמת את הריכוז הנמוך ביותר של עקומת סטנדרט עם 0.75 יומן 10 trueness כפי שמוצג עבור מגוון ליניאריות מחושב ב 5.5.5.5.
- הערכת הדירות ויכולת שחזור
הערה: בדוק את הדירות ויכולת שחזור באמצעות היחס בין סטיית התקן לממוצע של מדידות לשכפל (מקדם השונות, או CV = סטיית התקן /מְמוּצָע).- להעריך את הדירות של שיטת הפריטים על ידי 1 אנליסט:
- בחר 3 דגימות ביולוגיות עם 3 המון הגנום הנגיפי ברורים (נבדק בעבר PCR למשל).
- חלץ 8 משכפל של 3 דגימות כמפורט בסעיף 1. בצע את ההליך הגברה כמתואר בסעיף 2.
- לחשב את הממוצע וסטיית התקן של ערך ה- CT שנאספו עבור כל דגימה.
- חשב את CV התוך assay באמצעות CV הנוסחה = סטיית התקן / מתכוון.
- להעריך את השחזור של שיטת הפריטים על ידי 3 אנליסטים:
- בחר 3 דגימות ביולוגיות עם 3 המון הגנום הנגיפי ברורים (נבדק בעבר PCR למשל)
- חלץ 2 משכפל של 3 הדגימות שנבחרו 5.6.2.1 (כמתואר בסעיף 1). בצע את הליך ההגברה כמתואר חזור סעיף 2. צעדים 5.6.2.2 ידי 2 אנליסטים עצמאיים.
- לחשב את הממוצע ואת סטיית התקןשל ערך Ct שנאסף עבור כל דגימה.
- חשב את CV הבין-assay באמצעות CV הנוסחה = סטיית התקן / מתכוון.
- להעריך את הדירות של שיטת הפריטים על ידי 1 אנליסט:
תוצאות
השיטה RT-PCR כמותי, כפי שתואר לעיל, יושמה כדי לזהות ולכמת ההרפס-2 equid בנוזלי הנשימה. איור 1 מדגים תרשים זרימת עבודה סכמטי עבור פיתוח ותיקוף שיטה כמותית RT-PCR פי הנורמה AFNOR NF U47-600. הספציפי של primers ו הבדיקות אומתו במהלך פיתוח צעד-אחר-צעד של PCR. רק EHV-2 זנים היו מוגברים במערכת זו. כתוצאה מכך, הביצועים של היו qRT-PCR להתאפיין.
ראשית, כדי להעריך את PCR לוד, דילול סדרתי 6 פי עשר בוצע להקים את אזור ההפחתה (איור 2). בדוגמה זו, 6 דילולים סדרתי פי עשרה נעשו בין 10 -5 ו 10 -10 (בין 26,000 ו 0.26 עותקים / 2.5 מדגם μl) כדי להעריך את PCR בלוד. אזור ההפחתה lies בין דילולים של 10 -9 ו 10 -10 (בין 2.6 ו 0.26 עותקים / 2.5 מדגם μl). כדי לקבוע את הערך PCR LOD במקרה זה, 6 דילולים סדרתי כפולה של פלסמיד נעשו באזור הפחתה זו בין 5.2 לבין 0.16 עותקים / 2.5 מדגם μl. שווי לוד PCR היה 2.6 עותקים / 2.5 מדגם μl.
כדי לקבוע את הטווח ליניאריות LOQ PCR, ערך PCR לוד שמש להתחיל בטווח של 6 דילולים סדרו פי עשרה, בין 2.6 (LOD PCR) ו 260,000 עותקים / 2.5 מדגם μl. איור 3 ממחיש רגרסיה ליניארית עבור EHV2 qRT-PCR ממשפט אחד. ההופעות של רגרסיה ליניארית (איור 4) הן תוקפות ארבעה פעמים באמצעות החישובים המתואר בטבלה 3. החישובים נערכים על מנת להגדיר את הטווח ליניאריות פי הקריטריונים Bias המוחלט אני value ≤0.25 להיכנס 10, מה רמת i של עומס פלסמיד. במקרה זה, הליניאריות טווח שהשתרע בין 2.6 ו 260,000 עותקים / 2.5 מדגם μl. ה- PCR LOQ הוא הריכוז הנמוך ביותר בטווח ליניאריות (כלומר, 2.6 עותקים / 2.5 מדגם μl במקרה זה). U לין היה נחוש בדעתו להיות 0.12 יומן 10 בטווח 2.6-260,000 עותקים / 2.5 μl של ה- DNA.
לאחר פיתוח (איור 1, כחול) ואפיון של qRT-PCR (איור 1, צהוב), הנורמה U47-600 AFNOR NF ממליצה אפיון של שיטה אנליטית כולו מן מיצוי DNA כדי qRT-PCR (איור 1, כתום). הרגישות והסגוליות אבחון חושבו כמתואר בטבלה 4. ההופעות הכמותית של שיטה אנליטית כולו qRT-PCR הוערך ומאומתים עם פרופיל דיוק ( איור 5).
פרוטוקול זה, אשר משתמש המדינה- of-the-art טכנולוגיה מולקולרית, אפשר לנו לזהות ולכמת את עומס הגנום הנגיפי EHV-2 ב 172 דגימות ספוגית אף המתקבל סוסים עם הפרעות נשימה ו / או חשד קליני לזיהום. תחולת EHV-2 מהשדה דגימות (ביולוגי) היה 50% (86/172) באוכלוסיה זו. הניתוחים כמותיים הראו כי המון הגנום הנגיפי של EHV-2 היו גבוהים יותר משמעותית סוסים צעירים ואת לחלק מחדש של המון הגנום הנגיפי ירד עם הגיל (איור 6). במחקר הנוכחי, העומס הגנום הנגיפי הגבוה EHV-2 (1.9 x 10 11 עותקים / מ"ל) זוהה סייחים (איור 6).
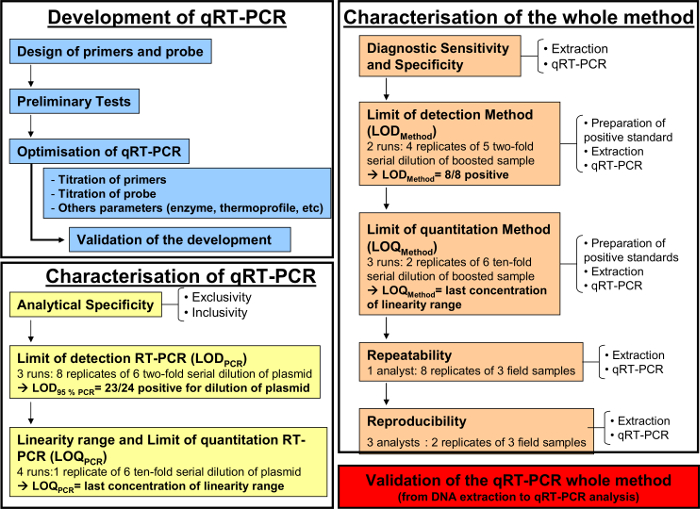
איור 1: תרשים זרימת עבודה לפיתוח (כחול), אפיון של RT-PCR כמותי(צהוב) ואת האפיון של שיטה אנליטית כולו מן מיצוי DNA כדי qRT-PCR (כתום) על פי הנורמה AFNOR NF U47-600-2. התרשים עבודה קורות חיים השלבים השונים לפיתוח, אפיון של RT כמותיים -PCR ואת האפיון של שיטה אנליטית כולו מן מיצוי DNA כדי qRT-PCR. לכל שלב, תרשים העבודה מציין את מספר ריצות נדרשו, דילולים לבצען ומספר האנליסטים הנדרשים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
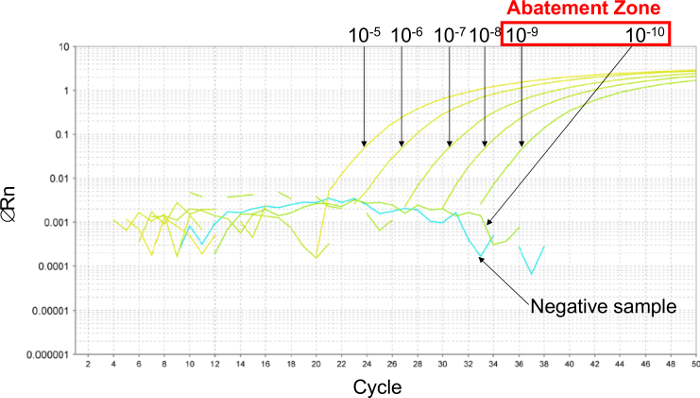
איור 2: קביעת אזור ההפחתה עם תוצאות נציגים עקומות בזמן אמת PCR שהושג עם 6 דילולים סדרו פי עשרה של פלסמיד. כדי להעריך את אזור ההפחתה, 6 סדרתי פי עשרהדילולים נעשים בין 10 -5 (26,000 עותקים / 2.5 מדגם μl) ו 10 -10 (0.26 עותקים / 2.5 מדגם μl). אזור הפחתה טמון בין דילולים של 10 -9 (2.6 עותקים / 2.5 מדגם μl) ו 10 -10 (0.26 עותקים / 2.5 מדגם μl). במקרה זה, 6 דילולים סדרתי כפולה של פלסמיד נעשו באזור הפחתה זו כדי לקבוע את PCR 95% לוד, בין 5.2 ו 0.16 עותקים / 2.5 מדגם μl. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
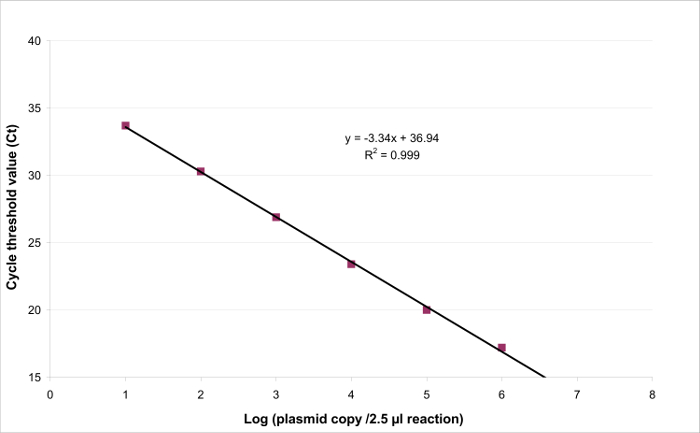
איור 3:. רגרסיה לינארית עבור EHV2 qRT-PCR הליניאריות של בדיקות כמותיות הוא היכולת ליצור תוצאות ואלה עומדות ביחס ישר לריכוז של היעד הנוכחי בתוך טווח מסוים. זה יכול להיות מודל על ידירגרסיה ליניארית (y = ax + b) בין התגובה אינסטרומנטלי (סף מחזור או CT) הלוגריתם של הכמות של היעד (מספר עותקי יעד / 2.5 מדגם μl). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו .
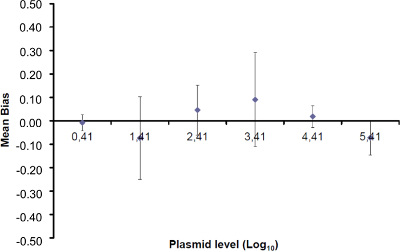
איור 4:. ביצועים של רגרסיה ליניארית של EHV-2 qPCR Mean הטיה מייצגים את ההבדל הממוצע בין כמות פלסמיד מדודה ( 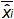 ) ואת כמות פלסמיד התיאורטית (x 'i) עבור כל רמת פלסמיד. הקווים האנכיים מייצגים את הוודאות ליניאריות (U Lini) המחושבת על פי הנוסחה
) ואת כמות פלסמיד התיאורטית (x 'i) עבור כל רמת פלסמיד. הקווים האנכיים מייצגים את הוודאות ליניאריות (U Lini) המחושבת על פי הנוסחה 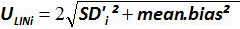
שם SD'i הוא סטיית התקן o f נמדד פלסמיד כמות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
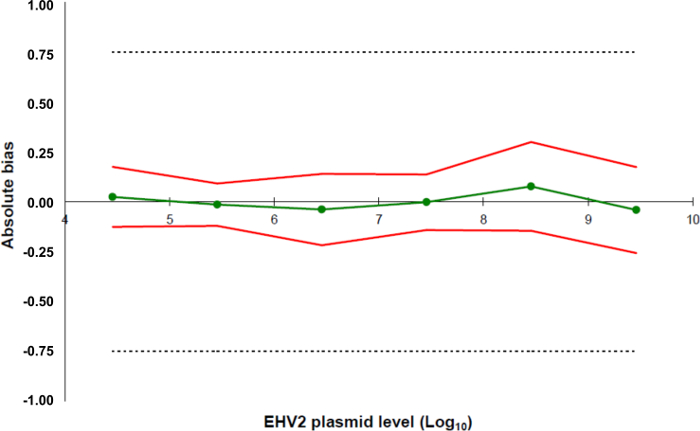
איור 5:. פרופילי דיוק מבוססים על תוצאות האימות של שיטת EHV-2 qRT-PCR הקו הירוק (עיגולים) מייצג את אמיתות הנתונים (טעות שיטתית, או הטיה). גבולות הקבילות מוגדרים ב ± 0.75 יומן 10 על ידי המעבדה (קווים מקווקווים). התחתונים ואת גבולות הדיוק העליונים נקבעו עבור כל רמת עומס פלסמיד מתוך ההטיה הממוצעת ± פעמי סטיית ההתקן של הנתונים האמינים (קווים אדומים). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
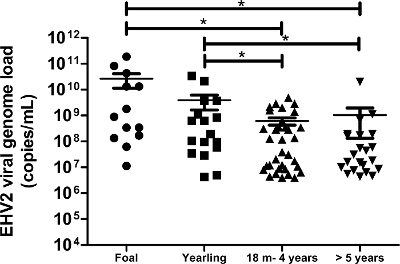
איור 6:. כימות המון הגנום הנגיפי של EHV-2 לפי גיל חלוקת עומס הגנום הנגיפי של EHV-2 בדגימות ספוגית האף מיוצגת עבור קבוצות גיל שונות. הקווים האופקיים מייצגים את ערכי החציון בתוך סטיית התקן (מ '= חודשים). * שונה באופן משמעותי על ידי ANOVA עם ניומן-Keuls פוסט הוק בדיקה (p <0.05). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| גן היעד | Primers, חללית רצפי plasmide (5'-3 ") | עמדת נוקלאוטיד | גודל מוצר (נוקלאוטידים) | תנאי רכיבה תרמיים | הפניות | |||
| EHV2 GB (HQ247755.1) | קדימה: GTGGCCAGCGGGGTGTTC | 2113-2130 | 78 | 95 ° C 5 דקות | 11 | |||
| הפוך: CCCCCAAAGGGATTYTTGAA | 2189-2170 | 95 ° C 15 שניות | 45 מחזורים | |||||
| Probe: FAM-CCCTCTTTGGGAGCATAGTCTCGGGG-MGB | 2132-2157 | 60 ° C 1 דקות | ||||||
| פלסמיד: ACCTGGGCACCATAGGCAAGGTGGTGGTCA ATGTGGCCAGCGGGGTGTTCTCCCTCTTTG GGAGCATAGTCTCGGGGGTGATAAGCTTTTT CAAAAATCCCTTTGGGGGCATGCTGCTCATA GTCCTCATCATAGCCGGGGTAGTGGTGGTG TACCTGTTTATGACCAGGTCCAGGAGCATAT ACTCTGCCCCCATTAGAATGCTCTACCCCGG GGTGGAGAGGGCGGCCCAGGAGCCGGGCG CGCACCCGGTGTCAGAAGACCAAATCAGGA ACATCCTGATGGGAATGCACCAATTTCAG | 2081-2381 | |||||||
טבלה 1:. רצפים של פריימרים, בדיקות ובקרות DNA סינתטי חיובית בשימוש בפרוטוקול זה רצף של פלסמיד (DNA סינתטי חיובי) תואמת נוקלאוטיד עמדות 2081-2381 של רצף EHV2gB (HQ247755.1). העיצוב של primers ו בדיקות להשתמש בפרוטוקול זה הושג באמצעות תוכנה ספציפית.
| פתוגנים | הפניה (מקור) | מספר הזנים | תוצאות |
| EHV-2 | |||
| EHV-2 | VR701 (ATCC) | 20 | חִיוּבִי |
| 20 דגימות (אוסף FDL) | |||
| EHV-5 | KD05 (GERC) | 20 | שלילי |
| 20 דגימות (אוסף FDL) | |||
| EHV-3 | VR352 (ATCC) | 2 | שלילי |
| T934 WSV (GERC) | |||
| EHV-1 | זן קנטאקי קי A (ATCC) | 3 | שלילי |
| 2 דוגמאות (אוסף FDL) | |||
| EHV-4 | VR2230 (ATCC) | 1 | שלילי |
| מטופש ההרפס AHV5 | אוסף FDL | 1 | שלילי |
| סוּסִיוירוס שפעת | A / סוסים / Jouars / 4/2006 (H3N8) | 1 | שלילי |
| (ספר עיון JX091752) | |||
| וירוס arteritis סוסים | VR796 (ATCC) | 2 | שלילי |
| Rhodococcus שוה | אוסף FDL | 1 | שלילי |
| Subsp שוה סטרפטוקוקוס. Zooepidemicus | אוסף FDL | 1 | שלילי |
| Subsp שוה סטרפטוקוקוס. שָׁוֶה | אוסף FDL | 1 | שלילי |
| burnetii Coxiella | ADI-142-100 (Adiagene) | 1 | שלילי |
| Chlamydophila abortus | ADI-211-50 (Adiagene) | 1 | שלילי |
| Klebsiella Pneumoniae | אוסף FDL | 1 | שלילי |
טבלה 2: סגולי אנליטית של qRT-PCR עבור EHV-2.
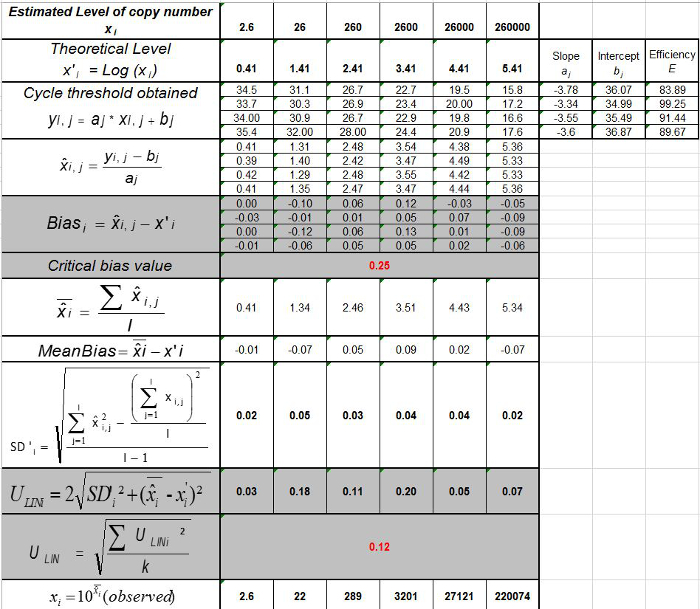
טבלה 3: חישוב אי הוודאות משוא פנים ליניאריות (מותאם מ NF U47-600-2 12). עבור כל ניסוי, ההופעות של רגרסיה ליניארית (y = ax + b) הן תוקפות באמצעות הטבלה כאשר y הוא סף המחזור מתקבל; a הוא המדרון שהושג;. X היא רמת פלסמיד ו- B הוא ליירט i הוא פלסמיד הרמה (i משתנית מ -1 עד רמות k); k הוא מספר רמות פלסמיד המשמש (למשל, k = 6 ב tהשולחן) שלו; j הוא הניסוי (j משתנית בין 1 ל I של ניסויים); I הוא מספר הניסויים, מורכב בין 3 ו -6 ניסויים (למשל I = 4 בטבלה זו) x i הוא כמות פלסמיד המוערכת לכל. אני פלסמיד רמה. x 'אני שווה לכל כמות פלסמיד התיאורטית שהושגה עם x המשוואה' i = להיכנס 10 (x i) לכל i פלסמיד רמה. במהלך כל ניסוי j, סף המחזור מתקבל לכל i רמת פלסמיד מחושבת עם רגרסיה ליניארית אני y, j = a x j i, j + b j. 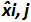 הוא כמות פלסמיד נמדד במהלך j לדין. Bias i sub> ההבדל שנצפה בין כמות פלסמיד מדודת כמות פלסמיד התיאורטית עבור כל בדיקה בכל רמת פלסמיד.
הוא כמות פלסמיד נמדד במהלך j לדין. Bias i sub> ההבדל שנצפה בין כמות פלסמיד מדודת כמות פלסמיד התיאורטית עבור כל בדיקה בכל רמת פלסמיד. 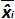 הוא הערך הממוצע של
הוא הערך הממוצע של 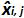 על ידי כל אני פלסמיד רמת; SD 'אני הוא סטיית התקן של הגודל הנמדד
על ידי כל אני פלסמיד רמת; SD 'אני הוא סטיית התקן של הגודל הנמדד 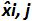 לכל i רמת פלסמיד; Mean הטיה היא הממוצע של Bias i; U Lini הוא חוסר הוודאות ליניאריות שנקבעה לכל i פלסמיד רמה שנמדדת SD'i ולהתכוון הטיה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
לכל i רמת פלסמיד; Mean הטיה היא הממוצע של Bias i; U Lini הוא חוסר הוודאות ליניאריות שנקבעה לכל i פלסמיד רמה שנמדדת SD'i ולהתכוון הטיה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
לוח 4:. חישוב רגישות אבחון (Se) וסגוליות (SP) של השיטה כולה שולחן שוורץ שימש לחישוב confidמרווח ence ב 95% של הרגישות והסגוליות של השיטה כולה כמתואר NF U47-600-2.
Discussion
מאז שנות ה -2000, בזמן אמת PCR כבר להחליף את הטכניקות תקן הזהב (תרבית תאים ושיטות התרבות חיידקים) ב מספר גדל והולך של מעבדות. יישום הטכניקה הוא קל יחסית. עם זאת אימות של שיטות מעבדה חיונית זיהוי מולקולרי וכימותי פתוגנים כדי להבטיח נתונים מדויקים, דיר אמין.
מאז צעד החילוץ הוא המקור העיקרי של אובדן של חומר ביולוגי, היא עשויה להיחשב המקור העיקרי של שגיאה של כימות בין פרוטוקול אחד למשנו. ככזה, יצירת עקומת סטנדרט של פלסמיד DNA במהלך qRT-PCR, בעיקר מהמדווח בספרות, מציין את העומס הגנום הנגיפי אבל לא לוקח בחשבון את הצעד החילוץ.
תיאור של אסטרטגיה דה נובו עבור תהליך אימות השיטה כולה בנורמה AFNOR NF U47-600-2 מייצג התקדמות משמעותית בתחום זה. כפי שמודגםבמאמר זה עבור EHV-2 בסוסים, או על ידי אחרים בדבורים 21, זו מחייבת הבחנה ברורה בין שלב הפיתוח על שלב האימות עם אפיון של PCR ואפיון של השיטה כולה. מגבלה אחת בגישה מעניינת לכך היא כי כל שינוי בפרוטוקול יגרום החובה revalidate את התהליך המלא אשר יכול להיות מאוד יקר. מגבלה זו גם הייתה מודגשת על ידי העובדה כי בין כותלי כימות תלוי המקור שממנו הווירוס מופק (למשל, נוזלים בדרכי נשימה, איברים, דם או שתן). למעשה, כל מטריצה מציג ספציפיות שונות במאפייני פיסיקלי כימיה שלהם וזה חשוב להגדיר כל מטריצה שונה באופן עצמאי לצורך איתור וכימות ויראלי ידי qRT-PCR. לפיכך, עומס הגנום הנגיפי של כל דגימה ביולוגית ניתן לכמת באופן מדויק יותר מן החילוץ. האפיון גם לוקח בחשבון את mod thermocyclerאל וכאשר שימוש שיטה בעבר היטב מאופיינת (למשל, שיטת qPCR EHV-2 המתואר במאמר זה) מחייב סוג חדש של מכונית במעבדת ההורה או מעבדה אחרת, יש לאשר את הביצועים של מכשיר זה. האישור של הביצועים של assay qPCR הוא תנאי הכרחי עבור כל הבדיקות להביא למעבדה. זו מושגת בדרך כלל על ידי ניתוח מדגם התייחסות עם מאפיינים ידועים. כזה המחאה היא תנאי ונחשב חובה כמבוקש על ידי הנורמה AFNOR NF 47-600-1 כדי לאמת את הביצועים של qPCR (לוד, יעילות LOQ) ואת חוסנו של השיטה כולה (לוד, LOQ). לא רק במהלך השלבים פיתוח ואפיון אלא גם כאשר נעשה שימוש במחקר, או למטרות אבחון, ניתן לזהות את גורמי הסיכון ואת מבוקרים היטב על מנת להבטיח סטנדרטיזציה של הפרוטוקול. מדאיג במיוחד הוא אימון צוות נאות, כוח אדם מיומן, בקרת איכות של החומרים מתכלהמשומשים והאחסון שלהם, שליטה על התנאים והמודעות סביבתיים מיידית תנאים המטרולוגי שעשויים להשפיע על הביצועים של המכשירים המדעיים המעורבים assay. שימוש דגימות התייחסות להשוואות בין-מעבדה גם יכול לסייע בשליטה על חוסר הוודאות. באופן זה, השוואה של נתונים בין מעבדות ניתן הקל. ואכן, בדיקות מיומנות בין-מעבדה חיוניות להעריך ולאשר את השחזור של השיטה.
תוצאות עומס הגנום נגיפיות אשר באות לידי ביטוי יחידות בינלאומיות (IU) של המטריצה הביולוגית נתחה (IU: עותקים / מיליליטר עבור נוזלים או עותקים / g עבור רקמות) הם קלים יותר לשימוש על מנת להשוות את התוצאות בין מעבדות שונות. כל התוצאות מעל LOQ מבוטאות עותקים / מ"ל וגם תוצאה בין לוד LOQ נלקח כתוצאה חיובית שאינם מדידים. הצגת נתוני quantificational של הגנום בצורה זו תואמת יותר במדויק למחזורים של ניתוחים (הגברה של הגנום). למעשה, בניסויים בתרביות תאים, ביטוי של העומס הנגיפי על ידי TCID 50 (מקור להדבקת תרבות החציוני רקם מנה) תלוי באופי של זני התאים וירוסים. כל שורת זן בעל קינטיקה הזיהום ייחודית וכמה וירוסים כמו EHV-2 יכול לקחת כמה ימים לפני השפעת cytopathogenic הראשונה היא נראה לעין.
לסיכום, שיטה חדשה זו של אפיון של qRT-PCR אמורה להקל על הרמוניזציה של מצגת נתונים ופרשנות בין מעבדות. זה יהיה שימושי מאוד עבור יישומים פוטנציאליים חדשים של qRT-PCR בעתיד כמו הקמת ערך חתוך עבור הכרזה על מצב המחלה ולא רק הנוכחות או היעדר של הפתוגן.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
The authors would like to thank Sophie Castagnet and Nadia Doubli-Bounoua for their technical support. This work received financial support from the General Council of Calvados and the agreement of Region Basse-Normandie and French Government (CPER 2007-2013; project R25 p3). The authors would like to thank the experts of the AFNOR group and particularly Jean-Philippe Buffereau and Eric Dubois.
Materials
| Name | Company | Catalog Number | Comments |
| AB-1900 natural color ABgene 96 well plate | Dutsher | 16924 | |
| Adhesive film qPCR Absolute | Dutsher | 16629 | Adhesive film used for sealing the plate prior to the qRT-PCR run |
| 0.5 ml microtubes, skirted, caps | Dutsher | 039258 | |
| Ethanol 98% | Sodipro | SAF322941000 | |
| Primers | Eurofins | Custom order | |
| Probe | Life Technologies | Custom order | |
| Plasmid | Eurofins | Custom order | |
| QIAamp RNA viral Mini Kit (containing: QIAamp Mini column, AVL buffer, AW1 buffer, AW2 buffer, AVE buffer, collection tubes) | Qiagen | 52906 | AVL buffer: pre-warm 5 min at 72 °C |
| Sequencing by Sanger method | Eurofins | Custom order | |
| Taqman Universal PCR Master Mix | Life Technologies | 4364340 | |
| Tris-EDTA buffer solution | Santa Cruz | sc-296653A | |
| NanoDrop 2000c Spectrophotometer | Thermoscientific | ND-2000C | |
| StepOnePlus Real-Time PCR systems | Life Technologies | 4376600 | pre-warm 15 min |
References
- Brault, S. A., et al. The immune response of foals to natural infection with equid herpesvirus-2 and its association with febrile illness. Vet.Immunol.Immunopathol. 137 (1-2), 136-141 (2010).
- Fortier, G., Van Erck, E., Pronost, S., Lekeux, P., Thiry, E. Equine gammaherpesviruses: pathogenesis, epidemiology and diagnosis. Vet.J. 186 (2), 148-156 (2010).
- Hue, E. S., et al. Detection and quantitation of equid gammaherpesviruses (EHV-2, EHV-5) in nasal swabs using an accredited standardised quantitative PCR method. J Virol.Methods. 198 (1), 18-25 (2014).
- Diallo, I. S., et al. Multiplex real-time PCR for the detection and differentiation of equid herpesvirus 1 (EHV-1) and equid herpesvirus 4 (EHV-4). Vet.Microbiol. 4 (1-3), 93-103 (2007).
- Williams, K. J., et al. Equine multinodular pulmonary fibrosis: a newly recognized herpesvirus-associated fibrotic lung disease. Vet.Pathol. 44 (6), 849-862 (2007).
- Mullis, K., et al. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Cold Spring Harb.Symp.Quant.Biol. 51 (1), 263-273 (1986).
- EPA Office of Water (4607). EPA-815-B-04-001. Quality Assurance/Quality Control Guidance for Laboratories Performing PCR Analyses on Environmental Samples. , (2004).
- Telford, E. A., et al. Equine herpesviruses 2 and 5 are gamma-herpesviruses. Virology. 195 (2), 492-499 (1993).
- Fortier, G., et al. Identification of equid herpesvirus-5 in respiratory liquids: A retrospective study of 785 samples taken in 2006-2007. Vet.J. 182 (2), 346-348 (2009).
- Brault, S. A., Bird, B. H., Balasuriya, U. B., MacLachlan, N. J. Genetic heterogeneity and variation in viral load during equid herpesvirus-2 infection of foals. Vet.Microbiol. 147 (3-4), 253-261 (2011).
- Association Francaise de Normalisation. NFU 47-600-1. Animal health analysis methods-PCR-Part 1: Requirements and recommandations for the implementation of veterinary PCR. , (2015).
- Association Francaise de Normalisation. NFU 47-600-2. Animal health analysis methods-PCR-Part 2: Requirements and recommendations for the development and the validation of veterinary PCR. , (2015).
- ISO. EN ISO-CEI 17025. General requirements for the competence of testing and calibration laboratories. , (2005).
- Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2010. Chapter1.1.1.4/ 5. Principles and Methods of Validation of Diagnostic Assay for Infectious Diseases. , This thoroughly revised chapter replaces Chapter 1.1.4 Principles of validation of diagnostic assays for infectious diseases and Chapter 1.1.5 Validation and quality control of polymerase chain reaction methods used for the diagnosis of infectious diseases from the sixth edition of the OIE Terrestrial Manual (2009).
- Apaza, S., et al. Detection and genogrouping of noroviruses from children's stools by Taqman One-step RT-PCR. J Vis.Exp. (65), e3232(2012).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis.Exp. (63), e3998(2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol.Biol. 94 (3), 441-448 (1975).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proc.Natl.Acad.Sci.U.S.A. 74 (12), 5463-5467 (1977).
- NCBI. BLAST Homepage and Selected Search Pages. Introducing the BLAST homepage and form elements/functions of selected search pages. , (2015).
- Greiner, M., Gardner, I. A. Application of diagnostic tests in veterinary epidemiologic studies. Prev.Vet Med. 45 (1-2), 43-59 (2000).
- Blanchard, P., Regnault, J., Schurr, F., Dubois, E., Ribiere, M. Intra-laboratory validation of chronic bee paralysis virus quantitation using an accredited standardised real-time quantitative RT-PCR method. J Virol.Methods. 180 (1-2), 26-31 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved