Method Article
呼吸器流体におけるウマヘルペスウイルス-2の診断のための定量的PCR法の開発と検証
要約
Here, we present a protocol for the development and validation of a quantitative PCR method used for the detection and quantification of EHV-2 DNA in equine respiratory fluids. The EHV-2 qRT-PCR validation protocol involves a three-part procedure: development, characterization of qRT-PCR assay alone, and characterization of the whole analytical method.
要約
The protocol describes a quantitative RT-PCR method for the detection and quantification of EHV-2 in equine respiratory fluids according to the NF U47-600 norm. After the development and first validation step, two distinct characterization steps were performed according to the AFNOR norm: (a) characterization of the qRT-PCR assay alone and (b) characterization of the whole analytical method. The validation of the whole analytical method included the portrayal of all steps between the extraction of nucleic acids and the final PCR analysis.
Validation of the whole method is very important for virus detection by qRT-PCR in order to get an accurate determination of the viral genome load. Since the extraction step is the primary source of loss of biological material, it may be considered the main source of error of quantification between one protocol and another. For this reason, the AFNOR norm NF-U-47-600 recommends including the range of plasmid dilution before the extraction step. In addition, the limits of quantification depend on the source from which the virus is extracted. Viral genome load results, which are expressed in international units (IU), are easier to use in order to compare results between different laboratories.
This new method of characterization of qRT-PCR should facilitate the harmonization of data presentation and interpretation between laboratories.
概要
ウマヘルペスウイルス2型(EHV-2)は、このような鼻汁、咽頭炎やリンパ節の腫れ1-3のような潜在的な臨床症状で、呼吸器症候群に関与しています。このウイルスはまた、馬産業の2のための重要なと負の経済的影響をもたらす可能性がある、馬の貧弱なパフォーマンスとの関連が疑われています。
今までは、ガンマ - EHVのゴールドスタンダード(γ-EHV)の検出は、細胞培養方法でした。この手順の最初の不便さは、EHV-2およびその他のγ-EHVの( 例えば、EHV-5)との間に差別が存在しないことでした。第二の不便は4,5をマニフェストに12〜28日からかかる細胞変性プロセスの遅い開発でした。
検証および正規化された定量的リアルタイムポリメラーゼ連鎖反応の開発(QRT-PCR)は、この方法は、迅速にEHV-2とEHV-区別するために、ウイルスを検出するために役立ちます5およびウイルスゲノムの負荷と定量化の側面に病気のおかげとの関係を研究します。
ポリメラーゼ連鎖反応(PCR)マリス6によって1986年に初めて記載され、生物学的診断(人間、環境と獣医学)の分野のほとんどに新しいゴールドスタンダードになろうとしているれました。特異性、感度、迅速性:病原体のゲノムの一部の増幅に基づいている。この方法は、多くの利点を提供します。また、アンプリコン混入のリスクを定量RT-PCRの出現及び品質保証7が後退しました。それにもかかわらず、新たなゴールドスタンダード法としてPCRの認識がちょうど改善されたパフォーマンスデータだけでなく、時間をかけて性能の劣化なしに全体の方法の開発と検証段階の制御の実証以上を必要としました。
EHV-2の検出のために使用される最初の分子ツールは、時間Cでしたonsumingおよびシーケンシング8に続いて、ネストされたPCRに関わる非特異的な増幅。ヘルペスウイルスの標的遺伝子は、デオキシリボ核酸(DNA)ポリメラーゼとDNAパッケージ9でした。ただし、ネストされたPCRアンプリコンによる汚染の高いリスクを提示します。それ以来、従来のPCR試験は、最近になって、リアルタイムPCRの特性はEHV-2 10の定量のために記載した。2009年に概説インターロイキン10様遺伝子または糖タンパク質B遺伝子を増幅するために設計されたが、データは利用できなかったされてい抽出プロセスを含む全方法の検証について。
このプロトコルでは、開発と検証の手順は協会フランセーズデ正規化 (AFNOR)によると、馬の呼吸器流体中のEHV-2 DNAの検出および定量化のための定量的PCR法に記載されている標準NF U47-600 3,11,12、フランス代表ではあります国際標準化委員会。この規範は、NF EN ISO / CEI 17025、2005〜13及びOIE(国際獣疫事務局)によると、11,12「動物衛生分析法における獣医学PCRの実施、開発と検証のための要件と推奨事項」詳細勧告、2010年14 EHV-2のqRT-PCR検証プロトコルは、3部構成の手順が含まれます。定量RT-PCRアッセイの(a)の開発、(b)は、単独で定量RT-PCRアッセイの特徴付けおよび全体の(c)の特性評価(PCR分析の生体試料からの核酸の抽出から)分析方法。
検出(LOD)の限界と定量限界(LOQ):定量RT-PCRアッセイの全体分析方法の特徴は、二つの限界の定義が含まれています。 LOD 95%PCRは、すべてのCAの95%で検出することができ、単位体積当たりの核酸コピーの最小数を表しますエス。 LOQ 95%PCRを考慮に不確実性を取ることを決定することができる核酸コピーの最小量を表します。
この定量RT-PCR法は、呼吸流体中の正確な検出およびEHV-2の迅速な定量化を可能にします。さらに、この方法は、他の新たな定量RT-PCRアッセイの開発のための標準化された手順とのような一般的なテンプレートを確実にするために、他の研究室に適用することができます。
プロトコル
注: 図1に示されているすべての異なるステップを参照してください。
核酸の1の抽出
注:核酸と気道汚染を制限するために、ヒュームフードの下で抽出を行います。試薬のいずれも不要なDNAで汚染されていないことを確認するために、DEPC処理水で抽出陰性コントロールを含めます。
- 以前に記載されたプロトコル15と、製造業者のプロトコルに従って、生物学的サンプルから核酸を抽出します。
- 溶解液(AVLバッファ)の560μlに生体試料の140μlを添加して、室温で10分間インキュベートします。エタノール560μlを添加します。この溶液(サンプル+溶解ソリューション+エタノール)の最初の630μlをシリカカラムや遠心に適用されます。
- このソリューションの残りの630μlを同じシリカカラムや遠心に適用されます。その後、500μlのカラムを洗浄2つの異なる洗浄緩衝液(AW1およびAW2)の。
- 溶出バッファー(AVE緩衝液)50μlの核酸を溶出し、室温に平衡化。キャップを閉めて1分間室温でインキュベートします。 1分間6000グラムで遠心分離します。
2.増幅手順
- 各反応のための反応混合物の22.5μLを準備します。 PCRマスターミックス、Xμlの20μMフォワードプライマー、Xμlの20μMリバースプライマー、22.5μLを達するために必要とされる超純水μlの10μMプローブおよびzのYμlとの12.5μlを添加し(xは、y、zのボリュームが得られます。滴定した後、セクション3.2.3および3.2.6)を参照してください。
- 小分けし、96ウェルプレートの各反応に適切な反応ミックスの22.5μlの。
注:抽出のためおよびPCRは、試薬のいずれも不要なDNAで汚染されていないことを確実にするためのネガティブコントロールを含めます。 - サンプル2.5μlの、抽出negativの2.5μLを追加e制御、PCR陰性コントロールとよく対応する反応に陽性試料(対照株またはプラスミド)の2.5μlに2.5μlの。配布後、接着プレートシールでプレートをカバーしています。 6000グラムで10秒間プレートを遠心。
- リアルタイムPCRシステムでプレートを置きます。アッセイレイアウトのテンプレートを選択し、実行を開始します。 95℃で15秒間の45サイクル、続いて95℃で10分間、60℃( 表1)で1分:PCRプログラムの設定を使用します。
- スプレッドシートにリアルタイムPCRシステムからの生データを転送します。ベースラインより上の増幅プロットでしきい値を設定し、指数関数的な成長領域内の各サンプルに対する閾値サイクルを得ること。直線性を得るための標準曲線として設定された各ポイントの標準をプロットします。標準曲線に基づいて、異なるサンプルのコピー数を計算します。
定量的RT-PCRの3開発
注:定量RT-PCR試験の開発は、参照株、特定の滴定プラスミド、およびさまざまなコントロールを必要とし、プライマーとプローブの滴定を伴います。
- 予備試験
- 前回の勧告16に従って、特定のソフトウェアで設計プライマーおよびプローブ。
- セクション1で説明したように参照株を抽出します。
- プライマーを最終濃度900 nMのプローブの最終濃度は250 nMのでセクション2で説明したように増幅します。 2.5節で説明したように信号を分析します。
- プローブなし(セクション3.1.3で説明したように)、同時に、参照株DNAの増幅を行います。サンガー法17,18によって得られたアンプリコンをシーケンス。ヌクレオチドBLAST 19を実行することにより、シーケンスを分析します。
- プライマーおよびプローブの滴定
- プローブの250 nMの最終濃度とし、異なる最終concentrで3つの異なるミックスを準備します前方のationsと陽性試料および陰性対照の3複製のためのリバースプライマー(50 nMの/ 50 nMで、300 nMの/ 300 nMで、900 nMの/ 900 nM)を有します。各ミックスについて、(900 nMの最終濃度を得るために、300 nMの最終濃度または4.5μLを得るために、50 nMの最終濃度を得るために、0.25μlの1.5μl)を20μMのフォワードプライマーの同じ適切なボリュームと20μMのリバースプライマーを追加、PCRマスターミックスを50μl、10μMのプローブと超純水2.5μlを90μlのに到達するために必要とされます。
- セクション2で説明したように増幅手順を実行します。
- 増幅、最も早いサイクル閾値(Ct)と3つの条件の間で最良の再現性の最高レベルを取得するための最良の条件を選択します。前方μlの最高の濃度と対応するボリュームxを決定し、リバースプライマー。
- 4試料(陽性試料および陰性対照の3反復)のための5つの異なるミックスを準備しますプローブの5つの異なる最終濃度(50 nMで、100 nMで、150 nMの、200 nMの、250 nM)を持ちます。各ミックスについて、取得するために0.5μlの、(セクション3.2.3で、以前に決定)20μMのフォワードプライマーであり、xμlの20μMのリバースプライマーのμlのPCRマスターミックスを50μl、10μMプローブの適切な量を(Xを追加90μLに到達するために必要に応じて50 nMの濃度が、1μlを250 nMの濃度)と超純水を得るために、150 nMの濃度を得るために、200 nMの濃度を得るために、2μlの2.5μLを1.5μLを100nMの濃度を得ました。
- セクション2で説明したように増幅手順を実行します。
- 増幅、最も早いサイクル閾値(Ct)と5条件との間の最良の再現性の最高レベルを取得するための最良の条件を選択します。 yは、プローブのためμlで最高の濃度と対応するボリュームを決定します。
定量レアの4キャラクタリゼーションリットル時間PCR(定量RT-PCR)
注:使用するのに最適な条件の現像工程と決意した後、PCRの特徴付けステップは、特異性、検出限界、直線性範囲及び定量RT-PCRの定量限界を含んでいます。
- プラスミドの調製および滴定
- PCRのために選択されたDNA標的遺伝子の関連断片含む市販のプラスミド注文(このプロトコールでは、ヌクレオチドEHV-2糖タンパク質B遺伝子の2081から2381までは、 表1を参照します)。
、合成DNAによる気道汚染のリスクを制限するために開発および検証手順のすべてのステップの間に別の部屋にヒュームフードの下でのプラスミドの連続希釈を行い、希釈したDNAと連携:注意してください。 - 再懸濁を50ng / mlのストック溶液を調製し、超純水でプラスミド。簡単にボルテックスし、遠心プラスミド原液。
注:プラスミドSTOの実際の濃度を決定しますプラスミドのコピー数を計算するために再懸濁後のCKソリューション。 - 分光光度計にプラスミドの1μLを加えます。 230 nmで、260 nmおよび280 nmでの光学密度(OD)を読みます。分光光度計のソフトウェア(OD 260 nm)の上のDNA濃度を読み取ります。
- アボガドロ数(N A)および式を用いてプラスミドのコピー数を計算します。
コピー数/μL=(N A [NG /μlのプラスミド])/(塩基対のプラスミド長さ×10 9×平均重量)=(6022×10 23のx [プラスミド])/(プラスミド長さ×10 9× 660)
- PCRのために選択されたDNA標的遺伝子の関連断片含む市販のプラスミド注文(このプロトコールでは、ヌクレオチドEHV-2糖タンパク質B遺伝子の2081から2381までは、 表1を参照します)。
- 定量RT-PCRの特異性(包括性と排他)をテスト
- PCRシステムの包括性をテストします。以前にシーケンシング(正の地位を確立)することを特徴とEHV-2陽性のDNAサンプルを、選択します。
- セクション2で説明したように増幅手順を実行します。
- 分析します2.5節で説明したように各サンプルのPCRデータ。セクション4.2.1で選択した全ての試料について指数曲線の存在を確認し、PCRの包括性を確認。
- 記載されているように、このようなEHV-1、EHV-4、EHV-3、EHV-5と愚かなヘルペスウイルス-5などの他のウマヘルペスウイルス、この場合には(ターゲットへの遺伝的類似性を有する病原体からのDNA抽出物を用いたPCRシステムの排他性をテストします表2)、この場合のホストの呼吸器疾患に関与する他の病原体(内、ウマ動脈炎ウイルス、ウマインフルエンザウイルス、Q熱リケッチア、ロドコッカス・エクイ、ストレプトコッカス・エクイエクイ 、 ストレプトコッカス・エクイズーエピデミカス、クラミジア流産や肺炎桿菌 、 ) 表2を参照してください。
- セクション2で説明したように増幅手順を実行します。
- 2.5節で説明したように各サンプルのPCRデータを分析します。で選択した全ての試料について指数曲線の不在を確認しますPCRの排他性を確認するためのセクション4.2.4。
- 定量RT-PCRの検出限界
- 6チューブに超純水90μLを分注します。
- 削減ゾーン(CT検出の損失)を標的とするために、プラスミドの6 10倍連続希釈を行います。超純水90μlの有する管に移し、プラスミド作業希釈から10μlを。ボルテックスと遠心簡単にチューブ。連続希釈プラスミドを受けたの最後のチューブまでの手順を繰り返し4.3.2。
- セクション2に記載されているように、プラスミドの6 10倍連続希釈物の増幅を行います。
- プラスミドの最終希釈の間ゾーンは検出されず、正の信号と第1の希釈を提示する( 図2を参照):除害ゾーンを決定します。
- 6 2倍連続希釈を開始するには、正の信号を(セクション4.3.4を参照)を与えるプラスミドの最終希釈を選択します。
注:3つの独立したトライを実行します定量RT-PCR(LOD 95%PCR)の検出限界を決定するために、ALS - 6チューブに超純水を25μlを分注します。
- プラスミドの6 2倍連続希釈を行います。転送プラスミド作業希釈から25μlを、超純水25μlのチューブに、セクション4.3.5で決定されるように。ボルテックスと遠心簡単にチューブ。連続希釈プラスミドを受けたの最後のチューブまでの手順を繰り返し4.3.7。
- 節に記載したように2繰り返し6 10倍の各々の8の複製(24反復)で3試験を取得するために、二回4.3.8する4.3.7ステッププラスミド6の二倍連続希釈の増幅を行いますプラスミドの連続希釈液。
注:定量RT-PCR(LOD 95%PCR)の検出限界は、症例の95%で検出される容量部による最小のDNAコピーの数として定義されます。 - プラスミドconcentraの各レベルの24の複製のうち、正の複製の数を計算る。
- LOD 95%PCRを決定します 。 LOD 95%PCRは、24反復のうち23陽性の複製の検出になるレベルです。
- 直線範囲と定量RT-PCRの定量限界
注:範囲で使用される最小の濃度がPCRは 4.3.10で先に決定LOD 95%に相当することを確実にするために、プラスミドの6 10倍連続希釈物と4つの独立した試験を行います。- 6チューブに超純水45μLを分注します。
- 10 7 LOD 95%PCRに対応するプラスミド作業希釈液の濃度が6 10倍連続希釈液を起動します。
- プラスミドの6 10倍連続希釈を行います。超純水45μlのチューブに転送(セクション4.4.2で決定された)プラスミド作業希釈から5μlを。ボルテックスと遠心簡単にチューブ。連続希釈の最後のチューブまで繰り返しステップ4.4.3は、pを受けていますlasmid。
- セクション2で説明したようにプラスミドの6 10倍連続希釈物を増幅します。
- 切片のための傾きaとbのため( 図3)で線形回帰のy =斧+ Bをトレースします。
- 標準曲線の傾きaから増幅効率(E)を計算式を用いて(4.4.5を参照)。
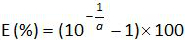 。
。
繰り返しは、4.4.1 4.4.6に三回を繰り返します。
注:増幅効率は、各サイクル後のPCR産物の増加量を表します。理想的な反応は、100%に近い効率に達します。実際には、E(%)は、75%および125%の間でした。高いEは、非特異的産物の増幅または連続希釈でのピペッティングエラーを示すことができます。低いEはまた、連続希釈、貧弱なプライマーの設計または非最適反応条件にピペッティングエラーを示すことができます。 - バイアスを計算する( 表3)。絶対バイアス値が臨界バイアス値(0.25対数10)未満であると、各プラスミドレベルに対してベリファイ。平均バイアスおよび各プラスミドのレベル( 表3)EHV-2 qPCRのための線形回帰の性能を評価する( 図4)のための線形不確実性(U LINI)を決定します 。U のLiNiは、計算された私はレベルをプラスミド毎に決定直線の不確実性があります標準偏差(SD'i)から、バイアスを意味します。式で与えられるEHV-2定量PCRの組み合わせ線形性の不確実性(U LIN)を決定します。

(一般的な絶対的なバイアス0.25ログ10に)バイアスの受入れは、研究室によって指定され、最低値と(ログ10コピー数で測定された量)0.5ログ10の最高値との差に対応しています注意してください。 U LIN の値は、異なる研究室からのqPCRの性能を比較するのに役立つ可能性があります。 - 定量RT-PCR(LOQ PCR)の定量限界を決定しますLOQ PCRは、直線性範囲( 表3)のために使用されるバイアス0.25ログ10と最も低い濃度です。
(DNA抽出からのqRT-PCRの結果に)全体の分析法の5キャラクタリゼーション
注:全体の方法の特徴は、定量RT-PCRデータを得るために必要なすべての手順の検証である( すなわち 、呼吸サンプルからのDNAの抽出から(セクション1を参照)、ターゲットの増幅および定量化する(セクション2を参照してください))。
- PCR反応および式と生物学的サンプル中に存在するコピー番号にコピー番号との対応関係を確立します。
 。
。
ザは、PCR反応においてプラスミドのコピー数であります
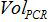 試料の体積は、増幅のためのPCR混合物に添加され、
試料の体積は、増幅のためのPCR混合物に添加され、 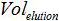 緩衝液AVEの量は、核酸を溶出するために使用され、かつ
緩衝液AVEの量は、核酸を溶出するために使用され、かつ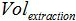 抽出されたサンプルの体積です。
抽出されたサンプルの体積です。 - 全体の分析法の感度と特異性をテストします
注:のみ知られているEHV-2陽性(または負)のサンプルは、このセクションで使用されています。- ターゲット(EHV-2)のための陽性試料を分析することによって定量RT-PCR法の「感度」をテストします。
- EHV-2陽性のDNAサンプルを選択し、以前に(正の状態)を特徴とします。
- セクション2で説明したように増幅手順を実行項1に記載の核酸を抽出します。
- (陽性サンプルの実陽性の数を決定しますこのRT-PCR)と偽陰性の数(知られているこのRT-PCRで陰性で陽性試料)で陽性です。
- 陰性サンプルを分析することによって定量RT-PCR法の「特異性」試験
- EHV-2陰性のDNAサンプル(負の状態)を選択します。
- セクション2で説明したように増幅手順を実行項1に記載の核酸を抽出します。
- 実際の陰性の数(このRT-PCRで陰性であることが知られている負のサンプル)と偽陽性(このRT-PCRで陽性であることが知られている負のサンプル)の数を決定します。
- 本当のSeの本当の陽性=数/(実際の陽性の数+偽陰性)とSP =数を次のように全体の方法( 表4)の「診断感度」(SE)および「診断特異性」(SP)を計算します実際の負のネガ/(数S +偽陽性)() 表4を参照してください。
- グライナー及びガードナー関係12,20の式全方法の感度および特異性の95%信頼区間を計算します。
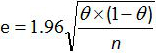
eは推定誤差であり、θは、SE(またはSP)およびN分析試料の数です。
注:サンプル数が少ないため、全体の方法の感度および特異性の95%信頼区間を計算するAFNORノルム12に従ってシュワルツテーブルを使用。
- ターゲット(EHV-2)のための陽性試料を分析することによって定量RT-PCR法の「感度」をテストします。
- 全体の分析法の特性評価のための負のリソース材料の作製
注意:、全体の方法(LOD 方法およびLOQ 法 )の検出および定量化の限界を決定する自由であることが知られている生物学的サンプルにプラスミドの既知の濃度を追加するにはターゲット(EHV-2この場合)の。これらのサンプルは、定量化されたプラスミドと一緒に、LOD 方法およびLOQ 方法を決定するために、正の基準を構成しています。- 正の基準を構築するために使用される生物学的サンプル中の標的(EHV-2)が存在しないことを確認します。
- 異なる既知の負の生物学的サンプルを選択してください。
- セクション2で説明したように増幅手順を実行項1に記載のような生物学的サンプルを抽出します。
- これらのサンプルにおけるPCRシグナルが存在しないことによって、標的が存在しないことを確認します。
注:5.4と5.5の間のすべてのステップのために同じ負の資源材料を使用してください。
- 負の資源材料(完全な検証のために必要な量)の15ミリリットルを得るために、異なる負のサンプルをプール。 100チューブにこの負の資源材料の135μLを分注します。 4℃でチューブを保持するか、長期貯蔵のために-80℃で。
- 正の基準を構築するために使用される生物学的サンプル中の標的(EHV-2)が存在しないことを確認します。
- リミ全体の分析方法の検出のトン
- 方法全体の削減ゾーンを決定します。
- 6チューブに超純水45μLを分注します。
- プラスミドの6 10倍連続希釈を行います。超純水45μlのチューブに(セクション4.3.10で決定されるように)10 7 LOD 95%PCRに対応するプラスミド希釈率から5μlを採取。ボルテックスと遠心簡単にチューブ。連続希釈の最後のチューブまで繰り返しステップ5.4.1.2は、プラスミドを受けています。
- 2を得るために負の資源材料の135μlの2管へのプラスミドの各希釈から5μlを採取し、6正の基準のために複製します。ボルテックスし、短時間遠心。
- セクション1で説明したように6正の標準の2反復の抽出を行うセクション2で説明したように増幅手順を実行します。
- 最後の濃間ゾーン:削減ゾーンを決定します正の信号と無信号を示していない第1の濃度を与えるプラスミドのentration。
- 2独立した試験により決定方法の検出(LOD 法 )の限界
注:全体の方法(LOD 法 )の検出限界を決定するために、2つの独立した試験を行います。- 正のシグナルを与えたプラスミドの最後の濃度、その4倍以上濃縮されてプラスミド作業希釈で6 2倍連続希釈(セクション5.4.1.5を参照)を起動します。
- 6チューブに超純水を25μlを分注します。
- プラスミドの5の二倍連続希釈を行います。超純水25μlのとチューブにプラスミド希釈率(セクション5.4.2.1で決定される)からの振替25μlずつ。ボルテックスと遠心簡単にチューブ。連続希釈の最後のチューブまで繰り返しステップ5.4.2.3は、プラスミドを受けています。
- plasmiの各希釈から5μlを採取負のリソース材料の135μlの4管へdは5正基準の4の複製を取得します。簡単にボルテックスし、チューブを遠心分離機。
- セクション1で説明したように5正標準の4反復の抽出を行うセクション2で説明したように増幅手順を実行します。
- 繰り返しは、プラスミド濃度の各レベルのための8の複製を取得するために、一度5.4.2.5する5.4.2.1を繰り返します。
- プラスミド濃度の各レベルのための8の反復のうち正の複製の数をカウントします。
- LOD 方法を決定します 。 LOD 方法 (セクション5.4.2.7で説明したように)8反復のうち8複製が正である時に最後のレベルです。
- 方法全体の削減ゾーンを決定します。
- 直線範囲と全体の分析法の定量限界
注:全体の方法(LOQ 法 )の定量限界を決定するために、生物学的にプラスミドの既知の濃度を追加ターゲット(EHV-2この場合)の自由であることが知られているサンプル。これらのサンプルは、LOQ 方法を決定するために、正の基準を構成しています。- 6チューブに超純水45μLを分注します。
- プラスミドの6 10倍連続希釈を行います。超純水45μlのチューブに10 7 LOD 法 (セクション5.4.2.8で決定される)に対応するプラスミド希釈率から5μlを採取。ボルテックスと遠心簡単にチューブ。連続希釈プラスミドを受けたの最後のチューブまでの手順を繰り返し5.5.2。
- 6正の基準の2の複製を取得するために、負の生物資源材料の135μlの2のチューブに移し、プラスミドの各希釈から5μlを。ボルテックスし、短時間遠心。
- セクションで説明したように増幅手順を実行し、セクション1で説明したように6正の標準の2反復の抽出を行う2.を繰り返して、5.5.1の手順5.5.4三度まで。
- 法の定量性能を評価し、検証するために、精度のプロファイルを定義します。
- 実験室のための方法全体の許容限度を定義します。このプロトコルでは、合否限界はラベオによって0.75ログ10±として定義されています フランク・ダンカム。
- 1試験のために、標準曲線の各推定値に対応するCt値の1の反復で(aは傾きおよびbは切片である)最初の線形回帰のy =斧+ Bをトレースします。この最初の線形回帰では、この最初の標準曲線のために使用されるCt値の複製のためのコピー数の実験値を計算します。第2の線形回帰を得て、第二標準曲線のために使用されるCt値の第二の複製のためのコピー数の実験値を計算するCt値の第二の反復と繰り返し手順5.5.5.2。
- 第二および第三の試験でステップ5.5.5.2を繰り返します。
- NF U47-600-2 12に従って、各プラスミドレベルの精度、真度及び精度の限界を計算します。
- すべての標準点(5.5.5.4)のための情報をコンパイルし、5.5.5.1で以前に定義された許容可能性の制限に精度プロファイルを作成するには、スプレッドシート、および5.5で計算されたように、下部と上部の精度限界とともに、データの正確さを作成します.5.4( 図5)。
- LOQ 方法を決定します :5.5.5.5で計算された直線範囲のために使用されるように、これは真実0.75ログ10と標準曲線の最低濃度に相当します。
- 再現性と再現性の評価
注:標準偏差および反復測定の平均値(変動係数、またはCV =標準偏差の比を使用することにより再現性と再現性を確認してください/平均)。- 1アナリストによって全体の方法の再現性を評価します:
- (以前例えばPCRにおいて試験)3つの異なるウイルスゲノムの負荷で3生物学的サンプルを選択してください。
- セクション2で説明したように増幅手順を実行し、セクション1で説明したように3つのサンプルの8の複製を抽出します。
- 平均各サンプルのために収集したCt値の標準偏差を計算します。
- 式CV =標準偏差/平均値を用いて、アッセイ内CVを計算します。
- 3アナリストによって全体の方法の再現性を評価します:
- (以前例えばPCRにおいて試験)3つの異なるウイルスゲノムの負荷で3生物学的サンプルを選択してください
- (セクション1で説明したように)5.6.2.1に選ばれた3つのサンプルの2反復を抽出します。 2つの独立したアナリストが5.6.2.2節2.繰り返しステップで説明したように増幅手順を実行します。
- 平均値と標準偏差を計算します各サンプルのために収集Ct値の。
- 式CV =標準偏差/平均値を用いて、アッセイ間CVを計算します。
- 1アナリストによって全体の方法の再現性を評価します:
結果
定量的RT-PCR法は、上述したように、呼吸流体中ウマヘルペスウイルス2を検出し、定量化するために実施された。 図1は、AFNOR標準NFに従 って定量的RT-PCR法の開発および検証するための模式的なワークフロー図を示しますU47-600。プライマーおよびプローブの特異性は、PCRのステップバイステップの開発中に検証されました。唯一のEHV-2株は、このシステムで増幅しました。続いて、定量RT-PCRの性能を特徴づけなければなりませんでした。
まず、6 10倍連続希釈を削減ゾーン( 図2)を確立するために実施したLOD PCRを推定します。この例では、6 10倍連続希釈物をLOD PCRを推定する(26,000及び0.26コピー/ 2.5μlのサンプルとの間の)10 -5と10 -10との間で行われました。除害ゾーンリットル(2.6および0.26コピー/ 2.5μlのサンプル間)10 -9〜10 -10の希釈液との間に居住。この場合のLOD PCR値を決定するために、プラスミドの6 2倍連続希釈を、この削減ゾーンで5.2および0.16コピー/ 2.5μlのサンプルの間で行われました。 LOD PCR値は2.6コピー/ 2.5μlのサンプルでした。
直線性の範囲とLOQ PCRを決定するために、LOD PCR値は2.6(LOD PCR)26万コピー/ 2.5μlのサンプルとの間の6 10倍連続希釈物の範囲を、開始するために使用された。 図3は EHV2のための線形回帰を示しています1試験の定量RT-PCR。線形回帰( 図4)の性能は、 表3に記載された計算を用いて、四重に検証されている。計算は、基準に従って直線範囲を定義するために実行される絶対的なバイアスIをヴァルUE≤0.25ログ10、プラスミド負荷のどのようなレベルの私 。この場合、直線性の範囲は、2.6 26万コピー/ 2.5μlの試料の間に横たわっていました。 LOQ PCRは、直線性範囲( すなわち 、2.6コピー/この場合、2.5μlのサンプル)中の最低濃度です。 U LINの範囲で2.6-260,000コピー/ DNA2.5μlの0.12ログ10であると決定しました。
定量RT-PCR( 図1、黄色)の開発( 図1、青)および特徴付けの後、AFNOR NF U47-600ノルムは、定量RT-PCR( 図1、オレンジ)のDNA抽出からの全分析法の特徴付けをお勧めします。 表4に記載されるように、診断の感度および特異性を計算した。定量RT-PCR全分析法の定量的な性能は、精度プロファイル(で評価し、検証されました図5)。
最先端の分子技術を使用しています。このプロトコルは、私たちが呼吸器疾患および/または感染の臨床的疑いで馬から得られた172鼻スワブ試料でEHV-2ウイルスゲノムの負荷を検出し、定量化することができました。フィールドからEHV-2の発生率(生物学)のサンプルは、この集団では(172分の86)は、50%でした。定量分析は、EHV-2のウイルスゲノムの負荷は若い馬で有意に高かったとウイルスゲノムの負荷の配分は、年齢( 図6)とともに減少することを示しました。本研究では、最高のEHV-2ウイルスゲノムの負荷は(1.9×10 11コピー/ mlの)仔馬( 図6)で検出されました。
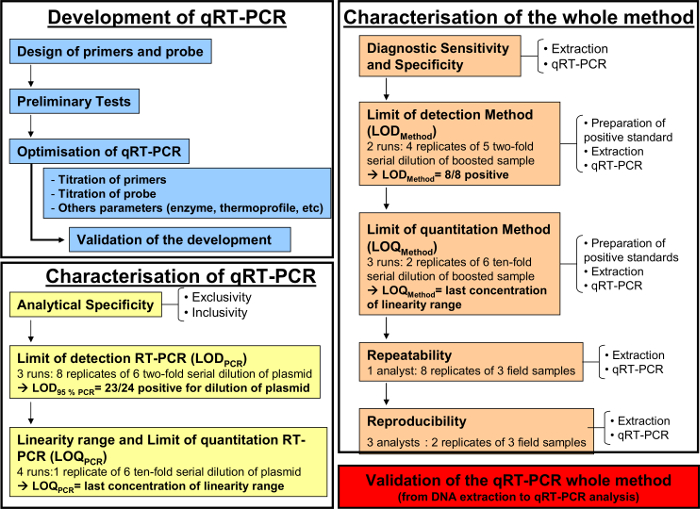
図1:開発のためのワークフローのチャート(青)、定量的RT-PCRのキャラクタリゼーション(黄色)とAFNORノルムNF U47-600-2に従ってDNA抽出からのqRT-PCR(オレンジ)の全分析法の特性評価。ワークフローのチャートは、定量的RTの特性評価、開発のための異なるステップを再開-PCRおよび定量RT-PCRにDNA抽出からの全分析法の特性評価。各ステップでは、ワークフローのチャートは、必要な実行、実行される希釈液と必要なアナリストの数の数を示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
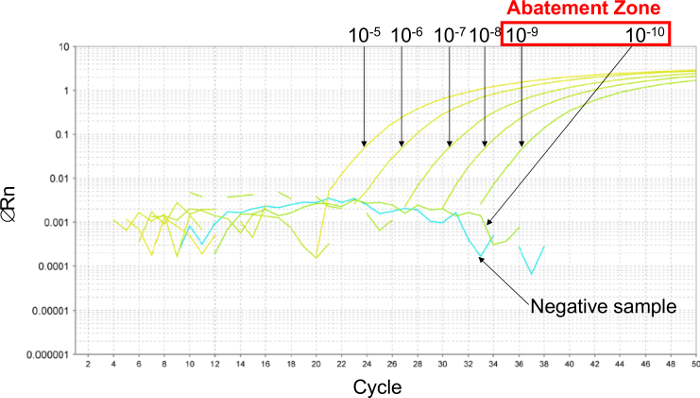
図2:プラスミドの6 10倍連続希釈液を用いて得られたリアルタイムPCR曲線の代表的な結果を軽減ゾーンの決意 。除害ゾーンを推定するために、6 10倍連続希釈は、10 -5(26,000コピー/ 2.5μlのサンプル)と10 -10(0.26コピー/ 2.5μlのサンプル)との間で行われています。除害ゾーンは10 -9(2.6コピー/ 2.5μlのサンプル)の希釈液と10 -10(0.26コピー/ 2.5μlのサンプル)の間にあります。この場合、プラスミドの6 2倍連続希釈液を5.2と0.16コピー/ 2.5μlのサンプルとの間で、LOD 95%PCRを決定するために、この削減ゾーンで行われました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
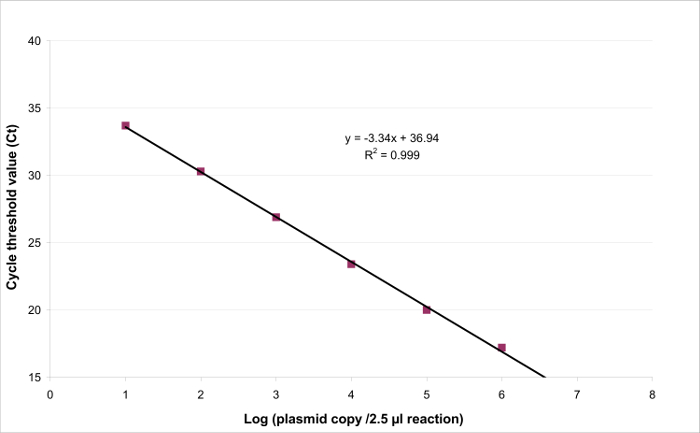
図3:EHV2定量RT-PCRのための線形回帰定量試験の直線性は、特定の範囲内に存在する標的の濃度に比例する結果を生成する能力です。これによってモデル化することができます。線形回帰(Y = AX + b)の楽器応答(サイクル閾値またはCT)とターゲットの量の対数(ターゲットコピー/ 2.5μlのサンプルの数)の間。 この図の拡大版をご覧になるにはこちらをクリックしてください。 。
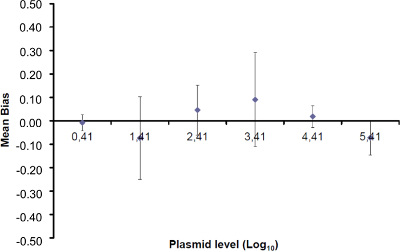
図4:EHV-2定量PCRの線形回帰のパフォーマンス平均バイアスは、(測定されたプラスミドの量との間の平均差を表します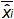 )および各プラスミドのレベルの理論的なプラスミド量(X 'I)。縦棒は、式によって与えられた直線の不確実性(U LINI)を表します
)および各プラスミドのレベルの理論的なプラスミド量(X 'I)。縦棒は、式によって与えられた直線の不確実性(U LINI)を表します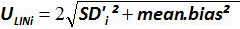
SD'iは、標準偏差、Oであり F測定されたプラスミドの量。 この図の拡大版をご覧になるにはこちらをクリックしてください。
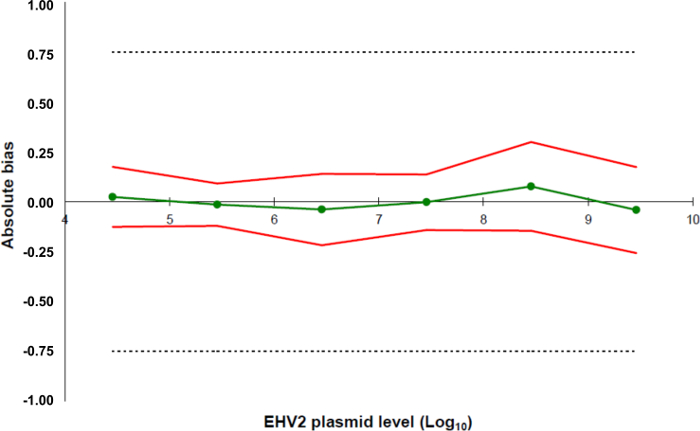
図5:EHV-2定量RT-PCR法の検証結果に基づいて、精度プロファイル緑線(丸)(系統誤差、又はバイアス)のデータの正確さを表しています。受容性の限界は、実験室(破線)で±0.75ログ10で定義されています。下限と上限の精度限界は信頼性データの標準偏差の2倍(赤線)の平均±バイアスから各プラスミドの負荷レベルについて決定した。 この図の拡大版をご覧になるにはこちらをクリックしてください。
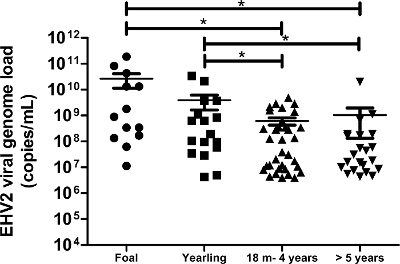
図6:年齢に応じEHV-2のウイルスゲノムの負荷の定量化は、鼻腔スワブ試料で検出されたEHV-2のウイルスゲノムの負荷分布が異なる年齢層のために表されています。水平線は、標準偏差(M =ヶ月)内の中央値を表します。 *ニューマン-クールズ事後検定(p <0.05)とのANOVAによって有意に異なる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| 標的遺伝子 | プライマー、プローブおよびplasmide配列(5'-3 ') | ヌクレオチド位置 | 製品サイズ(ヌクレオチド) | サーマルサイクリング条件 | リファレンス | |||
| EHV2のgB (HQ247755.1) | フォワード:GTGGCCAGCGGGGTGTTC | 2113-2130 | 78 | 95℃で5分間 | 11 | |||
| リバース:CCCCCAAAGGGATTYTTGAAを | 2189-2170 | 95°C 15秒 | 45サイクル | |||||
| プローブ:FAM-CCCTCTTTGGGAGCATAGTCTCGGGG-MGB | 2132-2157 | 60℃で1分 | ||||||
| プラスミド: ACCTGGGCACCATAGGCAAGGTGGTGGTCA ATGTGGCCAGCGGGGTGTTCTCCCTCTTTG GGAGCATAGTCTCGGGGGTGATAAGCTTTTT CAAAAATCCCTTTGGGGGCATGCTGCTCATA GTCCTCATCATAGCCGGGGTAGTGGTGGTG TACCTGTTTATGACCAGGTCCAGGAGCATAT ACTCTGCCCCCATTAGAATGCTCTACCCCGG GGTGGAGAGGGCGGCCCAGGAGCCGGGCG CGCACCCGGTGTCAGAAGACCAAATCAGGA ACATCCTGATGGGAATGCACCAATTTCAG | 2081-2381 | |||||||
表1:プライマー、プローブおよびこのプロトコルで使用される正の合成DNAコントロールの配列プラスミド(正の合成DNA)の配列は、EHV2gBシーケンス(HQ247755.1)の位置2081から2381のヌクレオチドに相当します。このプロトコルで使用されるプライマーおよびプローブの設計は、特定のソフトウェアを用いて得ました。
| 病原体 | リファレンス(原点) | 菌株数 | 結果 |
| EHV-2 | |||
| EHV-2 | VR701(ATCC) | 20 | ポジティブ |
| 20サンプル(FDLコレクション) | |||
| EHV-5 | KD05(GERC) | 20 | 負 |
| 20サンプル(FDLコレクション) | |||
| EHV-3 | VR352(ATCC) | 2 | 負 |
| T934 WSV(GERC) | |||
| EHV-1 | ケンタッキー株ケンタッキーA(ATCC) | 3 | 負 |
| 2サンプル(FDLコレクション) | |||
| EHV-4 | VR2230(ATCC) | 1 | 負 |
| 愚かなヘルペスウイルスAHV5 | FDLコレクション | 1 | 負 |
| 馬のインフルエンザウイルス | A /ウマ/ Jouars / 4/2006(H3N8) | 1 | 負 |
| (アクセッション番号JX091752) | |||
| ウマ動脈炎ウイルス | VR796(ATCC) | 2 | 負 |
| ロドコッカス・エクイ | FDLコレクション | 1 | 負 |
| ストレプトコッカス・エクイ亜種。ズーエピデミカス | FDLコレクション | 1 | 負 |
| ストレプトコッカス・エクイ亜種。エクイ | FDLコレクション | 1 | 負 |
| Q熱リケッチア | ADI-142から100(Adiagene) | 1 | 負 |
| クラミジア流産 | ADI-211から50(Adiagene) | 1 | 負 |
| クレブシエラPNEUmoniae | FDLコレクション | 1 | 負 |
表2:EHV-2のためのqRT-PCRの分析特異性。
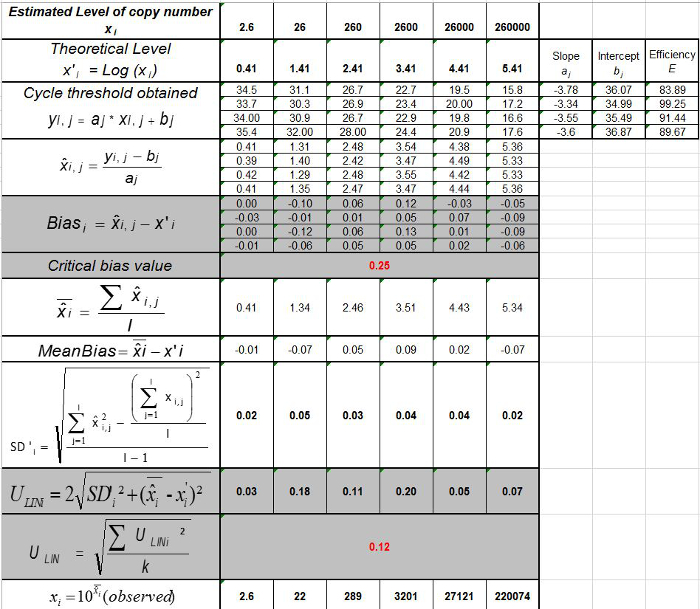
表3:(NF U47-600-2 12 から適応 ) バイアスと直線性不確かさの計算 。各試験について、線形回帰(Y = AX + B)の性能は、yが得られるサイクル閾値であるテーブルを使用して検証され、傾斜が得られる; xは 、プラスミドレベルで、bは切片である私はプラスミドです。レベル(iは 1からk個のレベルに変化する); kは 、プラスミドのレベルの数が使用されている(トンで例えば 、K = 6彼のテーブル); jは (jは I試験1〜異なります)試用版では、 私は、この表の例:I = 4)(3と6の試験の間に含まれる、試行回数をx iは 、それぞれの推定プラスミド量です。 私はレベルをプラスミド。X I = iがレベルをプラスミドそれぞれについて、(X I)10を記録し 「 私は、xの式で得られた理論的なプラスミドの量です」。各Jトライアル期間中、サイクル閾値は、各iについて得られ プラスミドレベルは、線形回帰を用いて計算されます Y I、J = j個の X I、J + B jを 。 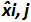 トライアルjの間に測定されたプラスミドの量である。 バイアスI サブ>測定されたプラスミドの量及び各試験のための理論的なプラスミドの量および各プラスミドのレベルの間で観察された差です。
トライアルjの間に測定されたプラスミドの量である。 バイアスI サブ>測定されたプラスミドの量及び各試験のための理論的なプラスミドの量および各プラスミドのレベルの間で観察された差です。 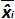 の平均値であります
の平均値であります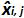 各によって私はレベルをプラスミド; SDは「 私は、測定量の標準偏差であります
各によって私はレベルをプラスミド; SDは「 私は、測定量の標準偏差であります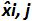 各iについて プラスミドレベル、 平均バイアスは、 バイアス、iの平均である; U LINIは 私が SD'iから計算レベルをプラスミドとバイアスを意味する毎に決定リニアリティの不確かさである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
各iについて プラスミドレベル、 平均バイアスは、 バイアス、iの平均である; U LINIは 私が SD'iから計算レベルをプラスミドとバイアスを意味する毎に決定リニアリティの不確かさである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
表4:診断感度(SE)の計算 と 全体の方法の 特異性(SP)シュワルツテーブルはconfidを計算するために使用しました。全体の方法の感度および特異度95%でレンス間隔NF U47-600-2に記載の方法。
ディスカッション
2000年代以来、リアルタイムPCRは、研究室の数の増加に金の標準的な技術(細胞培養および細菌培養法)に代わるされています。技術の実装は比較的容易です。しかし、実験室方法の検証は、正確で再現性と信頼性の高いデータを確実にするために、病原体の分子検出および定量化のために不可欠です。
抽出工程は、生物学的材料の損失の主要な源であるので、あるプロトコルから別の定量化の誤差の主な原因と考えられてもよいです。このように、主に文献に報告された定量RT-PCR中のDNAプラスミドの標準曲線の作成は、ウイルスゲノムの負荷を示しているが、抽出工程を考慮していません。
AFNORノルムNF U47-600-2全体メソッドの検証プロセスのためのデノボ戦略の説明は、この分野における重要な進歩を表しています。に示すようにEHV-2ウマのため、この論文では、または蜂21で他の人が、これは現像工程および方法全体のPCRの特性評価および特性評価と検証ステップの間に明確な区別が必要となります。この興味深いアプローチで1つの制限は、プロトコルの変化は非常にコストがかかる可能性があり、完全なプロセスを再検証する義務をもたらすことがあります。この制限はまた、定量化の範囲は、ウイルス( 例えば、呼吸器流体、器官、血液又は尿)が抽出されたソースに依存するという事実によって強調されました。実際には、各マトリックスは、それらの物理化学的特性が異なる特異性を提示し、独立して定量RT-PCRによるウイルスの検出および定量のために使用される各異なる行列を定義することが重要です。従って、各生物学的試料のウイルスゲノムの負荷が抽出からより正確に定量することができます。特徴付けはまた、サーマルサイクラーのmodを考慮に入れますエルと以前よく特徴付けられた方法( 例えば、本論文で述べたEHV-2定量PCR法)の使用は、親の実験室や他の研究室でのマシンの新しいタイプを必要とするとき、人はその楽器の性能を確認する必要があります。定量PCRアッセイの性能の確認はすべてのテストが実験室に持ち込むための前提条件です。これは通常、既知の特性を有する参照試料を分析することによって達成されます。このようなチェックが前提条件と定量PCR(LOD、LOQ効率)の性能と全体の方法(LOD、LOQ)の堅牢性を検証するために、NF 47-600-1 AFNORノルムによって要求されるように必須と考えられています。開発と特徴付けステップの間だけでなく、研究または診断目的のために使用される場合、リスク要因は、プロトコルの標準化を確実にするために、同定され、十分に制御することができます。特に懸念されるのに十分なスタッフのトレーニング、優秀な人材、消耗品の品質管理です使用されており、そのストレージ、即時の環境条件およびアッセイに関わる科学機器の性能に影響を与える可能性が計量条件の意識のコントロール。試験所間比較のための参照サンプルの使用は、不確実性を制御するのに役立つ可能性があります。このようにして、研究室間でのデータの比較を容易にすることができます。実際、研究室間の実力テストが評価し、方法の再現性を確認するために必須です。
分析生体マトリックスの国際単位(IU)で表されているウイルスゲノムの負荷の結果は、(IUは:流体またはコピーのコピー/ ml組織について/ g)は、異なる研究室間の結果を比較するために使用するのが容易です。 LOQ上記の全ての結果は、非定量化陽性の結果としたコピー/ mlとLODとLOQの間の結果として発現されます。このように、ゲノムの量化データを提示することはプロセスへとより正確に準拠します分析(ゲノムの増幅)のS。実際には、細胞培養実験において、TCID 50によるウイルス量の式(50%組織培養感染用量) 細胞やウイルス株の性質に依存します。各菌株のラインは、その独特の感染動態を有し、最初の細胞変性効果が明らかである前に、EHV-2のようないくつかのウイルスは数日かかることがあります。
結論として、定量RT-PCRの特性のこの新しい方法は、研究所間のデータの提示および解釈の調和を促進すべきです。これは、疾患の状態の宣言の代わりに、単に病原体の有無についてのカットオフ値の確立など、将来の定量RT-PCRの潜在的な新しいアプリケーションのために非常に有用であろう。
開示事項
著者は、彼らが競合する金融利害関係を持たないことを宣言します。
謝辞
The authors would like to thank Sophie Castagnet and Nadia Doubli-Bounoua for their technical support. This work received financial support from the General Council of Calvados and the agreement of Region Basse-Normandie and French Government (CPER 2007-2013; project R25 p3). The authors would like to thank the experts of the AFNOR group and particularly Jean-Philippe Buffereau and Eric Dubois.
資料
| Name | Company | Catalog Number | Comments |
| AB-1900 natural color ABgene 96 well plate | Dutsher | 16924 | |
| Adhesive film qPCR Absolute | Dutsher | 16629 | Adhesive film used for sealing the plate prior to the qRT-PCR run |
| 0.5 ml microtubes, skirted, caps | Dutsher | 039258 | |
| Ethanol 98% | Sodipro | SAF322941000 | |
| Primers | Eurofins | Custom order | |
| Probe | Life Technologies | Custom order | |
| Plasmid | Eurofins | Custom order | |
| QIAamp RNA viral Mini Kit (containing: QIAamp Mini column, AVL buffer, AW1 buffer, AW2 buffer, AVE buffer, collection tubes) | Qiagen | 52906 | AVL buffer: pre-warm 5 min at 72 °C |
| Sequencing by Sanger method | Eurofins | Custom order | |
| Taqman Universal PCR Master Mix | Life Technologies | 4364340 | |
| Tris-EDTA buffer solution | Santa Cruz | sc-296653A | |
| NanoDrop 2000c Spectrophotometer | Thermoscientific | ND-2000C | |
| StepOnePlus Real-Time PCR systems | Life Technologies | 4376600 | pre-warm 15 min |
参考文献
- Brault, S. A., et al. The immune response of foals to natural infection with equid herpesvirus-2 and its association with febrile illness. Vet.Immunol.Immunopathol. 137 (1-2), 136-141 (2010).
- Fortier, G., Van Erck, E., Pronost, S., Lekeux, P., Thiry, E. Equine gammaherpesviruses: pathogenesis, epidemiology and diagnosis. Vet.J. 186 (2), 148-156 (2010).
- Hue, E. S., et al. Detection and quantitation of equid gammaherpesviruses (EHV-2, EHV-5) in nasal swabs using an accredited standardised quantitative PCR method. J Virol.Methods. 198 (1), 18-25 (2014).
- Diallo, I. S., et al. Multiplex real-time PCR for the detection and differentiation of equid herpesvirus 1 (EHV-1) and equid herpesvirus 4 (EHV-4). Vet.Microbiol. 4 (1-3), 93-103 (2007).
- Williams, K. J., et al. Equine multinodular pulmonary fibrosis: a newly recognized herpesvirus-associated fibrotic lung disease. Vet.Pathol. 44 (6), 849-862 (2007).
- Mullis, K., et al. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Cold Spring Harb.Symp.Quant.Biol. 51 (1), 263-273 (1986).
- EPA Office of Water (4607). EPA-815-B-04-001. Quality Assurance/Quality Control Guidance for Laboratories Performing PCR Analyses on Environmental Samples. , (2004).
- Telford, E. A., et al. Equine herpesviruses 2 and 5 are gamma-herpesviruses. Virology. 195 (2), 492-499 (1993).
- Fortier, G., et al. Identification of equid herpesvirus-5 in respiratory liquids: A retrospective study of 785 samples taken in 2006-2007. Vet.J. 182 (2), 346-348 (2009).
- Brault, S. A., Bird, B. H., Balasuriya, U. B., MacLachlan, N. J. Genetic heterogeneity and variation in viral load during equid herpesvirus-2 infection of foals. Vet.Microbiol. 147 (3-4), 253-261 (2011).
- Association Francaise de Normalisation. NFU 47-600-1. Animal health analysis methods-PCR-Part 1: Requirements and recommandations for the implementation of veterinary PCR. , (2015).
- Association Francaise de Normalisation. NFU 47-600-2. Animal health analysis methods-PCR-Part 2: Requirements and recommendations for the development and the validation of veterinary PCR. , (2015).
- ISO. EN ISO-CEI 17025. General requirements for the competence of testing and calibration laboratories. , (2005).
- Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2010. Chapter1.1.1.4/ 5. Principles and Methods of Validation of Diagnostic Assay for Infectious Diseases. , This thoroughly revised chapter replaces Chapter 1.1.4 Principles of validation of diagnostic assays for infectious diseases and Chapter 1.1.5 Validation and quality control of polymerase chain reaction methods used for the diagnosis of infectious diseases from the sixth edition of the OIE Terrestrial Manual (2009).
- Apaza, S., et al. Detection and genogrouping of noroviruses from children's stools by Taqman One-step RT-PCR. J Vis.Exp. (65), e3232(2012).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis.Exp. (63), e3998(2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol.Biol. 94 (3), 441-448 (1975).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proc.Natl.Acad.Sci.U.S.A. 74 (12), 5463-5467 (1977).
- NCBI. BLAST Homepage and Selected Search Pages. Introducing the BLAST homepage and form elements/functions of selected search pages. , (2015).
- Greiner, M., Gardner, I. A. Application of diagnostic tests in veterinary epidemiologic studies. Prev.Vet Med. 45 (1-2), 43-59 (2000).
- Blanchard, P., Regnault, J., Schurr, F., Dubois, E., Ribiere, M. Intra-laboratory validation of chronic bee paralysis virus quantitation using an accredited standardised real-time quantitative RT-PCR method. J Virol.Methods. 180 (1-2), 26-31 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved