需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
导管手术放置了长期的心血管运动试验猪
摘要
Here we present a protocol to assess cardiopulmonary function in awake swine, at rest and during graded treadmill exercise. Chronic instrumentation allows for repeated hemodynamic measurements uninfluenced by cardiodepressive anesthetic agents.
摘要
这个协议描述了外科手术,长期仪器猪和行使的电动跑步机猪的过程。早期心肺功能障碍是难以诊断,尤其是在动物模型中,如心肺功能通常侵入测量,需要麻醉。由于许多麻醉剂是cardiodepressive,心血管功能的细微变化可以被屏蔽。与此相反,慢性仪器允许在清醒状态心肺功能的测量,以便测量可以安静休息条件下获得,无需麻醉和急性手术创伤的影响。此外,当动物被适当训练,也可以分级平板运动期间获得的测量结果。
流探头放在围绕主动脉或肺动脉为心输出量的测量和周围的左冠状动脉前降支为科伦的测量进制血流量。充满液体的导管被植入在主动脉,肺动脉,左心房,左心室和右心室的压力测量和血液取样。此外,一个20G的导管被定位在前室间静脉以允许冠状静脉采血。
恢复一周后,猪被放置在由马达驱动的跑步机,该导管被连接到压力和流量计,和猪经受五阶段逐步行使协议,每个阶段持续3分钟。血液动力学信号被连续记录和血样每次锻炼阶段的最后30秒期间拍摄。
研究慢性仪器动物的主要优点是,它允许心肺功能的串行评估,不仅在休息而且物理应力如锻炼期间。此外,心肺功能,可反复在疾病发展的评估第二慢性治疗期间,从而提高了统计功率,从而限制了一个研究所需的动物数量。
引言
足够心肺功能是必不可少的氧气和营养供给人体,尤其是在诸如运动1在代谢需求增加的条件。锻炼心肺响应的特征在于由若干在心脏功能 ,即适应的,在心脏速率,收缩力和行程体积,和微血管功能 ,即,血管舒张的血管床供给锻炼肌肉增加以及在肺脉管,和血管收缩在供给胃肠系统的血管床以及非活性肌肉1。受损的运动能力是心肺功能不全的早期标志,心肺运动试验作为一种有效的方法心功能不全,血管功能不全和/或肺功能不全的患者受损的运动能力2之间划定。早期心肺功能不全是difficult诊断,尤其是在动物模型中,如心肺功能通常侵入测量,需要麻醉,与许多麻醉剂具有cardiodepressive属性3。
慢性仪器允许在清醒状态心肺功能的测量,并且当动物充分调整到实验室条件测量可以安静休息的条件下没有麻醉和急性手术创伤的影响而获得。此外,当将动物适当训练的,也可以分级平板运动4,5-期间获得的测量结果。更具体地,左,右心室功能可以评估和与心肌灌注,而在冠状动脉,全身和肺部微循环血管舒缩音的调节可被确定。使用充满液体的导管允许的压力测量以及采血样不强加广告在动物ditional压力。研究慢性仪器动物的另一个优点是,心肺运动测试可以重复允许使用的动物作为其自身的控制,无论是在疾病的发展或慢性治疗期间,从而提高了统计功率,从而限制了一个研究所需的动物数量。
猪的心肺解剖学非常类似于人类的和有可能诱导各种形式的心肺疾病,如糖 尿病6,心肌梗塞7,肺动脉高血压8,9和起搏诱导心脏衰竭10,11。此外,猪的尺寸允许慢性仪表,以及足够量的重复血液采样分析不仅血液气体,而且以执行神经体液测量和/或要搜索的疾病的生物标志物。
本协议描述用于慢性手术LY仪器猪以及行使上的马达驱动的跑步机的猪的协议。
研究方案
涉及动物主题手续已经批准的动物护理委员会在Erasmus医学中心鹿特丹(荷兰)。猪6和80 kg的重量都使用该协议被成功检测。
1.动物人工处理的适应
- 在设施到任后,房子的孤独的动物,但使他们能够互相交流。
- Accustomize猪到人的处理和运输从动物设施的实验实验室,通过处理动物每天至少一次为一个星期。
- 通过行使他们在跑步机上进行手术前至少三次适当训练动物锻炼实验上的马达驱动的跑步机。
- 动物应禁食O / N在手术前,防止恶心,呕吐和胃流体从而潜在愿望。
2.准备手术
- 镇静
- 在10毫升注射器镇静制备药物。术前由替来他明/唑拉西泮(5毫克/千克),甲苯噻嗪(2.25毫克/千克)和阿托品(1毫克)。
- 在注射斜方肌药物肌肉注射用19克1.5''针稳重猪。
- 等待约10分钟,并检查肌肉松弛,意识,以确认镇静适当,稳定的水平。
- 将一个20G的周边安全导管在耳静脉麻醉和/或液体的后续静脉给药。
- 插管和通气
- 将在仰卧位表和/或小车的动物。
- 与口服吊具打开动物的口。
- 在颌骨或吞咽反射,阻碍插管的存在放松不足的情况下,管理硫喷妥钠(10毫克/千克)经静脉注射耳静脉导管。可替代地,猪可以掩蔽异氟醚诱导的镇静作用。
- 使用配有光源和一个米勒叶片的常规喉镜允许laryngoscopist直接查看喉。如果有喉痉挛,应用2%利多卡因将电源线和喉,减少痉挛,并允许插管。
- 插入插管探针插入气管内管,使管更好地符合了上气道的解剖学和通过嘴和声带进气管之间穿过该管。
- 膨胀用10毫升注射器,以帮助将其固定就位,以防止呼吸气体的泄漏,并保护气道从胃流体的可能的吸气球箍。
- 该管连接至呼吸过滤器(热量与湿度交换器),并在机械呼吸机。
- 放置在其右侧的动物上的手术台。
- 实现100-120毫米汞柱的氧分压的水平,与氧和氮(1:2 V / V)的混合物中通风动物,全光照克以下的呼吸机参数设置:压力控制方式:呼气末正压(PEEP)4 水柱 ;吸气峰压16 - 18 水柱 ;呼吸根据动物的大小的频率(对于20 kg动物,降低频率与体重增加)本应导致的约10毫升/ kg的潮气量,监视与二氧化碳图通风。
- 使用直肠温度计监测温度并保持37之间的温度 - 使用热灯或加热垫39ºC。此外,监测心脏率心电图。
- 麻醉
- 诱导和由通过耳静脉导管芬太尼(10微克/千克/小时)的静脉内给药加入异氟烷(体积/体积)的通风气体混合物或备选地为2.0%,优选维持麻醉。
- 通过开始手术前用后腿脚趾捏痛的测试检查反射麻醉深度足够。必要时,加额外的麻醉或等待几分钟。定期检查疼痛反射整个手术。
- 流体和抗生素
- 辖的阿莫西林(25毫克/千克)首次剂量通过耳静脉导管静脉内。
- 输液系统连接到耳静脉导管手术期间启用的葡萄糖的10%(500毫升)缓慢输注。
- 手术部位消毒
- 剃并清洁动物的皮肤上,从脊柱一路向左腋下大约25厘米宽的区域。
- 擦洗约5分钟碘伏擦洗(75毫克/毫升)的滋润肌肤。
- 灭菌用碘伏洗剂(100毫克/毫升)的皮肤之前,从用湿无菌纱布皮肤除去碘伏皂。
- 覆盖用无菌手术单的动物,以减少外科手术部位的细菌转移和随后的污染。
3.手术
- 打开胸部(开胸)
- 使在皮肤上的切口,开始1厘米尾椎肩胛骨下到左腋下的左下角(图1)。使用电凝烧灼血管中的皮肤,以防止失血过多。
- 通过前锯肌和胸大肌肌切断,用透热的切割方式。还可以使用透热烧灼血管中的肌肉层,以防止过多出血。
- 使用钝性分离仔细划分左四肋间的肋间肌用蚊式钳。现在布满了脏层和壁层胸膜左肺的肋软骨表面予以曝光。
- 要进入胸膜腔,小心刺破胸膜两层和撕裂他们打开。
- 使用胸椎牵开到伤口的边缘和肋分开,并有力地推动组织开,以获得胸膜腔的良好的曝光。
- 推开左肺在尾方向和用湿纱布保持它在适当位置。现在,心脏及大血管应清楚地暴露出来。
- 导管和流量探测器放置(图1)
- 使用钝性分离,除去〜胸降主动脉周围的结缔组织2 平方厘米。
- 执行荷包缝合,包括三个线圈,在主动脉壁与不可吸收USP3-0编织丝缝合(ó0.2毫米)。
- 穿透主动脉血管壁与在荷包缝合的中间的不锈钢为16G针头。
- 插入充满液体的导管的尖端(直到环)进入主动脉,拉荷包缝合牢固地结合在一起,领带缝线的两个字符串。
- 为了保持到位导管,风缝合导管周围3倍以上的环,再牛逼即缝合线的两个字符串。用一个新的线圈从插入位置颅大约1cm进一步固定导管。
- 流体填充导管连接到校准的压力传感器,其连接到计算机,以监测手术期间的平均动脉压。获取动脉血气来验证或调整正确的通风设置。
- 连同划线切开心包。请注意,以保持运行在完整心包膈神经。
- 确定肺动脉并与Farabeuf拉钩尾方向稍微拉出。现在升主动脉和主动脉弓予以曝光。监测平均动脉压而缩回肺动脉。
- 使在升主动脉,并使用梅岑鲍姆剪刀肺动脉之间的结缔组织一个小切口(约1厘米),以便能够剖析任升主动脉或肺动脉具有大弯曲蚊式钳放置流量探头。
- 放置在容器周围的气流探测器的橡胶带。为了更方便,将缝合线穿过橡胶带的一端,将容器周围此缝合和直到橡胶带围绕所述容器拉出。
- 固定在橡胶带流量探针测量装置。流量探头连接到计算机,并检查计算机上的心输出信号,以确认流量探头的正确位置。
- 作为主动脉流体填充导管( - 3.2.5 3.2.2)中描述放置在肺动脉流体填充导管,右心室,左心室和左心房的相同的方式。需要注意的是,没有必要在这些结构执行荷包缝合之前去除结缔组织。
- 暴露和解剖左前通过第一吊装用钳子的组织,使小的下行冠状动脉的近端部分(2 - 3毫米),切断与梅岑鲍姆剪刀中,接着用棉签仔细取笑所述组织从动脉远离。通过传递一个小角度的直蚊式钳下方确保冠状动脉完全剥离。
- 使平行于用缝合,其连接到冠状静脉导管前室间冠状静脉针迹。
- 穿刺与冠状静脉导管的20G的针头冠状静脉和静脉内插入导管的插管。
- 取出针并与已经执行的针迹(3.2.14)固定导管。另外一个新的针从最初的穿刺处固定导管约1厘米。
- 放置冠脉流量探头周围的解剖以前左冠状动脉前降支。当动脉被压缩并且是几乎不可见的,使用利多卡因10%喷雾放松容器以获得更好的曝光容器。检查冠脉流量的信号在电脑上的confIRM流量探针的正确位置( 图2)。
- 隧道
- 隧道流探针单独通过肌肉下方的左第三肋间隙并通过使用大量的弯曲蚊夹紧肋的上方。
- 隧道通过第三或通过刺穿肋间肌第五左侧肋间流体填充导管。钳关闭流体填充导管并取出活塞三通最小化刺穿区域,并防止在隧道中的流体填充导管的泄漏。
- 通过在肋间肌荷包缝合的装置固定流探针和流体填充导管与非吸收性USP2-0编织丝(Ø0.3毫米)。这种缝合线还用于防止重新instating胸腔内负压后漏气。
- 使在皮肤三切口约两厘米见方险恶并平行于脊柱,大约3厘米长3厘米除了对方。
- 刺穿从延髓切口部位左背阔肌到背面的切口下方的套管针。隧道流探头和流体导管此套管针内的背面。
- 放置在充满液体的导管的旋塞并取下夹具。撤血与1000国际单位/毫升肝素除去凝块和气泡和填充流体填充导管。冠状静脉导管应充满5000 IU / ml肝素。
- 关闭胸部
- 使一个切口的长度大约为1.5厘米,8厘米尾鳍和平行于第一切口。
- 从铅至第六肋间肌肉胸膜腔漏皮下用一个大弯蚊式钳此切口。漏极连接到抽吸装置以除去任何剩余的流体和恢复胸廓的闭合期间在胸膜腔内负压。
- 缓解和膨胀肺与吸气末持有。确保通过目视监测肺的适当填充。
- 通过拉动第四肋间的肋一起在两个分开的部位与不可吸收USP6编织聚酯(ø0.8毫米)关闭胸腔。
- 关闭锯肌和胸大肌与正在运行的线圈和使用非吸收性USP2-0编织丝运行表皮下缝合皮肤(Ø0.3毫米)
- 缝合在与导管之间的非吸收性USP2-0编织聚酯(Ø0.3毫米)背侧的切口。第一直接打结到皮肤从皮肤关闭切口,然后固定导管到缝线用结1厘米。为流探针,使用可吸收的USP2-0编织聚乳糖(Ø0.3毫米)缝合,以防止在气流探测器线缝合(图1)的切割。
- 小心地取出沥干同时的方颅施加压力切口维持在胸膜腔内负压。关闭与使用非吸收性USP2-0编织聚酯(Ø0.3毫米)荷包缝合切口和密封用凡士林伤口。
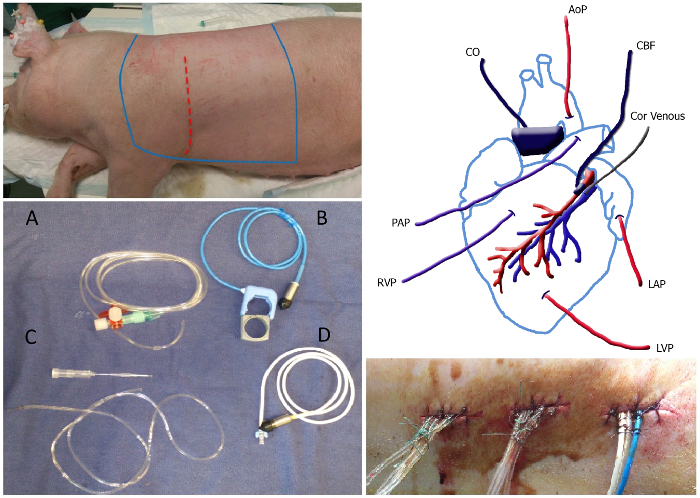
图1.概述外科左上面板:动物,应剃光和消毒的布鲁线之间的谎言的无菌区。切口部位被描绘为红色虚线。左下图:导管和流量探测器图片:充满液体的导管(A),主动脉/肺血流探测包括橡胶带(B),冠状静脉导管,包括20G的针头(C)和冠脉流量探头(D)。右上图:导管和流量探测器放置的示意图。 MAP,平均动脉压;林前静脉,冠状静脉导管; LAP,左心房压力; LVP左心室压力; RVP,右心室压力; PAP,肺动脉压; CO,心输出量; CBF,冠状动脉血流量。右下图:隧道式导管退出了缝合和打结沿缝合线在大约为1厘米的距离固定后,请点击此处查看该图的放大版本。
- 麻醉及恢复手术终止
- 停止麻醉,当所有的切口网站被关闭。
- 通过在股薄肌施用丁丙诺啡(0.015毫克/千克)即时提供镇痛。
- 停止通气当动物独立地呼吸和呼吸机断开气管套管。定期检查,如果动物被充分地呼吸。
- 放置导管的外化位点之间纱布垫以吸收伤口流体。
- 为了保护本身外导管的gments,给动物的弹性背心和包装人工两块羊皮之间的导管。
- 放气气管导管气球,当动物恢复其吞咽反射拔管。
- 由芬太尼缓释贴剂的方式提供长期镇痛(为20kg的猪12微克/小时;根据体重调节强度)。放置在皮肤上(例如下腹部)的薄部的音色以确保镇痛足够交付。
- 众议院单独动物整个手术后的时期。手术后为第一周的加热灯,以保持动物温暖。
- 提供足够的流体IV如果动物不能独立饮酒。
- 每日冲洗流体填充导管,通过第一抽取血液以除去凝块,然后用盐水再填充,最后用肝素化盐水(1000 - 5000国际单位/毫升),以防止血块形成。小心不要注入任何空气巴布莱而冲洗导管。
- 施用阿莫西林(25毫克/千克)静脉每日6天手术后防止手术后的感染。
- 让动物开始在跑步机上实验前一个星期恢复。
4.跑步机实验(图2)
- 冲洗流体填充导管如(3.5.10)并附加冲洗导管到压力换能器。测量直肠温度,以便能够获得温度校正血气值。
- 用盐水,以防止由于气泡的信号的阻尼冲洗压力传感器。附加的压力传感器,以在背侧弹性背心。
- 压力传感器和流量探头连接到放大器。开始在所述计算机程序测量并用0毫米汞柱被打开到空气校准压力传感器和流量探针(和关闭以动物),并使用一个压力计100毫米汞柱。 切换旋塞阀三通的方式,该流体导管具有与压力换能器的开放连接。注意,血压,现在可以得到的。检查的形状和幅度(图2)的信号。
- 如果需要,延长线连接至任意一个流体导管为混合静脉和动脉采血。
- 测量血流动力学当动物是在撒谎,以及静静地伫立在跑步机上。平均血压都在10秒的时间框架进行测量。
- 通过首先使用10毫升注射器,使得可使用肝素化的1ml注射器来获得将1ml纯血液吸溶于5ml血液获得动脉和混合静脉血液样本。为冠状静脉血液样品,2- ml注射器来代替10毫升注射器和撤回1毫升被足以获得纯血液。
- 保持在冰上密封1毫升注射器与血液气体分析仪处理该血液样本,以确定前动物的代谢和通气条件。
- 若使猪到五级运动方案在跑步机上,速度每3分钟,第1 - 5公里/小时(〜最大心脏率85%)。速度每2分钟各速度在静止位置 - 1.5后获得血流动力学和气体。
- 演习协议之后关闭旋塞,检查是否发生在0毫米汞柱校准漂移,请记下该校准。除去流体填充导管的压力传感器和断开流探针。
- 冲洗用盐水和肝素流体填充导管(1000 - 5000国际单位/毫升)。通过将它们人工羊皮两片之间的弹性背心下方保护导管和流动探针。动物现在可以返回其笼中。

图2.跑步机实验,左窗格LS:仪器在跑步机上猪。充满液体的导管连接到压力换能器,放置在猪的背部。右上图:总的实验装置,包括跑步机,放大器和记录电脑的概述。右下图:记录血流动力学数据的典型例子。从上到下;主动脉压(AOP,蓝色)和左心室压力(LVP,红色);左心房压力(LAP,蓝色)和左心室压力(红色);肺动脉压(PAP,蓝色)和右心室压力(RVP,红色);主动脉血流/心输出量(AOF,蓝色);冠状动脉血流量(CBF,红色)。 请点击此处查看该图的放大版本。
结果
运动长达5公里/小时导致心输出量增加了一倍,从4.3±0.3到8.5±0.7升/分钟将其主要由从每分钟137±7 256±8次在心脏速率的增加组合与完成小的增加心搏量从32±2到36±3毫升( 图3)。搏出量的增加通过增加左心室收缩容易,通过增加最大左室压的第一导数的证明DP /与左心室舒张的增加速率,并增加了左一起下降速率心房压,作为左心室的填充压力(图...
讨论
本研究描述了一种用于猪的慢性仪器的手术以及用于锻炼仪表猪上的马达驱动的跑步机,同时测量血流动力学和采取血液样本的动脉,混合静脉和冠状静脉血氧含量测定的协议。
该议定书中的关键步骤
有迹象表明,在插管过程中,已经开始在协议中的几个关键步骤。硫喷妥钠(2.1.5)是一种呼吸道抑郁剂,因此需要在管理迅速插管。另外,在手术过程中仔细监测呼吸机设...
披露声明
作者什么都没有透露。
致谢
这项研究是由荷兰心脏基金会资助2000T038(以DJ Duncker)授予2000T042(到D Merkus)的支持,欧盟FP7 - 健康 - 2010批MEDIA-261409(以DJ Duncker和D Merkus),荷兰心血管研究倡议:荷兰心脏基金会,荷兰联邦大学医疗中心,荷兰组织健康研究与发展的科学荷兰皇家科学院 CVON- ARENA CVON 2011-11(DJ到Duncker),CVON-PHAEDRA CVON2012-08(到D Merkus)和CVON重新连接CVON 2014-11(以DJ Duncker和D Merkus),索菲亚基金会(以德D.韦氏-Meijler,D Merkus和IKM赖斯)。
材料
| Name | Company | Catalog Number | Comments |
| 3-way stopcocks | B. Braun | 16496 | |
| Perfusor lines PVC (DEHP-free) 150 cm/2.6 ml | B. Braun | 8722960 | Used for fluid filled catheters |
| “python “ silicontubing | Rubber BV | 1757 ID 1 mm, OD 2 mm | Used for fluid filled catheters |
| Sodium Chloride 0.9% | Baxter | TKF7124 | |
| Glucose 10% | Baxter | WE0163 | |
| Suction device | |||
| Slim-Line electrosurgical pencil with 2 buttons | ERBE ELEKTROMEDIZIN GMBH | 20190-066 | |
| Servo Ventilator SV900C | Siemens-Elema AB | ||
| Laryngoscoop | Vererinary Technics Int. | 11.02.47 | |
| Sterile surgical gloves | |||
| tie-on surgical mask | 3M | 1818FS | |
| surgical hat | Klinidrape | 621301 | |
| Procedure pack | Molnlycke Health Care | 97027809 | Surgical drape, gauze pads, syringes, beaker etc |
| Droptears | Alcon | 288-28282-01 | |
| Betadine scrub 75 mg/ml Povidone-iodine | Meda Pharma BV | RVG08939 | |
| Betadine solution 100 mg/ml Povidone-iodine | Meda Pharma BV | RVG01331 | |
| Cuffed Endotracheal tube | Emdamed | size depends on animal size | |
| Breathing filter Hyrdo therm 3HME | Intersurgical | 1560000 | |
| Laryngoscope Handle+ Miller blade size 4 | Kawe Germany | ||
| Manual resuscitator- Combibag | Weinmann | 6515-12-313-5596 | |
| Perivascular flow probe 3PS | Transonic | For coronary artery; Size 2.5 - 4 mm depending on animal size | |
| Confidence flow probe | Transonic | For aorta/pulmonary artery, 16 - 20 mm; size depends on animal size | |
| Venflon-Venisystem 20 G x 32 mm | BD | 393224 | For coronary venous catheter |
| Blunt Needle 18 G | For coronary venous catheter | ||
| Tygon Tubing | Rubber BV | 2802 ID 0.8 mm (1/32’’), OD 2.4 mm (3/32’’) | For coronary venous catheter |
| Suction Handle 17 cm 6 6/8 " Coupland 18/8 martinit with tube connector | KLS Martin Group | 18-575-24 | |
| Scalple blade | |||
| Scalpel Handle 13.5 cm 5 3/8 " Stainless Steel solid | KLS Martin Group | 10-100-04 | |
| Vascular Forceps 20.2 cm 8 " De Bakey Stainless Stee | KLS Martin Group | 24-388-20 | ± 14 cm |
| Dressing Forceps 17 cm 6 6/8 " Cushing Stainless Steel | KLS Martin Group | 12-189-17 | ± 18 cm |
| halsted-musquito straight 12.5 cm - 5" | Rudolf Medical | RU-3100-13 | ± 12 cm |
| halsted-musquito curved 12.5 cm - 5" | Rudolf Medical | RU-3101-12 | ± 12 cm |
| Dissecting and Ligature Forceps 13 cm 5 1/8 " Gemini Stainless Steel | KLS Martin Group | 13-451-13 | ± 12 cm |
| Dissecting and Ligature Forceps 18.5 cm 7 2/8 " Schnidt Stainless Steel | KLS Martin Group | 13-363-18 | |
| Rib Retractor Finochietto, Baby Aluminium - | KLS Martin Group | 24-162-01 | |
| suture forceps Mayo-Hegar 3 mm 18 cm - 7" | Rudolf Medical | RU-6050-18 | |
| Metchenbaum blunt curved 14.5 cm - 5(3/4)" | Rudolf Medical | RU-1311-14M | |
| Retrector farabeuf 12 cm - 4 (3/4)" | Rudolf Medical | RU-4497-12 | |
| Towel forceps schrädel curved 9cm - 3,5" | Rudolf Medical | RU-3550-09 | |
| surgical scissors blunt 13 cm - 5" | Rudolf Medical | RU-1001-13 | |
| Gauzes Cutisoft 10 x 10 cm 4-ply | BSN Medical | 45846-00 | |
| Gauzes Cutisoft 5 x 5 cm 4-ply | BSN Medical | 45844-00 | |
| Flowmeter -CM2 / SF2 - 2gas (O2 and Air) | UNO BV | 180000008 | |
| Tec 7 Vaporizer | Datex-Ohmeda | ||
| Acederm wound spay | Ecuphar NV | ||
| Vaseline Album | Bufa | 165313 | |
| silkam 3-0 Natural silk, non-absorbable | B. Braun | F 1134043 | sutures for placement of catheters |
| silkam 2-0 Natural silk, non-absorbable | B. Braun | F 1134051 | sutures for muscular approximation |
| dagrofil 3-0 Polyester, non-absorbable | B. Braun | C 0842478 | sutures for fluid fille catheters after tunneling |
| Vicryl rapide 3-0, 1 x 45 cm FS2, V2930G | Daxtrio medische producten | 15560 | sutures for electrical catheters after tunneling |
| Vitafil 6 USP | SMI | 6080 | Ties |
| Syringes | 10 ml and 2.5 ml | ||
| Heparin LEO (heparin sodium) | LEO Pharma A/S | ||
| Zoletil | Virbac | tiletamine / zolazepam | |
| Sedazine | AST farma | 108855 | xylazine |
| Temgesic | RB Pharmaceuticals | 5429 | buprenorphine |
| Tensogrip | BSN Medical | 71522-00 | elastic vest |
参考文献
- Laughlin, M. H., et al. Peripheral circulation. Compr Physiol. 2, 321-447 (2012).
- Datta, D., Normandin, E., ZuWallack, R. Cardiopulmonary exercise testing in the assessment of exertional dyspnea. Ann Thorac Med. 10, 77-86 (2015).
- Vatner, S. F., Braunwald, E. Cardiovascular control mechanisms in the conscious state. N Engl J Med. 293, 970-976 (1975).
- Duncker, D. J., Bache, R. J. Regulation of coronary blood flow during exercise. Physiol Rev. 88, 1009-1086 (2008).
- Tune, J. D., Gorman, M. W., Feigl, E. O. Matching coronary blood flow to myocardial oxygen consumption. J Appl Physiol. 97 (1985), 404-415 (2004).
- van den Heuvel, M., et al. Coronary microvascular dysfunction in a porcine model of early atherosclerosis and diabetes. Am J Physiol Heart Circ Physiol. 302, H85-H94 (2012).
- Zhou, Z., et al. Pulmonary vasoconstrictor influence of endothelin in exercising swine depends critically on phosphodiesterase 5 activity. Am J Physiol Lung Cell Mol Physiol. 306, L442-L452 (2014).
- Pereda, D., et al. Swine model of chronic postcapillary pulmonary hypertension with right ventricular remodeling: long-term characterization by cardiac catheterization, magnetic resonance, and pathology. J Cardiovasc Transl Res. 7, 494-506 (2014).
- Mercier, O., et al. Endothelin A receptor blockade improves regression of flow-induced pulmonary vasculopathy in piglets. J Thorac Cardiovasc Surg. 140, 677-683 (2010).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259, H218-H229 (1990).
- Yarbrough, W. M., Spinale, F. G. Large animal models of congestive heart failure: a critical step in translating basic observations into clinical applications. J Nucl Cardiol. 10, 77-86 (2003).
- Duncker, D. J., Stubenitsky, R., Verdouw, P. D. Autonomic control of vasomotion in the porcine coronary circulation during treadmill exercise: evidence for feed-forward beta-adrenergic control. Circ Res. 82, 1312-1322 (1998).
- Stubenitsky, R., Verdouw, P. D., Duncker, D. J. Autonomic control of cardiovascular performance and whole body O2 delivery and utilization in swine during treadmill exercise. Cardiovasc Res. 39, 459-474 (1998).
- Zhou, Z., et al. Phosphodiesterase-5 activity exerts a coronary vasoconstrictor influence in awake swine that is mediated in part via an increase in endothelin production. Am J Physiol Heart Circ Physiol. 306, H918-H927 (2014).
- Gross, D. R. . Animal Models in Cardiovascular Research. , (2009).
- Merkus, D., Duncker, D. J. Perspectives: Coronary microvascular dysfunction in post-infarct remodelled myocardium. Eur Heart J Suppl. 16, A74-A79 (2014).
- de Beer, V. J., de Graaff, H. J., Hoekstra, M., Duncker, D. J., Merkus, D. Integrated control of pulmonary vascular tone by endothelin and angiotensin II in exercising swine depends on gender. Am J Physiol Heart Circ Physiol. 298, H1976-H1985 (2010).
- Lautt, W. W. Resistance or conductance for expression of arterial vascular tone. Microvasc Res. 37, 230-236 (1989).
- Merkus, D., et al. Phosphodiesterase 5 inhibition-induced coronary vasodilation is reduced after myocardial infarction. Am J Physiol Heart Circ Physiol. 304, H1370-H1381 (2013).
- Heusch, G. The paradox of alpha-adrenergic coronary vasoconstriction revisited. J Mol Cell Card. 51, 16-23 (2011).
- Merkus, D., Houweling, B., van den Meiracker, A. H., Boomsma, F., Duncker, D. J. Contribution of endothelin to coronary vasomotor tone is abolished after myocardial infarction. Am J Physiol Heart Circ Physiol. 288, H871-H880 (2005).
- Haitsma, D. B., et al. Minimal impairment of myocardial blood flow responses to exercise in the remodeled left ventricle early after myocardial infarction, despite significant hemodynamic and neurohumoral alterations. Cardiovasc Res. 52, 417-428 (2001).
- Bender, S. B., van Houwelingen, M. J., Merkus, D., Duncker, D. J., Laughlin, M. H. Quantitative analysis of exercise-induced enhancement of early- and late-systolic retrograde coronary blood flow. J Appl Physiol. 108 (3), 507-514 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。