このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
豚の長期心血管運動テストのためのカテーテルの外科的配置
要約
Here we present a protocol to assess cardiopulmonary function in awake swine, at rest and during graded treadmill exercise. Chronic instrumentation allows for repeated hemodynamic measurements uninfluenced by cardiodepressive anesthetic agents.
要約
このプロトコルは、慢性的に機器の豚とモーター駆動トレッドミル上ブタを行使するための手順への外科的手順を説明します。心肺機能がしばしば麻酔を必要とする、侵襲的に測定される初期の心肺機能障害は、特に、動物モデルにおいて、診断することは困難です。多くの麻酔薬がcardiodepressiveているように、心血管機能の微妙な変化をマスクすることができます。測定は麻酔および急性の外科的外傷の影響を与えることなく、静かな休息の条件の下で得られるように対照的に、慢性計測は、覚醒状態で心肺機能の測定を可能にします。動物が適切に訓練されている場合また、測定は、段階的なトレッドミル運動中に得ることができます。
フロープローブは、心拍出量を測定するための大動脈または肺動脈の周りおよびコロンの測定のための左冠動脈前下行枝の周りに配置されています進血流。液体で満たされたカテーテルは、圧力測定および血液サンプリングのための大動脈、肺動脈、左心房、左心室と右心室に移植されています。また、20 Gカテーテルは、冠状静脈血サンプリングを可能にするために前室間静脈内に配置されます。
回復週間後、3分続く各段階で、5段階の進行性運動プロトコルに豚は、カテーテルは、圧力と流量計に接続され、電動トレッドミル上に配置され、およびブタが施されます。血行動態信号が連続的に記録され、血液サンプルを各運動段階の最後の30秒の間に採取されています。
慢性的にインストルメント動物を研究の主な利点は、安静時だけでなく、運動などの物理的ストレスの間だけでなく、心肺機能のシリアル評価を可能にすることです。また、心肺機能は、病気の発症のA中に繰り返し評価することができますND慢性処置の間、それによって統計的検出力を増加させ、したがって、研究のために必要な動物の数を制限します。
概要
適切な心肺機能は特に、このような運動の1時などに増加した代謝要求の状態の間に、酸素や栄養素を体を供給することが不可欠です。運動に心肺応答は心機能、 すなわちにおける適応の数によって特徴付けられる。、行使筋肉を供給する血管床における心拍数、収縮性およびストローク量、および微小血管の機能、 すなわち、血管拡張の増加を同様に肺のように血管系、および胃腸系を供給する血管床だけでなく、非アクティブな筋肉1で血管収縮。障害者運動能力は、心肺機能障害の早期特徴であり、かつ心肺運動負荷試験が損なわ運動能力2を有する患者における心機能不全、血管機能不全および/ または肺機能不全の間に線引きする効果的な方法として使用されています。初期の心肺機能不全をd心肺機能のように、特に、動物モデルにおいて、診断するifficultはしばしばcardiodepressive特性3を有する多くの麻酔薬で麻酔を必要とする、侵襲的に測定されます。
慢性機器は覚醒状態の心肺機能の測定を可能にし、動物が完全に実験室条件の測定値に調整されるときに、麻酔および急性の外科的外傷の影響を与えることなく静かな静止条件下で得ることができます。動物が適切に訓練されている場合また、測定は、段階的なトレッドミル運動4,5の間に得 ることができます。より具体的には、左と、冠状動脈全身および肺微小循環における血管運動緊張の調節を決定することができ、一方、右心室の機能は、評価され、心筋灌流に関連することができます。液体で満たされたカテーテルの使用は、広告を与えることなく、血液サンプルを取るだけでなく、圧力の測定を可能にします動物ditionalストレス。慢性計装動物を研究の別の利点は、それによって統計的検出力を増加させ、したがって、研究のために必要な動物の数を制限し、心肺運動負荷試験は、疾患の発症中または長期治療中のいずれかの、それ自身の対照として、動物の使用を可能に繰り返すことができることです。
豚の心肺解剖学的構造は、密接に人間のこと似ており、糖尿病6、心筋梗塞7、肺高血圧8,9及びペーシング誘発性心不全10,11などの心肺疾患の様々な形態を誘導することが可能です。また、豚の大きさだけでなく、血液ガスを分析するだけでなく、神経液性測定を実行するために、および/または疾患のバイオマーカーを探索するために、慢性計装、および十分な量の繰り返し採血を可能にします。
このプロトコルは、慢性に使用され手術を説明LY機器豚だけでなく、モーター駆動トレッドミルで豚を行使するためのプロトコル。
プロトコル
動物を対象とする手順は、エラスムス医療センターロッテルダム(オランダ)での動物実験委員会によって承認されています。 6と80キロの間の重みを持つ豚が正常にこのプロトコルを使用してインストルメントされています。
人間の取り扱いに動物の1適応
- 施設に到着した後、独りで家動物が、互いに相互作用することを可能に。
- 少なくとも1日1回1週間のために動物を扱うことにより、実験室に動物施設からのヒトの取り扱いおよび輸送に豚をAccustomize。
- 手術前に3回の最低トレッドミル上でそれらを行使することにより、モータ駆動のトレッドミルでの運動実験のために適切に動物を訓練します。
- 動物は、吐き気、嘔吐および胃液のことにより、潜在的な吸引を防止するために、O / N手術前に絶食する必要があります。
外科2.準備
- 鎮静状態
- 10ミリリットルの注射器内鎮静のための薬を準備します。前投薬はチレタミン/ゾラゼパム(5ミリグラム/キログラム)で構成され、キシラジン、(2.25ミリグラム/ kg)及びアトロピン(1 mg)を。
- 豚を鎮静する19 G 1.5 ''針と僧帽筋に筋肉内に薬剤を注入します。
- 約10分間待ち、筋弛緩および鎮静の適切かつ安定したレベルを確認するために無意識を確認してください。
- 麻酔および/または流体のその後の静脈内投与のための耳静脈に20 G周辺の安全カテーテルを配置します。
- 挿管と換気
- 仰臥位でのテーブルおよび/またはトロリーに動物を置きます。
- 経口スプレッダーで動物の口を開きます。
- 顎または挿管を妨げる反射を、嚥下の存在の不十分な緩和の場合には、耳静脈カテーテルを介して静脈内チオペンタール(10mg / kgの)を管理。また、豚はマスクすることができましたイソフルランで鎮静を誘導します。
- laryngoscopistが直接喉頭を見ることができるように光とミラーの刃で従来の喉頭鏡を使用してください。喉頭痙攣がある場合は、けいれんを軽減し、挿管を可能にするためのコードや喉頭に2%リドカインを適用します。
- チューブは上気道の解剖学的構造に優れた適合させると気管に口を通って、声帯の間にチューブを渡すために気管内チューブに挿管スタイレットを挿入します。
- 呼吸ガスの漏れを防止するために、および胃液の可能性誤嚥から気道を保護するために、所定の位置に固定するのに役立つ10ミリリットルの注射器を用いてバルーンカフを膨らませます。
- 呼吸フィルタ(熱と湿気交換器)にし、人工呼吸器にチューブを接続します。
- 手術台上で、右側に動物を置きます。
- 、100-120 mmHgでののpO2レベルを達成する酸素の混合物で動物を換気し、窒素(1:2 v / v)で、usinグラム以下の人工呼吸器の設定:圧力制御モード:呼気終末陽圧(PEEP)4 CMH 2 O;最大吸気圧16から18 CMH 2 O;このカプノグラフィで換気をモニター、約10ミリリットル/ kgで一回換気量をもたらすはずである(20キログラムの動物について、増加体重頻度を減少させる)、動物の大きさに応じた周波数の呼吸。
- 直腸温度計を使用して温度を監視し、37との間の温度に維持 - ヒートランプまたは熱マットを使用して、39ºCを。また、心電図と心拍数を監視します。
- 麻酔
- 誘導及び耳静脈カテーテルを介して(v / v)の換気ガス混合物に又は代替的にフェンタニルの静脈内投与(10μgの/ kg /時)でイソフルランの2.0%を添加することによって、好ましくは、麻酔を維持します。
- 手術を開始する前に、後ろ足のつま先のピンチで痛みの反射神経をテストすることによって麻酔の十分な深さを確認してください。必要な場合、追加追加の麻酔または数分待ちます。手術を通じて定期的に痛みの反射神経をチェックしてください。
- 流体および抗生物質
- 静脈内耳静脈カテーテルを介してアモキシシリン(25ミリグラム/キログラム)の最初の用量を投与。
- 手術中に10%グルコース(500ミリリットル)のゆっくりとした注入を可能にするために耳静脈カテーテルに輸血システムを接続します。
- 手術部位の滅菌
- 左腋窩のすべての方法脊柱から約25センチ幅の領域にわたって動物の皮膚を剃るし、清掃してください。
- 約5分間ポビドンヨードスクラブ(75 mg / mlで)で潤い肌をスクラブ。
- ポビドンヨードローション(100 mg / mlで)で皮膚を殺菌する前に、濡れた滅菌ガーゼで皮膚からポビドンヨード石鹸を削除します。
- 手術部位の細菌の転送と、その後の汚染を低減するために、滅菌外科用ドレープで動物をカバーしています。
3.手術
- オープニング胸部(開胸)
- ダウン左腋窩に肩甲骨の左下角に1cmの尾側( 図1)を開始し、皮膚に切開を行います。過度の出血を防ぐために、皮膚の血管を焼灼するジアテルミーを使用してください。
- ジアテルミーの切断様式を使用して、鋸筋と大胸筋を通ってカットします。また、過度の出血を防止するために、筋肉層の血管を焼灼するジアテルミーを使用しています。
- 慎重に蚊クランプで左から4番目の肋間の肋間筋を分割する鈍的切開を使用してください。今、内臓と壁側胸膜に覆わ左肺の肋表面が露出されるべきです。
- 胸膜腔を入力するには、慎重に胸膜の両方の層を貫通し、それらを開いた涙。
- 傷のエッジと肋骨を分離するために胸部開創器を使用して、強制的に組織を駆動するために離れて胸膜腔の良好な露出を得ることができます。
- 尾側方向に左肺を離れて押して、濡れたガーゼで場所に保管してください。今、心臓や大血管を明確にさらされるべきです。
- カテーテルとフロープローブの配置( 図1)
- 下行胸部大動脈の周囲の結合組織の〜2cm角を削除するには、鈍的切開を使用してください。
- 非吸収性USP3-0編組絹縫合糸(Ø0.2mm)ので大動脈壁に、3ステッチからなる、巾着縫合を行います。
- 巾着縫合糸の真ん中にステンレス鋼16 G針で大動脈血管壁を貫通します。
- 大動脈に(リングまで)液体で満たされたカテーテルの先端を挿入し、しっかりと一緒に巾着縫合糸を引っ張ると、縫合糸の2つの文字列を結びます。
- トン再び、所定の位置にカテーテルを保持するカテーテルの周りに3回のリングの上に縫合糸を巻くとするために、縫合糸の2つの文字列を、すなわち。また、挿入場所から約1cm、頭蓋新しいステッチでカテーテルを固定します。
- 手術中に平均動脈圧を監視するために、コンピュータに接続されているキャリブレーションさ圧力変換器に液体で満たされたカテーテルを接続します。確認するか、正しい換気の設定を調整するために動脈血ガスを得ます。
- 交差したカットと心膜を開きます。無傷の心膜上で実行さ横隔神経を保つために注意してください。
- 肺動脈を特定し、Farabeufリトラクタと尾側方向にわずかにそれを引っ張ります。今、上行大動脈および大動脈弓を露出する必要があります。肺動脈を後退しながら、平均動脈圧を監視します。
- 上行大動脈とMetzenbaumはさみを使用して、肺動脈との間の結合組織の小さなカット(〜1cmに)作る、大きな湾曲して上行大動脈または肺動脈のいずれかを分析することができるように、蚊のクランプは、フロープローブを配置します。
- 容器の周りの流れプローブのゴムバンドを配置します。簡単に、これは、ゴムバンドの一端を通して縫合糸を配置するようにするには、容器の周りにこの縫合糸を配置し、ゴムバンドは、容器を囲むまでそれを引っ張ります。
- ゴムバンドのフロープローブ測定装置を修正しました。コンピュータにフロープローブを接続し、流量プローブの正しい配置を確認するために、コンピュータ上で心臓の出力信号を確認してください。
- 大動脈液体で満たされたカテーテル( - 3.2.5 3.2.2)について記載したのと同じ方法で肺動脈内の液体で満たされたカテーテルを、右心室、左心室と左心房を置きます。これらの構造に巾着縫合を実行する前に、結合組織を除去する必要はないことに留意されたいです。
- Metzenbaumはさみでカット - (3ミリメートル2)公開し、鉗子で組織を持ち上げると小さなを行うことで、左冠動脈前下行枝の近位部分を分析、慎重に綿棒で離れて動脈から組織をからかいました。下に小さなストレート傾斜した蚊クランプを通過させることにより、冠状動脈の完全な解剖を確認してください。
- 冠状静脈カテーテルに接続されている縫合糸、と前室間冠状静脈にステッチ平行してください。
- 冠状静脈カテーテルの20 G針で冠状静脈を穿刺し、静脈内にカテーテルのカニューレを挿入します。
- 針を外し、すでに実行ステッチ(3.2.14)でカテーテルを固定します。また、初期パンクの場所から約1センチメートル新しいステッチでカテーテルを固定します。
- 冠状動脈を下降以前解剖左前周りの冠血流プローブを配置します。動脈が狭窄であり、ほとんど表示されている場合には、容器のよりよい露出を得るために、血管を緩和するリドカイン10%のスプレーを使用しています。 CONFするコンピュータに冠血流の信号を確認してくださいフロープローブ( 図2)の正しい配置をIRM。
- トンネリング
- トンネル個々の筋肉の下に左第3肋間空間を介して、大規模な湾曲した蚊のクランプを使用して、リブ上記流量プローブ。
- 肋間筋を貫通して第3の左第五肋間空間のいずれかを介して、トンネルの液体で満たされたカテーテルを。液体で満たされたカテーテルをオフにクランプし、穿孔面積を最小限にし、トンネルの間に液体で満たされたカテーテルの漏洩を防止するために三方活栓を削除します。
- 肋間筋に巾着縫合糸を用いて非吸収性USP2-0編組絹(Ø0.3mm)の持つ流量プローブおよび液体で満たされたカテーテルを修正しました。この縫合糸はまた、再度行っ負の胸腔内圧後の空気漏れを防止するのに役立ちます。
- 皮膚中の3切開脊柱に不吉なと並列約2cm、約3cmでを作ります3センチメートル離れてお互いの長さ。
- ピアース背面の切開部への吻側切開部位から左広背筋の下にトロカール。トンネルこのトロカール内のバックに流れプローブおよび流体カテーテル。
- 液体で満たされたカテーテルに栓を配置し、クランプを取り外します。血栓および気泡を除去1,000 IU / mlのヘパリンと流体で満たされたカテーテルを満たすために、血液を引き出します。冠動脈静脈カテーテルは、5000 IU / mlのヘパリンで埋めなくてはなりません。
- 胸部を閉じます
- 最初の切開に約1.5センチ長さ8センチ尾側と平行な切開を行います。
- 大きな湾曲した蚊クランプを皮下この切開部に第六肋間筋を通して胸膜腔からの排水を導きます。残りの流体を除去し、胸部の閉鎖時に胸腔内の負圧を回復するために吸引装置にドレインを接続します。
- 緩和し、膨らませます吸気終末ホールドと肺。視覚的なモニタリングによる肺の十分な充填を確認してください。
- 一緒に非吸収性USP6編組ポリエステル(Ø0.8mm)の持つ2つの別々の部位での第四肋間の肋骨を引っ張ることにより、胸部を閉じます。
- ランニングステッチと非吸収性USP2-0編組シルクを使用して、実行中皮内縫合で皮膚に鋸筋と大胸筋を閉じます(Ø0.3mm)の
- カテーテルとの間の非吸収性USP2-0編組ポリエステル(Ø0.3mm)のと背側の切開を縫合。まず皮膚から結び目1センチメートルで縫合糸にカテーテルを固定、その後、切開部を閉じるために、皮膚に直接結び目を作ります。流量プローブの場合は、フロープローブワイヤーで縫合糸( 図1)の切断を防止するために、吸収性USP2-0編組ポリグラクチン(Ø0.3mm)の縫合糸を使用しています。
- の頭蓋側に圧力をかけながら慎重にドレインを削除胸腔内の負圧を維持するために切開。非吸収性USP2-0編組ポリエステル(Ø0.3mm)を使用して、巾着縫合糸で切開を閉じ、ワセリンで傷を封印。
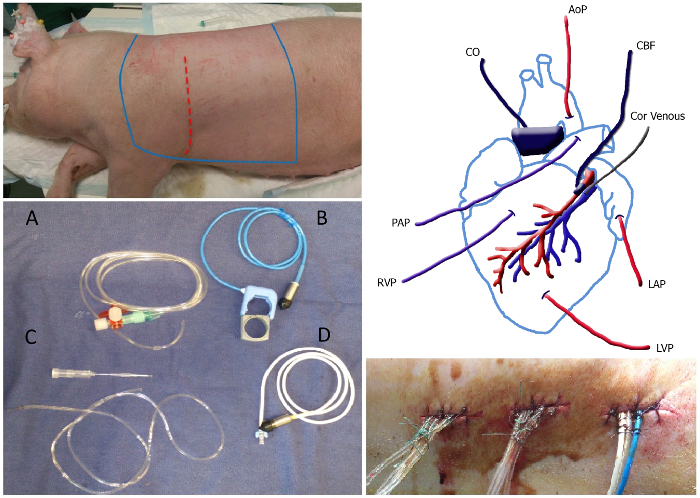
手術の図1.概要左上のパネル:動物の無菌エリア、ブルーラインの間に剃毛し、嘘を滅菌する必要があります。切開部位は、赤色の点線で示されています。左下のパネル:カテーテルとフロープローブの写真:液体で満たされたカテーテル(A)、ゴムバンド(B)、20 G針(C)および冠動脈流プローブ(D)を含む冠状静脈カテーテルなどの大動脈/肺流量プローブ。右上のパネル:カテーテルとフロープローブの配置の概略図。 MAPは、平均動脈圧;うわっの静脈、冠状静脈カテーテル。 LAPは、心房圧を残しました。 LVP左心室圧; RVP、右心室圧; PAP、肺動脈圧; CO、心拍出量。 CBF、冠血流。右下のパネル:。縫合糸に沿って約1cmの距離でステッチや結び目で固定バックを終了するトンネルカテーテルこの図の拡大版をご覧になるにはこちらをクリックしてください。
- 手術からの麻酔とリカバリの終了
- すべての切開部位が閉じているときに、麻酔を停止します。
- 薄筋に(0.015ミリグラム/キログラム)イムブプレノルフィンを投与することにより、鎮痛を提供します。
- 動物が独立して呼吸しているときに換気を停止し、人工呼吸器から気管チューブを外します。動物が十分に呼吸している場合は、定期的に確認してください。
- 創傷液を吸収するために、カテーテルの具象部位の間にガーゼパッドを配置します。
- 外部SEを保護するために、カテーテルのgmentsは、動物に弾性ベストを与え、人工シープスキンの2枚の間にカテーテルをパッケージ化します。
- 気管チューブのバルーンを収縮し、動物が嚥下反射を取り戻したときに抜管。
- フェンタニル徐放性パッチによって長期的な鎮痛を提供(20キロの豚のための12μgの/ hrで、体重に応じて強度を調整)。鎮痛の十分な供給を確保するために(そのような下腹部など)皮膚の薄い部分にパッチを配置します。
- ハウス全体の術後期間のための別途の動物。動物を暖かく保つために手術後の最初の週のための加熱ランプを提供します。
- 動物は独立して飲んでされていない場合、十分な流体IVを供給してください。
- 血栓形成を防止するために - (5000 IU / mlの千)最初のヘパリン添加生理食塩水で最終的に生理食塩水を補充してから、血栓を除去するために血液を引き出すことによって、日常の液体で満たされたカテーテルをフラッシュします。任意の空気bubbを注入しないように注意してくださいレカテーテルのフラッシュ中。
- 手術後の感染を防止するために、手術後6日間アモキシシリン(25ミリグラム/ kg)を静脈毎日を管理します。
- 動物がトレッドミル実験を開始する前に、1週間回復できるようにします。
4.トレッドミル実験(図2)
- (3.5.10)に記載のように液体で満たされたカテーテルをフラッシュし、圧力変換器にフラッシュされたカテーテルを添付します。温度補正された血液ガス値を得ることができるように直腸温度を測定します。
- 気泡による信号の減衰を防ぐために、生理食塩水で圧力変換器をフラッシュします。背側に弾性ベストに圧力変換器を取り付けます。
- アンプに圧力変換器と流量プローブを接続します。コンピュータプログラムで計測を開始し、0 mmHgでは空気に開放されて圧力変換器と流量プローブを校正(および動物に閉じている)と圧力計を用いて100 mmHgで。
- は、流体カテーテルは圧力変換器とのオープンな接続を持っていることのように三方活栓を切り替えます。血圧が今得ることができることに注意してください。形状および振幅( 図2)のための信号を確認してください。
- 必要に応じて、混合静脈および動脈血液のサンプリングのための流体のカテーテルのいずれかに延長線を接続します。
- 動物が横たわっているだけでなく、トレッドミル上で静かに立っている時に血行動態を測定します。平均血圧は、10秒の時間枠にわたって測定されています。
- 純粋な血液1mlをヘパリン処理1ml注射器を用いて得ることができるように、最初の10 mlシリンジを用いて、5mlの血液を吸引することによって、動脈および混合静脈血サンプルを得ます。冠状静脈血サンプルについて、2mLの注射器を用いる代わりに、1mlの10 mlシリンジと離脱は、純粋な血液を得るのに十分です。
- 決定するために、血液ガス分析器を用いて血液サンプルを処理する前に、氷上で密封された1ミリリットル注射器を保管してください動物の代謝と換気状態。
- 5キロ/時(最大心拍数の〜85%) - トレッドミル、スピードあたり3分、1に5段の運動プロトコルに豚を施します。静止位置にあるように、各速度に速度あたり2分 - 1.5後の血行動態及び血液ガスを得ます。
- 運動プロトコル後に栓を閉じて、ドリフトが0 mmHgのキャリブレーションで発生しているかどうかを確認し、このキャリブレーションをメモします。液体で満たされたカテーテルの圧力変換器を取り外し、流量プローブを切断します。
- ( - 5000 IU / mlの千)の生理食塩水およびヘパリンと流体で満たされたカテーテルをフラッシュします。人工シープスキンの2枚の間に弾性ベストの下にそれらを置くことによって、カテーテルとフロープローブを保護します。動物は、現在、そのケージに戻すことができます。

図2.トレッドミル実験。左ペインLS:トレッドミル上のインストルメント豚。流体で満たされたカテーテルは、豚の背面に配置された圧力変換器に接続されています。右上のパネル:トレッドミル、アンプと記録コンピュータを含む全実験のセットアップの概要。右下のパネル:記録された血行動態データの典型的な例。上から下へ。大動脈圧(AOP、青)と左心室圧(LVP、赤)。左心房圧(LAP、青)と左心室圧(赤);肺動脈圧(PAP、青)と右心室圧(RVP、赤)。大動脈流/心拍出量(AOF、青)。冠血流(赤CBF)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
結果
5キロ/時のエクササイズまでは、主との組み合わせで毎分137±7 256±8拍から心拍数の増加によって達成された4.3±0.3 0.7±8.5 L /分の心拍出量の倍増をもたらしました32±2±3〜36ミリリットル( 図3)からのストローク量のわずかな増加。一回拍出量の増加は共に左心室の弛緩速度の増加、左の増加に伴って、左心室圧のdP / dtmaxの一次導関数の最大値の増加によ...
ディスカッション
本研究は、豚の慢性計測のための手術だけでなく、血行動態を測定しながらモーター駆動トレッドミル上計装豚を行使し、動脈、混合静脈および冠状静脈血中の酸素含有量の測定のための血液試料を採取するためのプロトコルについて説明します。
プロトコル内の重要なステップ
挿管処置の間にすでに開始プロトコル内のいくつかの重要なステップがあります。チ?...
開示事項
著者らは、開示することは何もありません。
謝辞
この研究は、(DJドゥンカーへ)オランダ心臓財団の助成金2000T038によってサポートされていました(D. Merkusに)2000T042を付与し、欧州委員会FP7-健康-2010グラントMEDIA-261409(DJドゥンカーとD. Merkusへ)、オランダ心臓血管研究イニシアティブ:オランダ心臓財団、大学医療センターのためのオランダ連合、健康研究開発と科学のオランダ王立アカデミーのためのオランダ機構 CVON- ARENA CVON 2011-11、(D. Merkusへ)CVON-ファイドラCVON2012-08とCVON-RECONNECT CVON 2014から11(DJドゥンカーへ)、ソフィア財団(DJドゥンカーとD. Merkusへ)(D.デへウィイス-Meijler、D. MerkusとIKMライス)。
資料
| Name | Company | Catalog Number | Comments |
| 3-way stopcocks | B. Braun | 16496 | |
| Perfusor lines PVC (DEHP-free) 150 cm/2.6 ml | B. Braun | 8722960 | Used for fluid filled catheters |
| “python “ silicontubing | Rubber BV | 1757 ID 1 mm, OD 2 mm | Used for fluid filled catheters |
| Sodium Chloride 0.9% | Baxter | TKF7124 | |
| Glucose 10% | Baxter | WE0163 | |
| Suction device | |||
| Slim-Line electrosurgical pencil with 2 buttons | ERBE ELEKTROMEDIZIN GMBH | 20190-066 | |
| Servo Ventilator SV900C | Siemens-Elema AB | ||
| Laryngoscoop | Vererinary Technics Int. | 11.02.47 | |
| Sterile surgical gloves | |||
| tie-on surgical mask | 3M | 1818FS | |
| surgical hat | Klinidrape | 621301 | |
| Procedure pack | Molnlycke Health Care | 97027809 | Surgical drape, gauze pads, syringes, beaker etc |
| Droptears | Alcon | 288-28282-01 | |
| Betadine scrub 75 mg/ml Povidone-iodine | Meda Pharma BV | RVG08939 | |
| Betadine solution 100 mg/ml Povidone-iodine | Meda Pharma BV | RVG01331 | |
| Cuffed Endotracheal tube | Emdamed | size depends on animal size | |
| Breathing filter Hyrdo therm 3HME | Intersurgical | 1560000 | |
| Laryngoscope Handle+ Miller blade size 4 | Kawe Germany | ||
| Manual resuscitator- Combibag | Weinmann | 6515-12-313-5596 | |
| Perivascular flow probe 3PS | Transonic | For coronary artery; Size 2.5 - 4 mm depending on animal size | |
| Confidence flow probe | Transonic | For aorta/pulmonary artery, 16 - 20 mm; size depends on animal size | |
| Venflon-Venisystem 20 G x 32 mm | BD | 393224 | For coronary venous catheter |
| Blunt Needle 18 G | For coronary venous catheter | ||
| Tygon Tubing | Rubber BV | 2802 ID 0.8 mm (1/32’’), OD 2.4 mm (3/32’’) | For coronary venous catheter |
| Suction Handle 17 cm 6 6/8 " Coupland 18/8 martinit with tube connector | KLS Martin Group | 18-575-24 | |
| Scalple blade | |||
| Scalpel Handle 13.5 cm 5 3/8 " Stainless Steel solid | KLS Martin Group | 10-100-04 | |
| Vascular Forceps 20.2 cm 8 " De Bakey Stainless Stee | KLS Martin Group | 24-388-20 | ± 14 cm |
| Dressing Forceps 17 cm 6 6/8 " Cushing Stainless Steel | KLS Martin Group | 12-189-17 | ± 18 cm |
| halsted-musquito straight 12.5 cm - 5" | Rudolf Medical | RU-3100-13 | ± 12 cm |
| halsted-musquito curved 12.5 cm - 5" | Rudolf Medical | RU-3101-12 | ± 12 cm |
| Dissecting and Ligature Forceps 13 cm 5 1/8 " Gemini Stainless Steel | KLS Martin Group | 13-451-13 | ± 12 cm |
| Dissecting and Ligature Forceps 18.5 cm 7 2/8 " Schnidt Stainless Steel | KLS Martin Group | 13-363-18 | |
| Rib Retractor Finochietto, Baby Aluminium - | KLS Martin Group | 24-162-01 | |
| suture forceps Mayo-Hegar 3 mm 18 cm - 7" | Rudolf Medical | RU-6050-18 | |
| Metchenbaum blunt curved 14.5 cm - 5(3/4)" | Rudolf Medical | RU-1311-14M | |
| Retrector farabeuf 12 cm - 4 (3/4)" | Rudolf Medical | RU-4497-12 | |
| Towel forceps schrädel curved 9cm - 3,5" | Rudolf Medical | RU-3550-09 | |
| surgical scissors blunt 13 cm - 5" | Rudolf Medical | RU-1001-13 | |
| Gauzes Cutisoft 10 x 10 cm 4-ply | BSN Medical | 45846-00 | |
| Gauzes Cutisoft 5 x 5 cm 4-ply | BSN Medical | 45844-00 | |
| Flowmeter -CM2 / SF2 - 2gas (O2 and Air) | UNO BV | 180000008 | |
| Tec 7 Vaporizer | Datex-Ohmeda | ||
| Acederm wound spay | Ecuphar NV | ||
| Vaseline Album | Bufa | 165313 | |
| silkam 3-0 Natural silk, non-absorbable | B. Braun | F 1134043 | sutures for placement of catheters |
| silkam 2-0 Natural silk, non-absorbable | B. Braun | F 1134051 | sutures for muscular approximation |
| dagrofil 3-0 Polyester, non-absorbable | B. Braun | C 0842478 | sutures for fluid fille catheters after tunneling |
| Vicryl rapide 3-0, 1 x 45 cm FS2, V2930G | Daxtrio medische producten | 15560 | sutures for electrical catheters after tunneling |
| Vitafil 6 USP | SMI | 6080 | Ties |
| Syringes | 10 ml and 2.5 ml | ||
| Heparin LEO (heparin sodium) | LEO Pharma A/S | ||
| Zoletil | Virbac | tiletamine / zolazepam | |
| Sedazine | AST farma | 108855 | xylazine |
| Temgesic | RB Pharmaceuticals | 5429 | buprenorphine |
| Tensogrip | BSN Medical | 71522-00 | elastic vest |
参考文献
- Laughlin, M. H., et al. Peripheral circulation. Compr Physiol. 2, 321-447 (2012).
- Datta, D., Normandin, E., ZuWallack, R. Cardiopulmonary exercise testing in the assessment of exertional dyspnea. Ann Thorac Med. 10, 77-86 (2015).
- Vatner, S. F., Braunwald, E. Cardiovascular control mechanisms in the conscious state. N Engl J Med. 293, 970-976 (1975).
- Duncker, D. J., Bache, R. J. Regulation of coronary blood flow during exercise. Physiol Rev. 88, 1009-1086 (2008).
- Tune, J. D., Gorman, M. W., Feigl, E. O. Matching coronary blood flow to myocardial oxygen consumption. J Appl Physiol. 97 (1985), 404-415 (2004).
- van den Heuvel, M., et al. Coronary microvascular dysfunction in a porcine model of early atherosclerosis and diabetes. Am J Physiol Heart Circ Physiol. 302, H85-H94 (2012).
- Zhou, Z., et al. Pulmonary vasoconstrictor influence of endothelin in exercising swine depends critically on phosphodiesterase 5 activity. Am J Physiol Lung Cell Mol Physiol. 306, L442-L452 (2014).
- Pereda, D., et al. Swine model of chronic postcapillary pulmonary hypertension with right ventricular remodeling: long-term characterization by cardiac catheterization, magnetic resonance, and pathology. J Cardiovasc Transl Res. 7, 494-506 (2014).
- Mercier, O., et al. Endothelin A receptor blockade improves regression of flow-induced pulmonary vasculopathy in piglets. J Thorac Cardiovasc Surg. 140, 677-683 (2010).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259, H218-H229 (1990).
- Yarbrough, W. M., Spinale, F. G. Large animal models of congestive heart failure: a critical step in translating basic observations into clinical applications. J Nucl Cardiol. 10, 77-86 (2003).
- Duncker, D. J., Stubenitsky, R., Verdouw, P. D. Autonomic control of vasomotion in the porcine coronary circulation during treadmill exercise: evidence for feed-forward beta-adrenergic control. Circ Res. 82, 1312-1322 (1998).
- Stubenitsky, R., Verdouw, P. D., Duncker, D. J. Autonomic control of cardiovascular performance and whole body O2 delivery and utilization in swine during treadmill exercise. Cardiovasc Res. 39, 459-474 (1998).
- Zhou, Z., et al. Phosphodiesterase-5 activity exerts a coronary vasoconstrictor influence in awake swine that is mediated in part via an increase in endothelin production. Am J Physiol Heart Circ Physiol. 306, H918-H927 (2014).
- Gross, D. R. . Animal Models in Cardiovascular Research. , (2009).
- Merkus, D., Duncker, D. J. Perspectives: Coronary microvascular dysfunction in post-infarct remodelled myocardium. Eur Heart J Suppl. 16, A74-A79 (2014).
- de Beer, V. J., de Graaff, H. J., Hoekstra, M., Duncker, D. J., Merkus, D. Integrated control of pulmonary vascular tone by endothelin and angiotensin II in exercising swine depends on gender. Am J Physiol Heart Circ Physiol. 298, H1976-H1985 (2010).
- Lautt, W. W. Resistance or conductance for expression of arterial vascular tone. Microvasc Res. 37, 230-236 (1989).
- Merkus, D., et al. Phosphodiesterase 5 inhibition-induced coronary vasodilation is reduced after myocardial infarction. Am J Physiol Heart Circ Physiol. 304, H1370-H1381 (2013).
- Heusch, G. The paradox of alpha-adrenergic coronary vasoconstriction revisited. J Mol Cell Card. 51, 16-23 (2011).
- Merkus, D., Houweling, B., van den Meiracker, A. H., Boomsma, F., Duncker, D. J. Contribution of endothelin to coronary vasomotor tone is abolished after myocardial infarction. Am J Physiol Heart Circ Physiol. 288, H871-H880 (2005).
- Haitsma, D. B., et al. Minimal impairment of myocardial blood flow responses to exercise in the remodeled left ventricle early after myocardial infarction, despite significant hemodynamic and neurohumoral alterations. Cardiovasc Res. 52, 417-428 (2001).
- Bender, S. B., van Houwelingen, M. J., Merkus, D., Duncker, D. J., Laughlin, M. H. Quantitative analysis of exercise-induced enhancement of early- and late-systolic retrograde coronary blood flow. J Appl Physiol. 108 (3), 507-514 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved