Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La colocación quirúrgica de catéteres de larga duración cardiovascular prueba de esfuerzo en los cerdos
En este artículo
Resumen
Here we present a protocol to assess cardiopulmonary function in awake swine, at rest and during graded treadmill exercise. Chronic instrumentation allows for repeated hemodynamic measurements uninfluenced by cardiodepressive anesthetic agents.
Resumen
Este protocolo describe el procedimiento quirúrgico para crónicamente porcina instrumento y el procedimiento para ejercer porcina en una caminadora motorizada. disfunción cardiopulmonar temprana es difícil de diagnosticar, especialmente en modelos animales, como la función cardiopulmonar se mide a menudo invasiva, que requiere anestesia. Como muchos agentes anestésicos son cardiodepressive, los cambios sutiles en la función cardiovascular pueden estar enmascarados. En contraste, la instrumentación crónica permite la medición de la función cardiopulmonar en el estado despierto, por lo que las mediciones se pueden obtener en condiciones de reposo, sin los efectos de la anestesia y el trauma quirúrgico aguda. Por otra parte, cuando los animales son entrenados adecuadamente, las medidas pueden también ser obtenidos durante el ejercicio tapiz rodante graduada.
sondas de flujo se colocan alrededor de la aorta o la arteria pulmonar para la medición del gasto cardíaco y alrededor de la arteria descendente anterior coronaria para la medición de la coronel flujo de sangre ary. catéteres llenos de líquido se implantan en la aorta, arteria pulmonar, aurícula izquierda, ventrículo izquierdo y el ventrículo derecho para la medición de la presión y el muestreo de sangre. Además, un G catéter 20 se coloca en la vena interventricular anterior para permitir el muestreo de sangre venosa coronaria.
Después de una semana de recuperación, porcina se colocan en una cinta accionada por motor, los catéteres se conectan a medidores de presión y de flujo, y los cerdos se someten a un protocolo de ejercicio progresivo de cinco etapas, con cada etapa que dura 3 min. señales hemodinámicas se registran continuamente y las muestras de sangre se toman durante los últimos 30 segundos de cada etapa de ejercicio.
La principal ventaja de estudiar los animales crónicamente instrumentadas es que permite la evaluación de serie de la función cardiopulmonar, no sólo en reposo, pero también durante el estrés físico como el ejercicio. Por otra parte, la función cardiopulmonar se puede evaluar en varias ocasiones durante la enfermedad desarrollo unand durante el tratamiento crónico, lo que aumenta el poder estadístico y por lo tanto limitar el número de animales necesarios para un estudio.
Introducción
La función cardiopulmonar adecuada es esencial para abastecer el cuerpo con el oxígeno y los nutrientes, especialmente durante condiciones de aumento de la demanda metabólica, como durante el ejercicio 1. La respuesta cardiopulmonar al ejercicio se caracteriza por una serie de adaptaciones en la función cardíaca, es decir., Un aumento de la frecuencia cardíaca, el volumen de la contractilidad y accidente cerebrovascular, y la función microvascular, es decir, la vasodilatación en los lechos vasculares que suministran músculos en ejercicio, así como en el pulmonar vasculatura, y la vasoconstricción de los lechos vasculares que irrigan el sistema gastrointestinal, así como los músculos inactivos 1. Alteración de la capacidad de ejercicio es una característica temprana de la disfunción cardiopulmonar, y la prueba de esfuerzo cardiopulmonar se utiliza como un método eficaz para delinear entre la disfunción cardiaca, disfunción vascular y / o disfunción pulmonar en pacientes con deterioro de la capacidad de ejercicio 2. La disfunción cardiopulmonar temprana es difficult para diagnosticar, especialmente en modelos animales, como la función cardiopulmonar se mide a menudo invasiva, que requiere anestesia, con muchos agentes anestésicos que posee propiedades cardiodepressive 3.
instrumentación crónica permite la medición de la función cardiopulmonar en el estado despierto, y cuando los animales están completamente ajustadas a las mediciones de condiciones de laboratorio se puede obtener en condiciones de reposo sin los efectos de la anestesia y el trauma quirúrgico aguda. Por otra parte, cuando los animales son entrenados adecuadamente, las medidas pueden también ser obtenidos durante el ejercicio tapiz rodante graduada 4,5. Más específicamente, la izquierda y la función ventricular derecha puede ser evaluado y relacionada con la perfusión miocárdica, mientras que la regulación del tono vasomotor en la microcirculación coronaria, sistémica y pulmonar se puede determinar. El uso de catéteres llenos de líquido permite la medición de presión, así como la toma de muestras de sangre sin imponer adestrés condicionadas a los animales. Otra ventaja de estudiar animales instrumentados crónicamente es que las pruebas de ejercicio cardiopulmonar se puede repetir lo que permite el uso de un animal como su propio control, ya sea durante el desarrollo de la enfermedad o durante el tratamiento crónico, lo que aumenta el poder estadístico y por lo tanto limitar el número de animales necesarios para un estudio .
Anatomía cardiopulmonar de la especie porcina se parece mucho a la de los humanos y es posible inducir diversas formas de enfermedad cardiopulmonar, como la diabetes 6, infarto de miocardio 7, hipertensión pulmonar e insuficiencia cardíaca 8,9 estimulación inducida por 10,11. Además, el tamaño de la especie porcina permite instrumentación crónica, y repetido muestreo de sangre de la cantidad suficiente para analizar no sólo los gases en sangre, sino también para realizar mediciones neurohumorales y / o para buscar marcadores biológicos de la enfermedad.
Este protocolo describe la cirugía solía crónicaLy porcina instrumento, así como el protocolo para el ejercicio de los cerdos en una caminadora motorizada.
Protocolo
Los procedimientos que implican sujetos animales han sido aprobados por el Comité de Cuidado de Animales en el Centro Médico Erasmus de Rotterdam (Países Bajos). Porcina con pesos de entre 6 y 80 kg se han instrumentado con éxito utilizando este protocolo.
1. La adaptación de los animales a una manipulación humana
- Después de la llegada a la instalación, alojar a los animales en solitario, sino que puedan interactuar entre sí.
- Accustomize porcina a la manipulación humana y el transporte desde las instalaciones de animales de laboratorio experimental, por el manejo de los animales al menos una vez al día durante una semana.
- Entrenar a los animales apropiadamente para experimentos de ejercicio en una caminadora motorizada por su ejercicio en la cinta durante un mínimo de tres veces antes de la cirugía.
- Los animales deben estar en ayunas O / N antes de la cirugía para prevenir las náuseas, vómitos y así el potencial aspiración de fluidos estomacales.
2. Preparación para la Cirugía
- Sedación
- Preparar la medicación para la sedación en una jeringa de 10 ml. La premedicación consta de tiletamina / zolazepam (5 mg / kg), xilazina, (2,25 mg / kg) y atropina (1 mg).
- Inyectar el medicamento por vía intramuscular en el músculo trapecio con un 1,5 '' aguja de 19 G para sedar a los cerdos.
- Espere durante aproximadamente 10 minutos y comprobar para la relajación muscular y pérdida del conocimiento para confirmar el nivel adecuado y estable de la sedación.
- Colocar un catéter de seguridad periférica 20 G en una vena de la oreja para la administración intravenosa posterior de la anestesia y / o líquidos.
- Intubación y ventilación
- Colocar el animal sobre una mesa y / o carro en posición supina.
- Abra la boca del animal con un esparcidor oral.
- En caso de relajación insuficiente de las mordazas o presencia de reflejos para tragar, que dificultan la intubación, administrar tiopental (10 mg / kg) por vía intravenosa a través del catéter vena de la oreja. Alternativamente, el cerdo puede ser enmascaradocon isoflurano para inducir sedación.
- Utilizar un laringoscopio convencional con una luz y una cuchilla de Miller para permitir que el laringoscopista para ver directamente la laringe. Si hay laringoespasmo, aplicar lidocaína al 2% a las cuerdas y la laringe para reducir el espasmo y permitir la intubación.
- Insertar un estilete de intubación en el tubo endotraqueal para hacer que el tubo se ajusta mejor a la anatomía de la vía aérea superior y pasar el tubo por la boca y entre las cuerdas vocales en la tráquea.
- Inflar el manguito globo con una jeringa de 10 ml para ayudar a asegurar en su lugar, para evitar fugas de gases respiratorios, y para proteger las vías respiratorias de una posible aspiración de líquido del estómago.
- Conectar el tubo a un (intercambiador de calor y humedad) filtro de respiración y al ventilador mecánico.
- Colocar el animal sobre su lado derecho sobre la mesa quirúrgica.
- Para lograr los niveles de pO2 de 100 a 120 mmHg, ventile el animal con una mezcla de oxígeno y nitrógeno (1: 2 v / v), using los siguientes parámetros del ventilador: el modo de control de presión: la presión positiva al final de la espiración (PEEP) 4 cmH2O; la presión inspiratoria máxima 16 - 18 cm H 2 O; frecuencia dependiendo del tamaño del animal de respiración (para un animal de 20 kg, disminuir la frecuencia con el aumento de peso corporal) esto debería resultar en un volumen corriente de ~ 10 ml / kg, controlar la ventilación con capnografía.
- Controlar la temperatura con un termómetro rectal y mantener la temperatura entre los 37 - 39ºC usando una lámpara de calor o de la estera de calor. Por otra parte, controlar la frecuencia cardiaca con electrocardiograma.
- Anestesia
- Inducir y mantener la anestesia preferiblemente mediante la adición de 2,0% de isoflurano (v / v) a la mezcla de gas de ventilación o, alternativamente, por administración intravenosa de fentanilo (10 g / kg / h) a través del catéter de vena de la oreja.
- Comprobar la profundidad de la anestesia adecuada mediante pruebas de reflejos de dolor con una pizca dedo del pie pata trasera antes de iniciar la cirugía. Cuando es necesario, añadirLa anestesia adicional o esperar unos minutos. Revisar los reflejos de dolor regularmente a lo largo de la cirugía.
- Líquidos y antibióticos
- Administrar la primera dosis de amoxicilina (25 mg / kg) por vía intravenosa a través del catéter vena de la oreja.
- Conectar un sistema de transfusión al catéter vena de la oreja para permitir la infusión lenta de glucosa 10% (500 ml) durante la cirugía.
- La esterilización del sitio quirúrgico
- Afeitado y limpiar la piel del animal en un área de aproximadamente 25 cm de anchura de la columna vertebral hasta el final a la axila izquierda.
- Frote la piel hidratada con matorrales povidona yodada (75 mg / ml) durante aproximadamente 5 minutos.
- Retire el jabón de povidona yodada de la piel con gasas estériles mojadas, antes de la esterilización de la piel con la loción de la povidona yodada (100 mg / ml).
- Cubrir el animal con paños quirúrgicos estériles para reducir la transferencia de bacterias y contaminación posterior de la zona quirúrgica.
3. Cirugía
- La apertura de la Tórax (toracotomía)
- Hacer una incisión en la piel, a partir de 1 cm caudal al ángulo inferior izquierdo de la escápula hasta la axila izquierda (Figura 1). Utilice diatermia para cauterizar los vasos sanguíneos en la piel para evitar el sangrado excesivo.
- Cortar a través del músculo serrato y músculo pectoral mayor, utilizando la modalidad de corte de la diatermia. También el uso de diatermia para cauterizar los vasos sanguíneos en la capa muscular para evitar el sangrado excesivo.
- Utilice una disección roma para dividir cuidadosamente el músculo intercostal del cuarto espacio intercostal izquierdo con una pinza mosquito. Ahora la superficie costal del pulmón izquierdo cubierto con la pleura visceral y parietal debe ser expuesto.
- Para entrar en la cavidad pleural, perforar con cuidado las dos capas de la pleura y arrancarlas abierta.
- Utilice un retractor torácica para separar los bordes de la herida y las costillas y tejidos para conducir la fuerzaAdemás de obtener una buena exposición de la cavidad pleural.
- Alejar el pulmón izquierdo en la dirección caudal y mantenerlo en su lugar con una gasa húmeda. Ahora el corazón y los grandes vasos deben estar claramente expuestos.
- La colocación de catéteres y sondas de flujo (Figura 1)
- Utilice una disección roma para eliminar ~ 2 cm 2 de tejido conectivo circundante de la aorta torácica descendente.
- Realizar una sutura en bolsa de tabaco, que consta de tres puntos de sutura, en la pared de la aorta con una sutura de seda trenzada no absorbible USP3-0 (Ø0.2 mm).
- Penetran en la pared del vaso de la aorta con un acero 16 de la aguja G acero en el centro de la sutura en bolsa de tabaco.
- Inserte la punta del catéter lleno de líquido (hasta que el anillo) en la aorta, tirar de la sutura en bolsa de tabaco firmemente entre sí y atar los dos hilos de la sutura.
- Para mantener el catéter en su lugar, enrollar el hilo de sutura alrededor de 3 veces el catéter por encima del anillo y de nuevo tes decir, las dos cadenas de la sutura. Además asegurar el catéter con una nueva puntada de aproximadamente 1 cm craneal desde el lugar de inserción.
- Conectar el catéter lleno de fluido al transductor de presión calibrado, que está conectado al ordenador, para controlar la presión arterial media durante la cirugía. Obtener una gasometría arterial para comprobar o ajustar la configuración correcta ventilación.
- Abrir el pericardio con un corte cruzado. Tenga en cuenta para mantener el nervio frénico que corre sobre el pericardio intacta.
- Identificar la arteria pulmonar y tire de él ligeramente en la dirección caudal con un retractor Farabeuf. Ahora la aorta ascendente y el cayado aórtico deben ser expuestos. Monitor de la presión arterial media mientras se retrae la arteria pulmonar.
- Hacer un pequeño corte (~ 1 cm) en el tejido conectivo entre la aorta ascendente y la arteria pulmonar con tijeras Metzenbaum, para ser capaz de diseccionar, ya sea la aorta ascendente o la arteria pulmonar con un gran curvadapinza mosquito para colocar la sonda de flujo.
- Coloque la banda de caucho de la sonda de flujo alrededor del vaso. Para hacer esto más fácil, coloque una sutura a través de un extremo de la banda de goma, coloque esta sutura alrededor del vaso y tire de ella hasta que la banda de goma rodea el recipiente.
- Fijar el dispositivo de medición de la sonda de flujo en la banda de goma. Conecte la sonda de flujo al ordenador y comprobar la señal del gasto cardíaco en el equipo para confirmar la correcta colocación de la sonda de flujo.
- Colocar catéteres llenos de líquido en la arteria pulmonar, ventrículo derecho, ventrículo izquierdo y la aurícula izquierda en la misma manera que se ha descrito para el catéter lleno de líquido aórtica (3.2.2 - 3.2.5). Tenga en cuenta que no es necesario para eliminar el tejido conjuntivo antes de realizar una sutura en bolsa de tabaco en estas estructuras.
- Exponer y diseccionar la parte proximal de la arteria descendente anterior coronaria levantando primero el tejido con una pinza y hacer un pequeño (2 - 3 mm) se corta con tijeras Metzenbaum, Seguido de burlas cuidadosamente el tejido lejos de la arteria con un hisopo de algodón. Garantizar la disección completa de la arteria coronaria mediante el paso de una pequeña pinza mosquito en ángulo recto debajo.
- Hacer una puntada paralelo a la vena coronaria interventricular anterior con una sutura, que está conectado al catéter venoso coronario.
- La punción de la vena coronaria con el 20 G aguja del catéter venoso coronario e insertar la cánula del catéter por vía intravenosa.
- Retire la aguja y asegurar el catéter con la puntada ya realizado (3.2.14). Además fijar el catéter con una nueva puntada de aproximadamente 1 cm desde el lugar de la punción inicial.
- Coloque la sonda de flujo coronario alrededor de la anterior izquierda previamente diseccionado la arteria coronaria descendente. Cuando la arteria se estrecha y no es visible, el uso de lidocaína 10% de pulverización para relajar el recipiente para obtener una mejor exposición del recipiente. Compruebe la señal del flujo coronario en el equipo de confIRM una colocación correcta de la sonda de flujo (Figura 2).
- tunneling
- Túnel de las sondas de flujo de forma individual a través de la tercera espacio intercostal izquierdo por debajo del músculo y por encima de la costilla mediante el uso de una gran pinza mosquito curvada.
- Túnel de los catéteres llenos de fluido a través de ya sea el tercero o el quinto espacio intercostal izquierdo perforando el músculo intercostal. Abrazadera de los catéteres llenos de líquido y retirar la llave de tres vías para reducir al mínimo la zona de la perforación y prevenir la fuga de los catéteres llenos de líquido durante la construcción de túneles.
- Fijar las sondas de flujo y los catéteres llenos de fluido con seda no absorbible USP2-0 trenzado (ø0.3 mm) por medio de una sutura en bolsa de tabaco en el músculo intercostal. Esta sutura también sirve para evitar fugas de aire después de volver a instaurar la presión intratorácica negativa.
- Hacer tres incisiones en la piel de 2 cm de siniestros y paralelos a la columna vertebral, aproximadamente 3 cm delongitud 3 cm de distancia unos de otros.
- Perforar un trocar debajo del músculo dorsal izquierda músculo dorsal del sitio de la incisión rostral a las incisiones en la parte posterior. Túnel de las sondas y catéteres de flujo de fluido hacia la parte posterior dentro de este trocar.
- Colocar las llaves de paso en los catéteres llenos de líquido y quitar la pinza. Extraer sangre para eliminar los coágulos y burbujas de aire y llenar los catéteres llenos de líquido con 1.000 UI de heparina / ml. catéteres venosos coronarios deben llenarse con 5.000 UI de heparina / ml.
- Cerrando el tórax
- Hacer una incisión con una longitud de aproximadamente 1,5 cm, 8 cm caudal y paralela a la primera incisión.
- Dirigir el drenaje de la cavidad pleural a través de los músculos intercostales sexto por vía subcutánea a esta incisión con una gran pinza mosquito curvada. Conectar el desagüe para el dispositivo de succión para retirar el líquido restante y restablecer la presión negativa en la cavidad pleural durante el cierre del tórax.
- Aliviar e inflarel pulmón con una retención final de la inspiración. Asegurar un llenado adecuado de pulmón mediante control visual.
- Cierre el tórax tirando de las nervaduras de la cuarta espacio intercostal juntos en dos sitios separados con poliéster no absorbible USP6 trenzado (Ø0.8 mm).
- Cierre el músculo serrato y músculo pectoral mayor con un punto de funcionamiento y la piel con una sutura subcuticular ejecuta usando seda trenzada USP2-0 no absorbible (ø0.3 mm)
- Suturar las incisiones en el lado dorsal con poliéster no absorbible USP2-0 trenzado (ø0.3 mm) entre los catéteres. En primer lugar un nudo directamente sobre la piel para cerrar la incisión, a continuación, fijar los catéteres a la sutura con un nudo 1 cm de la piel. Para las sondas de flujo, usar una poliglactina absorbible USP2-0 trenzado (ø0.3 mm) de sutura para evitar el corte de la sutura en el cable de la sonda de flujo (Figura 1).
- Retirar con cuidado el desagüe mientras se aplica presión en el lado craneal dela incisión para mantener la presión negativa en la cavidad pleural. Cerrar la incisión con una sutura en bolsa de tabaco usando poliéster no absorbible trenzada USP2-0 (ø0.3 mm) y sellar la herida con vaselina.
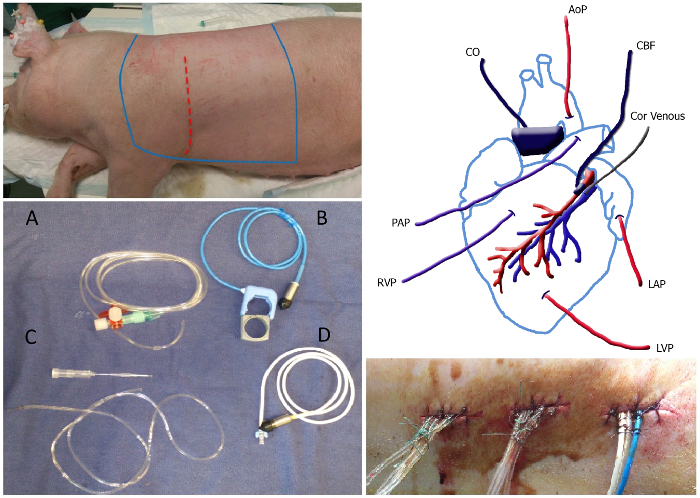
Figura 1. Descripción general de la cirugía Panel superior izquierdo:. La zona estéril del animal, que debe ser afeitada y se encuentra entre las líneas bleu esterilizado. El sitio de la incisión se representa como la línea de puntos de color rojo. Panel inferior izquierdo: Cuadro de catéteres y sondas de flujo: lleno de líquido del catéter (A), sonda de flujo pulmonar aorta / incluyendo banda de goma (B), catéter venoso coronario incluyendo aguja de calibre 20 (C) y la sonda de flujo coronario (D). Panel superior derecha: Vista esquemática de la colocación de los catéteres y sondas de flujo. MAP, la presión arterial media; venosa Cor, catéter venoso coronario; LAP, presión de la aurícula izquierda; LVPla presión ventricular izquierda; RVP, la presión del ventrículo derecho; PAP, presión arterial pulmonar; CO, el gasto cardíaco; CBF, el flujo sanguíneo coronario. Panel inferior derecho:. Tunneled catéteres que salen de la parte trasera se fija con una puntada y un nudo en aproximadamente 1 cm de distancia a lo largo de la sutura Haga clic aquí para ver una versión más grande de esta figura.
- La terminación de la anestesia y la recuperación de la cirugía
- Detener la anestesia cuando todos los sitios de las incisiones se cierran.
- Proporcionar analgesia mediante la administración de buprenorfina (0,015 mg / kg) im en el músculo gracilis.
- Detener la ventilación cuando el animal está respirando de forma independiente y desconecte el tubo traqueal del ventilador. Comprobar periódicamente si el animal está respirando adecuadamente.
- Colocar compresas de gasa entre los sitios de exteriorización de los catéteres para absorber fluido de la herida.
- Para proteger el exterior segments de los catéteres, dan al animal un chaleco elástico y el paquete de los catéteres entre dos piezas de piel de oveja artificial.
- Desinflar el balón del tubo traqueal y retirar la intubación cuando el animal recupera su reflejo de deglución.
- Proporcionar analgesia a largo plazo por medio de un parche de liberación lenta de fentanilo (12 g / h para un cerdo de 20 kg; ajustar la fuerza de acuerdo con el peso corporal). Colocar el parche en una parte delgada de la piel (por ejemplo, la parte inferior del abdomen) para garantizar la entrega adecuada de la analgesia.
- Casa del animal por separado para todo el período post-operatorio. Proporcionar una lámpara de calentamiento para la primera semana después de la cirugía para mantener caliente el animal.
- Iv suministrar suficiente líquido si el animal no está bebiendo de forma independiente.
- Enjuague los catéteres llenos de líquido al día, retirando primero la sangre para eliminar los coágulos, a continuación, volver a llenar con solución salina y finalmente con solución salina heparinizada (1000 - 5000 IU / ml) para prevenir la formación de coágulos de sangre. Tenga cuidado de no infundir cualquier bubb aireles al vaciar los catéteres.
- Administrar amoxicilina (25 mg / kg) iv al día durante 6 días después de la cirugía para prevenir infecciones post-quirúrgicas.
- Deje que el animal se recupere durante una semana antes de comenzar los experimentos de cinta rodante.
4. Cinta de correr experimento (Figura 2)
- Lave los catéteres llenos de líquido como se describe (3.5.10) y adjuntar los catéteres encendidas a los transductores de presión. Medir la temperatura rectal para ser capaz de obtener los valores de gases en sangre de temperatura corregido.
- Enjuague los transductores de presión con solución salina para evitar la amortiguación de las señales debido a las burbujas de aire. Una los transductores de presión al chaleco elástico en el lado dorsal.
- Conectar los transductores de presión y sondas de flujo al amplificador. Inicio de la medición en el programa de ordenador y calibrar los transductores de presión y sondas de flujo con 0 mmHg estar abierto al aire (y cerrada al animal) y 100 mmHg utilizando un manómetro.
- Cambiar la llave de tres vías de manera que los catéteres de fluidos tienen una conexión abierta con los transductores de presión. Tenga en cuenta que las presiones de sangre ahora se pueden obtener. Comprobar las señales de forma y de amplitud (Figura 2).
- Si es necesario, conectar una línea de extensión a cualquiera de los catéteres de fluidos para el muestreo de sangre venosa y arterial mixto.
- Medir la hemodinámica cuando el animal está mintiendo, así como de pie en silencio en la cinta. Promedio de las presiones sanguíneas se midieron durante un periodo de tiempo de 10 seg.
- Obtener arterial y muestras de sangre venosa mixta por primera retirada de 5 ml de sangre con una jeringa de 10 ml de manera que 1 ml de sangre pura se pueden obtener usando una jeringa de 1 ml heparinizada. Para las muestras de sangre venosa coronaria, una jeringa de 2 ml se utiliza en lugar de la jeringa 10 ml y la retirada de 1 ml es suficiente para obtener sangre pura.
- Mantenga los sellados jeringas de 1 ml en hielo antes de procesar las muestras de sangre con un analizador de gases en sangre para determinarla condición metabólica y ventilatoria del animal.
- Someter a los cerdos a un protocolo de ejercicio de cinco etapas en la cinta, 3 min por manual, 1 - 5 km / h (~ 85% de la frecuencia cardiaca máxima). Obtener la hemodinámica y gases en sangre después de 1,5 - a 2 minutos por la velocidad en cada velocidad como en la posición de reposo.
- Después de que el protocolo de ejercicio cerrar las llaves de paso y comprobar si ha ocurrido deriva en la calibración 0 mm Hg, tome nota de esta calibración. Retire los transductores de presión de los catéteres llenos de líquido y desconectar las sondas de flujo.
- Enjuague los catéteres llenos de fluido con solución salina y heparina (1.000 - 5.000 IU / ml). Proteger a los catéteres y sondas de flujo poniéndolos debajo del chaleco elástico entre dos piezas de piel de oveja artificial. El animal puede ahora ser devuelto a su jaula.

Figura 2. Experimento caminadora. Panel izquierdols: porcina instrumentada en la cinta. catéteres llenos de fluido están conectados a los transductores de presión, colocados en la parte posterior de los cerdos. Panel superior derecho: Resumen del total experimental, incluyendo la cinta de correr, amplificador y equipo de grabación. Abajo a la derecha del panel: Ejemplo típico de los datos hemodinámicos registrados. De arriba a abajo; la presión aórtica (POA, azul) y la presión ventricular izquierda (LVP, rojo); la presión de la aurícula izquierda (LAP, azul) y la presión ventricular izquierda (rojo); la presión arterial pulmonar (PAP, azul) y la presión ventricular derecha (RVP, rojo); flujo aórtico / gasto cardíaco (AoF, azul); el flujo sanguíneo coronario (CBF, rojo). Haga clic aquí para ver una versión más grande de esta figura.
Resultados
El ejercicio hasta 5 km / hr dio lugar a una duplicación del gasto cardíaco a partir de 4,3 ± 0,3 a 8,5 ± 0,7 L / min que se lleva a cabo principalmente por un aumento en la frecuencia cardíaca a partir de 137 ± 7 256 ± 8 latidos por min en combinación con una pequeño aumento en el volumen de eyección de 32 ± 2 36 ± 3 ml (Figura 3). El aumento en el volumen sistólico fue facilitada por un aumento en la contractilidad del ventrículo izquierdo, como se eviden...
Discusión
El presente estudio describe la cirugía para la instrumentación crónica de los cerdos, así como el protocolo para el ejercicio de los cerdos instrumentado en una cinta accionada por motor, mientras que la medición de la hemodinámica y tomar muestras de sangre para la medición del contenido de oxígeno en arterial, venosa mixta y la sangre venosa coronaria.
Los pasos críticos dentro del Protocolo
Hay varios pasos críticos en el protocolo que ya se inician durante el procedimie...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue apoyado por los Países Bajos Corazón beca de la Fundación 2000T038 (con DJ Duncker) 2000T042 subvención (a D. Merkus), Comisión Europea FP7-HEALTH-2010-261409 subvención MEDIA (con DJ Duncker y D. Merkus), Iniciativa de Investigación Cardiovascular Países Bajos: la Fundación del corazón holandés, la Federación holandesa de centros médicos universitarios, la Organización holandesa para la Investigación de la Salud y el Desarrollo y la Real Academia holandesa de Ciencias CVON- ARENA CVON 2011-11 (con DJ Duncker), CVON-Fedra CVON2012-08 (a D. Merkus) y CVON reconexión CVON 2014-11 (con DJ Duncker y D. Merkus), Fundación Sophia (a D. de Wijs-Meijler, D. Merkus y IKM Reiss).
Materiales
| Name | Company | Catalog Number | Comments |
| 3-way stopcocks | B. Braun | 16496 | |
| Perfusor lines PVC (DEHP-free) 150 cm/2.6 ml | B. Braun | 8722960 | Used for fluid filled catheters |
| “python “ silicontubing | Rubber BV | 1757 ID 1 mm, OD 2 mm | Used for fluid filled catheters |
| Sodium Chloride 0.9% | Baxter | TKF7124 | |
| Glucose 10% | Baxter | WE0163 | |
| Suction device | |||
| Slim-Line electrosurgical pencil with 2 buttons | ERBE ELEKTROMEDIZIN GMBH | 20190-066 | |
| Servo Ventilator SV900C | Siemens-Elema AB | ||
| Laryngoscoop | Vererinary Technics Int. | 11.02.47 | |
| Sterile surgical gloves | |||
| tie-on surgical mask | 3M | 1818FS | |
| surgical hat | Klinidrape | 621301 | |
| Procedure pack | Molnlycke Health Care | 97027809 | Surgical drape, gauze pads, syringes, beaker etc |
| Droptears | Alcon | 288-28282-01 | |
| Betadine scrub 75 mg/ml Povidone-iodine | Meda Pharma BV | RVG08939 | |
| Betadine solution 100 mg/ml Povidone-iodine | Meda Pharma BV | RVG01331 | |
| Cuffed Endotracheal tube | Emdamed | size depends on animal size | |
| Breathing filter Hyrdo therm 3HME | Intersurgical | 1560000 | |
| Laryngoscope Handle+ Miller blade size 4 | Kawe Germany | ||
| Manual resuscitator- Combibag | Weinmann | 6515-12-313-5596 | |
| Perivascular flow probe 3PS | Transonic | For coronary artery; Size 2.5 - 4 mm depending on animal size | |
| Confidence flow probe | Transonic | For aorta/pulmonary artery, 16 - 20 mm; size depends on animal size | |
| Venflon-Venisystem 20 G x 32 mm | BD | 393224 | For coronary venous catheter |
| Blunt Needle 18 G | For coronary venous catheter | ||
| Tygon Tubing | Rubber BV | 2802 ID 0.8 mm (1/32’’), OD 2.4 mm (3/32’’) | For coronary venous catheter |
| Suction Handle 17 cm 6 6/8 " Coupland 18/8 martinit with tube connector | KLS Martin Group | 18-575-24 | |
| Scalple blade | |||
| Scalpel Handle 13.5 cm 5 3/8 " Stainless Steel solid | KLS Martin Group | 10-100-04 | |
| Vascular Forceps 20.2 cm 8 " De Bakey Stainless Stee | KLS Martin Group | 24-388-20 | ± 14 cm |
| Dressing Forceps 17 cm 6 6/8 " Cushing Stainless Steel | KLS Martin Group | 12-189-17 | ± 18 cm |
| halsted-musquito straight 12.5 cm - 5" | Rudolf Medical | RU-3100-13 | ± 12 cm |
| halsted-musquito curved 12.5 cm - 5" | Rudolf Medical | RU-3101-12 | ± 12 cm |
| Dissecting and Ligature Forceps 13 cm 5 1/8 " Gemini Stainless Steel | KLS Martin Group | 13-451-13 | ± 12 cm |
| Dissecting and Ligature Forceps 18.5 cm 7 2/8 " Schnidt Stainless Steel | KLS Martin Group | 13-363-18 | |
| Rib Retractor Finochietto, Baby Aluminium - | KLS Martin Group | 24-162-01 | |
| suture forceps Mayo-Hegar 3 mm 18 cm - 7" | Rudolf Medical | RU-6050-18 | |
| Metchenbaum blunt curved 14.5 cm - 5(3/4)" | Rudolf Medical | RU-1311-14M | |
| Retrector farabeuf 12 cm - 4 (3/4)" | Rudolf Medical | RU-4497-12 | |
| Towel forceps schrädel curved 9cm - 3,5" | Rudolf Medical | RU-3550-09 | |
| surgical scissors blunt 13 cm - 5" | Rudolf Medical | RU-1001-13 | |
| Gauzes Cutisoft 10 x 10 cm 4-ply | BSN Medical | 45846-00 | |
| Gauzes Cutisoft 5 x 5 cm 4-ply | BSN Medical | 45844-00 | |
| Flowmeter -CM2 / SF2 - 2gas (O2 and Air) | UNO BV | 180000008 | |
| Tec 7 Vaporizer | Datex-Ohmeda | ||
| Acederm wound spay | Ecuphar NV | ||
| Vaseline Album | Bufa | 165313 | |
| silkam 3-0 Natural silk, non-absorbable | B. Braun | F 1134043 | sutures for placement of catheters |
| silkam 2-0 Natural silk, non-absorbable | B. Braun | F 1134051 | sutures for muscular approximation |
| dagrofil 3-0 Polyester, non-absorbable | B. Braun | C 0842478 | sutures for fluid fille catheters after tunneling |
| Vicryl rapide 3-0, 1 x 45 cm FS2, V2930G | Daxtrio medische producten | 15560 | sutures for electrical catheters after tunneling |
| Vitafil 6 USP | SMI | 6080 | Ties |
| Syringes | 10 ml and 2.5 ml | ||
| Heparin LEO (heparin sodium) | LEO Pharma A/S | ||
| Zoletil | Virbac | tiletamine / zolazepam | |
| Sedazine | AST farma | 108855 | xylazine |
| Temgesic | RB Pharmaceuticals | 5429 | buprenorphine |
| Tensogrip | BSN Medical | 71522-00 | elastic vest |
Referencias
- Laughlin, M. H., et al. Peripheral circulation. Compr Physiol. 2, 321-447 (2012).
- Datta, D., Normandin, E., ZuWallack, R. Cardiopulmonary exercise testing in the assessment of exertional dyspnea. Ann Thorac Med. 10, 77-86 (2015).
- Vatner, S. F., Braunwald, E. Cardiovascular control mechanisms in the conscious state. N Engl J Med. 293, 970-976 (1975).
- Duncker, D. J., Bache, R. J. Regulation of coronary blood flow during exercise. Physiol Rev. 88, 1009-1086 (2008).
- Tune, J. D., Gorman, M. W., Feigl, E. O. Matching coronary blood flow to myocardial oxygen consumption. J Appl Physiol. 97 (1985), 404-415 (2004).
- van den Heuvel, M., et al. Coronary microvascular dysfunction in a porcine model of early atherosclerosis and diabetes. Am J Physiol Heart Circ Physiol. 302, H85-H94 (2012).
- Zhou, Z., et al. Pulmonary vasoconstrictor influence of endothelin in exercising swine depends critically on phosphodiesterase 5 activity. Am J Physiol Lung Cell Mol Physiol. 306, L442-L452 (2014).
- Pereda, D., et al. Swine model of chronic postcapillary pulmonary hypertension with right ventricular remodeling: long-term characterization by cardiac catheterization, magnetic resonance, and pathology. J Cardiovasc Transl Res. 7, 494-506 (2014).
- Mercier, O., et al. Endothelin A receptor blockade improves regression of flow-induced pulmonary vasculopathy in piglets. J Thorac Cardiovasc Surg. 140, 677-683 (2010).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259, H218-H229 (1990).
- Yarbrough, W. M., Spinale, F. G. Large animal models of congestive heart failure: a critical step in translating basic observations into clinical applications. J Nucl Cardiol. 10, 77-86 (2003).
- Duncker, D. J., Stubenitsky, R., Verdouw, P. D. Autonomic control of vasomotion in the porcine coronary circulation during treadmill exercise: evidence for feed-forward beta-adrenergic control. Circ Res. 82, 1312-1322 (1998).
- Stubenitsky, R., Verdouw, P. D., Duncker, D. J. Autonomic control of cardiovascular performance and whole body O2 delivery and utilization in swine during treadmill exercise. Cardiovasc Res. 39, 459-474 (1998).
- Zhou, Z., et al. Phosphodiesterase-5 activity exerts a coronary vasoconstrictor influence in awake swine that is mediated in part via an increase in endothelin production. Am J Physiol Heart Circ Physiol. 306, H918-H927 (2014).
- Gross, D. R. . Animal Models in Cardiovascular Research. , (2009).
- Merkus, D., Duncker, D. J. Perspectives: Coronary microvascular dysfunction in post-infarct remodelled myocardium. Eur Heart J Suppl. 16, A74-A79 (2014).
- de Beer, V. J., de Graaff, H. J., Hoekstra, M., Duncker, D. J., Merkus, D. Integrated control of pulmonary vascular tone by endothelin and angiotensin II in exercising swine depends on gender. Am J Physiol Heart Circ Physiol. 298, H1976-H1985 (2010).
- Lautt, W. W. Resistance or conductance for expression of arterial vascular tone. Microvasc Res. 37, 230-236 (1989).
- Merkus, D., et al. Phosphodiesterase 5 inhibition-induced coronary vasodilation is reduced after myocardial infarction. Am J Physiol Heart Circ Physiol. 304, H1370-H1381 (2013).
- Heusch, G. The paradox of alpha-adrenergic coronary vasoconstriction revisited. J Mol Cell Card. 51, 16-23 (2011).
- Merkus, D., Houweling, B., van den Meiracker, A. H., Boomsma, F., Duncker, D. J. Contribution of endothelin to coronary vasomotor tone is abolished after myocardial infarction. Am J Physiol Heart Circ Physiol. 288, H871-H880 (2005).
- Haitsma, D. B., et al. Minimal impairment of myocardial blood flow responses to exercise in the remodeled left ventricle early after myocardial infarction, despite significant hemodynamic and neurohumoral alterations. Cardiovasc Res. 52, 417-428 (2001).
- Bender, S. B., van Houwelingen, M. J., Merkus, D., Duncker, D. J., Laughlin, M. H. Quantitative analysis of exercise-induced enhancement of early- and late-systolic retrograde coronary blood flow. J Appl Physiol. 108 (3), 507-514 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados