È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Posizionamento chirurgico di cateteri per durata Esercizio cardiovascolare test in Swine
In questo articolo
Riepilogo
Here we present a protocol to assess cardiopulmonary function in awake swine, at rest and during graded treadmill exercise. Chronic instrumentation allows for repeated hemodynamic measurements uninfluenced by cardiodepressive anesthetic agents.
Abstract
Questo protocollo descrive la procedura chirurgica per cronicamente suina strumento e la procedura di esercitare suina su un tapis roulant motorizzato. All'inizio disfunzione cardiopolmonare è difficile da diagnosticare, soprattutto nei modelli animali, come la funzione cardiopolmonare è spesso misurata invasivo, richiede anestesia. Come molti agenti anestetici sono cardiodepressive, sottili cambiamenti nella funzione cardiovascolare possono essere mascherati. Al contrario, strumentazione cronica consente la misurazione della funzionalità cardiopolmonare nello stato di veglia, in modo che le misurazioni possono essere ottenuti in condizioni di riposo tranquillo, senza gli effetti di anestesia e trauma chirurgico acuto. Inoltre, quando gli animali siano adeguatamente formati, le misure possono essere ottenuti anche durante l'esercizio tapis roulant graduale.
Le sonde di flusso sono disposti intorno l'aorta o arteria polmonare per la misurazione della gittata cardiaca e intorno discendente anteriore dell'arteria coronaria per la misurazione della coronil flusso di sangue ario. cateteri piene di liquido vengono impiantati in aorta, arteria polmonare, atrio sinistro, ventricolo sinistro e ventricolo destro per la misurazione della pressione e il prelievo di sangue. Inoltre, a 20 G catetere è posizionato nella vena interventricolare anteriore per consentire coronarico prelievo di sangue venoso.
Dopo una settimana di recupero, suina sono collocati su un tapis roulant motorizzato, i cateteri sono collegati a pressione e flussometri, e suini sono sottoposti a un protocollo progressivo esercizio cinque fasi, con ogni fase della durata di 3 min. segnali emodinamici vengono continuamente registrati e campioni di sangue sono presi durante l'ultimo 30 secondi di ogni tappa esercizio.
Il principale vantaggio di studiare animali cronicamente strumentate è che permette la valutazione seriale di funzione cardiopolmonare, non solo a riposo, ma anche durante stress fisico come l'esercizio fisico. Inoltre, la funzione cardiopolmonare può essere valutata più volte durante la malattia lo sviluppo di unnd durante il trattamento cronico, aumentando così potenza statistica e quindi limitando il numero di animali necessari per uno studio.
Introduzione
Adeguata la funzione cardiopolmonare è essenziale per fornire al corpo ossigeno e sostanze nutritive, in particolare durante le condizioni di un aumento della domanda metabolica, come durante l'esercizio 1. La risposta cardiopolmonare di esercizio è caratterizzato da una serie di adattamenti in funzione cardiaca, cioè., Un aumento della frequenza cardiaca, il volume contrattilità e ictus, e la funzione microvascolare, cioè, vasodilatazione nei letti vascolari forniscono muscoli esercitano così come nel polmonari vascolarizzazione, e vasocostrizione nei letti vascolari che alimentano il sistema gastrointestinale e muscoli inattivi 1. La capacità di esercizio alterata è un marchio di garanzia precoce di disfunzione cardiopolmonare, e test da sforzo cardiopolmonare è usato come un metodo efficace per delineare tra disfunzione cardiaca, disfunzione vascolare e / o disfunzione polmonare in pazienti con ridotta capacità di esercizio 2. All'inizio disfunzione cardiopolmonare è Difficult per diagnosticare, soprattutto nei modelli animali, come la funzione cardiopolmonare è spesso misurata invasivo, richiede anestesia, con molti agenti anestetici con proprietà cardiodepressive 3.
strumentazione cronica consente la misurazione della funzione cardiopolmonare in stato di veglia, e quando gli animali sono completamente adeguati alle misurazioni condizioni di laboratorio può essere ottenuto in condizioni di riposo tranquillo, senza gli effetti dell'anestesia e trauma chirurgico acuto. Inoltre, quando gli animali sono adeguatamente formati, le misure possono essere ottenuti anche durante tapis roulant classificato esercizio 4,5. Più in particolare, a sinistra e funzione ventricolare destra può essere valutato e legato alla perfusione miocardica, mentre regolazione del tono vasomotoria nel microcircolo coronarico, sistemica e polmonare può essere determinato. L'uso di cateteri piene di liquido permette di misurare pressione, nonché il prelievo di campioni di sangue, senza imporre annunciolo stress dizionale sugli animali. Un altro vantaggio di studiare animali cronicamente strumentate è che test cardiopolmonare può essere ripetuto consentendo l'uso di un animale come proprio controllo, sia durante lo sviluppo della malattia o durante il trattamento cronico, aumentando così potenza statistica e quindi limitando il numero di animali necessari per uno studio .
Anatomia cardiopolmonare di suini simile a quella degli esseri umani ed è possibile indurre varie forme di malattie cardiopolmonari, come diabete 6, infarto miocardico 7, ipertensione polmonare 8,9 e stimolazione indotta insufficienza cardiaca 10,11. Inoltre, la dimensione di suini permette strumentazione cronica, e campionamento del sangue ripetuta di quantità sufficiente per analizzare non solo emogasanalisi, ma anche di effettuare misure neuroumorali e / o per la ricerca di marcatori di malattia.
Questo protocollo descrive l'intervento chirurgico utilizzato per cronicastrumento suina mente così come il protocollo per l'esercizio del suina su un tapis roulant motorizzato.
Protocollo
Le procedure che coinvolgono soggetti animali sono stati approvati dal Comitato di cura degli animali a Erasmus Medical Center di Rotterdam (NL). Swine con pesi tra i 6 ei 80 kg è stato strumentato con successo utilizzando questo protocollo.
1. L'adattamento degli animali alle manipolazioni umana
- Dopo l'arrivo nella struttura, ospitare gli animali solitario, ma consentire loro di interagire con l'altro.
- Accustomize suina alla manipolazione umana e trasporto dal stabulario al laboratorio sperimentale, gestendo l'animale almeno una volta al giorno per una settimana.
- Addestrare gli animali in modo appropriato per gli esperimenti di esercizi su un tapis roulant motorizzato da loro l'esercizio sul tapis roulant per un minimo di tre volte prima di un intervento chirurgico.
- Gli animali devono essere tenuti a digiuno O / N prima dell'intervento chirurgico per prevenire la nausea, vomito e così il potenziale aspirazione di liquidi dello stomaco.
2. Preparazione per la chirurgia
- sedazione
- Preparare i farmaci per la sedazione in una siringa da 10 ml. Premedicazione consiste tiletamina / zolazepam (5 mg / kg), xilazina, (2,25 mg / kg) e atropina (1 mg).
- Iniettare il farmaco per via intramuscolare nel muscolo trapezio con un 19 G 1.5 '' ago per sedare il maiale.
- Attendere circa 10 minuti e verificare la presenza di rilassamento muscolare e perdita di coscienza per confermare il livello adeguato e stabile della sedazione.
- Posizionare un catetere di sicurezza periferico 20 G in una vena orecchio per la successiva somministrazione endovenosa di anestesia e / o liquidi.
- Intubazione e la ventilazione
- Posto l'animale su un tavolo e / o carrello in posizione supina.
- Aprire la bocca dell'animale con spreader orale.
- In caso di insufficiente rilassamento delle ganasce o presenza di deglutizione riflessi, che ostacolano l'intubazione, amministrare tiopentale (10 mg / kg) per via endovenosa tramite il catetere orecchio vena. In alternativa, il maiale poteva essere mascheratocon isoflurano per indurre sedazione.
- Utilizzare un laringoscopio convenzionale con una luce e una lama Miller per consentire al laringoscopista di visualizzare direttamente la laringe. Se c'è laringospasmo, applicare 2% lidocaina alle corde e laringe per ridurre lo spasmo e consentire l'intubazione.
- Inserire un mandrino intubazione endotracheale nel tubo di rendere il tubo conforme meglio l'anatomia delle vie aeree superiori e passare il tubo attraverso la bocca e tra le corde vocali nella trachea.
- Gonfiare il bracciale palloncino con una siringa da 10 ml per contribuire a fissarlo in posizione, per evitare perdite di gas respiratori, e per proteggere le vie aeree da possibili l'aspirazione di liquidi dello stomaco.
- Collegare il tubo ad un (scambiatore di calore e umidità) Filtro respirazione e al ventilatore meccanico.
- Posto l'animale sul lato destro sul tavolo operatorio.
- Per ottenere livelli di pO2 di 100-120 mmHg, ventilare l'animale con una miscela di ossigeno e azoto (1: 2 v / v), using le seguenti impostazioni del ventilatore: la modalità di controllo della pressione: pressione positiva di fine espirazione (PEEP) 4 cmH2O; picco di pressione inspiratoria 16 - 18 cm H 2 O; frequenza a seconda della dimensione dell'animale respirazione (di 20 kg animale, diminuire la frequenza con l'aumento di peso corporeo) dovrebbe tradursi in un volume corrente di ~ 10 ml / kg, monitorare la ventilazione con capnografia.
- Monitorare la temperatura con un termometro rettale e mantenere la temperatura tra 37-39 ° C utilizzando una lampada di calore o di stuoia di calore. Inoltre, il monitoraggio della frequenza cardiaca con elettrocardiogramma.
- Anestesia
- Indurre e mantenere l'anestesia preferibilmente aggiungendo 2,0% di isoflurano (v / v) per il gas miscela di ventilazione o in alternativa mediante somministrazione endovenosa di fentanil (10 mcg / kg / h) attraverso il catetere orecchio vena.
- Controllare un'adeguata profondità dell'anestesia testando riflessi dolore con una cerva pizzico gamba punta prima di iniziare l'intervento chirurgico. Se necessario, aggiungereanestesia supplementare o attendere per qualche minuto. Controllare riflessi dolore regolarmente durante l'intervento chirurgico.
- Fluidi e antibiotici
- Somministrare la prima dose di amoxicillina (25 mg / kg) per via endovenosa con il catetere orecchio vena.
- Collegare un sistema trasfusionale al catetere orecchio vena consentire infusione lenta di glucosio 10% (500 ml) durante l'intervento chirurgico.
- Sterilizzazione di sito chirurgico
- Shave e pulire la pelle dell'animale su una superficie di circa 25 cm di larghezza dalla colonna vertebrale fino l'ascella sinistra.
- Scrub la pelle idratata con scrub iodopovidone (75 mg / ml) per circa 5 minuti.
- Rimuovere il sapone iodopovidone dalla pelle con garze sterili umidi, prima di sterilizzare la pelle con lozione iodopovidone (100 mg / ml).
- Coprire l'animale con teli chirurgici sterili per ridurre il trasferimento batterica e conseguente contaminazione del sito chirurgico.
3. Chirurgia
- L'apertura del torace (toracotomia)
- Effettuare una incisione nella pelle, partendo 1 centimetro caudalmente all'angolo inferiore sinistro della scapola verso l'ascella sinistra (Figura 1). Utilizzare diatermia per cauterizzare i vasi sanguigni nella pelle per evitare un eccessivo sanguinamento.
- Tagliare il muscolo dentato e muscolo grande pettorale, utilizzando la modalità di taglio della diatermia. Anche utilizzare diatermia per cauterizzare i vasi sanguigni nello strato muscolare per evitare un eccessivo sanguinamento.
- Utilizzare smussa per dividere attentamente il muscolo intercostale del quarto spazio intercostale sinistro con un morsetto zanzara. Ora la superficie costiera del polmone sinistro coperto con pleura viscerale e parietale dovrebbe essere esposto.
- Per entrare nella cavità pleurica, perforare con attenzione entrambi gli strati della pleura e strappare aperto.
- Utilizzare un divaricatore toracico per separare i bordi della ferita e le costole e guidare con forza tessutia parte per ottenere una buona esposizione della cavità pleurica.
- Spingere via il polmone sinistro in direzione caudale e tenerlo in posizione con una garza umida. Ora il cuore e dei grossi vasi dovrebbero essere chiaramente esposti.
- Il posizionamento di cateteri e sonde di flusso (figura 1)
- Utilizzare smussa per rimuovere ~ 2 cm 2 del circostante tessuto connettivo della aorta toracica discendente.
- Eseguire una sutura a borsa di, composto da tre punti, nella parete aortica con un non-assorbibile USP3-0 sutura intrecciata seta (ø0.2 mm).
- Penetrare la parete del vaso aortico con un acciaio 16 G ago in acciaio al centro della sutura a borsa di.
- Inserire la punta del catetere piene di liquido (finché l'anello) nell'aorta, tirare la sutura a borsa di saldamente insieme e legare le due stringhe di sutura.
- Per mantenere il catetere in posizione, avvolgere la sutura 3 volte in tutto il catetere sopra l'anello e di nuocioè le due stringhe di sutura. Ulteriori fissare il catetere con un nuovo punto circa 1 cm craniale dal luogo di inserimento.
- Collegare il catetere pieno di liquido al trasduttore di pressione calibrata, che è collegata al computer, per monitorare la pressione arteriosa media durante l'intervento chirurgico. Ottenere un gas sangue arterioso per verificare o modificare le impostazioni per la ventilazione corrette.
- Aprire il pericardio con un taglio incrociato. Essere consapevoli di tenere il nervo frenico che corre sopra il pericardio intatto.
- Identificare l'arteria polmonare e tirarlo leggermente in senso caudale con un divaricatore Farabeuf. Ora l'aorta ascendente e l'arco aortico dovrebbero essere esposti. Monitorare la pressione arteriosa media mentre ritraendo l'arteria polmonare.
- Fare un piccolo taglio (~ 1 cm) nel tessuto connettivo tra l'aorta ascendente e l'arteria polmonare con le forbici Metzenbaum, per poter sezionare sia l'aorta ascendente o l'arteria polmonare con una grande curvamorsetto di zanzara per posizionare la sonda di mandata.
- Posizionare l'elastico della sonda flusso intorno alla nave. Per facilitare questa operazione, posizionare una sutura attraverso una estremità del nastro di gomma, collocare questa sutura intorno al vaso e tirarlo fino alla elastico circonda il vaso.
- Fissare il dispositivo di misura della sonda di flusso sul elastico. Collegare la sonda di flusso al computer e controllare il segnale di uscita cardiaca sul computer per confermare il corretto posizionamento della sonda flusso.
- Posizionare cateteri piene di liquido nell'arteria polmonare, ventricolo destro, ventricolo sinistro e atrio sinistro allo stesso modo come descritto per il catetere aortico pieno di liquido (3.2.2 - 3.2.5). Si noti che non è necessario rimuovere il tessuto connettivo prima di eseguire una sutura a borsa di queste strutture.
- Esporre e sezionare la parte prossimale della discendente anteriore dell'arteria coronaria dapprima sollevato il tessuto con una pinza e facendo una piccola (2 - 3 mm) tagliato con le forbici Metzenbaum, Seguita da eccitante accuratamente il tessuto lontano dalla arteria con un batuffolo di cotone. Assicurare completa dissezione dell'arteria coronaria facendo passare un morsetto zanzara angolata dritto sotto.
- Effettuare un punto parallelamente alla vena coronaria interventricolare anteriore con una sutura, che è collegato al catetere venoso coronarico.
- Perforare la vena coronaria con l'ago da 20 G del catetere venoso coronarico e inserire la cannula del catetere per via endovenosa.
- Rimuovere l'ago e fissare il catetere con il punto già eseguito (3.2.14). Ulteriori fissare il catetere con un nuovo punto a circa 1 cm dal luogo di foratura iniziale.
- Posizionare la sonda flusso coronarico intorno anteriore sinistra precedentemente sezionato coronaria discendente. Quando l'arteria è ristretta ed è difficilmente visibile, utilizzare lidocaina 10% spray per rilassare il recipiente per ottenere una migliore esposizione della nave. Controllare il segnale del flusso coronarico sul computer per confIRM un corretto posizionamento della sonda di flusso (Figura 2).
- traforo
- Tunnel le sonde di flusso singolarmente attraverso il terzo spazio intercostale sinistro sotto il muscolo e sopra la nervatura utilizzando un morsetto grande zanzara curvo.
- Tunnel i cateteri piene di liquido attraverso sia il terzo o il quinto spazio intercostale sinistro perforando il muscolo intercostale. Bloccare fuori i cateteri piene di liquido e togliere le tre vie rubinetto per ridurre al minimo l'area piercing e impedire la fuoriuscita dei cateteri piene di liquido durante il tunneling.
- Fissare le sonde di flusso e cateteri fluido-riempita con non-assorbibile seta USP2-0 intrecciato (ø0.3 mm) mediante una sutura stringa di borsa sul muscolo intercostale. Questa sutura serve anche per evitare perdite di aria dopo il ripristino della pressione intratoracica negativa.
- Fare tre incisioni nella pelle circa 2 cm sinistre e parallele alla colonna vertebrale, di circa 3 cm dilunghezza 3 cm di distanza l'uno dall'altro.
- PIERCE un trocar sotto il muscolo gran dorsale sinistro dal sito di incisione rostrale ai incisioni sul retro. Tunnel le sonde di flusso e cateteri fluido al indietro entro questo trocar.
- Posizionare i rubinetti sui cateteri piene di liquido e rimuovere il morsetto. Prelevare il sangue per rimuovere coaguli e bolle d'aria e riempire i cateteri fluido-riempita con 1.000 UI / ml di eparina. cateteri venosi coronarici devono essere riempiti con 5.000 UI / ml di eparina.
- Chiusura del torace
- Fare un'incisione con una lunghezza di circa 1,5 cm 8 centimetri caudale e parallela alla prima incisione.
- Condurre la fuga dalla cavità pleurica attraverso il sesto muscoli intercostali per via sottocutanea a questa incisione con una grande pinza zanzare curvo. Collegare lo scarico al dispositivo di aspirazione per rimuovere eventuali residui di liquido e ripristinare pressione negativa nella cavità pleurica durante la chiusura del torace.
- Alleviare e gonfiareil polmone con una tenuta di fine inspirazione. Assicurare un'adeguata riempimento del polmone dal monitoraggio visivo.
- Chiudere il torace tirando le costole del quarto spazio intercostale insieme in due siti distinti con poliestere USP6 intrecciato non riassorbibile (Ø0.8 mm).
- Chiudere il muscolo dentato e muscolo grande pettorale con un punto in esecuzione e la pelle con una sutura sottocuticolare esecuzione utilizzando non assorbibile in seta intrecciata USP2-0 (ø0.3 mm)
- Suturare le incisioni sul lato dorsale con poliestere non riassorbibile USP2-0 intrecciato (ø0.3 mm) tra i cateteri. Prima un nodo direttamente sulla pelle per chiudere l'incisione, poi fissare i cateteri per la sutura con un nodo 1 cm dalla cute. Per le sonde di flusso, utilizzare un assorbibile USP2-0 intrecciato Polyglactin (ø0.3 mm) suture per prevenire il taglio della sutura nel filo sonda di flusso (Figura 1).
- Rimuovere con attenzione lo scarico, mentre applicando una pressione sul lato cranialel'incisione per mantenere la pressione negativa nella cavità pleurica. Chiudere l'incisione con una sutura stringa di borsa utilizzando non riassorbibile in poliestere intrecciato USP2-0 (ø0.3 mm) e sigillare la ferita con vaselina.
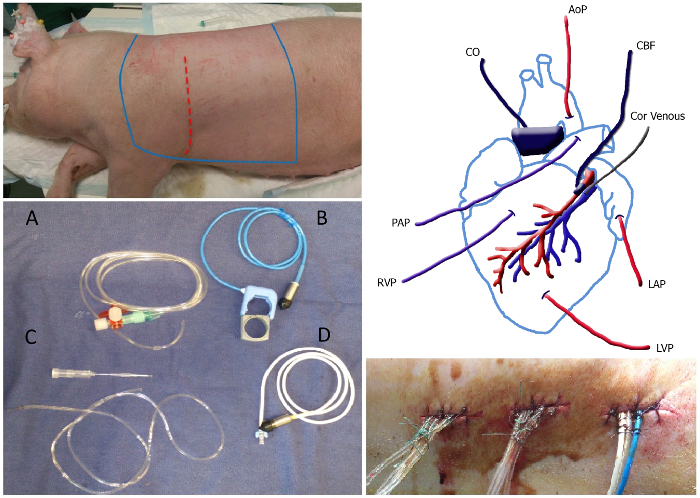
Figura 1. Panoramica del Top Chirurgia pannello di sinistra. La zona sterile dell'animale, che deve essere rasata e si trova tra le righe bleu sterilizzato. Il sito di incisione è raffigurato come la linea tratteggiata rossa. In basso pannello di sinistra: Immagine di cateteri e sonde di flusso: pieno di liquido catetere (A), sonda di flusso polmonare all'aorta / compresa elastico (B), catetere venoso coronarico incluso 20 ago G (C) e la sonda flusso coronarico (D). Pannello superiore destro: Schema di posizionamento dei cateteri e sonde di flusso. MAP, pressione arteriosa media; Cor venoso, catetere venoso coronarico; LAP, lasciato pressione atriale; LVPpressione ventricolare sinistra; RVP, la pressione del ventricolo destro; PAP, pressione arteriosa polmonare; CO, gittata cardiaca; CBF, flusso coronarico. Pannello in basso a destra:. Tunneled cateteri in uscita dal fondello serrato con un punto e un nodo a circa 1 cm di distanza lungo la sutura Clicca qui per vedere una versione più grande di questa figura.
- Cessazione di anestesia e di recupero da un intervento chirurgico
- Interrompere l'anestesia quando tutti i siti di incisione sono chiusi.
- Fornire analgesia somministrando buprenorfina (0,015 mg / kg) im nel muscolo gracile.
- Fermare la ventilazione quando l'animale sta respirando in modo indipendente e staccare il tubo tracheale dal ventilatore. Controllare regolarmente se l'animale sta respirando a sufficienza.
- Mettere garze tra i siti esteriorizzazione i cateteri per assorbire fluido ferita.
- Per proteggere l'esterno SEgments dei cateteri, conferiscono all'animale un giubbotto elastico e confezionare il cateteri tra due pezzi di pelle di pecora artificiale.
- Sgonfiare il palloncino del tubo tracheale e estubare quando l'animale riacquista il suo riflesso di deglutizione.
- Fornire l'analgesia a lungo termine per mezzo di un cerotto a lento rilascio di fentanil (12 microgrammi / ora per un maiale di 20 kg; regolare la forza in base al peso corporeo). Collocare il cerotto su una parte sottile della pelle (come il basso addome) per garantire un'adeguata erogazione di analgesia.
- Casa l'animale separatamente per l'intero periodo post-operatorio. Prevedere una lampada di riscaldamento per la prima settimana dopo l'intervento chirurgico per mantenere l'animale caldo.
- Fornire abbastanza iv fluido se l'animale non è potabile in modo indipendente.
- Lavare i cateteri ripiene di liquido giornaliera, dapprima ritirando anima per rimuovere coaguli, quindi il riempimento con soluzione salina e infine con soluzione salina eparinizzata (1.000 - 5.000 UI / ml) per impedire la formazione di coaguli di sangue. Fare attenzione a non infondere alcuna Bubb ariales durante il lavaggio dei cateteri.
- Somministrare amoxicillina (25 mg / kg) ev al giorno per 6 giorni dopo l'intervento chirurgico per prevenire infezioni post-chirurgiche.
- Lasciare che l'animale di recuperare per una settimana prima di iniziare gli esperimenti tapis roulant.
4. Tapis roulant Experiment (Figura 2)
- Lavare i cateteri piene di liquido come descritto (3.5.10) e fissare i cateteri arrossate ai trasduttori di pressione. Misurare la temperatura rettale per poter ottenere valori dei gas ematici temperatura corretta.
- Lavare i trasduttori di pressione con soluzione salina per evitare lo smorzamento dei segnali a causa di bolle d'aria. Attaccare i trasduttori di pressione alla maglia elastica sul lato dorsale.
- Collegare i trasduttori di pressione e sonde di flusso all'amplificatore. Avviare la misurazione nel programma di computer e calibrare i trasduttori di pressione e le sonde di flusso con 0 mmHg essere aperto all'aria (e chiuso per animali) e 100 mmHg con un manometro.
- commutare i tre vie rubinetto in modo che i cateteri fluido hanno una connessione aperta con i trasduttori di pressione. Si noti che le pressioni sanguigne possono ora essere ottenuti. Vedi segnali per forma e ampiezza (Figura 2).
- Se necessario, collegare una linea di estensione di uno dei cateteri fluido per il campionamento di sangue venoso e arterioso mista.
- Misurare l'emodinamica quando l'animale è sdraiato e in piedi in silenzio sul tapis roulant. pressione media del sangue sono misurati in un arco di tempo di 10 sec.
- Ottenere arterioso e campioni di sangue venoso misto dapprima ritirando 5 ml di sangue utilizzando una siringa da 10 ml in modo che 1 ml di sangue puro possono essere ottenuti utilizzando una siringa da 1 ml eparinizzata. Per le coronarie campioni di sangue venoso, una siringa da 2 ml è usato al posto della siringa da 10 ml e il ritiro di 1 ml è sufficiente per ottenere il sangue puro.
- Mantenere i sigillate 1 ml siringhe sul ghiaccio prima di elaborare i campioni di sangue con un analizzatore di gas del sangue per determinaremetabolico e ventilatorio condizioni dell'animale.
- Sottoporre il suina ad un protocollo di esercizio cinque fasi sul tapis roulant, 3 min per velocità, 1-5 km / h (~ 85% della frequenza cardiaca massima). Ottenere emodinamica e gas ematici dopo 1,5 - 2 min per velocità su ciascuna velocità nella posizione di riposo.
- Dopo il protocollo di esercizio chiudere i rubinetti e controllare se la deriva si è verificato nella calibrazione 0 mmHg, prendere nota di questa calibrazione. Rimuovere i trasduttori di pressione dei cateteri piene di liquido e scollegare le sonde di flusso.
- Lavare i cateteri piene di liquido con soluzione fisiologica ed eparina (1.000 - 5.000 UI / ml). Proteggere i cateteri e sonde di flusso mettendoli sotto il giubbotto elastico tra due pezzi di pelle di pecora artificiale. L'animale può essere riportato alla sua gabbia.

Figura 2. Treadmill Experiment. Riquadro a sinistraLS: strumentato suina sul tapis roulant. cateteri piene di liquido sono collegati ai trasduttori di pressione, posti sul retro del suino. Pannello superiore destro: Panoramica del totale set-up sperimentale, tra cui tapis roulant, amplificatore e computer di registrazione. In basso pannello di destra: tipico esempio di dati emodinamici registrati. Da cima a fondo; pressione aortica (AoP, blu) e la pressione ventricolare sinistra (LVP, rosso); pressione atriale sinistra (LAP, blu) e la pressione ventricolare sinistra (rosso); pressione arteriosa polmonare (PAP, blu) e la pressione del ventricolo destro (RVP, rosso); flusso aortico / gittata cardiaca (AoF, blu); coronarica flusso sanguigno (CBF, rosso). Fate clic qui per vedere una versione più grande di questa figura.
Risultati
Esercizio fino a 5 km / h determinato un raddoppio della portata cardiaca da 4,3 ± 0,3 fino a 8,5 ± 0,7 L / min che è stato principalmente realizzato da un aumento della frequenza cardiaca da 137 ± 7 di 256 ± 8 battiti per minuto in combinazione con un piccolo aumento della gittata da 32 ± 2 a 36 ± 3 ml (Figura 3). L'aumento della gittata sistolica è stata facilitata da un aumento della contrattilità del ventricolo sinistro, come evidenziato da un aumento ma...
Discussione
Il presente studio descrive l'intervento chirurgico per la strumentazione cronica di suini, nonché il protocollo per l'esercizio del suina strumentato su un tapis roulant motorizzato durante la misurazione emodinamica e prelievo di sangue per la misurazione del contenuto di ossigeno arterioso, venoso misto e sangue venoso coronarico.
I passaggi critici all'interno del protocollo
Ci sono diversi passaggi critici all'interno del protocollo che iniziano già durante la p...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato sostenuto da Paesi Bassi Heart Foundation concessione 2000T038 (a DJ Duncker) concessione 2000T042 (D. Merkus), Commissione Europea FP7-HEALTH-2010 concessione MEDIA-261.409 (a DJ Duncker e D. Merkus), Paesi Bassi Iniziativa ricerca cardiovascolare: Heart Foundation olandese, la Federazione olandese per Università Centri medici, l'Organizzazione olandese per la ricerca di salute e sviluppo e la Royal Netherlands Academy of Sciences CVON- ARENA cvon 2011-11 (a DJ Duncker), cvon-FEDRA CVON2012-08 (D. Merkus) e cvon-RECONNECT cvon 2014-11 (a DJ Duncker e D. Merkus), Sophia Foundation (di D. de Wijs-Meijler, D. Merkus e IKM Reiss).
Materiali
| Name | Company | Catalog Number | Comments |
| 3-way stopcocks | B. Braun | 16496 | |
| Perfusor lines PVC (DEHP-free) 150 cm/2.6 ml | B. Braun | 8722960 | Used for fluid filled catheters |
| “python “ silicontubing | Rubber BV | 1757 ID 1 mm, OD 2 mm | Used for fluid filled catheters |
| Sodium Chloride 0.9% | Baxter | TKF7124 | |
| Glucose 10% | Baxter | WE0163 | |
| Suction device | |||
| Slim-Line electrosurgical pencil with 2 buttons | ERBE ELEKTROMEDIZIN GMBH | 20190-066 | |
| Servo Ventilator SV900C | Siemens-Elema AB | ||
| Laryngoscoop | Vererinary Technics Int. | 11.02.47 | |
| Sterile surgical gloves | |||
| tie-on surgical mask | 3M | 1818FS | |
| surgical hat | Klinidrape | 621301 | |
| Procedure pack | Molnlycke Health Care | 97027809 | Surgical drape, gauze pads, syringes, beaker etc |
| Droptears | Alcon | 288-28282-01 | |
| Betadine scrub 75 mg/ml Povidone-iodine | Meda Pharma BV | RVG08939 | |
| Betadine solution 100 mg/ml Povidone-iodine | Meda Pharma BV | RVG01331 | |
| Cuffed Endotracheal tube | Emdamed | size depends on animal size | |
| Breathing filter Hyrdo therm 3HME | Intersurgical | 1560000 | |
| Laryngoscope Handle+ Miller blade size 4 | Kawe Germany | ||
| Manual resuscitator- Combibag | Weinmann | 6515-12-313-5596 | |
| Perivascular flow probe 3PS | Transonic | For coronary artery; Size 2.5 - 4 mm depending on animal size | |
| Confidence flow probe | Transonic | For aorta/pulmonary artery, 16 - 20 mm; size depends on animal size | |
| Venflon-Venisystem 20 G x 32 mm | BD | 393224 | For coronary venous catheter |
| Blunt Needle 18 G | For coronary venous catheter | ||
| Tygon Tubing | Rubber BV | 2802 ID 0.8 mm (1/32’’), OD 2.4 mm (3/32’’) | For coronary venous catheter |
| Suction Handle 17 cm 6 6/8 " Coupland 18/8 martinit with tube connector | KLS Martin Group | 18-575-24 | |
| Scalple blade | |||
| Scalpel Handle 13.5 cm 5 3/8 " Stainless Steel solid | KLS Martin Group | 10-100-04 | |
| Vascular Forceps 20.2 cm 8 " De Bakey Stainless Stee | KLS Martin Group | 24-388-20 | ± 14 cm |
| Dressing Forceps 17 cm 6 6/8 " Cushing Stainless Steel | KLS Martin Group | 12-189-17 | ± 18 cm |
| halsted-musquito straight 12.5 cm - 5" | Rudolf Medical | RU-3100-13 | ± 12 cm |
| halsted-musquito curved 12.5 cm - 5" | Rudolf Medical | RU-3101-12 | ± 12 cm |
| Dissecting and Ligature Forceps 13 cm 5 1/8 " Gemini Stainless Steel | KLS Martin Group | 13-451-13 | ± 12 cm |
| Dissecting and Ligature Forceps 18.5 cm 7 2/8 " Schnidt Stainless Steel | KLS Martin Group | 13-363-18 | |
| Rib Retractor Finochietto, Baby Aluminium - | KLS Martin Group | 24-162-01 | |
| suture forceps Mayo-Hegar 3 mm 18 cm - 7" | Rudolf Medical | RU-6050-18 | |
| Metchenbaum blunt curved 14.5 cm - 5(3/4)" | Rudolf Medical | RU-1311-14M | |
| Retrector farabeuf 12 cm - 4 (3/4)" | Rudolf Medical | RU-4497-12 | |
| Towel forceps schrädel curved 9cm - 3,5" | Rudolf Medical | RU-3550-09 | |
| surgical scissors blunt 13 cm - 5" | Rudolf Medical | RU-1001-13 | |
| Gauzes Cutisoft 10 x 10 cm 4-ply | BSN Medical | 45846-00 | |
| Gauzes Cutisoft 5 x 5 cm 4-ply | BSN Medical | 45844-00 | |
| Flowmeter -CM2 / SF2 - 2gas (O2 and Air) | UNO BV | 180000008 | |
| Tec 7 Vaporizer | Datex-Ohmeda | ||
| Acederm wound spay | Ecuphar NV | ||
| Vaseline Album | Bufa | 165313 | |
| silkam 3-0 Natural silk, non-absorbable | B. Braun | F 1134043 | sutures for placement of catheters |
| silkam 2-0 Natural silk, non-absorbable | B. Braun | F 1134051 | sutures for muscular approximation |
| dagrofil 3-0 Polyester, non-absorbable | B. Braun | C 0842478 | sutures for fluid fille catheters after tunneling |
| Vicryl rapide 3-0, 1 x 45 cm FS2, V2930G | Daxtrio medische producten | 15560 | sutures for electrical catheters after tunneling |
| Vitafil 6 USP | SMI | 6080 | Ties |
| Syringes | 10 ml and 2.5 ml | ||
| Heparin LEO (heparin sodium) | LEO Pharma A/S | ||
| Zoletil | Virbac | tiletamine / zolazepam | |
| Sedazine | AST farma | 108855 | xylazine |
| Temgesic | RB Pharmaceuticals | 5429 | buprenorphine |
| Tensogrip | BSN Medical | 71522-00 | elastic vest |
Riferimenti
- Laughlin, M. H., et al. Peripheral circulation. Compr Physiol. 2, 321-447 (2012).
- Datta, D., Normandin, E., ZuWallack, R. Cardiopulmonary exercise testing in the assessment of exertional dyspnea. Ann Thorac Med. 10, 77-86 (2015).
- Vatner, S. F., Braunwald, E. Cardiovascular control mechanisms in the conscious state. N Engl J Med. 293, 970-976 (1975).
- Duncker, D. J., Bache, R. J. Regulation of coronary blood flow during exercise. Physiol Rev. 88, 1009-1086 (2008).
- Tune, J. D., Gorman, M. W., Feigl, E. O. Matching coronary blood flow to myocardial oxygen consumption. J Appl Physiol. 97 (1985), 404-415 (2004).
- van den Heuvel, M., et al. Coronary microvascular dysfunction in a porcine model of early atherosclerosis and diabetes. Am J Physiol Heart Circ Physiol. 302, H85-H94 (2012).
- Zhou, Z., et al. Pulmonary vasoconstrictor influence of endothelin in exercising swine depends critically on phosphodiesterase 5 activity. Am J Physiol Lung Cell Mol Physiol. 306, L442-L452 (2014).
- Pereda, D., et al. Swine model of chronic postcapillary pulmonary hypertension with right ventricular remodeling: long-term characterization by cardiac catheterization, magnetic resonance, and pathology. J Cardiovasc Transl Res. 7, 494-506 (2014).
- Mercier, O., et al. Endothelin A receptor blockade improves regression of flow-induced pulmonary vasculopathy in piglets. J Thorac Cardiovasc Surg. 140, 677-683 (2010).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259, H218-H229 (1990).
- Yarbrough, W. M., Spinale, F. G. Large animal models of congestive heart failure: a critical step in translating basic observations into clinical applications. J Nucl Cardiol. 10, 77-86 (2003).
- Duncker, D. J., Stubenitsky, R., Verdouw, P. D. Autonomic control of vasomotion in the porcine coronary circulation during treadmill exercise: evidence for feed-forward beta-adrenergic control. Circ Res. 82, 1312-1322 (1998).
- Stubenitsky, R., Verdouw, P. D., Duncker, D. J. Autonomic control of cardiovascular performance and whole body O2 delivery and utilization in swine during treadmill exercise. Cardiovasc Res. 39, 459-474 (1998).
- Zhou, Z., et al. Phosphodiesterase-5 activity exerts a coronary vasoconstrictor influence in awake swine that is mediated in part via an increase in endothelin production. Am J Physiol Heart Circ Physiol. 306, H918-H927 (2014).
- Gross, D. R. . Animal Models in Cardiovascular Research. , (2009).
- Merkus, D., Duncker, D. J. Perspectives: Coronary microvascular dysfunction in post-infarct remodelled myocardium. Eur Heart J Suppl. 16, A74-A79 (2014).
- de Beer, V. J., de Graaff, H. J., Hoekstra, M., Duncker, D. J., Merkus, D. Integrated control of pulmonary vascular tone by endothelin and angiotensin II in exercising swine depends on gender. Am J Physiol Heart Circ Physiol. 298, H1976-H1985 (2010).
- Lautt, W. W. Resistance or conductance for expression of arterial vascular tone. Microvasc Res. 37, 230-236 (1989).
- Merkus, D., et al. Phosphodiesterase 5 inhibition-induced coronary vasodilation is reduced after myocardial infarction. Am J Physiol Heart Circ Physiol. 304, H1370-H1381 (2013).
- Heusch, G. The paradox of alpha-adrenergic coronary vasoconstriction revisited. J Mol Cell Card. 51, 16-23 (2011).
- Merkus, D., Houweling, B., van den Meiracker, A. H., Boomsma, F., Duncker, D. J. Contribution of endothelin to coronary vasomotor tone is abolished after myocardial infarction. Am J Physiol Heart Circ Physiol. 288, H871-H880 (2005).
- Haitsma, D. B., et al. Minimal impairment of myocardial blood flow responses to exercise in the remodeled left ventricle early after myocardial infarction, despite significant hemodynamic and neurohumoral alterations. Cardiovasc Res. 52, 417-428 (2001).
- Bender, S. B., van Houwelingen, M. J., Merkus, D., Duncker, D. J., Laughlin, M. H. Quantitative analysis of exercise-induced enhancement of early- and late-systolic retrograde coronary blood flow. J Appl Physiol. 108 (3), 507-514 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon